Слизистая оболочка рта
Строение. Слизистая оболочка рта в отличие от
других слизистых оболочек организма
человека имеет ряд особенностей. Она
характеризуется более высокой
устойчивостью к воздействию физических,
термических и химических раздражителей,
а также инфекции. Повышенная регенеративная
способность слизистой оболочки рта
обусловлена ее строением. Она состоит
из нескольких слоев. Поверхностный
слой
— эпителий,
представлен плоскими, шиловидными
клетками и базальной мембраной. Толщина
эпителия на различных участках
слизистой оболочки неодинакова.
Утолщен эпителий губ и щек, истончен
эпителий, выстилающий дно пол ости рта,
нижнюю поверхность языка. Эпителий
слизистой оболочки твердого неба и
десен имеет выраженное ороговение.
Процесс ороговения эпителия носит
защитный характер и наблюдается на тех
участках полости рта, которые испытывают
наибольшую нагрузку. Обнаружено, что
количество лейкоцитов в подлежащей
соединительной ткани ничтожно там,
где выражен роговой слой, а там, где
слизистая оболочка не защищена роговым
слоем, отмечается скопление лейкоцитов,
что, очевидно, также является признаком
защитной функции слизистой оболочки.
Характерной особенностью клеток эпителия слизистой оболочки рта человека является способность к синтезу и накоплению большого количества гликогена. Обращает на себя внимание зависимость между количеством гликогена и выраженностью процесса ороговения: на участках с ороговевающим эпителием (слизистая оболочка твердого неба и десен) гликоген отсутствует или имеется в виде следов.
Эпителий соединяется с собственным (соединительнотканным) слоем слизистой оболочки посредством базальной мембраны. Этот слой образует многочисленные выступы (сосочки), внедряющиеся в эпителий. В них располагаются сосуды, питающие эпителий и нервы. Выросты эпителия, располагающиеся между соединительнотканными сосочками, называются эпителиальными сосочками. Они увеличивают площадь соприкосновения между эпителием и соединительнотканной основой и способствуют их соединению и обмену веществ между ними.
Собственный слой слизистой оболочки
рта без резкой границы переходит в
подслизистую основу, состоящую из рыхлой
соединительной ткани. Наряду с пучками
коллагеновых волокон здесь имеется и
жировая ткань. Подобного слоя нет в
слизистой оболочке языка, десен, твердого
неба.
Наряду с пучками
коллагеновых волокон здесь имеется и
жировая ткань. Подобного слоя нет в
слизистой оболочке языка, десен, твердого
неба.
Десневые сосочки образованы рыхлой соединительной тканью, в которой проходят капилляры и находится много чувствительных нервных окончаний. Здесь отсутствует подслизистая основа, а собственный слой слизистой оболочки непосредственно соединен с надкостницей челюсти. Вокруг каждого зуба есть десневой карман (щелевидное пространство между шейкой зуба и свободным краем десны). При нарушении целости эпителия в области зубодесневого кармана нарушается физиологический барьер зуба, и зубодесневой карман становится участком, где развивается патологический процесс (гингивит, пародонтоз).
Слизистая оболочка языка отличается
от описанных участков слизистой оболочки
рта. На языке она плотно сращена с
межмышечной соединительной тканью,
подслизистая основа отсутствует.
Спинка языка покрыта неравномерно
ороговевающим многослойным плоским
эпителием, слизистая утолщена и
шероховата.
Секреторная функция. Слизистая оболочка рта является начальным секреторным отделом пищеварительного тракта. Во всех ее участках, где имеется подслизистая основа, находятся малые слюнные железы в виде скопления железистых клеток. Наибольшее количество малых слюнных желез располагается в подслизистой основе губ и мягкого неба. Эти железы играют большую роль в физиологии полости рта. Они увлажняют слизистую оболочку, а в условиях патологического процесса нередко являются зоной первичных повреждений.
Защитная
функция нормальной микробной флоры
рта. Полость
рта на протяжении всей жизни человека
является входными воротами для множества
микроорганизмов, проникающих с
пищевыми продуктами, при дыхании и др.
Всего здесь насчитывается более
30 видов
различных микроорганизмов. Разнообразие
микробных форм объясняется
благоприятными условиями в полости рта
для их размножения: слабощелочной
реакцией, равномерной влажностью,
наличием остатков белковой и углеводной
пищи. Микробная флора полости рта
преимущественно представлена
грамположительными и реже грамотрицательными
бактериями. Несмотря на относительную
стабильность микробной флоры, у каждого
здорового человека в различные
периоды жизни она может изменяться.
У плода полость рта стерильна, микробная
флора попадает в нее при прохождении
ребенка через родовые пути и после
первого кормления. Преимущественно
аэробный характер микробной флоры
рта сохраняется до прорезывания
первых зубов. При появлении зубов у
ребенка в полости рта обнаруживаются
анаэробные бактерии, увеличивается
число грамотрицательных форм, и микробный
состав приобретает такой же характер,
как у взрослого человека. Это
обусловлено наличием зубных альвеол и
крипт, создающих благоприятные условия
для размножения анаэробных бактерий.
Для беззубых ртов характерно уменьшение
анаэробной флоры; число микробов
увеличивается у лиц, носящих зубные
протезы.
Микробная флора полости рта
преимущественно представлена
грамположительными и реже грамотрицательными
бактериями. Несмотря на относительную
стабильность микробной флоры, у каждого
здорового человека в различные
периоды жизни она может изменяться.
У плода полость рта стерильна, микробная
флора попадает в нее при прохождении
ребенка через родовые пути и после
первого кормления. Преимущественно
аэробный характер микробной флоры
рта сохраняется до прорезывания
первых зубов. При появлении зубов у
ребенка в полости рта обнаруживаются
анаэробные бактерии, увеличивается
число грамотрицательных форм, и микробный
состав приобретает такой же характер,
как у взрослого человека. Это
обусловлено наличием зубных альвеол и
крипт, создающих благоприятные условия
для размножения анаэробных бактерий.
Для беззубых ртов характерно уменьшение
анаэробной флоры; число микробов
увеличивается у лиц, носящих зубные
протезы.
Количество
микроорганизмов в полости рта человека
после рождения определяется множеством
различных факторов, в первую очередь
общим состоянием макроорганизма: у
здоровых людей их меньше, чем у больных.
Таким образом, нормальная микробная флора рта выполняет защитную функцию, препятствуя размножению занесенных из внешней среды микроорганизмов. Если же развитие микроорганизмов в полости рта подавляется (например, при приеме антибиотиков), то возникает д и с б а к т е р и о з, т. е. нарушение баланса между постоянными обитателями микробной флоры полости рта и нарастание случайной флоры. Следовательно, бактериальный антагонизм является существенным фактором антибактериальной защиты слизистой оболочки рта.
К
защитной функции слизистой оболочки
рта относится способность лейкоцитов,
принимающих участие в фагоцитозе,
проникать через физиологический
зубодесневой карман. В норме
1 см2 слюны содержит
4000 лейкоцитов,
за час их мигрирует в полость рта около
500 000. При
патологическом процессе в полости
рта количество лейкоцитов увеличивается.
Регенерация слизистой оболочки рта отражает ее физиологическое состояние. В течение суток слущивается большое количество клеток плоского эпителия. Регенерация эпителия происходит в результате постоянного митотического деления клеток базального и шиловидного слоев. Скорость обновления эпителия определяется величиной митотического индекса, который колеблется в зависимости от времени суток, возраста и пола человека.
Повышенная регенеративная способность слизистой оболочки рта обусловлена ранним появлением в ней гликогена, повышенным содержанием РНК, а также накоплением кислых гликозоаминогликанов. Быстрое заживление ран слизистой оболочки рта обусловлено и наличием в ней малодифференцированных клеточных элементов, тканевым иммунитетом и антибактериальными свойствами слюны.
Буферные
свойства
слизистой оболочки рта заключаются в
нейтрализации кислых и основных
соединений и быстром восстановлении
рН среды полости рта. Буферные свойства
зависят от наличия и толщины рогового
слоя и секрета слюнных желез. Они
изменяются при наличии патологических
процессов в органах полости рта, при
этом рН изменяется в кислую или основную
сторону.
Буферные свойства
зависят от наличия и толщины рогового
слоя и секрета слюнных желез. Они
изменяются при наличии патологических
процессов в органах полости рта, при
этом рН изменяется в кислую или основную
сторону.
Тургор и физическая прочность слизистой оболочки рта определяются способностью выдерживать давление, сжатие, растяжение. Тургор обусловлен гидрофильностью слизистой оболочки, ее эластичностью, которая зависит от состояния эластических и коллагеновых волокон и развития жировой клетчатки в подслизистой основе.
Таким образом, слизистая оболочка рта
обладает барьерной функцией, которая
обусловлена различными анатомическими
и функциональными факторами. К ним
относятся: неравномерность ороговения,
митотическая активность клеток эпителия
и повышенная способность к регенерации,
высокая активность обменных процессов,
накопление гликогена, наличие большого
количества клеточных элементов в
собственном слое слизистой оболочки и
миграции лейкоцитов в полость рта,
бактерицидное действие компонентов
слюны, симбиоз и антагонизм микробной
флоры, избирательная всасывающая
способность и физическая прочность
слизистой оболочки и др.
Возрастные особенности слизистой оболочки рта. Слизистая оболочка с возрастом претерпевает значительные изменения.
Грудной возраст. У грудных детей отмечается однотипное строение слизистой оболочки рта во всех его областях, обусловленное низкой дифференцировкой эпителия и соединительной ткани. Эпителиальный слой тонкий и состоит из двух слоев — базальных и шиловидных клеток. Эпителиальные сосочки не развиты. В этом возрасте эпителий всех отделов полости рта содержит большое количество гликогена и РНК, кроме того, в эпителии и соединительной ткани определяется значительное количество кислых гликозоаминогликанов. Базальная мембрана во всех отделах полости рта очень тонкая и легко подвергается различным воздействиям.
В собственной пластинке слизистой
оболочки определяется рыхлая
неоформленная соединительная ткань,
волокнистые структуры малодифференцированы.
Особенности слизистой оболочки
новорожденных обусловливают непрочность
и легкую ранимость ее в этом возрасте. В то же время качественный состав тканей
обеспечивает высокую способность к
регенерации. Передача через плаценту
материнских антител, гормонов, ферментов
и других биологически активных
веществ обусловливает достаточно
высокую резистентность организма
ребенка к возникновению вирусных и
бактериальных стоматитов на первом
году жизни.
В то же время качественный состав тканей
обеспечивает высокую способность к
регенерации. Передача через плаценту
материнских антител, гормонов, ферментов
и других биологически активных
веществ обусловливает достаточно
высокую резистентность организма
ребенка к возникновению вирусных и
бактериальных стоматитов на первом
году жизни.
1—3 года. В раннем детстве в слизистой оболочке рта уже четко формируются регионарные отличия, обусловленные ее морфофункциональными особенностями. В этом возрасте в эпителии языка, губ и щек отмечается сравнительно низкое содержание гликогена, наблюдается стабилизация процессов формирования эпителия.
Коллагеновые и эластические волокна собственной пластинки слизистой оболочки расположены рыхло, без определенной ориентации, имеют нежное и гонкое строение, связанное с низкой степенью их зрелости.
Отмечается
незначительное содержание кислых
гликозоаминогликанов и высокое
содержание клеточных элементов в
собственной пластинке слизистой оболочки
с преимущественной локализацией их
в области сосудов. Наличие клеточных
элементов в сочетании с большим
количеством кровеносных сосудов
способствует высокой проницаемости
сосудистой стенки в этих областях.
Наличие клеточных
элементов в сочетании с большим
количеством кровеносных сосудов
способствует высокой проницаемости
сосудистой стенки в этих областях.
В соединительной ткани слизистой оболочки у детей в возрасте 1—3 лет появляется большое количество тучных клеток, имеющих периваскулярное расположение. При этом важно отметить, что они представлены молодыми неактивными формами, что имеет определенное значение в условиях нарушения тканевого гомеостаза. Количество плазматических клеток и гистиоцитов остается незначительным.
Эпителиальный покров слизистой оболочки
десен и твердого неба более плотный,
что обусловлено значительным уплощением
эпителиальных клеток и наличием зон
ороговения и паракератоза. Наряду с
этим исчезает гликоген, который,
вероятно, используется в процессах
кератинизации. Базальная мембрана и
волокнистые структуры собственной
пластинки слизистой оболочки десен и
твердого неба более плотные по сравнению
с грудным возрастом, что обусловлено
ориентированным расположением отдельных
волокон и пучков.
Таким образом, морфологические особенности слизистой оболочки рта в период от 1 года до 3 лет могут явиться одним из факторов, обусловливающих быстрое развитие и острое течение патологического процесса в ней.
4—12 лет. В возрасте от 4 до 12 лет происходят количественные и качественные изменения слизистой оболочки рта, обусловленные характером обменных процессов организма ребенка в этом периоде. Увеличиваются объем эпителия и содержание в нем гликогена и РНК по сравнению с ранним детским возрастом. Происходят уплотнение и огрубение базальной мембраны. В собственной пластинке слизистой оболочки нарастает количество ретикулиновых и эластических структур, созревает коллаген.
Меняется и клеточный состав
соединительнотканной основы. Значительно
возрастает количество лимфоидно-гистиоцитарных
элементов, образующих перива окулярные
инфильтраты. Появление лимфоидно-гистиоцитарных
скоплений, именуемых в литературе
круглоклеточными, свойственно
иммунологическим сдвигам и имеет
отношение к изменению белкового обмена,
так как сначала идет накопление
клеток, продуцирующих антитела (лимфоциты,
плазматические клетки), а затем выработка
специфических глобулинов, т. е.
собственно антител.
е.
собственно антител.
Подобная качественная перестройка структур слизистой оболочки у детей этого возраста связана, по-видимому, с сенсибилизацией организма и формированием защитных механизмов.
Происходят количественные и качественные изменения тучных клеток. Прежде всего значительно снижается их численность по сравнению с ранним детским периодом. Нарастает их активность, обусловленная накоплением в цитоплазме гепарина. Выделившийся из тучных клеток гепарин действует как неспецифический фактор защиты:
блокирует протеолитические и муколитические ферменты крови и тканей, нормализует патологическую проницаемость кровеносных капилляров и тем самым способствует восстановлению тканевого метаболизма.
12—14 лет. Возрастные
гистологические и гистохимические
отличия в возрасте после
10 лет и
главным образом после
12—14 лет
обусловлены влиянием факторов
гормональной регуляции. Этим
объясняется происхождение юношеских
гингивитов и лейкоплакий.
Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте
Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Воложин А.И.
Московский государственный медико-стоматологический университет
Гемонов В.В.
Кафедра патологической физиологии, кафедра госпитальной терапевтической стоматологии, пародонтологии и гериартрической стоматологии Московского государственного медико-стоматологического университета
Кабалоева Д. В.
В.
Кафедра патологической физиологии, кафедра госпитальной терапевтической стоматологии, пародонтологии и гериартрической стоматологии Московского государственного медико-стоматологического университета
Суражев Б.Ю.
Кафедра госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии Московского государственного медико-стоматологического университета
Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте
Авторы:
Воложин А.И., Гемонов В.В., Кабалоева Д.В., Суражев Б.Ю.
Подробнее об авторах
Журнал: Российская стоматология. 2011;4(1): 32‑37
Как цитировать:
Воложин А.И., Гемонов В.В., Кабалоева Д.В., Суражев Б. Ю. Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте. Российская стоматология.
2011;4(1):32‑37.
Ю. Заживление хирургической раны слизистой оболочки полости рта под влиянием применения рекомбинантного эпидермального фактора роста в эксперименте. Российская стоматология.
2011;4(1):32‑37.
Volozhin AI, Gemonov VV, Kabaloeva DV, Surazhev BIu. Healing of surgical wound in oral mucosa after the treatment with recombinant epidermal growth factor in experiment. Russian Stomatology. 2011;4(1):32‑37. (In Russ.)
Читать метаданные
Экспериментальное исследование позволило установить благоприятное влияние применения рекомбинантного эпидермального фактора роста на регенерацию при лечении ран слизистой оболочки полости рта у здоровых крыс. Анализ полученных данных показал, что преимущественное усиление репаративной регенерации было достигнуто при повышении концентрации препарата в питьевой воде до 500 мкг/мл.
Ключевые слова:
рекомбинантный эпидермальный фактор роста
регенерация слизистой оболочки полости рта
лечение ран
Авторы:
Воложин А. И.
И.
Московский государственный медико-стоматологический университет
Гемонов В.В.
Кафедра патологической физиологии, кафедра госпитальной терапевтической стоматологии, пародонтологии и гериартрической стоматологии Московского государственного медико-стоматологического университета
Кабалоева Д.В.
Кафедра патологической физиологии, кафедра госпитальной терапевтической стоматологии, пародонтологии и гериартрической стоматологии Московского государственного медико-стоматологического университета
Суражев Б.Ю.
Кафедра госпитальной терапевтической стоматологии, пародонтологии и гериатрической стоматологии Московского государственного медико-стоматологического университета
Закрыть метаданные
Факторы роста при лечении ран
Травма слизистой оболочки полости рта является распространенной причиной обращения за стоматологической помощью. Ее возникновение обусловлено различными причинами: хирургическими вмешательствами, ожогами и повреждениями при местном применении лекарственных препаратов; нарушением целостности слизистой оболочки в период адаптации к съемным протезам; механическим воздействием на десну и слизистую оболочку во время препарирования зубов, краем искусственной коронки и др.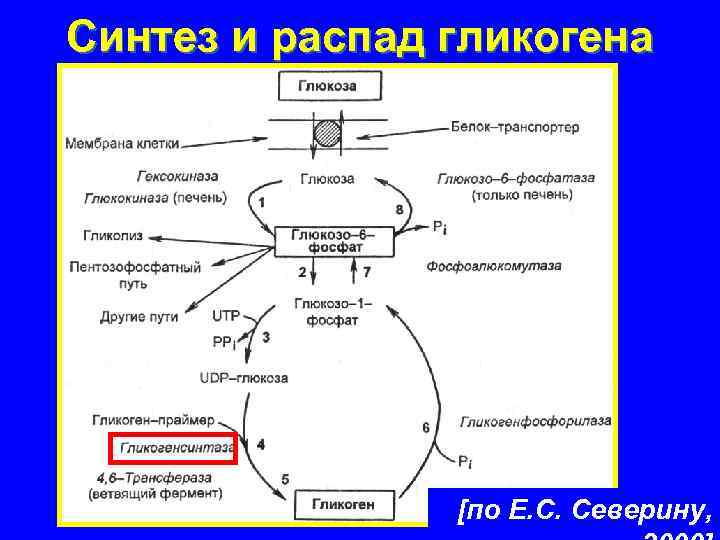 Негативные особенности заживления подобных ран обусловлены наличием в полости рта разнообразной микробной флоры, постоянной механической и термической нагрузкой на ткани этой локализации и высокой специфичностью их гистологического строения [9]. Несмотря на различную этиологию поражений, общим принципом лечения таких пациентов в стоматологической клинике является применение средств, направленных на регенеративные процессы в тканях [3]. Учитывая, что регенерация тканей представляет собой четко регулируемый каскадный и многокомпонентный морфофункциональный процесс, обеспечиваемый сложными кооперативными межклеточными взаимодействиями, представляет интерес поиск препаратов, применение которых обеспечило бы наилучший результат регенерации слизистой оболочки полости рта [4, 7]. Получение рекомбинантного эпидермального фактора роста (РЭФР) и его экспериментальное испытание на моделях регенерации эпидермиса явилось мощным толчком к развитию этого направления. РЭФР не обладает видовой специфичностью, т.
Негативные особенности заживления подобных ран обусловлены наличием в полости рта разнообразной микробной флоры, постоянной механической и термической нагрузкой на ткани этой локализации и высокой специфичностью их гистологического строения [9]. Несмотря на различную этиологию поражений, общим принципом лечения таких пациентов в стоматологической клинике является применение средств, направленных на регенеративные процессы в тканях [3]. Учитывая, что регенерация тканей представляет собой четко регулируемый каскадный и многокомпонентный морфофункциональный процесс, обеспечиваемый сложными кооперативными межклеточными взаимодействиями, представляет интерес поиск препаратов, применение которых обеспечило бы наилучший результат регенерации слизистой оболочки полости рта [4, 7]. Получение рекомбинантного эпидермального фактора роста (РЭФР) и его экспериментальное испытание на моделях регенерации эпидермиса явилось мощным толчком к развитию этого направления. РЭФР не обладает видовой специфичностью, т. е. функционирует у животных различных видов. Эпидермальный фактор роста (ЭФР) специфически связывается с рецепторами на поверхности клеточных мембран, стимулируя тем самым пролиферацию, таксис и дифференциацию клеток, что способствует быстрому и качественному заживлению ран [5, 10]. Этот фактор управляет ростом клеток эпителия, эндотелия и фибробластов, регулирует их хемотаксис [2]. При повреждениях в полости раны количество рецепторов к ЭФР возрастает [6]. Это вызывает перемещение клеток из здоровых неповрежденных тканей в пораженные участки [1, 8]. Эффективность отечественного РЭФР для оптимизации заживления ран слизистой оболочки полости рта еще не была изучена в эксперименте. Сейчас РЭФР проходит экспериментальную проверку, по итогам которой может быть рекомендован в качестве специфического стимулятора заживления ран на слизистой оболочке полости рта.
е. функционирует у животных различных видов. Эпидермальный фактор роста (ЭФР) специфически связывается с рецепторами на поверхности клеточных мембран, стимулируя тем самым пролиферацию, таксис и дифференциацию клеток, что способствует быстрому и качественному заживлению ран [5, 10]. Этот фактор управляет ростом клеток эпителия, эндотелия и фибробластов, регулирует их хемотаксис [2]. При повреждениях в полости раны количество рецепторов к ЭФР возрастает [6]. Это вызывает перемещение клеток из здоровых неповрежденных тканей в пораженные участки [1, 8]. Эффективность отечественного РЭФР для оптимизации заживления ран слизистой оболочки полости рта еще не была изучена в эксперименте. Сейчас РЭФР проходит экспериментальную проверку, по итогам которой может быть рекомендован в качестве специфического стимулятора заживления ран на слизистой оболочке полости рта.
Целью настоящей работы явилось экспериментальное обоснование применения РЭФР для оптимизации заживления повреждений слизистой оболочки полости рта.
Материал и методы
ЭФР относится к группе факторов роста (цитокины) и является полипептидом, состоящим из 53 аминокислот, его молекулярная масса 6021 Д. Фактор устойчив к действию кислот и высоких температур. Относится к наиболее стабильным из всех изученных белков. ЭФР играет значительную роль в регуляции обменных и восстановительных процессов, присутствуя в клетках всех тканей организма и регулируя рост клеток. Стимулирует таксис противовоспалительных клеток, что способствует быстрому и качественному заживлению ран.
Эксперимент выполнен на 36 белых крысах линии Вистар, массой 220-280 г. Под наркозом (Zoletil 50, «Vibrac», Франция) животным наносили круглые раны диаметром 5 мм на твердом небе до кости. Кровотечение останавливали гемостатической губкой. Животных были разделены на 3 группы по 12 крыс в каждой. В 1-й группе животные постоянно получали чистую питьевую воду; во 2-й группе животным давали воду с РЭФР в концентрации 100 мкг/мл; в 3-й группе животные получали воду с РЭФР в концентрации 500 мкг/мл.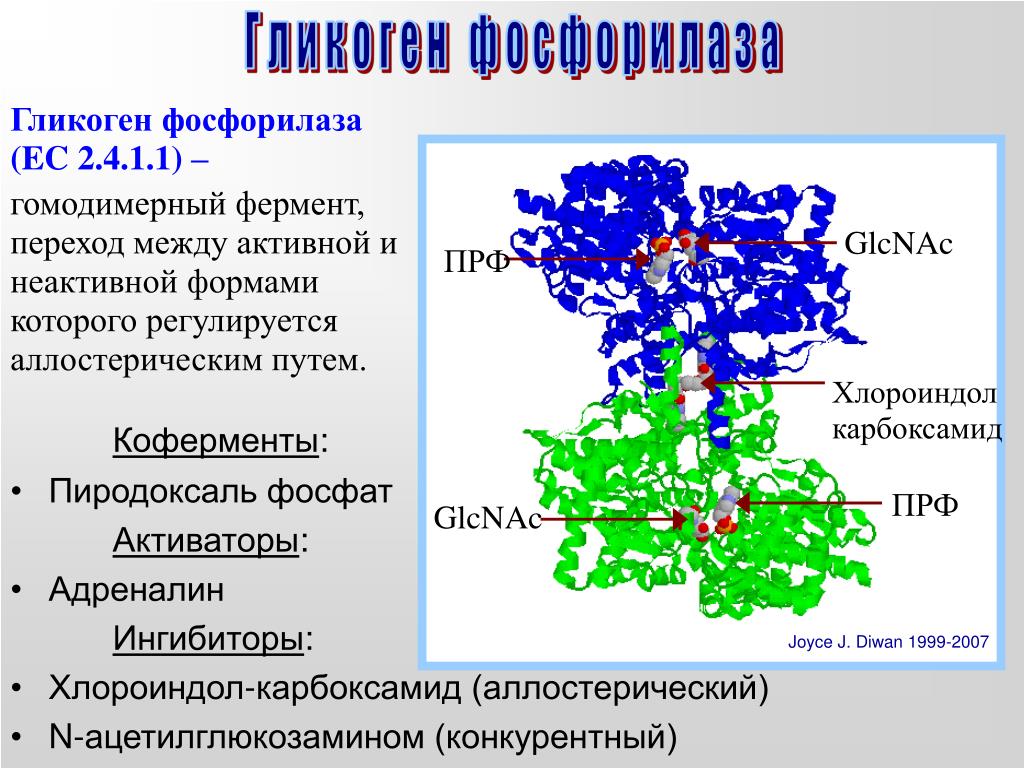 Растворы для питья готовили ежедневно, хранили при температуре –40°С. Воду с РЭФР животные 2-й и 3-й групп получали с 9 до 18 ч, в остальное время крысы пили обычную водопроводную воду, потребляли одинаковое количество жидкости, получали сбалансированный брикетированный корм. Из эксперимента животных выводили на 3, 7, 14 и 21-е сутки.
Растворы для питья готовили ежедневно, хранили при температуре –40°С. Воду с РЭФР животные 2-й и 3-й групп получали с 9 до 18 ч, в остальное время крысы пили обычную водопроводную воду, потребляли одинаковое количество жидкости, получали сбалансированный брикетированный корм. Из эксперимента животных выводили на 3, 7, 14 и 21-е сутки.
Выделяли верхнюю челюсть, фиксировали в 10% нейтральном формалине, декальцинировали в трилоне Б, заливали в целлоидин. Микропрепараты окрашивали гематоксилином и эозином, PAS-реакцией, азокармином, импрегнировали серебром. Динамику заживления ран оценивали планиметрически и патоморфологически, гистохимическую оценку репаративного процесса проводили по содержанию гликозаминогликанов, гликогена и нуклеиновых кислот.
РЭФР предоставлен ГНИИ особо чистых биопрепаратов (Санкт-Петербург). В России РЭФР синтезирован из E. сoli.
Результаты и обсуждение
В 1-й группе на 3-й день наблюдений диаметр раны у всех животных не отличался от первоначального в момент ее нанесения. Края раны ровные, на поверхности тонкий, мягкий струп из сохранивших жизнедеятельность лейкоцитов, склеенных плазмой. Центральная часть раны ограничена пластом многослойного эпителия. Дно дефекта образовано костной тканью твердого неба, покрытой утолщенной надкостницей (рис. 1).Рисунок 1. Раневой дефект на 3-и сутки (1-я группа). Костная ткань на дне дефекта. Утолщенная надкостница. Окраска гематоксилином и эозином. ×200. В самой кости и в надкостнице воспалительный процесс. Наряду с ним на границе дефекта с тканью отмечено начало репаративных процессов. На 7-е сутки область раны окружена пластом эпителия, внедряющимся под струп (рис. 2).Рисунок 2. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Наползающий пласт эпителия. Окраска гематоксилином и эозином. ×200. Диаметр дефекта уменьшается за счет наползания пласта эпителия под струп. Под струпом на поверхности кости располагается утолщенная надкостница с клетками фибробластического ряда. В клетках регенерирующего эпителия гранулы гликогена, заполняющие цитоплазму новообразованных клеток (рис.
Края раны ровные, на поверхности тонкий, мягкий струп из сохранивших жизнедеятельность лейкоцитов, склеенных плазмой. Центральная часть раны ограничена пластом многослойного эпителия. Дно дефекта образовано костной тканью твердого неба, покрытой утолщенной надкостницей (рис. 1).Рисунок 1. Раневой дефект на 3-и сутки (1-я группа). Костная ткань на дне дефекта. Утолщенная надкостница. Окраска гематоксилином и эозином. ×200. В самой кости и в надкостнице воспалительный процесс. Наряду с ним на границе дефекта с тканью отмечено начало репаративных процессов. На 7-е сутки область раны окружена пластом эпителия, внедряющимся под струп (рис. 2).Рисунок 2. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Наползающий пласт эпителия. Окраска гематоксилином и эозином. ×200. Диаметр дефекта уменьшается за счет наползания пласта эпителия под струп. Под струпом на поверхности кости располагается утолщенная надкостница с клетками фибробластического ряда. В клетках регенерирующего эпителия гранулы гликогена, заполняющие цитоплазму новообразованных клеток (рис.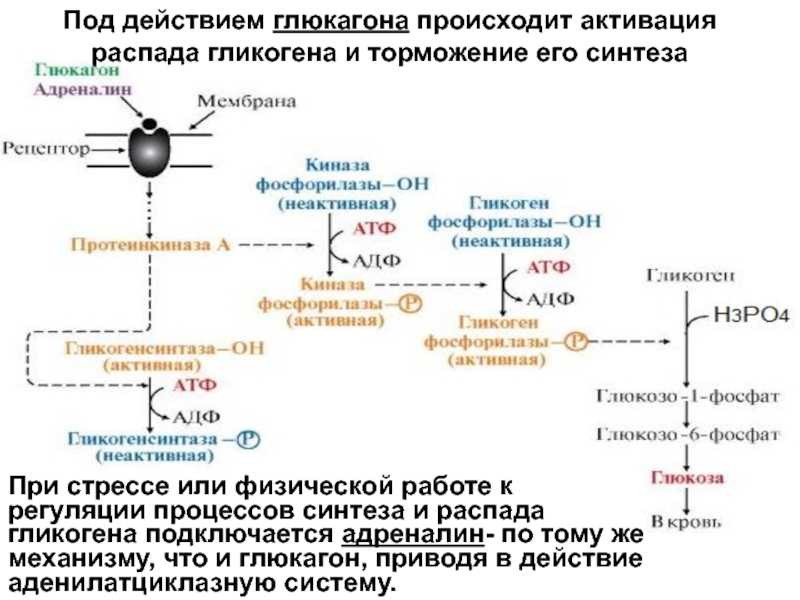 3).Рисунок 3. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Гликоген в наползающем пласте эпителия. Окраска: PAS-реакция. ×200. По краю дефекта происходит образование грануляционной ткани, ее основная масса представлена фибробластами различной степени зрелости, макрофагами, отдельными сегментоядерными лейкоцитами и тонкими пучками коллагеновых волокон. Фибробласты заполняли саму зону дефекта, формируя поверх костной ткани грануляционную ткань, содержащую кровеносные капилляры, по которой шло напластование эпителия. На 14-е сутки сохранялся тонкий струп. Пласт эпителия продолжал свое движение к центру дефекта. В эпителии появлялись клетки с признаками паракератоза, что свидетельствует о дифференциации клеток. Гликогенсодержащие клетки располагались непосредственно на мигрирующем крае эпителиального пласта. По мере дифференциации эпителиоцитов глыбки гликогена в них исчезали. Наползание пласта эпителия шло по грануляционной ткани, в этот период отмечалось увеличение коллагеновых волокон, происходило восстановление соединительнотканной основы (рис.
3).Рисунок 3. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (1-я группа). Гликоген в наползающем пласте эпителия. Окраска: PAS-реакция. ×200. По краю дефекта происходит образование грануляционной ткани, ее основная масса представлена фибробластами различной степени зрелости, макрофагами, отдельными сегментоядерными лейкоцитами и тонкими пучками коллагеновых волокон. Фибробласты заполняли саму зону дефекта, формируя поверх костной ткани грануляционную ткань, содержащую кровеносные капилляры, по которой шло напластование эпителия. На 14-е сутки сохранялся тонкий струп. Пласт эпителия продолжал свое движение к центру дефекта. В эпителии появлялись клетки с признаками паракератоза, что свидетельствует о дифференциации клеток. Гликогенсодержащие клетки располагались непосредственно на мигрирующем крае эпителиального пласта. По мере дифференциации эпителиоцитов глыбки гликогена в них исчезали. Наползание пласта эпителия шло по грануляционной ткани, в этот период отмечалось увеличение коллагеновых волокон, происходило восстановление соединительнотканной основы (рис.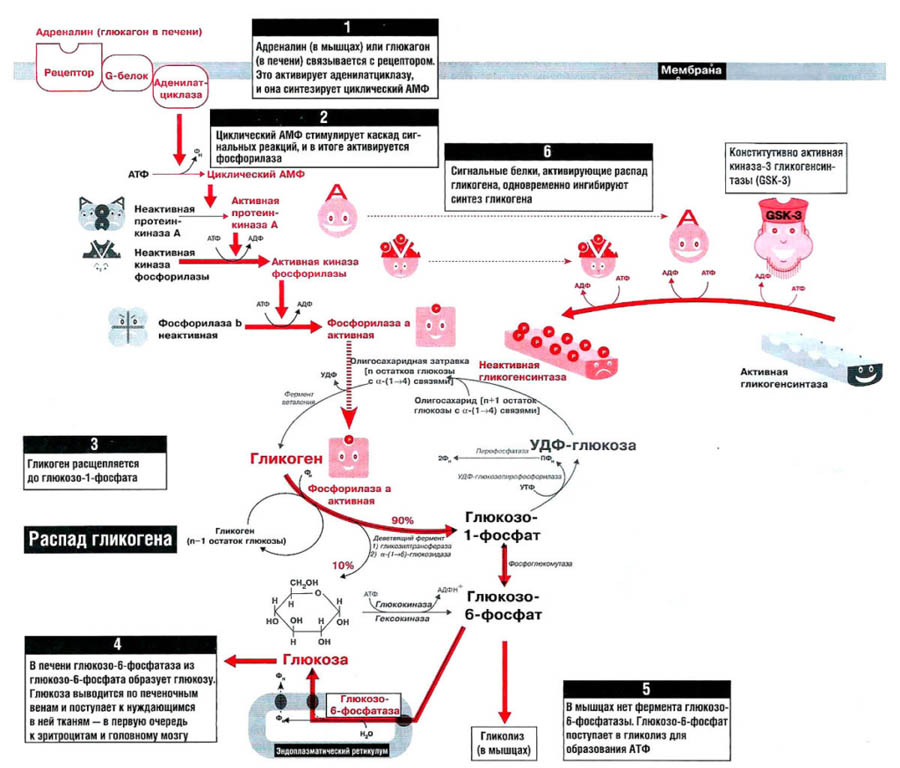 4).Рисунок 4. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (1-я группа). Новообразованные пучки коллагеновых волокон (синего цвета) в зоне дефекта. Окраска азокармином. ×200. Незакрытым пластом эпителия оставался лишь центральный участок дефекта. На 21-е сутки зона дефекта во всех наблюдениях была перекрыта утолщенным эпителием с менее выраженным роговым слоем. Нижняя поверхность его имела ровную границу. Под эпителием волокнистая соединительная ткань, богатая фибробластами различной степени зрелости. Обнаруживаются кровеносные сосуды, заполненные форменными элементами. В двух случаях центр дефекта оставался незакрытым эпителием, что связано с воспалительным процессом. При этом на поверхности дефекта находился струп, и эпителизация шла под его поверхностью.
4).Рисунок 4. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (1-я группа). Новообразованные пучки коллагеновых волокон (синего цвета) в зоне дефекта. Окраска азокармином. ×200. Незакрытым пластом эпителия оставался лишь центральный участок дефекта. На 21-е сутки зона дефекта во всех наблюдениях была перекрыта утолщенным эпителием с менее выраженным роговым слоем. Нижняя поверхность его имела ровную границу. Под эпителием волокнистая соединительная ткань, богатая фибробластами различной степени зрелости. Обнаруживаются кровеносные сосуды, заполненные форменными элементами. В двух случаях центр дефекта оставался незакрытым эпителием, что связано с воспалительным процессом. При этом на поверхности дефекта находился струп, и эпителизация шла под его поверхностью.
Во 2-й группе (РЭФР 100 мкг/мл) на 3-и сутки дефект покрыт эластичным струпом. Отмечается образование грануляционной ткани. По краям раны утолщенный пласт регенерирующего эпителия без ороговения, а в его клетках выявлялся гликоген (рис.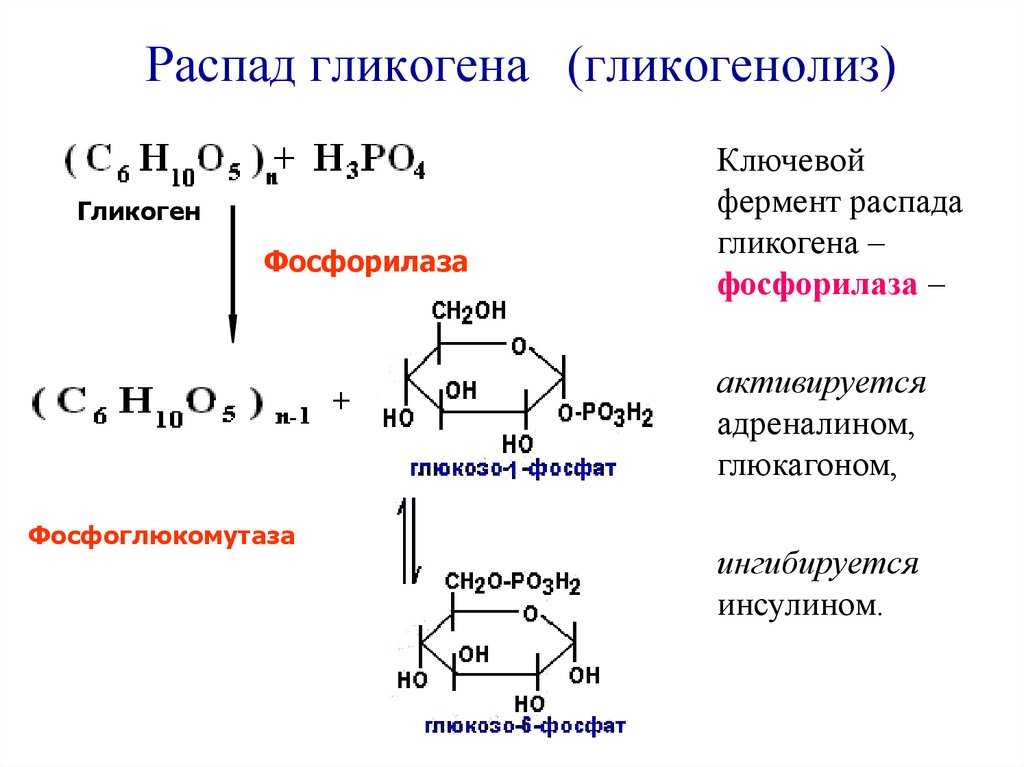 5).Рисунок 5. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (2-я группа). Начало эпителизации. Наползание эпителия под струпом. В пласте эпителия содержится гликоген. Окраска: PAS-реакция. ×200. Под струпом скопление фибробластов, макрофагов, лейкоцитов. Средняя часть дефекта заполнена рыхло расположенными лейкоцитами и макрофагами, а также фибробластами различной степени зрелости. Костная ткань покрыта утолщенной надкостницей, в составе которой обнаруживались остеобласты. В некоторых случаях отмечалось образование костной ткани. На 7-е сутки эксперимента по краю раны прогрессирующая эпителизация. Эпителиальный пласт утолщен, внедряется под струп, имеет ровную нижнюю поверхность. Толщина струпа неравномерна и варьировала в широких пределах. Эпителиальные сосочки отсутствовали.
5).Рисунок 5. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (2-я группа). Начало эпителизации. Наползание эпителия под струпом. В пласте эпителия содержится гликоген. Окраска: PAS-реакция. ×200. Под струпом скопление фибробластов, макрофагов, лейкоцитов. Средняя часть дефекта заполнена рыхло расположенными лейкоцитами и макрофагами, а также фибробластами различной степени зрелости. Костная ткань покрыта утолщенной надкостницей, в составе которой обнаруживались остеобласты. В некоторых случаях отмечалось образование костной ткани. На 7-е сутки эксперимента по краю раны прогрессирующая эпителизация. Эпителиальный пласт утолщен, внедряется под струп, имеет ровную нижнюю поверхность. Толщина струпа неравномерна и варьировала в широких пределах. Эпителиальные сосочки отсутствовали.
В новообразованном эпителии гликоген в виде мелких глыбок (рис. 6).Рисунок 6. Слизистая оболочка твердого неба на участке раны к 7-м суткам эксперимента (2-я группа). Пласт новообразованного эпителия внедряется под расположенный на поверхности дефекта струп.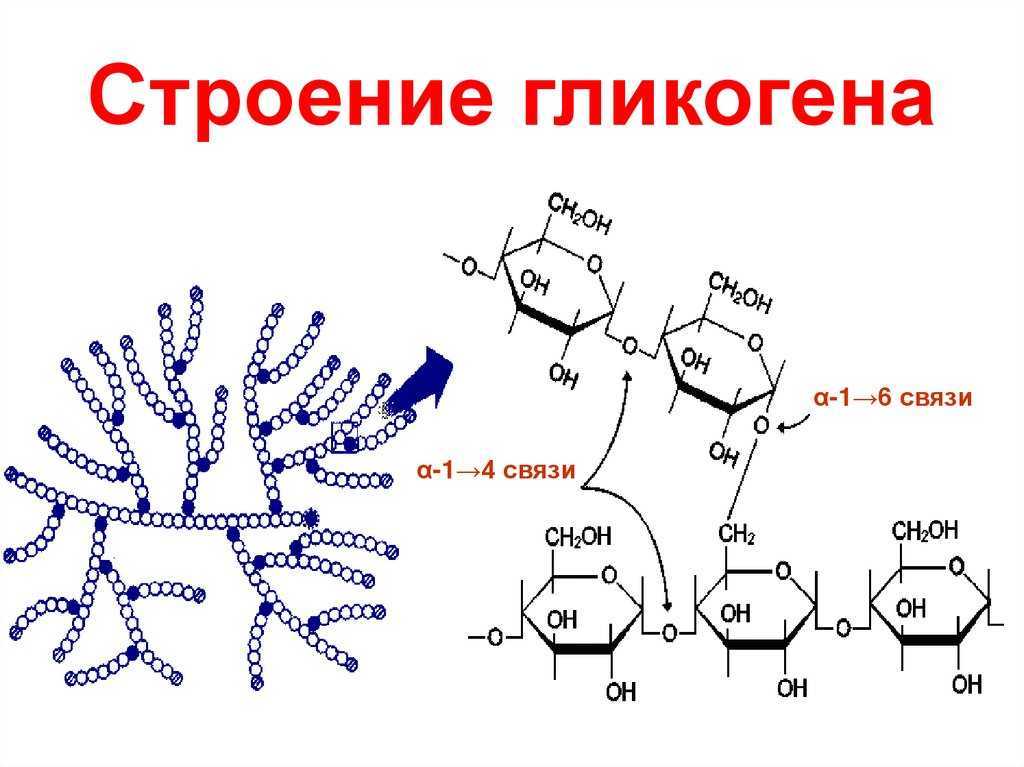 В эпителии располагается гликоген. Окраска: PAS-реакция. ×200. Под эпителием типичная грануляционная ткань с наличием капилляров и клеток: фибробластов, отдельных макрофагов, а ближе к центру дефекта располагались лейкоциты. Репаративные процессы шли от периферии к центру дефекта. Это относилось к образованию грануляционной ткани и процессу эпителизации дефекта. Сам процесс эпителизации происходил быстрее по сравнению с аналогичным сроком у животных 1-й группы. Это ускорение репаративных процессов относилось и к дифференциации новообразованного пласта эпителия. На 14-е сутки значительная часть дефекта была покрыта утолщенным пластом новообразованного эпителия. У одной из крыс отмечено полное перекрытие дефекта эпителием, характеризующимся выраженным роговым слоем (рис. 7).Рисунок 7. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Большая часть дефекта закрыта эпителием с явлением ороговения. Окраска гематоксилином и эозином. ×200. Его поверхностную часть образовывали клетки с явлениями ороговения, и лишь клетки самой передней части эпителиального клина не имели признаков ороговения.
В эпителии располагается гликоген. Окраска: PAS-реакция. ×200. Под эпителием типичная грануляционная ткань с наличием капилляров и клеток: фибробластов, отдельных макрофагов, а ближе к центру дефекта располагались лейкоциты. Репаративные процессы шли от периферии к центру дефекта. Это относилось к образованию грануляционной ткани и процессу эпителизации дефекта. Сам процесс эпителизации происходил быстрее по сравнению с аналогичным сроком у животных 1-й группы. Это ускорение репаративных процессов относилось и к дифференциации новообразованного пласта эпителия. На 14-е сутки значительная часть дефекта была покрыта утолщенным пластом новообразованного эпителия. У одной из крыс отмечено полное перекрытие дефекта эпителием, характеризующимся выраженным роговым слоем (рис. 7).Рисунок 7. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Большая часть дефекта закрыта эпителием с явлением ороговения. Окраска гематоксилином и эозином. ×200. Его поверхностную часть образовывали клетки с явлениями ороговения, и лишь клетки самой передней части эпителиального клина не имели признаков ороговения. В них обнаруживались скопления гликогена, которые сливались в однородную массу. Под эпителием располагалась грануляционная ткань с коллагеновыми и аргирофильными волокнами (рис. 8).Рисунок 8. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Коллагеновые и аргирофильные волокна в расположенной под эпителием ткани. Окраска: импрегнация серебром. ×400. У остальных крыс большая часть дефекта покрыта новообразованным пластом эпителия. На 21-е сутки дефекты у всех крыс были эпителизированы. По краям раны структура эпителия была полностью восстановлена, сам пласт немного утолщен (рис. 9).Рисунок 9. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (2-я группа). Область дефекта закрыта утолщенным пластом эпителия с наличием в клетках шиповатого слоя следов гликогена. Окраска: PAS-реакция. ×400. Струпа на поверхности раны нет. Дифференциация эпителия шла от центра дефекта к его периферии. По периферии отмечалось полное восстановление структуры эпителиального пласта.
В них обнаруживались скопления гликогена, которые сливались в однородную массу. Под эпителием располагалась грануляционная ткань с коллагеновыми и аргирофильными волокнами (рис. 8).Рисунок 8. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (2-я группа). Коллагеновые и аргирофильные волокна в расположенной под эпителием ткани. Окраска: импрегнация серебром. ×400. У остальных крыс большая часть дефекта покрыта новообразованным пластом эпителия. На 21-е сутки дефекты у всех крыс были эпителизированы. По краям раны структура эпителия была полностью восстановлена, сам пласт немного утолщен (рис. 9).Рисунок 9. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (2-я группа). Область дефекта закрыта утолщенным пластом эпителия с наличием в клетках шиповатого слоя следов гликогена. Окраска: PAS-реакция. ×400. Струпа на поверхности раны нет. Дифференциация эпителия шла от центра дефекта к его периферии. По периферии отмечалось полное восстановление структуры эпителиального пласта. Имело место восстановление рогового слоя и соединительнотканной основы, состоявшей из пучков коллагеновых волокон. Нижняя поверхность эпителиального пласта имела на большом протяжении сосочки, их появление шло от периферии дефекта к его центру.
Имело место восстановление рогового слоя и соединительнотканной основы, состоявшей из пучков коллагеновых волокон. Нижняя поверхность эпителиального пласта имела на большом протяжении сосочки, их появление шло от периферии дефекта к его центру.
В 3-й группе (РЭФР 500 мкг/мл) уже на 3-и сутки было отмечено наползание эпителия с краев дефекта, на поверхности которого располагался тонкий струп (рис. 10).Рисунок 10. Слизистая оболочка твердого неба на участке раны к 3-м суткам эксперимента (3-я группа). Наползание толстого пласта новообразованного эпителия. Эпителий внедряется под струп. Окраска гематоксилином и эозином. ×400. Толщина и рост наползающего под струп новообразованного эпителия более интенсивны, чем в 1-й группе. Утолщение идет в основном за счет клеток шиповатого слоя. Под пластом новообразованного эпителия образовывалась грануляционная ткань, богатая фибробластами различной степени зрелости и макрофагами. Новообразованный эпителий имел толстый роговой слой, нижняя поверхность эпителия была неровная за счет образованных здесь эпителиальных сосочков. На 7-е сутки эпителизация дефекта в сравнении с 1-й группой была более интенсивной. Эпителий покрывал большую часть дефекта, имел довольно толстый роговой слой. Активно образовывалась волокнистая соединительная ткань. Струп большей частью отсутствовал, и в этих участках поверхность дефекта была перекрыта тонкой эластичной пленкой, состоящей из плазмы крови и отдельных лейкоцитов. Под пластом эпителия располагалась новообразованная соединительная ткань с пучками рыхло расположенных коллагеновых волокон, а также разнообразных клеточных элементов. Вся площадь дефекта заполнена волокнистой соединительной тканью, которая ниже новообразованного пласта эпителия срасталась с надкостницей. Кость имела строение, типичное для пластинчатой кости, на ее поверхности располагались остеобласты. В некоторых участках отмечались узуры, заполненные соединительной тканью. На 14-е сутки у всех крыс дефект перекрыт эпителием с выраженным роговым слоем (рис. 11).Рисунок 11. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (3-я группа).
На 7-е сутки эпителизация дефекта в сравнении с 1-й группой была более интенсивной. Эпителий покрывал большую часть дефекта, имел довольно толстый роговой слой. Активно образовывалась волокнистая соединительная ткань. Струп большей частью отсутствовал, и в этих участках поверхность дефекта была перекрыта тонкой эластичной пленкой, состоящей из плазмы крови и отдельных лейкоцитов. Под пластом эпителия располагалась новообразованная соединительная ткань с пучками рыхло расположенных коллагеновых волокон, а также разнообразных клеточных элементов. Вся площадь дефекта заполнена волокнистой соединительной тканью, которая ниже новообразованного пласта эпителия срасталась с надкостницей. Кость имела строение, типичное для пластинчатой кости, на ее поверхности располагались остеобласты. В некоторых участках отмечались узуры, заполненные соединительной тканью. На 14-е сутки у всех крыс дефект перекрыт эпителием с выраженным роговым слоем (рис. 11).Рисунок 11. Слизистая оболочка твердого неба на участке раны к 14-м суткам эксперимента (3-я группа). Новообразованный пласт эпителия, перекрывающий зону травмы. На поверхности пласта четко виден роговой слой. Окраска гематоксилином и эозином. ×200. На его поверхности располагались уплощенные роговые чешуйки, которые местами слущивались. Лишь в отдельных случаях в самом центре дефекта имелся утолщенный пласт эпителия. Скорость пролиферации эпителия заметно увеличивалась. Подлежащая соединительная ткань построена из волокнистых структур, изменяющих свое расположение. Часть из них располагалась параллельно пласту эпителия. Нижняя поверхность эпителия образовывала выросты или сосочки. Подлежащая костная ткань имела обычную структуру, характерную для пластинчатой кости. На 21-е сутки выявлена полная регенерация эпителия, восстановлена и структура эпителиального пласта. На всем протяжении на поверхности эпителия имело место восстановление рогового слоя (рис. 12).Рисунок 12. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (3-я группа). Новообразованный утолщенный пласт эпителия с выраженным роговым слоем.
Новообразованный пласт эпителия, перекрывающий зону травмы. На поверхности пласта четко виден роговой слой. Окраска гематоксилином и эозином. ×200. На его поверхности располагались уплощенные роговые чешуйки, которые местами слущивались. Лишь в отдельных случаях в самом центре дефекта имелся утолщенный пласт эпителия. Скорость пролиферации эпителия заметно увеличивалась. Подлежащая соединительная ткань построена из волокнистых структур, изменяющих свое расположение. Часть из них располагалась параллельно пласту эпителия. Нижняя поверхность эпителия образовывала выросты или сосочки. Подлежащая костная ткань имела обычную структуру, характерную для пластинчатой кости. На 21-е сутки выявлена полная регенерация эпителия, восстановлена и структура эпителиального пласта. На всем протяжении на поверхности эпителия имело место восстановление рогового слоя (рис. 12).Рисунок 12. Слизистая оболочка твердого неба на участке раны к 21-м суткам эксперимента (3-я группа). Новообразованный утолщенный пласт эпителия с выраженным роговым слоем.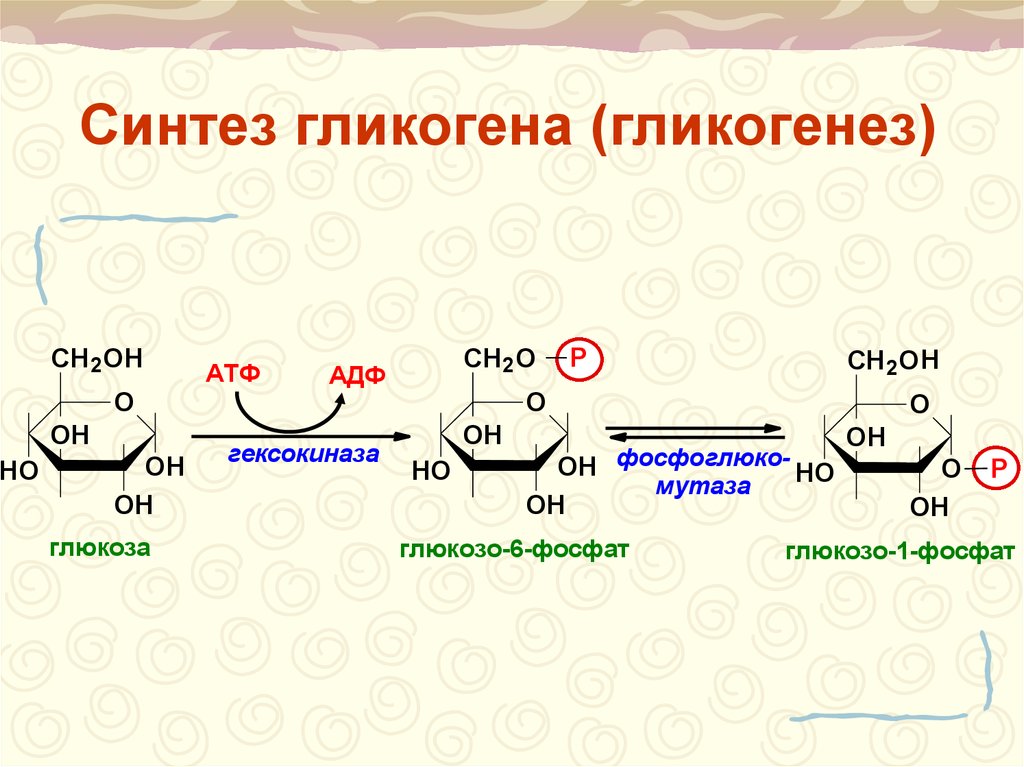 Коллагеновые волокна в подлежащей соединительной ткани. Окраска азокармином. ×400. Роговые чешуйки плотно прилежат друг к другу. Сам роговой слой отличался от остальных слоев по окраске. Гликоген в новообразованном эпителии нигде не выявлялся. Нижняя поверхность эпителиального пласта имеет волнообразный вид за счет образовавшихся здесь эпителиальных сосочков. Соединительная ткань собственной пластинки слизистой оболочки содержала волокнистые структуры и клеточные элементы, главным образом фибробласты.
Коллагеновые волокна в подлежащей соединительной ткани. Окраска азокармином. ×400. Роговые чешуйки плотно прилежат друг к другу. Сам роговой слой отличался от остальных слоев по окраске. Гликоген в новообразованном эпителии нигде не выявлялся. Нижняя поверхность эпителиального пласта имеет волнообразный вид за счет образовавшихся здесь эпителиальных сосочков. Соединительная ткань собственной пластинки слизистой оболочки содержала волокнистые структуры и клеточные элементы, главным образом фибробласты.
Таким образом, исследование установило благоприятное влияние применения РЭФР при заживлении ран слизистой оболочки полости рта. Анализ полученных данных показал, что наиболее оптимальной концентрацией препарата является 500 мкг/мл. Именно в этом случае происходит выраженное ускорение процесса эпителизации дефекта. В целом процесс репаративной регенерации осуществляется на базе одного и того же комплекса стереотипных реакций без проявления каких-либо новых их вариантов. Говоря о влиянии РЭФР, можно лишь отметить ускорение восстановительных процессов в слизистой оболочке неба у экспериментальных животных.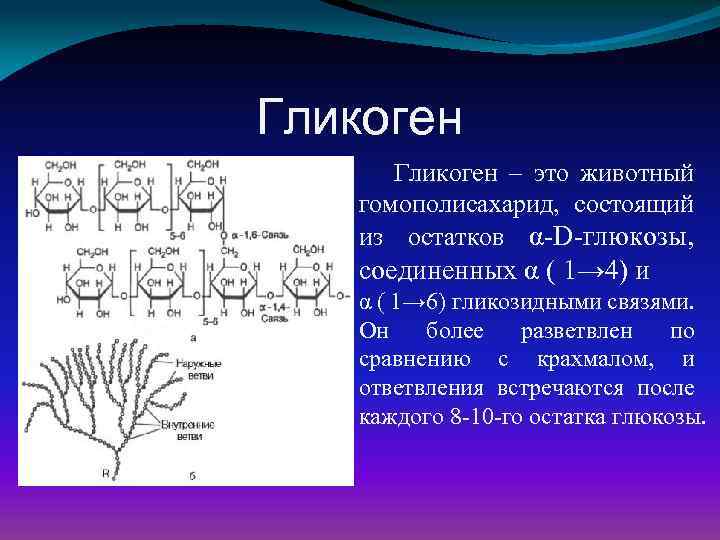
В целом результаты проведенного исследования показывают хорошую репаративную способность отечественного РЭФР, что может быть использовано в дальнейшем для его клинических испытаний.
Содержание и распределение гликогена при дисплазии эпителия полости рта
. 1981 г., февраль; 89 (1): 79–88.
doi: 10.1111/j.1600-0722.1981.tb01280.x.
Г. Исакссон, М. Шир
- PMID: 6165065
- DOI: 10.1111/j.1600-0722.1981.tb01280.x
G Исакссон и соавт.
Scand J Dent Res.
1981 фев.
. 1981 г., февраль; 89 (1): 79–88.
doi: 10.1111/j.1600-0722.1981.tb01280.x.
Авторы
Г. Исакссон, М. Шир
- PMID: 6165065
- DOI: 10.1111/j.1600-0722.1981.tb01280.x
Абстрактный
После окрашивания гематоксилин-эозином и PAS, контролируемым диастазой, исследовали 44 поражения полости рта с эпителиальной дисплазией и 25 других доброкачественных и злокачественных поражений слизистой оболочки полости рта. Регистрировали интенсивность PAS-позитивности на гликоген, степень дисплазии, тип ороговения и степень субэпителиального воспаления. В качестве контроля использовали гистологически нормальный эпителий по краям поражений. В качестве контроля использовали наличие и количество гликогена в нормальном эпителии по краям поражений. Присутствие и количество гликогена в нормальном эпителии на краю поражений использовали в качестве контроля. Наличие и количество гликогена в нормальном эпителии варьировалось в зависимости от формы кератинизации, при этом не- или паракератинизированный эпителий был богат гликогеном, тогда как в ортокератинизированном эпителии наблюдалась отрицательная реакция гликогена. Наиболее поразительной особенностью было резкое ограничение гликогена на стыке между недиспластическим и диспластическим эпителием. Разница в количестве гликогена в нормальном и диспластическом эпителии, оцененная полуколичественно, была статистически значимой. Статистически значимой разницы в содержании гликогена при разной степени дисплазии выявлено не было. Таким образом, PAS-окрашивание, контролируемое диастазой, может быть полезным методом различения диспластического эпителия от недиспластического в сомнительных случаях.
В качестве контроля использовали гистологически нормальный эпителий по краям поражений. В качестве контроля использовали наличие и количество гликогена в нормальном эпителии по краям поражений. Присутствие и количество гликогена в нормальном эпителии на краю поражений использовали в качестве контроля. Наличие и количество гликогена в нормальном эпителии варьировалось в зависимости от формы кератинизации, при этом не- или паракератинизированный эпителий был богат гликогеном, тогда как в ортокератинизированном эпителии наблюдалась отрицательная реакция гликогена. Наиболее поразительной особенностью было резкое ограничение гликогена на стыке между недиспластическим и диспластическим эпителием. Разница в количестве гликогена в нормальном и диспластическом эпителии, оцененная полуколичественно, была статистически значимой. Статистически значимой разницы в содержании гликогена при разной степени дисплазии выявлено не было. Таким образом, PAS-окрашивание, контролируемое диастазой, может быть полезным методом различения диспластического эпителия от недиспластического в сомнительных случаях. Псевдоэпителиоматозный гиперплазированный эпителий, покрывающий зернистоклеточную миобластому, не содержал гликогена. Пять из шести плоскоклеточных карцином и четыре веррукозных карциномы не содержали доказуемого гликогена. Гликоген присутствовал в эпителии исследованных случаев красного плоского лишая и «гиперплазии зубных протезов».
Псевдоэпителиоматозный гиперплазированный эпителий, покрывающий зернистоклеточную миобластому, не содержал гликогена. Пять из шести плоскоклеточных карцином и четыре веррукозных карциномы не содержали доказуемого гликогена. Гликоген присутствовал в эпителии исследованных случаев красного плоского лишая и «гиперплазии зубных протезов».
Похожие статьи
Иммунодетекция инволюкрина при поражениях слизистой оболочки полости рта.
Итоиз М.Э., Конти С.Дж., Хименес И.Б., Ланфранчи Х.Е., Фернандес-Алонсо Г.И., Кляйн-Санто А.Дж. Итоиз М.Е. и соавт. Дж Орал Патол. 1986 апр; 15 (4): 205-8. doi: 10.1111/j.1600-0714.1986.tb00608.x. Дж Орал Патол. 1986 год. PMID: 3088235
Различия в метаболизме гликогена (синтез гликогена и гликолиз) между нормальным и диспластическим/злокачественным эпителием полости рта.

Айзава Х., Ямада С.И., Сяо Т., Симанэ Т., Хаяши К., Ци Ф., Танака Х., Курита Х. Айзава Х. и др. Arch Oral Biol. 2017 ноябрь; 83: 340-347. doi: 10.1016/j.archoralbio.2017.08.014. Epub 2017 2 сентября. Arch Oral Biol. 2017. PMID: 28892665
Пролиферация клеток и экспрессия гена-супрессора опухоли в неокрашенной йодом области, окружающей плоскоклеточный рак полости рта.
Йокоо К., Нома Х., Иноуэ Т., Хашимото С., Симоно М. Йоко К. и др. Int J Oral Maxillofac Surg. 2004 г., январь; 33 (1): 75–83. doi: 10.1054/ijom.2002.0457. Int J Oral Maxillofac Surg. 2004. PMID: 14690663
Экзофитная бородавчатая гиперплазия полости рта: новое заболевание.
Патил С.
 , Варнакуласурия С., Радж Т., Санкет Д.С., Рао Р.С.
Патил С. и др.
Джей Инвестиг Клин Дент. 2016 ноябрь;7(4):417-423. doi: 10.1111/jicd.12166. Epub 2015 15 июня.
Джей Инвестиг Клин Дент. 2016.
PMID: 26075572
, Варнакуласурия С., Радж Т., Санкет Д.С., Рао Р.С.
Патил С. и др.
Джей Инвестиг Клин Дент. 2016 ноябрь;7(4):417-423. doi: 10.1111/jicd.12166. Epub 2015 15 июня.
Джей Инвестиг Клин Дент. 2016.
PMID: 26075572Экспрессия белков промежуточных филаментов при доброкачественных поражениях слизистой оболочки полости рта.
ван дер Вельден Л.А., Манни Дж.Дж., Рамакерс ФК, Куйперс В. ван дер Вельден Л.А. и соавт. Eur Arch Оториноларингол. 1999;256(10):514-9. doi: 10.1007/s004050050202. Eur Arch Оториноларингол. 1999. PMID: 10638360
Посмотреть все похожие статьи
Цитируется
Всесторонняя оценка фиксации гена PAX на тканях рака полости рта с использованием рутинной гистологии, иммуногистохимии и FTIR-микроспектроскопии.

Лахири П., Мукерджи С., Гош Б., Дас Д., Лахири Б., Варшни С.К., Пал М., Пол Р.Р., Чаттерджи Дж. Лахири П. и др. Биомолекулы. 2021 15 июня; 11 (6): 889. doi: 10.3390/biom11060889. Биомолекулы. 2021. PMID: 34203873 Бесплатная статья ЧВК. Клиническое испытание.
Типы публикаций
термины MeSH
вещества
Гликоген при клинической лейкоплакии: распределение и тонкая структура в слизистой оболочке щеки человека | JAMA Dermatology
Гликоген при клинической лейкоплакии: распределение и тонкая структура в слизистой оболочке щеки человека | JAMA Дерматология | Сеть ДЖАМА [Перейти к навигации]Эта проблема
- Скачать PDF
- Полный текст
Поделиться
Твиттер Фейсбук Электронная почта LinkedIn
- Процитировать это
- Разрешения
Артикул
Сентябрь 1970 г.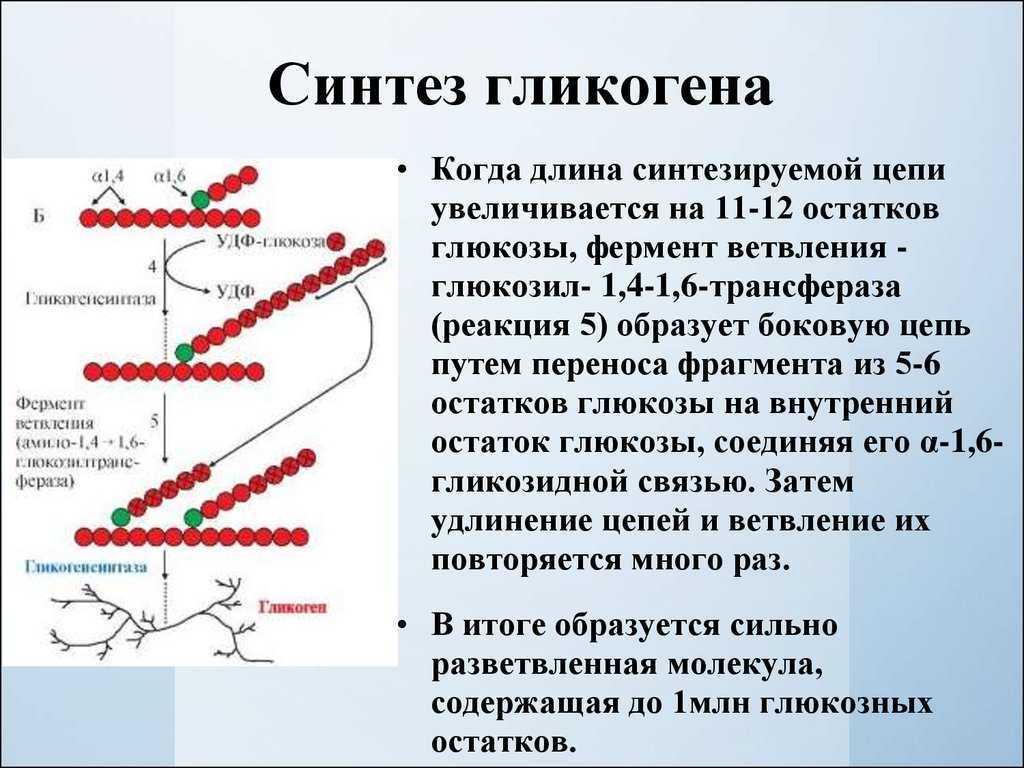
Анна Плачкова, MD ; Джон П. Уотерхаус, MD ; Джулия Мейер, доктор философии
Принадлежности авторов
Прага; Чикаго
Отделение патологии полости рта Стоматологического колледжа Университета Иллинойса в Медицинском центре Чикаго (доктор Уотерхаус и Мейер) и Института стоматологических исследований в Праге (доктор Плачкова).
Арка Дерматол. 1970;102(3):291-299. doi: 10.1001 / archderm.1970.040000
Полный текст
Абстрактный
Изучено распределение гликогена в препаратах для световой и электронной микроскопии девяти хирургических препаратов клинической лейкоплакии в нормально неороговевающих участках слизистой оболочки полости рта человека и в двух клинически нормальных участках слизистой оболочки щек. Общие оценки тканевого содержания гликогена в электронно- и светомикроскопических препаратах хорошо согласовывались.