АТФ, НАД+, НАДФ+, ФАД
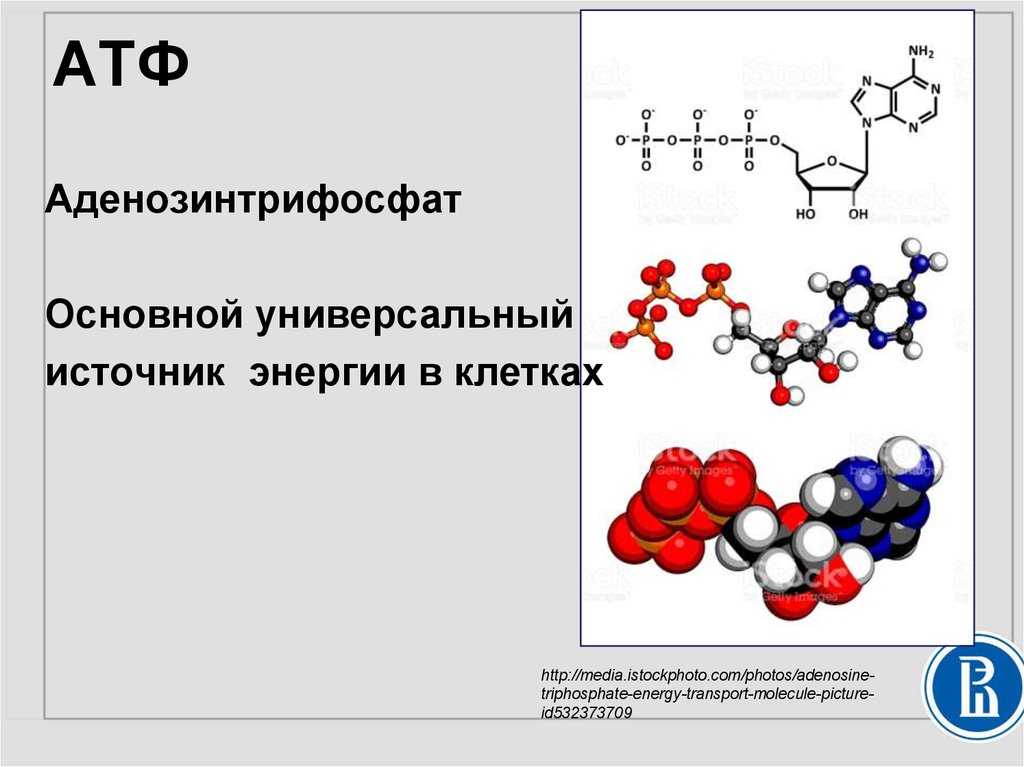
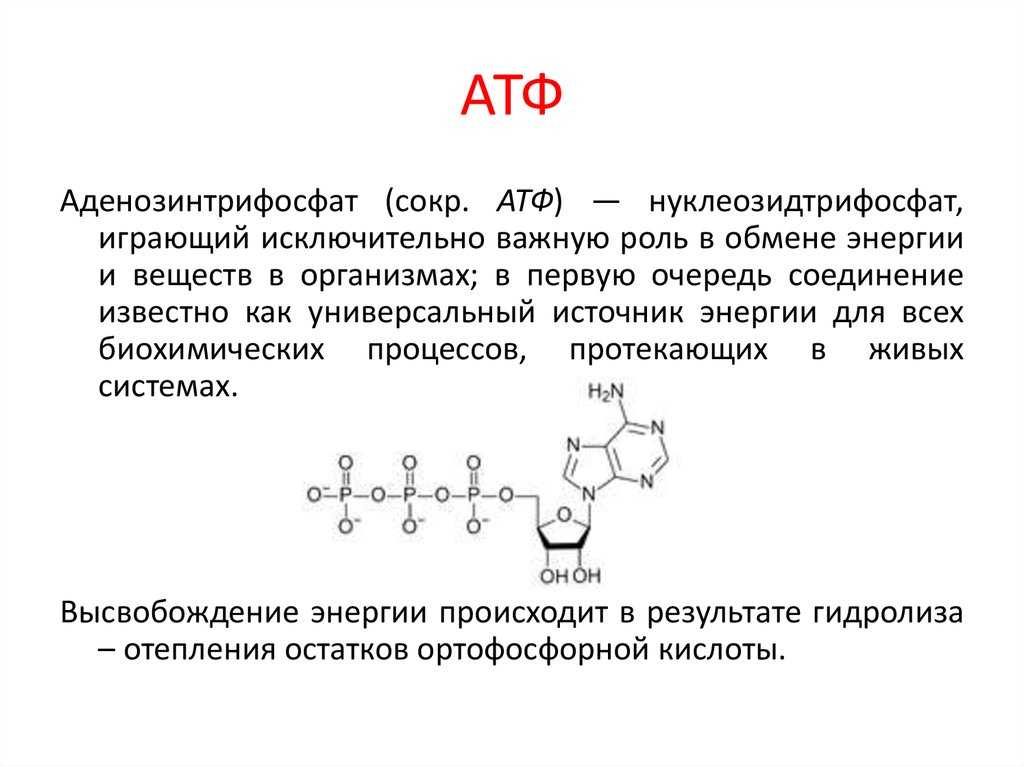
Аденозинтрифосфорная кислота (АТФ) — универсальный источник и основной аккумулятор энергии в живых клетках. АТФ содержится во всех клетках растений и животных. Количество АТФ в среднем составляет 0,04% (от сырой массы клетки), наибольшее количество АТФ (0,2-0,5%) содержится в скелетных мышцах. В клетке молекула АТФ расходуется в течение одной минуты после ее образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 часа.
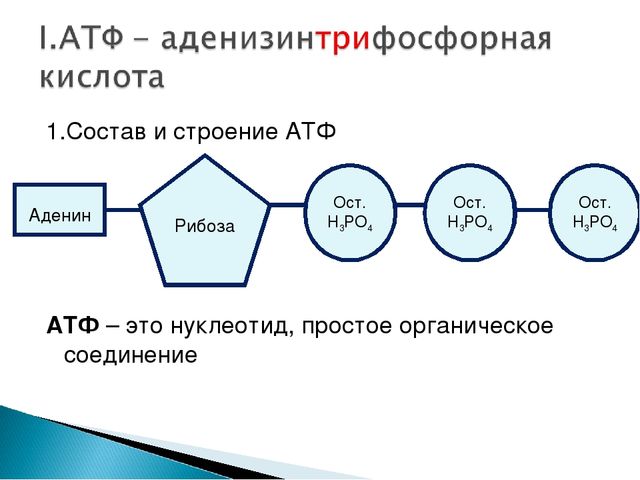
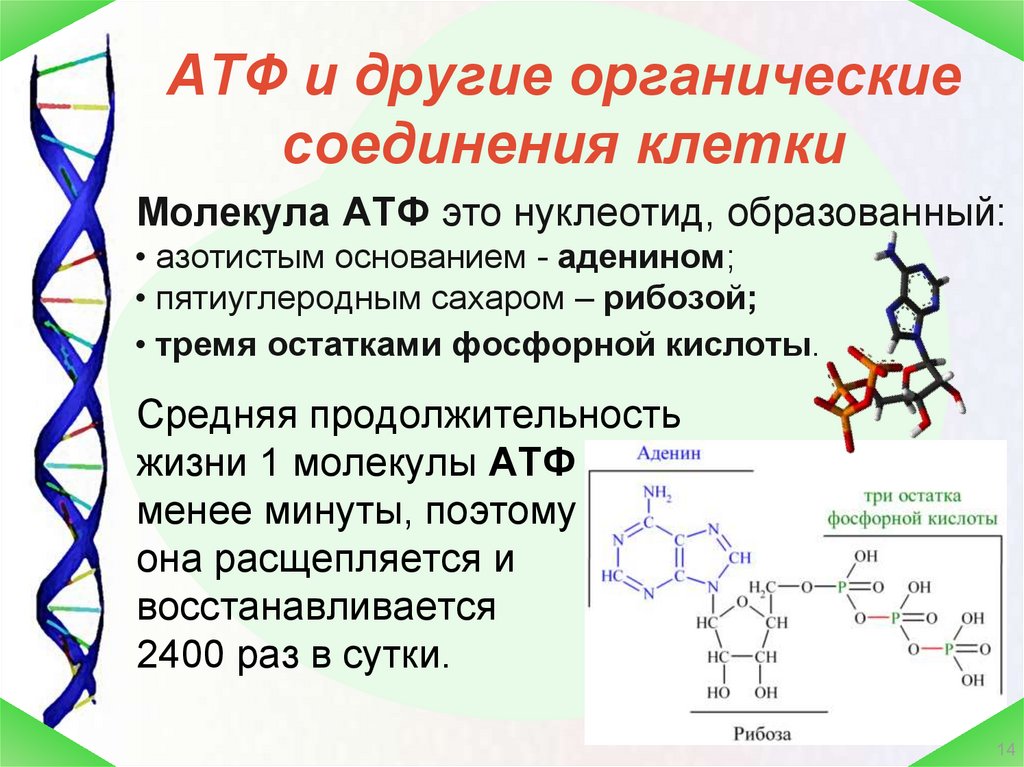
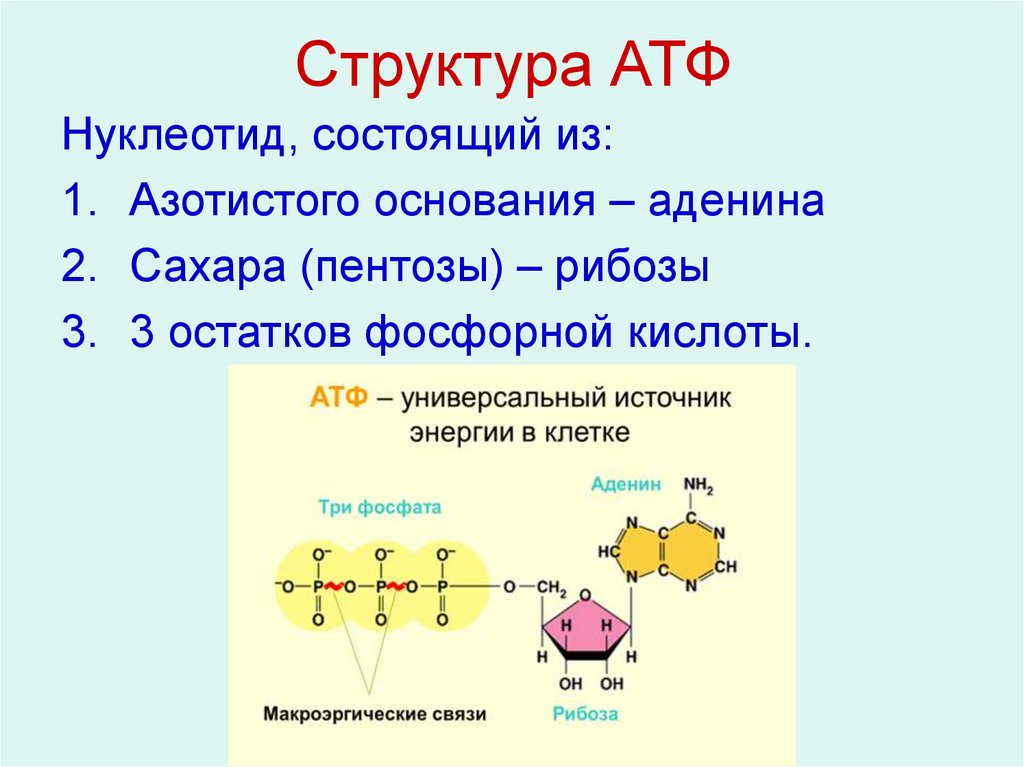
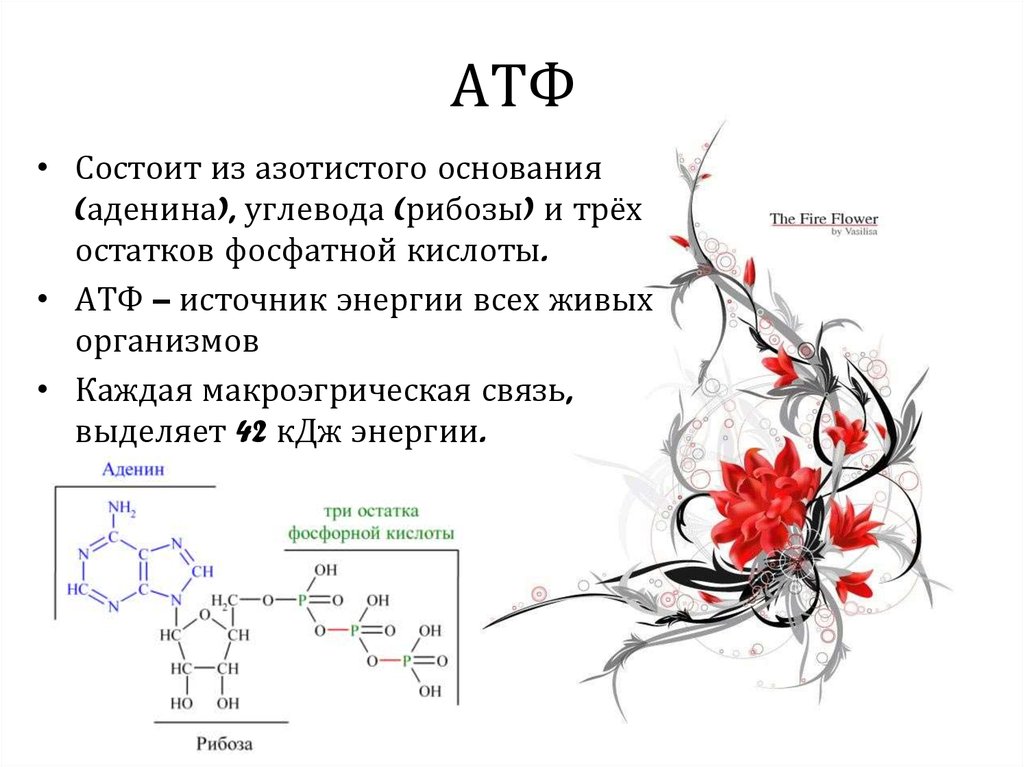
АТФ – мононуклеотид, состоящий из остатков азотистого основания (аденина), рибозы и трех остатков фосфорной кислоты. Поскольку АТФ содержит не один, а три остатка фосфорной кислоты, она относится к рибонуклеозидтрифосфатам.
Для большинства видов работ, происходящих в клетках, используется энергия гидролиза АТФ. При этом при отщеплении концевого остатка фосфорной кислоты АТФ переходит в АДФ (аденозиндифосфорную кислоту), при отщеплении второго остатка фосфорной кислоты – в АМФ (аденозинмонофосфорную кислоту).
Запасы АТФ постоянно пополняются. В клетках всех организмов синтез АТФ происходит в процессе фосфорилирования, т.е. присоединения фосфорной кислоты к АДФ. Фосфорилирование происходит с разной интенсивностью при дыхании (митохондрии), гликолизе (цитоплазма), фотосинтезе (хлоропласты).
Рис. Гидролиз АТФ
АТФ является основным связующим звеном между процессами, сопровождающимися выделением и накоплением энергии, и процессами, протекающими с затратами энергии. Кроме этого, АТФ наряду с другими рибонуклеозидтрифосфатами (ГТФ, ЦТФ, УТФ) является субстратом для синтеза РНК.
Кроме АТФ есть и другие молекулы с макроэргическими связями – УТФ (уридинтрифосфорная кислота), ГТФ (гуанозинтрифосфорная кислота), ЦТФ (цитидинтрифосфорная кислота), энергия которых используются для биосинтеза белка (ГТФ), полисахаридов (УТФ), фосфолипидов (ЦТФ).
 Но все они образуются за счет энергии АТФ.
Но все они образуются за счет энергии АТФ.
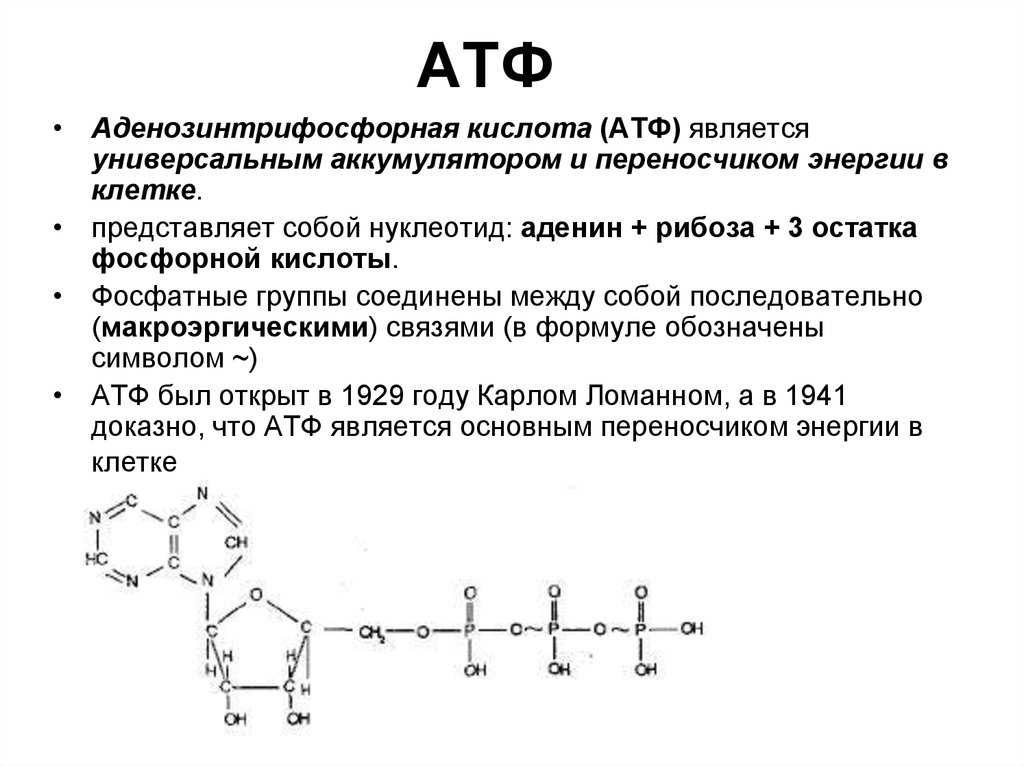
Помимо мононуклеотидов, важную роль в реакциях обмена веществ играют динуклеотиды (НАД+, НАДФ+, ФАД), относящиеся к группе коферментов (органические молекулы, сохраняющие связь с ферментом только в ходе реакции). НАД+ (никотинамидадениндинуклеотид), НАДФ+ (никотинамидадениндинуклеотидфосфат) – динуклеотиды, имеющие в своем составе два азотистых основания – аденин и амид никотиновой кислоты – производное витамина РР), два остатка рибозы и два остатка фосфорной кислоты (рис. .). Если АТФ – универсальный источник энергии, то НАД+ и НАДФ+ – универсальные акцепторы, а их восстановленные формы – НАДН и НАДФН – универсальные доноры восстановительных эквивалентов (двух электронов и одного протона). Входящий в состав остатка амида никотиновой кислоты атом азота четырехвалентен и несет положительный заряд (НАД+). Это азотистое основание легко присоединяет два электрона и один протон (т.е. восстанавливается) в тех реакциях, в которых при участии ферментов дегидрогеназ от субстрата отрываются два атома водорода (второй протон уходит в раствор):
Субстрат-Н2 + НАД+ субстрат + НАДН + Н+
Рис.
 . Структура молекулы динуклеотидов НАД+ и НАДФ+.
. Структура молекулы динуклеотидов НАД+ и НАДФ+.А – присоединение фосфатной группы к остатку рибозы в молекуле НАД. Б – присоединение двух электронов и одного протона (аниона Н-) к НАД+.
В обратных реакциях ферменты, окисляя НАДН или НАДФН, восстанавливают субстраты, присоединяя к ним атомы водорода (второй протон приходит из раствора).
ФАД – флавинадениндинуклеотид – производное витамина В2 (рибофлавина) также является кофактором дегидрогеназ, но ФАД присоединяет два протона и два электрона, восстанавливаясь до ФАДН2.
Подпишитесь на наш канал в Telegram
Независимая экспертиза митохондриальной ДНК (мтДНК). Стоимость. Примеры.
Генетическая информация определяет рост, развитие, строение, обмен веществ, психологический склад человека, а также предрасположенность к различным заболеваниям. Эта информация зашифрована в ДНК, которая представлена не только в ядре клетки, но и в органеллах (митохондриях), необходимых для превращения химической энергии из пищи в формы, необходимые клетке – это так называемая митохондриальная ДНК.
Митохондрии – это «энергетические станции» клетки, без которых она не сможет существовать. Митохондрии имеют собственную генетическую информацию, зашифрованную в митохондриальной ДНК. Когда-то митохондрии представляли собой бактерии. Но, попав в эукариотические клетки, они растеряли часть своей генетической информации, часть отдали в ядро клетки-хозяина, и сейчас митохондриальная ДНК состоит всего лишь из 37 генов, необходимых для окисления глюкозы до углекислого газа и воды и синтеза клеточного «топлива»: АТФ (аденозинтрифосфат) и НАДН (восстановленная форма никотинамидадениндинуклеотида).
Митохондриальная ДНК передается от матери ко всем ее детям, от дочерей к внукам. Почему же так происходит? Почему мы не можем унаследовать митохондриальную ДНК от отца?
Яйцеклетки (женские половые клетки) содержат огромное количество митохондрий, в сотни, а то и в тысячи раз больше, чем содержат сперматозоиды (мужские половые клетки), которым митохондрии необходимы в основном только для движения. При оплодотворении сперматозоид проникает в яйцеклетку, зачастую теряя свой жгутик и митохондрии, которые находятся в основании жгутика. Затем сперматозоид сливается с яйцеклеткой, происходит образование зиготы. Митохондрии сперматозоида, меченные убиквитинином, разрушаются ооцитом, и ядро сперматозоида сливается с ядром яйцеклетки (Рисунок 1), давая начало новой жизни.
При оплодотворении сперматозоид проникает в яйцеклетку, зачастую теряя свой жгутик и митохондрии, которые находятся в основании жгутика. Затем сперматозоид сливается с яйцеклеткой, происходит образование зиготы. Митохондрии сперматозоида, меченные убиквитинином, разрушаются ооцитом, и ядро сперматозоида сливается с ядром яйцеклетки (Рисунок 1), давая начало новой жизни.
Рисунок 1. Образование зиготы. Все клетки человека, кроме половых, несут диплоидный набор хромосом (46 хромосом). В ядрах половых клеток находится гаплоидный набор хромосом (23 хромосомы). После слияния сперматозоида с яйцеклеткой образуется зигота, формируются мужской и женские нуклеусы (в них находится по 23 хромосомы), которые сближаются и сливаются в ядро зиготы. С этого момента клетка становится диплоидной (несет двойной набор хромосом), и начинается деление клетки.
Митохондриальная ДНК наследуется по материнской линии. И мужчины, и женщины получают митохондрии из цитоплазмы материнской яйцеклетки. Эти маленькие двуспиральные цепочки ДНК тянутся к нам из далекого прошлого, со времен проматери «митохондриальной Евы», которая являлась общим предком всех ныне живущих людей по материнской линии.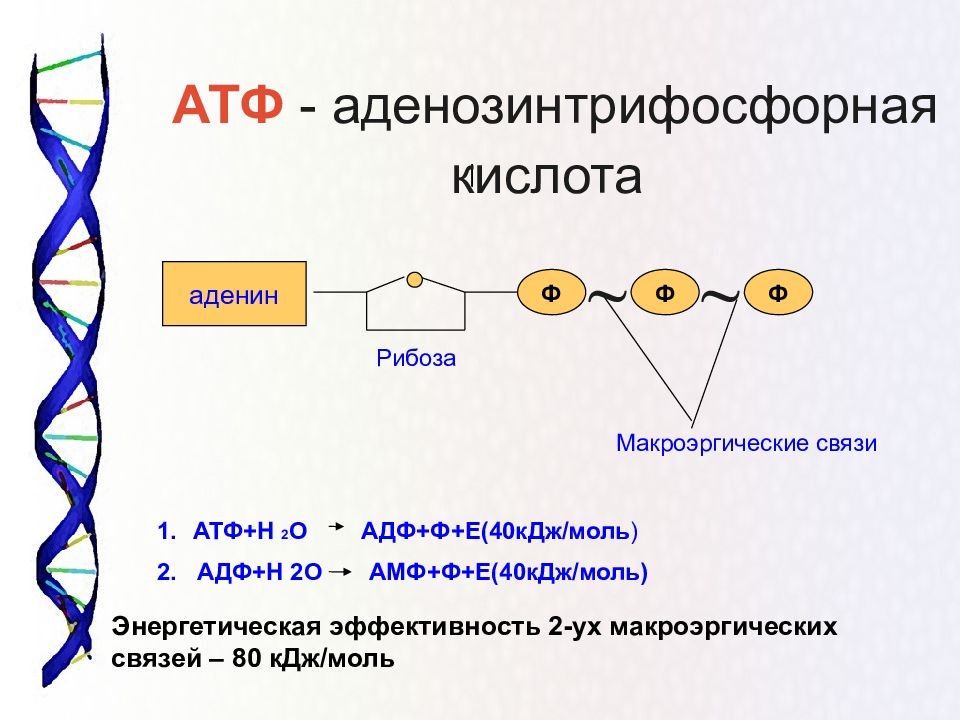
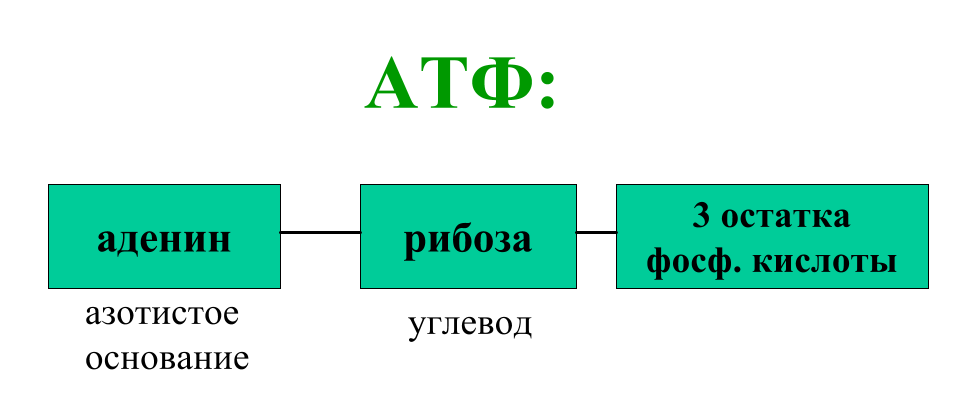
Рисунок 2. Принцип наследования мтДНК. В виде разноцветных кругов показаны различающиеся копии мтДНК.
Митохондриальная ДНК обладает рядом особенностей, которые отличают ее от ядерной ДНК и позволяют использовать при генетической экспертизе:
- мтДНК не подвержена рекомбинации, поэтому вся молекула изменяется только путем мутирования на протяжении тысячелетий;
- данный тип ДНК наследуется только по материнской линии;
- мтДНК можно выделить из любого биологического материала;
- благодаря большому количеству копий мтДНК иногда может быть единственным источником ДНК — например, при сильно деградированной ядерной ДНК или недостаточности биологического материала;
- высокий мутационный уровень мтДНК, по сравнению с одной копией ядерной ДНК, увеличивает идентификационный уровень генетической экспертизы.
В каких случаях необходимо проведение генетической экспертизы митохондриальной ДНК (мтДНК)?
- для установления родственной связи между двумя женщинами или женщиной и мужчиной у предполагаемых родственников по материнской линии.
 Например, дед/бабка-внук, дядя/тетя-племянник, брат-сестра;
Например, дед/бабка-внук, дядя/тетя-племянник, брат-сестра; - при исследовании крайне малого объема биологического материала. Количество копий мтДНК в одной клетке составляет 100-10 000, в то время как в ядерной ДНК всего лишь по две пары каждой из 23 хромосом;
- при исследовании образцов десятилетней, столетней и даже тысячелетней давности. Так, например, по мтДНК удалось идентифицировать останки членов российской императорской семьи Романовых.
- за неимением другого генетического материала. Например, при наличии всего лишь одного волоса. Ствол (стержень) волоса содержит незначительное количество ядерной ДНК, но является хорошим источником митохондриальной ДНК;
- для определения принадлежности генетического профиля той или иной генеалогической ветви человечества (европейской гаплогруппе, африканской, ближневосточной, американской и т.д.). Таким образом, можно определить происхождение человека.
Какие материалы необходимо предоставить для проведения генетической экспертизы митохондриальной ДНК (мтДНК)?
Митохондриальная ДНК присутствует во всех клетках организма.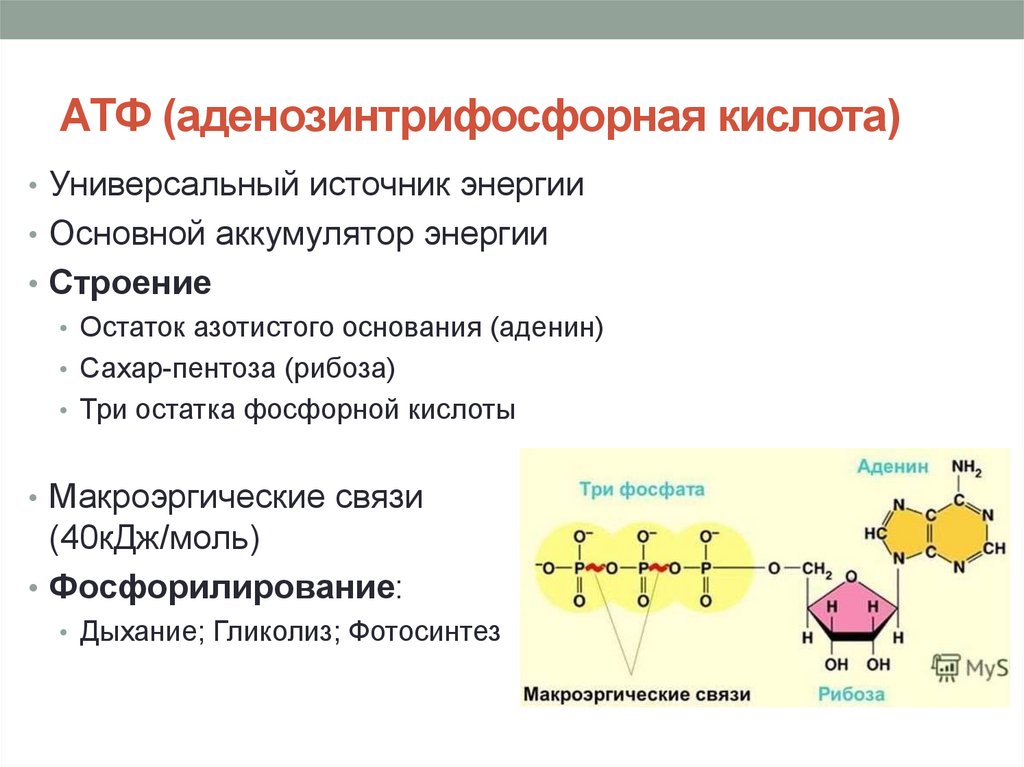 Она находится даже в тех клетках организма, в которых отсутствует ядро (тромбоциты, эритроциты, клетки стержня волос и т.д.). Поэтому для получения мтДНК подходят любые ткани организма: кости, зубы, кровь, сперма, фрагменты скелетированных трупов, фрагменты частей тела и многое другое. Обычно, как и при генетической экспертизе по установлению отцовства или материнства, берутся образцы буккального эпителия (соскоб ватной палочкой с внутренней стороны щеки), кровь из пальца в объеме 0,3-0,5 мл, кровь на ватном диске, волосы или ногти. Взятие образцов тканей осуществляется в соответствии со следующими законами:
Она находится даже в тех клетках организма, в которых отсутствует ядро (тромбоциты, эритроциты, клетки стержня волос и т.д.). Поэтому для получения мтДНК подходят любые ткани организма: кости, зубы, кровь, сперма, фрагменты скелетированных трупов, фрагменты частей тела и многое другое. Обычно, как и при генетической экспертизе по установлению отцовства или материнства, берутся образцы буккального эпителия (соскоб ватной палочкой с внутренней стороны щеки), кровь из пальца в объеме 0,3-0,5 мл, кровь на ватном диске, волосы или ногти. Взятие образцов тканей осуществляется в соответствии со следующими законами:
- ст. 35 Федерального закона от 31 мая 2001 г. №73-ФЗ «О государственной судебно-экспертной деятельности в Российской Федерации»;
- п. 84.4 «Порядок организации и производства судебно-медицинских экспертиз в государственных судебно-экспертных учреждениях Российской Федерации» (Приказ Минздравсоцразвития РФ №346н от 12.05.2010 г.).
Эксперты-генетики после получения биологического материала направляются в специализированную лабораторию, где полученный биоматериал последовательно проходит три этапа исследования: 1) выделение мтДНК; 2) амплифицирование (многократное умножение) определенного локуса мтДНК; 3) определение первичной последовательности нуклеотидов амплифицированного локуса.
На первом этапе эксперт производит выделение ДНК из полученного материала. Выделение митохондриальной ДНК из клеток является очень сложным процессом и в некоторых случаях может продлиться 24 часа. Например, весь процесс выделения митохондриальной ДНК из крови составляет около двух часов, в то время как для того, чтобы только лизировать (разрушить) ткань волоса или ногтя, приходится обрабатывать ее соответствующим ферментом около 12 часов. В большинстве случаев для этих целей используются коммерческие наборы реактивов ведущих зарубежных фирм-производителей, таких как Applied Biosystems (США), Promega (США), QIAGEN (Германия).
На втором этапе анализа производят полимеразно-цепную реакцию (ПЦР-реакцию), в результате которой определенный участок мтДНК (D-петля, или так называемая петля смещения) многократно увеличивается. Именно анализ нуклеотидной последовательности D-петли является дифференцирующим признаком при исследовании мтДНК. Высокий уровень вариабельности D-петли обусловлен тем, что у разных людей этот участок может иметь разную первичную последовательность нуклеотидов (так называемых «кирпичиков», из которых построена ДНК). В популяции обнаруживается целый набор вариантов, отличающихся друг от друга наличием различных мутаций: точковых нуклеотидных замен, микроделеций и микроинсерций. У каждого индивидуума в популяции имеется в норме только один такой вариант, который этот индивидуум унаследовал по своей материнской линии. Как следствие, полинуклеотидная D-петля обладает свойством индивидуальной специфичности.
В популяции обнаруживается целый набор вариантов, отличающихся друг от друга наличием различных мутаций: точковых нуклеотидных замен, микроделеций и микроинсерций. У каждого индивидуума в популяции имеется в норме только один такой вариант, который этот индивидуум унаследовал по своей материнской линии. Как следствие, полинуклеотидная D-петля обладает свойством индивидуальной специфичности.
На следующем этапе производят очистку амплифицированного участка митохондриальной ДНК и его секвенирование. Секвенирование – это определение первичной последовательности ДНК, иными словами — расшифровка генетического кода, который в принципе уникален для каждого организма. Сравнивая нуклеотидные последовательности D-петли из разных образцов, эксперт устанавливает степень их соответствия друг другу, а также сравнивает их с референсной последовательностью мтДНК. Расчет несовпадения нуклеотидов (мутаций) ДНК осуществляется согласно ст. 3.6 Методических указаний Минздрава РФ №2001/4 от 25.01.2001 г.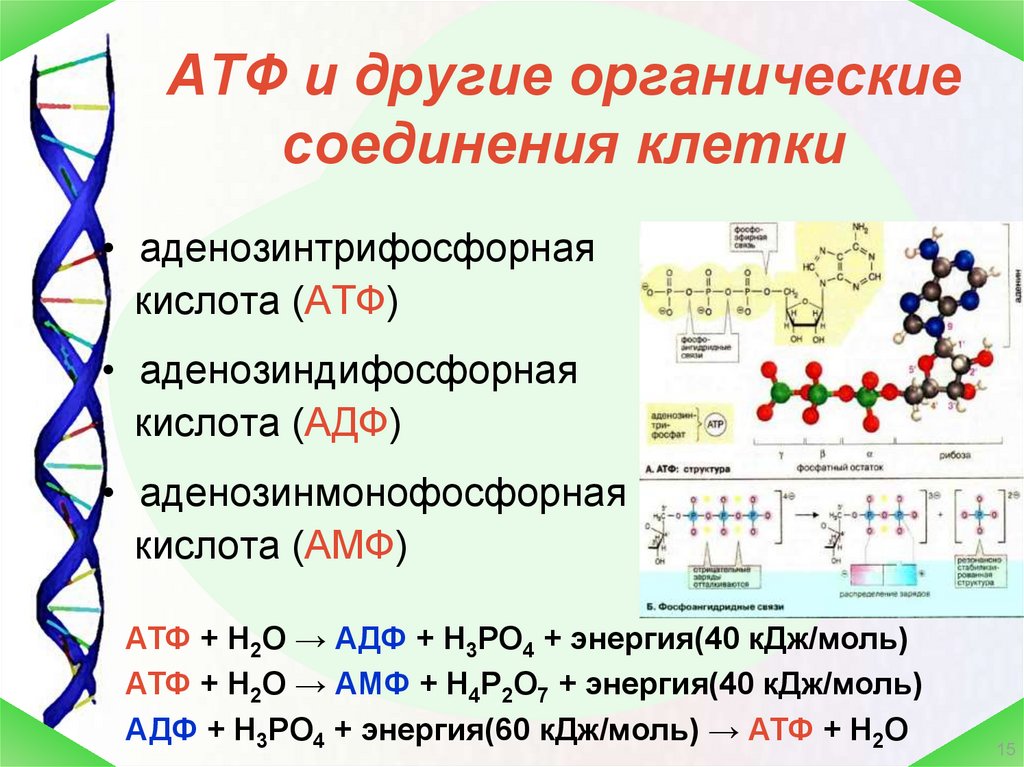 «Применение молекулярно-генетической индивидуализирующей системы на основе полиморфизма нуклеотидных последовательностей митохондриальной ДНК в судебно-медицинской экспертизе идентификации личности и установления биологического родства». В выводах генетической экспертизы митохондриальной ДНК указывается вероятность совпадения признаков, выраженная в процентах.
«Применение молекулярно-генетической индивидуализирующей системы на основе полиморфизма нуклеотидных последовательностей митохондриальной ДНК в судебно-медицинской экспертизе идентификации личности и установления биологического родства». В выводах генетической экспертизы митохондриальной ДНК указывается вероятность совпадения признаков, выраженная в процентах.
Все результаты тестирования мтДНК сравнивают с так называемой «стандартной кембриджской последовательностью». Это первая нуклеотидная последовательность митохондриальной ДНК, которая была расшифрована. Данная работа была выполнена в 1981 году в Кембридже Стеном Андерсеном, за что последовательность мтДНК получила второе название — «последовательность Андерсена» (в англоязычной литературе). Поскольку это была первая последовательность мтДНК, ее и взяли за международный стандарт. В настоящее время все мутации в анализируемой последовательности отсчитывают от нее. Сравнивая нуклеотидную последовательность исследуемой мтДНК со стандартной кембриджской последовательностью, устанавливают генетический профиль исследуемой мтДНК, то есть дают ему индивидуальную генетическую характеристику.
По генетическому профилю устанавливают, к какой расе или гаплогруппе относится исследуемая митохондриальная ДНК (и соответственно человек, которому она принадлежит). Следовательно, генетическая экспертиза митохондриальной ДНК позволяет построить ДНК-генеалогию и в определенных случаях предвидеть внешность разыскиваемого человека. Если по Y-хромосоме ученые пытаются найти предполагаемого Адама, то по генетическому профилю мтДНК можно найти предполагаемую Еву.
Генетическая экспертиза митохондриальной ДНК отвечает на два главных вопроса:
- Имеются ли совпадения нуклеотидных последовательностей мтДНК у анализируемых биологических образцов? Для этого по определенным правилам сопоставляют полученные индивидуальные профили полиморфизма анализируемых фрагментов ДНК с целью их отождествления или выявления сходства и различий и установления на этом основании определенных фактов, которые могут иметь доказательственное значение по делу.
- Если совпадение признаков установлено, то какова вероятность того, что это совпадение закономерно, а не является случайностью?
Нормативно-правовые документы, определяющие порядок проведения в Российской Федерации генетической экспертизы митохондриальной ДНК:
- Федеральный закон от 31 мая 2001 г.
 №73-ФЗ «О государственной судебно-экспертной деятельности в Российской Федерации»;
№73-ФЗ «О государственной судебно-экспертной деятельности в Российской Федерации»; - Приказ Минздравсоцразвития РФ №346н от 12.05.2010 г. «Об утверждении Порядка организации и производства судебно-медицинских экспертиз»;
- Методические указания Минздрава РФ №2001/4 от 25.01.2001 г. «Применение молекулярно-генетической индивидуализирующей системы на основе полиморфизма нуклеотидных последовательностей митохондриальной ДНК в судебно-медицинской экспертизе идентификации личности и установления биологического родства»;
- Семейный кодекс РФ. Глава 10 «Установление происхождения детей».
Проведение экспертизы по уголовному делу
Согласно Постановлению Пленума Верховного Суда Российской
Федерации от 21 декабря 2010 г. N 28 «О судебной
экспертизе по уголовным делам» экспертиза по уголовному делу может быть проведена либо государственным
экспертным учреждением, либо некоммерческой организацией, созданной в соответствии с Гражданским кодексом
Российской Федерации и Федеральным законом «О некоммерческих организациях», осуществляющих
судебно-экспертную деятельность в соответствии с принятыми ими уставами.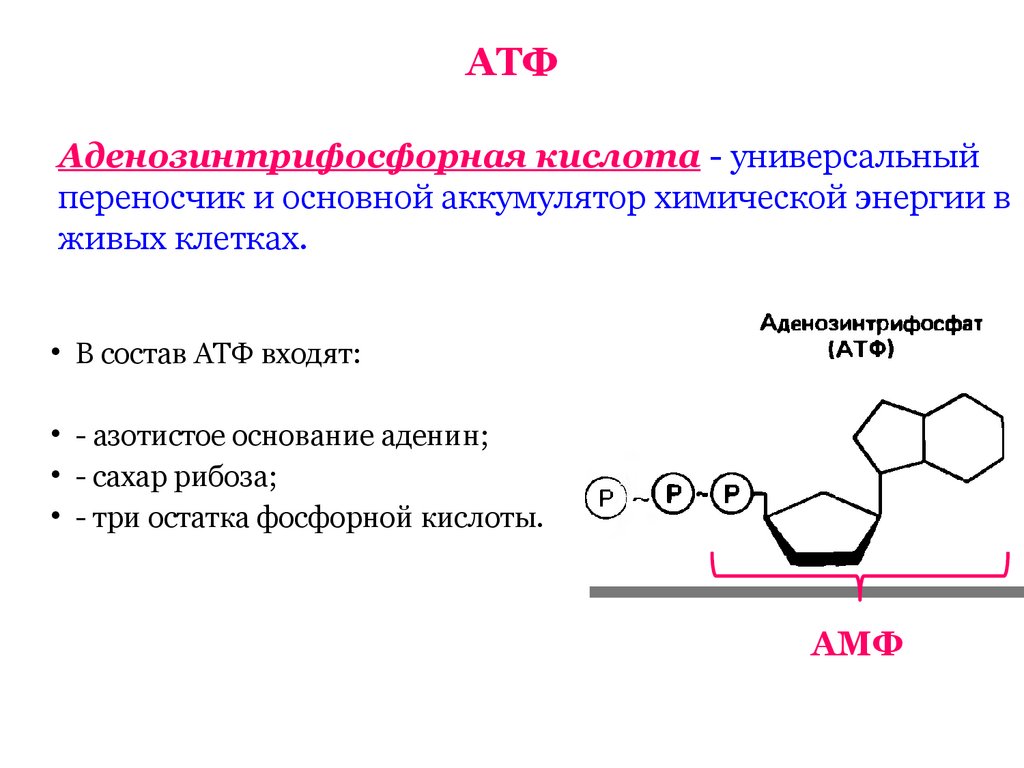
Коммерческие организации и лаборатории, индивидуальные предприниматели, образовательные учреждения, а также некоммерческие организации, для которых экспертная деятельность не является уставной, не имеют право проводить экспертизу по уголовному делу. Экспертиза, подготовленная указанными организациями в рамках уголовного процесса, может быть признана недопустимым доказательством, т.е. доказательством, полученным с нарушением требований процессуального закона.
Недопустимые доказательства не могут использоваться в процессе доказывания, в том числе, исследоваться или оглашаться в судебном заседании, и подлежат исключению из материалов уголовного дела.
Так как АНО «Судебный эксперт» является автономной некоммерческой организацией, а проведение судебных экспертиз является её основной уставной деятельностью (см. раздел «Документы организации»), то она имеет право проводить экспертизы в том числе и по уголовным делам.
[PDF] Расшифровка жизненно важных сегментов АТФ-зависимой РНК-хеликазы человека
- title={Расшифровка жизненно важных сегментов АТФ-зависимой РНК-хеликазы человека},
автор={Вандана Камджула и Ананья Каннеганти и Рохан Метла и Кусума Нидаманури и Сударшан Идупулапати и Ашиш Рунтхала},
журнал={Биоинформация},
год = {2020},
объем = {16},
страницы = {160 — 170}
}
- Вандана Камджула, Ананья Каннеганти, Ашиш Рунтхала
- Опубликовано 29 февраля 2020 г.
- Биология
- Биоинформация
Анализ АТФ-зависимой РНК-геликазы с использованием известных функционально близких аналогов фермента помогает раскрыть информацию о близких по функциональности ферментах. Фермент выполняет несколько взаимосвязанных биологических функций, и существует острая необходимость в интерпретации его ключевых остатков в активном центре, чтобы сделать вывод о функции и установить роль. Человеческий белок q96c10.1 аннотируется с помощью таких инструментов, как interpro, go и cdd. Физико-химические свойства оценивают с помощью инструмента протпарам. Мы описываем фермент…
Раскопки функционально важных остатков активного сайта белка DXS Bacillus subtilis путем изучения его ближайших гомологов
Биология
Журнал генной инженерии и биотехнологии
- 2020
В исследовании исследуются жизненно важные функциональные, филогенетические и консервативные остатки в активном центре белка DXS, ключевого ограничивающего скорость контроллера всего пути, чтобы с помощью вычислений понять эволюционный ландшафт этого промышленно полезного фермента и расширить свой репертуар субстратов, чтобы увеличить ферментативный выход неестественных молекул для приложений in vivo и in vitro.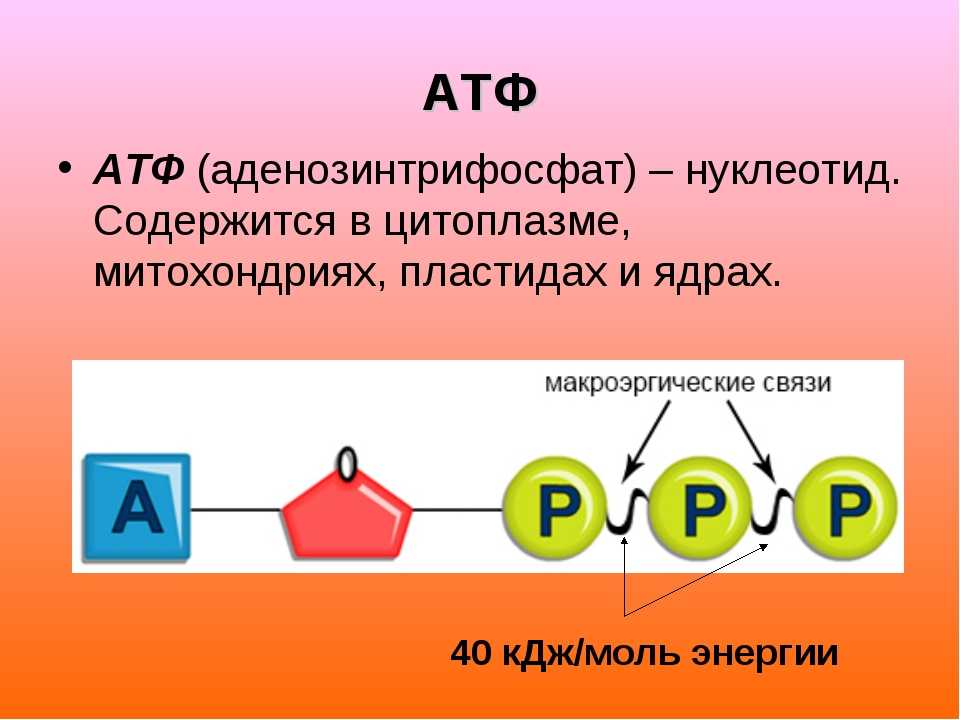
Вероятностное отклонение методологии ТБМ от идеального протокола
- Ашиш Рунтхала
Информатика
bioRxiv
- 2020
Путем замораживания границ домена можно предсказать показатели расхождения для наиболее важных этапов алгоритма моделирования, а затем применить его для анализа больших данных. точно уточнить оценку, используя константы взвешивания.
Вероятностное отклонение методологии моделирования на основе шаблона от идеального протокола
Путем замораживания границ домена прогнозируются показатели расхождения для наиболее важных шагов алгоритма моделирования, а для точного уточнения оценки используются константы взвешивания, большие данные анализ может быть развернут дальше.
Нацеливание на грипп на топологически консервативных субструктурах
- Z.
 Ahamed, Kamjula Vandana, K. Bhuvaneswari
Ahamed, Kamjula Vandana, K. Bhuvaneswari Биология
Biorxiv
- 2020
. против эволюционно законсервированных субструктур вируса птичьего гриппа H9N2.
Текущие стратегические ограничения филогенетических инструментов плохо влияют на вывод эволюционного дерева
- С. Насика, Ашиш Рунтхала
Биология
bioRxiv
- 2021
всю филогенетическую методологию.
РНК-хеликаза LGP2 негативно регулирует передачу сигналов RIG-I, предотвращая опосредованную TRIM25 активацию каспазы и убиквитинирование рекрутингового домена.
- K. Quicke, Kristin Y. Kim, C. Horvath, M. Suthar
Biology
Журнал исследований интерферонов и цитокинов: официальный журнал Международного общества исследований интерферонов и цитокинов
70011 2019 9000- R. Laskowski, J. Watson, J. Thornton
Биология
Nucleic Acids Res.
- 2005
- C. Felisberto-Rodrigues, Jemima C. Thomas, R.V. van Montfort
Биология
Биохимический журнал что связывание РНК запускает высвобождение АДФ благодаря значительной конформационной гибкости консервативных мотивов DEAH-, P-loop и hook-turn.
Механизм АТФ-зависимого раскручивания РНК белками DEAD-бокса
Представлена модель раскручивания РНК, объединяющая последние данные о влиянии аналогов АТФ и мутаций на активность белка DEAD-бокса, и показано, что локальная дестабилизация дуплексов РНК представляет собой серьезную проблему.
Сравнительное моделирование белковой структуры с помощью MODELLER
В этом разделе описывается расчет сравнительных моделей с помощью программы MODELLER, обсуждаются все четыре этапа сравнительного моделирования, часто наблюдаемые ошибки и некоторые приложения.

Семейство белков DEAD-box хеликаз РНК.
- Оливье Кордин, Ж. Банрокес, Н. Таннер, П. Линдер
Биология
Ген
- 2006
Белки Dead-box: семейное дело Из генетических и биохимических данных, полученных в основном на дрожжах, стало ясно, что эти белки играют важную роль в ремоделировании комплексов RNP контролируемым во времени образом.
ConSurf 2016: усовершенствованная методология оценки и визуализации эволюционной консервации макромолекул
- Хаим Ашкенази, Ширан Абади, Н. Бен-Тал
Биология
Рез. нуклеиновых кислот.
- 2016
В ConSurf введено несколько новых функций, в том числе автоматический выбор наилучшей эволюционной модели, используемой для вывода о скоростях, возможность гомологического моделирования запрашиваемых белков, предсказание вторичной структуры запрашиваемых молекул РНК из последовательности, возможность просмотра биологической сборки запроса (в дополнение к одиночной цепи), сопоставление степеней консервации с двухмерными моделями РНК и расширенный просмотр филогенетического дерева.
Роль DEAD-боксовой РНК-хеликазы DDX3 в метаболизме мРНК
Целью этого обзора является быстрый и критический обзор структуры и функций DDX3 с особым акцентом на его роль в метаболизме мРНК.
Раскручивание РНК у Saccharomyces cerevisiae: белки DEAD-box и родственные семейства.
Новая техника позволяет ученым включать и выключать АТФ-синтазу
0021
Институт Макса Планка 16 января 2018 г.
В темноте транс-азополифенол блокирует активность АТФ-синтазы (слева). Под действием УФ-излучения азополифенол переходит в цис-форму, в результате чего АТФ-синтаза больше не ингибируется и реактивируется, что показано здесь видимым движением вращающейся части белкового комплекса (справа). Вертикальная серая полоса представляет клеточную мембрану. Т. Meier, B. Eisel
Ферментный комплекс АТФ-синтаза является одним из наиболее важных молекулярных механизмов в клетке.
 Он производит аденозинтрифосфат (АТФ), который служит источником энергии почти для всех основных клеточных процессов. Производство и доступность АТФ также могут быть полезны для биотехнологических процессов вне клетки. Исследователи из Института биофизики Макса Планка во Франкфурте, Университета Людвига-Максимилиана (LMU) в Мюнхене и Имперского колледжа в Лондоне
Он производит аденозинтрифосфат (АТФ), который служит источником энергии почти для всех основных клеточных процессов. Производство и доступность АТФ также могут быть полезны для биотехнологических процессов вне клетки. Исследователи из Института биофизики Макса Планка во Франкфурте, Университета Людвига-Максимилиана (LMU) в Мюнхене и Имперского колледжа в ЛондонеИмперский колледж Лондона, основанный 8 июля 1907 года Королевской хартией, является государственным исследовательским университетом в Лондоне, специализирующимся на науке, технике, медицине и бизнесе. Его главный кампус расположен в Южном Кенсингтоне, у него есть инновационный кампус в Уайт-Сити, исследовательская станция в Силвуд-парке и учебные больницы по всему Лондону. Его полное юридическое название — Имперский колледж науки, технологий и медицины.
» data-gt-translate-attributes='[{«attribute»:»data-cmtooltip», «format»:»html»}]’>Имперский колледж Лондона разработал метод, который позволяет им переключать АТФ-синтазу включение и выключение с использованием азополифенолов и света.
Полифенолы естественным образом содержатся в черном винограде, арахисе, ягодах и красном вине. Это ароматические соединения с биологически активными свойствами, включающие красители, ароматизаторы и дубильные вещества. Считается, что эти фитохимические вещества обладают рядом полезных питательных эффектов, включая антиоксидантное и противовоспалительное действие, а в некоторых случаях даже говорят, что они помогают предотвратить рак. Полифенолы также могут оказывать бактерицидное действие, что позволяет им, например, подавлять кариес.
Однако оказалось, что эти необычные химические вещества могут даже больше: «Мы синтезировали азополифенолы, которые можно переключать между цис- и транс-формами с помощью ультрафиолетового света», — объясняет Феликс Хартрампф с химического факультета LMU. «Мы использовали это свойство, чтобы позволить нам включать и выключать АТФ-синтазу по желанию. В темноте азополифенолы принимают трансформацию, которая блокирует активность АТФ-синтазы. Под воздействием УФ-излучения они переходят в цис-форму, реактивируя АТФ-синтазу», — объясняет Бьянка Эйзель из Института биофизики Макса Планка.

Установлено, что LGP2 ингибирует RIG-I-опосредованную активность промоторов IFN-β, IRF-3 и NF-kB, что указывает на функцию выше митохондриальной противовирусной передачи сигналов адапторного белка RLR.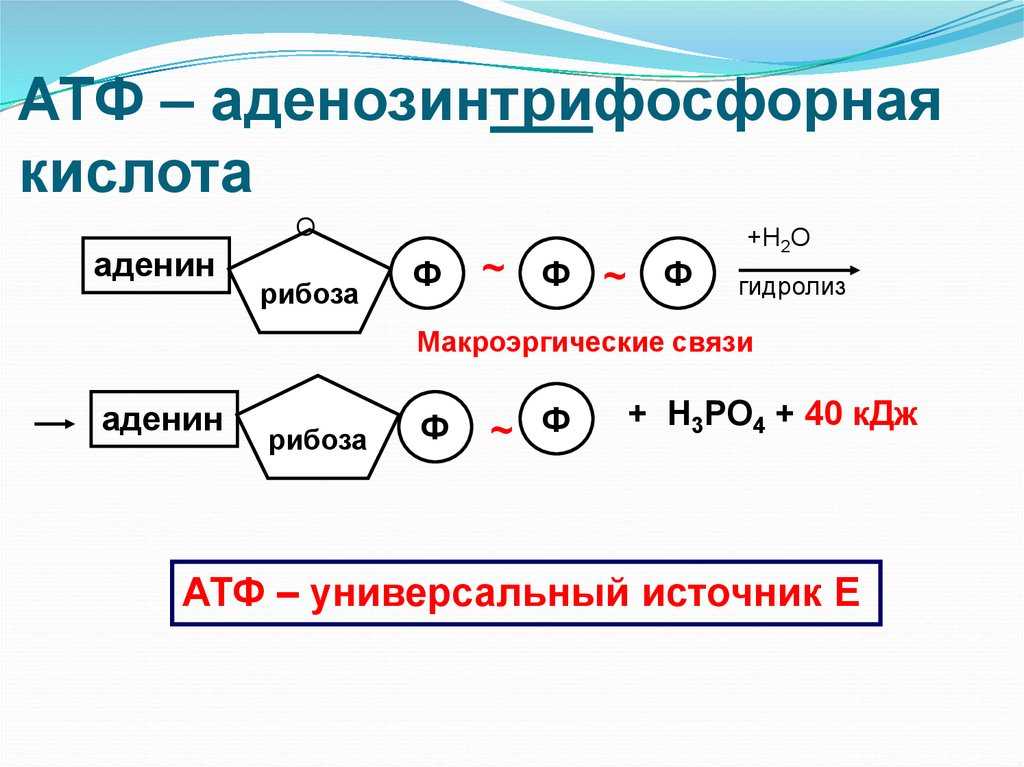
Интеллектуальная доставка полипептидного композита для эффективной терапии рака
Результаты показали, что композит HKMA обладает длительным периодом полураспада и специфическим эффектом уничтожения сферических клеток h560 in vitro и in vivo и обеспечивает потенциальную методологию для эффективного лечения рака.
ПОКАЗЫВАЕТСЯ 1-10 ИЗ 78 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантности Наиболее влиятельные документыНедавность
Оглядываясь назад на рождение геликаз РНК DEAD-box.
ProFunc: сервер для предсказания функции белка по трехмерной структуре
ProFunc () представляет собой веб-сервер для прогнозирования вероятной функции белков, чья трехмерная структура известна, но функция которых неизвестна, и использует как существующие, так и новые методы для анализа последовательности и структуры белка, определяющие функциональные мотивы или близкие отношения с функционально охарактеризованными белками.