Функциональная активность АТФ-зависимых К+-каналов бета-клеток поджелудочной железы в условиях экспериментально вызванного сахарного диабета и их реакция на введение сульфонилмочевинных препаратов | Бабичев
Общепринятым является факт, что секреция инсулина из р-клеток поджелудочной железы, стимулируемая глюкозой и продуктами ее метаболизма, определяется состоянием АТФ-зависи- мых К+-регулируемых каналов [2-4, 6, 7]. Эти каналы обладают свойством блокироваться гипогликемическими сульфаниламидными препаратами, которые используются для лечения диабета II типа (инсулиннезависимого). Каналы представляют собой класс мембранных белков, специализирующихся на высокоскоростном транспорте ионов. В данном случае речь идет о том, что по мере увеличения концентрации глюкозы в плазме одновременно происходит процесс деполяризации клеточной мембраны р-клеток за счет притока Са2+ и его накопления в цитозольной фракции, что и приводит к запуску секреции инсулина. Предполагают, что инсулин- независимый диабет есть результат нарушений работы АТФ-зависимых К+-регулируемых каналов.
Задачей настоящего исследования было оценить состояние К
Материалы и методы
Работа проводилась на культивируемых островковых клетках поджелудочной железы самцов беспородных крыс. Выделение и культивирование р-клеток проводилось по ранее описанному методу S. Misler и соавт. |8|. Клетки высевали на 35-миллимегровые пластиковые чашки Петри со средой RPMI и выдерживали минимум 24 ч при 37°С в атмосфере с 5% СО2 в целях прикрепления их ко дну. Перед началом электрофизиологических исследований в культуральную среду добавляли стрептозотоцин в различных концентрациях (1, 2, 5 мМ), растворенный в цитратном буфере.
В эксперименте использовали только одиночные клетки. Интеграционные токи регистрировали с помощью усилителя, имеющего цепи компенсации емкостных переходных процессов. Ионные токи регистрировали на запоминающем осциллографе и магнитографе. В ходе опыта подсчитывали среднее число каналов, открытых в фиксированной части клеточной мембраны.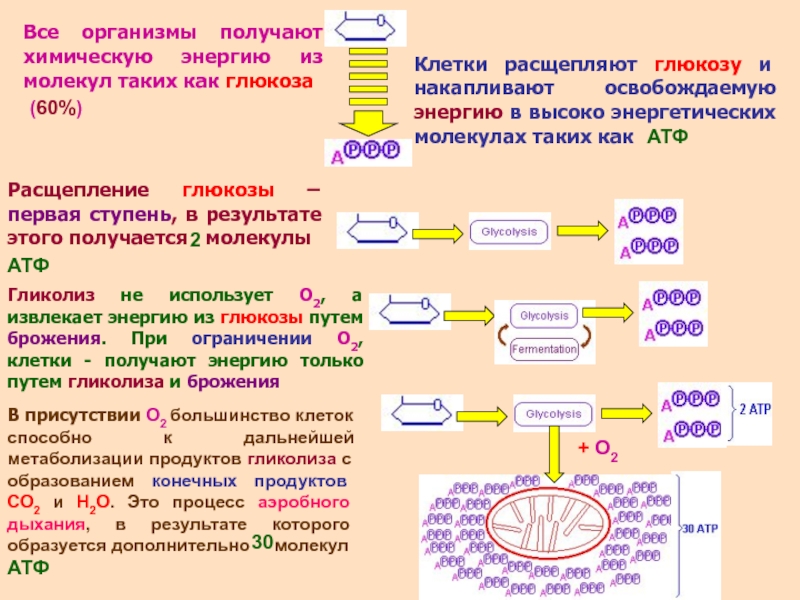
Результаты и их обсуждение
Электрофизиологическая оценка состояния АТФ-чувствительных К+ -каналов fl-клеток, функционально ослабленных под влиянием стрептозц- тоцина. В первой серии исследований нами была проведена идентификация К+-АТФ-чувствитель- ных каналов к глюкозе в фиксированных мембранах клеток. Каналы интактных клеток характеризовались устойчивой величиной потенциала покоя, который находился в пределах 60-62 мВ. Популяция этих каналов закрывалась через 2- 5 мин после начала перфузии клеток раствором, содержащим 5-10 мМ глюкозы. Закрытие каналов сопровождалось началом спайковой активности клеток, открывались же они вновь через 2- 5 мин после отмывания глюкозы, и это повторное открытие совпадало с исчезновением спайковой активности. Каналы не проявляли больших вариаций по величине потенциала покоя и . максимальная их величина была в пределах + 100 мВ.
Каналы интактных клеток характеризовались устойчивой величиной потенциала покоя, который находился в пределах 60-62 мВ. Популяция этих каналов закрывалась через 2- 5 мин после начала перфузии клеток раствором, содержащим 5-10 мМ глюкозы. Закрытие каналов сопровождалось началом спайковой активности клеток, открывались же они вновь через 2- 5 мин после отмывания глюкозы, и это повторное открытие совпадало с исчезновением спайковой активности. Каналы не проявляли больших вариаций по величине потенциала покоя и . максимальная их величина была в пределах + 100 мВ.
Аналогичные исследования, проведенные на клетках, предварительно перфузируемых различными дозами стрептозотоцина, показали сниженную их функциональную активность. Электрофизиологически это выражалось в снижении величины потенциала покоя на 10-25 мВ в зависимости от степени поражения. Наиболее демонстративными были изменения исследованных
Влияние глюкозы, глибенкламида, гликлазида и глипизида на некоторые электрофизиологические показатели К+-АТФ-зависимых каналов интактных (I) и функционально ослабленных (II) под воздействием стрептозотоцина (2 мМ) р-клеток
Глюкоза | Глибенкламид | Гликлазид | Глип | ИЗИД | ||||||||
Показатель | 0 | 3 мМ | 0 | 3,2 мМ | отмывание | 0 | 10 мМ | отмывание | 0 | 10 мМ | 0 | 10 мМ |
Средняя продолжительность
разряда (пачки), мс: I II | 212 181 | 16,4 14,3 | 43 37,2 | 13,0 11,8 | 164 160 | 320 304 | 105 83 | 280 258 | 345 310 | 139 120 | 270 244 | 117 82 |
Средняя продолжительность интервала между пачками, мс: I | ||||||||||||
29,1 | 221 | 78,0 | 520 | 60,0 | 30,8 | 860 | 160 | 46,0 | 570 | 353 | /13 | |
II | 23,2 | 192 | 54,0 | 470 | 38,2 | 25,8 | 618 | 98 | 34,5 | 480 | 29. | 670 |
Время открытия, мс: 1 | 1,90 | 1,50 | 1,60 | 1,50 | 1,60 | 1,80 | 1,55 | 1,60 | 1,88 | 1,63 | 1.75 | 1.45 |
11 | 1,81 | 1,19 | 0,98 | 1,34 | 1,70 | 1,54 | 1,32 | 1,41 | 1,68 | 1,43 | 1.42 | 1,23 |
Средняя продолжительность интервала в разряде, мс: 1 | ||||||||||||
0.47 | 0.40 | 0,45 | 0.41 | 0.44 | 0,46 | 0,42 | 0,39 | 0.50 | 0,50 | 0,45 | 0,40 | |
II | 0,35 | 0,29 | 0,31 | 0,30 | 0,36 | 0,38 | 0,39 | 0. | 0,42 | 0,40 | 0,43 | 0,38 |
нами показателей после перфузии 2 мМ стрептозотоцина. Период закрытия каналов после воздействия на эти клетки раствора, содержащего 5- 10 мМ глюкозы, задерживался и составлял 5- 7 мин (контроль 2-5 мин). Это приводило к увеличению латентного периода возникновения спайковой активности. Аналогичную картину наблюдали и после отмывания глюкозы: необходимо было 6-7 мин, чтобы вновь произошло открытие каналов и исчезла спайковая активность.
Функциональная оценка состояния АТФ-чувствительных К*-каналов ft-клеток, частично пораженных под воздействием сульфонилмочевинных препаратов. В таблице представлены полученные нами результаты исследований по анализу ряда электрофизиологических показателей состояния К +-АТФ-зависимых каналов интактных и функционально ослабленных р-клеток после аппликации глюкозы, глибенкламида, гликлазида и глипизида. Наиболее типичной реакцией исследуемых каналов в этих экспериментальных условиях было их полное закрытие под влиянием испытуемых препаратов. Однако в отличие от интактных клеток, когда концентрация применяемых препаратов для достижения эффекта колебалась от 1 до 20 мМ, для функционально ослабленных р-клеток необходимы были дозировки, превышающие вышеуказанные в 2,5-3 раза. Процесс закрытия канала наступает значительно медленнее, чем в норме, достигает устойчивого состояния в течение 40-50 с и длится до 14-15 мин. Отмывание клеток приводит к восстановлению активности этих каналов до исходного уровня, хотя этот процесс идет также весьма инерционно.
Наиболее типичной реакцией исследуемых каналов в этих экспериментальных условиях было их полное закрытие под влиянием испытуемых препаратов. Однако в отличие от интактных клеток, когда концентрация применяемых препаратов для достижения эффекта колебалась от 1 до 20 мМ, для функционально ослабленных р-клеток необходимы были дозировки, превышающие вышеуказанные в 2,5-3 раза. Процесс закрытия канала наступает значительно медленнее, чем в норме, достигает устойчивого состояния в течение 40-50 с и длится до 14-15 мин. Отмывание клеток приводит к восстановлению активности этих каналов до исходного уровня, хотя этот процесс идет также весьма инерционно.
Сравнительный анализ действия тестируемых сульфонилмочевинных препаратов на функционально ослабленные клетки, как и в случае с интактными клетками, показал, что глибенкла- мид является наиболее активным препаратом по способности стимулировать секрецию инсулина. Это наглядно проявлялось в более быстрых темпах закрытия каналов и начале возникновения спайковой активности по сравнению с действием гликлазида и глипизида.
В своих предыдущих исследованиях 111 на интактных р-клетках нами было показано, что анализируемые препараты оказывают специфическое действие на характер биоэлектрической активности АТФ-зависимых К+-каналов, точнее, на временной характер ее распределения. Как правило, активность анализируемых каналов проявляется пачковыми разрядами стандартной амплитуды, чередующимися с паузами длительностью несколько секунд. Структура биоэлектрической активности АТФ-зависимых К+-кана- лов р-клеток со сниженной активностью практически не менялась. Добавление любого из исследуемых препаратов вызывало сокращение длительности разрядов с одновременным увеличением интервала между пачками, такой же эффект наблюдался и после добавления глюкозы.
Детальный анализ динамики протекающих в ионном канале процессов, таких, как средняя продолжительность разрядов, время открытия канала, средняя продолжительность закрытия канала в пачковом разряде, средняя продолжительность интервала в разряде, как наиболее типичных и информативных показателей при оценке действия сульфаниламидных препаратов продемонстрировал, что все анализируемые показатели снижены по абсолютной величине, что свидетельствует о снижении функциональной активности каналов в наших экспериментальных условиях. Так, обработка р-клеток стрепозотоци- ном в дозе 2 мМ приводила к снижению средней продолжительности разряда на 14% от исходной, а интервал между пачками уменьшался на 29%. Продолжительность времени открытия снижалась на 5%, а средняя продолжительность интервала в разряде — на 25%. Эти данные свидетельствуют о том, что р-клетки в наших экспериментальных условиях сохраняют свою функциональную активность. Об этом также свидетельствуют данные ответной реакции пораженных р-клсток на введение глюкозы. Например, добавление 3,2 мМ глюкозы сокращает время открытия канала на 9% от исходного, средняя продолжительность интервала в разряде уменьшается на 8%. Средняя продолжительность разряда сокращалась в 3 раза, а интервал между пачками увеличивался в 8 раз. Все это свидетельствует в пользу специфической ответной реакции функционально ослабленных р-клеток на введение глюкозы, наиболее четко проявляющейся в сниженной способности каналов к открытию за счет сокращения длительности разрядов и увеличения продолжительности интервала между ними.
Например, добавление 3,2 мМ глюкозы сокращает время открытия канала на 9% от исходного, средняя продолжительность интервала в разряде уменьшается на 8%. Средняя продолжительность разряда сокращалась в 3 раза, а интервал между пачками увеличивался в 8 раз. Все это свидетельствует в пользу специфической ответной реакции функционально ослабленных р-клеток на введение глюкозы, наиболее четко проявляющейся в сниженной способности каналов к открытию за счет сокращения длительности разрядов и увеличения продолжительности интервала между ними.
Аналогичные результаты были получены нами в опытах с аппликацией сульфаниламидных препаратов. Применение К) мМ глибенкламида на р-клетки, частично пораженные стрептозотоци- ном. вызывало снижение вероятности открытия канала на 25-27%, время открытия уменьшалось на 13-14%, средняя продолжительность разряда сокращалась в 3,5 раза, продолжительность межимпульсных интервалов увеличивалась в 25 раз. Подобные результаты были отмечены нами и при применении гликлазида и глипизида.
Полученные нами данные свидетельствуют о том, что АТФ-зависимые К+-каналы р-клеток, подвергнутых воздействию стрептозотоцина, сохраняют в основном свои функциональные свойства и способны адекватно реагировать на специфические раздражители, какими являются глюкоза и сульфаниламидные препараты. Следует обратить внимание на факт более медленного закрытия АТФ-зависимых К+-каналов и удлинения тем самым латентного периода секреции инсулина, начиная от момента воздействия глюкозы или сульфонилмочевинных препаратов до момента экзоцитоза кванта инсулина. Процесс приобретает более инерционный характер. В этом случае нельзя исключить нарушения внутриклеточного метаболизма р-клеток, способного привести и к нарушениям их структуры. Хорошо известно, что добавление АТФ в культуру клеток очень быстро приводит к восстановлению активности К+-АТФ-чувствительных каналов, которые являются стратегически важной точкой в реализации эффекта сульфонилмочевинных препаратов в цепи стимул — секреция. Эти каналы являются ответственными за проявление прямого фармакологического действия на процессы электрогенеза, приводящие к секреции инсулина р- клетками. Весьма серьезным фактом, отмеченным нами, является то, что как глюкоза, так и сульфаниламидные препараты оказывают обратимое влияние на функционирование каналов. Наблюдавшиеся нами эффекты восстанавливались после отмывания препарата.
Эти каналы являются ответственными за проявление прямого фармакологического действия на процессы электрогенеза, приводящие к секреции инсулина р- клетками. Весьма серьезным фактом, отмеченным нами, является то, что как глюкоза, так и сульфаниламидные препараты оказывают обратимое влияние на функционирование каналов. Наблюдавшиеся нами эффекты восстанавливались после отмывания препарата.
Вопрос, поставленный нами в изучении особенностей функционирования ионных каналов в Р-клетках, частично ослабленных под влиянием стрептозотоцина, весьма актуален для специ- алистов-диабетологов при выборе препарата для терапии конкретного больного диабетом II типа.
Выводы
- АТФ-зависимые К+-каналы р-клеток поджелудочной железы, функционально ослабленных под влиянием стрептозотоцина, проявляют специфическую реакцию под действием глюкозы и сульфаниламидных препаратов, направленную на инициацию секреции инсулина. В этих экспериментальных условиях процесс закрытия АТФ- зависимых К+-каналов, характерный для начала процесса экзоцитоза инсулина, осуществляется значительно медленнее, чем у интактных р-клеток, что приводит к увеличению латентного периода секреции инсулина.

- Глибенкламид проявляет наиболее активно свои секретогенные свойства на функционально ослабленных р-клетках по сравнению с глипизи- дом и гликлазидом.
1. Бабичев В. Н., Игнатьев Н. С., Балаболкин М. Н. // Пробл. эндокринол. — 1993. — Т. 39, № 5. — С. 43—46.
2. Boyd А. Е. // Diabetes. — 1988. — Vol. 37. — Р. 847—450.
3. Cook D., Ikeuchi M. // Ibid. — 1989. — Vol. 38. — P. 416— 421.
4. Dunne M. J., Blot F. C., Peterson О. H. // J. Membr. Biol. — 1987. — Vol. 99. — P. 215—224.
5. Gillis K. D., Gee W. M., Hammond A. et al. //Amer. J. Physiol. — 1989. — Vol. 257. — P. 1119—1127.
6. Henguin J. C., Meissner H. P. // Biochem. Pharmacol. — 1982. — Vol. 31. — P. 1407—1415.
7. Loubatieres A. The Diabetic Pancreas / Eds B. W. Wolk, E. Wellman. — London, 1977. — P. 489—515.
8. Mister S., Falke L., Gillis K. et al. // Proc. nat. Acad. Sci. USA. — 1986. — Vol. 83. — P. 7119—7123.
9. Rorsman P.. Trube G. // Potassium Channels: Structure, Classification aqnd Therapeutic Potential / Ed. N. S. Cook. — Chichester, 1990. — P. 96—116.
N. S. Cook. — Chichester, 1990. — P. 96—116.
10. Rossman P., Berggren P. O., Bokvist K., Efendic S. // News in physiol. Sci. — 1990. — Vol. 5. — P. 143—147.
11. Tabcharani J. A.,. Mister S. // Biochim. biophys. Acta. — Vol. 982. — P. 62—72.
Митохондрии помнят, что они были бактериями – Наука – Коммерсантъ
23K 8 мин. …
Внутреннюю организацию клетки животных и растений можно сравнить с коммуной, где все равны и каждый выполняет одну, очень специфическую роль, создавая сбалансированный ансамбль. И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует
Эту структуру открыли в середине XIX века, и в течение 150 лет почти все считали, что ее единственная функция — быть энергетической машиной клетки. Грубо говоря, организм получает питательные вещества, которые после определенной деградации доходят до митохондрии и дальше происходит окислительная деградация питательных веществ, сопряженная с запасанием энергии в виде богатой энергией фосфорной связи в молекуле АТФ. Организм повсеместно использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр. В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
Постулат доминирующей в клетке энергетической функции митохондрии как-то оставлял в тени уже давно высказанную и всеми поддерживаемую теорию бактериального происхождения митохондрий. В простой трактовке она выглядит так: около 600 млн лет назад в клетку т. н. гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Однако попадание в ядерную клетку бактерий давало им и ряд преимуществ, в частности, оно дало им эволюционную нишу с ограниченным объемом и окруженную мембраной. Можно было обеспечить больший запас различных веществ, которые можно «складировать» не внутри ограниченного собственного объема, а снаружи, но в пределах своей «собственности», где они не будут разворованы другими организмами. Это соображение подтверждается в условиях, когда клетка вдруг перестает получать кислород и питательные вещества (например, при прекращении кровотока в участок ткани, что происходит при инфарктах и инсультах). Митохондрия в этих условиях уже не может быть энергетической машиной клетки (производить АТФ без кислорода трудно) и превращается в паразита — она начинает поглощать АТФ для того, чтобы обеспечить генерацию разницы мембранных потенциалов на своей мембране и поддержать свои собственные процессы. Для чего это нужно митохондрии — пока не понятно, но полуавтономный статус митохондрии в клетке тут проявляется особенно заметно — подобное поведение в кризисных условиях выглядит довольно эгоистичным. Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе «подушку безопасности» в условиях кризиса?
Для чего это нужно митохондрии — пока не понятно, но полуавтономный статус митохондрии в клетке тут проявляется особенно заметно — подобное поведение в кризисных условиях выглядит довольно эгоистичным. Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе «подушку безопасности» в условиях кризиса?
Попадание бактерий во внутриклеточную нишу обеспечивало и защиту от внешних врагов (а основные враги для бактерии — вирусы, то есть фаги). При этом было позволено выпускать сигнальные защитные вещества в ограниченный внутриклеточный объем; когда же бактерии существовали в «океане», выпуск таких сигнальных веществ был нерациональным — они немедленного разбавлялись в нем. Жизнь внутриклеточных бактерий в этой нише дала определенные преимущества: бактерии производят энергию и организуют в своей мембране белок, который выбрасывает в цитоплазму клетки синтезированный АТФ, чем клетка и пользуется. В итоге вроде бы наступает баланс: клетка дает митохондрии питательные субстраты, митохондрия дает клетке энергию,— что укрепляет теорию симбиотического взаимоотношения бактерий (они уже становятся митохондриями) с остальными частями клетки. Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики. Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики. Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Из сказанного видно, что понятие симбиоза и некоторого «эгоистического» поведения митохондрий довольно размыто. Да и идеалистическая картина симбиоза была «омрачена» в самом конце ХХ века открытием, что митохондрии, выпуская сигнальные молекулы, отдающие приказ на уничтожение клетки, отвечают за ее гибель. То есть вроде бы все по пословице «сколько волка ни корми…». Однако надо взглянуть на ситуацию с другой стороны. Нужна ли клеточная смерть организму? Да, но не для всех клеток. Это обязательный процесс для тех клеток, которые постоянно делятся — иначе будет разрастание ткани, которое может быть нежелательным. Принципиально это и для предотвращения и лечения различного опухолеобразования. А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
Это обязательный процесс для тех клеток, которые постоянно делятся — иначе будет разрастание ткани, которое может быть нежелательным. Принципиально это и для предотвращения и лечения различного опухолеобразования. А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики
Приведенные выше рассуждения — это явный конфликт эволюционной стратегии и человеческой логики, пытающейся оценить ситуацию с позиции субъекта, внутри которого живут существа, способные из друзей превратиться во врагов. Этот конфликт не мешает исследователям понимать, что митохондрия, хоть она и «помнит», что была бактерией, активно участвует в функционировании клетки; важная роль митохондрий объясняет необходимость предоставления им привилегий. В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
Этот конфликт не мешает исследователям понимать, что митохондрия, хоть она и «помнит», что была бактерией, активно участвует в функционировании клетки; важная роль митохондрий объясняет необходимость предоставления им привилегий. В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
Сегодня выяснилось, что большинство болезней сопровождается сбоем в работе внутриклеточной машины проверки качества митохондрий, своеобразного ОТК, отбраковывающего плохие митохондрии и отправляющего их на внутриклеточное переваривание (митофагию). Сбой возникает, например, при старении организма, и ОТК пропускает неправильные митохондрии. В результате в клетке начинают сосуществовать хорошие и плохие митохондрии. Когда же доля плохих превышает некоторый порог, наступает т. н. «фенотипическое проявление» болезни, которая до сих пор носила невидимый, латентный характер.
В результате в клетке начинают сосуществовать хорошие и плохие митохондрии. Когда же доля плохих превышает некоторый порог, наступает т. н. «фенотипическое проявление» болезни, которая до сих пор носила невидимый, латентный характер.
Можно сделать два вывода. Во-первых, без митохондрий ядерные клетки существовать не могут. Во-вторых, чтобы защитить клетку от поражения (чем бы оно ни было вызвано: химией, физикой или просто временем), надо «договориться» с митохондриями, то есть обеспечить им «достойное» существование. Это означает не только постоянную подпитку их активности за счет доставки питательных субстратов и кислорода, но и предоставление им своеобразной медицинской страховки, которая при необходимости обеспечит восстановление их структуры и функций и/или правильную утилизацию поврежденных митохондрий. Отсутствие утилизации поврежденных митохондриальных структур может привести к «заражению» здоровых структур, что непременно повлечет за собой заболевание.
Сейчас трансплантация органов стала вполне рутинной процедурой, хотя все еще сложной и дорогостоящей. Развивается и клеточная терапия, то есть пересадка стволовых клеток. А вот о возможности пересадки здоровых митохондрий говорить только начинают. Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо «разговоры» (по-английски это звучит более научно — cross-talk) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
Развивается и клеточная терапия, то есть пересадка стволовых клеток. А вот о возможности пересадки здоровых митохондрий говорить только начинают. Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо «разговоры» (по-английски это звучит более научно — cross-talk) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
На каком языке «общаются» органы, еще предстоит выяснить,— пока предполагают химический язык общения. Хорошая и здоровая почка со своими здоровыми митохондриями вырабатывает и посылает в кровь эритропоэтин (тот самый, приемом которого увлекались спортсмены и который не только стимулирует выработку эритроцитов, но и мобилизует общий метаболизм, что повышает выносливость). Эритропоэтин обладает сильными нейрозащитными свойствами.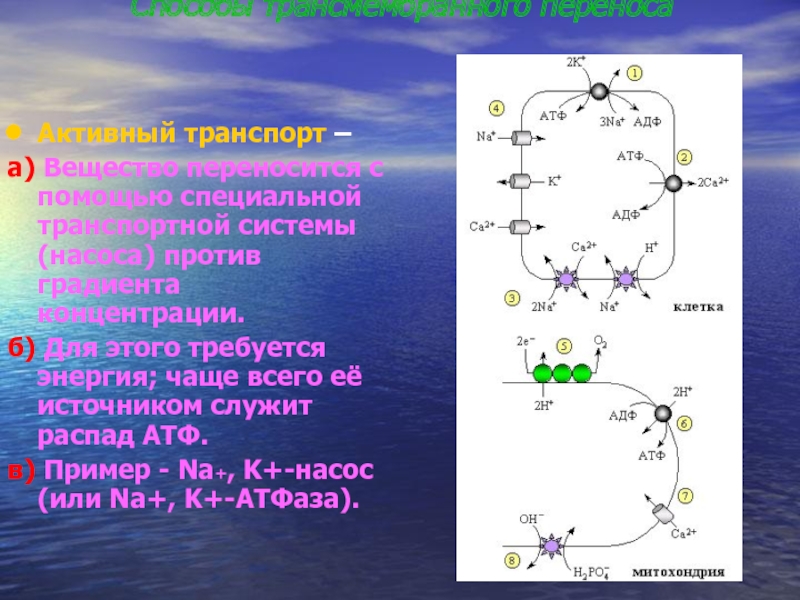 Стоит повредить почку, скажем, неумеренным приемом антибиотиков (антибиотики убивают и митохондрии, потому что они — бывшие бактерии), и последствия инсульта головного мозга становятся более драматическими. Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Стоит повредить почку, скажем, неумеренным приемом антибиотиков (антибиотики убивают и митохондрии, потому что они — бывшие бактерии), и последствия инсульта головного мозга становятся более драматическими. Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий
Возьмем, к примеру, сепсис — бактериальную инфекцию, одну из ведущих причин человеческой смертности. Сейчас уже можно — правда, пока шепотом — говорить и о «митохондриальном сепсисе», когда в кровь попадают компоненты митохондрий. Это не менее опасно, чем бактериальный сепсис, так как приводит к гиперактивации иммунного ответа (так называемый синдром системного воспаления, SIRS) и возможной гибели организма.
Как уже было упомянуто, естественными врагами бактерий являются вирусы. Это также верно и для митохондрий. Недавно открытая бактериальная система защиты от вирусов CRISPR (clustered regularly interspaced short palindromic repeats), имеющая все признаки элементарно организованной иммунной системы, заставила задуматься: нет ли иммунной системы у митохондрий? У бактерий эта иммунная система устроена следующим образом: в бактериальном геноме (структурно очень похожем на митохондриальный) располагаются своего рода библиотеки, или антивирусные базы данных — куски генов тех вирусов, с которыми эта бактерия когда-либо встречалась. При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке.
При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке. Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только «контрольный пакет акций», обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только «контрольный пакет акций», обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Приняв тезис «митохондрии помнят, что они были бактериями», мы можем поменять многое в стратегии базового научного мышления и практической медицинской деятельности, так или иначе связанных с митохондриями. А учитывая количество функций, выполняемых митохондриями в клетке, это большая часть всех биомедицинских задач: от рака до нейродегенеративных заболеваний.
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка
Часто достаточно вылечить митохондрии — и вылечится клетка
Дмитрий Зоров, доктор биологических наук, МГУ им. М.В. Ломоносова
Технология XCell ATF®
Почему это важно О R-фактор РесурсыЗапрос цитаты
Лидер в области интенсификации
Повышенная производительность
10-кратная VCD и более низкая себестоимость
Прорывная технология
Инновационная технология ATF 9 0003
Готовность к быстрому масштабированию
Интегрированная система
Простота конструкции
Мощный интерфейс
Высокое качество производства
Лидер по интенсификации Интенсификация позволяет производить больше продукции быстрее
XCell ® Технология ATF помогает упростить и интенсифицировать предшествующие процессы, чтобы доставлять больше продукции быстрее. Интенсивные процессы обеспечивают более высокую плотность клеток, требуют меньших биореакторов и занимают меньше времени. Увеличьте пропускную способность, производительность и мощность как в клиническом, так и в коммерческом производстве.
Интенсивные процессы обеспечивают более высокую плотность клеток, требуют меньших биореакторов и занимают меньше времени. Увеличьте пропускную способность, производительность и мощность как в клиническом, так и в коммерческом производстве.
Более высокая производительность и более низкий COG для кандидата на лечение малярии.
- 10X VCD более 2 недель Fed-серия (350 x 10 6 клеток/мл)
- 50% сокращение времени работы биореактора
- Увеличение урожайности в 20 раз
Система XCell ® ATF основана на отмеченной наградами технологии переменного тангенциального потока (ATF), создаваемой действием диафрагмы, движущейся вверх и вниз внутри головки насоса, соединены с корпусом фильтра и прикреплены к биореактору. Переменный тангенциальный поток достигается действием диафрагменного насоса.
Переменный тангенциальный поток достигается действием диафрагменного насоса.
Система XCell ® ATF System упрощает и ускоряет развитие интенсификации на начальном этапе от PD до промышленного масштаба. Интенсификация увеличивает пропускную способность, ускоряет передачу технологий и оптимизирует ваш процесс в клиническом производстве и MSAT, одновременно повышая производительность биореактора и снижая затраты в коммерческом производстве. Более высокая производительность, меньшие биореакторы и более высокая пропускная способность с более коротким временем сбора урожая в сочетании снижают риски расширения объекта и капитальные затраты.
Интегрированная система
Простота проектирования с лабораторной системой XCell™Лабораторная система XCell™, разработанная и спроектированная как комплексное решение, объединяет современный контроллер, устройства XCell® ATF, программное обеспечение и датчики расхода в комплексное решение.
- Контроллер, разработанный инженерами, способствует повышению интенсификации
- Настраиваемая конфигурация обеспечивает высокую пропускную способность — один коллектор поддерживает до 8 устройств XCell® ATF
- Программное обеспечение обеспечивает точное техническое управление с удобным интерфейсом
- Новое устройство XCell ATF® 1 подходит для интенсификации малых объемов и готово к масштабированию
- Глобальная техническая поддержка Repligen обеспечивает успешное внедрение и масштабирование
Лабораторная система XCell™
XCell ® Устройства и контроллеры ATF Система XCell ATF представляет собой комплексное решение для интенсификации восходящего потока с надежной интеграцией аппаратного и программного обеспечения. Доступны в форматах одноразового использования и из нержавеющей стали с размерами от лабораторных (2 л) до технологических (5000 л). Каждая система состоит из XCell ATF 9.Устройство 0045 ® , контроллер XCell™, программное обеспечение, трубки и датчики.
Доступны в форматах одноразового использования и из нержавеющей стали с размерами от лабораторных (2 л) до технологических (5000 л). Каждая система состоит из XCell ATF 9.Устройство 0045 ® , контроллер XCell™, программное обеспечение, трубки и датчики.
Устройства по шкале
Устройства по формату
Контроллеры
XCell ® Системы ATFXCell ® ATF Технология удержания клеток упрощает и ускоряет разработку интенсификации генная терапия, периодическая интенсификация с подпиткой, интенсификация посевного цикла, перфузия и приложения для обмена средами .
Решения
Генная терапия
Новые модальности
Перфузия
Перфузия N-1
Интенсификация семенного поезда
Контроллер XCell™ Lab Controller решает вашу задачу повышения производительности с помощью новых технологий, повышенной производительности и большего количества данных о процессе. Превратите разочарование от бесконечных перестановок в простое решение, которое генерирует больше ячеек и больше продукта… быстрее.
Превратите разочарование от бесконечных перестановок в простое решение, которое генерирует больше ячеек и больше продукта… быстрее.
Мыслите нестандартно
Интенсификация того стоит. По кирпичикам создайте интенсивный апстрим с системами XCell ATF®. Производите в два раза больше продукта за вдвое меньшее время, наблюдая, как биореакторы VCD увеличиваются и уменьшаются в размерах на той же площади предприятия.
ОМВ! с XCell™
О боже, жизнь становится насыщенной. Настройте лучшую в отрасли интенсификацию клеточных культур менее чем за 30 минут благодаря простоте конструкции устройств XCell ATF®. Отмечайте больше продуктов на работе… и у вас останется время для особых моментов дома. ЮГТИ.
РГЕН
$
Производственные центры передового опыта Repligen разрабатывает и производит продукты для биофармацевтической промышленности в соответствии с системой управления качеством ISO 9001.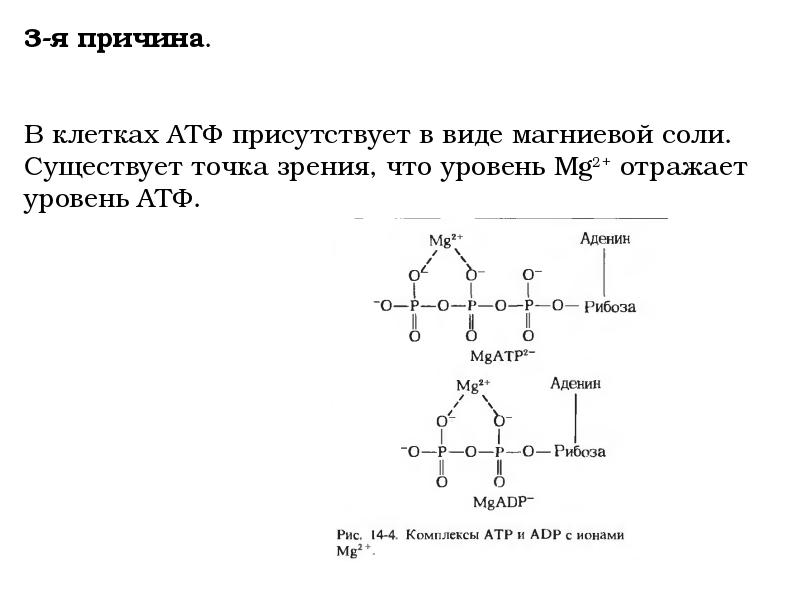 Мы ориентируемся на своевременную поставку высококачественных, стабильных и надежных продуктов, чтобы обеспечить непрерывность бизнеса для наших клиентов.
Мы ориентируемся на своевременную поставку высококачественных, стабильных и надежных продуктов, чтобы обеспечить непрерывность бизнеса для наших клиентов.
Производственные площадки Repligen расположены в Массачусетсе, Калифорнии и Нью-Джерси в США, а также в Швеции, Франции, Нидерландах, Германии, Франции и Эстонии.
Местоположение
Клиент в первую очередь.Поддержка является частью ДНК Repligen. Наша цель — обеспечить исключительное качество обслуживания клиентов и поддержать эффективное и успешное внедрение и внедрение всех продуктов и услуг Repligen.
- Поддержка полевых приложений
- Служба поддержки клиентов
- Инженеры выездного обслуживания
Есть вопрос?
Спецификации
Технология XCell ATF® Лабораторная система XCell® Технические характеристики лабораторной системы XCell®Вебинары
High Productive Harvest
Ноябрь 2018 г.
Ноябрь 2016 г.
Руководства пользователя
Устройства XCell ATF® и контроллеры XCell® Отчет о сейсмической анкеровке Руководство по настройке устройства XCell ATF® 1 Руководство пользователя лабораторного контроллера XCell® Руководство по вводу в эксплуатацию одноразового устройства XCell ATF® 2 Руководство по вводу в эксплуатацию одноразового устройства XCell ATF® 6 XCell Руководство по вводу в эксплуатацию одноразового устройства ATF® 10 Руководство пользователя контроллера XCell® C24:V3 Система XCell ATF® с контроллером C410:V4B Система XCell ATF® с контроллером C410:V3 Фильтр систем XCell ATF® Подготовка и автоклавВидео
ОМВ! С XCell® | Фактор R Решите процесс интенсификации — быстрее | Фактор R Нестандартное мышление | The R Factor Технология XCell ATF® XCell ATF® Одноразовая автономная процедура увлажнения Как установить фильтр из полых волокон Repligen F10 XCell ATF® Одноразовый мембранный механизм R Factor 9000 3 Решите Интенсивная головоломка. .. быстрее
.. быстрее
Белая книга
Исследование технологии перфузии XCell ATF® для интенсификации процесса производства вирусов в MSD Animal Health
Repligen Corporation
MSD Animal Health
Июль 2022 г.
Научные постеры
High Productive Harvest : Новый подход к ФРС Интенсификация процесса периодического действия Интенсивное размножение семян и высокопроизводительный сбор культур периодического действия с подкормкой с использованием системы XCell ATF® Уменьшение удержания белка в процессе перфузии и влияние размера пор фильтра Демонстрация характеристик одноразового использования XCell ATF® 2 и XCell ATF® 6 Инструменты для интенсификации производства клеточных культур и непрерывной последующей обработки Технология перфузии ATF: Улучшенная пропускная способность с подпиткой и уменьшенное расширение линии посевного материалаСертификат качества
Система XCell ATF® — примерНекоторые сторонние ссылки
Специальный отчет о непрерывной биообработке: вверх по течению, вниз по течению, готовы к прайм-тайму? Компания WuXi Biologics расширяет возможности перфузии клеточных культур с помощью системы ATF 10 Непрерывное производство: изменение парадигмы обработки для моноклонального антитела, включая оптимизацию среды Краткая история перфузионного биопроизводства: как высококонцентрированные культуры будут характеризовать фабрику будущего Технические характеристикиУстройства и контроллеры XCell ATF®
Руководство по выбору размера устройства XCell ATF® Представлены площади фильтров с полыми волокнами, объемы насоса XCellATF ® и типичные рабочие объемы биореактора, связанные с каждым устройством XCellATF ® . Фактическая емкость и размер сосуда зависят от конкретных условий процесса культивирования клеток.
Фактическая емкость и размер сосуда зависят от конкретных условий процесса культивирования клеток.
| Устройство | Эффективная площадь поверхности фильтра (м2) | Приблизительный объем заменяемой ATF (л) | Объем суспензионных культур (л) |
| XC ell ATF 1 | 0,022 | 0,017 | 0,5 — 2 |
| XCell ATF 2 | 0,13 | 0,1 | 2 — 10 |
| XCell ATF 4 | 90 326 0,770,4 | 10 — 50 | |
| XCell ATF 6 | 2,5 | 1,3 | 50–200 |
| XCell ATF 10 | 11,0 | 90 326 6,0200 — 1000 |
XCell ATF ® 1 Одноразовое устройство
XCell ATF ® 2 Одноразовое устройство
XCell ATF ® 6 Одноразовое устройство
XCell ATF ® 10 Одноразовое устройство
Наборы одноразовых трубок XCell ATF®
9 0040 Процедура смачивания фильтра XCell ATF ® Одинарный -Использование Устройства поставляются сухими. Для обеспечения надежной работы фильтра важно намочить фильтр перед использованием. Набор трубок XCell ATF ® и предлагаемые протоколы смачивания предназначены для:
Для обеспечения надежной работы фильтра важно намочить фильтр перед использованием. Набор трубок XCell ATF ® и предлагаемые протоколы смачивания предназначены для:
- Обеспечения эффективного и полного смачивания фильтра за счет сведения к минимуму образования воздушных карманов во время процесса смачивания
- Включить проверку целостности фильтра перед использованием при сохранении стерильности
- Обеспечьте средство для оценки стерильности устройства XCell ATF® до установления соединения с биореактором
- Разрешить замену устройства XCell ATF® во время обработки клеточной культуры без прерывания работы биореактора или XCell ATF®
XCell ATF® Устройства из нержавеющей стали
XCell ATF ® 2 Устройство из нержавеющей стали
XCell ATF ® 4 Устройство из нержавеющей стали
90 007 XCell ATF ® 6 Устройство из нержавеющей стали
XCell ATF ® 10 Устройство из нержавеющей стали
Как установить фильтр из полых волокон Посмотрите видео о том, как установить фильтр из полых волокон в устройство XCell ATF® 10 из нержавеющей стали.
XCell™ Controller
XCell™ Lab Controller
для использования с:
XCell ATF ® 1 (SU)
XCell ATF ® 2 (SU,SS)
XCell ® ATF 4 (SS)
XCell ATF ® Контроллер C410
для использования с:
XCell ATF ® 4 (SS)
XCell ATF ® 6 (СУ, СС)
XCell ATF ® 10 (SU, SS)
XCell ATF ® Тележка контроллера C410
(дополнительно)
Веб-семинары
High Productive Harvest
Ноябрь 2018 г.

 4
4 34
34