Актуальные проблемы низкорослости у детей и подростков: классификация, особенности клинической терапии вариантов заболевания | Касаткина
Э. П. Касаткина
https://doi.org/10.14341/probl12001
Полный текст:
PDF (Rus) | HTML | XML
- Статья
- Об авторе
Аннотация
Статья посвящена актуальным проблемам низкорослости у детей и подростков, классификации, особенностям клинической терапии вариантов заболевания.
Ключевые слова
актуальные проблемы, низкорослость, дети, подростки, классификация, клиническая терапия
Для цитирования:
Касаткина Э.П. Актуальные проблемы низкорослости у детей и подростков: классификация, особенности клинической терапии вариантов заболевания.
For citation:
Kasatkina E.P. Pressing problems of dwarfism in children and adolescents: Classification, specificities in the clinical course of the disease variants. Problems of Endocrinology. 1993;39(5):90-93.
(In Russ.)
https://doi. org/10.14341/probl12001
org/10.14341/probl12001
Задержка роста является частой причиной обращаемости детей к эндокринологу: примерно около 3 % детского населения имеют выраженную задержку роста. При этом дефицит гормона роста (ГР) как причина низкорослости выявляется не более чем у 8,5 %. У остальных детей наиболее часто выявляют конституциональные особенности роста и развития, реже — дефицит других анаболических гормонов, тяжелые соматические заболевания, генетические и хромосомные заболевания. В последние годы проблема выявления больных с дефицитом ГР как причины задержки роста становится особенно актуальной. Обусловлено это тем обстоятельством, что в качестве заместительной гормональной терапии у данной группы больных используют рекомбинантный человеческий ГР. Препарат дает хороший росто- вый эффект. Особенно выражен этот эффект у больных с задержкой роста, обусловленной дефицитом ГР. В связи с этим выявление подобных больных среди детей с нанизмом является очень важным этапом в цепи мероприятий, направленных на нормализацию роста детей.


 Задержка роста становится заметной на 2-м году жизни. Постепенно темпы роста снижаются, и после 4 лет жизни дети прибавляют в год не более 2-3 см. Костный возраст значительно отстает от хронологического. Помимо задержки роста у детей с дефицитом ГР имеет место склонность к гипогликемическим состояниям (снижены процессы гликогенолиза). Гипогликемия у некоторых детей может быть первым признаком заболевания и нередко выявляется уже в период новорожденности. Дефицит тиреотропного гормона у больных ЦГН является причиной гипотиреоза, что определяет комплекс характерных симптомов: психическая вялость, сухость кожных покровов, брадикардия, гипотония, запоры, позднее появление и поздняя смена зубов. Выраженный дефицит ТГ еще более ухудшает процессы роста и дифференцировки костей скелета у больных с ЦГН. Дефицит гонадотропных гормонов (ГТГ) является причиной развития гипогонадизма. У части мальчиков с ЦГН уже при рождении имеются признаки внутриутробного дефицита ГТГ: крипторхизм и микрофаллос. В дальнейшем у всех больных выявляются симптомы тяжелого гипогонадизма: вторичные половые признаки отсутствуют, зоны роста остаются открытыми.
Задержка роста становится заметной на 2-м году жизни. Постепенно темпы роста снижаются, и после 4 лет жизни дети прибавляют в год не более 2-3 см. Костный возраст значительно отстает от хронологического. Помимо задержки роста у детей с дефицитом ГР имеет место склонность к гипогликемическим состояниям (снижены процессы гликогенолиза). Гипогликемия у некоторых детей может быть первым признаком заболевания и нередко выявляется уже в период новорожденности. Дефицит тиреотропного гормона у больных ЦГН является причиной гипотиреоза, что определяет комплекс характерных симптомов: психическая вялость, сухость кожных покровов, брадикардия, гипотония, запоры, позднее появление и поздняя смена зубов. Выраженный дефицит ТГ еще более ухудшает процессы роста и дифференцировки костей скелета у больных с ЦГН. Дефицит гонадотропных гормонов (ГТГ) является причиной развития гипогонадизма. У части мальчиков с ЦГН уже при рождении имеются признаки внутриутробного дефицита ГТГ: крипторхизм и микрофаллос. В дальнейшем у всех больных выявляются симптомы тяжелого гипогонадизма: вторичные половые признаки отсутствуют, зоны роста остаются открытыми.

 При этом может нарушаться лишь один из регуляторных механизмов (катехоламиновый, серотониновый или допаминовый). Психологическая карликовость может иметь место у детей из неблагополучных семей. У подобных детей развивается выраженная задержка роста, костного возраста, психического развития, доказано наличие дефицита ГР. При изоляции этих детей из неблагоприятных условий уровень ГР самостоятельно восстанавливается, дети начинают расти, однако отставание интеллектуального развития остается на всю жизнь. Редкий вариант задержки роста — синдром Ларона — обусловлен дефектом рецепторов ГР. Клиническая картина у больных с подобным синдромом идентична клинической картине изолированного дефицита ГР. Однако уровень ГР у больных обычно превышает нормальные показатели. Отсутствие эффекта ГР объясняют снижением уровня соматомединов (прежде всего ИФР1), синтез которых не повышается при введении экзогенного ГР. Описаны семейные случаи заболевания, часто в этих семьях регистрируются кровные браки. Нельзя исключить возможность развития вариантов задержки роста, обусловленных также нарушением биологической активности ГР.
При этом может нарушаться лишь один из регуляторных механизмов (катехоламиновый, серотониновый или допаминовый). Психологическая карликовость может иметь место у детей из неблагополучных семей. У подобных детей развивается выраженная задержка роста, костного возраста, психического развития, доказано наличие дефицита ГР. При изоляции этих детей из неблагоприятных условий уровень ГР самостоятельно восстанавливается, дети начинают расти, однако отставание интеллектуального развития остается на всю жизнь. Редкий вариант задержки роста — синдром Ларона — обусловлен дефектом рецепторов ГР. Клиническая картина у больных с подобным синдромом идентична клинической картине изолированного дефицита ГР. Однако уровень ГР у больных обычно превышает нормальные показатели. Отсутствие эффекта ГР объясняют снижением уровня соматомединов (прежде всего ИФР1), синтез которых не повышается при введении экзогенного ГР. Описаны семейные случаи заболевания, часто в этих семьях регистрируются кровные браки. Нельзя исключить возможность развития вариантов задержки роста, обусловленных также нарушением биологической активности ГР.
 Диагностика подобных вариантов задержек роста нетрудна, так как на первый план в клинической картине выступают характерные симптомы основного эндокринного заболевания. Сложность при дифференциальной диагностике этих состояний может возникнуть лишь в том случае, когда у больного с легким вариантом первичного врожденного гипотиреоза имеет место пропорциональная задержка роста и костного возраста (моносимптомный вариант заболевания) и нет других типичных симптомов врожденного гипотиреоза. Особенности гормонального профиля этих заболеваний позволяют без труда установить правильный диагноз. Повышение уровня ТТГ и нормальный на фоне стимуляции уровень ГР (после насыщения ТГ) позволяют исключить у больного дефицит СТГ как причину задержки роста и установить диагноз первичного гипотиреоза (моносимптомный вариант). II. Эндокринно-независимые варианты задержки роста Значительно чаще у больных с задержкой роста признаки нарушения функции эндокринных желез отсутствуют, т. е. у большинства детей задержка роста обусловлена неэндокринными факторами.
Диагностика подобных вариантов задержек роста нетрудна, так как на первый план в клинической картине выступают характерные симптомы основного эндокринного заболевания. Сложность при дифференциальной диагностике этих состояний может возникнуть лишь в том случае, когда у больного с легким вариантом первичного врожденного гипотиреоза имеет место пропорциональная задержка роста и костного возраста (моносимптомный вариант заболевания) и нет других типичных симптомов врожденного гипотиреоза. Особенности гормонального профиля этих заболеваний позволяют без труда установить правильный диагноз. Повышение уровня ТТГ и нормальный на фоне стимуляции уровень ГР (после насыщения ТГ) позволяют исключить у больного дефицит СТГ как причину задержки роста и установить диагноз первичного гипотиреоза (моносимптомный вариант). II. Эндокринно-независимые варианты задержки роста Значительно чаще у больных с задержкой роста признаки нарушения функции эндокринных желез отсутствуют, т. е. у большинства детей задержка роста обусловлена неэндокринными факторами. Тяжелые соматические заболевания, в результате которых возникают состояния длительной гипоксии (врожденные пороки сердца, анемия, заболевания легких), нарушения всасывания (целиакия, муковисцидоз). Тяжелые метаболические нарушения (хронические заболевания печени и почек), а также патология костной системы (хондродистрофия, гаргоилизм и другие врожденные синдромы) часто сопровождаются выраженной задержкой роста. При данных вариантах нанизма признаки первичного нарушения функции эндокринных желез отсутствуют, костный возраст, как правило, соответствует хронологическому. На первый план выступают симптомы основного заболевания, что позволяет без труда установить причину задержки роста. Примордиальный нанизм (внутриматочный, первичный). Особенностью данного варианта задержки роста является нарушение процессов роста с периода внутриутробной жизни. Доношенные новорожденные с этой патологией имеют недостаточную длину и массу тела. На всех этапах жизни дети с примордиальным нанизмом значительно отстают от своих сверстников в росте.
Тяжелые соматические заболевания, в результате которых возникают состояния длительной гипоксии (врожденные пороки сердца, анемия, заболевания легких), нарушения всасывания (целиакия, муковисцидоз). Тяжелые метаболические нарушения (хронические заболевания печени и почек), а также патология костной системы (хондродистрофия, гаргоилизм и другие врожденные синдромы) часто сопровождаются выраженной задержкой роста. При данных вариантах нанизма признаки первичного нарушения функции эндокринных желез отсутствуют, костный возраст, как правило, соответствует хронологическому. На первый план выступают симптомы основного заболевания, что позволяет без труда установить причину задержки роста. Примордиальный нанизм (внутриматочный, первичный). Особенностью данного варианта задержки роста является нарушение процессов роста с периода внутриутробной жизни. Доношенные новорожденные с этой патологией имеют недостаточную длину и массу тела. На всех этапах жизни дети с примордиальным нанизмом значительно отстают от своих сверстников в росте. Однако в отличие от детей с эндокринно-обусловленной задержкой роста костный возраст у этих детей соответствует хронологическому, пубертатный период, как правило, наступает в обычные сроки. Уровень ГР соответствует нормальным показателям. Не вызывает сомнения факт, что группа детей с примордиальным нанизмом гетерогенна. В этой группе объединяются больные по одному главному признаку — нарушение процессов роста с периода внутриутробной жизни: генетические синдромы (Секкеля, Рассела — Сильвера и др.), внутрима- точная инфекция (краснуха, сифилис, токсоплазмоз, цитомегалия), «плод алкоголика» и др. Характерным признаком синдрома Шерешев- ского — Тернера является выраженная задержка роста. При классическом варианте синдрома (кариотип 45X0) рост больных не превышает 142- 145 см, при мозаицизме (45Х0/46ХХ) рост может быть несколько выше. При рождении дети с этим Синдромом имеют нормальные показатели длины и массы тела, задержка роста начинает обращать на себя внимание с 2-3-летнего возраста. С этого времени темпы роста снижаются до 2-3 см в год.
Однако в отличие от детей с эндокринно-обусловленной задержкой роста костный возраст у этих детей соответствует хронологическому, пубертатный период, как правило, наступает в обычные сроки. Уровень ГР соответствует нормальным показателям. Не вызывает сомнения факт, что группа детей с примордиальным нанизмом гетерогенна. В этой группе объединяются больные по одному главному признаку — нарушение процессов роста с периода внутриутробной жизни: генетические синдромы (Секкеля, Рассела — Сильвера и др.), внутрима- точная инфекция (краснуха, сифилис, токсоплазмоз, цитомегалия), «плод алкоголика» и др. Характерным признаком синдрома Шерешев- ского — Тернера является выраженная задержка роста. При классическом варианте синдрома (кариотип 45X0) рост больных не превышает 142- 145 см, при мозаицизме (45Х0/46ХХ) рост может быть несколько выше. При рождении дети с этим Синдромом имеют нормальные показатели длины и массы тела, задержка роста начинает обращать на себя внимание с 2-3-летнего возраста. С этого времени темпы роста снижаются до 2-3 см в год. Костный возраст, как правило, до 11 -12 лет соответствует хронологическому, в дальнейшем из-за выраженного гипогонадизма отстает от хронологического. При классическом варианте заболевания вторичные половые признаки отсутствуют, при мозаицизме — могут быть выражены в разной степени. Большое количество характерных диспластиче- ских симптомов, отрицательный или низкий процент полового хроматина подтверждают диагноз. Синдром Шерешевского — Тернера — наиболее частая (~20-30 %) причина задержки роста у девочек. У мальчиков с задержкой роста наиболее часто имеет место конституциональная задержка роста и полового созревания (синдром позднего пубертата) или семейная низкорослость. Конститтциональная задержка роста и полового созревания — синдром позднего пубертата — характеризуется особенностями роста и развития наследственного характера. Обычно родители и/или ближайшие родственники этих детей имеют те же особенности развития. Так, длина и масса тела при рождении не отличаются от таковых у здоровых детей.
Костный возраст, как правило, до 11 -12 лет соответствует хронологическому, в дальнейшем из-за выраженного гипогонадизма отстает от хронологического. При классическом варианте заболевания вторичные половые признаки отсутствуют, при мозаицизме — могут быть выражены в разной степени. Большое количество характерных диспластиче- ских симптомов, отрицательный или низкий процент полового хроматина подтверждают диагноз. Синдром Шерешевского — Тернера — наиболее частая (~20-30 %) причина задержки роста у девочек. У мальчиков с задержкой роста наиболее часто имеет место конституциональная задержка роста и полового созревания (синдром позднего пубертата) или семейная низкорослость. Конститтциональная задержка роста и полового созревания — синдром позднего пубертата — характеризуется особенностями роста и развития наследственного характера. Обычно родители и/или ближайшие родственники этих детей имеют те же особенности развития. Так, длина и масса тела при рождении не отличаются от таковых у здоровых детей. Наиболее низкие показатели темпов роста имеют место в первые годы жизни и, следовательно, наиболее выраженная задержка роста наблюдается у детей в возрасте 3-4 лет. С 4-5 лет темпы роста восстанавливаются (5-6 см в год), однако, имея исходно низкий рост, дети остаются в школьном возрасте низкорослыми. Костный возраст несколько (в среднем на 2 года) отстает от хронологического. Этим обстоятельством можно объяснить позднее вступление в пубертат: обычно половое развитие и, следовательно, пубертатный скачок в росте запаздывают у этих детей на 2-4 года. В связи с этим подростки с синдромом позднего пубертата резко отстают в своем развитии от сверстников. Позднее вступление в пубертат в данном случае следует признать благоприятным фактором, так как оно позволяет пациентам с подобными особенностями конституционального развития иметь в конечном итоге нормальный рост. При проведении дифференциальной диагностики вариантов задержки роста у мальчиков- следует помнить, что около 80 % подростков с задержкой роста и полового развития имеют эту конституциональную особенность роста и развития.
Наиболее низкие показатели темпов роста имеют место в первые годы жизни и, следовательно, наиболее выраженная задержка роста наблюдается у детей в возрасте 3-4 лет. С 4-5 лет темпы роста восстанавливаются (5-6 см в год), однако, имея исходно низкий рост, дети остаются в школьном возрасте низкорослыми. Костный возраст несколько (в среднем на 2 года) отстает от хронологического. Этим обстоятельством можно объяснить позднее вступление в пубертат: обычно половое развитие и, следовательно, пубертатный скачок в росте запаздывают у этих детей на 2-4 года. В связи с этим подростки с синдромом позднего пубертата резко отстают в своем развитии от сверстников. Позднее вступление в пубертат в данном случае следует признать благоприятным фактором, так как оно позволяет пациентам с подобными особенностями конституционального развития иметь в конечном итоге нормальный рост. При проведении дифференциальной диагностики вариантов задержки роста у мальчиков- следует помнить, что около 80 % подростков с задержкой роста и полового развития имеют эту конституциональную особенность роста и развития. Семейная низкорослость. Среди родственников детей с подобным вариантом задержки роста всегда имеются низкорослые. При рождении дети имеют нормальные показатели роста и массы тела, но темпы роста после 3-4 лет составляют 2- 4 см в год. Принципиальным является то, что костный возраст этих детей обычно соответствует хронологическому и, следовательно, вступление детей в пубертат соответствует нормальным срокам. Данное обстоятельство является причиной низкорослости взрослых пациентов с этими особенностями развития. Нельзя исключить, что причиной семейной низкорослости являются конституциональные особенности синтеза и секреции ГР. На основании изложенных данных классификация нанизма у детей может быть представлена следующим образом. КЛАССИФИКАЦИЯ ЗАДЕРЖКИ РОСТА У ДЕТЕЙ 1. Эндокринно-зависимые вариатты 1.1. Дефицит ГР 1.1.1. цгн 1.1.1.1. Идиопатический вариант (пангипопитуитаризм) 1.1.1.2. Органический вариант 1.1.2. Изолированный дефицит ГР 1.1.2.1. Значительный дефицит ГР 1.1.2.2. Частичный дефицит ГР 1.
Семейная низкорослость. Среди родственников детей с подобным вариантом задержки роста всегда имеются низкорослые. При рождении дети имеют нормальные показатели роста и массы тела, но темпы роста после 3-4 лет составляют 2- 4 см в год. Принципиальным является то, что костный возраст этих детей обычно соответствует хронологическому и, следовательно, вступление детей в пубертат соответствует нормальным срокам. Данное обстоятельство является причиной низкорослости взрослых пациентов с этими особенностями развития. Нельзя исключить, что причиной семейной низкорослости являются конституциональные особенности синтеза и секреции ГР. На основании изложенных данных классификация нанизма у детей может быть представлена следующим образом. КЛАССИФИКАЦИЯ ЗАДЕРЖКИ РОСТА У ДЕТЕЙ 1. Эндокринно-зависимые вариатты 1.1. Дефицит ГР 1.1.1. цгн 1.1.1.1. Идиопатический вариант (пангипопитуитаризм) 1.1.1.2. Органический вариант 1.1.2. Изолированный дефицит ГР 1.1.2.1. Значительный дефицит ГР 1.1.2.2. Частичный дефицит ГР 1.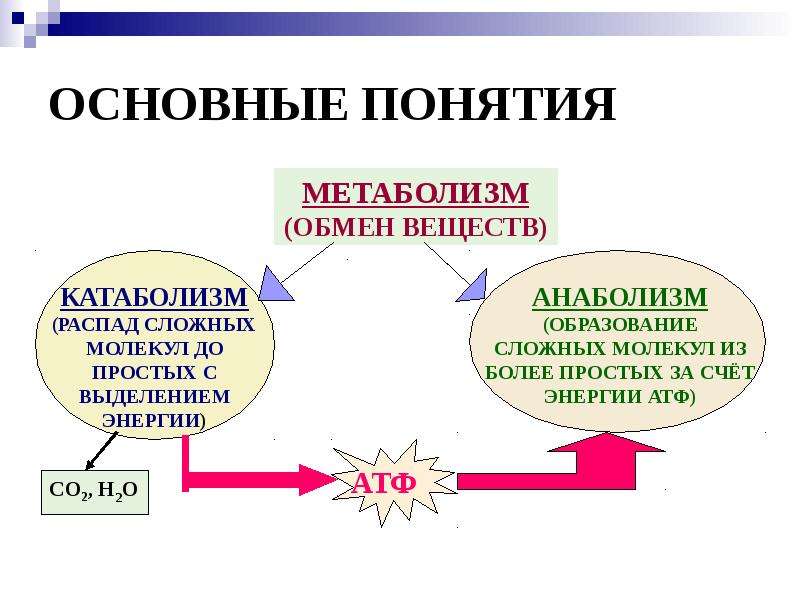 1.2.3. Нейросекреторная дисфункция 1.1.2.4. Психологическая карликовость 1.1.3. Синдром Ларона 1.2. Дефицит ТГ 1.2.1. Гипотиреоз 1.2.2. Моносимптомный вариант врожденного первичного гипотиреоза 1.3. Дефицит инсулина 1.3.1. Синдром Мориака, Нобекура 1.4. Дефицит половых гормонов 1.4.1. Первичный гипогонадизм 1.4.2. Вторичный гипогонадизм 1.5. Избыток половых гормонов 1.5.1. Преждевременное половое созревание (после окончания полового созревания) 1.6. Избыток глюкокортикоидов 1.6.1. Болезнь Иценко — Кушинга 2. Эндокринно-независимые варианты 2.1. Соматогенно-обусловленные Врожденные и приобретенные заболевания, сопровождающиеся: 2.1.1. хронической гипоксией 2.1.2. хронической анемией 2.1.3. нарушением процессов всасывания 2.1.4. нарушением функции почек 2.1.5. нарушением функции печени 2.2. Патология костной системы 2.3. Генетические и хромосомные синдромы 2.3.1. Примордиальный нанизм 2.3.2. Синдром Шерешевского — Тернера 3. Конституциональные особенности физиче ского развития 3.1. Синдром позднего пубертата 3.
1.2.3. Нейросекреторная дисфункция 1.1.2.4. Психологическая карликовость 1.1.3. Синдром Ларона 1.2. Дефицит ТГ 1.2.1. Гипотиреоз 1.2.2. Моносимптомный вариант врожденного первичного гипотиреоза 1.3. Дефицит инсулина 1.3.1. Синдром Мориака, Нобекура 1.4. Дефицит половых гормонов 1.4.1. Первичный гипогонадизм 1.4.2. Вторичный гипогонадизм 1.5. Избыток половых гормонов 1.5.1. Преждевременное половое созревание (после окончания полового созревания) 1.6. Избыток глюкокортикоидов 1.6.1. Болезнь Иценко — Кушинга 2. Эндокринно-независимые варианты 2.1. Соматогенно-обусловленные Врожденные и приобретенные заболевания, сопровождающиеся: 2.1.1. хронической гипоксией 2.1.2. хронической анемией 2.1.3. нарушением процессов всасывания 2.1.4. нарушением функции почек 2.1.5. нарушением функции печени 2.2. Патология костной системы 2.3. Генетические и хромосомные синдромы 2.3.1. Примордиальный нанизм 2.3.2. Синдром Шерешевского — Тернера 3. Конституциональные особенности физиче ского развития 3.1. Синдром позднего пубертата 3. 2. Семейная низкорослость Итак, задержка роста у детей — состояние гете рогенное. Наиболее выраженные формы заболевания обусловлены дефицитом ГР. В прошлом больные с дефицитом ГР были наиболее бесперспективными в плане лечения. В настоящее время ситуация изменилась. Именно эта группа детей на фоне заместительной гормональной терапии рекомбинантным человеческим ГР дает наиболее выраженную прибавку в росте. Более того, известны случаи нормализации роста у больных на фоне длительной заместительной гормональной терапии. В связи с этим дифференциальная диагностика нанизма, выявление детей с дефицитом ГР, т. е. отбор больных для лечения препаратом, является очень актуальной задачей современной клинической эндокринологии.
2. Семейная низкорослость Итак, задержка роста у детей — состояние гете рогенное. Наиболее выраженные формы заболевания обусловлены дефицитом ГР. В прошлом больные с дефицитом ГР были наиболее бесперспективными в плане лечения. В настоящее время ситуация изменилась. Именно эта группа детей на фоне заместительной гормональной терапии рекомбинантным человеческим ГР дает наиболее выраженную прибавку в росте. Более того, известны случаи нормализации роста у больных на фоне длительной заместительной гормональной терапии. В связи с этим дифференциальная диагностика нанизма, выявление детей с дефицитом ГР, т. е. отбор больных для лечения препаратом, является очень актуальной задачей современной клинической эндокринологии.Список литературы
1. Васюкова Е. А., Касаткина Э. П. Нарушения роста.- М., 1981.- С. 1-15.
2. Evaluation of growth hormone secretion: Physiology and clinical application. // Pediatric and Adolescent. Endocrinology Karger, 1983.- Vol. 12.- P. 1-199.
3. Growth II Pediatric Endocrinology / Ed. F. Lifshitz.- New York, 1985.- P. 1-139.
Growth II Pediatric Endocrinology / Ed. F. Lifshitz.- New York, 1985.- P. 1-139.
Об авторе
Э. П. КасаткинаЦентральный институт усовершенствования врачей М3 РФ
Россия
Рецензия
Для цитирования:
Касаткина Э.П. Актуальные проблемы низкорослости у детей и подростков: классификация, особенности клинической терапии вариантов заболевания. Проблемы Эндокринологии. 1993;39(5):90-93. https://doi.org/10.14341/probl12001
For citation:
Kasatkina E.P. Pressing problems of dwarfism in children and adolescents: Classification, specificities in the clinical course of the disease variants. Problems of Endocrinology.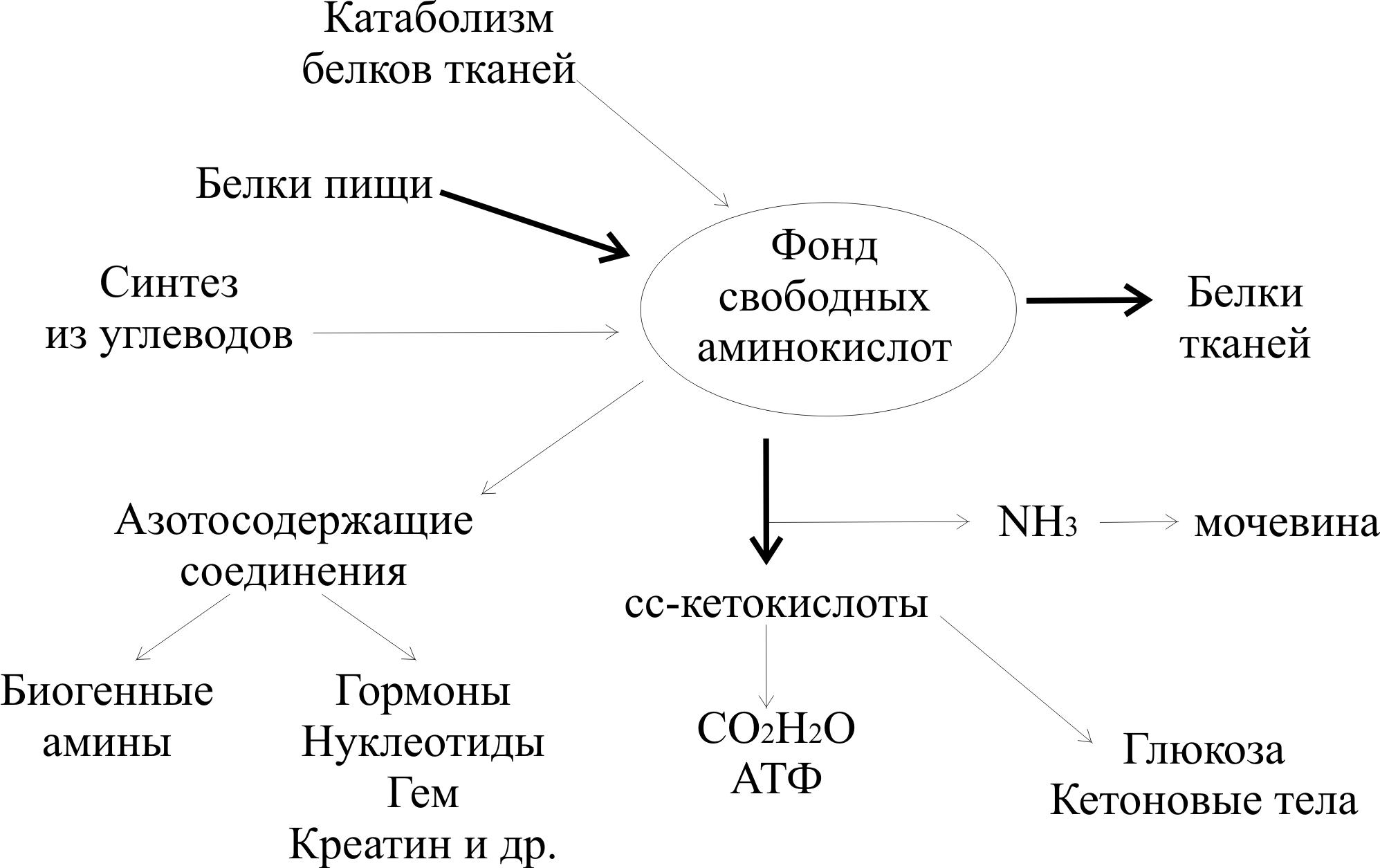 1993;39(5):90-93.
(In Russ.)
https://doi.org/10.14341/probl12001
1993;39(5):90-93.
(In Russ.)
https://doi.org/10.14341/probl12001
Просмотров: 12876
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
Тиреотом (Thyreotom). Таблетки пероральные Справочник лекарств. Томск
//= $single_post[«name_eng»] ?> //= $single_post[«name_rus»] ?>
Упаковка
Таблетки пероральныеФармакологическое действие
Препарат синтетических гормонов щитовидной железы. Увеличивает потребность тканей в кислороде, стимулирует их рост и дифференцировку, повышает уровень базального метаболизма (белков, жиров и углеводов). В малых дозах оказывает анаболический, а в больших — катаболический эффект. Угнетает выработку тиреотропного гормона. Усиливает энергетические процессы, оказывает положительное влияние на функции нервной и сердечно-сосудистой систем, печени и почек.
Показания к применению
— Гипотиреоз любого генеза. — Эутиреоидный зоб. — Заместительная терапия и профилактика рецидива зоба после резекции щитовидной железы. — Рак щитовидной железы (после оперативного лечения).Форма выпуска
таблетки 40 мкг + 10 мкг; флакон (флакончик) стеклянный 60, пачка картонная 1; таблетки 40 мкг + 10 мкг; блистер 50, пачка картонная 1; таблетки 40 мкг + 10 мкг; блистер 50, пачка картонная 2; Состав Таблетки 1 табл. левотироксин натрия 40 мкг лиотиронин 10 мкг вспомогательные вещества: лактозы моногидрат; крахмал кукурузный; желатин; кремния диоксид высокодисперсный; магния стеарат; глицерин 85% во флаконах стеклянных по 60 шт .; в пачке картонной 1 флакон или в блистере 50 шт .; в пачке картонной 1 или 2 блистера.Фармакодинамика
Препарат синтетических гормонов щитовидной железы. Увеличивает потребность тканей в кислороде, стимулирует их рост и дифференцировку, повышает уровень базального метаболизма (белков, жиров и углеводов). В малых дозах оказывает анаболический, а в больших — катаболический эффект. Угнетает выработку тиреотропного гормона. Усиливает энергетические процессы, оказывает положительное влияние на функции нервной и сердечно-сосудистой систем, печени и почек.
В малых дозах оказывает анаболический, а в больших — катаболический эффект. Угнетает выработку тиреотропного гормона. Усиливает энергетические процессы, оказывает положительное влияние на функции нервной и сердечно-сосудистой систем, печени и почек.Фармакокинетика
Левотироксин При приеме внутрь левотироксин всасывается почти исключительно в верхнем отделе тонкой кишки. Всасывается до 80% принятой дозы препарата. Прием пищи снижает всасываемость левотироксина. Cmax в сыворотке крови достигается примерно через 5-6 ч после приема внутрь. После всасывания более 99% препарата связывается с белками сыворотки (тироксин глобулином, тироксинзв’язуючого преальбумином и альбумином). В различных тканях происходит монодейодування примерно 80% левотироксина с образованием трийодтиронина и неактивных продуктов. Тиреоидные гормоны метаболизируются главным образом в печени, почках, головном мозге и в мышцах. Небольшое количество препарата подвергается дезаминуванню и декарбоксилированию, а также кон’югированию с серной и глюкуроновой кислотами (в печени). Метаболиты выводятся с мочой и желчью. T1 / 2 левотироксина — 6-7 дней. При тиреотоксикозе T1 / 2 укорачивается до 3-4 дней, а при гипотиреозе удлиняется до 9-10 дней.
Лиотиронин
Абсорбция при приеме внутрь — 95% (в течение 4 ч). Связывание с белками плазмы высокое. T1 / 2 — 2,5 сут.
Метаболиты выводятся с мочой и желчью. T1 / 2 левотироксина — 6-7 дней. При тиреотоксикозе T1 / 2 укорачивается до 3-4 дней, а при гипотиреозе удлиняется до 9-10 дней.
Лиотиронин
Абсорбция при приеме внутрь — 95% (в течение 4 ч). Связывание с белками плазмы высокое. T1 / 2 — 2,5 сут.Использование во время беременности
В период беременности и грудного вскармливания терапия гормонами щитовидной железы, назначенными по поводу гипотиреоза, должна продолжаться. В период беременности требуется увеличение дозы препарата из-за повышения уровня содержания ТЗГ. При беременности применение препарата в комбинации с тиреостатиками противопоказано, поэтому может потребоваться увеличение доз тиреостатиков. Поскольку тиреостатики, в отличие от левотироксина, могут проникать через плаценту, то у плода может развиться гипотиреоз. Количество гормонов щитовидной железы, секретируется с грудным молоком при грудном вскармливании (даже при проведении лечения высокими дозами препарата), недостаточно, для того чтобы вызвать какие-либо нарушения у ребенка. Однако в период грудного вскармливания препарат следует принимать с осторожностью, строго в рекомендуемых дозах под наблюдением врача.
Однако в период грудного вскармливания препарат следует принимать с осторожностью, строго в рекомендуемых дозах под наблюдением врача.Противопоказания к применению
Повышенная индивидуальная чувствительность к препарату, нелеченный тиреотоксикоз, острый инфаркт миокарда, стенокардия III-IV функционального класса, острый миокардит, нелеченная недостаточность надпочечников.Побочные действия
Побочные эффекты обычно не наблюдаются при правильном применении под контролем врача. Возможны — аллергические реакции, прогрессирование сердечной недостаточности и стенокардии.Способ применения и дозировка
Внутрь, не менее чем за 30 мин до завтрака, не разжевывая и запивая достаточным количеством жидкости, однократно. Суточная доза определяется индивидуально зависимости от показаний. Гипотиреоз. Взрослым: начальная доза — 1 табл. на сутки, затем возможно увеличение дозы на 1 табл. каждые 2-4 недели до достижения поддерживающей суточной дозы — 2-5 табл. Детям: при подборе дозы при длительном лечении учитывают массу тела, рост и поверхность тела ребенка. Средняя рекомендуемая поддерживающая доза — 2-2,5 табл. на сутки.
Эутиреоидное зоб. Взрослым: начальная доза — 1-2 табл. на сутки, поддерживающая доза — 3-6 табл. на сутки.
Подросткам: начальная доза — 1-1,5 табл. на сутки, поддерживающая доза — 2,5-3,5 табл. на сутки.
Детям: по 0,5-1 табл. на сутки.
Профилактика рецидива зоба после оперативного лечения: взрослым — 2-3 табл. на сутки.
После оперативного лечения по поводу рака щитовидной железы: начальная доза — 3 табл. на сутки, поддерживающая доза — 6 табл. на сутки.
Прием препарата следует осуществлять регулярно.
Продолжительность лечения определяется формой заболевания. Как правило, при гипотиреозе и после тиреоидэктомии по поводу рака щитовидной железы лечение проводят в течение всей жизни.
Длительность применения при эутиреоидном зобе, а также с целью профилактики рецидива зоба после оперативного лечения составляет от нескольких месяцев или лет до применения в течение всей жизни.
Средняя рекомендуемая поддерживающая доза — 2-2,5 табл. на сутки.
Эутиреоидное зоб. Взрослым: начальная доза — 1-2 табл. на сутки, поддерживающая доза — 3-6 табл. на сутки.
Подросткам: начальная доза — 1-1,5 табл. на сутки, поддерживающая доза — 2,5-3,5 табл. на сутки.
Детям: по 0,5-1 табл. на сутки.
Профилактика рецидива зоба после оперативного лечения: взрослым — 2-3 табл. на сутки.
После оперативного лечения по поводу рака щитовидной железы: начальная доза — 3 табл. на сутки, поддерживающая доза — 6 табл. на сутки.
Прием препарата следует осуществлять регулярно.
Продолжительность лечения определяется формой заболевания. Как правило, при гипотиреозе и после тиреоидэктомии по поводу рака щитовидной железы лечение проводят в течение всей жизни.
Длительность применения при эутиреоидном зобе, а также с целью профилактики рецидива зоба после оперативного лечения составляет от нескольких месяцев или лет до применения в течение всей жизни.Передозировка
Симптомы (характерные для тиреотоксикоза): сердцебиение, нарушение ритма сердца, боли в сердце, беспокойство, тремор, нарушение сна, повышенная потливость, повышение аппетита, уменьшение массы тела, диарея. Лечение: в зависимости от выраженности симптомов рекомендуется уменьшение суточной дозы препарата или перерыв в лечении на несколько дней, назначение бета-адреноблокаторов. После исчезновения побочных эффектов лечение следует начинать с осторожностью с более низкой дозы.
Лечение: в зависимости от выраженности симптомов рекомендуется уменьшение суточной дозы препарата или перерыв в лечении на несколько дней, назначение бета-адреноблокаторов. После исчезновения побочных эффектов лечение следует начинать с осторожностью с более низкой дозы.Взаимодействие с другими препаратами
Тиреотом усиливает действие непрямых антикоагулянтов (возможно уменьшение их дозы). Применение трициклических антидепрессантов с тиреотома может привести к усилению действия антидепрессантов. Тиреоидные гормоны могут увеличивать потребность в инсулине и пероральных гипогликемических препаратах. Более частый контроль уровня глюкозы крови рекомендуется проводить в периоды начала лечения препаратом, а также при изменении режима его дозирования. Тиреотом снижает действие сердечных гликозидов. При одновременном применении холестирамин, колестипол и алюминия гидроксид уменьшают плазменную концентрацию препарата за счет торможения всасывания его в кишечнике. При одновременном применении с анаболическими стероидами, аспарагиназой, тамоксифеном возможно фармакокинетическое взаимодействие на уровне связывания с белком. При одновременном применении с фенитоином, салицилатами, клофибратом, фуросемидом в высоких дозах (250 мг) повышается содержание несвязанных с белками плазмы крови гормонов щитовидной железы.
Прием естрогенвмистких препаратов увеличивает содержание тироксин связывающего глобулина, что может повысить потребность в тиреотома у некоторых пациентов. Соматотропин при одновременном применении с тиреотома может ускорить закрытие эпифизарных зон роста.
Прием фенобарбитала, карбамазепина и рифампицина может увеличивать клиренс левотироксина и потребовать повышения дозы тиреотома.
При одновременном применении с фенитоином, салицилатами, клофибратом, фуросемидом в высоких дозах (250 мг) повышается содержание несвязанных с белками плазмы крови гормонов щитовидной железы.
Прием естрогенвмистких препаратов увеличивает содержание тироксин связывающего глобулина, что может повысить потребность в тиреотома у некоторых пациентов. Соматотропин при одновременном применении с тиреотома может ускорить закрытие эпифизарных зон роста.
Прием фенобарбитала, карбамазепина и рифампицина может увеличивать клиренс левотироксина и потребовать повышения дозы тиреотома.Меры предосторожности
При гипотиреозе, обусловлено поражением гипофиза, необходимо выяснить, имеется ли одновременно недостаточность коры надпочечников. В данном случае заместительную терапию глюкокортикостероидами следует начинать до начала лечения гипотиреоза тиреоидными гормонами во избежание развития острой надпочечниковой недостаточности. Препарат не влияет на профессиональную деятельность, связанную с вождением транспортных средств и управлением механизмами.
Условия хранения
Список Б.: При температурі 15-25 ° C.Срок годности
36 мес.Опасные эффекты катаболического состояния и синдром усталости надпочечников
Катаболизм относится к набору метаболических путей, которые расщепляют большие молекулы на более мелкие. Например, эти пути расщепляют белки на аминокислоты и жиры на жирные кислоты. Это помогает обеспечить клетки энергией. Но катаболизм и катаболическое состояние — не одно и то же, как мы увидим позже.
Узнать больше:
» Прочитайте нашу полную статью о катаболическом состоянии и синдроме усталости надпочечников
» Часто задаваемые вопросы об усталости надпочечников
» Пройдите наш 3-минутный тест, чтобы узнать, есть ли у вас усталость надпочечников
Анаболизм противоположен. Это относится к набору метаболических путей, которые создают молекулы из более мелких единиц. Вместе катаболизм и анаболизм образуют две части вашего метаболического цикла. И для того, чтобы ваше тело было здоровым и сильным и поддерживало оптимальный вес и мышечную массу, эти два пути должны быть в равновесии. Дисбаланс может привести к катаболическому состоянию, что иногда может произойти, если у вас синдром усталости надпочечников (AFS).
И для того, чтобы ваше тело было здоровым и сильным и поддерживало оптимальный вес и мышечную массу, эти два пути должны быть в равновесии. Дисбаланс может привести к катаболическому состоянию, что иногда может произойти, если у вас синдром усталости надпочечников (AFS).
Усталость надпочечников — это состояние, возникающее в результате хронического стресса. Ваши надпочечники должны усердно работать, чтобы вырабатывать кортизол, основной гормон организма, борющийся со стрессом. Если ваши надпочечники перегружены слишком долго, ваши надпочечники нарушают регуляцию, и вы испытываете надпочечниковую усталость.
АФС, характеризующийся набором различных симптомов. Они включают усталость, увеличение веса, бессонницу, туман в голове, тревогу, легкую депрессию, низкое либидо, ПМС, бесплодие, выпадение волос, сухость кожи, гипогликемию, тягу к соли и сладкому, частые простуды и грипп, пищевую и лекарственную чувствительность, головокружение и неспособность справиться со стрессом.
На более поздних стадиях AFS вы можете оказаться в катаболическом состоянии, и ваши симптомы будут гораздо более очевидными, постоянными и тяжелыми. Это обычная проблема, которую мы видим у наших клиентов, занимающихся коучингом по питанию, и ее необходимо решать с помощью различных стратегий, включая лучшее питание.
Катаболизм против катаболического состояния
Катаболизм является естественной и необходимой частью вашего метаболизма. Он включает процессы:
- Расщепления мышечного белка для глюконеогенеза, который представляет собой образование глюкозы из неуглеводных источников.
- Гликолиз, который является этапом производства клеткой АТФ, энергетической валюты жизни.
- Цикл лимонной кислоты.
- Расщепление жировых отложений на жирные кислоты.
Без катаболизма ваше тело не смогло бы расщеплять пищу, чтобы использовать ее для получения энергии. Затем анаболизм использует эту энергию для создания новых клеток, а также для создания и обновления структур вашего тела. Эти два компонента образуют полный метаболический цикл, и оба они одинаково важны.
Эти два компонента образуют полный метаболический цикл, и оба они одинаково важны.
Но в нашей стремительной современной жизни баланс между катаболизмом и анаболизмом часто нарушается.
Большинство людей переживают периоды сильного стресса и не ведут образ жизни, оптимальный для их здоровья. Многие из нас в конечном итоге переедают, придерживаются нездоровой диеты, ведут малоподвижный образ жизни, борются с хроническими заболеваниями, подвергаются воздействию токсинов и/или находятся под сильным давлением на работе или дома. Эти факторы в сочетании с изменениями метаболизма, которые происходят с возрастом, могут сделать ваш метаболический цикл более склонным к катаболизму. Если ваш катаболизм становится хроническим, вы можете достичь катаболического состояния. И это имеет много негативных последствий.
Последствия катаболического состояния
Катаболическое состояние возникает, когда компонент катаболизма в вашем метаболическом цикле гораздо более заметен, чем компонент анаболизма. Это означает, что анаболизма недостаточно, чтобы уравнять распад молекул. Процессы роста и восстановления происходят недостаточно быстро, чтобы компенсировать катаболизм.
Это означает, что анаболизма недостаточно, чтобы уравнять распад молекул. Процессы роста и восстановления происходят недостаточно быстро, чтобы компенсировать катаболизм.
Затем вы начинаете замечать потерю мышечной массы и подкожного жира, усталость, низкий уровень энергии, непереносимость физических упражнений и снижение вашей способности справляться с любым видом стресса. Что здесь происходит, так это то, что вашему телу так мало энергии, что оно пытается расщепить свои собственные мышцы и жировые ткани, чтобы произвести их.
Если эта каннибализация мышц для получения энергии продолжится, она в конечном итоге обратится к вашим внутренним органам. Как вы можете себе представить, это ужасная ситуация и причина некоторых из самых изнурительных симптомов.
Если вы не справитесь с этим катаболическим состоянием, ваше тело может войти в худшее состояние. Это называется кахексией, или катаболическим истощением, и влечет за собой быструю потерю мышечной ткани и подкожного жира. Вы можете потерять от 5 до 20% своего веса, даже если у вас нормальный вес.
Вы можете потерять от 5 до 20% своего веса, даже если у вас нормальный вес.
Причины катаболического состояния и катаболического истощения
Существует несколько причин, по которым ваше тело может перейти в катаболическое состояние и катаболическое истощение, включая усталость надпочечников. Но сначала полезно понять некоторые из общих факторов, которые способствуют катаболическому состоянию:
- Продвинутые стадии рака, когда раковые клетки берут на себя метаболическую активность и питательные резервы нормальных клеток
- Чрезмерное увлечение детоксикацией, особенно если это не подходит для вашего текущего состояния
- Обезвоживание
- Мышечная травма вследствие операции или травмы
- Потеря коллагена
- Хроническое заболевание печени, которое замедляет обмен веществ и способствует накоплению токсинов в организме, что затем приводит к расщеплению белков
- Хронические инфекции, такие как H. Pylori или болезнь Лайма
- Злоупотребление некоторыми лекарствами, такими как антибиотики
- Длительное голодание
- Хронический стресс
- Хроническое воспаление
Очень распространенной основной проблемой является нарушение всасывания питательных веществ. Это происходит, когда у вас есть проблемы с желудочно-кишечным трактом (ЖКТ), такие как воспаление, травма, дисбактериоз, рак или хирургическое вмешательство. Таким образом, даже если вы едите достаточно и едите правильную пищу, ваше тело не может усваивать питательные вещества, и в результате вы недоедаете.
Это происходит, когда у вас есть проблемы с желудочно-кишечным трактом (ЖКТ), такие как воспаление, травма, дисбактериоз, рак или хирургическое вмешательство. Таким образом, даже если вы едите достаточно и едите правильную пищу, ваше тело не может усваивать питательные вещества, и в результате вы недоедаете.
Примечание о воспалении
Воспаление, хотя и является естественным и необходимым физиологическим процессом, может иметь очень вредные последствия, если оно становится хроническим. Хроническое воспаление снижает синтез мышечного белка и увеличивает скорость его распада. Цитокины, представляющие собой молекулы, участвующие в передаче клеточных сигналов во время воспаления, вызывают высвобождение кортизола и нейротрансмиттеров катехоламинов. Эти два фактора нарушают клеточный метаболизм и скорость основного обмена, что может ухудшить катаболическое состояние.
Симптомы катаболического состояния
Таким образом, по мере развития катаболического состояния происходит потеря мышечной массы и общей массы тела. Если это продолжается, внутренние органы разрушаются. И независимо от того, сколько мышц и органов задействовано для создания энергии, этого недостаточно, потому что это также истощает ваши энергетические и питательные запасы.
Если это продолжается, внутренние органы разрушаются. И независимо от того, сколько мышц и органов задействовано для создания энергии, этого недостаточно, потому что это также истощает ваши энергетические и питательные запасы.
Катаболическое состояние также вызывает много повреждений, которые очевидны, когда вы смотрите на симптомы. Эти симптомы включают в себя:
- Неспособность набрать вес даже после увеличения потребления калорий
- Необъяснимая потеря веса
- Видимая потеря мышечной массы
- Низкое энергопотребление
- Низкая температура тела и быстрое охлаждение
- Быстрая утомляемость
- Низкая переносимость физической нагрузки
- Бессонница
- Проблемы с пищеварением, такие как вздутие живота и запор
- Пониженная желудочная кислота
- Повышенная чувствительность к определенным пищевым продуктам
- Недостаток энергии, чтобы закончить трапезу за один присест
- Очень быстрое чувство сытости, всего после нескольких укусов
- Гипогликемия
- Мышечные судороги
- Боль в суставах
- Одышка
- Мозговой туман
- Изменения пигментации кожи
- Пигментные пятна
- Морщины вокруг глаз и на лбу
- Боль и дискомфорт в области печени
- Слабая мочевая система
- Низкое либидо
- Низкое кровяное давление
- Головокружение и предобморочное состояние, особенно при вставании
- Электролитный дисбаланс
- Хронический стресс
Конечно, вы не получите все эти симптомы сразу. На самом деле, катаболическое состояние может подкрадываться к вам так постепенно, что вы почти не замечаете его, пока оно не станет достаточно сильным. И, как и в случае с усталостью надпочечников, симптомы можно спутать с симптомами другого состояния (или нескольких). Это может привести к тому, что вы будете обращаться за лечением не в те места.
На самом деле, катаболическое состояние может подкрадываться к вам так постепенно, что вы почти не замечаете его, пока оно не станет достаточно сильным. И, как и в случае с усталостью надпочечников, симптомы можно спутать с симптомами другого состояния (или нескольких). Это может привести к тому, что вы будете обращаться за лечением не в те места.
АФС и катаболическое состояние
Многие симптомы катаболического состояния схожи с усталостью надпочечников и нарушением регуляции нейроэндометаболической (НЭМ) реакции на стресс. NEM — это глобальная реакция вашего организма на стресс, состоящая из шести цепей: гормональной, биоэнергетической, кардиономической, нейроаффектной, воспалительной и детоксикационной.
Несмотря на то, что надпочечники, которые являются частью цепи гормонов NEM, являются первой линией защиты от стресса, весь ваш NEM задействован когда присутствует стресс. Вот почему вы видите так много разных симптомов стресса. И поскольку катаболическое состояние — это очень стрессовое состояние, весь ваш NEM задействован, когда вы в нем находитесь. Вот почему вы видите так много разных симптомов. Это, а также потому, что катаболическое состояние повлияет на каждую часть вашего тела.
Вот почему вы видите так много разных симптомов. Это, а также потому, что катаболическое состояние повлияет на каждую часть вашего тела.
Итак, катаболическое состояние, являющееся результатом одного из причинных факторов, перечисленных выше, может привести к АФС и дисрегуляции НЭМ. Но AFS и дисрегуляция NEM сами по себе являются причинными факторами катаболического состояния. И у обоих есть хронический стресс в качестве основной причины.
Катаболизм на различных стадиях AFS
Во время первых двух стадий утомления надпочечников выработка кортизола высока. Но по мере прогрессирования АФС надпочечники ослабевают до предела истощения, и их выброс кортизола падает. Кортизол увеличивает расщепление белков для высвобождения энергии. Это означает, что он увеличивает катаболизм. Таким образом, начальные стадии AFS создают дисбаланс в метаболическом цикле, который больше склоняется к катаболизму.
При выполнении AFS
На более поздних стадиях AFS катаболическое состояние уже идет полным ходом, хотя уровень кортизола значительно снизился. В то же время анаболизм слишком слаб, чтобы вернуть равновесие в метаболический цикл. Фаза восстановления и ремонта теперь слишком медленная, чтобы оказать влияние. Усталость продолжает ухудшаться, создавая большую потребность в энергии, что затем ухудшает катаболическое состояние.
В то же время анаболизм слишком слаб, чтобы вернуть равновесие в метаболический цикл. Фаза восстановления и ремонта теперь слишком медленная, чтобы оказать влияние. Усталость продолжает ухудшаться, создавая большую потребность в энергии, что затем ухудшает катаболическое состояние.
Это когда вы действительно начинаете видеть признаки катаболического состояния. Морщины образуются на вашем лице, потому что ваш коллаген расщепляется без пополнения. Хроническая боль в мышцах и суставах может возникать по мере того, как ваши мышцы и органы разрушаются. Вы можете закончить с синдромом хронической усталости, синдромом хронической боли или фибромиалгией.
Моторика вашего желудочно-кишечного тракта нарушается, поэтому вам будет труднее переваривать пищу. Вы можете закончить с СРК и несварением желудка. Недостаток усвоения питательных веществ приведет к множеству других проблем, включая снижение иммунитета, снижение способности к физическим упражнениям, слабость и более частые падения из-за этого, а также замедление заживления ран.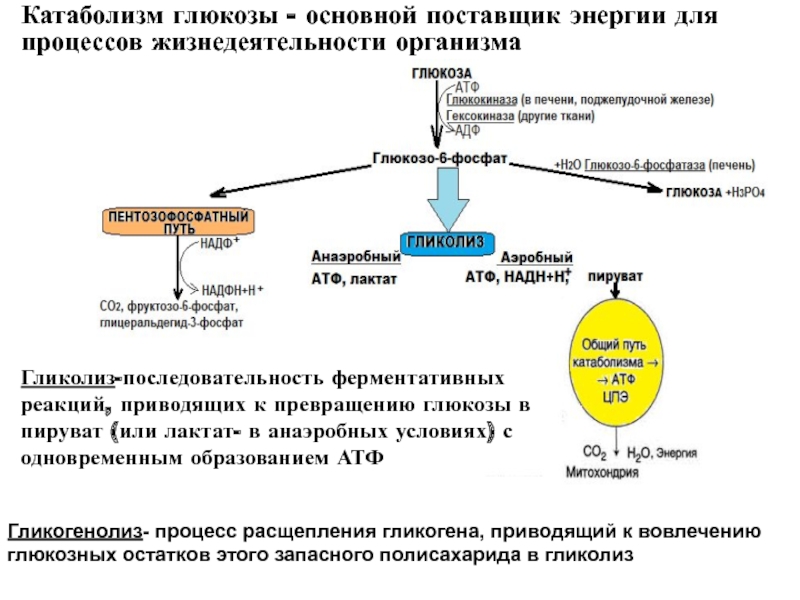
Если позволить катаболическому состоянию перейти в катаболическое истощение, это может в конечном итоге привести к смерти. К счастью, есть много вещей, которые вы можете с этим поделать, независимо от того, насколько запущено ваше состояние. Важно быть осторожным и обдуманным при восстановлении, чтобы получить от него максимальную пользу и избежать его ловушек. Для этого вам понадобится помощь и руководство экспертов по усталости надпочечников, таких как наша команда тренеров по питанию.
Три стадии выздоровления
Поскольку катаболическое состояние, которое возникает при продвинутой стадии AFS, делает тело очень хрупким, вам придется проходить этапы восстановления. К этим этапам нужно относиться с осторожностью и осторожностью, и они должны проходить под руководством медицинского работника, имеющего опыт работы в этих условиях.
Ниже приведены три шага или стадии процесса восстановления:
Шаг 1: Остановка развития катаболического состояния
Это достигается изменением образа жизни и диеты. Вам нужно пополнить запасы потерянной энергии и питательных веществ, и это должно быть сделано на макро- и микронутриентном уровне. Внедрение диеты при усталости надпочечников и ее индивидуализация в соответствии с вашим типом метаболизма и состоянием — это правильный путь. Ваша еда должна состоять из продуктов, которые легко усваиваются, таких как супы, бульоны, коктейли и тушеные блюда. Ешьте каждый час или два часа, если ваше тело голодно и быстро сжигает калории, которые вы принимаете. Наша команда тренеров по питанию помогает бесчисленному количеству людей, страдающих усталостью надпочечников, найти правильный план питания для их состояния и восстановления.
Вам нужно пополнить запасы потерянной энергии и питательных веществ, и это должно быть сделано на макро- и микронутриентном уровне. Внедрение диеты при усталости надпочечников и ее индивидуализация в соответствии с вашим типом метаболизма и состоянием — это правильный путь. Ваша еда должна состоять из продуктов, которые легко усваиваются, таких как супы, бульоны, коктейли и тушеные блюда. Ешьте каждый час или два часа, если ваше тело голодно и быстро сжигает калории, которые вы принимаете. Наша команда тренеров по питанию помогает бесчисленному количеству людей, страдающих усталостью надпочечников, найти правильный план питания для их состояния и восстановления.
Вам следует принять некоторые меры по управлению стрессом и гигиене сна, чтобы дать своему телу отдых, необходимый для восстановления.
Шаг 2: Преодоление смещения катаболизма
Поскольку в этот момент ваш метаболический цикл все еще смещен в сторону катаболизма, вам необходимо вернуть его к равновесию. Вы можете сделать это за счет большего количества корректировок питания и использования мягких питательных веществ. Это требует очень квалифицированного медицинского работника, так как есть много соображений, которые необходимо учитывать. Надпочечниковые сбои по-прежнему представляют большой риск, и ваше состояние может пойти по любому пути.
Вы можете сделать это за счет большего количества корректировок питания и использования мягких питательных веществ. Это требует очень квалифицированного медицинского работника, так как есть много соображений, которые необходимо учитывать. Надпочечниковые сбои по-прежнему представляют большой риск, и ваше состояние может пойти по любому пути.
Некоторые питательные вещества, которые следует учитывать, включают:
- Сывороточный и гороховый белок
- Аминокислоты
- L-карнитин
- Креатин
- Витамин С
- Омега-3 жирные кислоты
- Липосомальный витамин D3
- Гидролизованный коллаген
Шаг 3: Возвращение к равновесию
После того, как вы остановили развитие катаболического состояния и обратили вспять склонность к катаболизму, вам нужно восстановить баланс метаболических процессов. Вы можете сделать это с помощью анаболических гормонов. К анаболическим гормонам относятся:
- Тестостерон
- ДГЭА
- Гормон роста
Важно, чтобы вы не использовали анаболические гормоны слишком часто или слишком рано. Это может вызвать чрезмерную стимуляцию вашего тела и усилить давление на надпочечники.
Это может вызвать чрезмерную стимуляцию вашего тела и усилить давление на надпочечники.
Другие меры предосторожности
Некоторые программы восстановления слишком много внимания уделяют увеличению потребления калорий. Это может быть непосильным для хрупкого тела. Изменения в диете и потреблении калорий должны быть плавными и постепенными.
Как уже было сказано, нужно быть осторожным с употреблением анаболических гормонов. Но это касается любых добавок и средств, будь то витамины, минералы, травы, железы, гормоны или прогормоны. Это связано с тем, что при продвинутом AFS ваш контур детоксикации не работает должным образом. У вас может быть перегруженная печень и система, чувствительная к определенным соединениям.
Если вы не принимаете добавки в правильной дозировке и в нужное время, вы можете непреднамеренно увеличить токсическую нагрузку на свой организм. Это, в свою очередь, усилит воспаление, которое является одной из основных причин катаболизма.
Поскольку обезвоживание может способствовать катаболизму, рекомендуется увеличить потребление воды. Но вы должны делать это постепенно, чтобы избежать усугубления дисбаланса электролитов. Ваш натриево-калиевый баланс особенно важен, так как на него влияет АФС. Вы можете добавлять электролиты в питьевую воду. И убедитесь, что ваша вода комнатной температуры, а не холодной.
Отдых должен иметь приоритет над физическими упражнениями. Но как только ваше тело будет готово, вам могут помочь очень легкие растяжки, такие как дыхание надпочечников и йога надпочечников. Не пытайтесь сделать больше только потому, что вы восстановили немного дополнительной энергии.
Заключение
Если у вас продвинутая форма AFS, вы, вероятно, также находитесь в состоянии катаболизма. Это может быть очень опасным состоянием, во время которого ваше тело разрушает мышцы и органы для производства энергии.
Вылечиться от этого состояния непросто. Это требует мягкого, индивидуального подхода, направленного на поощрение вашего метаболизма, чтобы найти более естественный и здоровый баланс. Наша команда тренеров по питанию помогла многим страдающим усталостью надпочечников найти этот индивидуальный режим питания.
Наша команда тренеров по питанию помогла многим страдающим усталостью надпочечников найти этот индивидуальный режим питания.
Влияние физических упражнений на анаболические и катаболические гормоны в пожилом возрасте: систематический обзор
1. Frontera WR, Hughes VA, Lutz KJ, Evans WJ. Поперечное исследование мышечной силы и массы у мужчин и женщин в возрасте от 45 до 78 лет. J Appl Physiol Bethesda Md 1985. 1991;71(2):644–650. [PubMed] [Google Scholar]
2. Флег Дж.Л., Лакатта Э.Г. Роль потери мышечной массы в возрастном снижении V O 2 макс. J Appl Physiol Bethesda Md 1985. 1988;65(3):1147–1151. [PubMed] [Google Scholar]
3. Conley KE, Cress ME, Jubrias SA, Esselman PC, Odderson IR. От свойств мышц к возможностям человека с использованием магнитного резонанса. J Gerontol A Biol Sci Med Sci. 1995; 50:35–40. [PubMed] [Google Scholar]
4. Korhonen MT, Cristea A, Alén M, Häkkinen K, Sipilä S, Mero A, et al. Старение, тип мышечных волокон и сократительная функция у спортсменов, тренирующихся на короткие дистанции. J Appl Physiol Bethesda Md 1985. 2006;101(3):906–917. [PubMed] [Академия Google]
J Appl Physiol Bethesda Md 1985. 2006;101(3):906–917. [PubMed] [Академия Google]
5. Lexell J, Taylor CC, Sjöström M. Какова причина возрастной атрофии? Общее количество, размер и соотношение различных типов волокон, изученных в целой латеральной широкой мышце бедра у мужчин в возрасте от 15 до 83 лет. J Neurol Sci. 1988;84(2–3):275–294. doi: 10.1016/0022-510X(88)
6. Кундерт АМЛ, Николаидис П.Т., Ди Ганги С., Роземанн Т., Кнехтле Б. Изменения в прыжках и метаниях у спортсменов возрастных групп, участвующих в чемпионатах Европы по легкой атлетике среди ветеранов от 19 лет.78 и 2017. Общественное здравоохранение Int J Environ Res. 2019;16(7):1200. doi: 10.3390/ijerph26071200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Galloway MT, Jokl P. Старение успешно: важность физической активности для поддержания здоровья и функционирования. J Am Acad Orthop Surg. 2000;8(1):37–44. doi: 10.5435/00124635-200001000-00004. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
8. Проктор Д.Н., Балагопал П., Наир К.С. Возрастная саркопения у людей связана со снижением скорости синтеза специфических мышечных белков. Дж Нутр. 1998;128(2 Приложение):351S–355S. doi: 10.1093/jn/128.2.351S. [PubMed] [CrossRef] [Google Scholar]
9. Lexell J, Henriksson-Larsén K, Winblad B, Sjöström M. Распределение различных типов волокон в скелетных мышцах человека: эффекты старения изучены на поперечных срезах целых мышц. Мышечный нерв. 1983;6(8):588–595. doi: 10.1002/mus.880060809. [PubMed] [CrossRef] [Google Scholar]
10. Im JY, Bang HS, Seo DY. Влияние 12-недельной комбинированной программы упражнений на физическую функцию и гормональный статус у пожилых корейских женщин. Общественное здравоохранение Int J Environ Res. 2019;16(21):4196. doi: 10.3390/ijerph26214196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Mayhew AJ, Griffith LE, Gilsing A, Beauchamp MK, Kuspinar A, Raina P. ежедневная активность инвалидов в канадском лонгитюдном исследовании старения. J Gerontol A Biol Sci Med Sci. 2020;75(1):147–154. doi: 10.1093/gerona/glz122. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Gerontol A Biol Sci Med Sci. 2020;75(1):147–154. doi: 10.1093/gerona/glz122. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. ван ден Бельд А.В., Кауфман Дж.М., Цилликенс М.С., Ламбертс С.В.Дж., Иган Дж.М., ван дер Лели А.Дж. Физиология эндокринной системы при старении. Ланцет Диабет Эндокринол. 2018;6(8):647–658. doi: 10.1016/S2213-8587(18)30026-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Велес М.П., Розендаал Н., Альварадо Б., да Камара С., Беланже Э., Пиркл К.М. Данные о связи между возрастом наступления естественной менопаузы и физическими функциями у пожилых женщин из Краткой сводки данных Международного исследования мобильности при старении (IMIAS). 2019;23:103811. doi: 10.1016/j.dib.2019.103811. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Герман М., Бергер П. Гормональные изменения у стареющих мужчин: терапевтическое показание? Опыт Геронтол. 2001;36(7):1075–1082. дои: 10.1016/S0531-5565(01)00113-9. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
15. Селлами М., Бен Абдеррахман А., Кебси В., Де Соуза М.В., Зухал Х. Оригинальное исследование: влияние спринтерских и силовых тренировок на глюкорегуляторные гормоны: влияние пожилого возраста. Экспер Биол Мед. 2017;242(1):113–123. doi: 10.1177/1535370216662711. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Sellami M, Dhahbi W, Hayes LD, Kuvacic G, Milic M, Padulo J. Влияние острых и хронических упражнений на колебания стероидных гормонов у молодых и мужчин среднего возраста. Стероиды. 2018; 132:18–24. doi: 10.1016/j.steroids.2018.01.011. [PubMed] [CrossRef] [Академия Google]
17. Хаккинен К., Пакаринен А. Мышечная сила и концентрации сывороточного тестостерона, кортизола и ГСПГ у мужчин и женщин среднего и пожилого возраста. Acta Physiol Scand. 1993;148(2):199–207. doi: 10.1111/j.1748-1716.1993.tb09549.x. [PubMed] [CrossRef] [Google Scholar]
18. Мацумото А.М., Марк Б.Т., Грюневальд Д.А., Уолден-Хансон Т. , Наай М.А. Старение и нейроэндокринная регуляция репродукции и массы тела. Опыт Геронтол. 2000;35(9–10):1251–1265. doi: 10.1016/S0531-5565(00)00158-3. [PubMed] [CrossRef] [Академия Google]
, Наай М.А. Старение и нейроэндокринная регуляция репродукции и массы тела. Опыт Геронтол. 2000;35(9–10):1251–1265. doi: 10.1016/S0531-5565(00)00158-3. [PubMed] [CrossRef] [Академия Google]
19. Янссен ЯМЖЛ. Влияние физических упражнений на эндокринное старение. Передний горм. рез. 2016;47:68–81. doi: 10.1159/000445158. [PubMed] [CrossRef] [Google Scholar]
20. Cao JJ, Kurimoto P, Boudignon B, Rosen C, Lima F, Halloran BP. Старение ухудшает активацию рецептора ИФР-1 и вызывает резистентность скелета к ИФР-1. Джей Боун Шахтер Рез. 2007;22(8):1271–1279. doi: 10.1359/jbmr.070506. [PubMed] [CrossRef] [Google Scholar]
21. Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al. Нацеливание на рецептор ИФР-1 в позднем возрасте улучшает продолжительность жизни и здоровья самок мышей. Нац коммун. 2018;9(1):2394. doi: 10.1038/s41467-018-04805-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Hickson RC, Czerwinski SM, Falduto MT, Young AP. Глюкокортикоидный антагонизм при физических нагрузках и андрогенно-анаболических стероидах. Медицинские спортивные упражнения. 1990;22(3):331–340. doi: 10.1249/00005768-19
Глюкокортикоидный антагонизм при физических нагрузках и андрогенно-анаболических стероидах. Медицинские спортивные упражнения. 1990;22(3):331–340. doi: 10.1249/00005768-19
00-00010. [PubMed] [CrossRef] [Google Scholar]
23. Kim YC. Добавки тестостерона у стареющих мужчин. Int J Impot Res. 1999;11(6):343–352. doi: 10.1038/sj.ijir.3
6. [PubMed] [CrossRef] [Академия Google]24. Lee DK, Chang C. Экспрессия и деградация рецептора андрогена: механизм и клиническое значение. J Clin Endocrinol Metab. 2003;88(9):4043–4054. doi: 10.1210/jc.2003-030261. [PubMed] [CrossRef] [Google Scholar]
25. Dunn JF, Nisula BC, Rodbard D. Транспорт стероидных гормонов: связывание 21 эндогенного стероида как с глобулином, связывающим тестостерон, так и с глобулином, связывающим кортикостероиды, в плазме человека. J Clin Endocrinol Metab. 1981;53(1):58–68. doi: 10.1210/jcem-53-1-58. [PubMed] [CrossRef] [Академия Google]
26. Goldman AL, Bhasin S, Wu FCW, Krishna M, Matsumoto AM, Jasuja R. Переоценка связывания тестостерона с кровотоком: физиологические и клинические последствия. Endocr Rev. 2017;38(4):302–324. doi: 10.1210/er.2017-00025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Переоценка связывания тестостерона с кровотоком: физиологические и клинические последствия. Endocr Rev. 2017;38(4):302–324. doi: 10.1210/er.2017-00025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Gruenewald DA, Matsumoto AM. Терапия добавками тестостерона для пожилых мужчин: потенциальные преимущества и риски. J Am Geriatr Soc. 2003;51(1):101–115. doi: 10.1034/j.1601-5215.2002.51018.x. [PubMed] [CrossRef] [Академия Google]
28. Корпус Э., Харман С.М., Блэкман М.Р. Гормон роста человека и старение человека. Endocr Rev. 1993;14(1):20–39. doi: 10.1210/edrv-14-1-20. [PubMed] [CrossRef] [Google Scholar]
29. Kim T, Chang JS, Kim H, Lee KH, Kong ID. Интенсивная ходьба влияет на IGF-1 и IGFBP3 в сыворотке крови. J Lifestyle Med. 2015;5(1):21–25. doi: 10.15280/jlm.2015.5.1.21. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Strain T, Fitzsimons C, Kelly P, Mutrie N. Забытые рекомендации: перекрестный анализ участия в укреплении мышц, балансе и координации деятельность взрослых и пожилых людей в Шотландии. Общественное здравоохранение BMC. 2016;16(1):1108. doi: 10.1186/s12889-016-3774-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Общественное здравоохранение BMC. 2016;16(1):1108. doi: 10.1186/s12889-016-3774-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Ари З., Кутлу Н., Уяник Б.С., Танели Ф., Буюкязи Г., Тавли Т. Сывороточный тестостерон, гормон роста и инсулиноподобный фактор роста. 1, время умственной реакции и максимальные аэробные нагрузки у мужчин пожилого возраста, ведущих малоподвижный образ жизни и длительно физически тренированных. Int J Neurosci. 2004;114(5):623–637. doi: 10.1080/002074504
499. [PubMed] [CrossRef] [Google Scholar]32. Нельсон М.Е., Мередит К.Н., Доусон-Хьюз Б., Эванс В.Дж. Гормональный и минеральный статус костей у тренирующихся на выносливость и малоподвижных женщин в постменопаузе. J Clin Endocrinol Metab. 1988;66(5):927–933. doi: 10.1210/jcem-66-5-927. [PubMed] [CrossRef] [Google Scholar]
33. Герберт П., Хейс Л.Д., Скалторп Н.Ф., Грейс FM. ВИИТ приводит к увеличению мышечной силы и выработке свободного тестостерона у мужчин-спортсменов-мастеров. Эндокр Коннект. 2017;6(7):430–436. doi: 10.1530/EC-17-0159. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эндокр Коннект. 2017;6(7):430–436. doi: 10.1530/EC-17-0159. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Rosety MÁ, Díaz AJ, Rosety JM, Pery MT, Brenes-Martín F, Bernardi M, et al. Упражнения улучшали качество спермы и уровень репродуктивных гормонов у взрослых, ведущих малоподвижный образ жизни и страдающих ожирением. Нутр Хосп. 2017;34(3):603. дои: 10.20960/нх.549. [PubMed] [CrossRef] [Google Scholar]
35. Mônico-Neto M, Antunes HKM, Dattilo M, Medeiros A, Souza HS, Lee KS, et al. Упражнения с отягощениями: немедикаментозная стратегия минимизации или обращения вспять мышечной атрофии, вызванной лишением сна. Мед Гипотезы. 2013;80(6):701–705. doi: 10.1016/j.mehy.2013.02.013. [PubMed] [CrossRef] [Google Scholar]
36. Ferreira CB, dos Teixeira PS, dos Santos GA, Maya ATD, do Brasil PA, Souza VC, et al. Влияние 12-недельной программы тренировок на физическую функцию ослабленных пожилых людей, находящихся в специализированных учреждениях. J Старение Res. 2018;2018:e7218102. doi: 10.1155/2018/7218102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2018;2018:e7218102. doi: 10.1155/2018/7218102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Geirsdottir OG, Arnarson A, Ramel A, Briem K, Jonsson PV, Thorsdottir I. Мышечная сила и физическая функция у пожилых людей через 6–18 месяцев после 12-недельной программы упражнений с отягощениями. Scand J Общественное здравоохранение. 2015;43(1):76–82. doi: 10.1177/1403494814560842. [PubMed] [CrossRef] [Google Scholar]
38. Borst SE, Millard WJ, Lowenthal DT. Гормон роста, физические упражнения и старение: будущее терапии для ослабленных пожилых людей. J Am Geriatr Soc. 1994;42(5):528–535. дои: 10.1111/j.1532-5415.1994.tb04976.x. [PubMed] [CrossRef] [Google Scholar]
39. Swift DL, Earnest CP, Blair SN, Church TS. Влияние различных доз аэробных упражнений на функцию эндотелия у женщин в постменопаузе с повышенным артериальным давлением: результаты исследования DREW. Бр Дж Спорт Мед. 2012;46(10):753–758. doi: 10.1136/bjsports-2011-0
. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 40. Yasar Z, Elliott BT, Kyriakidou Y, Nwokoma CT, Postlethwaite RD, Gaffney CJ, et al. Интервальная спринтерская тренировка (SIT) снижает сывороточный эпидермальный фактор роста (EGF), но не другие воспалительные цитокины у тренированных пожилых мужчин. Eur J Appl Physiol. 2021;121(7):1909–1919. doi: 10.1007/s00421-021-04635-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Yasar Z, Elliott BT, Kyriakidou Y, Nwokoma CT, Postlethwaite RD, Gaffney CJ, et al. Интервальная спринтерская тренировка (SIT) снижает сывороточный эпидермальный фактор роста (EGF), но не другие воспалительные цитокины у тренированных пожилых мужчин. Eur J Appl Physiol. 2021;121(7):1909–1919. doi: 10.1007/s00421-021-04635-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Herbert P, Hayes LD, Beaumont AJ, Grace FM, Sculthorpe NF. Шесть недель высокоинтенсивных интервальных тренировок (HIIT) способствуют четырехлетнему сохранению аэробных способностей у пожилых мужчин, ведущих малоподвижный образ жизни: повторное исследование. Опыт Геронтол. 2021;15(150):111373. doi: 10.1016/j.exger.2021.111373. [PubMed] [CrossRef] [Google Scholar]
42. Pedisic Z, Shrestha N, Kovalchik S, Stamatakis E, Liangruenrom N, Grgic J, et al. Связан ли бег с более низким риском смертности от всех причин, сердечно-сосудистых заболеваний и рака, и чем больше, тем лучше? Систематический обзор и метаанализ. Бр Дж Спорт Мед. 2020;54(15):898–905. doi: 10.1136/bjsports-2018-100493. [PubMed] [CrossRef] [Google Scholar]
Бр Дж Спорт Мед. 2020;54(15):898–905. doi: 10.1136/bjsports-2018-100493. [PubMed] [CrossRef] [Google Scholar]
43. Главные медицинские работники Англии, Шотландии, Уэльса и Северной Ирландии. Начни активно, оставайся активным. Отчет о физической активности для здоровья от главных медицинских работников четырех стран. Лондон: Корона; 2011. [Google Scholar]
44. Эллиотт Б.Т., Хейс Л.Д., Хьюз Д.К., Бертшер М. От редакции: физические упражнения как средство противодействия старению человека. Фронт Физиол. 2020;11:883. doi: 10.3389/fphys.2020.00883. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Эллиотт Б.Т., Герберт П., Скалторп Н., Грейс Ф.М., Стрэттон Д., Хейс Л.Д. Упражнения на протяжении всей жизни, но не краткосрочные высокоинтенсивные интервальные тренировки, повышают GDF11, маркер успешного старения: предварительное исследование. Physiol Rep. 2017;5(13):e13343. doi: 10.14814/phy2.13343. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Chodzko-Zajko WJ. Упражнения и физическая активность для пожилых людей. Kinesiol Rev. 2014;3(1):101–106. doi: 10.1123/kr.2014-0043. [Перекрестная ссылка] [Академия Google]
Chodzko-Zajko WJ. Упражнения и физическая активность для пожилых людей. Kinesiol Rev. 2014;3(1):101–106. doi: 10.1123/kr.2014-0043. [Перекрестная ссылка] [Академия Google]
47. Коупленд Дж.Л. Упражнения у пожилых людей: влияние возраста на эндокринологию упражнений. В: Hackney AC, Constantini NW, редакторы. Эндокринология физической активности и спорта (интернет) Cham: Springer; 2020. С. 421–440. [Google Scholar]
48. Moher D, Shamseer L, Clarke M, Ghersi D, Liberati A, Petticrew M, et al. Заявление о предпочтительных элементах отчетности для протоколов систематического обзора и метаанализа (PRISMA-P) 2015 г. Сист Ред. 2015;4(1):1. doi: 10.1186/2046-4053-4-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. McTiernan A, Wu L, Chen C, Chlebowski R, Mossavar-Rahmani Y, Modugno F, et al. Связь ИМТ и физической активности с половыми гормонами у женщин в постменопаузе. Obes Silver Spring Md. 2006; 14 (9): 1662–1677. doi: 10.1038/oby.2006.191. [PubMed] [CrossRef] [Google Scholar]
50. Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA, редакторы. Кокрановский справочник по систематическим обзорам вмешательств, версия 6.2 (обновлено в феврале 2021 г.). Cochrane, 2021. Доступно на сайте www.training.cochrane.org/handbook.
Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA, редакторы. Кокрановский справочник по систематическим обзорам вмешательств, версия 6.2 (обновлено в феврале 2021 г.). Cochrane, 2021. Доступно на сайте www.training.cochrane.org/handbook.
51. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. Заявление PRISMA для составления систематических обзоров и метаанализов исследований, оценивающих медицинские вмешательства: объяснение и уточнение. БМЖ. 2009;339:b2700. doi: 10.1136/bmj.b2700. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Maher CG, Sherrington C, Herbert RD, Moseley AM, Elkins M. Надежность шкалы PEDro для оценки качества рандомизированных контролируемых испытаний. физ. тер. 2003;83(8):713–721. дои: 10.1093/ptj/83.8.713. [PubMed] [CrossRef] [Google Scholar]
53. Коэн Дж. Анализ статистической мощности для поведенческих наук. 2. Хиллсдейл: L. Erlbaum Associates; 1988. с. 567. [Google Scholar]
54. Хопкинс В.Г., Маршалл С.В., Баттерхэм А.М., Ханин Дж. Прогрессивная статистика для исследований в области спортивной медицины и физических упражнений. Медицинские спортивные упражнения. 2009;41(1):3–13. doi: 10.1249/MSS.0b013e31818cb278. [PubMed] [CrossRef] [Google Scholar]
Хопкинс В.Г., Маршалл С.В., Баттерхэм А.М., Ханин Дж. Прогрессивная статистика для исследований в области спортивной медицины и физических упражнений. Медицинские спортивные упражнения. 2009;41(1):3–13. doi: 10.1249/MSS.0b013e31818cb278. [PubMed] [CrossRef] [Google Scholar]
55. Motiani KK, Savolainen AM, Eskelinen JJ, Toivanen J, Ishizu T, Yli-Karjanmaa M, et al. Две недели непрерывных тренировок средней интенсивности, но не высокоинтенсивных интервальных тренировок, увеличивают стимулированное инсулином усвоение глюкозы кишечником. J Appl Physiol. 2017;122(5):1188–1197. doi: 10.1152/japplphysiol.00431.2016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Kim C, Dabelea D, Kalyani RR, Christophi CA, Bray GA, Pi-Sunyer X, et al. Изменения висцерального ожирения, подкожного ожирения и половых гормонов в программе профилактики сахарного диабета. J Clin Endocrinol Metab. 2017;102(9):3381–3389. doi: 10.1210/jc.2017-00967. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Hildreth KL, Barry DW, Moreau KL, Vande Griend J, Meacham RB, Nakamura T, et al. Эффекты тестостерона и прогрессивных упражнений с отягощениями у здоровых, хорошо функционирующих пожилых мужчин с низким нормальным уровнем тестостерона. J Clin Endocrinol Metab. 2013;98 (5): 1891–1900. doi: 10.1210/jc.2012-3695. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Hildreth KL, Barry DW, Moreau KL, Vande Griend J, Meacham RB, Nakamura T, et al. Эффекты тестостерона и прогрессивных упражнений с отягощениями у здоровых, хорошо функционирующих пожилых мужчин с низким нормальным уровнем тестостерона. J Clin Endocrinol Metab. 2013;98 (5): 1891–1900. doi: 10.1210/jc.2012-3695. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Крейг Б.В., Браун Р., Эверхарт Дж. Влияние прогрессивных тренировок с отягощениями на уровни гормона роста и тестостерона у молодых и пожилых людей. Механическое старение Dev. 1989;49(2):159–169. doi: 10.1016/0047-6374(89)
-7. [PubMed] [CrossRef] [Google Scholar]59. Vaczi M, Nagy SA, Kőszegi T, Ambrus M, Bogner P, Perlaki G, et al. Механическая, гормональная и гипертрофическая адаптация к 10-недельным циклам эксцентрических упражнений и упражнений на растяжку-укорочение у пожилых мужчин. Опыт Геронтол. 2014;58:69–77. doi: 10.1016/j.exger.2014.07.013. [PubMed] [CrossRef] [Google Scholar]
60. Ahtiainen JP, Hulmi JJ, Kraemer WJ, Lehti M, Nyman K, Selänne H, et al. Тренировки с тяжелыми упражнениями с отягощениями и экспрессия рецепторов андрогенов в скелетных мышцах у молодых и пожилых мужчин. Стероиды. 2011;76(1–2):183–192. doi: 10.1016/j.steroids.2010.10.012. [PubMed] [CrossRef] [Google Scholar]
Ahtiainen JP, Hulmi JJ, Kraemer WJ, Lehti M, Nyman K, Selänne H, et al. Тренировки с тяжелыми упражнениями с отягощениями и экспрессия рецепторов андрогенов в скелетных мышцах у молодых и пожилых мужчин. Стероиды. 2011;76(1–2):183–192. doi: 10.1016/j.steroids.2010.10.012. [PubMed] [CrossRef] [Google Scholar]
61. Ahtiainen JP, Nyman K, Huhtaniemi I, Parviainen T, Helste M, Rannikko A, et al. Влияние силовых тренировок на метаболизм тестостерона у молодых и пожилых мужчин. Опыт Геронтол. 2015;69: 148–158. doi: 10.1016/j.exger.2015.06.010. [PubMed] [CrossRef] [Google Scholar]
62. Glintborg D, Christensen LL, Kvorning T, Larsen R, Brixen K, Hougaard DM, et al. Силовые тренировки и лечение тестостероном оказывают противоположное влияние на уровень фактора ингибитора миграции у стареющих мужчин. Медиаторы воспаления. 2013;2013:1–7. doi: 10.1155/2013/539156. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Hayes LD, Grace FM, Baker JS, Sculthorpe N. Индуцированные физическими упражнениями реакции в слюнном тестостероне, кортизоле и их соотношениях у мужчин: мета- анализ. Спорт Мед. 2015;45(5):713–726. дои: 10.1007/s40279-015-0306-у. [PubMed] [CrossRef] [Google Scholar]
Спорт Мед. 2015;45(5):713–726. дои: 10.1007/s40279-015-0306-у. [PubMed] [CrossRef] [Google Scholar]
64. Hayes LD, Herbert P, Sculthorpe NF, Grace FM. Упражнения повышают уровень свободного тестостерона у пожилых мужчин, ведущих малоподвижный образ жизни. Эндокр Коннект. 2017;6(5):306–310. doi: 10.1530/EC-17-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Кришнан С., Густафсон М.Б., Кэмпбелл С., Гайквад Н.В., Кейм Н.Л. Связь между циркулирующими эндогенными андрогенами и изменениями чувствительности к инсулину с физическими упражнениями у женщин среднего возраста. Менопауза. 2014;21(9): 967–974. doi: 10.1097/GME.0000000000000198. [PubMed] [CrossRef] [Google Scholar]
66. Nunes PRP, Barcelos LC, Oliveira AA, Furlanetto R, Martins FM, Resende EAMR, et al. Адаптация мышечной силы и гормональные реакции после двух различных протоколов тренировок с отягощениями у женщин в постменопаузе. J Прочность Конд Рез. 2019;33(5):1276–1285. doi: 10.1519/JSC. 0000000000001788. [PubMed] [CrossRef] [Google Scholar]
0000000000001788. [PubMed] [CrossRef] [Google Scholar]
67. Сато К., Иемицу М., Мацутани К., Курихара Т., Хамаока Т., Фудзита С. Тренировки с отягощениями восстанавливают стероидогенез мышечных половых стероидных гормонов у пожилых мужчин. FASEB J. 2014; 28 (4): 1891–1897. doi: 10.1096/fj.13-245480. [PubMed] [CrossRef] [Google Scholar]
68. Уокер С., Сантоламазза Ф., Кремер В., Хаккинен К. Влияние длительных тренировок с гипертрофическим сопротивлением на острые эндокринные реакции у молодых и пожилых мужчин. J Закон о физике старения. 2015;23(2):230–236. doi: 10.1123/japa.2013-0029. [PubMed] [CrossRef] [Google Scholar]
69. Friedenreich CM, Wang Q, Shaw E, Heer EV, Zhou R, Brenner DR, et al. Влияние предписанного объема упражнений на биомаркеры хронического стресса у женщин в постменопаузе: результаты исследования рака молочной железы и упражнений в Альберте (BETA) Prev Med Rep. 2019;15:100960. doi: 10.1016/j.pmedr.2019.100960. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Banitalebi E, Faramarzi M, Bagheri L, Kazemi AR. Сравнение 12-недельных тренировок с отягощениями до, после и/или между аэробными упражнениями на гормональный статус пожилых женщин: рандомизированное контролируемое исследование. Horm Mol Biol Clin Investig (Интернет). 2018;35(3). http://www.degruyter.com/view/j/hmbci.2018.35.issue-3/hmbci-2018-0020/hmbci-2018-0020.xml. По состоянию на 17 августа 2020 г. [PubMed]
Banitalebi E, Faramarzi M, Bagheri L, Kazemi AR. Сравнение 12-недельных тренировок с отягощениями до, после и/или между аэробными упражнениями на гормональный статус пожилых женщин: рандомизированное контролируемое исследование. Horm Mol Biol Clin Investig (Интернет). 2018;35(3). http://www.degruyter.com/view/j/hmbci.2018.35.issue-3/hmbci-2018-0020/hmbci-2018-0020.xml. По состоянию на 17 августа 2020 г. [PubMed]
71. DiPietro L, Yeckel CW, Dziura J. Постепенное улучшение толерантности к глюкозе после низкоинтенсивных упражнений с отягощениями по сравнению со среднеинтенсивными аэробными тренировками у пожилых женщин. J Phys Act Health. 2008;5(6):854–869. doi: 10.1123/jpah.5.6.854. [PubMed] [CrossRef] [Google Scholar]
72. Ha M-S, Son WM. Комбинированные упражнения — это метод улучшения инсулинорезистентности и гормональных биомаркеров, связанных со старением, у пожилых корейских женщин. Опыт Геронтол. 2018; 114:13–18. doi: 10.1016/j.exger.2018.10.012. [PubMed] [CrossRef] [Академия Google]
73. Мицельска К., Гмят А., Жиховска М., Козловска М., Валентукевич А., Лысак-Радомская А. и соавт. Положительный эффект от 15 единиц высокоинтенсивной круговой тренировки у женщин зависит от возраста, исходной резистентности к инсулину и физических возможностей. Diabetes Res Clin Pract. 2019; 152: 156–165. doi: 10.1016/j.diabres.2019.05.009. [PubMed] [CrossRef] [Google Scholar]
Мицельска К., Гмят А., Жиховска М., Козловска М., Валентукевич А., Лысак-Радомская А. и соавт. Положительный эффект от 15 единиц высокоинтенсивной круговой тренировки у женщин зависит от возраста, исходной резистентности к инсулину и физических возможностей. Diabetes Res Clin Pract. 2019; 152: 156–165. doi: 10.1016/j.diabres.2019.05.009. [PubMed] [CrossRef] [Google Scholar]
74. Ogawa K, Sanada K, Machida S, Okutsu M, Suzuki K. Гипертрофия мышц, вызванная силовыми упражнениями, была связана со снижением воспалительных маркеров у пожилых женщин. Медиаторы воспаления. 2010;2010:1–7. дои: 10.1155/2010/171023. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Ramos JS, Dalleck LC, Borrani F, Mallard AR, Clark B, Keating SE, et al. Влияние различных объемов высокоинтенсивных интервальных тренировок на проинсулин у участников с метаболическим синдромом: рандомизированное исследование. Диабетология. 2016;59(11):2308–2320. doi: 10.1007/s00125-016-4064-7. [PubMed] [CrossRef] [Google Scholar]
76. Consitt LA, Saxena G, Saneda A, Houmard JA. Возрастные нарушения фосфорилирования ПДГ и лактата плазмы в скелетных мышцах указывают на метаболическую негибкость и влияние физических упражнений. Am J Physiol Endocrinol Metab. 2016; 311(1):E145–E156. doi: 10.1152/ajpendo.00452.2015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Consitt LA, Saxena G, Saneda A, Houmard JA. Возрастные нарушения фосфорилирования ПДГ и лактата плазмы в скелетных мышцах указывают на метаболическую негибкость и влияние физических упражнений. Am J Physiol Endocrinol Metab. 2016; 311(1):E145–E156. doi: 10.1152/ajpendo.00452.2015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Søgaard D, Baranowski M, Larsen S, Taulo Lund M, Munk Scheuer C, Vestergaard Abildskov C, et al. Насыщенные мышцами биоактивные липиды увеличиваются с возрастом и под влиянием высокоинтенсивных интервальных тренировок. Int J Mol Sci. 2019;20(5):1240. doi: 10.3390/ijms20051240. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Praksch D, Sandor B, Kovacs D, Petrovics P, Kovacs K, Toth K, et al. Влияние программы физической подготовки на дому и в центре на кардиометаболическое здоровье и уровень ИФР-1 у пожилых женщин. Eur Rev Aging Phys Act. 2019;16(1):13. doi: 10.1186/s11556-019-0220-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Yamada M, Nishiguchi S, Fukutani N, Aoyama T, Arai H. Вмешательство по почте для предотвращения саркопении, увеличение анаболического гормона и массы скелетных мышц в сообществе японские пожилые люди: исследование INE (вмешательство с помощью питания и физических упражнений). J Am Med Dir Assoc. 2015;16(8):654–660. doi: 10.1016/j.jamda.2015.02.017. [PubMed] [CrossRef] [Google Scholar]
Yamada M, Nishiguchi S, Fukutani N, Aoyama T, Arai H. Вмешательство по почте для предотвращения саркопении, увеличение анаболического гормона и массы скелетных мышц в сообществе японские пожилые люди: исследование INE (вмешательство с помощью питания и физических упражнений). J Am Med Dir Assoc. 2015;16(8):654–660. doi: 10.1016/j.jamda.2015.02.017. [PubMed] [CrossRef] [Google Scholar]
80. Bermon S, Ferrari P, Bernard P, Altare S, Dolisi C. Ответы общего и свободного инсулиноподобного фактора роста-I и белка, связывающего инсулиноподобный фактор роста- 3 после упражнений с отягощениями и тренировок у пожилых людей. Acta Physiol Scand. 1999;165(1):51–56. doi: 10.1046/j.1365-201x.1999.00471.x. [PubMed] [CrossRef] [Google Scholar]
81. Im JY, Bang HS, Seo DY. Влияние 12-недельной комбинированной программы упражнений на физическую функцию и гормональный статус у пожилых корейских женщин. Общественное здравоохранение Int J Environ Res. 2019;16(21):E4196. doi: 10.3390/ijerph26214196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Bonnefoy M, Kostka T, Patricot MC, Berthouze SE, Mathian B, Lacour JR. Влияние острых и хронических упражнений на инсулиноподобный фактор роста-I у здоровых активных пожилых мужчин и женщин. Старение Clin Exp Res. 1999;11(6):373–379. doi: 10.1007/BF03339815. [PubMed] [CrossRef] [Google Scholar]
83. Boxer RS, Kleppinger A, Brindisi J, Feinn R, Burleson JA, Kenny AM. Влияние дегидроэпиандростерона (ДГЭА) на сердечно-сосудистые факторы риска у пожилых женщин с признаками слабости. Возраст Старение. 2010;39(4):451–458. doi: 10.1093/aging/afq043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Вингрен Дж.Л., Кремер В.Дж., Ратамесс Н.А., Андерсон Дж.М., Волек Дж.С., Мареш С.М. Физиология тестостерона в упражнениях с отягощениями и тренировках: регулирующие элементы выше по течению. Спорт Мед Окл, Новая Зеландия. 2010;40(12):1037–1053. дои: 10.2165/11536910-000000000-00000. [PubMed] [CrossRef] [Google Scholar]
85. Hayes LD, Elliott BT. Краткосрочные физические упражнения непостоянно влияют на базальный уровень тестостерона у пожилых мужчин: систематический обзор и метаанализ. Фронт Физиол. 2019; 9:1878. doi: 10.3389/fphys.2018.01878. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Hayes LD, Elliott BT. Краткосрочные физические упражнения непостоянно влияют на базальный уровень тестостерона у пожилых мужчин: систематический обзор и метаанализ. Фронт Физиол. 2019; 9:1878. doi: 10.3389/fphys.2018.01878. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Khaled EB, Sami TA. Низкий тестостерон и диабет. Curr Diabetes Rev. 2013;9(5):418–421. doi: 10.2174/157339981130999
87. Ага ББ. Тестостерон и риск сердечно-сосудистых заболеваний. Curr Opin Endocrinol Diabetes Obes. 2015;22(3):193–202. doi: 10.1097/MED.0000000000000161. [PubMed] [CrossRef] [Google Scholar]
88. Lv W, Du N, Liu Y, Fan X, Wang Y, Jia X и др. Низкий уровень тестостерона и риск болезни Альцгеймера у пожилых мужчин: систематический обзор и метаанализ. Мол Нейробиол. 2016;53(4):2679–2684. doi: 10.1007/s12035-015-9315-y. [PubMed] [CrossRef] [Google Scholar]
89. Carcaillon L, Brailly-Tabard S, Ancelin ML, Tzourio C, Foubert-Samier A, Dartigues J-F, et al. Низкий уровень тестостерона и риск слабоумия у пожилых мужчин: влияние возраста и образования. Альцгеймерс Демент J Alzheimers Assoc. 2014;10(5 Приложение):S306–314. [PubMed] [Академия Google]
Низкий уровень тестостерона и риск слабоумия у пожилых мужчин: влияние возраста и образования. Альцгеймерс Демент J Alzheimers Assoc. 2014;10(5 Приложение):S306–314. [PubMed] [Академия Google]
90. Hayes LD, Sculthorpe N, Herbert P, Baker JS, Spagna R, Grace FM. Шесть недель кондиционирующих упражнений увеличивают общий, но не свободный тестостерон у пожилых мужчин, ведущих малоподвижный образ жизни. Стареющий мужчина. 2015;18(3):195–200. doi: 10.3109/13685538.2015.1046123. [PubMed] [CrossRef] [Google Scholar]
91. Tissandier O, Péres G, Fiet J, Piette F. Тестостерон, дегидроэпиандростерон, инсулиноподобный фактор роста 1 и инсулин у малоподвижных и физически тренированных пожилых мужчин. Eur J Appl Physiol. 2001;85(1–2):177–184. doi: 10.1007/s004210100420. [PubMed] [CrossRef] [Академия Google]
92. Hayes LD, Sculthorpe N, Young JD, Baker JS, Grace FM. Критическая разница, примененная к тестостерону и кортизолу слюны, вызванным физической нагрузкой, с использованием твердофазного иммуноферментного анализа (ELISA): отличие биологических изменений от статистических. J Physiol Biochem. 2014;70(4):991–996. doi: 10.1007/s13105-014-0368-6. [PubMed] [CrossRef] [Google Scholar]
J Physiol Biochem. 2014;70(4):991–996. doi: 10.1007/s13105-014-0368-6. [PubMed] [CrossRef] [Google Scholar]
93. Hayes LD, Sculthorpe N, Herbert P, Baker JS, Hullin DA, Kilduff LP, et al. Измерение тестостерона в слюне не выявляет биохимический гипогонадизм у стареющих мужчин: ROC-анализ. Эндокринный. 2015;50(1):256–259. doi: 10.1007/s12020-014-0516-3. [PubMed] [CrossRef] [Google Scholar]
94. de Guia RM, Agerholm M, Nielsen TS, Consitt LA, Søgaard D, Helge JW, et al. Аэробные упражнения и упражнения с отягощениями обращают вспять возрастное снижение способности спасения NAD+ в скелетных мышцах человека. Physiol Rep. 2019;7(12):e14139. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Hayes LD, Herbert P, Sculthorpe N, Grace F. Высокоинтенсивные интервальные тренировки (HIIT) приводят к небольшому улучшению уровня глюкозы натощак, инсулина и резистентности к инсулину у пожилых людей, ведущих малоподвижный образ жизни. мужчин, но не мастеров спорта. Опыт Геронтол.

