Остеоартроз – болезнь с воспалительными и катаболическими процессами в суставах :: ТРУДНЫЙ ПАЦИЕНТ
Н.А.Хитров
ФГБУ «ЦКБ с поликлиникой» Управления делами Президента РФ, Москва
Представлены данные о патогенезе и клинике остеоартроза (ОА), в основе которых лежат как воспалительные процессы, так и механизм дегенерации тканей суставов. Представлена характеристика синовита при ОА, полученная с помощью ультразвукового исследования. Описана противовоспалительная терапия ОА коленного сустава в фазе обострения нимесулидом – нестероидным противовоспалительным препаратом с селективной ингибицией ЦОГ-2. Получены хорошие клинические результаты в виде уменьшения боли и припухлости сустава, увеличения объема движений в нем с хорошей переносимостью препарата.
Ключевые слова: артроз, артрит, остеоартроз, остеоартрит, синовит, нимесулид.
Osteoarthrosis as a disease with inflammatory and catabolic processes in joints
N.A.Hitrov
Central hospital and policlinic of the Executive Office of President of the Russian Federation, Moscow
Data regarding pathogenesis and clinical features of osteoarthrosis as an inflammatory and degenerative tissue of joints disease are presented. Ultrasound characteristic of synovitis in osteoarthrosis are described. Results of selective COX-2 inhibitor nimesulide use during exacerbation of osteoarthrosis of knee joint are described. After treatment pain and swelling of the joint decreased, volume of movement increased and medication was well tolerated.
Ultrasound characteristic of synovitis in osteoarthrosis are described. Results of selective COX-2 inhibitor nimesulide use during exacerbation of osteoarthrosis of knee joint are described. After treatment pain and swelling of the joint decreased, volume of movement increased and medication was well tolerated.
Key words: arthrosis, arthritis, osteoarthrosis, osteoarthritis, synovitis, nimesulide.
Сведения об авторе:
Хитров Николая Аркадьевич – д.м.н., доцент, заведующий ревматологическим кабинетом поликлиники ЦКБ УД Президента РФ
Остеоартроз (ОА) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы околосуставных мышц [1].
ОА является самой распространенной формой суставной патологии, им болеет 10–20% населения. Заболевание коррелирует с возрастом, чаще развивается после 35–40 лет, а у людей старше 70 лет рентгенологические признаки ОА встречаются до 90% случаев.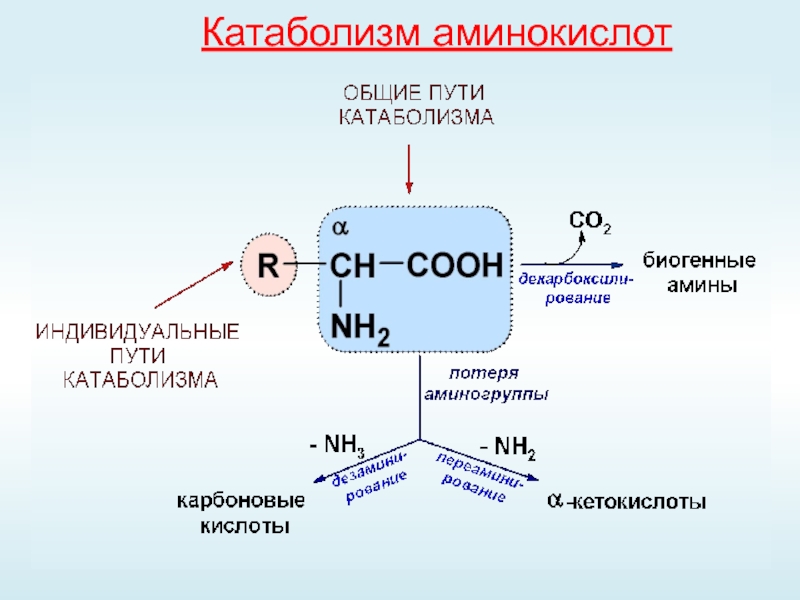
До конца не установлен эпицентр поражения при ОА – хрящ или субхондральная кость. Суставной гиалиновый хрящ не имеет нервных окончаний и кровеносных сосудов и остается открытым вопрос – откуда он получает питание: из внутрисуставной синовиальной жидкости или субхондральной кости, которой в последнее время уделяется все большее внимание. При ОА дегенеративные процессы в хряще и в субхондральной кости протекают параллельно. Но причины данных катаболических процессов при этом до конца не известны.
Воспалительные процессы и, прежде всего, синовит постоянно сопровождают течение ОА, играют значительную роль как в формировании клиники болезни, так и в деструкции суставных структур [2]. Огромное значение воспалительного компонента при ОА привело к тому, что в англоязычной литературе остеоартроз называется остеоартритом, да и в нашей стране, особенно на врачебных конференциях данная болезнь называется то остеоартроз, то остеоартрит.
На протяжении всей истории медицины в названия болезней закладывалась топическая принадлежность, особенности патогенеза заболевания (воспалительный, сосудисто-трофический характер и т. п.), например: пиелонефрит, инфаркт миокарда, цирроз печени и т.п. «Правильность» названия болезни помогает врачу разработать верный путь лечения больного с данной нозологией: посоветовать нужный режим, рекомендации по питанию; выбрать тактику медикаментозной терапии: противовоспалительной, метаболической и т.д. Само название болезни часто «узаконивает» для врача (и для пациента тоже) верность или неверность выбранной тактики лечения, улучшает комплаенс – сотрудничество в лечении между врачом и пациентом.
п.), например: пиелонефрит, инфаркт миокарда, цирроз печени и т.п. «Правильность» названия болезни помогает врачу разработать верный путь лечения больного с данной нозологией: посоветовать нужный режим, рекомендации по питанию; выбрать тактику медикаментозной терапии: противовоспалительной, метаболической и т.д. Само название болезни часто «узаконивает» для врача (и для пациента тоже) верность или неверность выбранной тактики лечения, улучшает комплаенс – сотрудничество в лечении между врачом и пациентом.
По мере развития научных знаний о сущности патогенетических процессов в организме рождаются новые, не известные ранее, нозологические формы, например: остеонекроз головки бедра, анкилозирующий спондилит, реактивные артриты и т.д. Данный процесс никогда не будет завершен, и по мере развития медицинских представлений о сути болезни, будут пересматриваться их названия.
Остеоатроз длительное время считался «золушкой в ревматологии». Этому заболеванию не уделялось должного внимания как в частных этиопатогенетических механизмах развития болезни, так и в общемедицинских воззрениях на данную болезнь. Недопонимание многих существенных моментов ОА сказывается в частности на том, что в настоящее время перед ревматологами России стоит выбор названия одной и той же болезни: остеоартроз или остеоартрит?
Недопонимание многих существенных моментов ОА сказывается в частности на том, что в настоящее время перед ревматологами России стоит выбор названия одной и той же болезни: остеоартроз или остеоартрит?
Еще в 1911 г. T. Muller предложил выделить группу заболеваний суставов дегенеративно-дистрофической природы как «arthrosis deformans», где ОА отводилось ведущее место. ОА традиционно определялся как «хроническое прогрессирующее невоспалительное заболевание суставов неизвестной этиологии, характеризующееся дегенерацией суставного хряща и структурными изменениями субхондральной кости, а также явно или скрыто протекающим умеренно выраженным синовитом» [2]. В последние годы произошел поворот в воззрениях на ОА. Ранее заболевание расценивалось как стигма старения организма в целом и сопутствующей этому процессу дегенерации суставных структур, в частности. В настоящее время ОА воспринимается как агрессивный катаболизм суставного хряща под воздействием воспаления, требующий противовоспалительной активной терапии [3–5].
Вторичные воспалительные процессы и, прежде всего, синовит сопровождают течение ОА, играют значительную роль как в формировании клиники болезни, так и в дальнейшей деструкции суставных структур [1, 6].
Все больше и больше уделяется внимание суставу не как совокупности костных суставных поверхностей, хрящевых структур, синовиальной жидкости, суставной капсулы и параартикулярного аппарата, а как единому органу с присущими ему едиными воспалительными, иммунными, нейротрофическими метаболическими и функциональными составляющими.
В последних определениях ОА все больше и больше внимания уделяется синовиту при ОА. Синовит усиливает деструкцию суставных структур. Активизирующиеся при синовите различные медиаторы воспаления: интерлейкины, фактор некроза опухоли, колониестимулирующие факторы, субстанция Р, простагландины, активаторы плазминогена и плазмина, металлопротеиназы, катепсины, супероксидные радикалы и другие пагубно, деструктивно влияют на различные суставные структуры и, прежде всего, на гиалиновый хрящ, усиливая в них разрушительные процессы [7, 8]. Главная трагедия синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
Главная трагедия синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
Обострение ОА характеризуется вторичным синовитом сустава, когда усиливается боль, припухлость суставов, ухудшается подвижность в нем. Воспалительная, утолщенная синовиальная оболочка, выстилающая полость суставной капсулы при синовите, хорошо видна при ультразвуковом исследовании суставов (рис. 1). Длинной стрелкой указаны утолщения синовиальной оболочки в верхнем завороте коленного сустава, хорошо визуализируемые на фоне гиперпродукции анэхогенной гомогенной синовиальной жидкости – короткая стрелка.
Синовит при ОА занимает значимое место не только в патогенезе болезни, но и в клинической картине заболевания, резко усугубляя ее, и заставляя больного обращаться за врачебной помощью. Клиника ОА во многом определяется болевым синдромом, который многогранен при ОА.
Боль при ОА носит неоднородный характер. В целом для ОА характерен механический ритм болей – возникновение боли под влиянием физической нагрузки и стихание ее за период отдыха, что связано со снижением амортизационных способностей хряща и подхрящевых костных структур к нагрузкам.
Возможны ночные боли, связанные с венозным стазом и повышением кровяного внутрикостного давления в спонгиозной части кости. Нередко боли в пораженных суставах усиливаются под влиянием неблагоприятных метеорологических условий – высокого атмосферного давления, низкой температуры, повышения влажности, которые могут воздействовать на интраартикулярные рецепторы.
Кратковременная «стартовая боль» возникает при первых движениях после покоя и вскоре проходит на фоне двигательной активности. Стартовые боли обусловлены трением суставных поверхностей, на которых оседает детрит – продукт разрушения хрящевой ткани. После нескольких движений в суставе детрит выталкивается в завороты суставной сумки и боли прекращаются.
Возможна так называемая «блокада сустава» – быстро развивающийся резко выраженный болевой синдром вследствие ущемления «суставной мыши» – костного или хрящевого фрагмента между суставными поверхностями. При этом боль лишает больного возможности выполнять малейшие движения в данном суставе. Блокаде коленного сустава способствует часто развивающаяся при ОА дегенеративная менископатия.
Боли при движении, «стартовая» боль и «блокада сустава» объясняются нарушениями кинематики сустава, поэтому в покое данная болезненность, как правило, уменьшается. ОА – первично хроническое заболевание. Человек, у которого возник остеоартроз, обречен страдать им навсегда и сталкиваться с суставной болью на протяжении всей своей оставшейся жизни. В данных случаях боль носит охранительный характер и определяет лечебный щадящий двигательный режим для больного, является индикатором адекватности физической нагрузки на суставы.
Иной механизм боли формируется при синовите. При синовите появляется постоянная боль, связанная с длительной сенситизацией ноцицепторов в процессе воспаления. Данную боль, которой сопутствуют утренняя скованность, припухлость сустава, локальное повышение кожной температуры, можно трактовать как хроническую, которая в сочетании с вегетативными, психологическими и эмоциональными факторами теряет приспособительное биологическое значение и снижает качество жизни.
Данную боль, которой сопутствуют утренняя скованность, припухлость сустава, локальное повышение кожной температуры, можно трактовать как хроническую, которая в сочетании с вегетативными, психологическими и эмоциональными факторами теряет приспособительное биологическое значение и снижает качество жизни.
Синовит при ОА характеризуется повышенным образованием провоспалительных цитокинов, простагландинов, фактора некроза опухоли, лизосомальных ферментов, металлопротеаз и других ферментов, которые не только поддерживают воспаление в суставе, но и усиливают катаболические процессы в хрящевой и субхондральной ткани сустава. При этом пункция сустава с эвакуацией воспаленной синовиальной жидкости и последующим введением глюкокортикоидов при ОА дает положительный, но непродолжительный эффект.
Синовит побуждает врача (и больного) к проведению противовоспалительного лечения, которое на сегодняшний момент сохраняется краеугольным камнем в курации данной болезни, несмотря на активное внедрение хондропротективной терапии. Противовоспалительная терапия не только снимает тягостный для пациента симптом суставной боли, но и устраняет другие симптомы воспаления при ОА: припухлость, гипертермию сустава, улучшает его функцию. Более важный смысл противовоспалительной терапии при ОА заключается в ингибиции провоспалительных цитокинов и, за счет этого, уменьшения катаболических процессов суставных структур [9].
Противовоспалительная терапия не только снимает тягостный для пациента симптом суставной боли, но и устраняет другие симптомы воспаления при ОА: припухлость, гипертермию сустава, улучшает его функцию. Более важный смысл противовоспалительной терапии при ОА заключается в ингибиции провоспалительных цитокинов и, за счет этого, уменьшения катаболических процессов суставных структур [9].
Это обуславливает лечение синовита и хронического болевого синдрома препаратами, подавляющими воспаление, к которым, прежде всего, относятся нестероидные противовоспалительные препараты (НПВП). Больные очень часто негативно относятся к данным препаратам, воспринимая их как «обезболивающие» препараты, принимаемые от случая к случаю при усилении болей в суставе. Врачу необходимо объяснять, что курсовое противовоспалительное лечение является патогенетическим – влияющим на механизмы болезни, в своем роде хондропротективным, «защищающим» хрящ от деструктивного влияния воспаления.
При подходе к лечению ОА необходимо основываться на нескольких положениях:
1. Боль при ОА, являющаяся ведущим симптомом и причиняющая мучительные страдания, требует скорейшего лечения. Эффективное купирование болевого синдрома является первоочередной задачей фармакотерапии ОА. Быстрота достижения и стойкость анальгетического эффекта относятся к основным критериям оценки адекватности лечения, по крайней мере, с точки зрения больного.
Боль при ОА, являющаяся ведущим симптомом и причиняющая мучительные страдания, требует скорейшего лечения. Эффективное купирование болевого синдрома является первоочередной задачей фармакотерапии ОА. Быстрота достижения и стойкость анальгетического эффекта относятся к основным критериям оценки адекватности лечения, по крайней мере, с точки зрения больного.
2. Простые анальгетики, наиболее часто используемые при ОА, тем не менее, мало приемлемы, т.к. не действуют на патогенетические звенья синовита, что нивелирует их эффект. Кроме того, простые и опиоидные анальгетики вызывают феномен «анальгетической личности», при которой больной, не чувствуя боли, чрезмерно расширяет свою двигательную активность, которая не улучшает, а усугубляет как вторичное воспаление, так и клинику болезни.
3. Назначение миорелаксантов при ОА, патогенетически обусловленное, чревато применением у пожилых больных, так как может ухудшить координацию движений.
4. Лечение боли, во многом, должно сводиться к лечению синовита, который при ОА усугубляет клинику, обостряя все симптомы, и снижает качество жизни больного. Главная трагедия синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
Главная трагедия синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
5. Лечение необходимо проводить в короткие сроки, чтобы активный синовит, утяжеляющий боль, был бы быстро купирован и не оказал патологического деструктивного воздействия на суставные ткани. При ОА острый болевой синдром обычно сопровождается выраженной воспалительной реакцией.
6. Важнейшим классом лекарств, используемых для патогенетической терапии болевого синдрома, (особенно в тех ситуациях, когда развитие боли тесно связано с процессами тканевого воспаления и, особенно, синовита), являются НПВП. Их отличает хорошо доказанная эффективность, предсказуемость фармакологического действия, доступность и удобство применения.
7. Длительное или постоянное применение НПВП нецелесообразно ввиду повышения риска развития осложнений, а также отрицательного влияния ряда препаратов этой группы на метаболизм хряща. Поэтому данные препараты рекомендуются больному курсом на период обострения ОА.
Поэтому данные препараты рекомендуются больному курсом на период обострения ОА.
8. Множество соматический заболеваний сопутствуют ОА, что часто встречается у пожилых людей. Терапия не должна иметь побочных действий, чтобы не усугубить клинику сопутствующих болезней. Хорошо известно, что основное фармакологическое действие НПВП связано с блокадой циклооксигеназы (ЦОГ)-2, фермента, активно синтезирующегося в очагах повреждения и воспаления клетками воспалительного ответа и отвечающего за синтез важнейших медиаторов боли и воспаления – простагландинов. Осложнения, возникающие при приеме НПВП (прежде всего со стороны ЖКТ), традиционно связываются с подавлением «физиологической» формы ЦОГ-1, играющей важную роль в поддержании многих параметров гомеостаза человеческого организма, в том числе, защитного потенциала слизистых оболочек ЖКТ [10, 11].
Тем не менее «физиологическая» ЦОГ-1 также принимает участие в процессе развития воспаления и поэтому подавление ее активности в области повреждения (а не во всем организме!) может рассматриваться как положительный момент. Именно такое свойство имеет нимесулид, обладающий умеренной селективностью в отношении ЦОГ-2, практически не влияющий на «физиологическую» ЦОГ-1 в слизистой оболочке желудка, но эффективно подавляющий ее в очагах воспаления [12].
Именно такое свойство имеет нимесулид, обладающий умеренной селективностью в отношении ЦОГ-2, практически не влияющий на «физиологическую» ЦОГ-1 в слизистой оболочке желудка, но эффективно подавляющий ее в очагах воспаления [12].
9. Для борьбы с болевым и противовоспалительным синдромом в виде синовита при ОА полезно использовать комбинацию различных способов введения лекарственного препарата: системный – пероральный и локальный – аппликационный желательно одного препарата, так как пути воздействия на патомеханизмы болезни при этом несколько разнятся, а совокупность побочных действий препарата не увеличивается.
Для лечения болевого и воспалительного синдрома при ОА коленного сустава при обострении в виде синовита хорошо зарекомендовал себя Найз (нимесулид Д-р Редди`с Лабораторис Лтд, Индия) – нестероидный противовоспалительный препарат, обладающий анальгетическим, противовоспалительным и жаропонижающим действием.
Фармакологически Найз преимущественно ингибирует циклооксигеназу-2, подавляет синтез воспалительных простагландинов в очаге воспаления, тем самым подавляет синовит при ОА. Найз, ингибируя синтез металлопротеиназ, нивелирует их катаболическое действие на суставной гиалиновый хрящ, тем самым осуществляет хондропротекцию, что особенно важно при ОА. После приема внутрь хорошо всасывается из ЖКТ. Максимальная концентрация достигается через 1,5–2,5 ч, период полувыведения – 2–3 ч. Биотрансформируется в печени. Основным метаболитом является фармакологически активный гидроксинимесулид. Выводится преимущественно почками. При длительном применении не кумулируется в организме.
Найз, ингибируя синтез металлопротеиназ, нивелирует их катаболическое действие на суставной гиалиновый хрящ, тем самым осуществляет хондропротекцию, что особенно важно при ОА. После приема внутрь хорошо всасывается из ЖКТ. Максимальная концентрация достигается через 1,5–2,5 ч, период полувыведения – 2–3 ч. Биотрансформируется в печени. Основным метаболитом является фармакологически активный гидроксинимесулид. Выводится преимущественно почками. При длительном применении не кумулируется в организме.
Найз используется в лечении больных ОА в двух формах: таблетированной и геля. Пероральный Найз для взрослых назначают в два приема в сутки по 100 мг. Рекомендуется осуществлять прием таблеток до еды, но при наличии диспепсии можно принимать препарат после еды. Найз гель наносят на кожу. Перед этим желательно область кожи тщательно вымыть и высушить. Столбик Найз геля, длина которого составляет 3 см, наносят на максимально болезненный участок и растирают до тонкого равномерного слоя. Эту процедуру нужно проводить 3–4 раза в сутки. И таблетированный Найз, и Найз гель давно используются в нашей стране с большим успехом.
И таблетированный Найз, и Найз гель давно используются в нашей стране с большим успехом.
Материал и методы
Для лечения Найзом были отобраны 30 пациентов с ОА коленного сустава в фазе обострения, проявлявшегося усилением болей, тугоподвижностью, припухлостью сустава. В группу вошли 7 мужчин, 23 женщины, среднего возраста 61,3±9,2 года, давностью заболевания 7,3±2,8 лет, преимущественно
II и III-й рентгенологической стадии по Kellgren.
Больным назначался Найз по 100 мг 2 раза в день перорально и одновременно Найз гель местно
4 раза в день, 14 дней. На фоне лечения другая терапия не проводилась, кроме стандартных рекомендаций по режиму. Внутрисуставные и параартикулярные инъекции стероидов не проводились пациентам за 1 мес до начала терапии Найзом.
Результаты и обсуждение
Результаты показали, что на фоне проведенного лечения у значительного большинства пациентов уменьшилась боль в суставе, что выражалось улучшением самочувствия, повышением настроения, уменьшением раздражительности и нормализацией сна, прежде всего, за счет уменьшения ночных болей. До начала лечения боль по оценке больных по ВАШ равнялась 68,5±8,7 мм, в конце лечения боль составила 31,7±6,8 мм. Средняя окружность больного коленного сустава, изначально составлявшая 43,7±3,4 см, в конце лечения уменьшилась до 42,3±3,6 см. Объем сгибания в коленном суставе в среднем изначально равнялся 96,4±8,9°, а через 14 дней – 129,1±9,6°. Уменьшение болей и увеличение амплитуды движений в суставе привели к положительной динамике индекса WOMAC, который до начала лечения составил 668,6±139,7 мм, а в конце лечения снизился до 412,4±115,3 мм. По окончании лечения Найзом значительное улучшение отметили 18 больных, улучше-ние – 10, отсутствие динамики – 2 больных. Отрицательной динамики при лечении не отмечено.
До начала лечения боль по оценке больных по ВАШ равнялась 68,5±8,7 мм, в конце лечения боль составила 31,7±6,8 мм. Средняя окружность больного коленного сустава, изначально составлявшая 43,7±3,4 см, в конце лечения уменьшилась до 42,3±3,6 см. Объем сгибания в коленном суставе в среднем изначально равнялся 96,4±8,9°, а через 14 дней – 129,1±9,6°. Уменьшение болей и увеличение амплитуды движений в суставе привели к положительной динамике индекса WOMAC, который до начала лечения составил 668,6±139,7 мм, а в конце лечения снизился до 412,4±115,3 мм. По окончании лечения Найзом значительное улучшение отметили 18 больных, улучше-ние – 10, отсутствие динамики – 2 больных. Отрицательной динамики при лечении не отмечено.
Ультразвуковое исследование (УЗИ) коленного сустава до и после лечения проводилось 14 пациентам. До лечения у 12 из них в супрапателлярном завороте отмечалось наличие жидкости, утолщение синовиальной оболочки, представленные на рис. 1. После лечения Найзом, по данным УЗИ 14 пациентов, жидкость сохранялась только у 5 больных, у 9 больных она отсутствовала, что представлено на рис. 2. Уменьшение жидкости в суставе вместе со снижением параартикулярных воспалительных процессов отразились на уменьшении окружности коленного сустава в процессе терапии.
2. Уменьшение жидкости в суставе вместе со снижением параартикулярных воспалительных процессов отразились на уменьшении окружности коленного сустава в процессе терапии.
Таким образом, при назначении больным, страдающим гонартрозом, 2-недельного курса Найза отмечено его симптом-модифицирующее действие, проявившееся в уменьшении болевого синдрома, уменьшении припухлости, увеличении объема движений в суставе, уменьшении индекса WOMAC. Результаты проведенного исследования позволяют констатировать хорошую переносимость Найза и его клиническую эффективность у больных ОА.
В целом, как видно из работы, синовит определяет патоморфогенез, клинику, качество жизни при ОА и требует активного лечения НПВП. С другой стороны, синовит при ОА не вызывает лихорадочного синдрома, симптомов хронического воспаления (слабости, психастении, анорексии, похудания, значимых изменений в анализах крови), что не позволяет ему достигнуть роли синовита, как, например, при ревматоидном артрите. Варианты синовита при различных суставных заболеваниях требуют дальнейшего пристального изучения, и только будущее покажет, какое название в отечественной ревматологии сохранится: остеоартроз или остеоартрит.
Данные о воспалительных процессах в артрозном суставе, ведущих к катастрофическим процессам в нем, эффективность противовоспалительной терапии артроза вроде бы склоняет нас пересмотреть название ОА в пользу остеоартрита. Это позволит врачам «узаконить» и уточнить место противовоспалительной терапии при данном процессе. С другой стороны, название болезни остеоартрит с воспалительным окончанием «-ит» побудит практических врачей сблизить данное заболевание с такими воспалительными суставными нозологиями, как ревматоидный артрит, реактивный артрит и т. п., отличающимися более агрессивной противовоспалительной терапией, во многом единственной, но не хондропротективной. Будет ли это правильно или в головах практических врачей возникнет «кризис»?
Литература
1. Ревматология: национальное руководство / Под ред. Е.Л. Насонова, В.А. Насоновой. М.: ГЭОТАР-Медиа, 2008; 573–588.
2. Ревматические болезни: Рук. для врачей / Под ред. В.А. Насоновой, Н.В. Бунчука. М.: Медицина, 1997; 385–396.
3. Raisz L.G. Prostaglandins and bone: physiology and pathophysiology. Osteoarthritis Cartilage, 1999; 79: 83–94.
4. Laufer S., Gay S., Brune K. Inflammation and Rheumatic Diseases: The molecular basis of novel therapies. Georg Thieme Verlag, 2003; 139.
5. Grushko G., Schneiderman R., Maroudas A. Some biochemical and biophysical parameters for the study of the pathogenesis of osteoarthritis: a comparison between the processes of aging and degeneration in human hip cartilage. Connec Tissue Res. 1989; 19: 149–176.
6. Hedbom E., Huselmann H.J. Molecular aspects of pathogenesis in osteoarthritis: the role of inflammation. Cell Mol Life Sci. 2002; 59: 45–53.
7. Pickvance E.A., Oegema T.R. Jr., Thompson R.C. Immunolocalization of selected cytokines and proteases in canine articular cartilage after transarticular loading. J. Orthop. Res. 1993; 113: 313–323.
8. Agarwal S., Long P., Seyedain A. et al. A central role for the nuclear factor-kB pathway in anti-inflammatory and proinflammatory actions of mechanical strain. FASEB J. 2003; 17: 899–901.
FASEB J. 2003; 17: 899–901.
9. Насонов Е.Л., Каратеев А.Е. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Русский медицинский журнал. 2006; 14: 25: 1769–1777.
10. Feldman M., McMahon A.T. Do cyclooxigenase–2 inhibitors provide benefits similar to those of traditional nonsteroidal anti–inflammatory drugs, with less gastrointestinal toxicity? Ann. Intern. Med. 2000; 132: 134–143.
11. Цветкова Е.С., Панасюк Е.Ю., Иониченок Н.Г., Рубцов О.В. Перспективы применения ингибиторов циклооксигеназы-2 при остеоартрозе. Consilium medicum. 2004; 6: 2: 100.
12. Каратеев А.Е., Барскова В.Г. Критерии выбора нестероидного противовоспалительного препарата. Справочник практического врача. 2007; 5: 5: 13–17.
Душа и тело: ночной дожор
Человек — существо социальное. Громадное количество наших задумок, желаний или инициатив разбиваются не о сложность и исполнение, а о людей, которые нас окружают. Меняя привычки, мы вынуждено меняем и жизнь вокруг нас, иногда это связанно и с привычками ближних.
В целом, мне в этой части вполне везет. Семейство у меня привыкло к тому, что я могу замутить что-то новое. Они меня любят и почти всегда поддерживают. Конечно, по началу, их смешило, когда я ковылял с крепатурой на ногах, но на самом деле меня это и самого забавляло.
Со знакомыми, конечно, сложнее. Сейчас, когда я рассказываю про свои истории с бегом и тренировками, приходит очень много людей, которые подробно рассказывают мне как это вредно, что это все пустая мода. У меня очень большая аудитория в соцсетях и понятно, что там люди очень разные. И чем сильнее они отличаются, тем чаще им хочется высказываться. Практически целое общественное мнение получается.
Возражения публики в целом можно разделить на две группы. Первая — это даже не особо возражения, скорее апелляции к имиджу. «Блин, теперь и Готовцев начал бегать, куда катится мир?». Хочется ответить — не катится, а бежит… Вторая группа — рекомендации по здоровью. «Береги колени», «это вредно», «с твоим весом надо ходить, а не бегать». Правда, это пишут в основном те, кто меня давно не видел.
Правда, это пишут в основном те, кто меня давно не видел.
Знаете, вот на этом примере очень четко видно, как стоит разделять происходящее вокруг себя. Есть свои и чужие. Не то чтобы чужих никогда не надо слушать, но надо всегда помнить, что не только они для тебя чужие, но и ты для них. И что они там тебе насоветуют, даже из самых лучших побуждений — бог его знает. Хотите тоже совет от чужого человека, то есть меня? Слушайте чужие советы, но не пускайте их себе в душу. В том числе, и этот совет!
С душой разобрались, займемся желудком 🙂
Бывает у меня момент, когда вечером очень хочется есть. Организм страдает и требует своего. А диетологи говорят, что в этом состоянии находиться очень вредно — катаболические процессы нарастают и мотивация падает.
Но есть фокус — надо съесть что-то приличное по объему, но при этом не сильно калорийное. Можно, конечно, съесть большой пакет отрубей и запить водой, но такие простые и безыскусные методы — не наш выбор. Если у нас есть техника, будем ей пользоваться.
Если у нас есть техника, будем ей пользоваться.
В воке один из самый вкусных ингредиентов — жаренный огурец. И мы знаем, что огурец, с точки зрения калорий, то, что нам нужно. Но и совсем без калорий проку не будет. Значит надо добавить что-то осмысленное и, в идеале, белковое.
Отлично, сделаем теплый салат
1. Приготовим заранее 1 яйцо, поставим на огонь небольшую кастрюлю с водой и нарежем огурец крупной соломкой. Выложим его в ковш мультипечи аккуратным колодцем, сбрызнем каким-нибудь полезным маслом, например, кунжутным и посыпем кунжутными же семенами.
2. Дальше ставим печь на 200 градусов на 15 минут. Пусть жарится.
3. Тем временем приготовим яйцо пашот. Воду в кастрюле доводим до самого легкого кипения, подсаливаем и добавляем в нее уксус, лучше яблочный или винный. У меня — яблочный.
4. Яйцо аккуратно выбиваем в плошечку.
5. Воду раскручиваем в кастрюле до образования водоворота и в его середину с минимальной высоты выпускаем яйцо. С первого раза может не получиться, но вообще это не так сложно, как кажется. В итоге у нас должен получиться жидкий желток, плавающий в аккуратном мешочке из белка.
С первого раза может не получиться, но вообще это не так сложно, как кажется. В итоге у нас должен получиться жидкий желток, плавающий в аккуратном мешочке из белка.
6. Выкладываем на тарелку зажаренный огурец, кладем на него пашот, надрезаем его и даем желтку стечь на огурцы, после его немедленно солим и сразу же едим. Приятного аппетита!
Цикл трикарбоновых кислот | Биохимия, метаболизм, ферменты
цикл трикарбоновых кислот
См. все среды
Категория: Наука и техника
- Ключевые люди:
- Сэр Ганс Адольф Кребс
- Похожие темы:
- клеточное дыхание восстановительный цикл трикарбоновых кислот
Просмотреть весь связанный контент →
цикл трикарбоновой кислоты , (цикл ТСА), также называемый цикл Кребса и цикл лимонной кислоты , вторая стадия клеточного дыхания, трехстадийный процесс, посредством которого живые клетки расщепляют молекулы органического топлива в присутствие кислорода для сбора энергии, необходимой им для роста и деления. Этот метаболический процесс происходит у большинства растений, животных, грибов и многих бактерий. У всех организмов, кроме бактерий, цикл ЦТК осуществляется в матриксе внутриклеточных структур, называемых митохондриями.
Этот метаболический процесс происходит у большинства растений, животных, грибов и многих бактерий. У всех организмов, кроме бактерий, цикл ЦТК осуществляется в матриксе внутриклеточных структур, называемых митохондриями.
Цикл ТСА играет центральную роль в расщеплении или катаболизме молекул органического топлива, то есть глюкозы и некоторых других сахаров, жирных кислот и некоторых аминокислот. Прежде чем эти довольно большие молекулы смогут войти в цикл трикарбоновых кислот, они должны быть расщеплены до двухуглеродного соединения, называемого ацетил-коферментом А (ацетил-КоА). После подачи в цикл трикарбоновых кислот ацетил-КоА превращается в углекислый газ и энергию.
More From Britannica
метаболизм: полное окисление
Цикл ТСА состоит из восьми стадий, катализируемых восемью различными ферментами (см. рисунок). Цикл инициируется (1), когда ацетил-КоА реагирует с соединением оксалоацетатом с образованием цитрата и высвобождением кофермента А (КоА-SH).
Энергия производится в несколько этапов этого цикла реакций. На этапе 5 вырабатывается одна молекула аденозинтрифосфата (АТФ), молекула, которая обеспечивает работу большинства клеточных функций. Однако большая часть энергии, полученной в цикле ТСА, захватывается соединениями никотинамидадениндинуклеотида (NAD + ) и флавинадениндинуклеотида (FAD) и позже преобразуется в АТФ.
Британский биохимик немецкого происхождения сэр Ганс Адольф Кребс предложил этот цикл, который он назвал циклом лимонной кислоты, в 1937. За свою работу он получил Нобелевскую премию по физиологии и медицине 1953 года.
Сэр Ганс Адольф Кребс | Биография, карьера в области биохимии и цикла лимонной кислоты
Сэр Ханс Адольф Кребс
Все СМИ
Категория: Наука и техника
- Дата рождения:
- 25 августа 1900 г. Хильдесхайм Германия
- Умер:
- 22 ноября 1981 г. (81 год) Оксфорд Англия
- Награды и награды:
- Медаль Копли (1961) Нобелевская премия (1953 г.)
- Предметы изучения:
- цикл трикарбоновых кислот цикл мочевины
Просмотреть весь связанный контент →
Сэр Ханс Адольф Кребс , (родился 25 августа 1900 г., Хильдесхайм, Германия — умер 22 ноября 1981 г., Оксфорд, Англия), британский биохимик немецкого происхождения, получивший (вместе с Фрицем Липманн) Нобелевскую премию по физиологии и медицине 1953 года за открытие в живых организмах ряда химических реакций, известных как цикл трикарбоновых кислот (также называемый циклом лимонной кислоты или циклом Кребса). Эти реакции включают превращение в присутствии кислорода веществ, образующихся при расщеплении сахаров, жиров и белковых компонентов, в углекислый газ, воду и соединения, богатые энергией.
Эти реакции включают превращение в присутствии кислорода веществ, образующихся при расщеплении сахаров, жиров и белковых компонентов, в углекислый газ, воду и соединения, богатые энергией.
Во Фрайбургском университете (1932 г.) Кребс открыл (вместе с немецким биохимиком Куртом Хенселейтом) ряд химических реакций (теперь известных как цикл мочевины), посредством которых аммиак превращается в мочевину в тканях млекопитающих; мочевина, гораздо менее токсичная, чем аммиак, впоследствии выделяется с мочой у большинства млекопитающих. Этот цикл также служит основным источником аминокислоты аргинина.
Сын еврейского врача, Кребс был вынужден в 1933 году уехать из нацистской Германии в Англию, где продолжил свои исследования в Кембриджском университете (1933–35). В Шеффилдском университете, Йоркшир (1935–1954), Кребс измерил количество определенных четырехуглеродных и шестиуглеродных кислот, образующихся в печени и грудных мышцах голубя, когда сахара полностью окисляются с образованием углекислого газа, воды и энергии.

