4.2.1.3. Углеводы \ КонсультантПлюс
4.2.1.3. Углеводы
Углеводы представляют собой многоатомные альдегидо- и кетоспирты, которые подразделяют на простые (моно- и дисахариды) и сложные (олиго- и полисахариды). Усвояемые углеводы (простые углеводы и крахмал) являются важнейшими источниками энергии.
Физиологическая потребность в усвояемых углеводах для взрослого человека составляет 56 — 58% от энергетической суточной потребности: от 301 до 551 г/сутки для мужчин и от 238 до 435 г/сутки для женщин.
Физиологическая потребность в углеводах — для детей до 1 года 13 г/кг массы тела в сутки, для детей старше 1 года (с увеличением возраста) — от 188 до 421 г/сутки.
Моносахариды и дисахариды. К моносахаридам относятся глюкоза, фруктоза и галактоза, к дисахаридам — сахароза, лактоза и мальтоза.
Сахароза (тростниковый или свекловичный сахар) — наиболее известный и широко применяемый в питании и пищевой промышленности углевод, который вносят (добавляют) в пищевую продукцию при производстве, приготовлении и/или непосредственном употреблении (добавленные сахара). Наряду с сахарозой в пищевую продукцию добавляют другие сахара (моно- и дисахариды), в том числе из меда, сиропов, фруктовых и овощных соков и их концентратов.
Наряду с сахарозой в пищевую продукцию добавляют другие сахара (моно- и дисахариды), в том числе из меда, сиропов, фруктовых и овощных соков и их концентратов.
Потребление добавленных сахаров для детей и взрослых не должно превышать 10% от калорийности суточного рациона. Для лиц с избыточной массой тела (ИМТ 25 — 29) и ожирением (ИМТ более 30) рекомендовано снижение потребления добавленных сахаров до уровня 5% от калорийности суточного рациона [17, 34]. Эти рекомендации не относятся к потреблению природных (собственных) сахаров, естественным образом содержащихся в непереработанных фруктах, овощах и молоке.
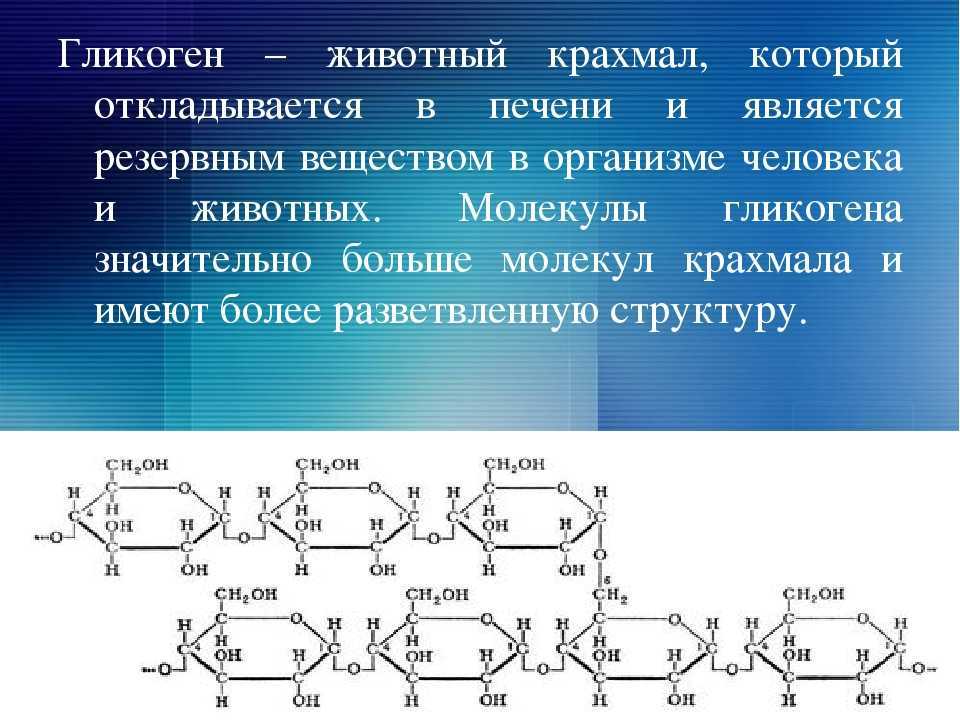
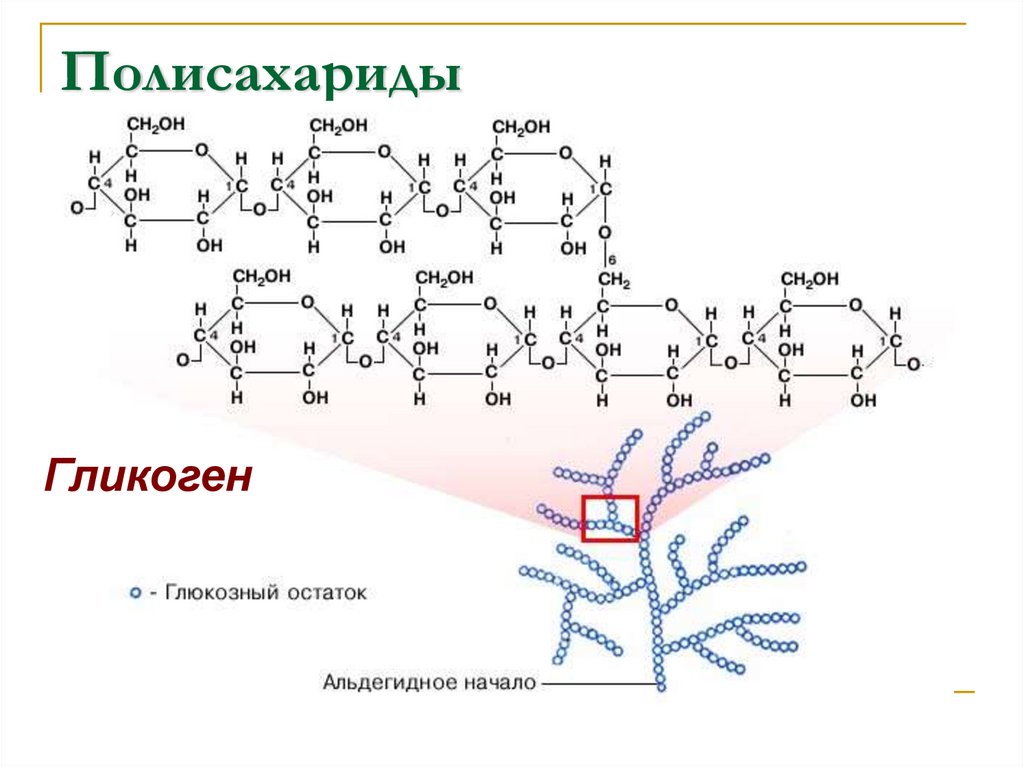
Полисахариды — сложные углеводы, представляющие собой высокомолекулярные соединения, состоящие из большого числа мономеров глюкозы и других моносахаридов, подразделяются на крахмальные (усвояемые) полисахариды (крахмал и гликоген) и некрахмальные (неусвояемые) полисахариды — пищевые волокна (клетчатка/целлюлоза, гемицеллюлоза, пектины и другие).
Крахмал является основным полисахаридом, обеспечивающим физиологическую потребность организма в усвояемых углеводах.
Пищевые волокна — съедобные части растений или аналогичные углеводы, устойчивые к перевариванию и адсорбции в тонком кишечнике человека, полностью или частично ферментируемые в толстом кишечнике (полисахариды, олигосахариды, лигнин и ассоциированные растительные вещества). Пищевые волокна относятся к некрахмальным полисахаридам, которые перевариваются в толстом кишечнике в незначительной степени, однако при этом оказывают существенное влияние на процессы переваривания, усвоения, микробиоциноз и эвакуацию остатков пищи. Эффекты физиологического воздействия пищевых волокон зависят от их растворимости в воде. Растворимые пищевые волокна (пектин, альгинаты, полидекстроза и др.) способны оказывать опосредованное влияние на метаболизм холестерина и липидов (липопротеины низкой плотности и триглицериды), на гликемическую нагрузку пищи, уровень глюкозы и инсулина, проявлять пребиотическое действие, связывать и выводить тяжелые металлы. Нерастворимые волокна (целлюлоза, гемицеллюлоза, лигнин) выполняют функции энтеросорбента, участвуют в механизме предупреждения кариеса.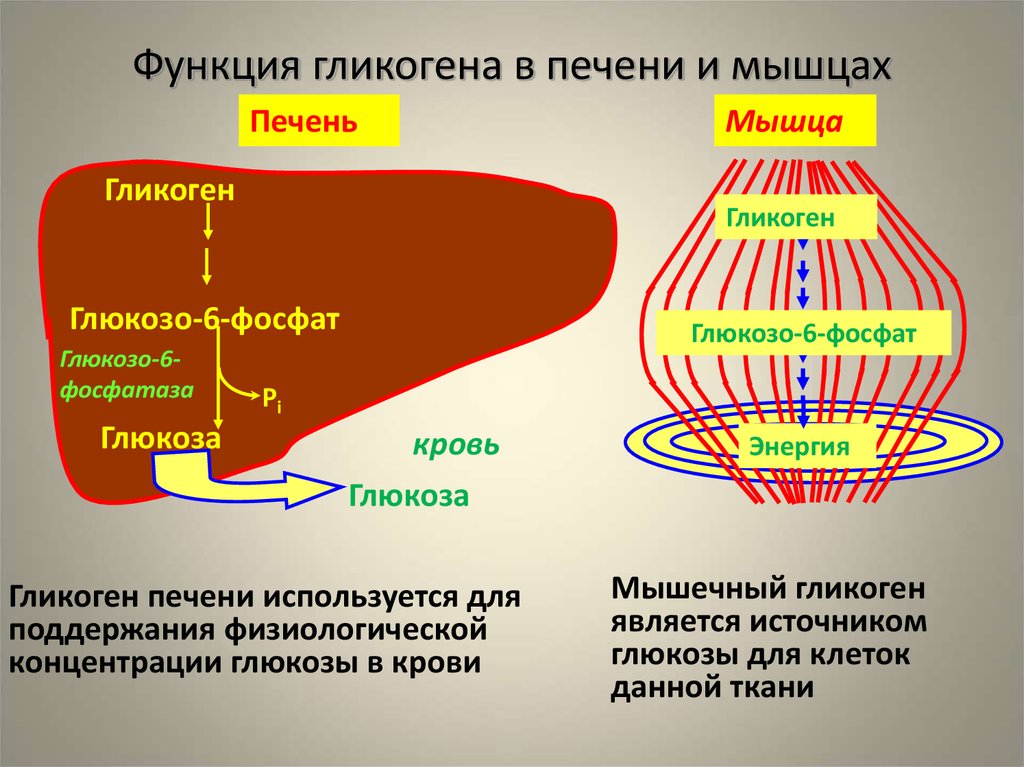
Физиологическая потребность в пищевых волокнах для взрослого человека составляет 20 — 25 г/сутки или 10 г/1000 ккал, для детей старше 1 года — 10 — 22 г/сутки.
Гликемический индекс пищевой продукции. В целях регулирования потребления углеводов и, в частности, сахаров, необходимо учитывать гликемический индекс — относительный показатель влияния углеводов, содержащихся в пищевом продукте, на уровень глюкозы в крови. Гликемический индекс позволяет провести сравнение гликемического эффекта различных пищевых продуктов, содержащих равное количество углеводов и классифицировать их в зависимости от выраженности постпрандиального гликемического эффекта.
Чем выше гликемический индекс пищевого продукта, тем быстрее в крови повышается уровень глюкозы. Продукт с высоким гликемическим индексом может вызывать резкое повышение уровня сахара, представляющее собой риск для здоровья у людей с сахарным диабетом.
Продукты с низким гликемическим индексом (менее 55) медленнее перевариваются, всасываются и метаболизируются, что приводит к более медленному росту уровня глюкозы и инсулина в крови.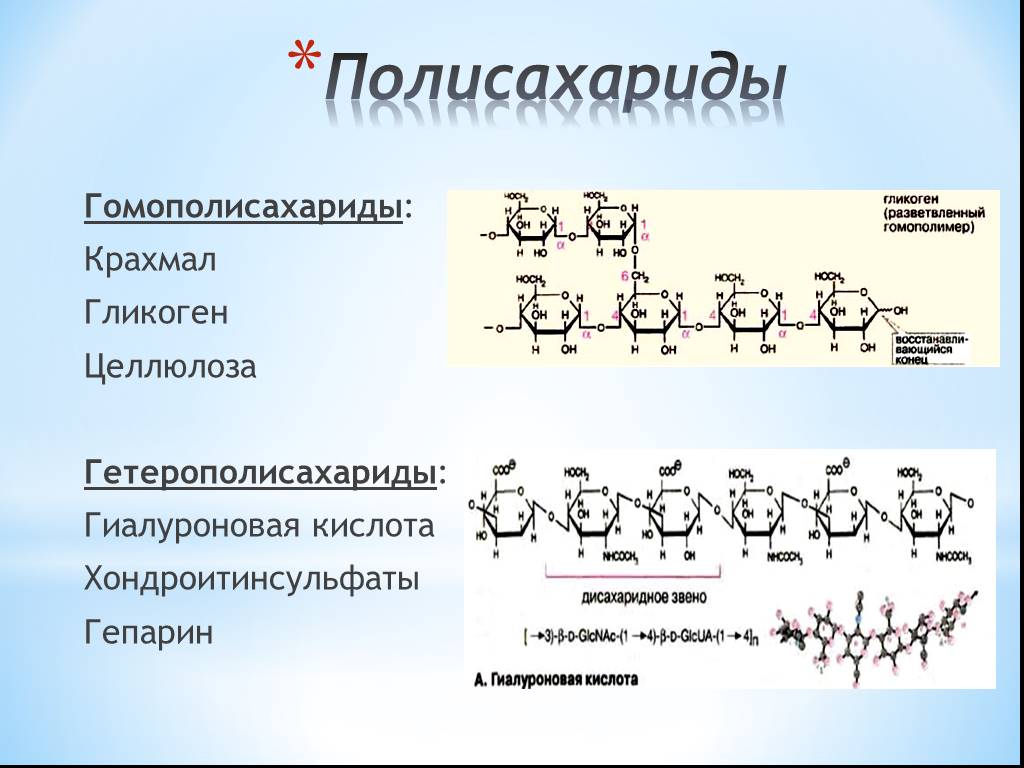 Рационы с низким гликемическим индексом позволяют контролировать уровень глюкозы в крови и снижают риск развития сахарного диабета 2 типа и ишемической болезни сердца.
Рационы с низким гликемическим индексом позволяют контролировать уровень глюкозы в крови и снижают риск развития сахарного диабета 2 типа и ишемической болезни сердца.
Справочные таблицы гликемических индексов пищевой продукции позволяют рассчитать гликемическую нагрузку, оптимизировать рацион и исключить нарушения структуры питания.
Полисахарид — описание ингредиента, инструкция по применению, показания и противопоказания
16 Апреля 2020
7 Августа 2020
3 минуты
18334
ProWellness
Оглавление
- Описание полисахарида
- Функции полисахаридов
- Фармакологические свойства
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами.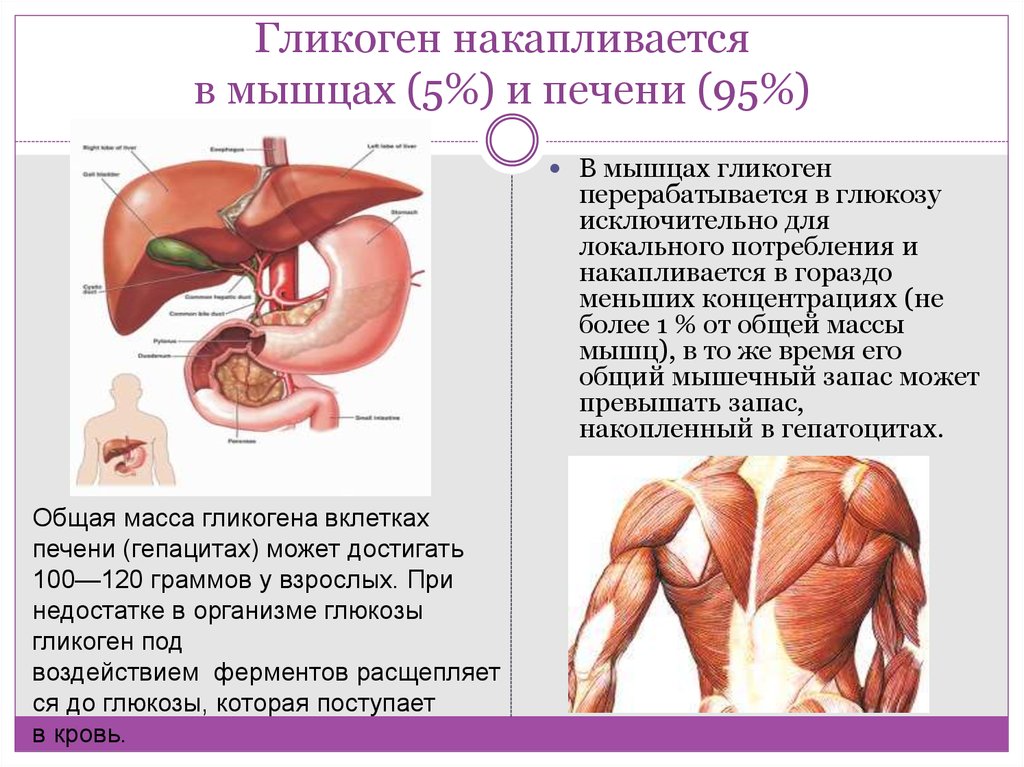 Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Описание полисахарида
Полисахариды – это сложные биоорганические вещества, принадлежащие к классу углеводов. Другое их название – гликаны.
Полисахарид представляет собой полимерную молекулу, состоящую из моносахаридных остатков, объединенных гликозидной связью. То есть это сложная молекула, цепочка которой построена из объединенных друг с другом остатков более простых углеводов. Структуру вещества может составлять разное количество мономеров: от десятков до сотен. Она бывает разветвленной и линейной.
Она бывает разветвленной и линейной.
Полисахариды плохо растворяются в воде либо совсем не растворяются. Они бывают бесцветными и соломенными, не имеют вкуса и запаха.
Функции полисахаридов
К полисахаридам относятся разнообразные вещества, выполняющие в организме человека различные функции:
- Энергетическая функция – гликоген, крахмал. Отвечают за накопление углеводов и снабжение организма глюкозой.
- Запасающая функция – крахмал, гликоген. Создают запас энергии в жировых тканях.
- Кофакторная – гепарин. Понижает свертываемость крови и выступает в качестве кофактора ферментативных соединений.
- Опорная – хондроитинсульфат, целлюлоза. Целлюлоза содержится в растительных стеблевых тканях, а хондроитинсульфат – в животных костных.
- Защитная – кислые гетерополисахариды. Входят в состав стенок клеток живых организмов. Входят в состав секрета, выделяемого железами, покрывающего стенки желудка, пищевода и других органов и защищающего их от механических повреждений и атак болезнетворных микроорганизмов.
- Гидроосмотическая – кислые гетерополисахариды. Отвечают за удерживание воды и ионов с положительным зарядом в клетках, не дают накопиться жидкости в пространстве между клетками.
- Структурная – кислые гетерополисахариды. Сконцентрированы в межклеточном веществе, проявляют цементирующие свойства.
Внимание! Полисахариды тяжело усваиваются в организме человека ввиду сложной структуры. Однако они крайне важны и должны присутствовать в рационе каждого человека.
Сложные углеводы улучшают пищеварение. Растворимые полимеры связываются с желчными кислотами и растворяют их, улучшая усвоение, что способствует понижению уровня холестерина в крови. Кроме того, они тормозят всасывание простых сахаров, нормализуют концентрацию липидов в крови и очищают кишечник.
Фармакологические свойства
Эко-сертифицированные полисахариды активно применяются в медицине. Они проявляют противоопухолевую, антитоксическую, противовирусную, антисклеротическую активность.
Большой интерес для медицины представляет антисклеротическое действие гликанов. Они образуют с кровяными белками комплексы, препятствующие прилипанию холестерина к сосудистым стенкам, что снижает риск атеросклероза.
Антитоксическая функция связана со способностью полимеров выводить из организма тяжелые металлы, радионуклиды, токсины, продукты метаболизма.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста.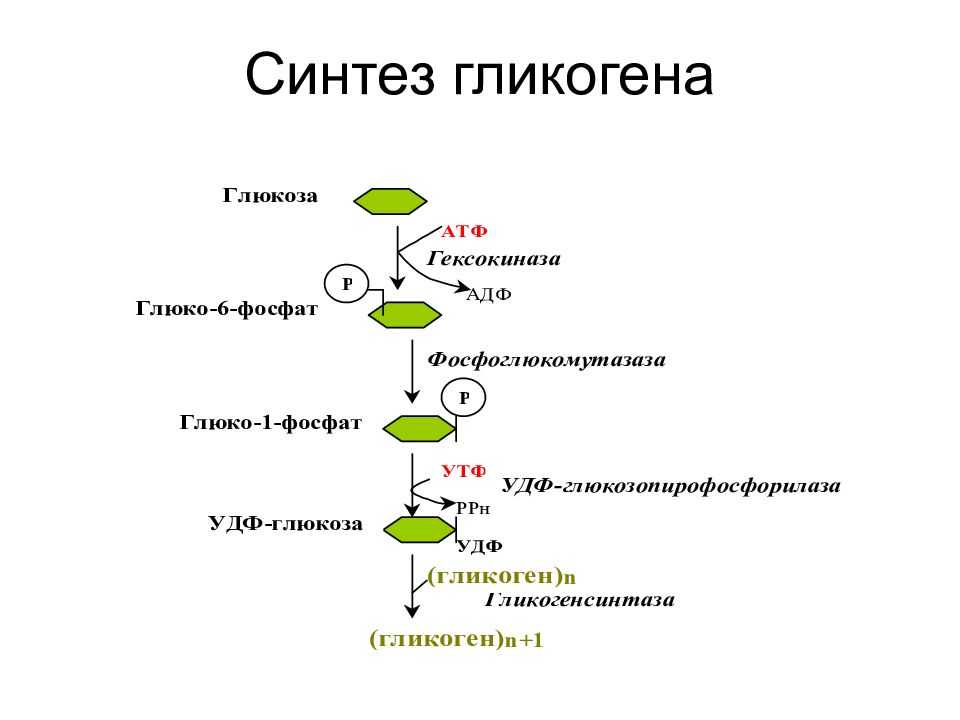
Биохимия, гликоген — StatPearls — Книжная полка NCBI
Салах А. Даглас; Шамим С. Мохиуддин.
Информация об авторе и организациях
Последнее обновление: 8 мая 2022 г.
Введение
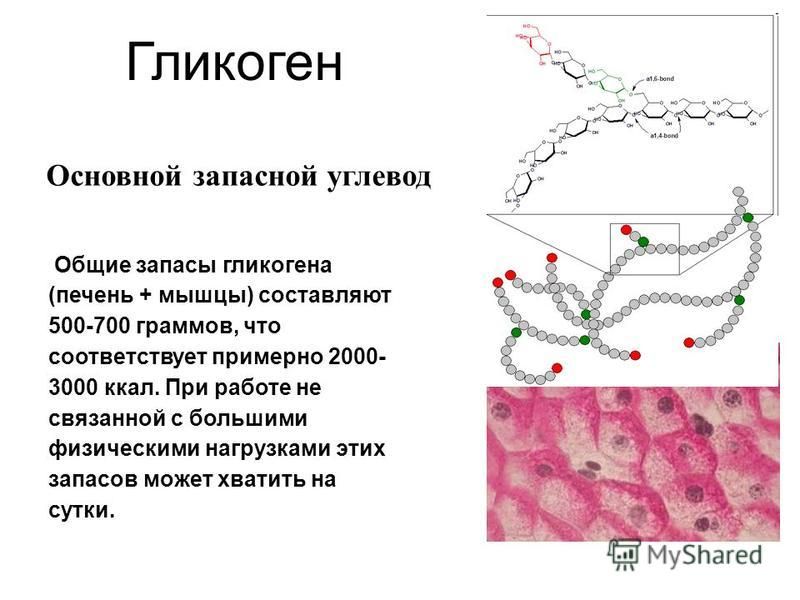
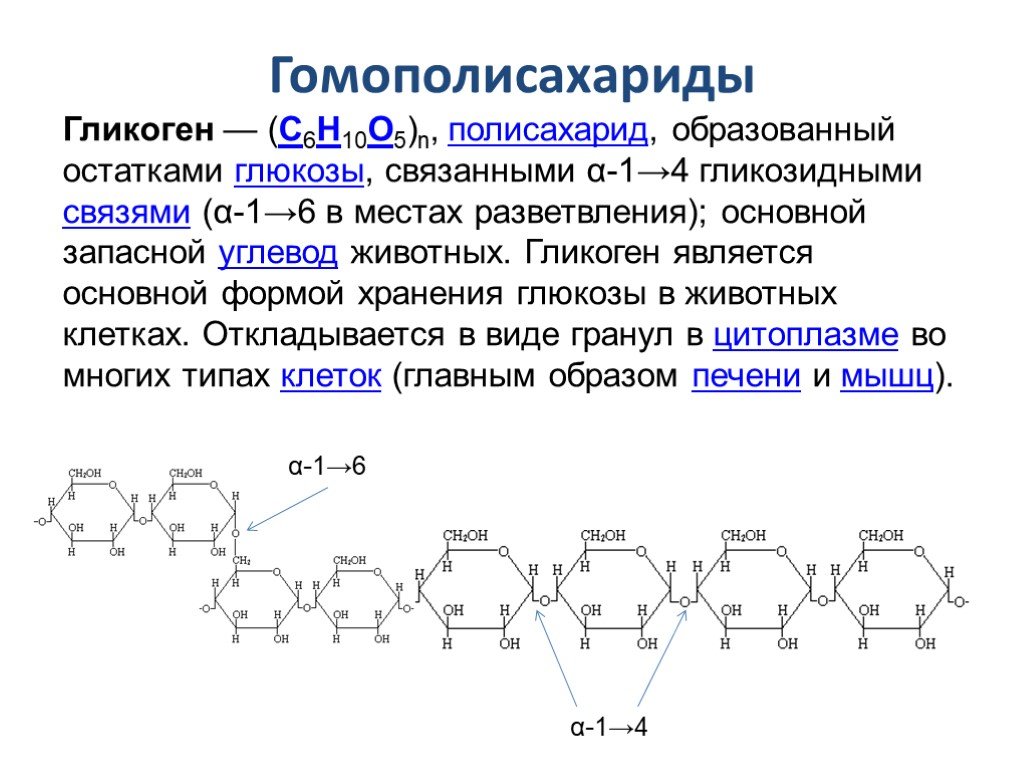
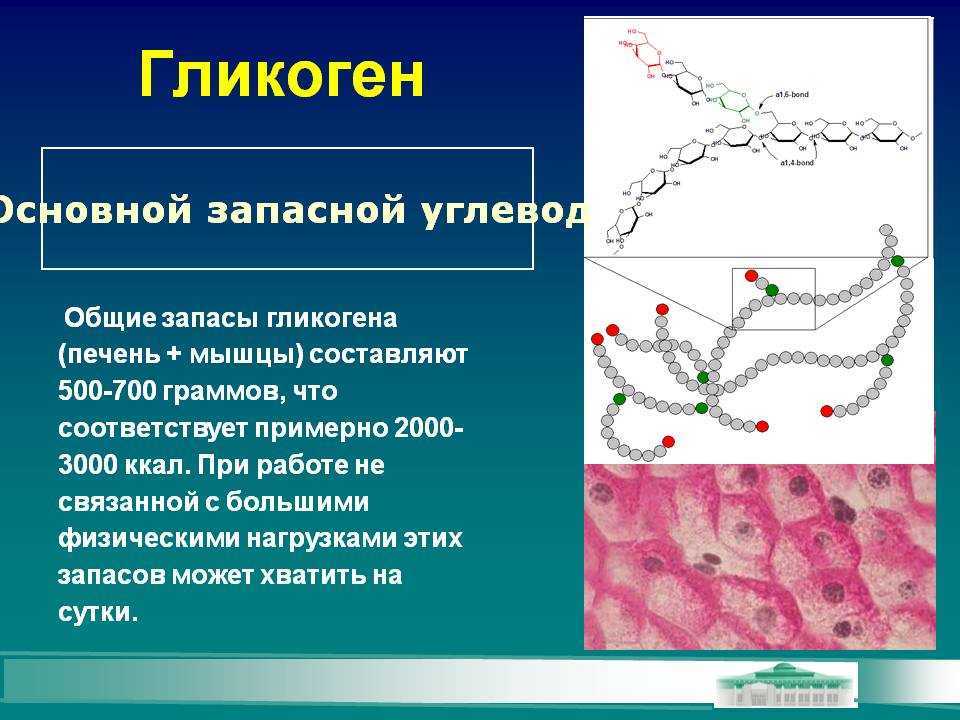
Гликоген представляет собой разветвленный полимер глюкозы, который животные используют в качестве источника энергии. Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких концентрациях в других тканях, таких как почки, сердце и мозг.[1][2] Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения.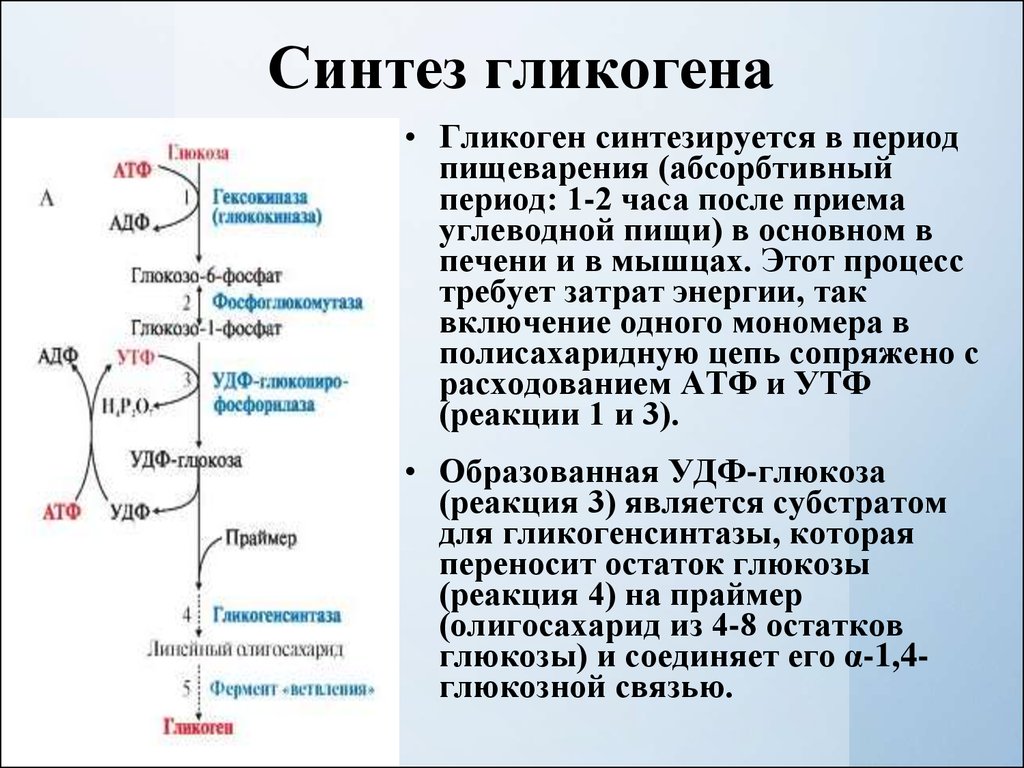 Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма.[3][4]
Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма.[3][4]
Основы
Ключевые фундаментальные положения:
Гликоген влияет на гомеостаз глюкозы.
Гликоген имеет высокую концентрацию в печени, хотя больше всего гликогена по массе содержится в скелетных мышцах. Гликогена в растительных тканях нет.
Скелетные мышцы не могут высвобождать гликоген в кровоток из-за недостатка глюкозо-6-фосфатазы (G6Pase)
Гликоген состоит из двух основных связей: альфа-1,4 и альфа-1 ,6 гликозидные связи — эти связи дают начало линейным цепям и точкам ветвления соответственно.
Разветвление гликогена имеет важное значение, поскольку оно обеспечивает повышенную растворимость в воде и наличие нескольких участков для его расщепления; это позволяет легко и быстро утилизировать гликоген, когда он расщепляется.
Синтез и расщепление гликогена коррелируют с состояниями высокой и низкой энергии соответственно.
Инсулин и глюкагон представляют собой пептидные гормоны, которые регулируют метаболизм гликогена, сигнализируя о состояниях высокой и низкой энергии соответственно.
Сотовый уровень
Постановление
Гликоген либо синтезируется, либо расщепляется в зависимости от потребностей организма. Это важная молекула для поддержания гомеостаза глюкозы. Двумя основными пептидными гормонами, участвующими в его регуляции, являются инсулин и глюкагон, которые способствуют анаболизму и катаболизму. Понимание широких эффектов этих двух гормонов важно в контексте метаболизма гликогена.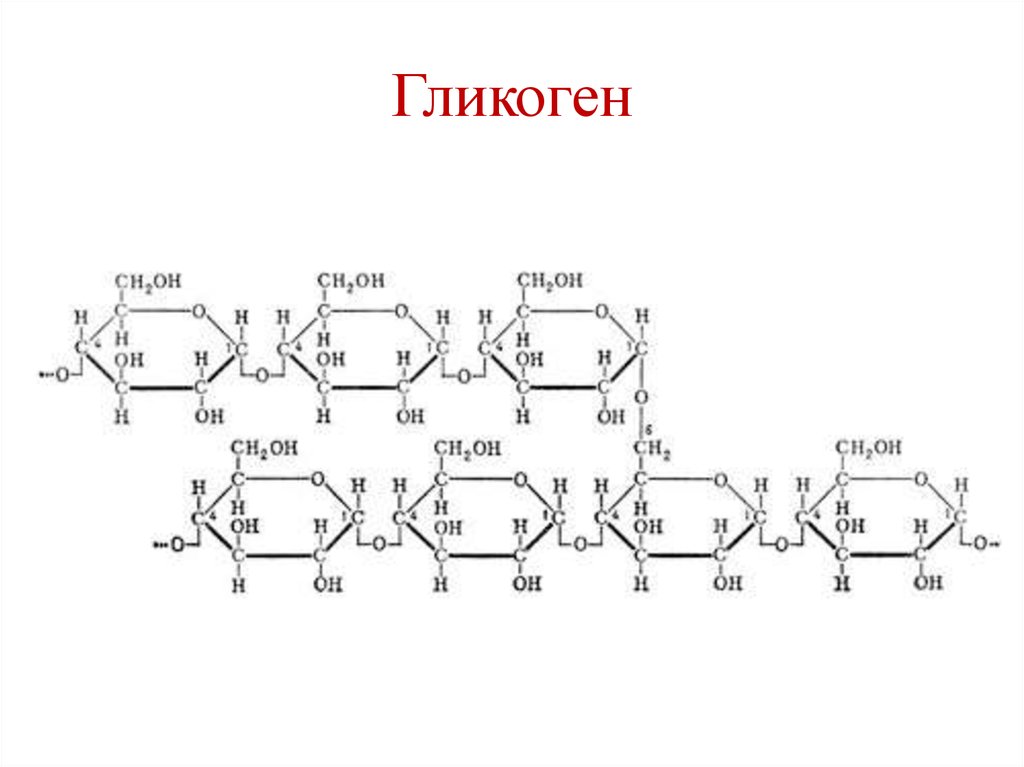 Инсулин сигнализирует о высокоэнергетическом состоянии; таким образом, его последующие эффекты включают синтез липидов и гликогена. Глюкагон сигнализирует о низком энергетическом состоянии; следовательно, его последующие эффекты обратны действию инсулина. Таким образом, повышенное высвобождение глюкагона приведет к последующему эффекту повышенного липолиза и гликогенолиза для удовлетворения потребностей организма.
Инсулин сигнализирует о высокоэнергетическом состоянии; таким образом, его последующие эффекты включают синтез липидов и гликогена. Глюкагон сигнализирует о низком энергетическом состоянии; следовательно, его последующие эффекты обратны действию инсулина. Таким образом, повышенное высвобождение глюкагона приведет к последующему эффекту повышенного липолиза и гликогенолиза для удовлетворения потребностей организма.
В частности, последующие эффекты инсулина и глюкагона изменяют активность нескольких ферментов, противоположно участвующих в метаболизме гликогена посредством дефосфорилирования и фосфорилирования соответственно. Инсулин связан с активацией протеинфосфатазы 1 (PP1) и протеинкиназы B (PKB). Глюкагон связан с цАМФ-опосредованным путем, который активирует протеинкиназу А (ПКА). В синтезе гликогена гликогенсинтаза является основным ферментом, регулируемым ферментами PP1, PKB и PKA.
Гликогенсинтаза имеет две основные формы: гликогенсинтаза и гликогенсинтаза b. Это активная и неактивная формы соответственно.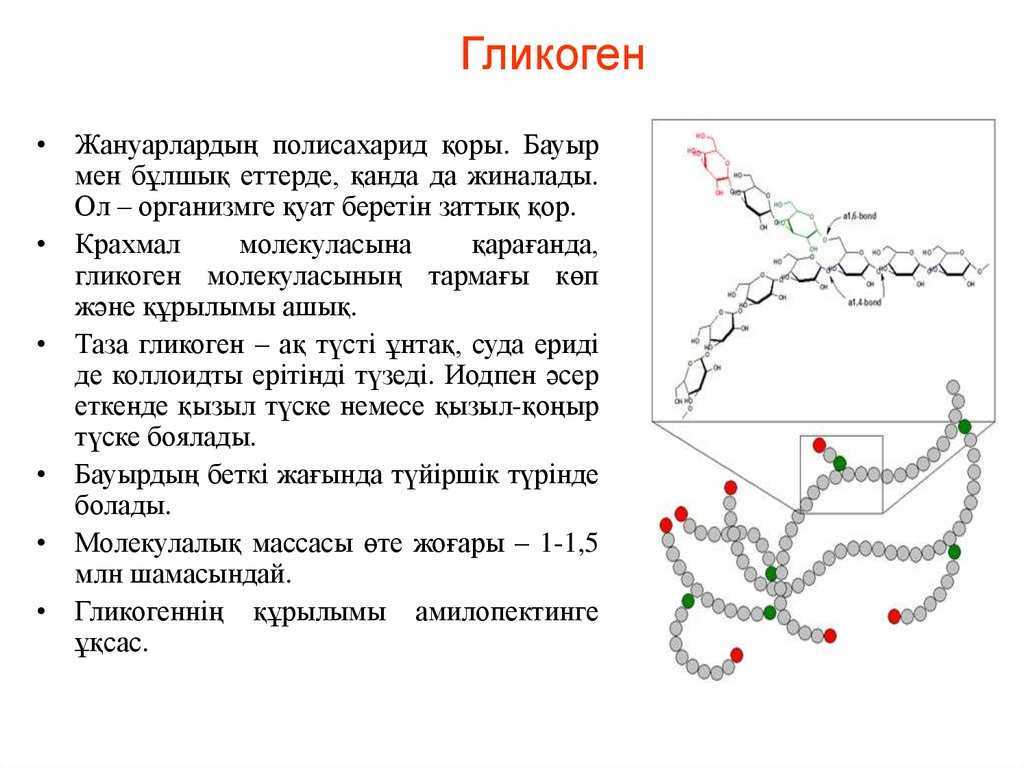 [6] Существенное структурное различие между ними состоит в том, что гликогенсинтаза b более фосфорилирована, чем гликогенсинтаза а. В инсулин-опосредованном пути PP1 дефосфорилирует гликогенсинтазу b, превращая ее в гликогенсинтазу а. PKB может поддерживать эту форму гликогенфосфорилазы путем инактивации фермента, известного как гликогенсинтаза-киназа 3 (GSK3)[7], который в противном случае фосфорилировал бы гликогенсинтазу а. В глюкагон-опосредованном пути PKA фосфорилирует PP1, предотвращая активацию PP1 гликогенсинтазы b в гликогенсинтазу a.
[6] Существенное структурное различие между ними состоит в том, что гликогенсинтаза b более фосфорилирована, чем гликогенсинтаза а. В инсулин-опосредованном пути PP1 дефосфорилирует гликогенсинтазу b, превращая ее в гликогенсинтазу а. PKB может поддерживать эту форму гликогенфосфорилазы путем инактивации фермента, известного как гликогенсинтаза-киназа 3 (GSK3)[7], который в противном случае фосфорилировал бы гликогенсинтазу а. В глюкагон-опосредованном пути PKA фосфорилирует PP1, предотвращая активацию PP1 гликогенсинтазы b в гликогенсинтазу a.
Двумя основными формами гликогенфосфорилазы являются гликогенфосфорилазы a и b, которые представляют собой активную и неактивную формы соответственно.[6] PKA активирует киназу гликогенфосфорилазы, которая впоследствии фосфорилирует и активирует гликогенфосфорилазу. Напротив, PP1 дефосфорилирует гликогенфосфорилазу, превращая ее в b-форму. Важно отметить, что печеночная изоформа гликогенфосфорилазы нуждается в глюкозе для связывания с аллостерическим сайтом, чтобы позволить PP1 дефосфорилировать ее.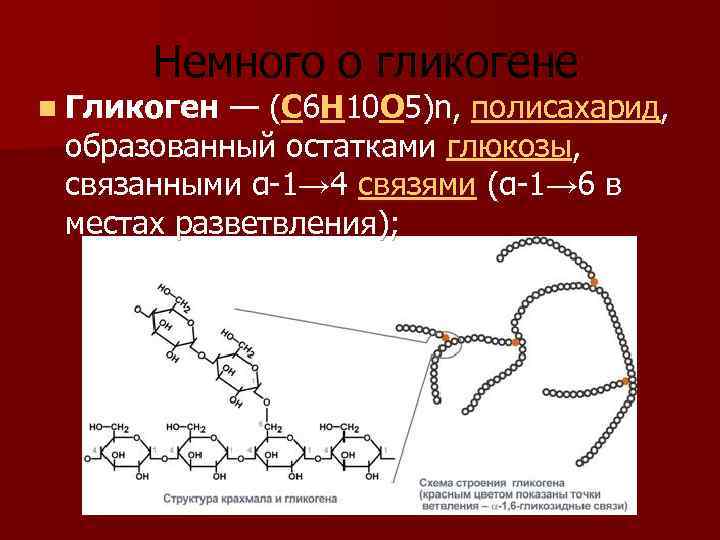 Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
Регуляция метаболизма гликогена характерна для скелетных мышц. Киназа мышечной гликогенфосфорилазы повышает свою активность в присутствии кальция в цитоплазме, высвобождаемого из саркоплазматического ретикулума при мышечном сокращении. Он содержит субъединицы кальмодулина, обладающие высоким сродством к кальцию. Кроме того, известно, что соединения с низким энергетическим состоянием, такие как AMP, IMP и Pi, являются положительными аллостерическими регуляторами гликогенфосфорилазы скелетных мышц.
Молекулярный уровень
Гликогенез
Гликогенез или синтез гликогена представляет собой многоэтапный процесс, который начинается с превращения глюкозы в глюкозо-6-фосфат с помощью гексокиназы или печеночной изоформы гексокиназы, известной как глюкокиназа. Этот процесс является важным этапом, поскольку добавление фосфатной группы улавливает глюкозу внутри клетки. G6P впоследствии превращается в глюкозо-1-фосфат (G1P) с помощью фосфоглюкомутазы.
Однако, прежде чем гликогенсинтаза заработает, ей требуется гликогеновый праймер. Гликогенин синтезирует этот начальный праймер для гликогенсинтазы. Вкратце, гликогенин действует путем присоединения молекулы УДФ-глюкозы в положении 1C к гидроксильной группе остатка тирозина, что вызывает выход УДФ, а длина праймера впоследствии увеличивается до 10–20 остатков глюкозы.[4] Ветвление впоследствии происходит с помощью фермента ветвления гликогена, который имеет две каталитические активности, которые включают трансферазу и альфа-1,6 гликозидазу, которая образует разветвленную связь.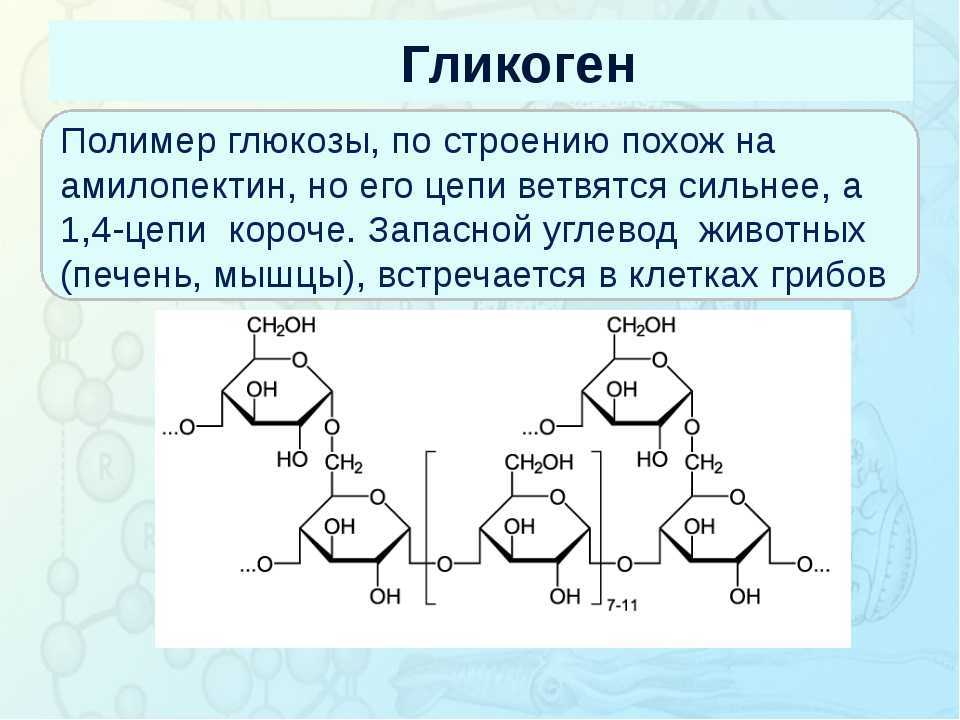 Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
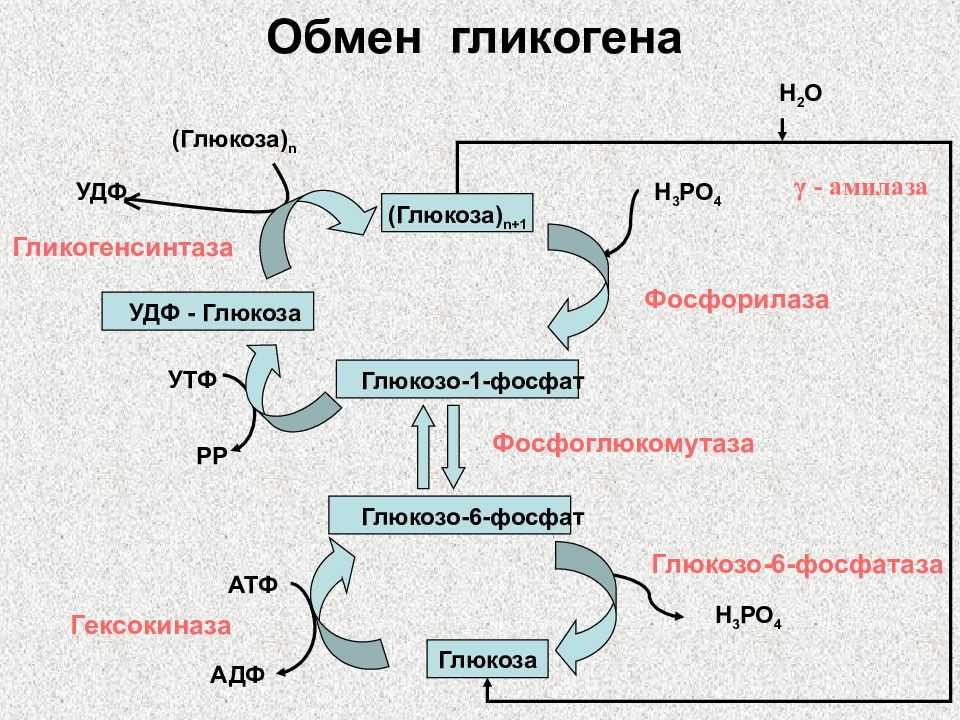
Гликогенолиз
Гликогенолиз или расщепление гликогена в первую очередь требует гликогенфосфорилазы и фермента деветвления. Гликогенфосфорилаза включает поступление фосфата (Pi) и PLP (пиридоксальфосфата), кофактора, полученного из витамина B6.[10] В конечном итоге он удаляет один остаток глюкозы из гликогена в форме глюкозо-1-фосфата. Однако гликогенфосфорилаза не может расщепить альфа-1,4-связи по мере приближения к точке соединения; таким образом, фермент, разветвляющий гликоген, захватывает четыре остатка глюкозы, прежде чем достигнет точки соединения. Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.
Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.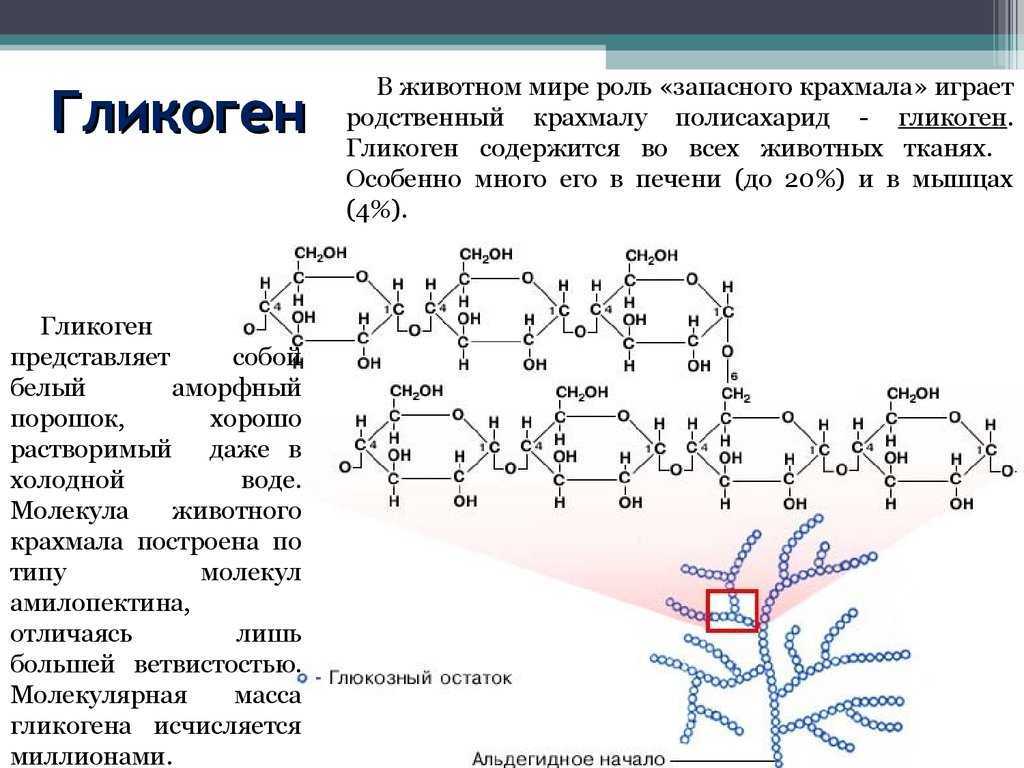
Клиническое значение
Существует множество болезней накопления гликогена (БГБ), вызванных генетическими мутациями ферментов, непосредственно участвующих в анаболизме и катаболизме гликогена. Как правило, они наследуются по аутосомно-рецессивному типу и часто проявляются в раннем детстве. Основные GSD и нарушенные ферменты следующие [3][11]:
Тип 0: гликогенсинтаза мышц (GYS1) или гликогенсинтаза печени (GYS2)
Тип Ia (болезнь фон Гирке): гликоген -6-фосфатаза, особенно G6PC (удаляет фосфатную группу из G6P)
Тип 1b (болезнь фон Гирке): гликоген-6-фосфатаза, особенно G6PT (транспортирует G6P в эндоплазматический ретикулум)
Тип II (болезнь Помпе): кислая альфа-глюкозидаза (ГАА; в лизосомах)
Тип III (болезнь Кори): фермент, разветвляющий гликоген
Тип IV (болезнь Андерсена): фермент, разветвляющий гликоген.
Тип V (болезнь Мак-Ардла): мышечная и сердечная гликогенфосфорилаза
Тип VI (болезнь Герса): гликогенфосфорилаза печени
Вопросы для повторения
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Комментарий к этой статье.
Ссылки
- 1.
Роуч П.Дж., Депаоли-Роуч А.А., Херли Т.Д., Тальябраччи В.С. Гликоген и его метаболизм: некоторые новые разработки и старые темы. Biochem J. 2012 Feb 01;441(3):763-87. [Бесплатная статья PMC: PMC4945249] [PubMed: 22248338]
- 2.
Jensen J, Rustad PI, Kolnes AJ, Lai YC. Роль распада гликогена скелетных мышц в регуляции чувствительности к инсулину при физических нагрузках. Фронт Физиол. 2011;2:112. [Бесплатная статья PMC: PMC3248697] [PubMed: 22232606]
- 3.
Эллингвуд С.С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141. [Бесплатная статья PMC: PMC6050127] [PubMed: 29875163]
- 4.
Адева-Андани М.М., Гонсалес-Лукан М., Донапетри-Гарсия С., Фернандес-Фернандес С., Аменейрос-Родригес Э. Метаболизм гликогена у людей. Клиника ББА. 2016 июнь; 5:85-100.
 [Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]
[Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]- 5.
Петерсен М.С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587. [Бесплатная статья PMC: PMC5777172] [PubMed: 28731034]
- 6.
Сюй К., Морган К.Т., Тодд Герис А., Элстон Т.С., Гомес С.М. Модель всего организма для регуляции гликогена показывает критическую роль круговорота субстрата в поддержании гомеостаза глюкозы в крови. PLoS Comput Biol. 2011 Декабрь;7(12):e1002272. [Бесплатная статья PMC: PMC3233304] [PubMed: 22163177]
- 7.
Кросс Д.А., Алесси Д.Р., Коэн П., Анджелкович М., Хеммингс Б.А. Ингибирование киназы-3 гликогенсинтазы инсулином, опосредованное протеинкиназой B. Природа. 1995 21–28 декабря; 378 (6559)): 785-9. [PubMed: 8524413]
- 8.
Baker DJ, Timmons JA, Greenhaff PL. Ингибирование гликогенфосфорилазы при лечении диабета 2 типа: систематическая оценка метаболических и функциональных эффектов в скелетных мышцах крыс.
 Диабет. 2005 г., август; 54 (8): 2453-9. [PubMed: 16046314]
Диабет. 2005 г., август; 54 (8): 2453-9. [PubMed: 16046314]- 9.
Heikinheimo P, Lehtonen J, Baykov A, Lahti R, Cooperman BS, Goldman A. Структурная основа пирофосфатазного катализа. Состав. 1996 15 декабря; 4 (12): 1491-508. [PubMed: 8994974]
- 10.
Schneider G, Käck H, Lindqvist Y. Многообразие ферментов, зависимых от витамина B6. Состав. 2000 г., 15 января; 8 (1): R1-6. [PubMed: 10673430]
- 11.
Hicks J, Wartchow E, Mierau G. Болезни накопления гликогена: краткий обзор и обновленная информация о клинических особенностях, генетических аномалиях, патологических особенностях и лечении. Ультраструктура Патол. 2011 окт; 35 (5): 183-96. [PubMed: 21910565]
Биохимия, гликоген — StatPearls — NCBI Bookshelf
Салах А. Даглас; Шамим С. Мохиуддин.
Информация об авторе и организациях
Последнее обновление: 8 мая 2022 г.
Введение
Гликоген представляет собой разветвленный полимер глюкозы, который животные используют в качестве источника энергии.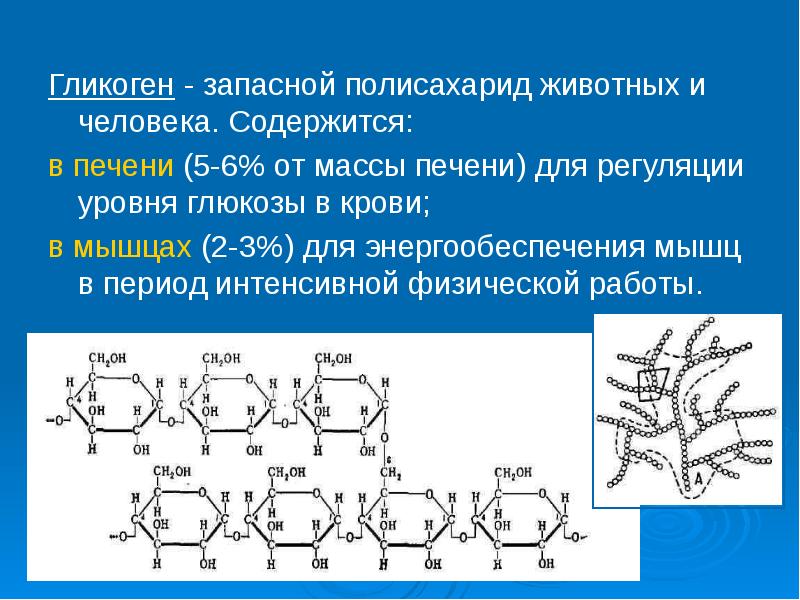 Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких концентрациях в других тканях, таких как почки, сердце и мозг.[1][2] Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения. Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма.
Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких концентрациях в других тканях, таких как почки, сердце и мозг.[1][2] Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения. Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма. [3][4]
[3][4]
Основы
Ключевые фундаментальные положения:
Гликоген влияет на гомеостаз глюкозы.
Гликоген имеет высокую концентрацию в печени, хотя больше всего гликогена по массе содержится в скелетных мышцах. Гликогена в растительных тканях нет.
Скелетные мышцы не могут высвобождать гликоген в кровоток из-за недостатка глюкозо-6-фосфатазы (G6Pase)
Гликоген состоит из двух основных связей: альфа-1,4 и альфа-1 ,6 гликозидные связи — эти связи дают начало линейным цепям и точкам ветвления соответственно.
Разветвление гликогена имеет важное значение, поскольку оно обеспечивает повышенную растворимость в воде и наличие нескольких участков для его расщепления; это позволяет легко и быстро утилизировать гликоген, когда он расщепляется.
Синтез и расщепление гликогена коррелируют с состояниями высокой и низкой энергии соответственно.
Инсулин и глюкагон представляют собой пептидные гормоны, которые регулируют метаболизм гликогена, сигнализируя о состояниях высокой и низкой энергии соответственно.
Сотовый уровень
Постановление
Гликоген либо синтезируется, либо расщепляется в зависимости от потребностей организма. Это важная молекула для поддержания гомеостаза глюкозы. Двумя основными пептидными гормонами, участвующими в его регуляции, являются инсулин и глюкагон, которые способствуют анаболизму и катаболизму. Понимание широких эффектов этих двух гормонов важно в контексте метаболизма гликогена. Инсулин сигнализирует о высокоэнергетическом состоянии; таким образом, его последующие эффекты включают синтез липидов и гликогена. Глюкагон сигнализирует о низком энергетическом состоянии; следовательно, его последующие эффекты обратны действию инсулина. Таким образом, повышенное высвобождение глюкагона приведет к последующему эффекту повышенного липолиза и гликогенолиза для удовлетворения потребностей организма.
В частности, последующие эффекты инсулина и глюкагона изменяют активность нескольких ферментов, противоположно участвующих в метаболизме гликогена посредством дефосфорилирования и фосфорилирования соответственно. Инсулин связан с активацией протеинфосфатазы 1 (PP1) и протеинкиназы B (PKB). Глюкагон связан с цАМФ-опосредованным путем, который активирует протеинкиназу А (ПКА). В синтезе гликогена гликогенсинтаза является основным ферментом, регулируемым ферментами PP1, PKB и PKA.
Инсулин связан с активацией протеинфосфатазы 1 (PP1) и протеинкиназы B (PKB). Глюкагон связан с цАМФ-опосредованным путем, который активирует протеинкиназу А (ПКА). В синтезе гликогена гликогенсинтаза является основным ферментом, регулируемым ферментами PP1, PKB и PKA.
Гликогенсинтаза имеет две основные формы: гликогенсинтаза и гликогенсинтаза b. Это активная и неактивная формы соответственно.[6] Существенное структурное различие между ними состоит в том, что гликогенсинтаза b более фосфорилирована, чем гликогенсинтаза а. В инсулин-опосредованном пути PP1 дефосфорилирует гликогенсинтазу b, превращая ее в гликогенсинтазу а. PKB может поддерживать эту форму гликогенфосфорилазы путем инактивации фермента, известного как гликогенсинтаза-киназа 3 (GSK3)[7], который в противном случае фосфорилировал бы гликогенсинтазу а. В глюкагон-опосредованном пути PKA фосфорилирует PP1, предотвращая активацию PP1 гликогенсинтазы b в гликогенсинтазу a.
Двумя основными формами гликогенфосфорилазы являются гликогенфосфорилазы a и b, которые представляют собой активную и неактивную формы соответственно.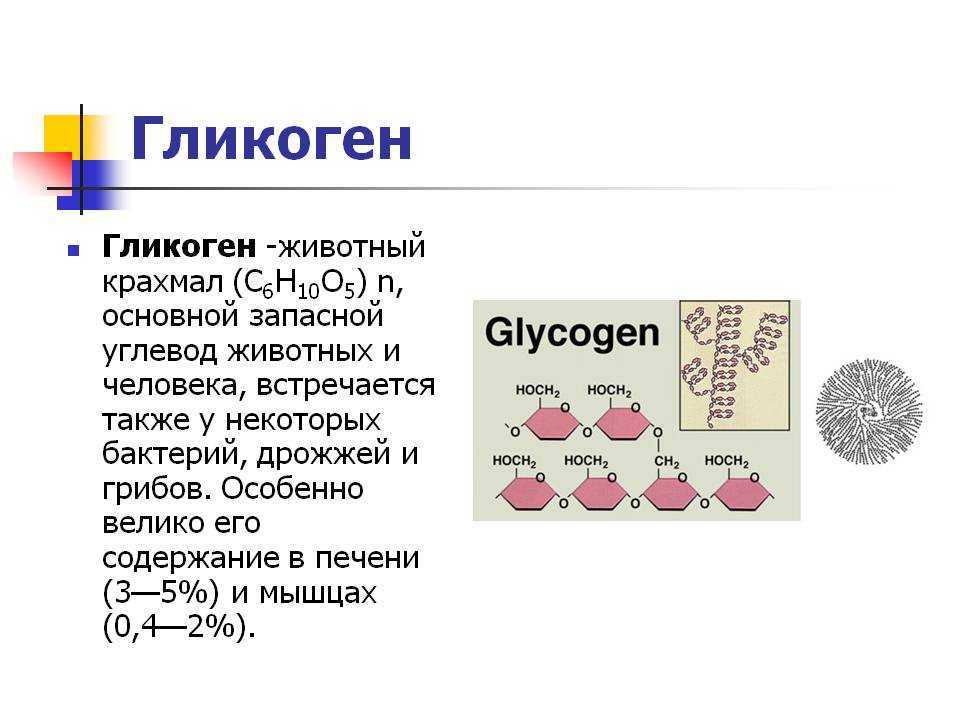 [6] PKA активирует киназу гликогенфосфорилазы, которая впоследствии фосфорилирует и активирует гликогенфосфорилазу. Напротив, PP1 дефосфорилирует гликогенфосфорилазу, превращая ее в b-форму. Важно отметить, что печеночная изоформа гликогенфосфорилазы нуждается в глюкозе для связывания с аллостерическим сайтом, чтобы позволить PP1 дефосфорилировать ее. Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
[6] PKA активирует киназу гликогенфосфорилазы, которая впоследствии фосфорилирует и активирует гликогенфосфорилазу. Напротив, PP1 дефосфорилирует гликогенфосфорилазу, превращая ее в b-форму. Важно отметить, что печеночная изоформа гликогенфосфорилазы нуждается в глюкозе для связывания с аллостерическим сайтом, чтобы позволить PP1 дефосфорилировать ее. Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
Регуляция метаболизма гликогена характерна для скелетных мышц. Киназа мышечной гликогенфосфорилазы повышает свою активность в присутствии кальция в цитоплазме, высвобождаемого из саркоплазматического ретикулума при мышечном сокращении. Он содержит субъединицы кальмодулина, обладающие высоким сродством к кальцию. Кроме того, известно, что соединения с низким энергетическим состоянием, такие как AMP, IMP и Pi, являются положительными аллостерическими регуляторами гликогенфосфорилазы скелетных мышц.
Молекулярный уровень
Гликогенез
Гликогенез или синтез гликогена представляет собой многоэтапный процесс, который начинается с превращения глюкозы в глюкозо-6-фосфат с помощью гексокиназы или печеночной изоформы гексокиназы, известной как глюкокиназа. Этот процесс является важным этапом, поскольку добавление фосфатной группы улавливает глюкозу внутри клетки. G6P впоследствии превращается в глюкозо-1-фосфат (G1P) с помощью фосфоглюкомутазы. G1P превращается в УДФ-глюкозу с помощью глюкозо-1-фосфатуридилтрансферазы, для которой в качестве дополнительного субстрата требуется УТФ. На этом этапе фосфатная группа глюкозо-1-фосфата осуществляет нуклеофильную атаку на альфа-фосфат UTP, что приводит к высвобождению пирофосфата (PPi), высокореактивной молекулы, которая быстро подвергается гидролизу. Высвобождение PPi помогает ускорить реакцию.[9] Гликогенсинтаза создает альфа-1,4 гликозидную связь между УДФ-глюкозой и растущей цепью гликогена.
Этот процесс является важным этапом, поскольку добавление фосфатной группы улавливает глюкозу внутри клетки. G6P впоследствии превращается в глюкозо-1-фосфат (G1P) с помощью фосфоглюкомутазы. G1P превращается в УДФ-глюкозу с помощью глюкозо-1-фосфатуридилтрансферазы, для которой в качестве дополнительного субстрата требуется УТФ. На этом этапе фосфатная группа глюкозо-1-фосфата осуществляет нуклеофильную атаку на альфа-фосфат UTP, что приводит к высвобождению пирофосфата (PPi), высокореактивной молекулы, которая быстро подвергается гидролизу. Высвобождение PPi помогает ускорить реакцию.[9] Гликогенсинтаза создает альфа-1,4 гликозидную связь между УДФ-глюкозой и растущей цепью гликогена.
Однако, прежде чем гликогенсинтаза заработает, ей требуется гликогеновый праймер. Гликогенин синтезирует этот начальный праймер для гликогенсинтазы. Вкратце, гликогенин действует путем присоединения молекулы УДФ-глюкозы в положении 1C к гидроксильной группе остатка тирозина, что вызывает выход УДФ, а длина праймера впоследствии увеличивается до 10–20 остатков глюкозы.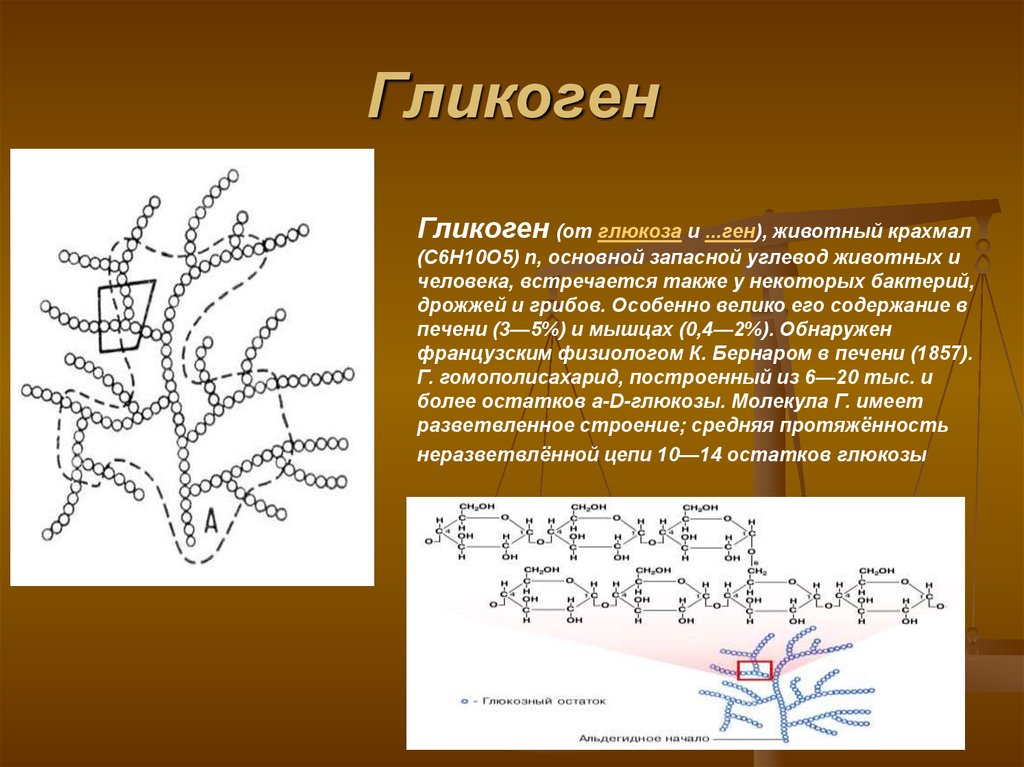 [4] Ветвление впоследствии происходит с помощью фермента ветвления гликогена, который имеет две каталитические активности, которые включают трансферазу и альфа-1,6 гликозидазу, которая образует разветвленную связь. Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
[4] Ветвление впоследствии происходит с помощью фермента ветвления гликогена, который имеет две каталитические активности, которые включают трансферазу и альфа-1,6 гликозидазу, которая образует разветвленную связь. Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
Гликогенолиз
Гликогенолиз или расщепление гликогена в первую очередь требует гликогенфосфорилазы и фермента деветвления. Гликогенфосфорилаза включает поступление фосфата (Pi) и PLP (пиридоксальфосфата), кофактора, полученного из витамина B6.[10] В конечном итоге он удаляет один остаток глюкозы из гликогена в форме глюкозо-1-фосфата. Однако гликогенфосфорилаза не может расщепить альфа-1,4-связи по мере приближения к точке соединения; таким образом, фермент, разветвляющий гликоген, захватывает четыре остатка глюкозы, прежде чем достигнет точки соединения.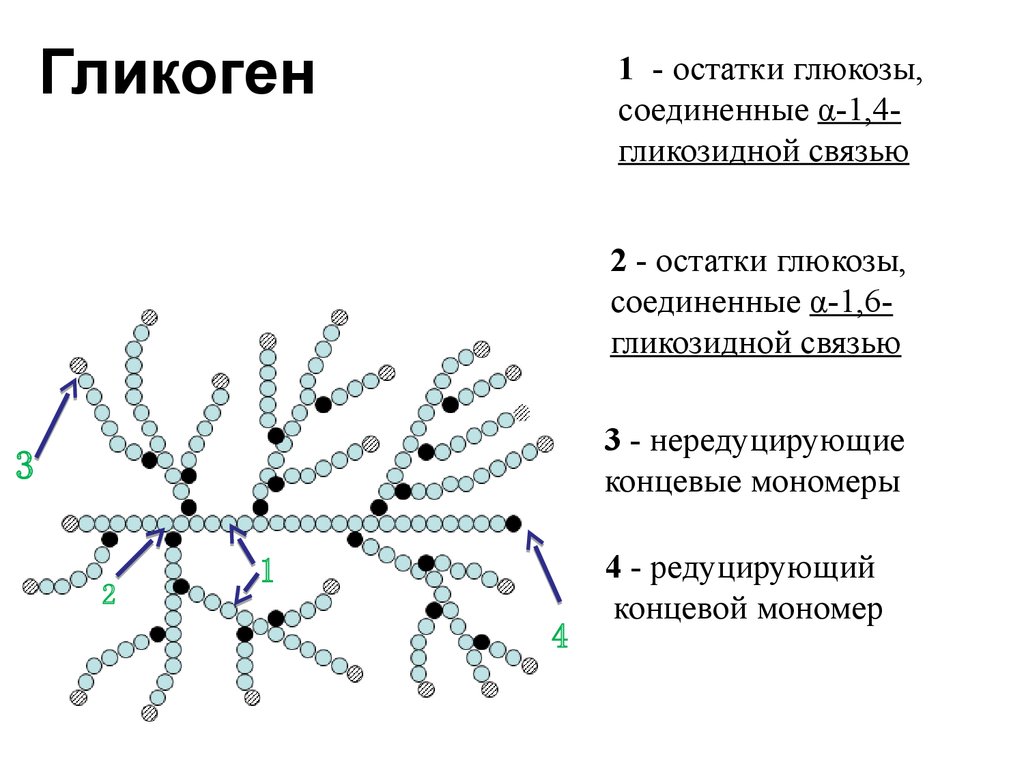 Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.
Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.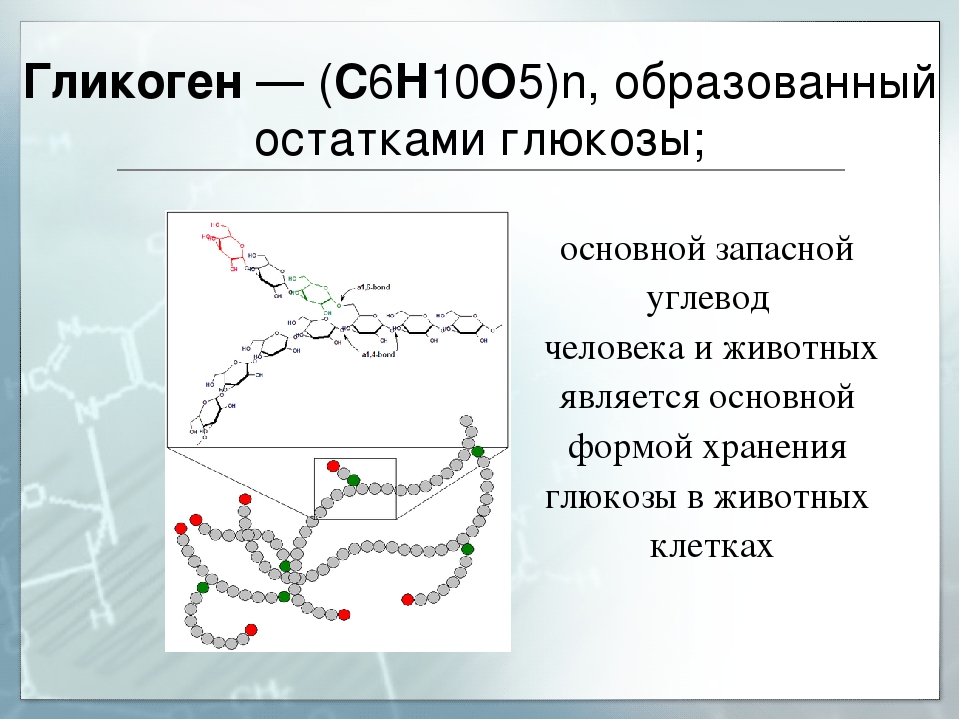
Клиническое значение
Существует множество болезней накопления гликогена (БГБ), вызванных генетическими мутациями ферментов, непосредственно участвующих в анаболизме и катаболизме гликогена. Как правило, они наследуются по аутосомно-рецессивному типу и часто проявляются в раннем детстве. Основные GSD и нарушенные ферменты следующие [3][11]:
Тип 0: гликогенсинтаза мышц (GYS1) или гликогенсинтаза печени (GYS2)
Тип Ia (болезнь фон Гирке): гликоген -6-фосфатаза, особенно G6PC (удаляет фосфатную группу из G6P)
Тип 1b (болезнь фон Гирке): гликоген-6-фосфатаза, особенно G6PT (транспортирует G6P в эндоплазматический ретикулум)
Тип II (болезнь Помпе): кислая альфа-глюкозидаза (ГАА; в лизосомах)
Тип III (болезнь Кори): фермент, разветвляющий гликоген
Тип IV (болезнь Андерсена): фермент, разветвляющий гликоген.
Тип V (болезнь Мак-Ардла): мышечная и сердечная гликогенфосфорилаза
Тип VI (болезнь Герса): гликогенфосфорилаза печени
Вопросы для повторения
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Роуч П.Дж., Депаоли-Роуч А.А., Херли Т.Д., Тальябраччи В.С. Гликоген и его метаболизм: некоторые новые разработки и старые темы. Biochem J. 2012 Feb 01;441(3):763-87. [Бесплатная статья PMC: PMC4945249] [PubMed: 22248338]
- 2.
Jensen J, Rustad PI, Kolnes AJ, Lai YC. Роль распада гликогена скелетных мышц в регуляции чувствительности к инсулину при физических нагрузках. Фронт Физиол. 2011;2:112. [Бесплатная статья PMC: PMC3248697] [PubMed: 22232606]
- 3.
Эллингвуд С.С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141. [Бесплатная статья PMC: PMC6050127] [PubMed: 29875163]
- 4.
Адева-Андани М.М., Гонсалес-Лукан М., Донапетри-Гарсия С., Фернандес-Фернандес С., Аменейрос-Родригес Э. Метаболизм гликогена у людей. Клиника ББА. 2016 июнь; 5:85-100.
 [Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]
[Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]- 5.
Петерсен М.С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587. [Бесплатная статья PMC: PMC5777172] [PubMed: 28731034]
- 6.
Сюй К., Морган К.Т., Тодд Герис А., Элстон Т.С., Гомес С.М. Модель всего организма для регуляции гликогена показывает критическую роль круговорота субстрата в поддержании гомеостаза глюкозы в крови. PLoS Comput Biol. 2011 Декабрь;7(12):e1002272. [Бесплатная статья PMC: PMC3233304] [PubMed: 22163177]
- 7.
Кросс Д.А., Алесси Д.Р., Коэн П., Анджелкович М., Хеммингс Б.А. Ингибирование киназы-3 гликогенсинтазы инсулином, опосредованное протеинкиназой B. Природа. 1995 21–28 декабря; 378 (6559)): 785-9. [PubMed: 8524413]
- 8.
Baker DJ, Timmons JA, Greenhaff PL. Ингибирование гликогенфосфорилазы при лечении диабета 2 типа: систематическая оценка метаболических и функциональных эффектов в скелетных мышцах крыс.


