«Чем отличаются коллаген и гликоген по строению?» — Яндекс Кью
Популярное
Сообщества
БиологияТерапевт
Маргарита Л.
·
14,6 K
ОтветитьУточнитьИлья Кренёв
Биология
865
Популяризатор биологии, особенно биохимии и доказательной медицины. Область научной… · 5 окт 2019 ·
mir_mol
Коллаген – это белок, а гликоген – полисахарид.
Коллаген представляет собой фибриллярный, вытянутый, белок, каждая молекула представляет собой левозакрученную спираль из трёх переплетающихся полипептидных цепочек. В цепочках много гидроксилированных аминокислот, благодаря которым цепочки взаимодействуют между собой. Витамин C нужен, в первую очередь, для гидроксилирования аминокислот, недостаток витамина C ведёт к проблемам с соединительной тканью, в частности, к цинге. Каждая третья аминокислота в цепочках спирали – глицин, у которого боковая группа представлена лишь одним протоном. Глицин обеспечивает компактность структуры молекулы коллагена. В реальном коллагене тройные спирали располагаются строго определённым образом относительно друг друга, образуя структуры более высокого порядка – фибриллы, обладающие свойством механической прочности. В частности, это позволяет костям не ломаться и выполнять опорную функцию. Вообще говоря, коллаген – самый распространённый белок млекопитающих, он составляет порядка четверти всей нашей белковой массы. Известно около 30 классов коллагена, которые распределены по разным тканям.
Витамин C нужен, в первую очередь, для гидроксилирования аминокислот, недостаток витамина C ведёт к проблемам с соединительной тканью, в частности, к цинге. Каждая третья аминокислота в цепочках спирали – глицин, у которого боковая группа представлена лишь одним протоном. Глицин обеспечивает компактность структуры молекулы коллагена. В реальном коллагене тройные спирали располагаются строго определённым образом относительно друг друга, образуя структуры более высокого порядка – фибриллы, обладающие свойством механической прочности. В частности, это позволяет костям не ломаться и выполнять опорную функцию. Вообще говоря, коллаген – самый распространённый белок млекопитающих, он составляет порядка четверти всей нашей белковой массы. Известно около 30 классов коллагена, которые распределены по разным тканям.
Гликоген – это не белок, а полисахарид, а именно полимер глюкозы. Главная его функция – запасающая (глюкоза – источник энергии). В структуре молекулы гликогена можно увидеть, что линейные области цепочки иногда прерываются развилками.
1 эксперт согласен
Комментировать ответ…Комментировать…
Екатерина Ива
515
Врач клинической и лабораторной диагностики. Кандидат биологических наук. Биохимик… · 30 июн 2021
Слова и правда кажется почти одинаковыми. Но это просто из-за особенностей словообразования. Из копыт шерсти варили когда-то что-то похожее на клей: колла по-гречески. А вот лет 150 назад из печени получили вещество, которое могло образовать сахар, и его назвали от греческого гликос — сладкий. (глюкоза, глицерин, глицин — еще примеры хотя это углевод, трехатомный… Читать далее
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Врачи впервые успешно полечили гликогеноз внутриутробно
Американские врачи опубликовали результаты первой попытки внутриутробного лечения гликогеноза II типа. В клиническом наблюдении, опубликованном в The England Journal of Medicine, они описывают лечение ребенка с гомозиготной мутацией в гене кислой альфа-глюкозидазы. У таких пациентов во время лечения развивается иммунный ответ против ферментозаместительной терапии, лекарство становится неэффективным, и продолжительность жизни не превышает нескольких лет. Чтобы избежать реакции, врачи начали лечение в конце второго триместра внутриутробного развития. В результате родилась девочка без клинических проявлений гликогеноза, развивающаяся в соответствии с возрастными нормами.
В клиническом наблюдении, опубликованном в The England Journal of Medicine, они описывают лечение ребенка с гомозиготной мутацией в гене кислой альфа-глюкозидазы. У таких пациентов во время лечения развивается иммунный ответ против ферментозаместительной терапии, лекарство становится неэффективным, и продолжительность жизни не превышает нескольких лет. Чтобы избежать реакции, врачи начали лечение в конце второго триместра внутриутробного развития. В результате родилась девочка без клинических проявлений гликогеноза, развивающаяся в соответствии с возрастными нормами.
Болезнь Помпе, или болезнь накопления гликогена II типа, — редкое наследственное аутосомно-рецессивное заболевание, встречающееся у одного из нескольких десятков-сотен тысяч человек (в России зарегистрировано меньше полусотни пациентов, а их реальное число, видимо, в 10-20 раз выше). При этой болезни нарушена работа фермента кислой альфа-глюкозидазы (GAA), расщепляющего гликоген в клетках. Когда он накапливается в большом количестве, происходит повреждение клеток, и сильнее всего страдает центральная нервная система, сердце и скелетные мышцы.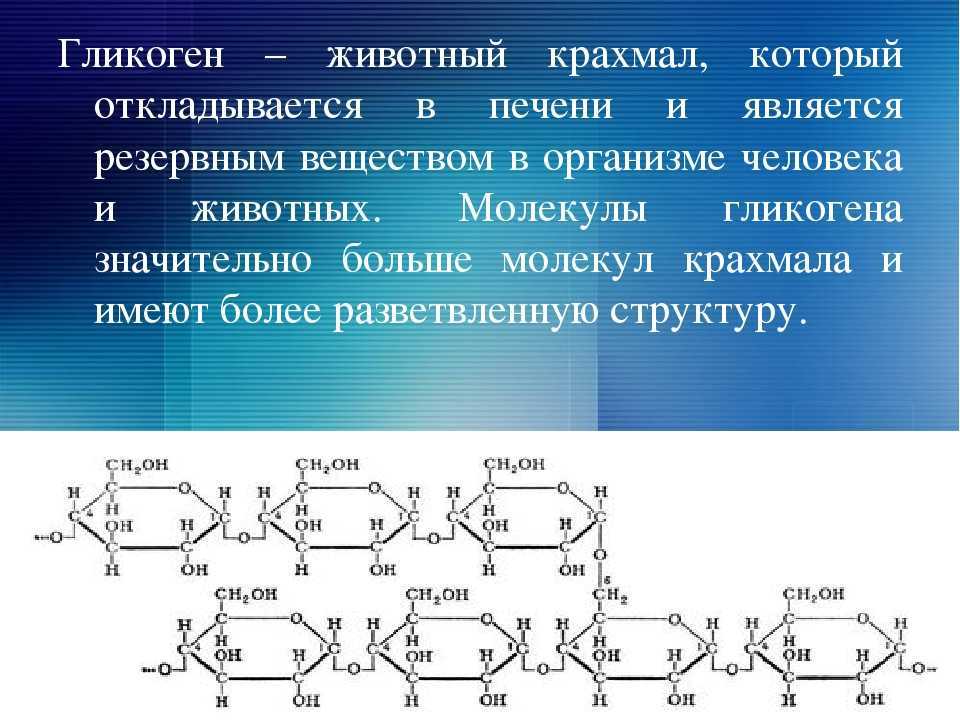 Если функция фермента снижена, то болезнь дебютирует в подростковом или взрослом возрасте. Но если фермент полностью нефункционален, то мышечная слабость и нарушения работы сердца появляются во младенчестве, и многие пациенты живут не более года.
Если функция фермента снижена, то болезнь дебютирует в подростковом или взрослом возрасте. Но если фермент полностью нефункционален, то мышечная слабость и нарушения работы сердца появляются во младенчестве, и многие пациенты живут не более года.
В последние десять лет было несколько попыток генной терапии болезни Помпе. Но пока они не дают прорывных результатов, и самое эффективное лечение — это заместительная терапия: пациенты должны пожизненно раз в несколько недель получать кислую альфа-глюкозидазу внутривенно.
Но каждое введение альфа-глюкозидазы — это сотни миллиграмм чужеродного белка, попадающего прямо в кровь. Иммунная система воспринимает лекарство как чужеродное вещество и вырабатывает против него антитела, в результате средство перестает работать. Чтобы продолжить лечение, врачи вынуждены использовать иммуносуппрессанты, что не добавляет пациентам здоровья. И чем меньше будет сходство между нефункциональным белком, который производят клетки, и ферментом, которым будут лечить пациента, тем выше вероятность иммунных реакций.
Педиатры и генетики из США и Канады во главе с Типпи Маккензи (Tippi McKenzie) из Университета Калифорнии в Сан-Франциско представили описание пренатального лечения болезни Помпе. К врачам обратилась беременная женщина-носительница мутации в гене GAA. У двоих ее детей ранее была подтверждена болезнь Помпе, в первые месяцы жизни у них развивалась слабость мышц, и, несмотря на лечение, они умерли на первом и третьем годах жизни. Женщина состояла в близкородственном браке с носителем той же мутации.
Врачи провели биопсию хориона, и генетическое тестирование показало, что дочь пациентки имеет гомозиготную нонсенс-мутацию в гене GAA. Выявленная мутация сильно искажала структуру фермента — в таких случаях заболевание развивается во младенчестве, а если проводить заместительную терапию, то иммунный ответ на лекарство возникает уже в первые месяцы жизни.
Врачи приняли решение начать терапию внутриутробно. Ведь если ввести лекарство в организм до начала созревания гуморального звена иммунной системы (оно начинается во втором триместре беременности), то лимфоциты должны принимать чужеродный белок как свой и иммунного ответа не должно быть.
Девочка родилась здоровой, гистологическое исследование плаценты не показало признаков избыточного накопления гликогена в тканях плода. С момента рождения и до 13 месяцев (возраст на момент опубликования статьи) пациентка развивалась и росла в соответствии с возрастными нормами. Анализы крови ребенка не показывали повреждения мышц, а при эхокардиографии не было изменений, характерных для накопления гликогена в миокарде. В течение всего наблюдения уровень антител колебался в диапазоне от невыявляемого до незначимого.
Исследователи, участвовавшие в лечении, уже начали клиническое исследование первой фазы на людях, в рамках которого планируют отточить алгоритм внутриутробного лечения орфанного заболевания.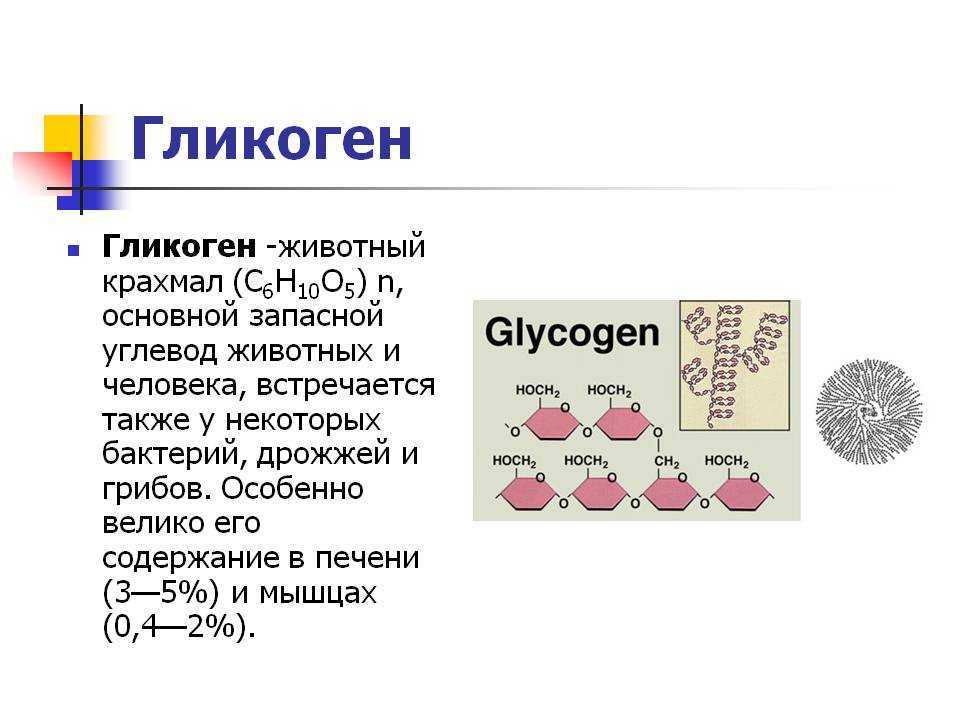
Редкие болезни — это не только сложно, но и зачастую очень, очень дорого. В начале 2022 года мы рассказывали про самое дорогое лекарство в мире, которое излечивает от генетическго нарушения структуры гемоглобина. Но спустя полгода его рекорд был побит другим лекарством, и тоже от орфанной болезни.
ГенетикаНашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Белок киназы гликогенсинтазы | Пептид GSK3B
Больше информацииКиназа-3 бета-гликогенсинтазы человека рекомбинантная
ПКА-320
2 мкг (60 долларов США)
10 мкг (145 долларов США)
1 мг (5200 долларов США)
Поставляется с пакетами со льдом
Наверх
GSK3B Человек, sf9
Больше информацииКиназа-3 бета гликогенсинтазы, sf9Человеческий рекомбинантный
ПКА-084
2 мкг (60 долларов США)
1 мг (5200 долларов США)
Поставляется с пакетами со льдом
Наверх
Информация о гликогенсинтазкиназе-3 бета / GSK3B:
Белок гликогенсинтазкиназы-3 бета, также известный как GSK3B, представляет собой фермент, вырабатываемый геном GSK3B. Он также обнаружен у людей и различных модельных организмов. У мышей он кодируется немного другим геном.
Он также обнаружен у людей и различных модельных организмов. У мышей он кодируется немного другим геном.
Функция GSK3B
GSK3B выполняет различные функции в организме человека, а также у других видов животных..
В качестве отрицательного регулятора гормонального контроля гомеостаза глюкозы во избежание повреждения чувствительных тканей, таких как сетчатка. GSK3B является частью гормонального аппарата организма, который поддерживает уровень глюкозы в разумных пределах, защищая организм от чрезмерно высоких уровней; Инсулин регулирует синтез гликогена в скелетных мышцах, GSK3B ингибирует синтез гликогена в скелетных мышцах путем ингибирования активности GYS1; Опосредовать развитие резистентности к инсулину GSK3B может опосредовать развитие резистентности к инсулину, регулируя активность факторов транскрипции. Биопсия мышечных клеток людей с диабетом показала, что они содержат гораздо более высокие уровни фермента. Поэтому есть смысл создать препараты, ингибирующие действие GSK3B, а также GSK3A.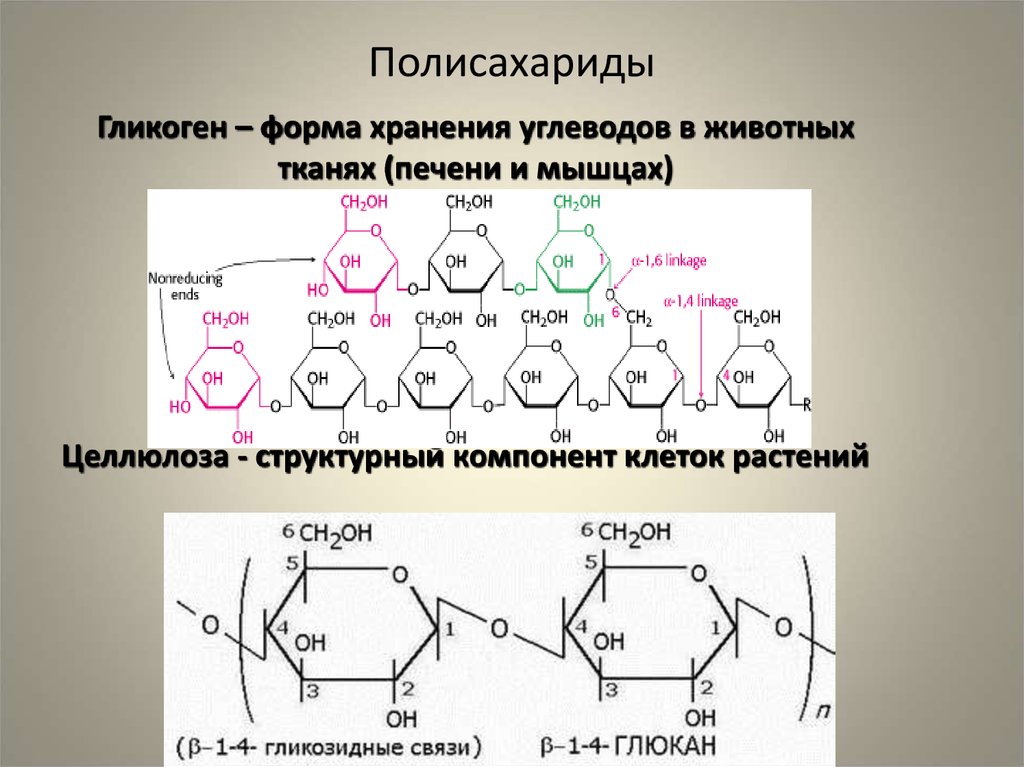 Доклинические модели уже указывают на это как на потенциальный источник терапии в будущем.
Доклинические модели уже указывают на это как на потенциальный источник терапии в будущем.
Кроме того, GSK3B может отрицательно регулировать бета-клетки поджелудочной железы. Организм требует, чтобы бета-клетки поджелудочной железы функционировали, чтобы вырабатывать инсулин для регулирования уровня сахара в крови. GSK3B может разрушать эти клетки, что приводит к развитию диабета.
GSK3B связан с биполярным расстройством, хотя механизмы не совсем ясны. Одной из возможных причин этого может быть взаимодействие GSK3B с циркадным ритмом, то есть его способность влиять на режим бодрствования и сна. Фермент регулирует циркадные часы посредством фосфорилирования компонентов, определяющих циркадный ритм. К ним относятся PER2, CLOCK и ARNTL/BMAL1.
GSK3B может быть значительным эволюционным ответом на условия голодания. В условиях голодания клетки регулируют свои внутренние химические процессы, активизируя действие генов и ферментов, которые очищают клетки от остатков пищи и укрепляют клеточную защиту.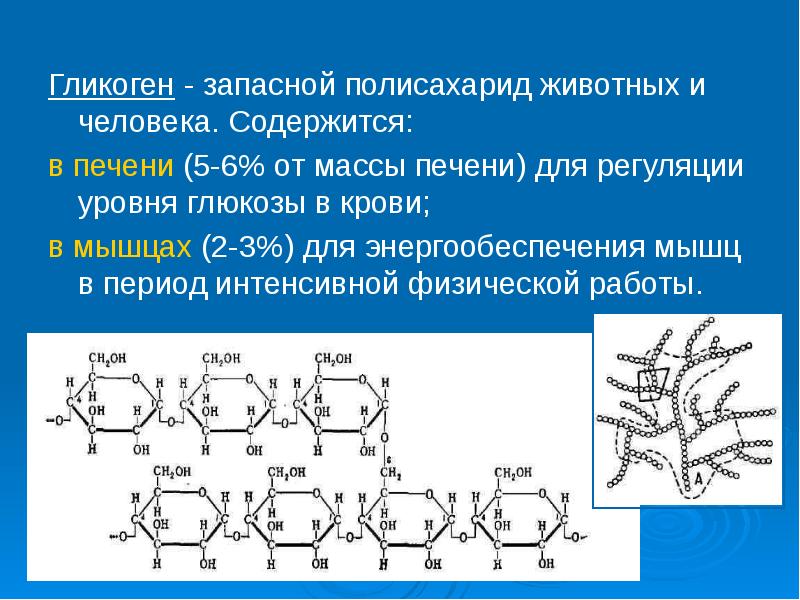 GSK3B может действовать как регулятор аутофагии в низкоэнергетических средах, побуждая клетки поедать самих себя для получения дополнительной энергии и повышения выживаемости. Фермент может иметь жизненно важное значение в ацетилировании регуляторов аутофагии.
GSK3B может действовать как регулятор аутофагии в низкоэнергетических средах, побуждая клетки поедать самих себя для получения дополнительной энергии и повышения выживаемости. Фермент может иметь жизненно важное значение в ацетилировании регуляторов аутофагии.
Гликогенсинтаза киназа-3 бета Взаимодействия
GSK3B взаимодействует с рядом белков. Одним из белков, с которым он взаимодействует, является KIAA1211L. Этот белок находится в высоких концентрациях в головном мозге и связан с различными психическими расстройствами и раком.
GSK3B также взаимодействует с белком AKAP11 у человека. Этот белок присутствует в сперматозоидах на протяжении всего их жизненного цикла.
Бета-катенин — это белок, обнаруженный у людей и кодируемый геном CTNNB1. Исследования показывают, что мутации и сверхэкспрессия белка связаны с большим количеством раковых заболеваний человека. Эти виды рака включают рак легких, злокачественный рак молочной железы, рак яичников, рак эндометрия, рак печени и колоректальный рак.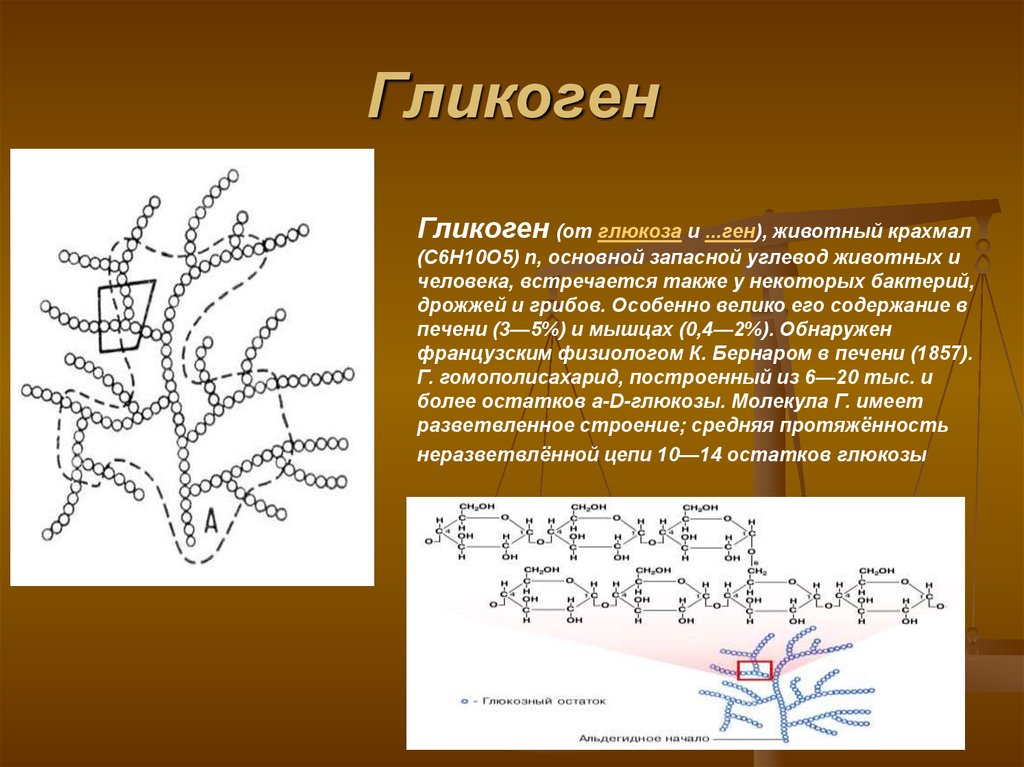 GSK3B может опасно взаимодействовать с этим белком, что может привести к образованию опухолей.
GSK3B может опасно взаимодействовать с этим белком, что может привести к образованию опухолей.
Последовательность гликоген-ассоциированной регуляторной субъединицы протеинфосфатазы 1 типа человека и анализ ее кодирующей области и уровня мРНК в мышцах пациентов с ИНСД | Диабет
Пропустить пункт назначения Nav
Оригинальные статьи| 01 октября 1994 г.
Ю Хуа Чен;
Ларс Хансен;
Мао Сян Чен;
Кристиан Бьёрбек;
Хенрик Вестергорд;
Торбен Хансен;
Патисия Т. В. Коэн;
Олуф Педерсен
Адресуйте корреспонденцию и запросы на перепечатку д-ру Олуфу Педерсену, Steno Diabetes Center, DK-2820 Gentofte, Дания.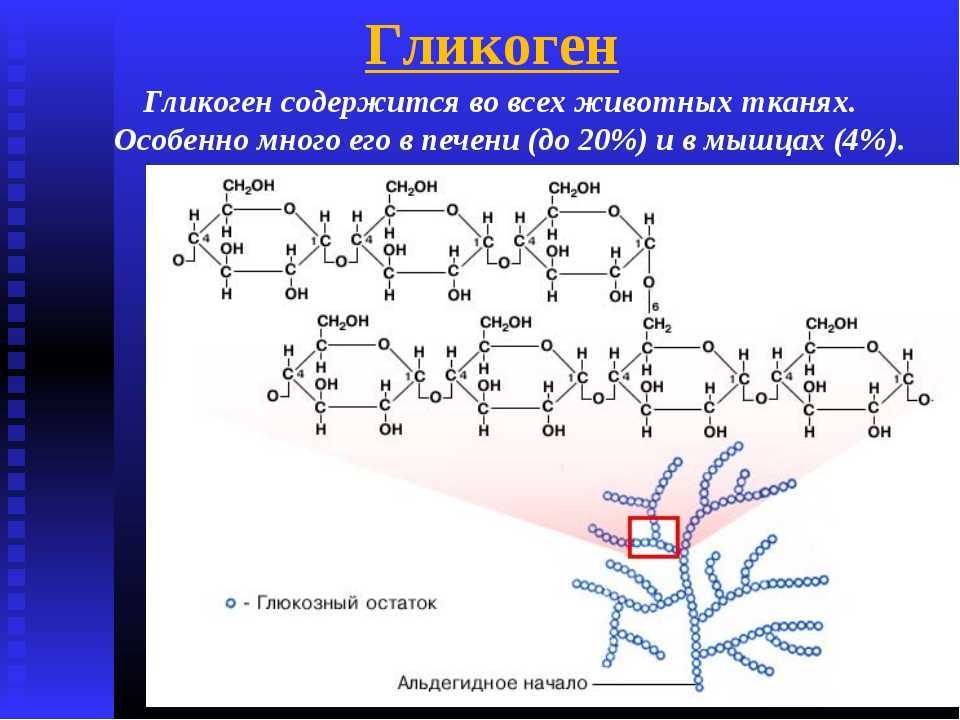
1
NIDDM, инсулиннезависимый сахарный диабет; GS, гликогенсинтаза; PP1, протеинфосфатаза типа 1; С-субъединица, каталитическая субъединица; G-субъединица, гликогенассоциированная регуляторная субъединица; PKA, протеинкиназа А; ISPK-1, инсулин-стимулируемая протеинкиназа 1; ПЦР, полимеразная цепная реакция; РИА, радиоиммуноанализ; NEFA, неэтерифицированная жирная кислота; нт, нуклеотид; kb, килобаза; dNTP, 2′-дезоксинуклеозид-5′-трифосфат; п.н., пара оснований; SSCP, одноцепочечный конформационный полиморфизм; ИМТ, индекс массы тела.
Диабет 1994;43(10):1234–1241
https://doi.org/10.2337/diab.43.10.1234
История статьи
Получено:
15 февраля 1994 г.
Пересмотр получено:
21 июня 1994 г.
Принято:
21 июня 1994 г.
- Разделенный экран
- Взгляды
- Содержание артикула
- Рисунки и таблицы
- Видео
- Аудио
- Дополнительные данные
- Экспертная оценка
- Нажмите здесь, чтобы открыть pdf в другом окне PDF для
- Делиться
- Твиттер
- MailTo
Иконка Цитировать Цитировать
Получить разрешения
Цитата
Ю Хуа Чен, Ларс Хансен, Мао Сян Чен, Кристиан Бьёрбек, Хенрик Вестергаард, Торбен Хансен, Патисия Т.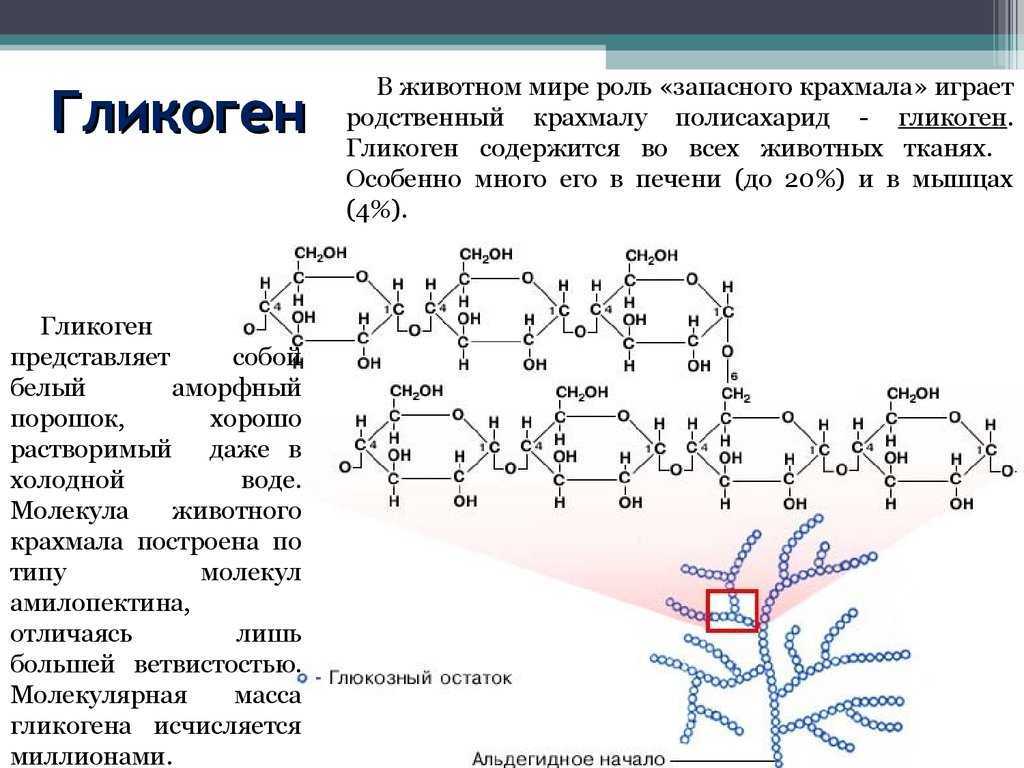 В. Коэн, Олуф Педерсен; Последовательность гликоген-ассоциированной регуляторной субъединицы протеинфосфатазы 1 типа человека и анализ ее кодирующей области и уровня мРНК в мышцах пациентов с NIDDM. Диабет 1 октября 1994 г.; 43 (10): 1234–1241. https://doi.org/10.2337/diab.43.10.1234
В. Коэн, Олуф Педерсен; Последовательность гликоген-ассоциированной регуляторной субъединицы протеинфосфатазы 1 типа человека и анализ ее кодирующей области и уровня мРНК в мышцах пациентов с NIDDM. Диабет 1 октября 1994 г.; 43 (10): 1234–1241. https://doi.org/10.2337/diab.43.10.1234
Скачать файл цитаты:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- Конечная примечание
- РефВоркс
- Бибтекс
Расширенный поиск
Нарушение инсулино-стимулированного синтеза гликогена в периферических тканях является характерным признаком многих пациентов с инсулиннезависимым сахарным диабетом (ИНСД) и их ближайших родственников с нормальной толерантностью к глюкозе, что свидетельствует о предполагаемых наследственных дефектах этого метаболического пути. В предыдущих исследованиях нам не удалось выявить мутации в кодирующих областях мышечно-специфического гена гликогенсинтазы и трех генов, кодирующих каталитические субъединицы протеинфосфатазы 1 (PP1), как частых причин резистентности к инсулину. Поскольку связанная с гликогеном регуляторная субъединица протеинфосфатазы 1 (G-субъединица PP1) играет ключевую роль в стимуляции инсулином синтеза гликогена, а активность PP1 снижена у инсулинорезистентных субъектов, мы теперь клонировали G-субъединицу человека. кДНК для поиска аномалий в соответствующем гене (обозначенном PPP1R3 в номенклатуре генома человека) у пациентов с NIDDM. кДНК человека была выделена из библиотеки кДНК скелетных мышц, и было обнаружено, что она кодирует белок массой 126 кДа, аминокислотная идентичность которого на 73% соответствует G-субъединице PP1 кролика. кДНК G-субъединицы человека от 30 пациентов с резистентным к инсулину NIDDM анализировали на наличие генетических вариаций в G-субъединице с помощью сканирования одноцепочечного конформационного полиморфизма (SSCP) обратно транскрибируемой мРНК.
В предыдущих исследованиях нам не удалось выявить мутации в кодирующих областях мышечно-специфического гена гликогенсинтазы и трех генов, кодирующих каталитические субъединицы протеинфосфатазы 1 (PP1), как частых причин резистентности к инсулину. Поскольку связанная с гликогеном регуляторная субъединица протеинфосфатазы 1 (G-субъединица PP1) играет ключевую роль в стимуляции инсулином синтеза гликогена, а активность PP1 снижена у инсулинорезистентных субъектов, мы теперь клонировали G-субъединицу человека. кДНК для поиска аномалий в соответствующем гене (обозначенном PPP1R3 в номенклатуре генома человека) у пациентов с NIDDM. кДНК человека была выделена из библиотеки кДНК скелетных мышц, и было обнаружено, что она кодирует белок массой 126 кДа, аминокислотная идентичность которого на 73% соответствует G-субъединице PP1 кролика. кДНК G-субъединицы человека от 30 пациентов с резистентным к инсулину NIDDM анализировали на наличие генетических вариаций в G-субъединице с помощью сканирования одноцепочечного конформационного полиморфизма (SSCP) обратно транскрибируемой мРНК.

