Применение АТФ-люминометров в медицинских организациях
Товары
Люминометр SystemSure Plus с поверкой
127200.00
Люминометр EnSure с поверкой
147600.00
Контроль биологической чистоты с использованием АТФ-люминометров широко применяется на эпидемиологически значимых объектах, на предприятиях пищевой отрасли, общественного питания и лечебно-профилактических учреждениях.
В медицинских учреждениях вопрос контроля чистоты приобретает огромное значение, поскольку во время медицинских процедур и в течение пребывания пациентов в стационарах и поликлиниках, на различные поверхности, медицинские инструменты, оборудование и предметы ухода могут попасть биологические жидкости, которые содержат патогенные и условно патогенные микроорганизмы. При недостаточном уровне чистоты это может повлечь распространение различных инфекций.
При недостаточном уровне чистоты это может повлечь распространение различных инфекций.
Обеспечение чистоты в медицинских учреждениях регламентируется СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность».
В медицинских учреждениях может проводиться генеральная или ежедневная поддерживающая влажная уборка с использованием профессиональных моющих и дезинфицирующих средств. Помимо этого регулярно обрабатываются все медицинские инструменты и оборудование. В результате этого значительно снижается микробная обсемененность внутрибольничной среды и снижается возможность возникновения очагов инфекций.
Как правило, тщательность уборки и дезинфекции контролируют с помощью стандартных бактериологических исследований, которые позволяют выявить санитарно-показательные микроорганизмы (стафилококк, кишечную палочку, сальмонеллу и т.д.) и определить общую микробную обсемененность предметов и поверхностей. Такие исследования требуют наличия собственной микробиологической лаборатории, что могут себе позволить не все лечебно-профилактические учреждения.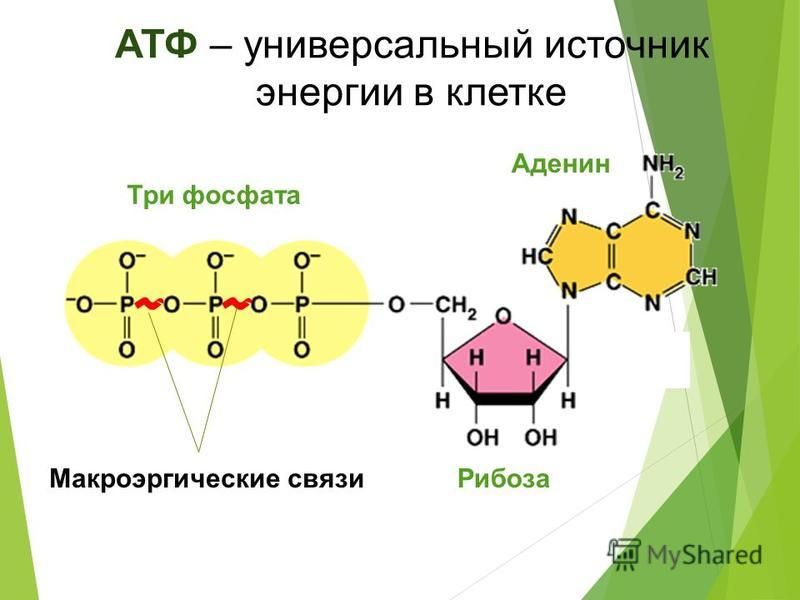
Современным методом контроля чистоты, не требующим оборудования полноценной лаборатории, является применение АТФ-люминометров, например модели SystemSURE Plus, разработанной компанией Hygiena.
Принцип работы люминометра основан на химической реакции, которая вызывается при попадании молекул АТФ (аденозинтрифосфата), содержащихся в патогенных микроорганизмах, на питательную среду, которая находится внутри АТФ-теста. При этом молекуулы начинуют испускать свечение, сила которого оценивается люминометром и переводится в числовые показатели. Свечение оценивается в RLU, которые позволяют определить уровень биологического загрязнения образца. Чем выше свечение, тем выше RLU, и тем больше микробная обсемененность объекта.
Чтобы получить образец для исследования, используют специальные АТФ-тесты. они представляют собой стерильные пробирки с реагентом и предувлажненными тампонами для забора смыва с поверхности. Смыв отбирают перекрестными вращательными движениями с достаточным нажимом на тампон, таким образом, чтобы были задействованы все его поверхности.
После этого тампон помещают в пробирку, плотно завинчивают крышку, надламывают клапан АТФ-теста и выдавливают реагент в пробирку. После этого активированный тест помещают в люминометр. Реакция биолюминесценции начинается моментально, поэтому результаты можно оценивать в режиме реального времени. При этом необходимо учитывать, что свечение могут излучать не только патогенные микроорганизмы, но и молекулы любых других органических загрязнений. Поэтому уровень RLU может быть выше, чем реальный уровень микробной обсемененности.
Но даже в этом случае, если высокий RLU обусловлен остаточным АТФ, результаты исследования будут свидетельствовать о некачественной обработке предмета или поверхности, что недопустимо для лечебно-профилактического учреждения.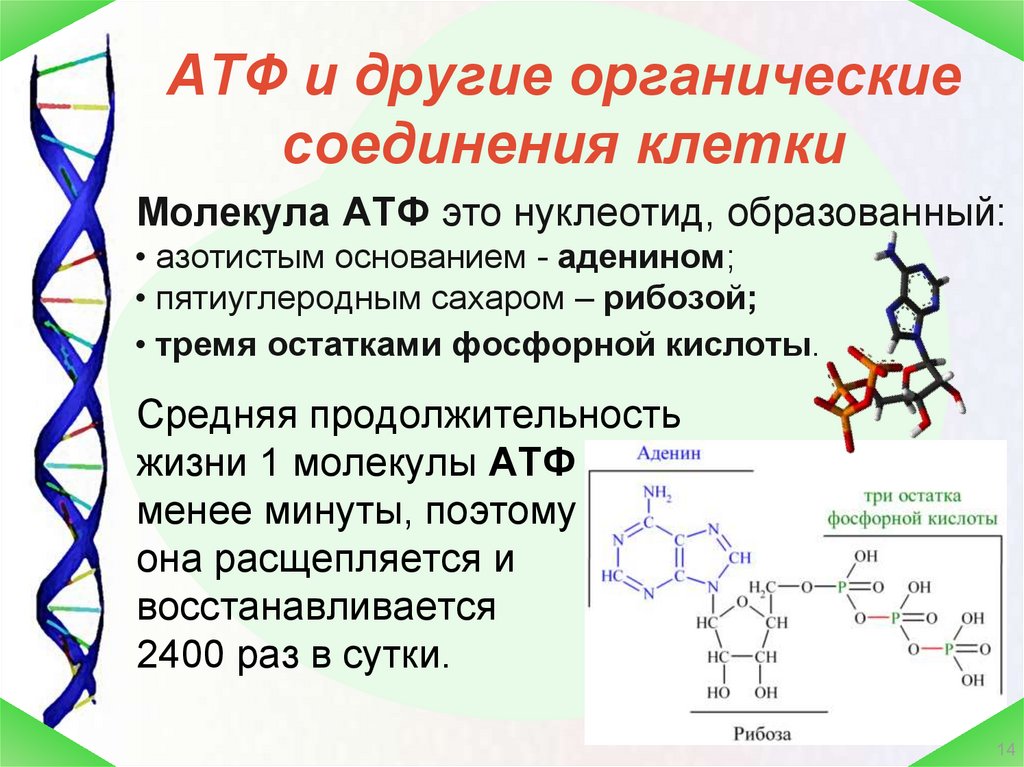 Такие загрязнения служат питательной средой для размножения болезнетворных бактерий.
Такие загрязнения служат питательной средой для размножения болезнетворных бактерий.
Существуют исследования, которые подтверждают связь степени биологической нагрузки с количеством микробных клеток в исследуемых образцах.
Так, концентрация микробных клеток 1,5 × 105 может быть сопоставима с показателем 400–500 RLU и более, содержание в образце от 1 до 150 клеток соответствует 0–100 RLU. При оценке биологической загрязненности объектов больничной среды производители люминометров рекомендуют использовать следующие пороговые значения: 0–25RLU —тест пройден, поверхность чистая, 26–50 RLU — тест пройден условно, данную поверхность следует обрабатывать более тщательно, >50 RLU — тест не пройдет, поверхность недостаточно чистая.
Контрольные значения при работе с АТФ-люминометром могут быть определены специалистами медицинской организации самостоятельно опытным путем. Для этого с каждого контролируемого объекта после тщательной обработки отбирают смывы. Процедуру проводят не менее 10 раз. Среднее значение RLU будет являться верхней границей пороговой отметки. В случае получения неудовлетворительного результата АТФ-теста следует провести корректирующие мероприятия. Объект обрабатывается повторно, а персонал, участвовавший в обработке, должен пройти повторное обучение по проведению санитарно-противоэпидемических мероприятий и уборочных работ.
Среднее значение RLU будет являться верхней границей пороговой отметки. В случае получения неудовлетворительного результата АТФ-теста следует провести корректирующие мероприятия. Объект обрабатывается повторно, а персонал, участвовавший в обработке, должен пройти повторное обучение по проведению санитарно-противоэпидемических мероприятий и уборочных работ.
С помощью люминометрии удобно контролировать качество генеральных уборок в медицинских учреждениях. Для этого отбираются образцы с поверхностей, с которыми чаще всего контактируют пациенты — кнопки лифта, дверные ручки, перила, стулья в коридорах, клавиатуры компьютеров на сестринских постах и т.д.
Также этим методом удобно контролировать качество обработки медицинских инструментов перед стерилизацией.
Люминометрия применяется и для оценки качества обработки рук медицинским персоналом. При правильной обработке рук показатель всегда будет ниже 100 RLU, чаще всего до 60 RLU. При проверке качества обработки рук также проверяется чистота раковина, кранов, дозаторов жидкого мыла и антисептика и т. д. Поскольку кожа является живым органом достичь нулевого показателя невозможно.
д. Поскольку кожа является живым органом достичь нулевого показателя невозможно.
АТФ-люминометр необходим для контроля чистоты на пищеблоке медицинской организации.
Люминометры помогают оценить чистоту мытья фруктов, овощей и другого сырья, используемого для приготовления питания.
Посуда, используемая для питания пациентов также подлежит регулярному контролю. использованная посуда после удаления остатков пищи моется с обезжиривающими средствами, после чего ополаскивается горячей водой.
Некачественно вымытая посуда может стать источником распространения инфекционных заболеваний и вызывать внутрибольничные вспышки инфекций. Недостаточно тщательно удаленные остатки пищи с посуды, столовых приборов и щеток для их мытья служат благоприятной средой для разрастания колоний патогенных микроорганизмов.
АТФ-люминометры используются при реализации программ производственного контроля и внутреннего аудита качества, в рамках инфекционного контроля в медицинской организации, а также в ходе проверок отделений эпидемиологической службой или администрацией учреждения. В медицинских организациях, где внедрена объективная система мониторинга с применением люминометрии, уборки проводятся на 42 % более эффективно. Прибор позволяет выявлять дефекты при проведении уборочных работ, обработке и дезинфекции инструментов и оборудования, проводить образовательные и обучающие мероприятия для медицинского персонала.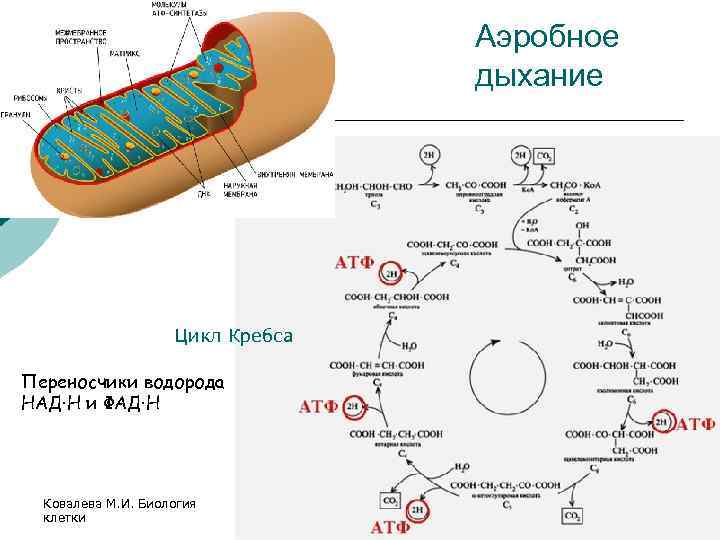
Преимущества использования АТФ-люминометрии в медицинских учреждениях очевидны. Этот метод позволяет в сжатые сроки оценивать степень санитарной чистоты поверхности, качество проведенной уборки и оперативно проводить корректирующие мероприятия при необходимости. Также он помогает оценить качество работы персонала службы клининга лечебно-профилактического учреждения и выявить проблемные зоны и критические точки, которые очищаются недостаточно тщательно.
С помощью АТФ-люминометрии можно оценить эффективность используемых моющих и дезинфицирующих средств и сэкономить время и бюджет, которые затрачиваются на проведение классического микробиологического контроля. В целом, этот метод позволяет обеспечить пациенту безопасное пребывание в медицинском учреждении и исключить распространение инфекций в его стенах.
Люминометр прост в применении, поэтому может использоваться любым сотрудником учреждения после кратковременного обучения. Обычно это поручают сестринскому и младшему медицинскому персоналу.
Компания “НоваСнаб” предлагает все необходимое для организации контроля чистоты с помощью АТФ-люминометра в медицинских учреждениях. В нашем ассортименте есть самые популярные модели люминометров надеждного производителя “Hygiena” и все виды тестов к ним — для определения чистоты поверхностей и воды.
Наши менеджеры проконсультируют по любым вопросам, которые могут возникнуть в процессе и после приобретения у нас этого оборудования, а также обучат ваш персонал ежедневному использованию люминометрии в вашем учреждении и способам налаживания постоянного мониторинга санитарной чистоты поверхностей, медицинского оборудования и инструментов, посуды, столовых приборов и рук персонала.
Также выбирайте: Тесты для люминометра
синтаза | это… Что такое АТФ-синтаза?
Молекулярная модель АТФ-синтазы
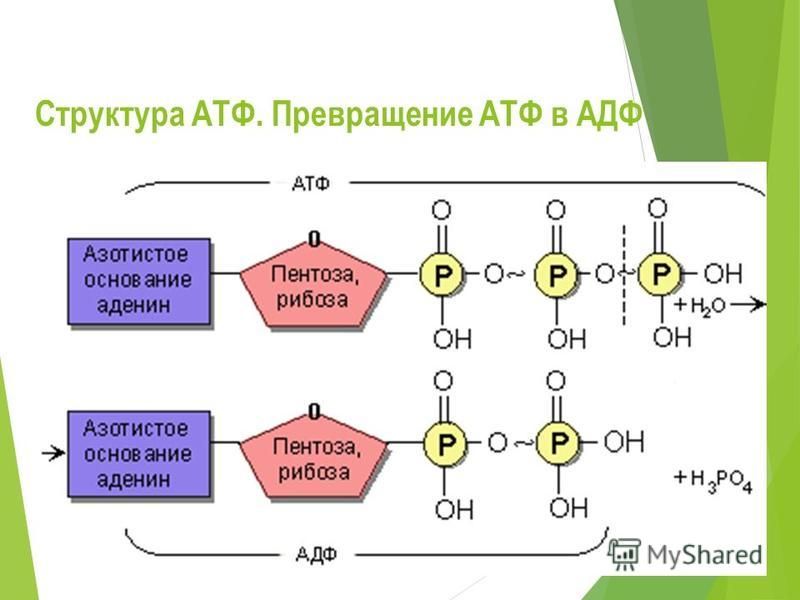
Аденозинтрифосфатсинта́за (АТФ-синта́за) — класс ферментов, синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов. Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
- АДФ + Фн → АТФ + H2O
АТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ относится к так называемым макроэргическим соединениям, при гидролизе которых происходит освобождение значительного количества энергии.
Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы.
Содержание
|
Структура и номенклатура
Имеющаяся в митохондриях АТФ-синтаза F1FO очень хорошо исследована.
- компонент FO — трасмембранный домен,
- компонент F1 находится вне мембраны, в матриксе.
АТФ-синтазный комплекс FOF1 по форме напоминает плодовое тело гриба, у которого компонент F1 — это шляпка, ножка — это γ-субъединица компонента F1, а «корни» гриба — компонент FO, заякоренный в мембране.
В структурно-функциональном плане АТФ-синтетаза состоит из двух крупных фрагментов, обозначаемых символами F1 и FO. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°.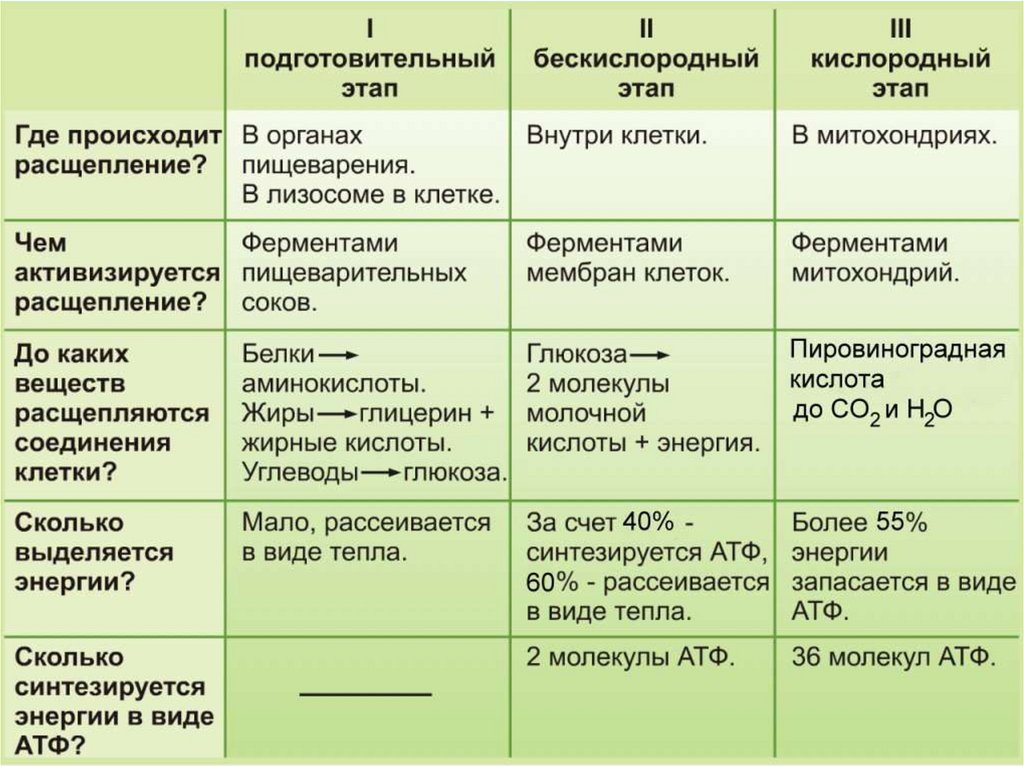 В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтетазы, называемая фактором сопряжения FO, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода (ядер протия). Всего в состав комплекса FO входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону FO субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону FO субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Номенклатура фермента имеет традиционное происхождение, поэтому довольно непоследовательна.
Обозначение компонента F1 является сокращением от «Fraction 1» (часть 1), а символом FO (в индексе записана буква O, а не ноль) обозначался участок связывания олигомицина.
Некоторые субъединицы фермента имеют также буквенные обозначения:
- Греческие: α, β, γ, δ, ε
- Латинские: a, b, c, d, e, f, g, h
Другие — более сложные обозначения:
- F6 (от «Fraction 6»)
- OSCP — белок, чувствительный к олигомицину (от англ. the oligomycin sensitivity conferral protein), ATP5O
- A6L (названный так по названию гена, кодирующего его в митохондриальном геноме)
- IF1 (фактор ингибирования 1), ATPIF1
Компонент F1 достаточно велик (диаметр его составляет 9 нм), чтобы быть видимым в трансмиссионный электронный микроскоп при негативном окрашивании[1].
Частичками F1 усеяна внутренняя митохондриальная мембрана. Изначально считалось, что они содержат весь дыхательный аппарат митохондрии. Однако после долгих экспериментов группа Эфраима Рекера (впервые выделившая компонент F1 в 1961) показала, что эти частички связаны с АТФазной активностью в том числе и в разделённых митохондриях, и в субмитохондриальных частицах, формирующихся при ультразвуковом воздействии на митохондрии. Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
Модель синтеза АТФ: механический катализ
В 60—70 годах XX века Пол Бойер предположил, что синтез АТФ связан с изменениями конфигурации АТФ-синтазы, вызываемыми вращением γ-субъединицы, так называемый механизм изменения участка связывания («перевёртыш», англ. flip-flop). Исследовательской группе под руководством Джона Э. Уокера, относившейся тогда к Лаборатории молекулярной биологии в Кембридже, удалось выделить АТФ-синтазный каталитический комплекс F1 в кристаллической форме. На тот момент это была самая крупная из известных науке асимметричная белковая структура. Ее исследования показали, что модель вращающегося катализа, предложенная Бойером, соответствует действительности. За это открытие Бойер и Уокер получили половину Нобелевской премии по химии в 1997 году. Вторую половину получил Йенс Кристиан Скоу «за первое открытие фермента, осуществляющего транспорт ионов — Na+,K+-аденозинтрифосфатазы».
Механизм действия АТФ-синтазы. АТФ показан красным, АДФ и фосфат — розовым, вращающаяся субъединица γ — черным.
Кристалл F1 состоит из перемежающихся α- и β-субъединиц (по 3 каждого вида), расположенных как дольки апельсина вокруг асимметричной γ-субъединицы. В соответствии с принятой моделью синтеза АТФ (также называемой моделью непостоянного катализа), градиент электрического поля, направленный поперёк внутренней митохондриальной мембраны и обусловленный электронной транспортной цепочкой, заставляет протоны проходить сквозь мембрану через АТФ-синтазный компонент FO. Часть компонента FO (кольцо из c-субъединиц) вращается, когда протоны проходят через мембрану. Это c-кольцо жёстко связано с асимметричной центральной ножкой (состоящей в основном из γ-субъединицы), которая в свою очередь вращается внутри α3β3-участка компонента F1. Это приводит к тому, что три участка катализа, связывающиеся с нуклеотидами, претерпевают изменения в конфигурации, приводящие к синтезу АТФ.
Основные субъединицы (α3β3) компонента F1 соединены дополнительной боковой ножкой с неподвижным участком FO, что предотвращает их вращение вместе с γ-субъединицей. Структура неповрёжденной АТФ-синтазы с низкой точностью выявлена при помощи электронной криомикроскопии (ЭКМ). Показано, что боковая ножка — это гибкая перемычка, похожая на канат, наматывающаяся на комплекс во время его работы.
При каждом обороте γ-субъединицы на 3600 синтезируются три молекулы АТФ, При этом, видимо, у разных организмов из межмембранного пространства в матрикс проходит от 10 до 14 протонов — по числу с-субъединиц[2].
В определённых условиях каталитическая реакция может протекать в обратном направлении, при этом гидролиз АТФ вызывает прокачку протонов через мембрану.
В механизме изменения участка связывания задействован активный участок β-субъединицы, последовательно проходящий через три состояния[3].
В «открытом» состоянии АДФ и фосфат подходят к активному участку. Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется.
Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется.
Физиологическое значение
Как и у многих других ферментов, действие АТФ-синтазы F1FO обратимо. Большие концентрации АТФ заставляют её расщеплять АТФ и создавать трансмембранный протонный градиент. Такое использование АТФ-синтазы отмечено у анаэробных бактерий, не имеющих электронной транспортной цепочки. Эти бактерии применяют гидролиз АТФ для создания протонного градиента, который задействован в движении жгутиков и клеточном питании.
У аэробных бактерий в нормальных условиях АТФ-синтаза, как правило, работает в обратном направлении, производя АТФ за счёт энергии электрохимического потенциала, создаваемого электронной транспортной цепочкой. В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
КПД АТФ-синтазы близок к 100%[4].
АТФ-синтаза у разных организмов
АТФ-синтаза растений
У растений АТФ-синтаза CF1FO присутствует в хлоропластах. Она встроена в мембрану тилакоида, причём компонент CF1 выступает в строму, где протекают реакции тёмного фотосинтеза (также называемые светонезависимыми реакциями Кальвиновского цикла). Структура и механизм катализа АТФ-синтазы хлоропластов почти такая же, как и в митохондриях. Однако электрохимический потенциал у хлоропластов формируется не дыхательной электротранспортной цепочкой, а фотосинтетическими белками.
АТФ-синтаза
E. coliАТФ-синтаза кишечной палочки — самая простая из всех известных АТФ-синтаз.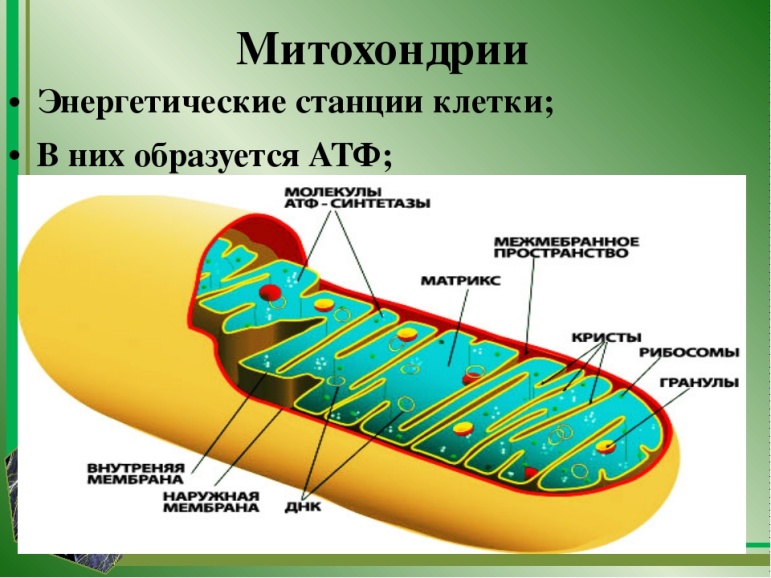 Она состоит всего из 8 видов субъединиц.
Она состоит всего из 8 видов субъединиц.
АТФ-синтаза дрожжей
Напротив, АТФ-синтаза дрожжей — самая сложная из известных. Она состоит из 20 различных видов субъединиц.
Эволюция АТФ-синтазы
Эволюция АТФ-синтазы считается примером модульной эволюции, при которой две субъединицы, каждая обладающая своими функциями, соединились и получили новые функции.
Гексамер α3β3, входящий в состав компонента F1 проявляет существенное сходство с гексамерной ДНК-геликазой. Оба типа ферментов образуют кольцо с вращательной симметрией 3 порядка, обладающее центральной пóрой. Действие каждого из них также зависит от относительного вращения макромолекулы внутри поры: геликазы используют спиральную форму ДНК для движения вдоль неё и для обнаружения суперскручивания, тогда как α3β3-гексамер использует изменения своей конфигурации из-за вращения γ-субъединицы для осуществления каталитической реакции.
Протонный мотор компонента FO проявляет большое функциональное сходство с протонными моторами жгутиков. И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счёт энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счёт энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
Теория молекулярной эволюции предполагает, что две субъединицы с независимыми функциями — ДНК-геликаза с дополнительным АТФ-азным действием и протонный мотор — смогли соединяться, причём вращение мотора вызывало проявление АТФ-азной активности геликазы. Или же, наоборот, в первичной связке ДНК-геликазы и протонного мотора гидролиз АТФ на геликазе заставлял работать протонный мотор. Это соединение затем постепенно оптимизировалось, получило возможность катализировать обратную реакцию и через какое-то время превратилось в сложную АТФ-синтазу, существующую в настоящее время. Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
См. также
- Окислительное фосфорилирование
- Митохондрия
- Хлоропласт
- Дыхательная электронтранспортная цепь
- Протонный насос
- Аденозинтрифосфатазы
Примечания
- ↑ Fernandez-Moran et al., Journal of Molecular Biology, Vol 22, p 63, 1962
- ↑ Протонный градиент АТФ-синтетазы (англ.)
- ↑ Gresser MJ, Myers JA, Boyer PD (1982). «Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model». J. Biol. Chem. 257 (20): 12030–8. PMID 6214554.
- ↑ K. Kinosita, Jr. R. Yasuda, H. Noji, K. Adachi. А rotary molecular motor that can work at near 100% efficiency.
 Philos Trans R Soc Lond B Biol Sci. 2000 April 29; 355(1396): 473—489.
Philos Trans R Soc Lond B Biol Sci. 2000 April 29; 355(1396): 473—489.
Литература
- Ю. М. Романовский, А. Н. Тихонов Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза — вращающийся молекулярный мотор (рус.) // УФН. — 2010. — Т. 180. — С. 931—956.
Ссылки
- «АТФ-синтаза — чудесная молекулярная машина» (англ.)
- Хорошо проиллюстрированная лекция об АТФ-синтазе, прочитанная Энтони Крофтсом в Университете Иллинойса в Урбана-Шампен (англ.)
- Протонные и натриевые насосы-АТФазы типа F, V и A в базе данных OPM (англ.)
- Нобелевская премия по химии за 1997 год, присуждённая Полу Д. Бойеру и Джону Э. Уокеру за открытие ферментного механизма синтеза АТФ, и Йенсу К. Скоу за открытие ионно-транспортного фермента Na+, K±АТФазы (англ.)
- Harvard Multimedia Production Site — видеоролик, показывающий синтез АТФ
полевых офисов в Северной Каролине | Бюро по алкоголю, табаку, огнестрельному оружию и взрывчатым веществам
Español
По вопросам или информации, касающимся , обращайтесь в отраслевые подразделения:
- Лицензии на огнестрельное оружие (FFL) или взрывчатые вещества (FEL)
- Кража или утеря огнестрельного оружия лицензиата
- Пулеметы, глушители или другое оружие NFA
- Огнестрельное оружие, боеприпасы и другие вопросы импорта
- Перевозка огнестрельного оружия
- Надлежащая продажа/покупка/передача огнестрельного оружия, боеприпасов или взрывчатых веществ
- Прочие вопросы по огнестрельному оружию/взрывчатым веществам
Asheville Satellite Office (Industry Operations)
Veach-Baley Federal Complex
151 Patton Avenue, Room 255
Asheville, North Carolina 28801
USA View Map
Голос: (828) 0 900 09070 6 (828 ) 271-4041
Charlotte Group III (Промышленные операции)
Районный супервайзер
3600 Arco Corporate Drive, Suite 500
Шарлотта, Северная Каролина 28273
США 5 Голос: 1 Посмотреть карту 06 (704) 716-1830 Факс : (704) 716-1831
Fayetteville Satellite Office (Промышленные операции)
225 Green Street, Suite 300
Fayetteville, North Carolina 28301
USA View Map
: Voice
:0006 (910) 483-3030 Факс: (910) 323-2258
Greensboro Group II (Промышленные операции)
Комната супервайзера 180144 041 Гринсборо, Северная Каролина 27407
США Просмотреть карту
Голос: (336) 235-4950 Факс: (336) 235-4951
Raleigh Satellite Office (Industry Operations of Suites of
35 Neuse Falls Road) 470002Роли, Северная Каролина 27609
USA View Map
Телефон: (919) 719-2021 Факс: (919) 719-2022
Офис Wilmington Satellite (Industry Operations Suites), Cbreth 5 Dreth 2
1900 00Уилмингтон, Северная Каролина 28403
USA View Map
Телефон: (910) 343-6801 Факс: (910) 343-6827
- Предположительно незаконно хранение/продажа/покупка огнестрельного оружия
- Предполагаемая преступная деятельность, связанная со взрывчатыми веществами, табаком или поджогом
- Любые другие вопросы правоохранительных органов
Asheville Satellite Office
Veach-Baley Federal Complex
151 Patton Avenue, Room 255
Asheville, North Carolina 28801
USA View Map
271-4041
Charlotte Groups
3600 Arco Corporate Drive, Suite 500
Charlotte, North Carolina 28273
USA Просмотреть карту
Группа I
Руководитель группы
Голос: (704) 716-1810 Факс:
Руководитель группы
Голос: (704) 716-1820 Факс: (704) 716-1821
Группа IV
Руководитель группы
Голос:6 9 0 0 8 7 (16–1704) Факс:
(704) 716-1841
Полевой офис в Фейетвилле
Ответственный агент-резидент
225 Green Street, Suite 300
Fayetteville, North Carolina 28301
USA Просмотреть карту
Greensboro Group I
Ответственный представитель-резидент
1801 Stanley Road, Room 300
Greensboro, North Carolina 27407
USA View Map
235-4901
Полевой офис в Роли
Ответственный агент-резидент
4700 Falls of Neuse Road, Suite 395
Raleigh, North Carolina 27609
USA View Map
(919) 719-2022
Полевой офис в Уилмингтоне
Ответственный агент-резидент
1205 Culbreth Dr.