Исследовательский проект «Белковая форма жизни и выявление яичного белка альбумина» • Наука и образование ONLINE
Главная Работы на конкурс Предметное образование Естественно-научные дисциплины Исследовательский проект «Белковая форма жизни и выявление яичного белка альбумина»
Автор: Утебов Максим Сергеевич
Место работы/учебы (аффилиация): МБОУ г. Астрахани «Лицей №3», 10 класс
Научный руководитель: Чичирова Ольга Павловна
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком
вызвано наличием у белка определённых функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности. На долю белка приходится не менее 50% сухой массы органических соединений животной клетки. В каждой клетке находится более 3 000 молекул белков. В человеческом организме насчитывается выше 10 млн. белков. Функционирование белка служит прототипом важнейших процессов жизнедеятельности организма. Размен веществ (пищеварение, дыхание и др.), мышечное сокращение, сердитая проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов высокоспецифичных катализаторов биохимических реакций, являющихся белками. Базу костной и соединительной тканей, роговых образований сочиняют структурные белки. Они же сформировывают остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при разделении клеточки, работа мускул осуществляются по единичному механизму при посредстве белков сократительной системы. Белки оберегают организм от инфекции. Контакты клеточки с внешней средой делают разнородные белки, умеющие различать форму молекул, регистрировать температурные конфигурации, ничтожные примеси веществ, отличать один цвет от иного.
белков. Функционирование белка служит прототипом важнейших процессов жизнедеятельности организма. Размен веществ (пищеварение, дыхание и др.), мышечное сокращение, сердитая проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов высокоспецифичных катализаторов биохимических реакций, являющихся белками. Базу костной и соединительной тканей, роговых образований сочиняют структурные белки. Они же сформировывают остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при разделении клеточки, работа мускул осуществляются по единичному механизму при посредстве белков сократительной системы. Белки оберегают организм от инфекции. Контакты клеточки с внешней средой делают разнородные белки, умеющие различать форму молекул, регистрировать температурные конфигурации, ничтожные примеси веществ, отличать один цвет от иного.
Актуальность. Белки являются одними из четырех основных органических веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но по своему значению и
биологическим функциям они занимают в ней особое место.
Цель: выяснение роли белков в органическом мире, в жизни человека. Изучение и экспериментальное получение белка альбумина.
Теоретическая значимость работы: рассмотрение, изучение темы «Белковая форма жизни» и выявление яичного белка альбумина»; выяснение роли белков в органическом мире, в жизни человека.
Практическая значимость работы: изучение теоретического материала по данной теме и проведение практической части, в котором я проведу опыт, эксперимент, связанный с видимым проявлением яичного белка альбумина.
Задачи:
- Проанализировать имеющиеся литературные источники и информационные ресурсы по объекту исследования.
- Выяснить, что такое белки, и каково их строение, функции и свойства.
- Провести эксперимент по определению состава и свойств белка.
- Сделать вывод о проделанной работе.
Метод исследования: теория, эксперимент, наблюдение.
Объект исследования — куриный белок.
Проект «Влияние погоды на настроение и успеваемость учащихся»
Доступна к просмотру полнотекстовая версия работы
От настроения многое зависит в нашей жизни. Если оно зависит от погоды, то нужно попробовать строить планы, учитывая погодные условия, чтобы отрицательный заряд не повлиял на продуктивность учебной деятельности. В нашей стране довольно часто и иногда…
Посмотреть работу
Исследовательская работа «Алое — удивительное растение наших подоконников»
Доступна к просмотру полнотекстовая версия работы
Цель: исследование комнатного растения алоэ и использование его в качестве лекарственного средства в жизни человека. Задачи: Исследовать 3 родственных вида алоэ: агава, алоэ-Вера, алоэ древовидное. Выявить целебные свойства данных растений. Выяснить…
Выяснить…
Посмотреть работу
Исследовательский проект «Биоразлагаемые полимеры — упаковка будущего»
Доступна к просмотру полнотекстовая версия работы
Актуальность проекта обусловлена тем, что упаковка из полимеров является эстетичной, удобной и дешевой, поэтому нет смысла ожидать её замены на другие материалы. Но использованные полимерные упаковки выбрасываются на свалки и у мест проживания челове…
Посмотреть работу
Исследовательский проект «Съедобная кормушка»
Доступна к просмотру полнотекстовая версия работы
Зима – очень тяжелое время года для птиц. Холодно и голодно им. Из-за холода птицы теряют много тепла. Как же им согреться? Для того чтобы согреться птицам необходимо много есть, и еды им нужно зимой намного больше чем летом. Поиск еды – главное заня…
Посмотреть работу
Мероприятие завершено
Альбумин — важный белок сыворотки крови
Альбумин (ALB) – белок плазмы крови, который выполняет большое количество важных функций. Он участвует в процессах метаболизма, переносит по организму ряд химических веществ и прочее. Определение уровня этого белка играет важную роль в оценке состояния печени. ALB составляет примерно 60% от общего количества белка.
Он участвует в процессах метаболизма, переносит по организму ряд химических веществ и прочее. Определение уровня этого белка играет важную роль в оценке состояния печени. ALB составляет примерно 60% от общего количества белка.
Биохимический анализ: альбумин
Поддержание оптимального уровня этого белка крайне важно для функционирования организма в целом. От этого зависит объем крови, циркулирующей в организме. Кроме того, белок отвечает за регулирование осмотического давления. Этот показатель меняется под влиянием многих факторов (например, после употребления соленых продуктов). Поэтому его регулирование является очень важным процессом. Альбумин также отвечает за транспортировку и хранение многих биологических соединений и аминокислот. При обследовании состояния здоровья уровень ALB является одним из ключевых показателей.
Кому необходимо сдать анализ
Анализ крови на альбумин используется в комплексе с данными других исследований при диагностике многих заболеваний. Чаще всего анализ назначается при подозрении на патологии почек и печени. Также его результаты используют для оценки состояния здоровья пациентов с онкологическими диагнозами, обширными травмами или ожогами. Тест назначается самостоятельно или в комплексе с другими анализами. Состав необходимого в конкретном случае обследования определяется врачом на основании жалоб пациента, результатов осмотра, анамнеза.
Чаще всего анализ назначается при подозрении на патологии почек и печени. Также его результаты используют для оценки состояния здоровья пациентов с онкологическими диагнозами, обширными травмами или ожогами. Тест назначается самостоятельно или в комплексе с другими анализами. Состав необходимого в конкретном случае обследования определяется врачом на основании жалоб пациента, результатов осмотра, анамнеза.
Интерпретация результатов
Альбумин синтезируется в печени. В норме за сутки вырабатывается примерно 15 грамм белка. Он сохраняется в организме и выполняет свои функции в течение нескольких недель. Основное назначение данного теста – оценка белково-синтетической функции печени.
Повышение показателей свидетельствует об обезвоживании организма. Причины дегидратации могут быть разными (например, серьезные ожоги). Также высокий уровень ALB может указывать на наличие инфекции и ряд других заболеваний. Для их точной диагностики в обязательном порядке проводится дополнительное обследование.
Недостаток белка в большинстве случаев указывает на патологии почек. Также он может наблюдаться при наличии воспалительного процесса. Снижение показателей во время беременности является нормой. Референсные значения зависят от возраста пациента. Для взрослых норма колеблется в пределах 35-52 г/л. По результатам теста можно судить о степени тяжести ряда заболеваний.
Выводы
Количество ALB требуется для диагностики ряда заболеваний, выбора оптимальной тактики лечения. Оно характеризует обмен веществ, состояние здоровья в целом. При выраженных симптомах проблем с почками данный тест назначается в первую очередь. Также он может проводиться в составе комплексного обследования либо после него, если выявлены отклонения и необходимо уточнить их характер и причину. Интерпретация результатов может выполняться только врачом, для самодиагностики тест не предназначен. В некоторых случаях возможны отклонения от нормы при отсутствии заболеваний.
Казеин, овальбумин и коллаген: структура и функция
| ✅ Тип бумаги: Бесплатное эссе | |
| ✅ Количество слов: 1855 слов | ✅ Опубликовано: 24 мая 2018 г. |
Ссылка на это
Поделись этим: Фейсбук Логотип Facebook Твиттер Логотип Твиттера Реддит Логотип Reddit LinkedIn Логотип LinkedIn WhatsApp Логотип WhatsApp
Введение
Белки представляют собой очень важные сложные молекулы, которые выполняют важные биологические функции в клетках, наиболее важных для жизни (рост, восстановление, регенерация и т. д.). Белки представляют собой полимеры, состоящие из аминокислот (строительных блоков), которые отличаются от других молекул содержанием азота и связаны пептидными связями. Структура белка зависит от аминокислотной последовательности (первичная структура), которая определяет конформацию молекулы (вторичная и третичная структуры). Аминокислоты очень хорошо растворимы, из-за присутствия в них кислорода и азота очень электроотрицательны (аминокислоты легко переносятся в водном состоянии). Белки также могут встречаться в виде четвертичных структур. Первичная структура дает линейную последовательность аминокислот в полипептидной цепи, в то время как вторичная структура показывает расположение цепи в пространстве (полипептидная цепь свернута в спираль или спираль, чтобы иметь трехмерную структуру, альфа-спираль).
В этом эссе я начну с обсуждения структуры белков и перейду к обсуждению их функций. Будут использованы три основных примера белков; казеин, овальбумин и коллагеновый белок.
Структура белков
Первичная структура белка определяет ключевое место, называемое активным центром, областью, связанной с первичной активностью белка, даже если она часто состоит из небольшого числа остатков. Следовательно, уникальная линейная последовательность аминокислот в полипептидной цепи определяет первичную структуру белка. Первичная структура состоит из различных аминокислот, соединенных пептидными связями.
Получите помощь в написании эссе
Если вам нужна помощь в написании эссе, наша профессиональная служба написания эссе всегда готова помочь!
Служба написания эссе Вторичная структура составляет 60% структуры белка, состоящей из конформации альфа-спирали или бета-цепи (пластов). Это наиболее распространенная спиральная структура белков, образующая правую спираль (правостороннее расположение). На каждый виток альфа-спирали приходится 3,6 аминокислоты. Эта спиральная структура локально стабилизирована водородной связью, которая возникает между группой C=O одной аминокислоты и группой NH четвертой аминокислоты в цепи, дисульфидной связью, притяжением между положительными и отрицательными зарядами, а также гидрофобным и гидрофильным радикалом, которые ответственны за для устойчивости конструкции. Все аминокислоты в полипептидной цепи имеют L-конфигурацию, которая может привести к стабильной спирали, если она имеет правостороннюю структуру. В отличие от белков овальбумина, белки казеина не взаимодействуют внутримолекулярно с третичной структурой. Локальные взаимодействия могут происходить внутри молекулы в бета-слое, но взаимодействия между отдаленными частями той же молекулы не происходит. Молекула имеет гидрофобное ядро. В β-складке конформация представляет собой линейную пептидную цепь и стабилизируется за счет водородных связей с соседними параллельными цепями того же типа.
Это наиболее распространенная спиральная структура белков, образующая правую спираль (правостороннее расположение). На каждый виток альфа-спирали приходится 3,6 аминокислоты. Эта спиральная структура локально стабилизирована водородной связью, которая возникает между группой C=O одной аминокислоты и группой NH четвертой аминокислоты в цепи, дисульфидной связью, притяжением между положительными и отрицательными зарядами, а также гидрофобным и гидрофильным радикалом, которые ответственны за для устойчивости конструкции. Все аминокислоты в полипептидной цепи имеют L-конфигурацию, которая может привести к стабильной спирали, если она имеет правостороннюю структуру. В отличие от белков овальбумина, белки казеина не взаимодействуют внутримолекулярно с третичной структурой. Локальные взаимодействия могут происходить внутри молекулы в бета-слое, но взаимодействия между отдаленными частями той же молекулы не происходит. Молекула имеет гидрофобное ядро. В β-складке конформация представляет собой линейную пептидную цепь и стабилизируется за счет водородных связей с соседними параллельными цепями того же типа. Стерические взаимодействия вызывают легкое изгибание пептидных цепей, что приводит к образованию морщин (складчатый лист). Большинство белков и больших пептидов, таких как овальбумин, имеют сегменты альфа-спирали или бета-листа, их третичные структуры могут состоять из менее высокоорганизованных витков, нитей и клубков. Повороты меняют направление пептидной цепи и считаются третьим общим паттерном вторичной структуры. Бета-листы в овальбумине скручиваются примерно на 5–25° на остаток; таким образом, плоскости листов не параллельны. В-складчатые листы, образованные отдельными или одиночными полипептидными цепями, а две соседние цепи удерживаются межмолекулярными
Стерические взаимодействия вызывают легкое изгибание пептидных цепей, что приводит к образованию морщин (складчатый лист). Большинство белков и больших пептидов, таких как овальбумин, имеют сегменты альфа-спирали или бета-листа, их третичные структуры могут состоять из менее высокоорганизованных витков, нитей и клубков. Повороты меняют направление пептидной цепи и считаются третьим общим паттерном вторичной структуры. Бета-листы в овальбумине скручиваются примерно на 5–25° на остаток; таким образом, плоскости листов не параллельны. В-складчатые листы, образованные отдельными или одиночными полипептидными цепями, а две соседние цепи удерживаются межмолекулярными
водородные связи, расположенные параллельно (в одном направлении) или антипараллельно. Вторичная структура белка является результатом взаимодействия боковых цепей, расположенных в пределах нескольких остатков друг от друга. Белки достаточно длинные, чтобы в конечном итоге они могли сворачиваться, позволяя остаткам, которые находятся дальше друг от друга в первичной структуре, взаимодействовать друг с другом. Эти взаимодействия приводят к третичной структуре белка.
Эти взаимодействия приводят к третичной структуре белка.
В третичной структуре складка белка является трехмерной. Молекулы очень компактны в этой структуре. Различные аминокислоты взаимодействуют (гидрофобное взаимодействие или дисульфидные связи) с образованием кластера в центре белка, который полностью сгибает и изгибает белок, придавая ему свою форму. примеры требуемой третичной структуры включают коллаген и белок овальбумина. Овальбумин представляет собой глобулярное питательное вещество и запасной гликопротеин, который играет жизненно важную роль в хранении аминокислот в организме. Овальбумин, например, представляет собой белок, присутствующий в яичном белке (368 аминокислот), который присутствует на 70% в яичном белке. Последовательность включает шесть цистеинов с одинарной дисульфидной связью между Cys74 и Cys121. Аминоконец белка ацетилирован. Овальбумин не имеет классической N-концевой лидерной последовательности, хотя является секреторным белком. Вместо этого гидрофобная последовательность может действовать как внутренняя сигнальная последовательность, участвующая в трансмембранном расположении. Этот белок нейтрален и растворим в воде. (Хантингтон и др., 2001). Овальбумин богат глутаматной и аспартатной аминокислотами. Он имеет третичную структуру и имеет гидрофобное ядро в центре сферической формы (растворим в воде). Структура небольшая по длине и ширине и поэтому имеет яйцевидную или сферическую форму. Белки овальбумина имеют более сложную конформацию, чем белки коллагена.
Этот белок нейтрален и растворим в воде. (Хантингтон и др., 2001). Овальбумин богат глутаматной и аспартатной аминокислотами. Он имеет третичную структуру и имеет гидрофобное ядро в центре сферической формы (растворим в воде). Структура небольшая по длине и ширине и поэтому имеет яйцевидную или сферическую форму. Белки овальбумина имеют более сложную конформацию, чем белки коллагена.
Белок коллагена представляет собой структуру, подобную длинному волокну (параллельный полипептид), которая содержит три пептидные цепи, образующие тройную спиральную структуру за счет внутримолекулярных водородных связей, что придает структуре ее стабильность. Остатки ОН обеспечивают дополнительную прочность благодаря Н-связям, а остатки глицена, которые присутствуют в большом количестве (33%), позволяют белку сворачиваться более плотно, поскольку они помещаются внутри спирали. В коллагеновом волокне три из этих спиралей скручены вместе, образуя подобную веревке структуру, называемую суперспиральной спиралью. Именно эта структура придает коллагену большую прочность. Вторичная структура (альфа-спиральная конформация) далее сворачивается в третичную структуру. Гидрофобные цепи удерживаются внутри, тогда как гидрофильные цепи располагаются снаружи, что сворачивает и скручивает структуру, придавая молекуле стабильность. Эта третичная структура поддерживается водородными связями, дисульфидными связями, ионными связями и гидрофобными взаимодействиями. Эта структура сближает отдаленные боковые цепи аминокислот. Ковалентные связи образуются между лизиновыми остатками, которые укрепляют структуру белка, позволяя ему растягиваться и возвращаться к исходной длине, когда это необходимо. (Woster, nd).
Именно эта структура придает коллагену большую прочность. Вторичная структура (альфа-спиральная конформация) далее сворачивается в третичную структуру. Гидрофобные цепи удерживаются внутри, тогда как гидрофильные цепи располагаются снаружи, что сворачивает и скручивает структуру, придавая молекуле стабильность. Эта третичная структура поддерживается водородными связями, дисульфидными связями, ионными связями и гидрофобными взаимодействиями. Эта структура сближает отдаленные боковые цепи аминокислот. Ковалентные связи образуются между лизиновыми остатками, которые укрепляют структуру белка, позволяя ему растягиваться и возвращаться к исходной длине, когда это необходимо. (Woster, nd).
Функция белков
Казеин, молочный фосфопротеин, содержащий сложные эфиры фосфорной кислоты серина и треонина, эти белки важны для зубов и костей. Белки казеина присутствуют в молоке на 70-80% и состоят из большого количества пролиновых пептидов и не имеют дисульфидных связей. Поэтому там он имеет умеренно мало вторичной или третичной структуры. Казеин плохо растворим в воде, но хорошо растворяется в щелочах или сильных кислотах, проявляя гидрофобные свойства, появляется в молоке в виде взвеси частиц. Казеин также используется в производстве клеев, связующих веществ, защитных покрытий, пластмасс (таких как ручки ножей и вязальные спицы), тканей и пищевых добавок, он нетоксичен и очень стабилен. Эти белки богаты лизином, который является одной из незаменимых аминокислот в молоке. Белки казеина различаются в молоке разных млекопитающих, таких как животные и люди, и бывают трех типов; α, β и γ Они отличаются друг от друга своей молекулярной массой, скоростью миграции в электрическом поле и содержанием фосфора (Horne, 2002; Wang et al, 2009).).
Казеин плохо растворим в воде, но хорошо растворяется в щелочах или сильных кислотах, проявляя гидрофобные свойства, появляется в молоке в виде взвеси частиц. Казеин также используется в производстве клеев, связующих веществ, защитных покрытий, пластмасс (таких как ручки ножей и вязальные спицы), тканей и пищевых добавок, он нетоксичен и очень стабилен. Эти белки богаты лизином, который является одной из незаменимых аминокислот в молоке. Белки казеина различаются в молоке разных млекопитающих, таких как животные и люди, и бывают трех типов; α, β и γ Они отличаются друг от друга своей молекулярной массой, скоростью миграции в электрическом поле и содержанием фосфора (Horne, 2002; Wang et al, 2009).).
Коллаген является наиболее распространенным белком у млекопитающих, присутствующим в соединительных тканях (коже, костях, сухожилиях, хрящах, роговице и т. д.), который обеспечивает жесткость, защиту, гибкость и смазывание. Этот белок совершенно нерастворим в воде и подвержен влиянию изменения температуры. Богат глицином и аланином, но также содержит серин и тирозин. Содержит три длинные полипептидные цепи, каждая из которых состоит примерно из тысячи аминокислот. Эти цепочки закручиваются в правильную тройную спираль, отвечающую за эластичность кожи и сухожилий. При сильном нагревании превращаются в гелеобразующие вещества, гелеобразующие растворяются в воде и дают вязкий раствор, который можно использовать как клей и как загуститель. пищевая промышленность. Если коллаген частично гидролизуется в мягких условиях (кислота, нагревание и т. д.), три нити коллагена разделяются на глобулярные, случайные клубки, образуя желатин, который имеет более низкую антигенность, но все же сохраняет часть своей последовательности, что способствует адгезии и пролиферации клеток (Wang et al. , 2009 г.).
Богат глицином и аланином, но также содержит серин и тирозин. Содержит три длинные полипептидные цепи, каждая из которых состоит примерно из тысячи аминокислот. Эти цепочки закручиваются в правильную тройную спираль, отвечающую за эластичность кожи и сухожилий. При сильном нагревании превращаются в гелеобразующие вещества, гелеобразующие растворяются в воде и дают вязкий раствор, который можно использовать как клей и как загуститель. пищевая промышленность. Если коллаген частично гидролизуется в мягких условиях (кислота, нагревание и т. д.), три нити коллагена разделяются на глобулярные, случайные клубки, образуя желатин, который имеет более низкую антигенность, но все же сохраняет часть своей последовательности, что способствует адгезии и пролиферации клеток (Wang et al. , 2009 г.).
Многие процессы могут привести к денатурации белка, что означает изменение вторичной, третичной или четвертичной структуры. Растворимость может быть результатом различных уровней структуры. Например, соединительные белки не растворяются в воде. Хотя белки овальбумина растворимы в воде и более чувствительны к температуре или нагреванию (в отличие от коллагена, в них отсутствует последовательность глицина), это означает, что они могут легко терять свою вторичную и третичную структуру, процесс, называемый денатурацией (Huntington et al, 2001). Когда денатурированные молекулы объединяются в белковую сеть, этот процесс называется коагуляцией или гелем. Эта сформированная белковая сеть улавливает воду в пище между своими ячейками для образования геля или коагуляции, придавая пище ее консистенцию (яичное мясо). Она используется для поглощения воды (сгущения) и для стабилизации эмульсии и пены. Когда яйцо готовится, вязкость снижается. изменение цвета яиц, это изменение цвета указывает на изменение структуры белков альбумина при нагревании. Взаимодействие как полярных, так и неполярных единиц часто приводит к тому, что белок принимает сферическую форму. Хотя белки овальбумина чувствительны к денатурации (структурное разворачивание), некоторые из них могут быть удивительно стабильными.
Хотя белки овальбумина растворимы в воде и более чувствительны к температуре или нагреванию (в отличие от коллагена, в них отсутствует последовательность глицина), это означает, что они могут легко терять свою вторичную и третичную структуру, процесс, называемый денатурацией (Huntington et al, 2001). Когда денатурированные молекулы объединяются в белковую сеть, этот процесс называется коагуляцией или гелем. Эта сформированная белковая сеть улавливает воду в пище между своими ячейками для образования геля или коагуляции, придавая пище ее консистенцию (яичное мясо). Она используется для поглощения воды (сгущения) и для стабилизации эмульсии и пены. Когда яйцо готовится, вязкость снижается. изменение цвета яиц, это изменение цвета указывает на изменение структуры белков альбумина при нагревании. Взаимодействие как полярных, так и неполярных единиц часто приводит к тому, что белок принимает сферическую форму. Хотя белки овальбумина чувствительны к денатурации (структурное разворачивание), некоторые из них могут быть удивительно стабильными. Нагревание белков может расщеплять водородные связи, ионные или гидрофобные связи. Белковые структуры чувствительны к температуре и рН, в частности, агрегация белков разворачивает содержимое альфа-спирали, денатурируется или разрушается при нагревании при высокой температуре. Некоторые белки жесткие и нерастворимы в воде, либо связаны ковалентно, либо расположены под действием других сил, которые нелегко разрушить, примеры конъюгированных белков включают коллаген (Gossett et al, 1984, Хантингтон и др., 2001).
Нагревание белков может расщеплять водородные связи, ионные или гидрофобные связи. Белковые структуры чувствительны к температуре и рН, в частности, агрегация белков разворачивает содержимое альфа-спирали, денатурируется или разрушается при нагревании при высокой температуре. Некоторые белки жесткие и нерастворимы в воде, либо связаны ковалентно, либо расположены под действием других сил, которые нелегко разрушить, примеры конъюгированных белков включают коллаген (Gossett et al, 1984, Хантингтон и др., 2001).
Заключение
Пищевые белки, такие как коллаген, казеин и яичный альбумин, обеспечивают высокое или низкое питательное качество для человека. Качество пищи зависит от структуры и функциональных свойств белка. Некоторыми функциональными свойствами белков являются растворимость, гидратация, вязкость, текстурирование, образование теста, эмульгирующие и пенообразующие свойства. Растворимость — это способность белков растворяться в воде, которая уменьшается во время термической обработки, эта потеря растворимости имеет серьезные последствия для эмульгирующих и пенообразующих свойств белка.
Поделись этим: Фейсбук Логотип Facebook Твиттер Логотип Твиттера Реддит Логотип Reddit LinkedIn Логотип LinkedIn WhatsApp Логотип WhatsApp
Процитировать эту работу
Чтобы экспортировать ссылку на эту статью, выберите стиль ссылки ниже:
- АПА
- ГНД
- МЛА-7
- Гарвард
- Ванкувер
- Википедия
- ОСКОЛА
UKEssays. (ноябрь 2018 г.). Казеин, овальбумин и коллаген: структура и функция. Получено с https://us.ukessays.com/essays/biology/function-of-ovalbumin-casein-and-collagen-proteins-biology-essay.php?vref=1 Ссылка скопирована в буфер обмена.
«Казеин, овальбумин и коллаген: структура и функция». ukessays.com. 11 2018. UKEssays. 07 2023
«Казеин, овальбумин и коллаген: структура и функция». UKEssays. ukessays.com, ноябрь 2018 г. Интернет. 1 июля 2023 г.
ukessays.com, ноябрь 2018 г. Интернет. 1 июля 2023 г.
UKEssays. Ноябрь 2018 г. Казеин, овальбумин и коллаген: структура и функция. [В сети]. Доступно по адресу: https://us.ukessays.com/essays/biology/function-of-ovalbumin-casein-and-collagen-proteins-biology-essay.php?vref=1 [Проверено 1 июля 2023 г.]. Ссылка скопирована в буфер обмена.
UKEssays. Казеин, овальбумин и коллаген: структура и функция [Интернет]. Ноябрь 2018 г. [По состоянию на 1 июля 2023 г.]; Доступно по адресу: https://us.ukessays.com/essays/biology/function-of-ovalbumin-casein-and-collagen-proteins-biology-essay.php?vref=1. Ссылка скопирована в буфер обмена.
{{цитировать веб-сайт|последний=ответы |первый=все |url=https://us.ukessays.com/essays/biology/function-of-ovalbumin-casein-and-collagen-proteins-biology-essay.php ?vref=1 |title=Казеин, овальбумин и коллаген: структура и функция |publisher=UKEssays. com |date=ноябрь 2018 |accessdate=1 июль 2023 |location=Ноттингем, Великобритания}}
Ссылка скопирована в буфер обмена.
com |date=ноябрь 2018 |accessdate=1 июль 2023 |location=Ноттингем, Великобритания}}
Ссылка скопирована в буфер обмена.
All Answers ltd, «Казеин, овальбумин и коллаген: структура и функция» (UKEssays.com, июль 2023 г.)
Сопутствующие услуги
Посмотреть всеСлужба написания эссе
От 124 фунтов стерлингов
Служба написания диссертаций
От 124 фунтов стерлингов
Служба написания заданий
От 124 фунтов стерлингов
Закон о защите авторских прав в цифровую эпоху / Запрос на удаление
Если вы являетесь автором этого эссе и больше не хотите, чтобы ваша работа публиковалась на UKEssays.com, пожалуйста:
22-5 Каковы функции (а) овальбумина и (б) миозина?
1 Вещество, энергия и измерение2 Атомы3 Химические связи4 Химические реакции5 Газы, жидкости и твердые вещества6 Растворы и коллоиды7 Скорости реакций и химическое равновесие8 Кислоты и основания9 Ядерная химия10 Органическая химия11 Алканы12 Алкены и алкины13 Бензол и его производные14 Спирты, эфиры и тиолы15 Хиральность: Направленность молекул16 Амины17 Альдегиды и кетоны18 Карбоновые кислоты19 Карбоновые ангидриды, сложные эфиры и амиды20 Углеводы21 Липиды22 Белки23 Ферменты24 Химические связи: нейротрансмиттеры и гормоны25 Нуклеотиды, нуклеиновые кислоты и наследственность26 Экспрессия генов и синтез белка27 Биоэнергетика: как организм Преобразует пищу в энергию28 Специфический катаболизм Пути: метаболизм углеводов, липидов и белков 29Пути биосинтеза 30 Питание 31 Иммунохимия expand_more
22. 1 Каковы многие функции белков? 22.2 Что такое аминокислоты? 22.3 Что такое цвиттерионы? 22.4 Как аминокислоты объединяются для образования белков? 22.5 Что определяет характеристики аминокислот? 22.6 Что такое необычные аминокислоты? 22.7 Каковы свойства белков? 22.8 Какова первичная структура белка? 22.9 Что такое вторичная структура белка? 22.10 Интерлюдия: как присутствие переходных металлов влияет на структуру белков? 22.11 Что такое третичная структура белка? 22.12 Что такое четвертичная структура белка? 22.13 Как происходит денатурация белков? Вопросы к главе expand_more
1 Каковы многие функции белков? 22.2 Что такое аминокислоты? 22.3 Что такое цвиттерионы? 22.4 Как аминокислоты объединяются для образования белков? 22.5 Что определяет характеристики аминокислот? 22.6 Что такое необычные аминокислоты? 22.7 Каковы свойства белков? 22.8 Какова первичная структура белка? 22.9 Что такое вторичная структура белка? 22.10 Интерлюдия: как присутствие переходных металлов влияет на структуру белков? 22.11 Что такое третичная структура белка? 22.12 Что такое четвертичная структура белка? 22.13 Как происходит денатурация белков? Вопросы к главе expand_more
Задача 22.5P: 22-5 Каковы функции а) овальбумина и (б) миозина? Задача 22.6P: 22-6 Представители какого класса белков нерастворимы в воде и могут служить структурными …Задача 22.7P: 22-7 Какова функция иммуноглобулина?Задача 22.8PЗадача 22.9P: 22-9 В чем различие строения тирозина и фенилаланина?Задача 22.10P: 22-10 Классифицируйте следующие аминокислоты как неполярные, полярные, но нейтральные, кислые или основные. (a)…Задача 22.11P: 22-11 Какая аминокислота имеет самый высокий процент азота (г N/100 г аминокислоты)? Задача 22.12P Задача 22.13P Задача 22.14P Задача 22.15P Задача 22.16P: 22-16 Какие аминокислоты в таблице 22-1 имеют более одного стереоцентра? Задача 22.17P: 22-17 В чем сходство и различие структур аланина и фенилаланина? Задача 22.18P: 22-18 Нарисуйте структуры L- и D-валина. Задача 22.19PProblem 22.20P: 22-20 Покажите, как аланин в растворе в его изоэлектрической точке действует как буфер (напишите уравнения для… Задача 22.21P: 22-21 Объясните, почему аминокислота не может существовать в неионизированной форме при любой pH. Задача 22.22P: 22-22 Изобразите структуру валина при pH 1 и при pH 12. Задача 22.23P Задача 22.24P: 22-24 Изобразите наиболее преобладающую форму гистидина в его изоэлектрической точке. Задача 22.25P: 22- 25 Нарисуйте наиболее преобладающую форму лизина в его изоэлектрической точке. Задача 22.26P Задача 22.27P: 22-27 Покажите химическими уравнениями, как аланин и глютамин могут быть объединены, чтобы получить два различных.
(a)…Задача 22.11P: 22-11 Какая аминокислота имеет самый высокий процент азота (г N/100 г аминокислоты)? Задача 22.12P Задача 22.13P Задача 22.14P Задача 22.15P Задача 22.16P: 22-16 Какие аминокислоты в таблице 22-1 имеют более одного стереоцентра? Задача 22.17P: 22-17 В чем сходство и различие структур аланина и фенилаланина? Задача 22.18P: 22-18 Нарисуйте структуры L- и D-валина. Задача 22.19PProblem 22.20P: 22-20 Покажите, как аланин в растворе в его изоэлектрической точке действует как буфер (напишите уравнения для… Задача 22.21P: 22-21 Объясните, почему аминокислота не может существовать в неионизированной форме при любой pH. Задача 22.22P: 22-22 Изобразите структуру валина при pH 1 и при pH 12. Задача 22.23P Задача 22.24P: 22-24 Изобразите наиболее преобладающую форму гистидина в его изоэлектрической точке. Задача 22.25P: 22- 25 Нарисуйте наиболее преобладающую форму лизина в его изоэлектрической точке. Задача 22.26P Задача 22.27P: 22-27 Покажите химическими уравнениями, как аланин и глютамин могут быть объединены, чтобы получить два различных. .. Задача 22.28P: 22-28 Тетрапептид сокращенно DPKH Какая аминокислота находится на N-конце, а какая на… Задача 22.29P: 22-29 Нарисуйте структуру трипептида, состоящего из треомна, аргинина и метионина. Задача 22.30P: 22-30 (a) Используйте трехбуквенные сокращения, чтобы написать представление следующего трипептида:… Задача 22.31 P: 22-31 Полипептидная цепь состоит из чередующихся валина и фенилаланина. Какая часть…Задача 22.32PЗадача 22.33P: 22-33 Какая из трех функциональных групп гистидина наиболее уникальна?Задача 22.34PЗадача 22.35P: 22-35 Почему гистидин считается основной аминокислотой, если pKa его боковая цепь равна 6,0? Задача 22.36P Проблема 22.37P Проблема 22.38P: 22-38 Почему пролин не поглощает свет при 280 нм? Задача 22.39PЗадача 22.40PЗадача 22.41PЗадача 22.42P: 22-42 а) Сколько атомов пептидной связи лежат в одной плоскости? (б) Какие это атомы? Задача 22.43P: 22-43 (а) Нарисуйте структурную формулу трипептида Met-Ser-Cys. (b) Нарисуйте различные ионные… Задача 22.
.. Задача 22.28P: 22-28 Тетрапептид сокращенно DPKH Какая аминокислота находится на N-конце, а какая на… Задача 22.29P: 22-29 Нарисуйте структуру трипептида, состоящего из треомна, аргинина и метионина. Задача 22.30P: 22-30 (a) Используйте трехбуквенные сокращения, чтобы написать представление следующего трипептида:… Задача 22.31 P: 22-31 Полипептидная цепь состоит из чередующихся валина и фенилаланина. Какая часть…Задача 22.32PЗадача 22.33P: 22-33 Какая из трех функциональных групп гистидина наиболее уникальна?Задача 22.34PЗадача 22.35P: 22-35 Почему гистидин считается основной аминокислотой, если pKa его боковая цепь равна 6,0? Задача 22.36P Проблема 22.37P Проблема 22.38P: 22-38 Почему пролин не поглощает свет при 280 нм? Задача 22.39PЗадача 22.40PЗадача 22.41PЗадача 22.42P: 22-42 а) Сколько атомов пептидной связи лежат в одной плоскости? (б) Какие это атомы? Задача 22.43P: 22-43 (а) Нарисуйте структурную формулу трипептида Met-Ser-Cys. (b) Нарисуйте различные ионные… Задача 22. 44P: 22-44 Как белок может действовать как буфер? Задача 22.45P: 22-45 Белки наименее растворимы в своих изоэлектрических точках. Что произойдет с белком… Задача 22.46P: 22-46 Сколько различных трипептидов можно получить (а) используя один, два или три остатка каждого из… Задача 22.47P: 22-47 Сколько различных тетрапептидов можно сделать (а) если пептиды содержат остатки… Задача 22.48P: 22-48 Сколько аминокислотных остатков в А-цепи инсулина одинаковы в инсулине человека,… Задача 22.49P: 22-49 Основываясь на ваших знаниях о химических свойствах боковых цепей аминокислот, предложите… Задача 22.50P: 22-50 Является ли случайный клубок a (a) первичным, (b) вторичным, (c) третичным или (d) четвертичная структура?… Задача 22.51P: 22-51 Определите, являются ли следующие структуры, существующие в коллагене, первичными, вторичными… Задача 22.52P Задача 22.53P: 22-53 Играют ли ионы железа и цинка роль в структура белка? Если да, то какова роль или или… Задача 22.54P Задача 22.55P: 22-55 Рассмотрим координационное соединение Fe(CO)5 и покажем, что при образовании этого соединения.
44P: 22-44 Как белок может действовать как буфер? Задача 22.45P: 22-45 Белки наименее растворимы в своих изоэлектрических точках. Что произойдет с белком… Задача 22.46P: 22-46 Сколько различных трипептидов можно получить (а) используя один, два или три остатка каждого из… Задача 22.47P: 22-47 Сколько различных тетрапептидов можно сделать (а) если пептиды содержат остатки… Задача 22.48P: 22-48 Сколько аминокислотных остатков в А-цепи инсулина одинаковы в инсулине человека,… Задача 22.49P: 22-49 Основываясь на ваших знаниях о химических свойствах боковых цепей аминокислот, предложите… Задача 22.50P: 22-50 Является ли случайный клубок a (a) первичным, (b) вторичным, (c) третичным или (d) четвертичная структура?… Задача 22.51P: 22-51 Определите, являются ли следующие структуры, существующие в коллагене, первичными, вторичными… Задача 22.52P Задача 22.53P: 22-53 Играют ли ионы железа и цинка роль в структура белка? Если да, то какова роль или или… Задача 22.54P Задача 22.55P: 22-55 Рассмотрим координационное соединение Fe(CO)5 и покажем, что при образовании этого соединения. .. Задача 22.56P Задача 22.57P: 22 -57 Рассмотрим координационное соединение [Zn(Nh4)2Cl2], которое содержит ионы Zn(Nh4)22+ и Cl. Показать… Задача 22.58P Задача 22.59P: 22-59 Как влияют солевые мостики на третичную структуру белков? Задача 22.60P Задача 22.61P: 22-61 Полиглутаминовая кислота (полипептидная цепь, состоящая только из остатков глутаминовой кислоты) имеет а-спираль… Задача 22.62P: 22-62 Различие между межмолекулярными и внутримолекулярными водородными связями между основной цепью… Задача 22.63P: 22-63 Определите первичную, вторичную и третичную структуры в пронумерованных ячейках: Задача 22.64P: 22-64 Если оба цистеиновых остатка в В-цепи инсулина были заменены на остатки аланина, как… Задача 22.65P: 22-65 (a) Чем отличается четвертичная структура фетального гемоглобина от гемоглобина взрослого… Задача 22.66PЗадача 22.67PЗадача 22.68PЗадача 22.69PProblem 22.70PProblem 22.71P: 22-71 Какая боковая цепь аминокислот чаще всего участвует в денатурации путем восстановления?Problem 22.
.. Задача 22.56P Задача 22.57P: 22 -57 Рассмотрим координационное соединение [Zn(Nh4)2Cl2], которое содержит ионы Zn(Nh4)22+ и Cl. Показать… Задача 22.58P Задача 22.59P: 22-59 Как влияют солевые мостики на третичную структуру белков? Задача 22.60P Задача 22.61P: 22-61 Полиглутаминовая кислота (полипептидная цепь, состоящая только из остатков глутаминовой кислоты) имеет а-спираль… Задача 22.62P: 22-62 Различие между межмолекулярными и внутримолекулярными водородными связями между основной цепью… Задача 22.63P: 22-63 Определите первичную, вторичную и третичную структуры в пронумерованных ячейках: Задача 22.64P: 22-64 Если оба цистеиновых остатка в В-цепи инсулина были заменены на остатки аланина, как… Задача 22.65P: 22-65 (a) Чем отличается четвертичная структура фетального гемоглобина от гемоглобина взрослого… Задача 22.66PЗадача 22.67PЗадача 22.68PЗадача 22.69PProblem 22.70PProblem 22.71P: 22-71 Какая боковая цепь аминокислот чаще всего участвует в денатурации путем восстановления?Problem 22.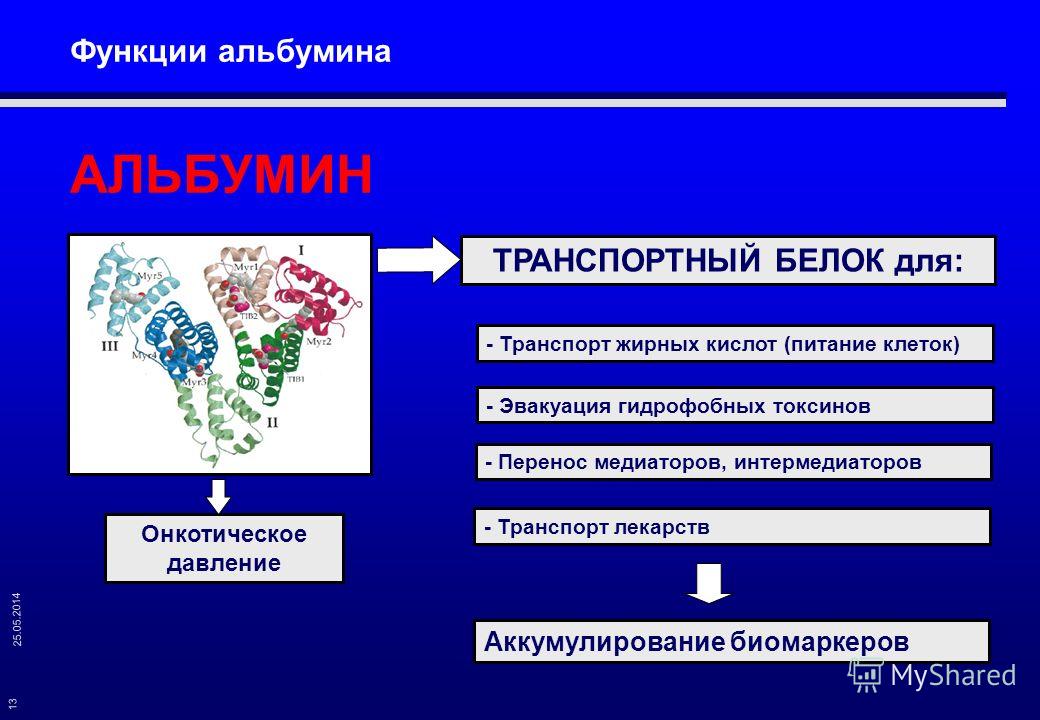 72P: 22-72 Что делает восстановитель при выпрямлении кудрявых волос?Problem 22.73P: 22-73 Нитрат серебра иногда вводят в глаза новорожденным в качестве профилактической меры… Задача 22.74P: 22-74 Почему медсестры и врачи протирают кожу перед инъекцией 70-процентным спиртом? Задача 22.75P: 22-75 (Химические соединения 22A) Почему некоторые люди должны избегать употребления диетических газированных напитков с Nutrasweet? Проблема 22.76P Проблема 22.77 P Проблема 22.78 P Проблема 22.79PЗадача 22.80PЗадача 22.81PЗадача 22.82P: 22-82 (Химические соединения 22H) Как фиброскоп помогает заживлять кровоточащие язвы?Задача 22.83PЗадача 22.84P: 22-84 Сколько различных дипептидов можно получить (а) используя только аланин, триптофан , глутаминовая кислота,…Задача 22.85P: 22-85 Денатурация обычно связана с переходами от спиральных структур к случайным клубкам….Задача 22.86PЗадача 22.87PЗадача 22.88PЗадача 22.89P: 22-89 Какое нековалентное взаимодействие происходит между следующие аминокислоты? (а) Валин и.
72P: 22-72 Что делает восстановитель при выпрямлении кудрявых волос?Problem 22.73P: 22-73 Нитрат серебра иногда вводят в глаза новорожденным в качестве профилактической меры… Задача 22.74P: 22-74 Почему медсестры и врачи протирают кожу перед инъекцией 70-процентным спиртом? Задача 22.75P: 22-75 (Химические соединения 22A) Почему некоторые люди должны избегать употребления диетических газированных напитков с Nutrasweet? Проблема 22.76P Проблема 22.77 P Проблема 22.78 P Проблема 22.79PЗадача 22.80PЗадача 22.81PЗадача 22.82P: 22-82 (Химические соединения 22H) Как фиброскоп помогает заживлять кровоточащие язвы?Задача 22.83PЗадача 22.84P: 22-84 Сколько различных дипептидов можно получить (а) используя только аланин, триптофан , глутаминовая кислота,…Задача 22.85P: 22-85 Денатурация обычно связана с переходами от спиральных структур к случайным клубкам….Задача 22.86PЗадача 22.87PЗадача 22.88PЗадача 22.89P: 22-89 Какое нековалентное взаимодействие происходит между следующие аминокислоты? (а) Валин и.

