Инсулин (Insulin) — узнать цены на анализ и сдать в Симферополе
Что такое инсулин (Insulin)?
Инсулин (Insulin) – это гормон, который вырабатывается бета-клетками поджелудочной железы после приема пищи в ответ на повышение уровня глюкозы (сахара) в крови. Благодаря инсулину глюкоза, которая является основным источником энергии в организме, попадает во все клетки и сохраняется в некоторых органах «про запас». Таким образом, инсулин регулирует концентрацию глюкозы в крови. Также инсулин регулирует обмен липидов.
При недостатке инсулина или в случае, когда клетки не реагируют на его действие (инсулинорезистентности), уровень глюкозы в крови увеличивается, а клетки не дополучают необходимого питания. В итоге нарушается функция сердечно-сосудистой и нервной систем (вплоть до инфаркта и инсульта), почек (вплоть до хронической почечной недостаточности и необходимости гемодиализа), сетчатки глаза (вплоть до потери зрения). Сахарный диабет бывает двух типов: при 1-ом типе поджелудочная железа не вырабатывает достаточное количество инсулина (для лечения пациенту необходимо постоянно получать этот гормон в виде инъекций), при 2-ом типе – инсулина вырабатывается больше нормы, но клетки к нему резистентны (для лечения необходимо выяснить причину и нормализовать действие гормона).
Для чего определяют уровень инсулина в крови?
Определение уровня инсулина используют для обнаружения причин гипогликемии – сниженной концентрации глюкозы крови. Это состояние является жизнеугрожающим, поскольку от уровня глюкозы в значительной степени зависит питание головного мозга. Гипогликемия может сопровождаться такими симптомами, как неожиданная слабость, головокружение, потеря сознания, учащенное сердцебиение, чувство голода, беспокойство, раздражительность, потливость, иногда проявляется агрессией.
Исследование уровня инсулина может быть дополнено анализами на уровень С-пептида, глюкозы натощак и при нагрузке (в том числе глюкозотолерантным тестом), уровнем гликированного гемоглобина, оценкой инсулинорезистентности.
При каких заболеваниях повышается уровень инсулина в крови?
Уровень инсулина повышается при инсулиноме (опухоли из бета-клеток поджелудочной железы, продуцирующей слишком большое количество гормона), сахарном диабете 2-го типа (инсулиннезависимом), ожирении, метаболическом синдроме (сочетании инсулинорезистентности, ожирения и артериальной гипертонии – повышения кровяного давления), заболеваниях печени, при эндокринологических заболеваниях, сопровождающихся повышением концентрации кортизала в крови (болезнь и синдром Иценко – Кушинга), акромегалии (заболевании, при котором гипофиз выделяет избыточное количество гормона роста, или соматотропина), миотонической дистрофии (наследственной патологии, при которой снижается мышечный тонус и происходит атрофия мышц), генетически обусловленной непереносимости фруктозы и/или галактозы.
Уровень инсулина может снижаться при поражении поджелудочной железы (панкреатите, панкреонекрозе, аутоиммунном поражении, онкологическом поражении, изменениях при муковисцидозе и т.д.) и при снижении функции гипофиза – гипопитуитаризме.
Почему результат анализа может быть некорректным?
На концентрацию инсулина в крови оказывают влияние инъекции инсулина, прием гипогликемических средств, а также многих других лекарственных препаратов, например, глюкокортикоидов, леводопы, оральных контрацептивов и т.д. В любом случае необходимо сообщить врачу, назначившему анализ о получаемой терапии, чтобы интерпретация результатов анализа была максимально точной.
Пределы обнаружения: 1,0-3300 мкЕд/мл.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Трактовка результатов определения уровня Инсулина в сыворотке крови
Единицы измерения: мкЕд/мл.
Альтернативные единицы: мЕд/л, пмоль/л.
Пересчет единиц: мЕд/л = мкЕд/мл; пмоль/л х 0,138 = мкЕд/мл.
Референсные значения: 2,7 — 10,4 мкЕд/мл*.
* референсные значения зависят от технологии теста, актуальные референсные значения приведены в распечатке результата.
Приведённые референсные значения соотносятся с состоянием натощак после ночного периода голодания у здоровых нетучных людей с индексом массы тела (ИМТ) до 30 кг/м2. ИМТ= (вес, кг)/(рост, м)2.
Повышение значений
- Инсулинома.

- Инсулиннезависимый диабет (тип 2).
- Болезни печени.
- Акромегалия.
- Синдром Кушинга.
- Миотоническая дистрофия.
- Семейная непереносимость фруктозы и галактозы.
- Ожирение.
- Прием инсулина или гипогликемических препаратов.
- Лекарственная интерференция: ацетогексамид, альбутерол, аминокислоты, глюконат кальция (новорожденные), хлорпропамид, ципрогептадин (не больные диабетом), даназол, фруктоза, глюкагон, глюкоза, гормон роста, леводопа (при лечении паркинсонизма), медроксипрогестерон, ниацин (высокие дозы), пероральные контрацептивы, панкреозимин (в/в введение), фентоламин (инфузия), преднизолон, хинидин, секретин (в/в), спиронолктон, сахароза, тербуталин, толазамид, толбутамид.
Секреция инсулина в норме и при сахарном диабете 2 типа | Аметов
По данным Международной федерации диабета (IDF), в настоящее время сахарным диабетом болеют более 246 млн. человек. Было установлено, что каждую 21-ю секунду на нашей планете появляется новый пациент, страдающий этим заболеванием.
человек. Было установлено, что каждую 21-ю секунду на нашей планете появляется новый пациент, страдающий этим заболеванием.Основную часть этих пациентов составляют больные сахарным диабетом 2 типа. Следует подчеркнуть, что длительное время применительно к этому заболеванию существовало ошибочное мнение. Считалось, что это более легкая форма диабета, при которой осложнения могут и не возникать, что цели терапии могут быть не столь жесткими, а ожирение лучше всего игнорировать по причине того, что мы не очень умеем лечить это заболевание. В настоящее время ученые твердо убеждены, что речь идет о тяжелом, хроническом и постоянно прогрессирующем заболевании, составляющем 85–90% от общего количества больных диабетом. Заболевание, при котором в момент установления диагноза более 50% больных уже имеют поздние осложнения диабета.
Хорошо известно, что сахарный диабет 2 типа характеризуется наличием двух фундаментальных дефектов – инсулинорезистентности и нарушения функции β-клеток поджелудочной железы. В этой связи уместно вспомнить определение Всемирной Организации Здравоохранения (ВОЗ) и Американской Диабетической Ассоциации (ADA), применительно к сахарному диабету 2 типа, основанное на фенотипах:
В этой связи уместно вспомнить определение Всемирной Организации Здравоохранения (ВОЗ) и Американской Диабетической Ассоциации (ADA), применительно к сахарному диабету 2 типа, основанное на фенотипах:
Говоря о возможных механизмах, участвующих в развитии нарушений гомеостаза глюкозы при данном заболевании, следует выделить как минимум три различных уровня:
1 уровень – поджелудочная железа, где β-клетки в силу различных причин могут не «узнавать» глюкозу, а следовательно, нарушается секреция инсулина;
2 уровень – печень, где может повышаться скорость продукции глюкозы, или в силу недостаточного подавления этого процесса инсулином, либо глюкозой, или в силу стимуляции – глюкагоном или катехоламинами;
3 уровень – периферические клетки-мишени – мышечная и жировая ткани, где в силу различных причин снижается чувствительность к инсулину и развивается состояние, известное под названием инсулинорезистентность.

Известно, что глюкоза, поступившая с пищей, первоначально распределяется в организме человека следующим образом:
50% глюкозы поступает в клетки головного мозга;
50% глюкозы утилизируется мышечной и, в меньшей степени, жировой тканью.
Необходимо отметить, что, для того чтобы попасть в головной мозг, глюкоза с помощью специального транспортного белка – ГЛЮТ-1 вначале проникает через гематоэнцефалический барьер. Причем этот процесс контролируется с помощью специальных сенсоров, кстати представляющих из себя КАТФ-зависимые каналы. В этой связи важно напомнить, что указанные сенсоры четко контролируют уровень глюкозы, поступающей в головной мозг. Его снижение вызовет развитие нейрогликопении, а повышение уровня глюкозы, поступающей в головной мозг, будет способствовать развитию нейроглюкотоксичности. Этот процесс носит название пластичность, и в этом случае под этим термином подразумевают память на определенные требуемые уровни глюкозы.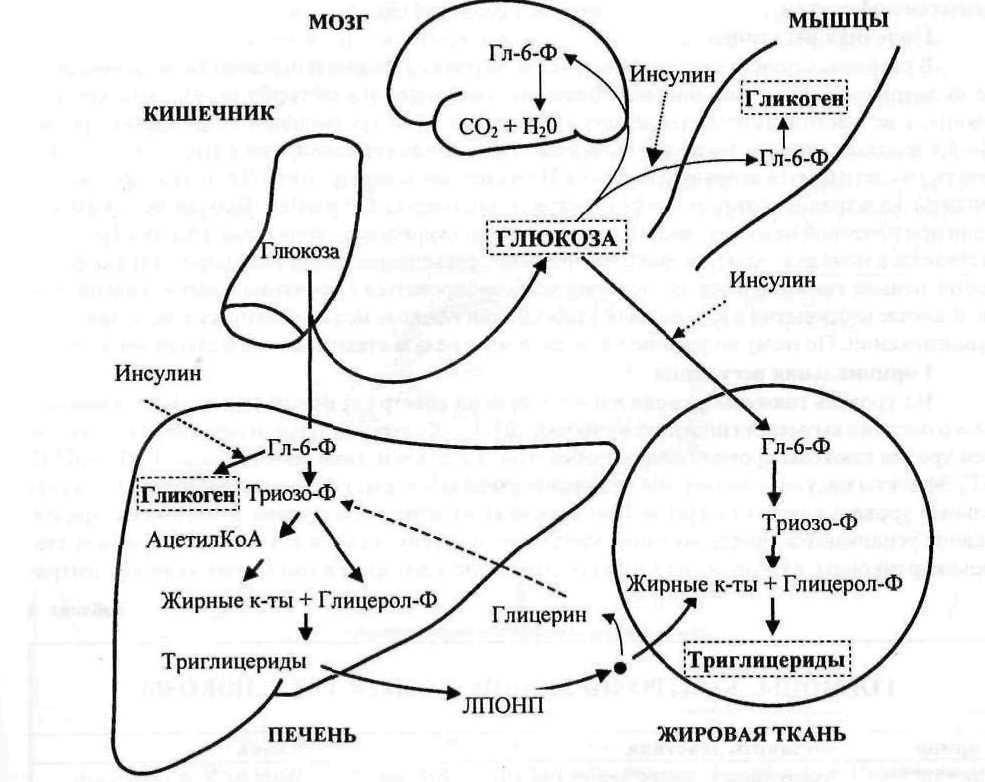
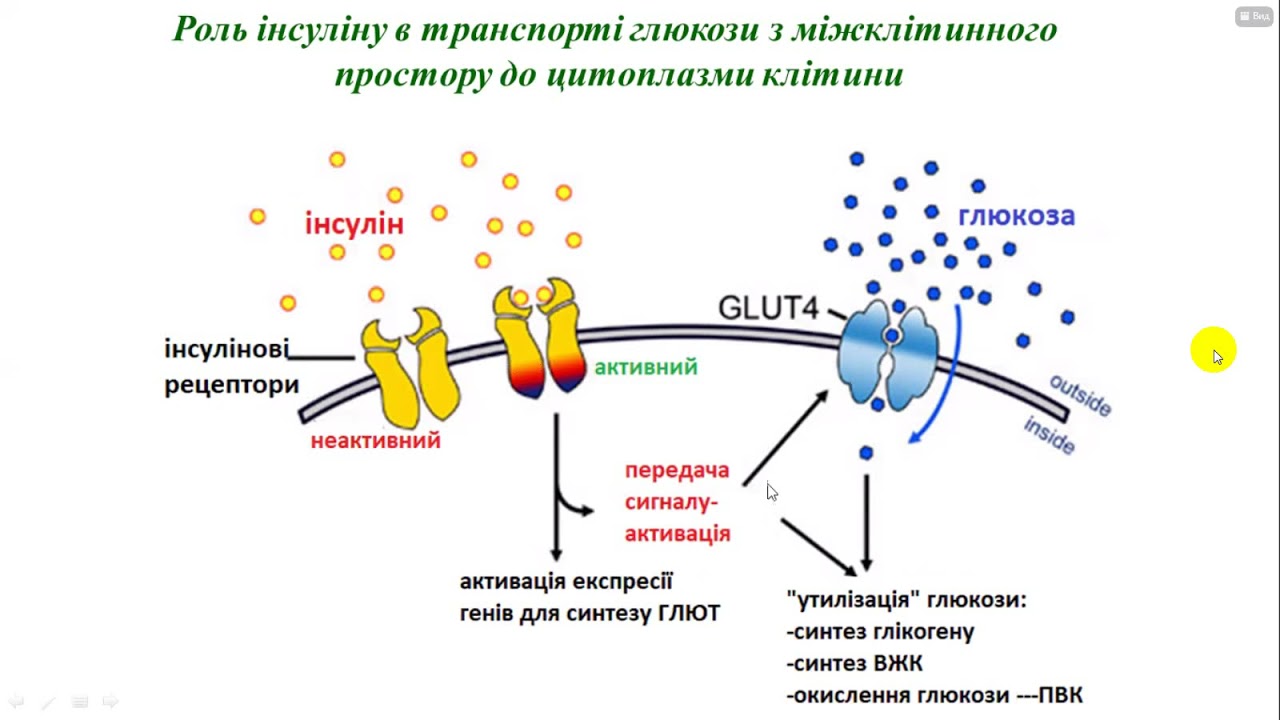
В свою очередь регулирование поступления потока глюкозы в мышечную ткань осуществляет наряду с инсулином специализированный транспортный белок ГЛЮТ 4. Таким образом, необходимо обратить внимание, что известные нам специализированные транспортные белки осуществляют не только транспорт глюкозы внутрь клетки, но и осуществляют регулирование распределения глюкозы между различными органами и тканями, а также распределение глюкозы между внеклеточным и внутриклеточным пространством.
Известно, что у здоровых лиц инсулин регулирует три ключевых процесса:
захват глюкозы тканями-мишенями;
выход эндогенной глюкозы из печени;
выход свободных жирных кислот из жировой ткани через процессы липолиза.
Следует особо отметить, что секреция инсулина из β-клеток поджелудочной железы контролируется многоуровневой системой, которая обеспечивает уровень секреции этого гормона адекватно и пропорционально суточным колебаниям уровней глюкозы.
Самой хорошей и простой иллюстрацией такого жесткого контроля за колебаниями гликемии в течение суток со стороны инсулина, очевидно, могут быть данные, касающиеся концентрации глюкозы в течение суток у здоровых добровольцев, когда уровень глюкозы измерялся не менее 18 раз в течение суток. Так, средний уровень глюкозы составил 4,22±0,8 ммоль/л, самый низкий уровень составил, в среднем, 3,88±0,6 ммоль/л, а самый высокий уровень глюкозы в течение суток равнялся, в среднем, 4,88±1,0 ммоль/л.
Возвращаясь к патофизиологическим дефектам, лежащим в основе патогенеза сахарного диабета 2 типа, необходимо обратить внимание читателей на гипотезу усиления (рис. 2) (R.P. Robertson, 2005). Как видно из данных, представленных на рис. 2, инсулинорезистентность и дисфункция β-клеток поджелудочной железы, на старте развиваясь независимо друг от друга, на каком-то этапе объединяются и способствуют развитию гипергликемии и связанной с ней острой и хронической глюкозотоксичности.
Известно, что обеспечение нормального метаболизма глюкозы требует тщательной координации и контроля за секрецией и действием инсулина (табл. 1).
Говоря о действии инсулина следует также обратить внимание на результаты исследований профессора H.Yki-Yarvinen, 2004, изучавшей причины, приводящие к изменениям действия инсулина (табл. 2). Обращает на себя внимание тот факт, что только физические нагрузки и увеличение мышечной массы приводят к улучшению чувствительности к инсулину, в то время как остальные – подавляли действие инсулина.
В последние годы большое внимание ученых привлекают к себе исследования, посвященные этапам развития патологического процесса при сахарном диабете 2 типа. В этой связи определенный интерес заслуживает публикация Gordon S. Weir, Susan Bonner-Weir, 2004, в которой рассматривается данная проблема. Эти авторы считают, что развитие и прогрессирование диабета можно рассматривать через призму определенных факторов, характеризующихся изменениями различных метаболических параметров и функции β-клеток (рис. 3). В частности, на стадии 0, в самом начале заболевания, уровень глюкозы начинает повышаться от «великолепно» нормальных значений ~4,5 ммоль/л до более высоких значений, находящихся в пределах ~5,0 ммоль/л. Эти изменения, конечно, не могут быть признаны как клинически патологические, так как они не достигают официальной категории нарушенной гликемии натощак (НГН ≥ 5,6 ммоль/л или 100 мг%) или нарушенной толерантности к глюкозе (НТГ, 2-часовой постглюкозный уровень ≥ 7,8 ммоль/л или 140 мг%).
3). В частности, на стадии 0, в самом начале заболевания, уровень глюкозы начинает повышаться от «великолепно» нормальных значений ~4,5 ммоль/л до более высоких значений, находящихся в пределах ~5,0 ммоль/л. Эти изменения, конечно, не могут быть признаны как клинически патологические, так как они не достигают официальной категории нарушенной гликемии натощак (НГН ≥ 5,6 ммоль/л или 100 мг%) или нарушенной толерантности к глюкозе (НТГ, 2-часовой постглюкозный уровень ≥ 7,8 ммоль/л или 140 мг%).
Таким образом, лица, предрасположенные к развитию сахарного диабета 2 типа, первоначально прогрессируют в сторону развития нарушенной гликемии натощак, а далее развивается нарушенная толерантность к глюкозе. Причем стадии НГН и НТГ могут продолжаться в течение длительного периода времени, до тех пор пока разовьется выраженная клиника сахарного диабета.
Хотя эта прогрессия специально обсуждается нами в контексте сахарного диабета 2 типа, очень похожие изменения развиваются и при сахарном диабете 1 типа или в тех случаях, когда трансплантация культуры β-клеток или поджелудочной железы в целом терпит неудачу.
В стадии 1, которая носит название компенсация, наиболее общий пример обнаружен при инсулинорезистентности (ИР) на фоне ожирения, связанного с более высокой секрецией инсулина и повышенной острой глюкозостимулированной секрецией инсулина в ответ на внутривенную нагрузку глюкозой. В этом случае большая часть повышенной секреции инсулина несомненно обусловлена увеличением массы β-клеток, что было показано на аутопсии у людей в ряде экспериментальных моделей. Следует отметить, что масса β-клеток в физиологических условиях четко контролируется и регулируется через равновесие между рождением β-клеток (репликация β-клеток и неогенез островков), с одной стороны, и гибелью β-клеток (апоптоз), с другой.
В литературе существуют данные, которые указывают, что усиление функции β-клеток поджелудочной железы, развивающееся на фоне инсулинорезистентности, может быть связано как с увеличением массы функционирующих β-клеток, так и с развитием гипертрофии β-клеток поджелудочной железы.
Хотя до сих пор неизвестно, с чем связан повышенный уровень инсулина на стадии компенсации – с увеличением массы β-клеток или усилением секреции на единицу массы β-клеток. Несмотря на то, что о компенсации в первую очередь думают и говорят, как о ситуации во время инсулинорезистентности, похожие изменения положительно могут встречаться и на ранних стадиях аутоиммунной деструкции, имеющей место на этапах развития сахарного диабета 1 типа.
На этой стадии (компенсация) возможно также развитие уменьшения массы β-клеток поджелудочной железы, что может явиться сигналом для увеличения массы функционирующих β-клеток и возможностей секреции инсулина, что, предположительно, может удлинять преддиабетический период, который на самом деле может продолжаться много лет!
В этой связи следует указать, что в настоящее время существует огромный интерес в изучении сигналов, приводящих к увеличению массы β-клеток на данной стадии развития патологического процесса. К сожалению, недостаточно проработанный, но вероятный вариант объяснения этого факта заключается в том, что существует механизм обратной связи между инсулинорезистентностью и функцией β-клеток поджелудочной железы. В связи с чем на фоне снижения чувствительности к инсулину развивается гипергликемия, которая, в свою очередь, будет способствовать стимулирование β-клеточного роста и создание возможностей для адекватной данному состоянию секреции инсулина. При относительно нормальных уровнях глюкозы, очевидно, только вышеуказанного объяснения будет недостаточно, и требуются дополнительные исследования.
К сожалению, недостаточно проработанный, но вероятный вариант объяснения этого факта заключается в том, что существует механизм обратной связи между инсулинорезистентностью и функцией β-клеток поджелудочной железы. В связи с чем на фоне снижения чувствительности к инсулину развивается гипергликемия, которая, в свою очередь, будет способствовать стимулирование β-клеточного роста и создание возможностей для адекватной данному состоянию секреции инсулина. При относительно нормальных уровнях глюкозы, очевидно, только вышеуказанного объяснения будет недостаточно, и требуются дополнительные исследования.
В литературе существуют и другие версии объяснений, в частности что существует обратная связь по принципу «закрытой петли», которая тщательно регулируется, подобно термостату, поддерживающему температуру в очень узком диапазоне. В связи с этим даже очень небольшие изменения в уровне глюкозы могут приводить к изменениям точки отсчета в глюкозостимулированной секреции инсулина, в конечном итоге поддерживающей «нормальные» уровни глюкозы в плазме крови.
Также важную роль в достижении и поддержании быстрого равновесия между внеклеточной и внутриклеточной глюкозой играют транспортеры глюкозы, в частности ГЛЮТ-2, который обеспечивает нормальные уровни глюкозы в плазме крови.
Трудно определить точный диапазон уровней глюкозы для стадии 2 – стабильная адаптация, однако уровни глюкозы натощак между 5,0–7,3 ммоль/л (89–130 мг%), на наш взгляд, являются разумной аппроксимацией.
На стадии стабильной адаптации β-клетки уже не могут обеспечивать истинно нормальный уровень глюкозы. Однако эта стадия считается стабильной, потому что если бы не наличие некоторых процессов, таких как аутоиммунитет, способствующий быстрой деструкции β-клеток, пациенты могли бы находиться долгое время на стадии 2, при отсутствии прогрессирования патологического процесса.
Параллельно повышению уровня глюкозы во время стадии 2 происходят важные изменения дифференциации и функции β-клеток. Наиболее хорошо изученным и наиболее впечатляющим изменением является выпадение глюкозостимулированной секреции инсулина (ГССИ). В частности, было показано, что нормальный ГССИ остается до тех пор, пока уровень гликемии сохраняется <5,6 ммоль/л (100 мг%). Однако снижение ГССИ начинает драматически проявляться при уровнях глюкозы выше, чем 5,6%, а при уровнях гликемии натощак выше, чем 6,4 ммоль/л (114 мг%), ГССИ полностью исчезает! В то же время, несмотря на потерю ГССИ (1-я фаза), сохранена 2-я фаза в секреции инсулина в ответ на глюкозу, а также сохранен острый ответ на так называемые неглюкозные стимулы (например, аргинин).
В частности, было показано, что нормальный ГССИ остается до тех пор, пока уровень гликемии сохраняется <5,6 ммоль/л (100 мг%). Однако снижение ГССИ начинает драматически проявляться при уровнях глюкозы выше, чем 5,6%, а при уровнях гликемии натощак выше, чем 6,4 ммоль/л (114 мг%), ГССИ полностью исчезает! В то же время, несмотря на потерю ГССИ (1-я фаза), сохранена 2-я фаза в секреции инсулина в ответ на глюкозу, а также сохранен острый ответ на так называемые неглюкозные стимулы (например, аргинин).
В настоящее время потеря глюкозостимулированной секреции инсулина объясняется либо гипотезой глюкозотоксичности, либо гипотезой липотоксичности. Однако эти гипотезы требуют дополнительной проверки. Хотя в клинической практике нормализация показателей углеводного и жирового обмена приводит и к восстановлению 1-й фазы в секреции инсулина, и к прандиальной регуляции.
Следует отметить, что лица, у которых развивается сахарный диабет 2 типа, могут находиться на стадии 2 до тех пор, пока не разовьется потеря пластичности, а масса функционирующих β-клеток перестает адекватно реагировать на возрастающие потребности организма в инсулине. Предполагается, что стадия 2 заканчивается, когда уровень глюкозы натощак становится выше, чем 7,3 ммоль/л (130 мг%) и относительно быстро может от стадии 3 – стадии нестабильной ранней декомпенсации – перейти в стадию 4, характеризующуюся уровнями гликемии 16–20 ммоль/л (285–350 мг%)!
Предполагается, что стадия 2 заканчивается, когда уровень глюкозы натощак становится выше, чем 7,3 ммоль/л (130 мг%) и относительно быстро может от стадии 3 – стадии нестабильной ранней декомпенсации – перейти в стадию 4, характеризующуюся уровнями гликемии 16–20 ммоль/л (285–350 мг%)!
Аналогичная быстрая прогрессия патологического процесса может быть также при сахарном диабете 1 типа, однако при этом типе диабета стадия 2 длится очень непродолжительное время.
Стадия стабильной декомпенсации – стадия 4 – может быть также достаточно скоротечной в связи с продолжающейся потерей массы функционирующих β-клеток, что в финале приводит к тяжелой декомпенсации – стадия 5.
Лица, которые прогрессировали от стадии 3 к клиническому диабету на стадии 4, как правило, имеют достаточную секрецию инсулина, что позволяет им остаться на этой стадии и что подтверждается отсутствием кетоацидоза у этих пациентов. В большинстве случаев эта стадия может оставаться всю жизнь у лиц с сахарным диабетом 2 типа и, напротив, может быстро прогрессировать в стадию 5 у больных сахарным диабетом 1 типа, в силу аутоиммунной деструкции.
Морфометрические исследования поджелудочной железы postmortem у лиц, болевших сахарным диабетом 2 типа, свидетельствуют о снижении массы функционирующих β-клеток на ~ 50% по сравнению с контролем. В этой связи следует отметить, что существуют данные о том, что при уменьшении массы β-клеток на 50% возможности секреции инсулина также снижаются на 50%! (рис. 4).
На стадии тяжелой декомпенсации происходит значительная потеря массы β-клеток, причем в такой степени выраженности, что у этих пациентов развивается кетоацидоз, и терапия инсулином действительно необходима им для сохранения жизни.
Характерно, что у пациентов, имеющих стадию тяжелой декомпенсации, уровни гликемии, как правило, > 22 ммоль/л, хотя могут меняться в зависимости от характера питания и степени обезвоживания. Аналогичная ситуация обычно имеет место у больных сахарным диабетом 1 типа или у больных после трансплантации поджелудочной железы или культуры β-клеток, когда большинство клеток разрушены аутоиммунным процессом. Такая ситуация, однако, крайне редко встречается при типичном сахарном диабете 2 типа, но возможна в случаях воздействия некоторых токсинов или в случаях тяжелого панкреатита.
Такая ситуация, однако, крайне редко встречается при типичном сахарном диабете 2 типа, но возможна в случаях воздействия некоторых токсинов или в случаях тяжелого панкреатита.
Несомненно, определенный интерес представляют также результаты исследований, посвященные синтезу и первым минутам жизни инсулина в организме человека. Так, на сегодняшний день изучена общая последовательность событий, происходящих от этапа транскрипции гена инсулина до этапа секреции (рис. 5).
Было отмечено, что возможны нарушения как на этапе формировании молекулы инсулина, так и на этапах превращения проинсулина в инсулин.
Говоря о базальной секреции инсулина в норме, известно, что β-клетки превращают проинсулин в инсулин и С-пептид в эквивалентных количествах. Однако не весь инсулин поступает в периферический кровоток, так как около 60% его удаляется (очищается) при первом прохождении через печень. Таким образом, концентрация инсулина в портальной вене будет в 2–3 раза выше, чем в периферическом кровотоке.
Кроме того, следует помнить, что клиренс инсулина происходит также в почках, при этом почки удаляют до 40% инсулина. В результате концентрация инсулина в норме у худых субъектов обычно составляет 18–90 пикомоль/л. И для того чтобы поддерживать эти значения инсулина, его секреция варьирует от 0,25 до 1,25 ед/час.
Также принципиально важное значение имели результаты исследований последних лет, которые были посвящены различным нарушениям в секреции инсулина при сахарном диабете 2 типа. Так, были установлены следующие наиболее часто встречающиеся дефекты.
Снижение или потеря первой фазы в глюкозостимулированной секреции инсулина.
Снижение или неадекватность (↓,↑) секреции инсулина и на другие стимулы (например, пища).
Изменения в осцилляторной секреции инсулина (ускорение пульса, нерегулярность пульса, снижение амплитуды и несовпадение с суточным, также пульсовым характером секреции глюкозы).

Потенциально обратимое снижение секреции инсулина вследствие глюкозотоксичности и липотоксичности.
Усиление секреции проинсулина.
С практической точки зрения определенное значение будет иметь сопоставление динамики глюкозы и инсулина в ответ на пероральный глюкозотолерантный тест у лиц с нарушенной толерантностью к глюкозе и у пациентов с сахарным диабетом 2 типа по сравнению со здоровыми лицами (рис. 6).
Следует подчеркнуть, что пациенты с сахарным диабетом 2 типа были разделены на две подгруппы. В первой подгруппе уровень гликемии натощак был < 8,3 ммоль/л (~ 6,6–7,7 ммоль/л), а во второй подгруппе гликемия натощак была > 8,3 ммоль/л.
Обращает на себя внимание факт усиления секреции инсулина в группе лиц с НТГ, что свидетельствует о хороших компенсаторных возможностях на этом этапе развития событий. Также следует иметь ввиду, что у лиц с сахарным диабетом 2 типа и концентрацией глюкозы < 8,3 ммоль/л создается впечатление о достаточной количественной секреции инсулина, но имеет место опоздание во времени, что уже свидетельствует о проблемах прандиальной регуляции.
И, наконец, наличие плоской инсулинемической кривой говорит об отсутствии адекватной реакции β-клеток поджелудочной железы в ответ на нагрузку глюкозой у больных сахарным диабетом 2 типа, при гликемии натощак > 8,3 ммоль/л. Этот факт указывает на необходимость более внимательного отношения в плане выбора тактики лечения у этих пациентов и, может быть, назначения инсулинотерапии на более ранних этапах лечения.
Продолжая тему прандиальной регуляции у больных сахарным диабетом вследствие выпадения первой фазы в секреции инсулина, необходимо особо отметить, что первая фаза в секреции инсулина появляется в норме в портальной вене уже через 60–120 секунд (!), а в периферическом кровотоке – через 3–4 минуты. Этот ответ продолжается, как правило, в течение 10 минут и отражает немедленную секрецию инсулина, который уже был синтезирован и находился в секреторных гранулах в непосредственной близости к мембране β-клетки.
Было показано (Kahn, 1993), что величина первой фазы в секреции инсулина зависит от двух факторов:
1) скорость и величина вводимой глюкозы;
2) степень инсулиночувствительности.
Интересно отметить, что вторая фаза в секреции инсулина также начинается немедленно после болюса глюкозы, но она замаскирована первой фазой в течение первых 10 минут. Начиная с этого времени (10 минут) вторая фаза начинает проявляться и продолжается в течение всего периода гипергликемии. Эта фаза обеспечивается и первично синтезированным инсулином, и инсулином, который синтезируется вновь. Вторая фаза в секреции инсулина повышается линейно, начиная от уровня глюкозы 13,9 ммоль/л, и достигает своего максимума при концентрации глюкозы выше, чем 25 ммоль/л. Таким образом, когда речь идет об истощении β-клеток поджелудочной железы, то имеется ввиду выпадение как первой, так и второй фаз в секреции инсулина.
Завершая материал, касающийся инсулиносекреции при сахарном диабете 2 типа, необходимо отметить, что в настоящее время активно изучаются и другие, в том числе и неглюкозные, стимулы.
Как видно из данного материала, много уже сделано и изучено, однако важнейшей задачей сегодня является разработка путей коррекции различных нарушений функции (пластичности) β-клеток поджелудочной железы при сахарном диабете 2 типа.
Инсулин и резистентность к инсулину — PMC
1. Всемирная организация здравоохранения. Ожирение: предотвращение и борьба с глобальной эпидемией, серия докладов о консультациях ВОЗ. Всемирная организация здравоохранения, Женева, 2000 г. [PubMed]
2. Cefalu WT. Резистентность к инсулину: клеточные и клинические концепции. Exp Biol Med (Maywood) 2001; 226:13–26. [PubMed] [Google Scholar]
3. Reaven G. Метаболический синдром или синдром резистентности к инсулину? Разные названия, разные концепции и разные цели. Эндокринол Метаб Клин Норт Ам. 2004; 33: 283–303. [PubMed] [Академия Google]
4. Блисс М. История лечения диабета инсулином. 1993; 16 (Приложение 3): 4–7. [PubMed] [Google Scholar]
5. Домашний PD. Инсулинотерапия. В: Alberti KGMM, Zimmet P, редакторы Defronzo RA и Keen H (Hon) редактор International Textbook of Diabetes Mellitus (2 nd ed) John Wiley & Sons, New York; 1997 г. с. 899–928.
6. Додсон Г., Штайнер Д. Роль сборки в биосинтезе инсулина. Curr Opin Struct Biol. 1998; 8: 189–94. [PubMed] [Google Scholar]
Curr Opin Struct Biol. 1998; 8: 189–94. [PubMed] [Google Scholar]
7. Schroder D, Zuhlke H. Генная технология, характеристика гена инсулина и связь с исследованиями диабета. Эндокринология. 1982;79:197–209. [PubMed] [Google Scholar]
8. Malaisse WJ. Биосинтез и секреция инсулина in vitro . В: редакторы Alberti KGMM, Zimmet P, Defronzo RA и Keen H (Hon). Международный учебник по сахарному диабету (2 и изд.), John Wiley & Sons, Нью-Йорк; 1997 г. с. 315–36.
9. Porksen N, Hollingdal M, Juhl C, Butler P, Veldhuis JD, Schmitz O. Пульсирующая секреция инсулина: обнаружение, регулирование и роль при диабете. Диабет. 2002; 51 (Приложение 1): S245–54. [PubMed] [Академия Google]
10. Братанова-Точкова Т.К., Cheng H, Daniel S, et al. Механизмы запуска и усиления, пулы гранул и двухфазная секреция инсулина. Диабет. 2002; 51 (Приложение 1): S83–90. [PubMed] [Google Scholar]
11. Nielsen JH, Galsgaard ED, Moldrup A, et al. Регуляция массы бета-клеток гормонами и факторами роста. Диабет. 2001; 50 (Приложение 1): S25–9. [PubMed] [Google Scholar]
Диабет. 2001; 50 (Приложение 1): S25–9. [PubMed] [Google Scholar]
12. De Lonlay, Saudubray J-M. Стойкая гиперинсулинемическая гипогликемия. В: Fernandes J, Sudubray J-M, van den Berghe editors Врожденные метаболические заболевания: диагностика и лечение. (3 rd ed): Springer, Гейдельберг, Германия; 2000 стр. 117–26.
13. Soria B, Quesada I, Ropero AB, Pertusa JA, Martin F, Nadal A. Новые игроки в передаче сигналов островков поджелудочной железы: от мембранных рецепторов до ядерных каналов. Диабет. 2004; 53 (Приложение 1): S86–91. [PubMed] [Google Scholar]
14. MacDonald PE, El-Kholy W, Riedel MJ, Salapatek AM, Light PE, Wheeler MB. Множественное действие GLP-1 на процесс стимулированной глюкозой секреции инсулина. Диабет. 2002; 51 (Приложение 3): S434–42. [PubMed] [Академия Google]
15. Гавел П.Я. Периферические сигналы, передающие метаболическую информацию в мозг: краткосрочная и долгосрочная регуляция потребления пищи и гомеостаза энергии. Exp Biol Med (Maywood) 2001; 226:963–77. [PubMed] [Google Scholar]
Exp Biol Med (Maywood) 2001; 226:963–77. [PubMed] [Google Scholar]
16. Нильсен Дж. Х., Серуп П. Молекулярная основа развития, роста и регенерации островков. Текущее мнение в области эндокринологии и диабета. 1998; 5: 97–107. [Google Scholar]
17. Kahn SE, McCulloch DK, Porte D. Секреция инсулина у здоровых людей и людей с диабетом. В: Alberti KGMM, Zimmet P, Defronzo RA, редакторы и Keen H, (достопочтенный) редактор. Международный учебник сахарного диабета. (2 nd ed) John Wiley & Sons, Нью-Йорк; 1997 г. с. 337–54.
18. Chen M., Porte D., Jr Влияние скорости и дозы инфузии глюкозы на острую реакцию инсулина у человека. J Clin Endocrinol Metab. 1976; 42: 1168–75. [PubMed] [Google Scholar]
19. Liu Z, Barrett EJ. Метаболизм белков человека: его измерение и регуляция. Am J Physiol Endocrinol Metab. 2002; 283:E1105–12. [PubMed] [Google Scholar]
20. Amery CM, Nattrass M. Жирные кислоты и секреция инсулина. Сахарный диабет Ожирение Metab. 2000; 2: 213–21. [PubMed] [Академия Google]
2000; 2: 213–21. [PubMed] [Академия Google]
21. Frost GS, Brynes AE, Dhillo WS, Bloom SR, McBurney MI. Влияние обогащения пасты клетчаткой и содержания жира на опорожнение желудка, реакцию GLP-1, глюкозы и инсулина на прием пищи. Eur J Clin Nutr. 2003; 57: 293–8. [PubMed] [Google Scholar]
22. Reaven GM. Влияние различий в количестве и виде пищевых углеводов на реакцию глюкозы и инсулина в плазме у человека. Am J Clin Nutr. 1979; 32: 2568–78. [PubMed] [Google Scholar]
23. Wolever TM. Гликемический индекс. Мировая диета Rev Nutr. 1990;62:120–85. [PubMed] [Google Scholar]
24. Efendic S, Portwood N. Обзор инкретиновых гормонов. Горм Метаб Рез. 2004; 36: 742–6. [PubMed] [Google Scholar]
25. Kido Y, Nakae J, Accili D. Рецептор инсулина и его клеточные мишени. J Clin Endocrinol Metab. 2001; 86: 972–9. [PubMed] [Google Scholar]
26. Уизерс Д.Дж., Уайт М. Перспектива: сигнальная система инсулина – общее звено в патогенезе диабета 2 типа. Эндокринология.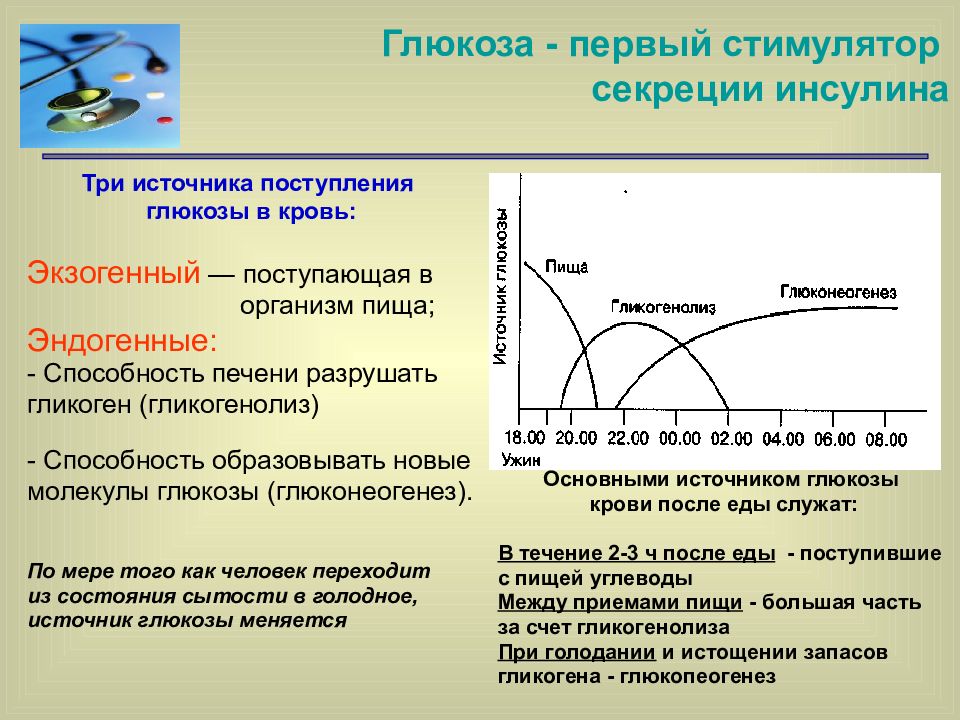 2000; 141:1917–21. [PubMed] [Академия Google]
2000; 141:1917–21. [PubMed] [Академия Google]
27. Burks DJ, White MF. Белки IRS и функция бета-клеток. Диабет. 2001; 50 (Приложение 1): S140–5. [PubMed] [Google Scholar]
28. Хантер С.Дж., Гарви В.Т. Действие инсулина и резистентность к инсулину: заболевания, связанные с дефектами рецепторов инсулина, сигнальной трансдукции и эффекторной системы транспорта глюкозы. Am J Med. 1998; 105:331–45. [PubMed] [Google Scholar]
29. Карам Дж. Х. Гормоны поджелудочной железы и сахарный диабет. В: Greenspan FS, Strewler GJ, редакторы. Фундаментальная и клиническая эндокринология. Appleton & Lange, Стэмфорд, Коннектикут, США; 1997 стр. 601–2.
30. Дентон Р.М., Таваре Дж.М. Молекулярные основы действия инсулина на внутриклеточный метаболизм. В: Alberti KGMM, Zimmet P, Defronzo RA, Keen H (Hon), редакторы. Международный учебник по сахарному диабету (2 и изд.), John Wiley & Sons, Нью-Йорк; 1997 г. с. 469–88.
31. Клеммонс Д.Р. Структурно-функциональный анализ инсулиноподобных факторов роста. Бр Мед Булл. 1989; 45: 465–80. [PubMed] [Google Scholar]
Бр Мед Булл. 1989; 45: 465–80. [PubMed] [Google Scholar]
32. Frystyk J, Ørskof H. IGFI, IGFII, IGF-связывающие белки и диабет. В: Alberti KGMM, Zimmet P, Defronzo RA, Keen H (достопочтенный), редакторы. Международный учебник по сахарному диабету (2 nd ed) John Wiley & Sons, Нью-Йорк; 1997 г. с. 417–36.
33. Уиткрофт С.Б., Уильямс И.Л., Шах А.М., Кирни М.Т. Патофизиологические последствия резистентности к инсулину на функцию эндотелия сосудов. Диабет Мед. 2003; 20: 255–68. [PubMed] [Google Scholar]
34. Smith U. Нарушение («диабетическое») передачи сигналов и действия инсулина происходит в жировых клетках задолго до непереносимости глюкозы — возникает ли резистентность к инсулину в жировой ткани? Int J Obes Relat Metab Disord. 2002;26:897–904. [PubMed] [Google Scholar]
35. Джорджино Ф., Лавиола Л., Эрикссон Дж.В. Региональные различия действия инсулина в жировой ткани: результаты исследований in vivo и in vitro. Acta Physiol Scand. 2005; 183:13–30.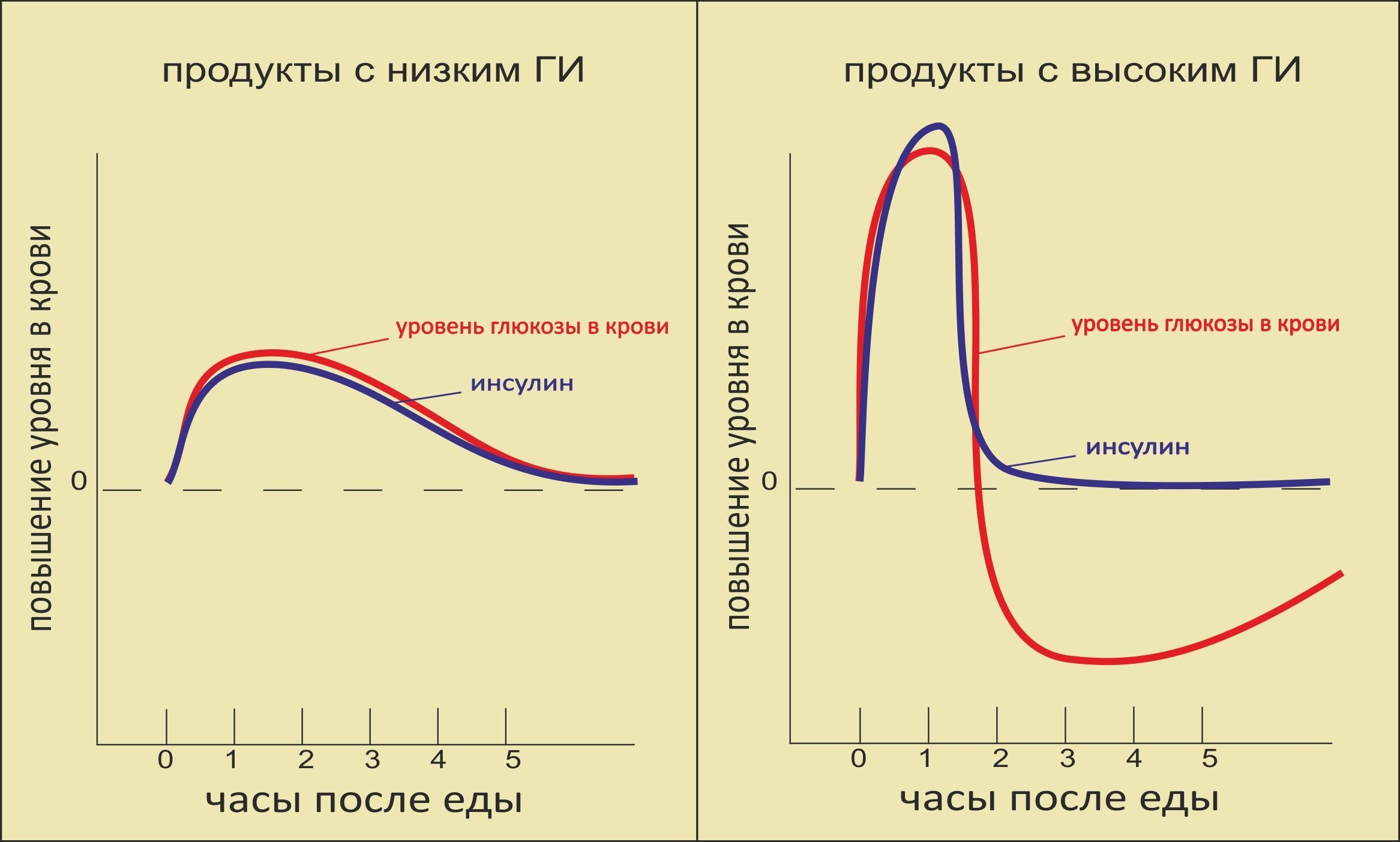 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
36. Халвациотис П.Г., Терк Д., Алзаид А., Диннин С., Рицца Р.А., Наир К.С. Влияние инсулина на кинетику лейцина при сахарном диабете 2 типа. Диабет Nutr Metab. 2002; 15: 136–42. [PubMed] [Google Scholar]
37. Гранди С.М. Каков вклад ожирения в метаболический синдром? Эндокринол Метаб Клин Норт Ам. 2004; 33: 267–82. [PubMed] [Академия Google]
38. Краусс Р.М., Сири П.В. Метаболические нарушения: триглицериды и липопротеины низкой плотности. Эндокринол Метаб Клин Норт Ам. 2004; 33: 405–15. [PubMed] [Google Scholar]
39. Деварадж С., Розенсон Р.С., Джиалал И. Метаболический синдром: оценка провоспалительного и прокоагулянтного статуса. Эндокринол Метаб Клин Норт Ам. 2004; 33: 431–53. [PubMed] [Google Scholar]
40. Stockhorst U, de Fries D, Steingrueber HJ, Scherbaum WA. Инсулин и ЦНС: влияние на прием пищи, память и эндокринные параметры, а также роль интраназального введения инсулина людям. Физиол Поведение. 2004; 83: 47–54. [PubMed] [Академия Google]
[PubMed] [Академия Google]
41. Герозиссис К. Мозговой инсулин и кормление: двусторонняя связь. Евр Дж Фармакол. 2004; 490:59–70. [PubMed] [Google Scholar]
42. Watson GS, Craft S. Роль резистентности к инсулину в патогенезе болезни Альцгеймера: последствия для лечения. Препараты ЦНС. 2003; 17:27–45. [PubMed] [Google Scholar]
43. Кулкарни Р.Н. Островковая бета-клетка. Int J Biochem Cell Biol. 2004; 36: 365–71. [PubMed] [Google Scholar]
44. Unger JW, Betz M. Инсулиновые рецепторы и белки передачи сигналов в гипоталамо-гипофизарной системе: взгляд на морфологические данные и функциональные последствия. Гистол Гистопатол. 1998;13:1215–24. [PubMed] [Google Scholar]
45. Unger JW, Lange W. Инсулиновые рецепторы в гипофизе: морфологические доказательства влияния на клетки, синтезирующие опиоидные пептиды. Сотовые Ткани Res. 1997; 288: 471–83. [PubMed] [Google Scholar]
46. Нагасака Ю., Канеко Т. [Молекулярная биология регуляции почечной функции — структура, функция и распределение рецептора-инсулина, глюкагона] Nippon Rinsho. 1992;50:2921–4. [PubMed] [Google Scholar]
1992;50:2921–4. [PubMed] [Google Scholar]
47. Сечи Л.А., Бартоли Э. Молекулярные механизмы инсулинорезистентности при артериальной гипертензии. Кровь Pres Suppl. 1996;1:47–54. [PubMed] [Google Scholar]
48. Порецкий Л., Калин М.Ф. Гонадотропная функция инсулина. Endocr Rev. 1987; 8: 132–41. [PubMed] [Google Scholar]
49. Самото Т., Маруо Т., Катаяма К., Барнеа Э.Р., Мочизук М. Измененная экспрессия рецепторов инсулина и инсулиноподобного фактора роста-1 в фолликулярных и стромальных отделах поликистозных яичников. Endocr J. 1993;40:413–24. [PubMed] [Google Scholar]
50. Abele V, Pelletier G, Tremblay RR. Радиоаутографическая локализация и регуляция рецепторов инсулина в семенниках крыс. J Прием Res. 1986;6:461–73. [PubMed] [Google Scholar]
51. Thomas DM, Udagawa N, Hards DK, et al. Экспрессия рецептора инсулина в первичных и культивируемых осеокластоподобных клетках. Кость. 1998; 23:181–186. [PubMed] [Google Scholar]
52. Lichtenstein AH, Schwab US. Связь пищевого жира с метаболизмом глюкозы. Атеросклероз. 2000; 150: 227–43. [PubMed] [Google Scholar]
Связь пищевого жира с метаболизмом глюкозы. Атеросклероз. 2000; 150: 227–43. [PubMed] [Google Scholar]
53. Bray GA, Lovejoy JC, Smith SR, et al. Влияние различных жиров и жирных кислот на ожирение, резистентность к инсулину и воспаление. Дж Нутр. 2002; 132: 2488–9.1. [PubMed] [Google Scholar]
54. Sampath H, Ntambi JM. Регуляция экспрессии генов полиненасыщенными жирными кислотами. Nutr Rev. 2004; 62: 333–9. [PubMed] [Google Scholar]
55. Simopoulos AP. Незаменимые жирные кислоты в здоровье и хронических заболеваниях. Am J Clin Nutr. 1999; 70 (3 Приложение): 560S–569S. [PubMed] [Google Scholar]
56. Borkman M, Chisholm DJ, Furler SM, et al. Влияние добавок рыбьего жира на метаболизм глюкозы и липидов при NIDDM. Диабет. 1989; 38: 1314–9. [PubMed] [Академия Google]
57. Friedberg CE, Janssen MJ, Heine RJ, Grobbee DE. Рыбий жир и гликемический контроль при диабете. Метаанализ. Уход за диабетом. 1998; 21: 494–500. [PubMed] [Google Scholar]
58. Wolever TM. Диетические углеводы и действие инсулина на человека. Бр Дж Нутр. 2000; 83 (Приложение 1): S97–102. [PubMed] [Google Scholar]
Wolever TM. Диетические углеводы и действие инсулина на человека. Бр Дж Нутр. 2000; 83 (Приложение 1): S97–102. [PubMed] [Google Scholar]
59. Toida S, Takahashi M, Shimizu H, Sato N, Shimomura Y, Kobayashi I. Влияние кормления с высоким содержанием сахарозы на накопление жира у самцов крыс Wistar. Обес Рез. 1996; 4: 561–8. [PubMed] [Академия Google]
60. Дэви Б.М., Мелби К.Л. Влияние углеводов, богатых клетчаткой, на симптомы синдрома X. J Am Diet Assoc. 2003; 103:86–96. [PubMed] [Google Scholar]
61. Beck B, Villaume C, Bau HM, et al. Долгосрочное влияние диеты с добавлением пшеничных отрубей на секрецию желудочно-кишечных гормонов и на усвоение питательных веществ у здорового человека. Хум Нутр Клин Нутр. 1986; 40: 25–33. [PubMed] [Google Scholar]
62. Cani PD, Dewever C, Delzenne NM. Фруктаны инулинового типа модулируют желудочно-кишечные пептиды, участвующие в регуляции аппетита (глюкагоноподобный пептид-1 и грелин) у крыс. Бр Дж Нутр. 2004;92: 521–6. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
63. Roberfroid M. Пищевые волокна, инулин и олигофруктоза: обзор, сравнивающий их физиологические эффекты. Crit Rev Food Sci Nutr. 1993; 33: 103–48. Опечатка в: Crit Rev Food Sci Nutr 1993; 33:553. [PubMed] [Google Scholar]
64. Хиггинс Дж.А. Устойчивый крахмал: метаболические эффекты и потенциальная польза для здоровья. J АОАС междунар. 2004; 87: 761–8. [PubMed] [Google Scholar]
65. Linn T, Santosa B, Gronemeyer D, et al. Влияние длительного потребления белка с пищей на метаболизм глюкозы у людей. Диабетология. 2000;43:1257–65. [PubMed] [Академия Google]
66. Гринфилд Дж.Р., Самарас К., Хейворд С.С., Чизхолм Д.Дж., Кэмпбелл Л.В. Благотворное постпрандиальное влияние небольшого количества алкоголя на факторы риска диабета и сердечно-сосудистых заболеваний: модификация резистентностью к инсулину. J Clin Endocrinol Metab. 2 ноября 2004 г. [Epub перед печатью] [PubMed]
67. Magis DC, Jandrain BJ, Scheen AJ. Алкоголь, чувствительность к инсулину и диабет. Преподобный Мед Льеж. 2003; 58: 501–7. [PubMed] [Google Scholar]
Преподобный Мед Льеж. 2003; 58: 501–7. [PubMed] [Google Scholar]
68. Андерсон Р.А. Хром, непереносимость глюкозы и диабет. J Am Coll Nutr. 1998;17:548–55. [PubMed] [Google Scholar]
69. Винсент Дж.Б. Биохимия хрома. Дж Нутр. 2000;130:715–8. [PubMed] [Google Scholar]
70. Fernandez-Real JM, Lopez-Bermejo A, Ricart W. Взаимосвязь между метаболизмом железа и диабетом. Диабет. 2002; 51: 2348–54. [PubMed] [Google Scholar]
71. Bhathena SJ, Velasquez MT. Благоприятная роль диетических фитоэстрогенов при ожирении и сахарном диабете. Am J Clin Nutr. 2002;76:1191–201. [PubMed] [Google Scholar]
72. Broadhurst CL, Polansky MM, Anderson RA. Инсулиноподобная биологическая активность водных экстрактов кулинарных и лекарственных растений in vitro. J Agric Food Chem. 2000;48:849–52. [PubMed] [Google Scholar]
73. Grassi D, Lippi C, Necozione, Desideri, Ferri C. Кратковременный прием темного шоколада сопровождается значительным повышением чувствительности к инсулину и снижением артериального давления у здоровых людей. Am J Clin Nutr. 2005; 81: 611–4. [PubMed] [Google Scholar]
Am J Clin Nutr. 2005; 81: 611–4. [PubMed] [Google Scholar]
74. Томас Э., Зорцано А., Рудерман Н.Б. Упражнения и сигнализация инсулина: историческая перспектива. J Appl Physiol. 2002; 93: 765–72. [PubMed] [Google Scholar]
75. Manson JE, Nathan DM, Krolewski AS, Stampfer MJ, Willett WC, Hennekens CH. Проспективное исследование физических упражнений и заболеваемости диабетом среди врачей-мужчин в США. ДЖАМА. 1992;268:63–7. [PubMed] [Google Scholar]
76. Knowler WC, Barrett-Connor E, Fowler SE, et al. Исследовательская группа программы профилактики диабета. Снижение заболеваемости диабетом 2 типа с помощью изменения образа жизни или метформина. НЭЖМ. 2002; 346: 393–403. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Tuomilehto J, Lindstrom J, Eriksson JG, et al. Финская исследовательская группа по профилактике диабета. Профилактика сахарного диабета 2 типа путем изменения образа жизни среди субъектов с нарушенной толерантностью к глюкозе. N Engl J Med. 2001; 344:1343–50. [PubMed] [Академия Google]
2001; 344:1343–50. [PubMed] [Академия Google]
78. Дом Г.Л. Регуляция экспрессии GLUT-4 в скелетных мышцах с помощью физических упражнений. J Appl Physiol. 2002; 93: 782–7. [PubMed] [Google Scholar]
79. Хенриксен Э.Дж. Влияние интенсивных упражнений и тренировок на резистентность к инсулину. J Appl Physiol. 2002; 93: 788–96. [PubMed] [Google Scholar]
80. Джулин Р. Зират. Вызванные физическими упражнениями изменения в передаче сигналов инсулина в скелетных мышцах. J Appl Physiol. 2002; 93: 773–81. [PubMed] [Google Scholar]
81. Ван ден Берге Г. Как контроль уровня глюкозы в крови с помощью инсулина спасает жизни в реанимации? Джей Клин Инвест. 2004; 114:1187–9.5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Маретт А. Медиаторы индуцированной цитокинами резистентности к инсулину при ожирении и других воспалительных состояниях. Curr Opin Clin Nutr Metab Care. 2002; 5: 377–83. [PubMed] [Google Scholar]
83. Росмонд Р. Роль стресса в патогенезе метаболического синдрома. Психонейроэндокринология. 2005; 30:1–10. [PubMed] [Google Scholar]
Психонейроэндокринология. 2005; 30:1–10. [PubMed] [Google Scholar]
84. Spiegel K, Leproult R, Van Cauter E. Влияние дефицита сна на метаболические и эндокринные функции. Ланцет. 1999;354:1435–9. [PubMed] [Google Scholar]
85. Вгонцас А.Н., Масторакос Г., Бикслер Э.О., Калес А., Голд П.В., Хрусос Г.П. Влияние лишения сна на активность гипоталамо-гипофизарно-надпочечниковой оси и оси роста: потенциальные клинические последствия. Clin Endocrinol (Oxf) 1999; 51: 205–15. [PubMed] [Google Scholar]
86. Ворона Р.Д., Winn MP, Babineau TW, Eng BP, Feldman HR, Ware JC. Пациенты с избыточным весом и ожирением в первичной медицинской помощи сообщают о меньшем сне, чем пациенты с нормальным индексом массы тела. Arch Intern Med. 2005; 165: 25–30. [PubMed] [Академия Google]
87. Spiegel K, Tasali E, Penev P, Van Cauter E. Сокращение сна у здоровых молодых мужчин связано со снижением уровня лептина, повышением уровня грелина и усилением чувства голода и аппетита. Энн Интерн Мед. 2004; 141:846–50. [PubMed] [Google Scholar]
2004; 141:846–50. [PubMed] [Google Scholar]
88. Mullington J, Hermann D, Holsboer F, Pollmacher T. Возрастное подавление ночных уровней гормона роста во время депривации сна. Нейроэндокринология. 1996; 64: 233–41. [PubMed] [Google Scholar]
89. Хью Ф.Л., О’Нил Д., Камарудин Н., Алфорд Ф.П., Бест Д.Д. Дефицит гормона роста и риск сердечно-сосудистых заболеваний. Baillieres Clin Endocrinol Metab. 1998;12:199–216. [PubMed] [Google Scholar]
90. Tassone F, Lanfranco F, Gianotti L, et al. Синдром обструктивного апноэ сна ухудшает чувствительность к инсулину независимо от антропометрических показателей. Clin Endocrinol (Oxf) 2003; 59: 374–379. [PubMed] [Google Scholar]
91. Yee B, Liu P, Philips C, Grunstein R. Нейроэндокринные изменения при апноэ во сне. Curr Opin Pulm Med. 2004; 10: 475–81. [PubMed] [Google Scholar]
92. Бьютт Н.Ф. Углеводный и липидный обмен при беременности: нормальный по сравнению с гестационным сахарным диабетом. Am J Clin Nutr. 2000;71(прил.):1256С–61С. [PubMed] [Академия Google]
2000;71(прил.):1256С–61С. [PubMed] [Академия Google]
93. Сили Э.В., Соломон К.Г. Инсулинорезистентность и ее потенциальная роль в гипертонии, вызванной беременностью. J Clin Endocrinol Metab. 2003; 88: 2393–8. [PubMed] [Google Scholar]
94. Vague J. Степень мужской дифференциации ожирения: фактор, определяющий предрасположенность к сахарному диабету, атеросклерозу, подагре и мочекаменной болезни. 1956. Обес Рез. 1996; 4: 204–12. [PubMed] [Google Scholar]
95. Aronne LJ, Segal KR. Показатели результатов ожирения и распределения жира: оценка и клинические последствия. Обес Рез. 2002; 10 (Приложение 1): 14S–21S. [PubMed] [Академия Google]
96. Томлинсон Дж.В., Синха Б., Буджальска И., Хьюисон М., Стюарт П.М. Экспрессия 11-бета-гидроксистероиддегидрогеназы 1 типа в жировой ткани не увеличивается при ожирении человека. J Clin Endocrinol Metab. 2002; 87: 5630–5. [PubMed] [Google Scholar]
97. Персегин Г., Петерсен К., Шульман Г.И. Клеточный механизм резистентности к инсулину: потенциальные связи с воспалением. Int J Obes Relat Metab Disord. 2003; 27 (Приложение 3): S6–11. [PubMed] [Google Scholar]
Int J Obes Relat Metab Disord. 2003; 27 (Приложение 3): S6–11. [PubMed] [Google Scholar]
98. Jansson PA, Pellme F, Hammarstedt A, et al. Новый клеточный маркер резистентности к инсулину и раннего атеросклероза у людей связан с нарушением дифференцировки жировых клеток и низким уровнем адипонектина. FASEB J. 2003; 17:1434–40. [PubMed] [Академия Google]
99. Ривен ГМ. Важность выявления пациента с избыточным весом, который получит наибольшую пользу от потери веса. Энн Интерн Мед. 2003; 138:420–3. [PubMed] [Google Scholar]
100. Бресслер П., Де Фронцо Р.А. В: Alberti KGMM, Zimmet P, Defronzo RA, Keen H (достопочтенный), редакторы. Международный учебник по сахарному диабету (2 и изд.), John Wiley & Sons, Нью-Йорк; 1997 г. с. 213–54.
101. Анант Дж., Парамесваран С., Гунатилаке С. Побочные эффекты атипичных антипсихотических препаратов. Курр Фарм Дез. 2004;10:2219–29. [PubMed] [Google Scholar]
102. Чен Д., Мишра А., Гарг А. Липодистрофия у пациентов, инфицированных вирусом иммунодефицита человека. J Clin Endocrinol Metab. 2002; 87: 4845–56. [PubMed] [Google Scholar]
J Clin Endocrinol Metab. 2002; 87: 4845–56. [PubMed] [Google Scholar]
103. Lebovitz HE. Пероральные противодиабетические средства. Мед Клин Норт Ам. 2004; 88: 847–63. икс-х. [PubMed] [Google Scholar]
104. Эрманн Д.А. Синдром поликистоза яичников. N Engl J Med. 2005; 352:1223–36. [PubMed] [Google Scholar]
105. Fernandez J, Smit GPA. Болезни накопления гликогена. В: Fernandes J, Sudubray J-M, van den Berghe, editors. Врожденные метаболические заболевания: диагностика и лечение. (3 -е изд. ). Springer, Гейдельберг, Германия; 2000 р. 86–101.
106. Гарг А., Мишра А. Липодистрофии: редкие нарушения, вызывающие метаболический синдром. Эндокринол Метаб Клин Норт Ам. 2004; 33: 305–31. [PubMed] [Google Scholar]
107. Maassen JA, Hart LM, Van Essen E, et al. Митохондриальный диабет: молекулярные механизмы и клиническая картина. Диабет. 2004; 53 (Приложение 1): S103–9. [PubMed] [Google Scholar]
108. Panetta J, Smith LJ, Boneh A. Эффект высоких доз витаминов, кофермента Q и диеты с высоким содержанием жиров у детей с митохондриальными заболеваниями.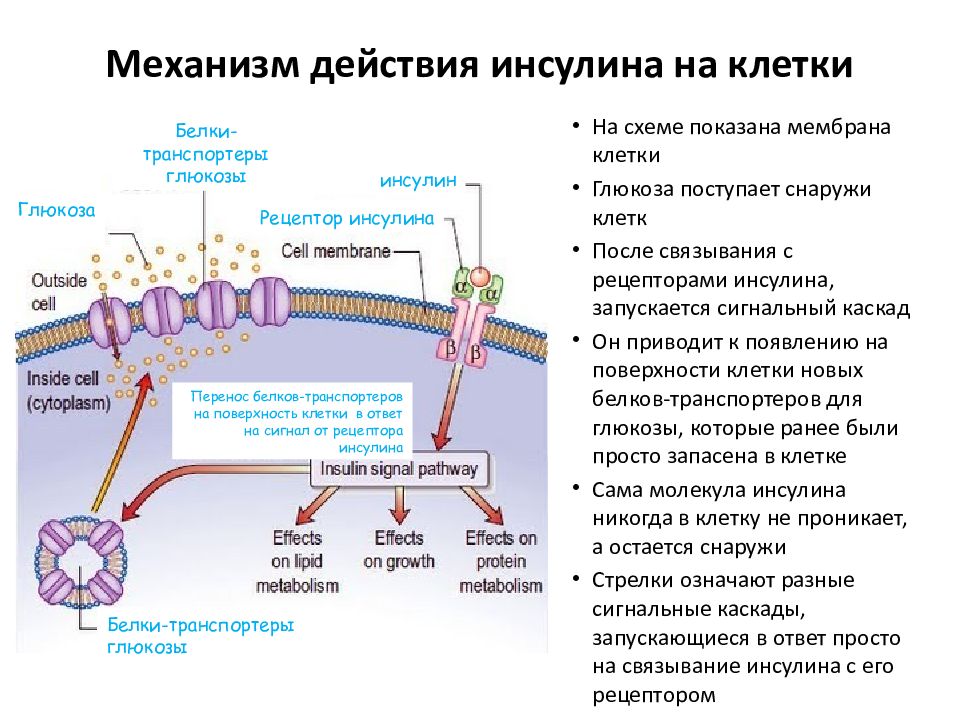 J Наследовать Metab Dis. 2004; 27: 487–9.8. [PubMed] [Google Scholar]
J Наследовать Metab Dis. 2004; 27: 487–9.8. [PubMed] [Google Scholar]
109. Педерсен К.Ф., Дюфур С., Бефрой Д., Гарсия Р., Шульман Г.И. Нарушенная митохондриальная активность у резистентного к инсулину потомства больных сахарным диабетом 2 типа. N Engl J Med. 2004; 350:660–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Giacchero R, Fiorir L, Scaglioni S, Sala M, Giovanni M. Резистентность к инсулину и функция поджелудочной железы при болезни накопления гликогена Тип 1. J Inherit Metab Dis. 2003; 26 (дополнение 2): 124. [Академия Google]
111. Scheuner MT, Raffel LJ, Rotter JI. Генетика диабета. В: Alberti KGMM, Zimmet P, Defronzo RA, Keen H (достопочтенный), редакторы. Международный учебник по сахарному диабету (2 и изд.), John Wiley & Sons, Нью-Йорк; 1997 г. с. 37–88.
112. Борнстейн Дж. Методика анализа малых количеств инсулина с использованием аллоксановых диабетических, гипофизэктомированных и адреналэктомированных крыс. Aust J Exp Biol Med Sci. 1950; 28: 87–91. [PubMed] [Google Scholar]
1950; 28: 87–91. [PubMed] [Google Scholar]
113. Yalow, RS, Berson SA. Иммуноанализ эндогенного инсулина плазмы человека. Джей Клин Инвест. 1960;39:1157–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
114. Bjorntorp P. Вызывают ли стрессовые реакции абдоминальное ожирение и сопутствующие заболевания? Obes Rev. 2001; 2:73–86. [PubMed] [Google Scholar]
115. Bass J, Turek FW. Бессонница в Америке: путь к ожирению и метаболическому синдрому? Arch Intern Med. 2005; 165:15–6. [PubMed] [Google Scholar]
116. Гранди С.М. Каков вклад ожирения в метаболический синдром? Эндокринол Метаб Клин Норт Ам. 2004; 33: 267–82. [PubMed] [Академия Google]
117. Ривен ГМ. Инсулинорезистентность/компенсаторная гиперинсулинемия, гипертоническая болезнь и сердечно-сосудистые заболевания. J Clin Endocrinol Metab. 2003; 88: 2399–403. [PubMed] [Google Scholar]
118. Wang CC, Goalstone ML, Draznin B. Молекулярные механизмы резистентности к инсулину, влияющие на сердечно-сосудистую биологию. Диабет. 2004; 53: 2735–40. [PubMed] [Google Scholar]
Диабет. 2004; 53: 2735–40. [PubMed] [Google Scholar]
119. Шинозаки К., Кашиваги А., Масада М., Окамура Т. Молекулярные механизмы нарушения функции эндотелия, связанные с резистентностью к инсулину. Curr Drug нацелен на сердечно-сосудистую гемоболическую дисфункцию. 2004; 4:1–11. [PubMed] [Академия Google]
120. Джейкобс Х.С., Конвей Г.С. Лептин, поликистозные яичники и синдром поликистозных яичников. Обновление воспроизведения гула. 1999; 5: 166–71. [PubMed] [Google Scholar]
121. Ангуло П., Линдор К.Д. Неалкогольная жировая болезнь печени. J Гастроэнтерол Гепатол. 2002; 17 (Прил.): S186–90. [PubMed] [Google Scholar]
122. Calle EE, Kaaks R. Избыточный вес, ожирение и рак: эпидемиологические данные и предлагаемые механизмы. Нат Рев Рак. 2004; 4: 579–91. [PubMed] [Google Scholar]
123. Komninou D, Ayonote A, Richie JP, Jr, Rigas B. Резистентность к инсулину и ее вклад в канцерогенез толстой кишки. Exp Biol Med (Мейвуд) 2003; 228:396–405. [PubMed] [Google Scholar]
124. Каакс Р. Питание, гормоны и рак молочной железы: является ли инсулин недостающим звеном? Рак вызывает контроль. 1996; 7: 605–25. [PubMed] [Google Scholar]
Каакс Р. Питание, гормоны и рак молочной железы: является ли инсулин недостающим звеном? Рак вызывает контроль. 1996; 7: 605–25. [PubMed] [Google Scholar]
125. Lanfranco F, Gianotti L, Pivetti S, et al. У пациентов с ожирением с синдромом обструктивного апноэ сна наблюдается своеобразное изменение кортикотрофной, но не тиротрофной и лактотрофной функции. Clin Endocrinol (Oxf) 2004; 60:41–8. [PubMed] [Google Scholar]
126. Wilcox I, McNamara SG, Collins FL, Grunstein RR, Sullivan CE. «Синдром Z»: взаимодействие апноэ сна, сосудистых факторов риска и заболеваний сердца. грудная клетка. 1998;53 (Приложение 3):S25–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
127. Chin K, Shimizu K, Nakamura T, et al. Изменения уровня интраабдоминального висцерального жира и лептина в сыворотке крови у пациентов с синдромом обструктивного апноэ сна после назальной терапии постоянным положительным давлением в дыхательных путях. Тираж. 1999; 100: 706–12. [PubMed] [Google Scholar]
128. Сапин Р. Анализы инсулина: ранее известные и новые аналитические функции. Клин Лаборатория. 2003;49:113–21. [PubMed] [Академия Google]
Сапин Р. Анализы инсулина: ранее известные и новые аналитические функции. Клин Лаборатория. 2003;49:113–21. [PubMed] [Академия Google]
129. Wallace TM, Levy JC, Matthews DR. Использование и злоупотребление моделированием HOMA. Уход за диабетом. 2004; 27:1487. [PubMed] [Google Scholar]
130. Wallace TM, Matthews DR. Оценка инсулинорезистентности у человека. Диабет Мед. 2002; 19: 527–34. [PubMed] [Google Scholar]
131. Сикарис К.А. Клиническая биохимия ожирения. Clin Biochem Rev. 2004; 25:165–82. [Статья бесплатно PMC] [PubMed] [Google Scholar]
132. Белфиоре Ф., Янелло С., Волпичелли Г. Индексы чувствительности к инсулину, рассчитанные на основе базального и индуцированного ПГТТ уровня инсулина, глюкозы и СЖК. Мол Жене Метаб. 1998;63:134–41. [PubMed] [Google Scholar]
133. McLaughlin T, Abbasi F, Cheal K, Chu J, Lamendola C, Reaven G. Использование метаболических маркеров для выявления людей с избыточным весом, резистентных к инсулину. Энн Интерн Мед. 2003; 139: 802–9. [PubMed] [Google Scholar]
2003; 139: 802–9. [PubMed] [Google Scholar]
5 лучших продуктов для улучшения резистентности к инсулину
Если у вас есть резистентность к инсулину, вы можете уменьшить ее или даже обратить вспять, приняв привычки здорового образа жизни, такие как регулярные физические упражнения и здоровое питание.
Резистентность к инсулину возникает, когда клетки вашего тела плохо реагируют на инсулин. Инсулин вырабатывается поджелудочной железой и помогает переносить глюкозу из крови в клетки, где она используется для получения энергии. Если у вас резистентность к инсулину, ваша поджелудочная железа должна вырабатывать большее количество инсулина, чтобы поддерживать нормальный уровень глюкозы в крови.
Употребление в пищу продуктов, повышающих уровень сахара в крови, заставляет поджелудочную железу выделять инсулин для поглощения сахаров. Потребление большого количества продуктов, повышающих уровень сахара в крови, оказывает большую нагрузку на поджелудочную железу. Со временем этот дополнительный стресс может ухудшить резистентность к инсулину, и ваше состояние может прогрессировать до диабета 2 типа.
Со временем этот дополнительный стресс может ухудшить резистентность к инсулину, и ваше состояние может прогрессировать до диабета 2 типа.
«Соблюдение диеты с низким содержанием рафинированных или простых углеводов может помочь вашему организму лучше контролировать уровень сахара и может улучшить резистентность к инсулину», — говорит Шелби Хоскинс, MS, RD, LMNT, CDCES, преподаватель диабета в штате Небраска и зарегистрированный диетолог.
Этого можно достичь, соблюдая более сбалансированную диету, включающую сочетание продуктов из разных групп продуктов, таких как фрукты и овощи, цельнозерновые продукты, фасоль и бобовые, а также полезные молочные продукты и жиры. «Это поможет вам медленнее переваривать пищу, что приведет к более медленному и устойчивому повышению уровня сахара в крови и более устойчивому уровню энергии», — отмечает Хоскинс.
Еще один способ замедлить рост сахара в крови — сочетать источник углеводов с белком или полезным жиром. Например, соедините яблоко с арахисовым маслом, цельнозерновые крекеры с сыром или банан с миндалем.
Хотя вам не нужно полностью исключать какие-либо продукты из своего рациона, важно знать, как определенные продукты влияют на уровень сахара в крови, и как сбалансировать или компенсировать их с помощью других продуктов питания, говорит Хоскинс.
Хоскинс рекомендует следующие продукты, чтобы обеспечить более стабильный источник энергии и поддержать чувствительность к инсулину.
1. Сложные углеводы
Эти виды пищи богаты клетчаткой и питательными веществами. Чтобы узнать, цельное ли это зерно, прочитайте этикетку, говорит Хоскинс. Первый ингредиент должен начинаться со слова «цельный», например, цельная пшеница или цельный овес.
Сложные углеводы включают:
- Цельнозерновая пшеница
- Овес
- Коричневый рис
- Лебеда
- Цельнозерновой хлеб
- Макаронные изделия из цельного зерна
- Цельный ячмень
- Просо
- Булгарская пшеница
- Гречка
- Цельная рожь
- Цельная кукуруза
2. Нежирные белки
Нежирные белки
- Нежирные куски красного мяса
- Цыпленок
- Рыба, такая как лосось, тунец и форель
- Фасоль, чечевица и бобовые
- Орехи и семена
- Ореховые масла
3. Фрукты
Все фрукты богаты клетчаткой и питательными веществами, но некоторые содержат больше сахара, чем другие, например, виноград и бананы. Поэтому, если вы хотите съесть большую порцию, имейте в виду, что вы можете съесть чашку ягод по сравнению с половиной банана примерно с тем же содержанием сахара, говорит Хоскинс. Имея это в виду, некоторые фрукты с низким содержанием углеводов включают:
- Арбуз, дыня и персики
- Апельсины, манго и ананас
- Ягоды, такие как малина, клубника и черника
4. Овощи
Хотя овощи всегда являются хорошим выбором, имейте в виду, что некоторые овощи, такие как картофель и сладкий картофель, содержат больше крахмала, чем другие, и содержат больше углеводов. К овощам с низким содержанием углеводов или без них относятся:
К овощам с низким содержанием углеводов или без них относятся:
- Брокколи
- Темная листовая зелень
- Помидоры
- Перец
- Огурцы
- Морковь
5. Молочные продукты и полезные жиры
- Арахисовое масло
- Йогурт с высоким содержанием белка и низким содержанием углеводов (пример: греческий йогурт)
- Сыры
- Гайки
- Яйца, сваренные вкрутую
Продукты, которые следует ограничить:
Продукты с высоким содержанием добавленных сахаров могут перегрузить способность организма вырабатывать достаточное количество инсулина, поэтому их следует ограничивать.
К ним относятся:
- Подслащенные напитки, такие как газированные напитки, обычные фруктовые соки, сладкий чай или лимонад
- Продукты с высоким содержанием насыщенных жиров, такие как цельное молоко, сливочное масло, кокосовое масло и красное мясо
- Сладкие сладости, такие как конфеты, печенье, пирожные и мороженое
- Белый хлеб, рис, макаронные изделия и мучные изделия
- Упакованные пищевые продукты и закуски с высокой степенью переработки
- Консервированные фрукты, которые часто упаковывают в сахарный сироп (найдите без добавления сахара)
- Жареные продукты
- Алкоголь
Советы по составлению сбалансированной инсулинорезистентной диеты
Попытка внести изменения в свой рацион, необходимые для соблюдения этого выбора продуктов питания, поначалу может показаться непосильной задачей. Чтобы упростить задачу, Хоскинс рекомендует следующие советы:
Чтобы упростить задачу, Хоскинс рекомендует следующие советы:
- Ставьте перед собой небольшие реалистичные цели. «Выберите для изменения одну или две вещи, которые легче достижимы», — говорит она. «Они не должны быть огромными изменениями. Может быть, это добавление двух-трех овощей в свой рацион в день или сокращение или исключение соков или газированных напитков с сахаром».
- Установите временной интервал. Затем дополняйте его по мере достижения целей
- Не кори себя, если у тебя плохой день. Примите решение начать все заново на следующий день и вернуться на правильный путь
Нужна помощь в контроле уровня сахара в крови?
Позвоните нам по телефону 800.922.0000, чтобы назначить встречу с одним из наших специалистов.
Вы спросили, мы ответили: Что такое инсулинорезистентность?
Что такое инсулинорезистентность? Если я вырабатываю инсулин, то почему я должен принимать лекарства от диабета?
Подробнее
Разница между резистентностью к инсулину и преддиабетом
Предиабет и резистентность к инсулину — возможно, вы слышали, что эти термины используются вместе.

