Катаболизм
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
ABC
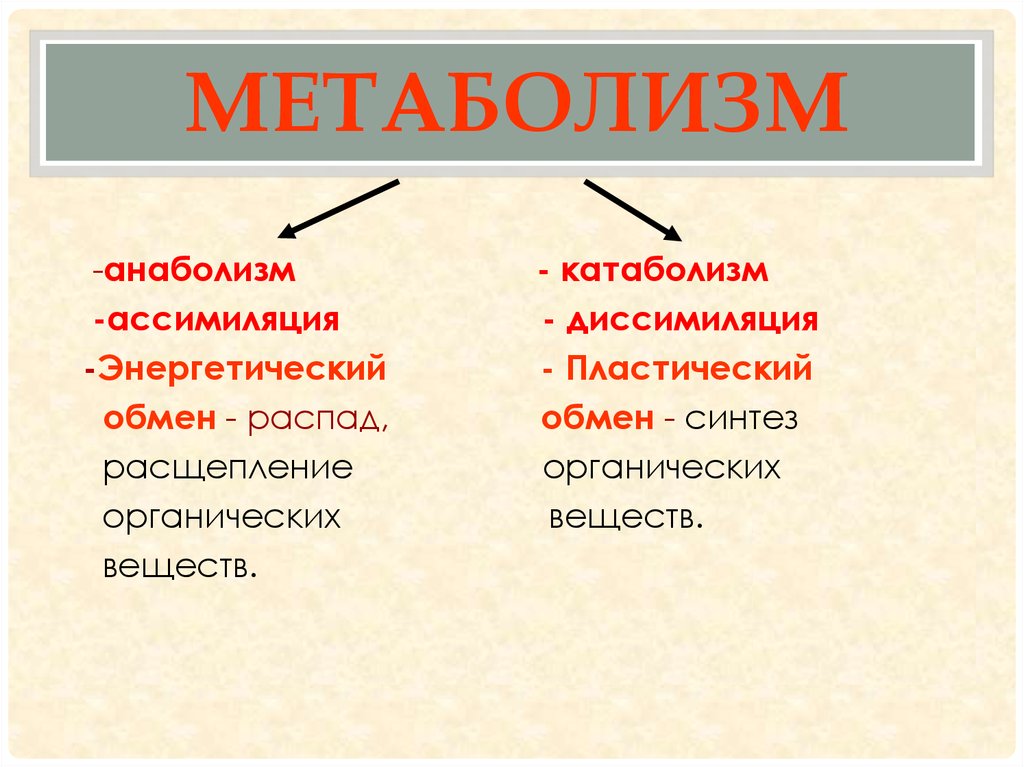
Катаболизм
Катаболизм (от греч. katabole — сбрасывание, разрушение), совокупность химических процессов, составляющих противоположную анаболизму сторону обмена веществ.Катаболизм это первый враг спортсмена на пути сохранения приобретенных путем силовых тренировок мышц. В результате катаболизма происходит разрушение мышечной ткани: белки распадаются на исходные аминокислоты, которые частично идут на биосинтез, а частично просто выводятся из организма. Такие гормоны, как кортизол, глюкагон и адреналин сдвигают баланс обмена веществ в сторону преобладания катаболизма, и в том числе распада мышечной ткани. Стрессы, ограничительные диеты, чрезмерные нагрузки и недосыпания создают неблагоприятный гормональный фон, что негативно сказывается на состоянии мышечной ткани. На мышечную массу влияют два различных фактора: скорость анаболизма, увеличивающего мышцу, и скорость катаболизма, уменьшающего её. Два этих процесса происходят постоянно в мышцах. Если скорость анаболизма выше скорости катаболизма, то вы наращиваете массу.
katabole — сбрасывание, разрушение), совокупность химических процессов, составляющих противоположную анаболизму сторону обмена веществ.Катаболизм это первый враг спортсмена на пути сохранения приобретенных путем силовых тренировок мышц. В результате катаболизма происходит разрушение мышечной ткани: белки распадаются на исходные аминокислоты, которые частично идут на биосинтез, а частично просто выводятся из организма. Такие гормоны, как кортизол, глюкагон и адреналин сдвигают баланс обмена веществ в сторону преобладания катаболизма, и в том числе распада мышечной ткани. Стрессы, ограничительные диеты, чрезмерные нагрузки и недосыпания создают неблагоприятный гормональный фон, что негативно сказывается на состоянии мышечной ткани. На мышечную массу влияют два различных фактора: скорость анаболизма, увеличивающего мышцу, и скорость катаболизма, уменьшающего её. Два этих процесса происходят постоянно в мышцах. Если скорость анаболизма выше скорости катаболизма, то вы наращиваете массу. Если скорость катаболизма выше, вы теряете мышечную массу. По окончании тренировки повышенный фон кортизола так и остается на высоком уровне, продолжая во время отдыха «сжигать» ткани нашего организма, особенно мышцы, превращая аминокислоты мышечной ткани в глюкозу, хотя в это время нам нужно совсем другое, нам нужно восстанавливать потраченные во время тренировки ресурсы и восстанавливать, добиваясь прогресса в увеличении выносливости, мышечной массы и силы.Чем сильнее тренировочный стресс, тем больше мы расходуем энергии в единицу времени, тем ниже уровень глюкозы в крови и тем сильнее сигнал о необходимости секретировать как можно большее количество кортизола, что бы этот уровень глюкозы повысить, превратив аминокислоты мышечной ткани (преимущественно ВСАА, глютамин) в глюкозу. Этот процесс называется глюконеогенез – образование глюкозы из не углеводных источников.Но катаболизм возникает не только после тренировки. Утро — вот настоящий ужас для спортсмена. Как только мы просыпаемся организму в огромных количествах нужны аминокислоты и глюкоза.
Если скорость катаболизма выше, вы теряете мышечную массу. По окончании тренировки повышенный фон кортизола так и остается на высоком уровне, продолжая во время отдыха «сжигать» ткани нашего организма, особенно мышцы, превращая аминокислоты мышечной ткани в глюкозу, хотя в это время нам нужно совсем другое, нам нужно восстанавливать потраченные во время тренировки ресурсы и восстанавливать, добиваясь прогресса в увеличении выносливости, мышечной массы и силы.Чем сильнее тренировочный стресс, тем больше мы расходуем энергии в единицу времени, тем ниже уровень глюкозы в крови и тем сильнее сигнал о необходимости секретировать как можно большее количество кортизола, что бы этот уровень глюкозы повысить, превратив аминокислоты мышечной ткани (преимущественно ВСАА, глютамин) в глюкозу. Этот процесс называется глюконеогенез – образование глюкозы из не углеводных источников.Но катаболизм возникает не только после тренировки. Утро — вот настоящий ужас для спортсмена. Как только мы просыпаемся организму в огромных количествах нужны аминокислоты и глюкоза. И именно с этой повышенной секрецией кортизола нам и следует бороться принимая Протеин, либо аминокислотные комплексы, либо BCAA они отлично восполнят запас аминокислот в организме. Можно ещё во время тренеровки добавлять глюкозу (чем ниже уровень глюкозы в крови и тем сильнее сигнал о необходимости секретировать как можно большее количество кортизола) в аминокислоты или ВСАА, в этом случае происходит выброс инсулина, который так же является антикатаболиком. Не следует добавлять глюкозу если вы находитесь на сбросе жира так как инсулин остановит движение жирных кислот на переработку в энергию, тут следует увеличить дозировку аминокислот,ВСАА что бы катаболизм не добрался до ваших мышц, по этой причине как ни странно бы это звучало белка нам нужно больше на сбросе жира, а не на наборе массы.
И именно с этой повышенной секрецией кортизола нам и следует бороться принимая Протеин, либо аминокислотные комплексы, либо BCAA они отлично восполнят запас аминокислот в организме. Можно ещё во время тренеровки добавлять глюкозу (чем ниже уровень глюкозы в крови и тем сильнее сигнал о необходимости секретировать как можно большее количество кортизола) в аминокислоты или ВСАА, в этом случае происходит выброс инсулина, который так же является антикатаболиком. Не следует добавлять глюкозу если вы находитесь на сбросе жира так как инсулин остановит движение жирных кислот на переработку в энергию, тут следует увеличить дозировку аминокислот,ВСАА что бы катаболизм не добрался до ваших мышц, по этой причине как ни странно бы это звучало белка нам нужно больше на сбросе жира, а не на наборе массы.
Назад в раздел
Metabolism: Catabolism and Anabolism | Biology
7.1: Что такое метаболизм?
Обзор
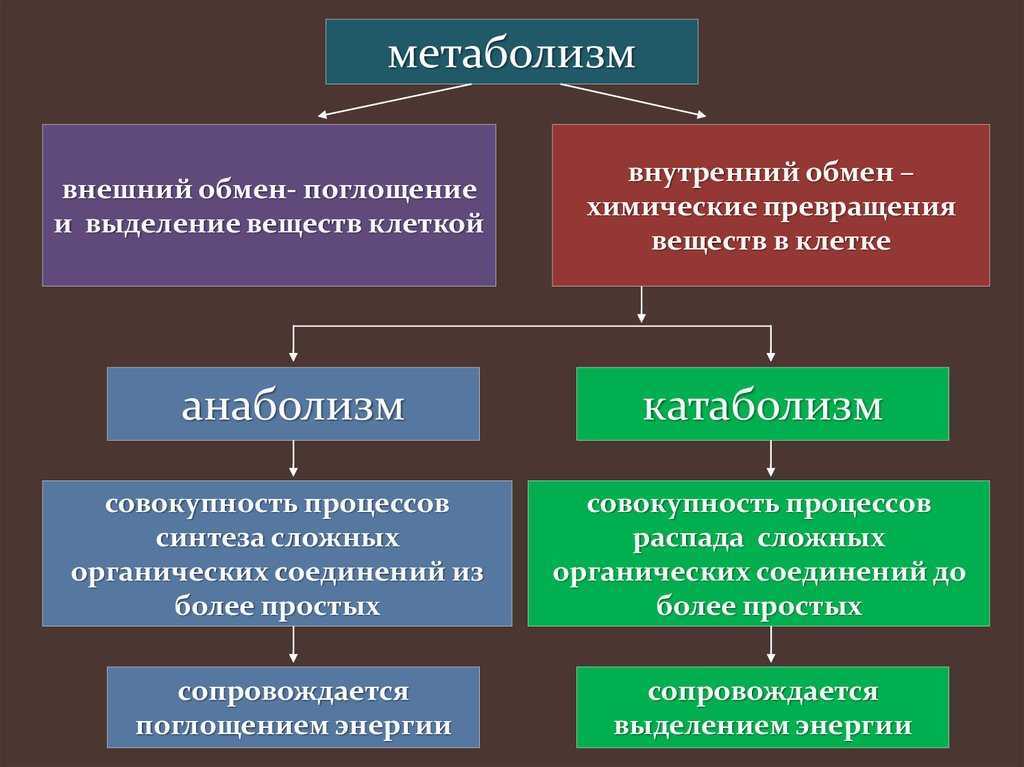
Метаболизм представляет всю химическую активность в клетке, включая реакции, которые строят молекулы (анаболизм) и те, которые разбивают молекулы вниз (катаболизм).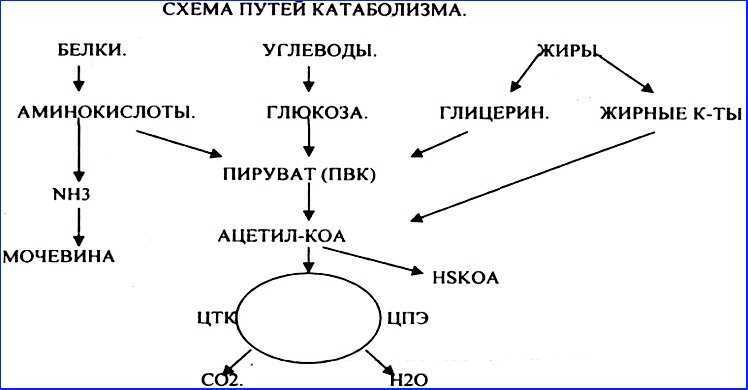 Анаболические реакции требуют энергии, в то время как катаболические реакции обеспечивают его. Таким образом, метаболизм описывает, как клетки преобразуют энергию через различные химические реакции, которые часто становятся более эффективными с помощью ферментов.
Анаболические реакции требуют энергии, в то время как катаболические реакции обеспечивают его. Таким образом, метаболизм описывает, как клетки преобразуют энергию через различные химические реакции, которые часто становятся более эффективными с помощью ферментов.
Метаболизм – это сумма всех химических реакций, которые происходят в организме
Метаболизм является управление энергией в клетках и обеспечивает три ключевые функции:
- преобразование пищи в энергию для запуска различных клеточных процессов,
- производство энергии для создания клеточных компонентов, и
- удаление отходов.
Для получения энергии макромолекулы из пищи должны быть разбиты на более мелкие молекулы – через катаболический путь. Это, в свою очередь, дает энергию для построения больших молекул из небольших строительных блоков через анаболический путь. Другими словами, потенциальная энергия в пище, состоящая из химической энергии, хранящейся в связях между атомами, может быть преобразована в кинетическую энергию, которая может быть использована для клеточных реакций. Ферменты являются важными молекулярными инструментами в метаболических путей, так как они значительно ускорить многие химические реакции за счет сокращения количества необходимой энергии.
Ферменты являются важными молекулярными инструментами в метаболических путей, так как они значительно ускорить многие химические реакции за счет сокращения количества необходимой энергии.
Катаболические пути разбиваются молекулы и высвобождают энергию
Катаболизм является распад макромолекул для любых целей. Это включает в себя деградацию молекул пищи в меньшие молекулы, которые могут быть использованы в качестве строительных блоков, процесс, который высвобождает энергию, которая передается в АТФ. Переваривание белка является примером катаболизма. Для того, чтобы организм использует белок, который мы едим, он должен быть разбит из больших белковых молекул на более мелкие полипептиды, а затем на отдельные аминокислоты.
Избыток аминокислот, которые разбиты для удаления релиз, азотсодержащих аммиака. Этот аммиак является токсичным на высоких уровнях, и, таким образом, должны быть преобразованы в более безопасную форму, что организмы могут обрабатывать и распоряжаться. У людей аммиак сочетается с углекислым газом и преобразуется в мочевину, прежде чем быть выведенным из организма в виде мочи. Другие организмы используют различные виды азотных отходов, таких как мочевая кислота у птиц и рептилий. По сравнению с мочевиной, мочевая кислота требует гораздо меньше воды, чтобы быть освобождены из организма и, следовательно, имеет адаптивное значение определенных условий.
Другие организмы используют различные виды азотных отходов, таких как мочевая кислота у птиц и рептилий. По сравнению с мочевиной, мочевая кислота требует гораздо меньше воды, чтобы быть освобождены из организма и, следовательно, имеет адаптивное значение определенных условий.
Анаболические пути синтезируют сложные молекулы
Анаболические пути строят большие молекулы из небольших молекул строительного блока, используя энергию (в виде АТФ). Например, белковая анаболия включает в себя нанизывания аминокислот для формирования полипептидов. Синтезированные полипептиды затем складываются в трехмерные белковые структуры. Избыток аминокислот может быть использован для того чтобы сделать триглицериды и хранить как сало, или преобразован в глюкозу и использован для того чтобы сделать ATP. Таким образом, как анаболические, так и катаболические пути необходимы для поддержания энергетического баланса.
Другим, менее известным примером анаболизма является производство конденсированных танинов в семенах. Семена, которые едят животные могут быть защищены от пищеварения, если их семена пальто содержат темного цвета, сгущенные дубильные вещества. Растения производят танины, связывая молекулы антоциана, используя те же реакции обезвоживания, используемые для создания полипептидов.
Семена, которые едят животные могут быть защищены от пищеварения, если их семена пальто содержат темного цвета, сгущенные дубильные вещества. Растения производят танины, связывая молекулы антоциана, используя те же реакции обезвоживания, используемые для создания полипептидов.
Литература для дополнительного чтения
Heindel, Jerrold J., Bruce Blumberg, Mathew Cave, Ronit Machtinger, Alberto Mantovani, Michelle A. Mendez, Angel Nadal, et al. “Metabolism Disrupting Chemicals and Metabolic Disorders.” Reproductive Toxicology (Elmsford, N.Y.) 68 (2017): 3–33. [Source]
Lam, Yan Y., and Eric Ravussin. “Analysis of Energy Metabolism in Humans: A Review of Methodologies.” Molecular Metabolism 5, no. 11 (September 20, 2016): 1057–71. [Source]
Катаболизм – определение, этапы, важность и часто задаваемые вопросы
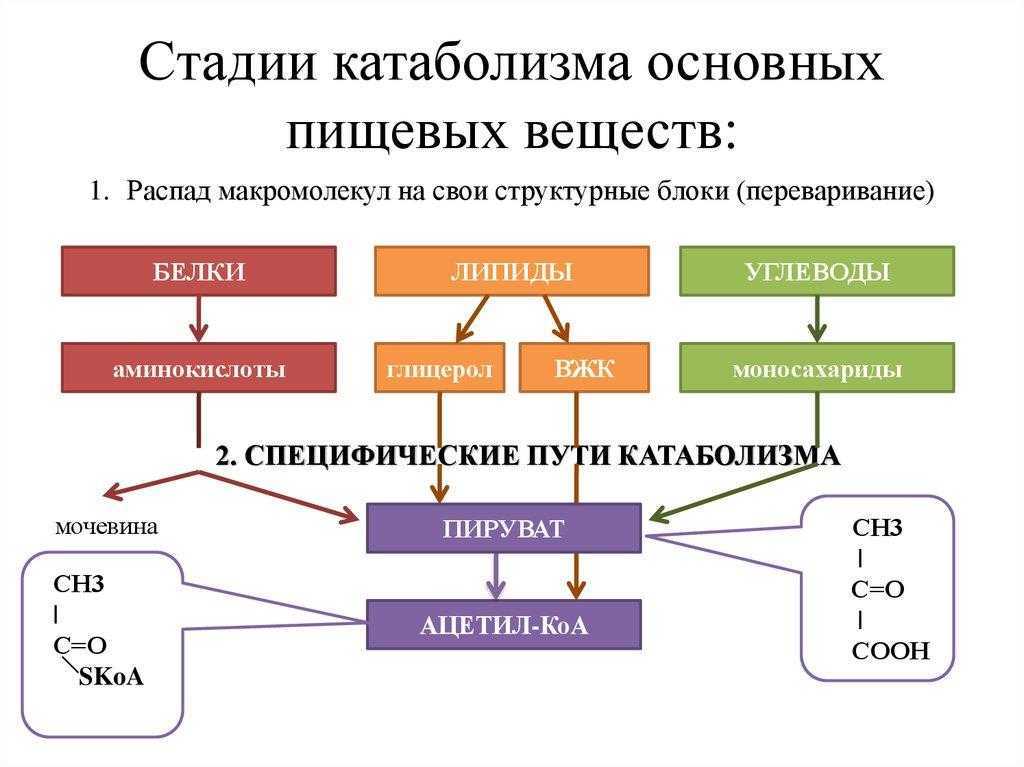
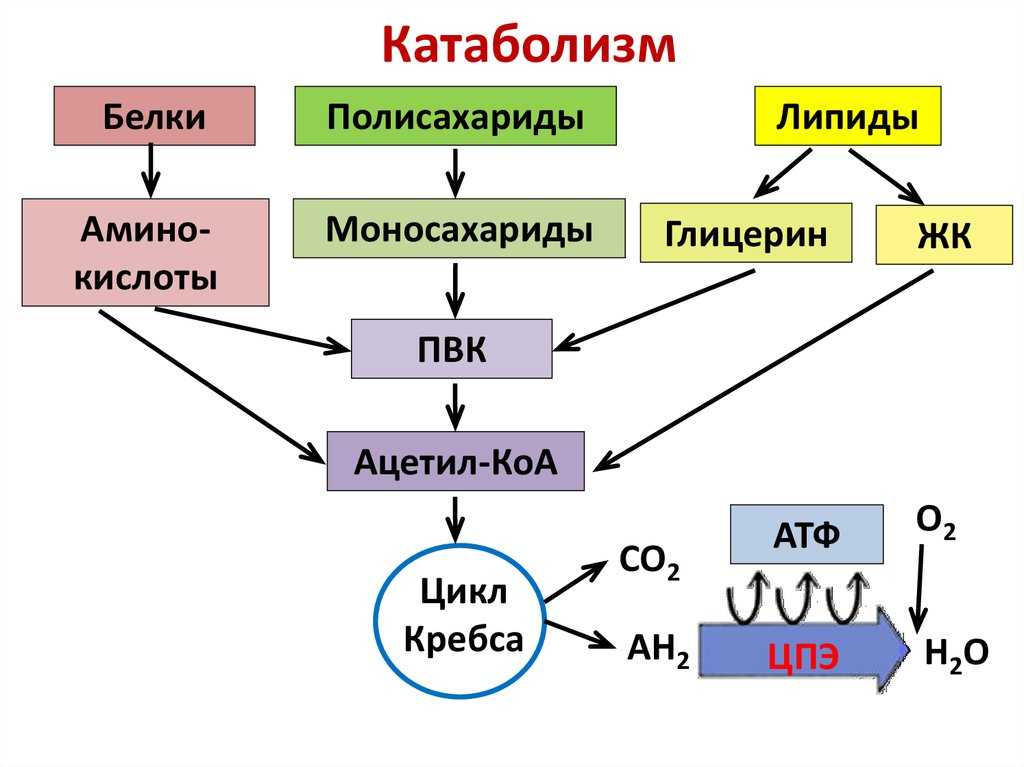
Катаболизм означает расщепление сложных молекул. Это означает, что катаболизм — это расщепление сложных веществ на их составные части (такие как аминокислоты, глюкоза и жирные кислоты), которые образуют субстраты для метаболических путей.
Метаболизм состоит в основном из двух основных частей, одну из которых можно определить как анаболизм, а другую как катаболизм. Процесс катаболизма представляет собой действие набора метаболических путей, которые расщепляют молекулы на более мелкие единицы, которые могут быть либо окислены для высвобождения энергии, либо могут использоваться в других анаболических реакциях.
(Изображение будет загружено в ближайшее время)
Примечание. Процесс катаболизма включает расщепление больших молекул, таких как липиды, полисахариды, нуклеиновые кислоты и белки, на более мелкие единицы, такие как жирные кислоты, моносахариды, аминокислоты и, соответственно.
Катаболизм в различных организмах
Точная природа катаболических реакций варьируется от организма к организму, и ее можно классифицировать в соответствии с их источниками энергии и углеродом, которые могут быть приведены ниже.
Органотрофы — использует органические источники в качестве источника энергии.
Литотрофы – используются неорганические субстраты.
Фототроф — использует солнечный свет в качестве химической энергии.
Катаболизм можно разделить на 3 стадии. Эти три стадии объясняются следующим образом.
Этап 1 — Стадия пищеварения
Крупные органические молекулы органической химии, такие как липиды, белки и полисахариды, перевариваются в более мелкие компоненты их внешних клеток. Эта стадия воздействует на белки целлюлозы или крахмал, которые не могут быть поглощены клетками напрямую.
Стадия 2 — Высвобождение энергии
После того, как молекулы расщепляются, они поглощаются клетками и превращаются в еще более мелкие молекулы, как правило, в ацетилкофермент А, который высвобождает некоторое количество энергии.
Стадия 3 — Хранение энергии
Высвобожденная энергия затем запасается за счет восстановления кофермента никотинамидадениндинуклеотида в НАДН.
Этот полный процесс обеспечивает химическую энергию, необходимую для роста клеток и их поддержания. Несколькими примерами катаболических процессов являются цикл лимонной кислоты, гликолиз, расщепление мышечного белка с использованием аминокислот в качестве субстратов для расщепления жира в жировой ткани до жирных кислот, глюконеогенез и окислительное дезаминирование нейротрансмиттеров моноаминоксидазой.
(Изображение будет загружено в ближайшее время)
Катаболические гормоны
Различные сигналы управляют концепцией катаболизма, где большинство известных сигналов представляют собой молекулы и гормоны, участвующие в самом метаболизме. Традиционно эндокринологи классифицируют различные гормоны как катаболические и анаболические в зависимости от того, какую часть метаболизма они стимулируют.
С начала 20 века так называемые классические катаболические гормоны известны как глюкагон, кортизол и адреналин (и другие катехоламины).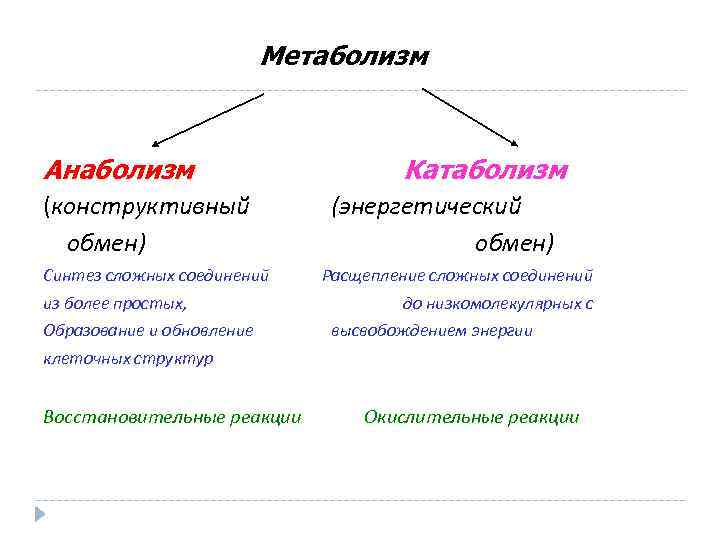 В последние десятилетия было обнаружено большинство гормонов с по крайней мере несколькими катаболическими эффектами, такие как орексин (также называемый гипокретином), цитокины и мелатонин.
В последние десятилетия было обнаружено большинство гормонов с по крайней мере несколькими катаболическими эффектами, такие как орексин (также называемый гипокретином), цитокины и мелатонин.
Катаболизм белков
В молекулярной биологии катаболизм белков можно определить как расщепление белков на простые производные соединения и аминокислоты для транспорта в клетку через плазматическую мембрану и полимеризацию в новые белки, в конечном итоге через рибосомы рибонуклеиновые кислоты (РНК ). Катаболизм белков — это расщепление макромолекул, что, по сути, представляет собой процесс пищеварения.
Катаболизм белков чаще всего осуществляется неспецифическими экзо- и эндопротеазами. Однако некоторые конкретные протеазы используются для расщепления белка в целях регулирования и для целей доставки белков. Примером может служить подкласс протеолитических ферментов, известный как олигопептидаза.
Аминокислоты, полученные в результате катаболизма, могут быть непосредственно переработаны для производства новых белков и превращены в различные аминокислоты или подвергнуты катаболизму аминокислот, которые должны быть преобразованы в другие соединения посредством цикла Кребса.
Важность катаболических путей
Катаболический путь или путь деградации превращает сложное вещество в более простые единицы.
Их использование можно перечислить следующим образом, где они также приведены в качестве примеров катаболических путей.
При гликолизе 6-углеродная глюкоза расщепляется до 3-углеродного пирувата. Итак, этот пируват используется в синтезе различных других компонентов. (катаболизм, происходящий внутри клетки.
В кишечнике соки воздействуют на белки и превращают их в пептон, который легко расщепляется до аминокислоты и легко всасывается в кровь (катаболизм в кишечнике).
Превращение гликогена (разветвленного полимера глюкозы) в глюкозу происходит при недостатке глюкозы в крови (катаболизм преимущественно в печеночно-кровяной среде)9.
 0003
0003
Значение не ограничивается только этими двумя. Помимо этого, у него есть многочисленные подсчеты. И анаболизм, и катаболизм поддерживают постоянную концентрацию питательных веществ в нашем организме.
Разница между катаболическим и анаболическим путями
Катаболизм — это метаболизм, который расщепляет сложные молекулы на более простые, тогда как анаболизм — это метаболические пути, которые создают сложные молекулы из более простых.
Лучшим примером катаболизма является расщепление глюкозы до молочной кислоты. Многие из этих путей являются экзергоническими, что означает, что они высвобождают энергию и генерируют АТФ (аденозинтрифосфат).
Преобразование молочной кислоты обратно в глюкозу в печени является анаболическим путем, известным как глюконеогенез. Для этого требуется вход АТФ, как и для большинства анаболических путей.
Биохимия, катаболизм белков — StatPearls
Введение
Катаболизм белков — это расщепление белков на усваиваемые мономеры для дальнейшей деградации или повторной сборки.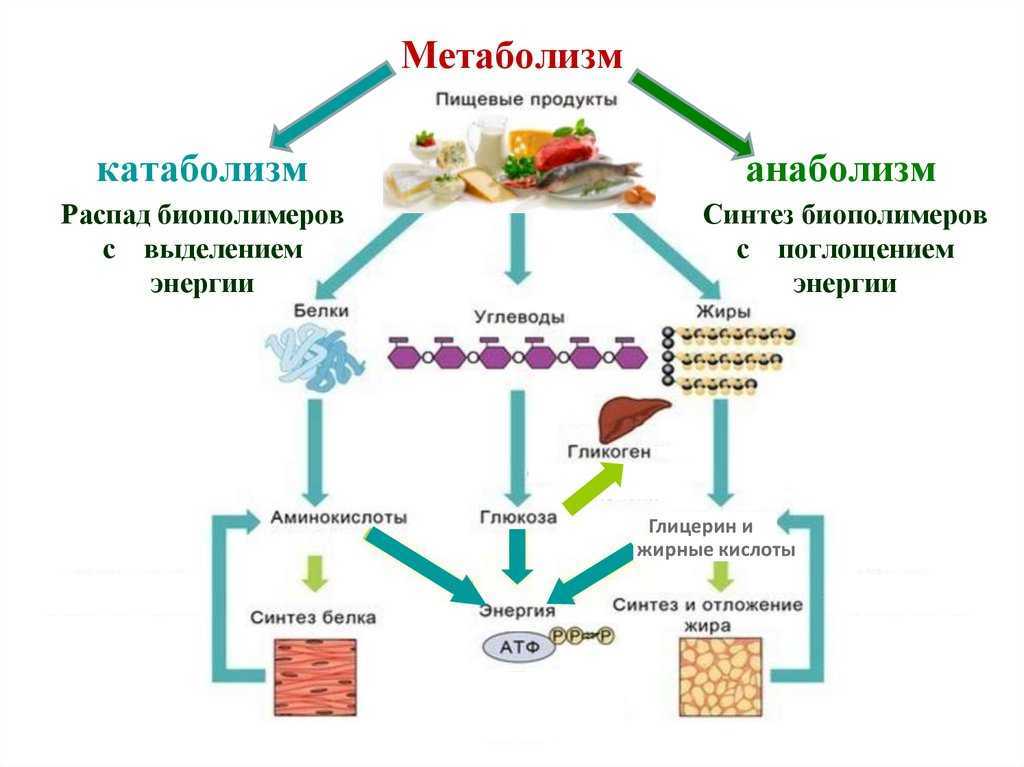 Катаболизм белков в просвете кишечника важен по нескольким причинам, одна из которых — мобилизация незаменимых аминокислот для всасывания. Незаменимые аминокислоты не могут синтезироваться в организме человека, но необходимы для биосинтеза жизненно важных белков, поэтому их единственным источником является расщепление полипептидов с помощью пищеварительных ферментов. Этот процесс начинается в желудке и продолжается в тонкой кишке. Большие белковые цепи разбираются, чтобы в конечном итоге оставить свободные аминокислоты, которые могут попасть в кровь и транспортироваться к различным клеткам тела для дальнейшего расщепления.
Катаболизм белков в просвете кишечника важен по нескольким причинам, одна из которых — мобилизация незаменимых аминокислот для всасывания. Незаменимые аминокислоты не могут синтезироваться в организме человека, но необходимы для биосинтеза жизненно важных белков, поэтому их единственным источником является расщепление полипептидов с помощью пищеварительных ферментов. Этот процесс начинается в желудке и продолжается в тонкой кишке. Большие белковые цепи разбираются, чтобы в конечном итоге оставить свободные аминокислоты, которые могут попасть в кровь и транспортироваться к различным клеткам тела для дальнейшего расщепления.
Эндопептидазы в форме зимогена высвобождаются слизистой оболочкой желудка и экзокринной частью поджелудочной железы для расщепления полипептидной цепи между определенными аминокислотными остатками. Находясь в меньшей форме, экзопептидазы удаляют последние аминокислоты с C- или N-конца дипептида или трипептида одну за другой, способствуя абсорбции в микроворсинках. Клетки могут использовать эти аминокислоты для создания жизненно важных белков или в качестве субстратов для производства энергии. Белки, созданные внутриклеточно, также могут катаболизироваться по тем же причинам. Внутриклеточные белки, которые либо были неправильно свернуты, либо больше не функционируют в клетке, также подвергаются внутриклеточному белковому катаболизму в лизосомах с помощью образования убиквитина и протеасом. Если клетка находится в низкоэнергетическом состоянии, свободные аминокислоты в цитозоле подвергаются дальнейшей деградации с образованием промежуточных продуктов цикла лимонной кислоты и направляются туда для производства АТФ. В то время как углеродный остов вступает в пути выработки энергии, азотный остов модифицируется и выводится в основном через почки.
Клетки могут использовать эти аминокислоты для создания жизненно важных белков или в качестве субстратов для производства энергии. Белки, созданные внутриклеточно, также могут катаболизироваться по тем же причинам. Внутриклеточные белки, которые либо были неправильно свернуты, либо больше не функционируют в клетке, также подвергаются внутриклеточному белковому катаболизму в лизосомах с помощью образования убиквитина и протеасом. Если клетка находится в низкоэнергетическом состоянии, свободные аминокислоты в цитозоле подвергаются дальнейшей деградации с образованием промежуточных продуктов цикла лимонной кислоты и направляются туда для производства АТФ. В то время как углеродный остов вступает в пути выработки энергии, азотный остов модифицируется и выводится в основном через почки.
Основы
rКатаболический процесс начинается, когда протеолитические ферменты высвобождаются в форме зимогена из слизистой оболочки желудочно-кишечного тракта. После секретирования зимогены расщепляются на активные протеазы. Пепсин из слизистой оболочки желудка гидролизует более крупный полипептид на более мелкие полипептиды, которые впоследствии могут быть дополнительно расщеплены панкреатическими протеазами, высвобождаемыми в двенадцатиперстной кишке. Трипсин, химотрипсин, эластаза и карбоксипептидазы, синтезируемые экзокринной частью поджелудочной железы, могут расщеплять полипептид в определенных точках расщепления на аминокислоты и олигопептиды. Аминопептидазы, расположенные на щеточной кайме эпителиальных клеток кишечника, гидролизуют оставшиеся олигопептиды до аминокислот, которые затем всасываются в кровоток через трансмембранные транспортные системы. Существуют как облегченные, так и активные транспортные механизмы для транспорта аминокислот в клетки.
Пепсин из слизистой оболочки желудка гидролизует более крупный полипептид на более мелкие полипептиды, которые впоследствии могут быть дополнительно расщеплены панкреатическими протеазами, высвобождаемыми в двенадцатиперстной кишке. Трипсин, химотрипсин, эластаза и карбоксипептидазы, синтезируемые экзокринной частью поджелудочной железы, могут расщеплять полипептид в определенных точках расщепления на аминокислоты и олигопептиды. Аминопептидазы, расположенные на щеточной кайме эпителиальных клеток кишечника, гидролизуют оставшиеся олигопептиды до аминокислот, которые затем всасываются в кровоток через трансмембранные транспортные системы. Существуют как облегченные, так и активные транспортные механизмы для транспорта аминокислот в клетки.
Катаболизм белков является жизненно важной частью клеточного обмена. Когда цитозольные белки, такие как сигнальные или структурные пептиды, больше не нужны, они должны расщепляться в лизосомах для создания новых белков, которые могут выполнять необходимые метаболические функции.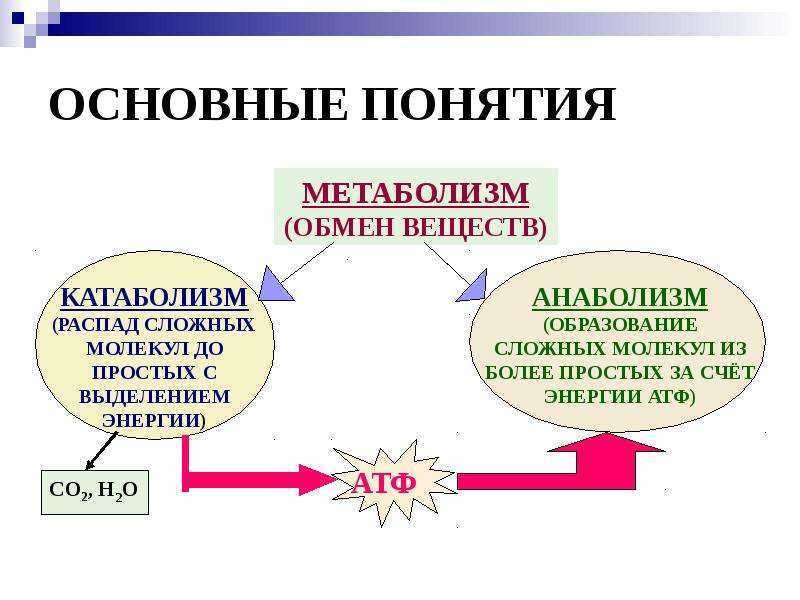 Если полученные аминокислоты не используются для синтеза новых белков для жизненно важных внутриклеточных функций, они могут войти в цикл лимонной кислоты для выработки энергии. Когда запрограммированная смерть является судьбой клетки, катепсины и другие катаболические ферменты работают вместе в процессе апоптоза.
Если полученные аминокислоты не используются для синтеза новых белков для жизненно важных внутриклеточных функций, они могут войти в цикл лимонной кислоты для выработки энергии. Когда запрограммированная смерть является судьбой клетки, катепсины и другие катаболические ферменты работают вместе в процессе апоптоза.
Желудочные пептидазы: главные клетки слизистой оболочки желудка секретируют пепсиноген.[1] С помощью соляной кислоты, выделяемой париетальными клетками желудка, пепсиноген изменяет конформацию в сильнокислой среде желудка и расщепляется до активной протеазы — пепсина. Кислота также денатурирует пищевые белки и частично разворачивает их для облегчения протеолиза. Пепсин обычно расщепляет пептидные связи, содержащие карбоксильную группу, от кислой или ароматической аминокислоты; однако его широкая специфичность позволяет ему расщеплять пептидные связи и в других точках. Более мелкие пептиды, а иногда и свободные аминокислоты, затем попадают в двенадцатиперстную кишку, где встречаются с пептидазами, секретируемыми поджелудочной железой.
Панкреатические и кишечные пептидазы: Экзокринная часть поджелудочной железы секретирует различные пищеварительные ферменты, включая амилазу, липазу, колипазу, бикарбонат и неактивные протеазы. Бикарбонат, высвобождаемый в просвет кишечника, повышает рН и позволяет протеазам поджелудочной железы активироваться из их зимогенной формы. Одна конкретная протеаза, трипсин, является наиболее важной для пищеварительного процесса, потому что она сама расщепляет белки, а также активирует другие протеазы из их неактивных форм. Трипсин отщепляется от проферментной формы трипсиногена энтеропептидазой. Затем трипсин продолжает активировать химотрипсиноген, проэластазу и прокарбоксипептидазы в химотрипсин, эластазу и карбоксипептидазы соответственно. Трипсин гидролизует пептидные связи с карбоксильной группой аргинина или лизина. С другой стороны, химотрипсин имеет тенденцию воздействовать на пептидные связи между гидрофобными аминокислотами.[4] Трипсин и химотрипсин относятся к категории сериновых протеаз и имеют сходный метод протеолиза.
Эластаза, также являющаяся сериновой протеазой, расщепляет эластин, а также белки с небольшими гидрофобными боковыми цепями, такие как глицин или аланин. Ацинарные клетки поджелудочной железы выделяют две формы эластазы, причем эластаза II обладает более широкой специфичностью, чем эластаза I.[5] Нуклеофильная аминокислота в активном центре эндопептидазы гидролизует пептидную связь на более мелкие пептидные цепи, которые нуждаются в дальнейшей деградации; это может происходить с помощью экзопептидаз, которые удаляют одну аминокислоту с конца белковой цепи.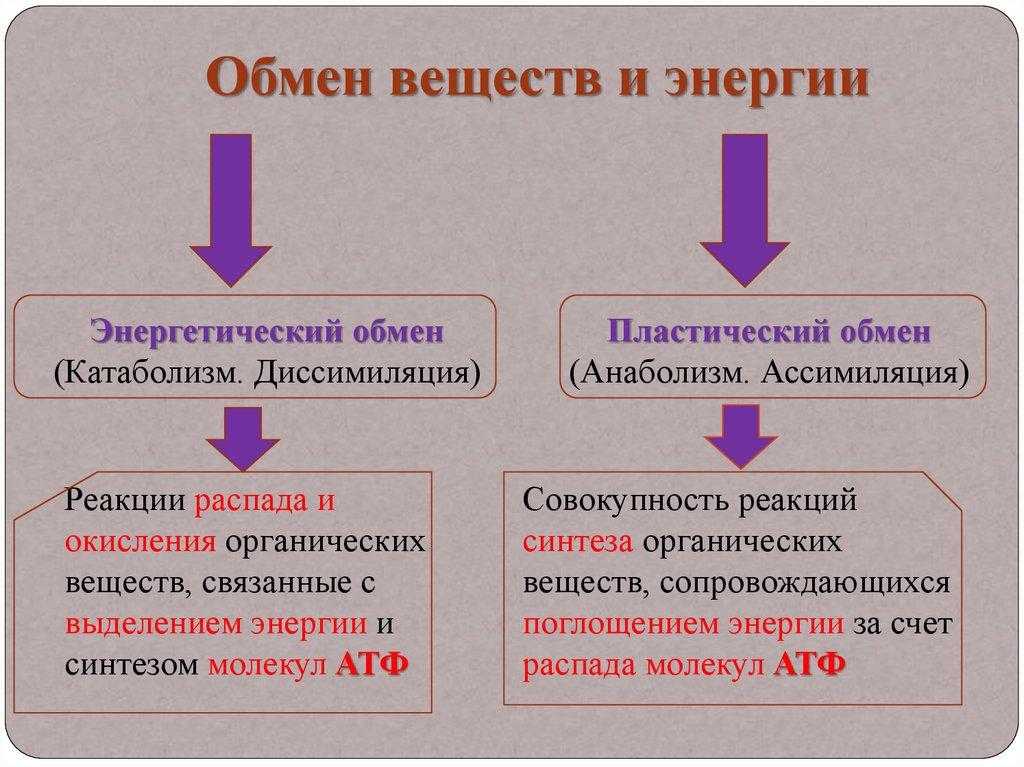
Внутриклеточный обмен белков: белки внутри клетки также подвергаются катаболизму для пополнения внутриклеточного пула аминокислот. Хотя у всех белков есть период полураспада, некоторые из них разлагаются в течение нескольких минут, а некоторые — в течение нескольких часов или дней. Некоторыми примерами сильно синтезированных и деградированных белков являются белки мышечных клеток, гемоглобин, эпителиальные клетки желудочно-кишечного тракта и сами протеолитические ферменты. Многие из этих белков расщепляются лизосомальными протеазами, так что составляющие их аминокислоты можно использовать для восстановления белков, потребности которых зависят от текущего физиологического состояния клетки.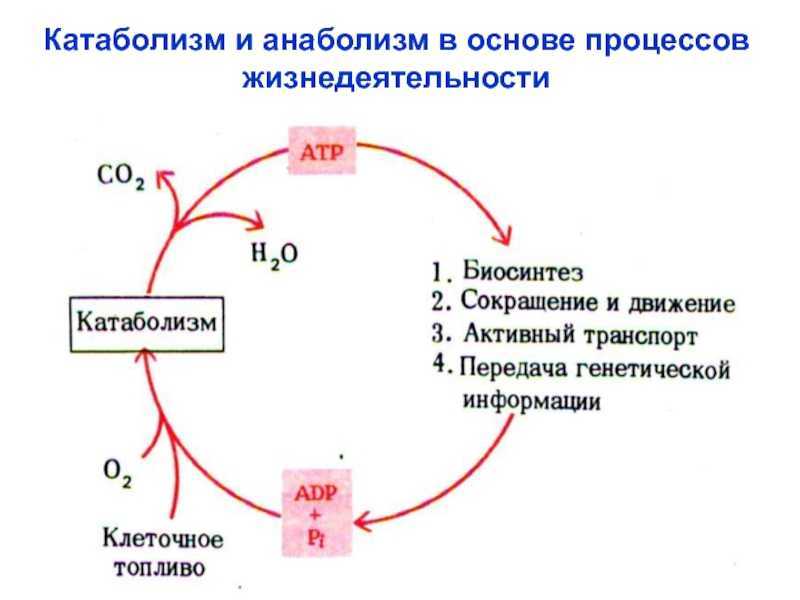
Сотовый уровень
Трансмембранный транспорт: работа эндопептидаз, химотрипсина, эластазы и карбоксипептидазы, а также экзопептидаз, карбоксипептидазы и аминопептидазы, в конечном итоге дает свободные аминокислоты. Существуют механизмы облегченной диффузии и активного транспорта для поглощения этих соединений из просвета кишечника посредством вторичного активного транспорта [7]. Аминокислоты пересекают щеточную границу кишечных клеток через натрий-зависимую транспортную систему, в которой низкая внутриклеточная концентрация натрия обеспечивает совместное проникновение натрия и аминокислоты.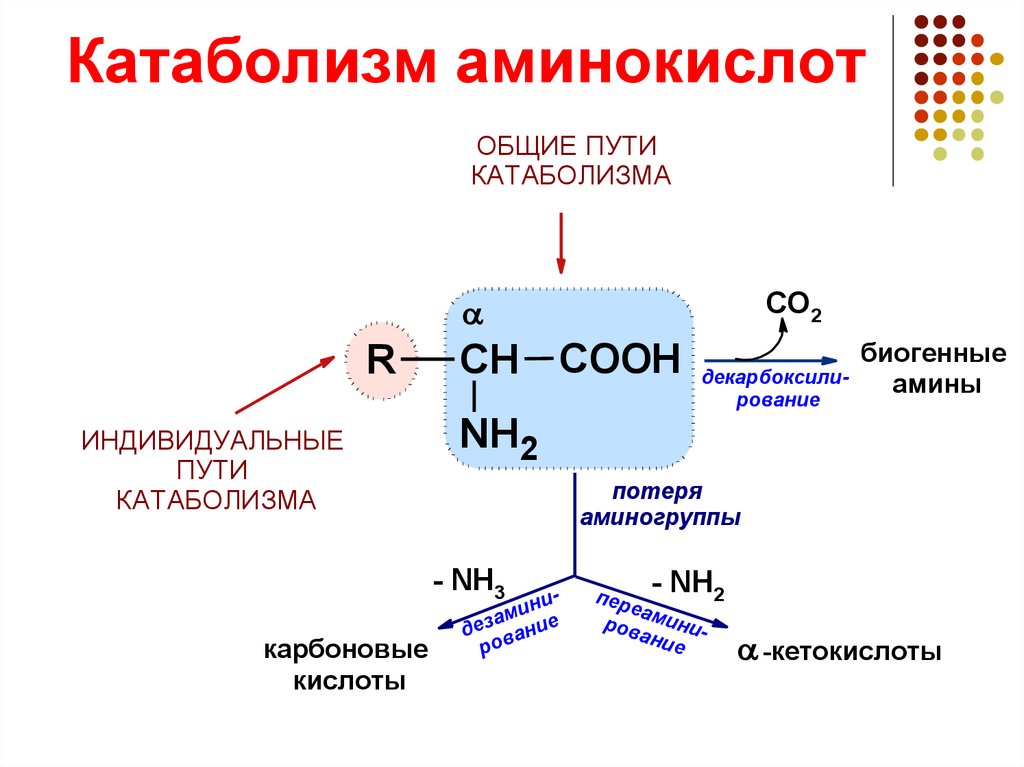 Натрий-калиевая АТФаза на базолатеральной мембране поддерживает низкую концентрацию натрия внутри клетки. Как только аминокислоты попадают в клетку на апикальной мембране, они транспортируются вниз по градиенту на базальной мембране в кровоток, обычно в портальную циркуляцию. Шесть различных натрий-зависимых переносчиков аминокислот перекрываются по своей специфичности в отношении аминокислот, которые они транспортируют через апикальную мембрану щеточной каймы; однако носители отдают предпочтение типам транспортируемых аминокислот. Предпочтительные аминокислоты включают нейтральные аминокислоты, кислые аминокислоты, основные аминокислоты, цистин, пролин и гидроксипролин. Натрийзависимые переносчики аминокислот в клетках просвета кишечника также присутствуют в почечном эпителии в различных изоферментных формах.[8] С другой стороны, облегченные транспортные системы на базальной стороне сравнимы с обнаруженными в других типах тканей. Аминокислоты также могут всасываться из крови через эти облегченные транспортеры и использоваться в качестве субстратов для цикла лимонной кислоты для выработки энергии — двунаправленность облегченных транспортеров способствует выживанию кишечного эпителия во время голодания.
Натрий-калиевая АТФаза на базолатеральной мембране поддерживает низкую концентрацию натрия внутри клетки. Как только аминокислоты попадают в клетку на апикальной мембране, они транспортируются вниз по градиенту на базальной мембране в кровоток, обычно в портальную циркуляцию. Шесть различных натрий-зависимых переносчиков аминокислот перекрываются по своей специфичности в отношении аминокислот, которые они транспортируют через апикальную мембрану щеточной каймы; однако носители отдают предпочтение типам транспортируемых аминокислот. Предпочтительные аминокислоты включают нейтральные аминокислоты, кислые аминокислоты, основные аминокислоты, цистин, пролин и гидроксипролин. Натрийзависимые переносчики аминокислот в клетках просвета кишечника также присутствуют в почечном эпителии в различных изоферментных формах.[8] С другой стороны, облегченные транспортные системы на базальной стороне сравнимы с обнаруженными в других типах тканей. Аминокислоты также могут всасываться из крови через эти облегченные транспортеры и использоваться в качестве субстратов для цикла лимонной кислоты для выработки энергии — двунаправленность облегченных транспортеров способствует выживанию кишечного эпителия во время голодания.
Транспортеры на апикальной поверхности мышц, печени и других тканей поглощают аминокислоты из крови и концентрируют их. Хотя они похожи на люминальные натрий-зависимые переносчики аминокислот в эпителии кишечника, эти переносчики различаются по своей генетической основе, белковому составу и специфичности.[8] Многие ткани экспрессируют A-систему, ASC-систему и L-систему для транспорта аминокислот в клетку; однако из них L-система является единственной без натрий-зависимого механизма. Клетки кишечника и почек экспрессируют В-систему, Х-систему и иминосистему [9].] Определенный тип ткани может содержать определенный тип переносчика аминокислот, не встречающийся в других тканях, например, экспрессия N-системы печени и ее специфичность в отношении абсорбции глутамина. Изоформа N-системы поглощения глутамина может экспрессироваться в тканях другого типа. Однако он будет иметь другие свойства и состав, чем тот, который присутствует в печени. Каждая система отличается своей специфичностью в отношении аминокислот и имеет значение при различных патологиях.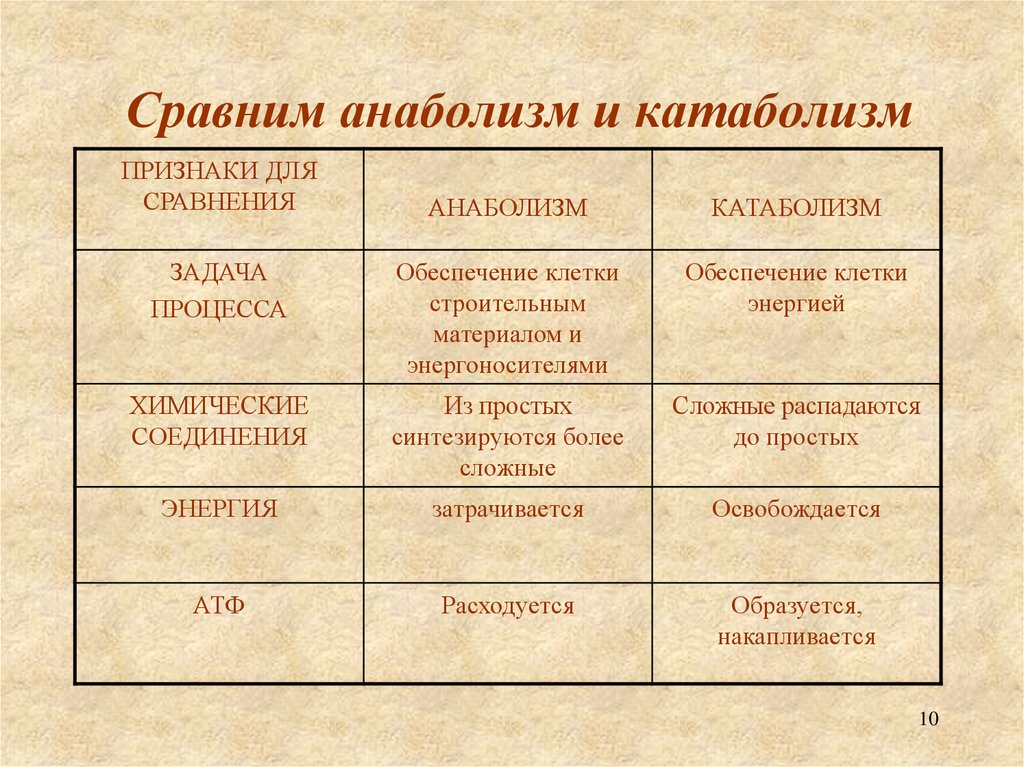
Лизосомальная деградация: если белки больше не нужны или синтезируются неправильно, внутриклеточные белки расщепляются с использованием лизосом и протеасомного комплекса. Белки попадают в лизосому посредством аутофагии, строго регулируемого процесса, при котором везикулы сливаются с мембраной лизосомы.[10] Аутофагии могут способствовать низкоэнергетические состояния, такие как низкий уровень АТФ или высокий уровень АМФ в клетке. Поскольку AMP-активированная протеинкиназа активируется при высоких уровнях AMP, она может фосфорилировать комплексы туберозного склероза 1 и 2, что приводит к активации Rheb-GTPase. Эта активация важна, потому что она инактивирует Rheb и, таким образом, также инактивирует mTOR, главный ингибитор аутофагии; именно так низкоэнергетические состояния способствуют катаболизму белков. И наоборот, активация комплексов туберозного склероза 1 и 2 инсулином через Akt-киназу приводит к активизации mTOR. Активированный mTOR способствует синтезу белка, а не деградации.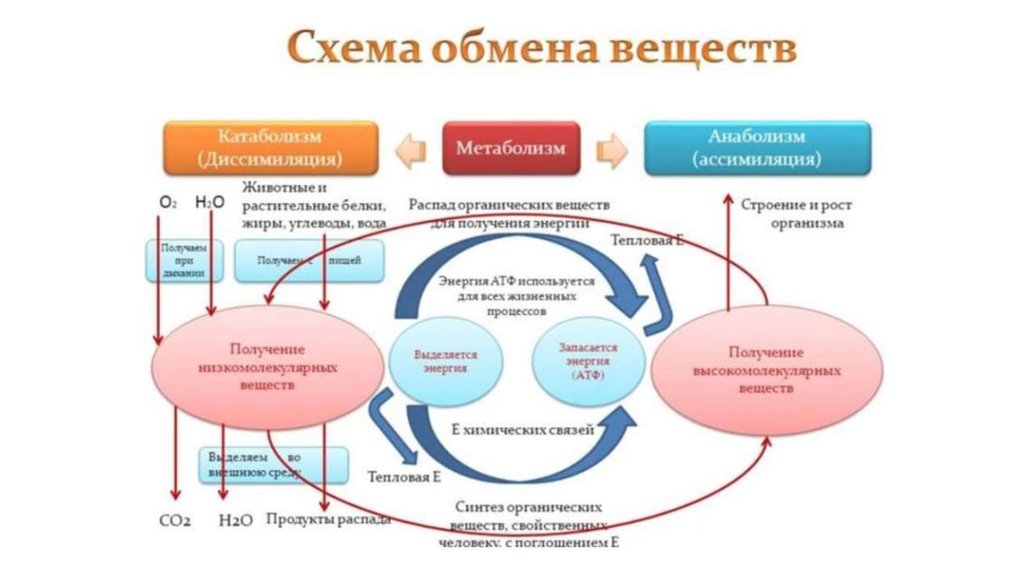
Убиквитинирование — это процесс, при котором молекула убиквитина ковалентно присоединяется к белкам, подлежащим деградации, и взаимодействует с протеасомой внутри лизосомы для расщепления указанного белка с использованием АТФ-зависимого процесса.[12] Убиквитин должен сначала активироваться через E1, E2 и E3, прежде чем стать ковалентно присоединенным к эпсилон-аминогруппе боковых цепей лизина через ферментный комплекс. Обычно белок получает больше молекул убиквитина на концевом лизине, образуя хвост. После формирования хвоста убиквитинированный белок отделяется от лигирующего ферментного комплекса и перемещается к протеасоме. Протеасома представляет собой цилиндрический протеазный комплекс 26S с несколькими каталитическими центрами внутри. Протеасомный комплекс 26S имеет два альфа- и два бета-кольца, содержащие три внутренних каталитических центра, подобных трипсину, химотрипсину и постглутамилпептидилгидролазе. Конструкция четырехкольцевой структуры такова, что альфа-кольца играют стабилизирующую роль, тогда как бета-субъединицы являются активными каталитическими частями комплекса.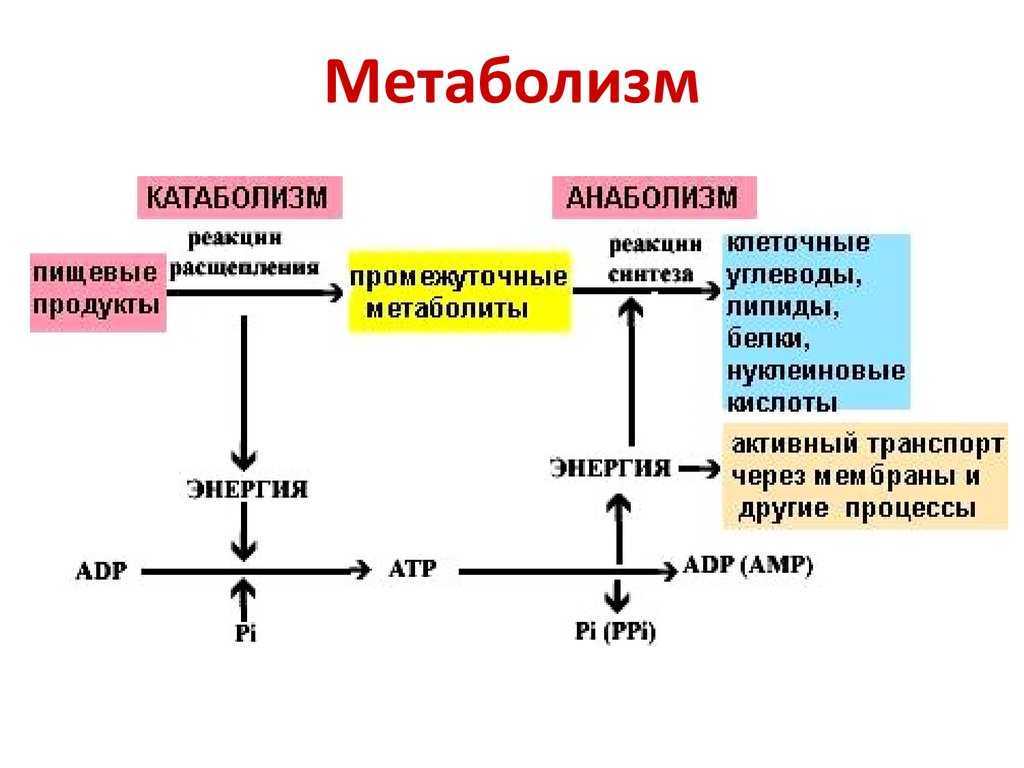 [13] Он сохраняет молекулы убиквитина, но использует гидролиз АТФ для разворачивания и перемещения белка глубже в комплекс и высвобождения свободных аминокислот.[10] Белки, гидролизуемые этим процессом, известны как последовательности PEST, названные так в честь общих аминокислот, включенных в цепь. Аминокислоты пролин, глутамат, серин и треонин находятся в высоких концентрациях в белках последовательности PEST.[14]
[13] Он сохраняет молекулы убиквитина, но использует гидролиз АТФ для разворачивания и перемещения белка глубже в комплекс и высвобождения свободных аминокислот.[10] Белки, гидролизуемые этим процессом, известны как последовательности PEST, названные так в честь общих аминокислот, включенных в цепь. Аминокислоты пролин, глутамат, серин и треонин находятся в высоких концентрациях в белках последовательности PEST.[14]
Оказавшись внутри лизосомы, лизосомальные протеазы, называемые катепсины, могут также расщеплять цитозольные белки, помеченные для катаболизма. Катепсины представляют собой еще один тип цистеиновых протеаз, присутствующих в перицеллюлярной среде, ядрах цитозоля и митохондриях.[15] Передача сигналов фактора некроза опухоли, клеточный стресс и каспазы могут запускать лизосомальное высвобождение катепсина, расщепляя внутриклеточные белки, такие как Bid, что приводит к последующей активации апоптотического каскада каспаз.
Молекулярный уровень
Судьба внутриклеточного пула аминокислот сильно зависит от метаболического состояния отдельной ткани и организма в целом. В сытом физиологическом состоянии аминокислоты могут расщепляться дальше до их углеродного и азотного скелетов. В то время как углеродный скелет может подвергаться окислению для получения энергии, азотный компонент выводится из организма через азотсодержащие отходы. Первоначально азот присутствует в виде аммиака, ядовитого для человеческого организма вещества. Печень превращает токсичный аммиак в мочевину посредством цикла мочевины в нетоксичную водорастворимую форму азота, которая легко выводится почками.
В сытом физиологическом состоянии аминокислоты могут расщепляться дальше до их углеродного и азотного скелетов. В то время как углеродный скелет может подвергаться окислению для получения энергии, азотный компонент выводится из организма через азотсодержащие отходы. Первоначально азот присутствует в виде аммиака, ядовитого для человеческого организма вещества. Печень превращает токсичный аммиак в мочевину посредством цикла мочевины в нетоксичную водорастворимую форму азота, которая легко выводится почками.
По мере того, как азотный скелет отбрасывается, углеродный скелет аминокислот может использоваться для производства энергии путем окисления в пируват (триптофан, глицин, аланин, серин, цистеин) и ацетил-КоА. Пируват и ацетил-Коэнзим А являются субстратами цикла лимонной кислоты, в конечном итоге производящего АТФ и углекислый газ. Ацетил-КоА также может образовывать кетоновые тела, выбрасываемые в кровоток для использования в качестве источника энергии определенными тканями.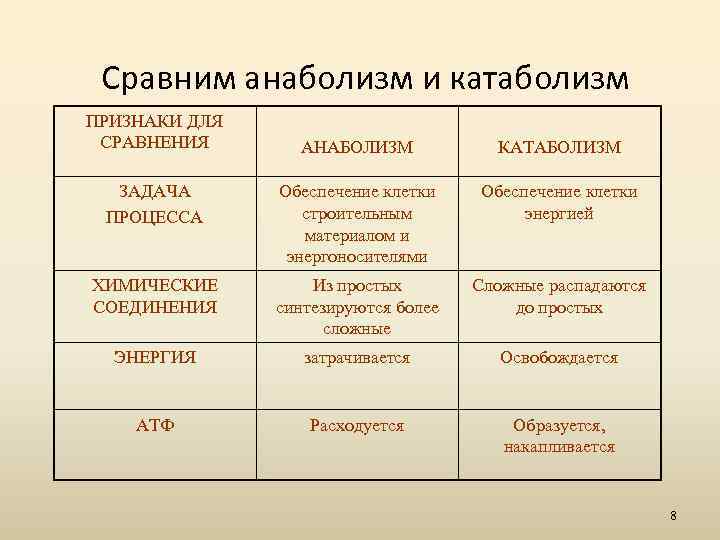 Аминокислоты, которые превращаются в ацетил-КоА или ацетоацетат, называются кетогенными из-за их склонности превращаться в кетоновые тела.[17] Например, лизин и лейцин являются одновременно кетогенными и незаменимыми аминокислотами.
Аминокислоты, которые превращаются в ацетил-КоА или ацетоацетат, называются кетогенными из-за их склонности превращаться в кетоновые тела.[17] Например, лизин и лейцин являются одновременно кетогенными и незаменимыми аминокислотами.
Другая возможная судьба — превращение углеродного скелета в промежуточные продукты цикла лимонной кислоты альфа-кетоглутарат (аргинин, гистидин, глутамин, пролин, глутамат), сукцинил-КоА (валин, треонин, изолейцин, метионин), фумарат (аспартат, тирозин, фенилаланин) и оксалоацетат (аспартат, аспарагин) [18]. Стоит отметить, что малат, промежуточное звено цикла лимонной кислоты, может перемещаться по кровотоку в печень и участвовать в глюконеогенезе.[19] Если аминокислота может стать предшественником глюкозы, ее называют глюкогенной. Из-за различных промежуточных продуктов и точек входа в цикл Кребса аминокислоты могут быть как глюкогенными, так и кетогенными.
Тестирование
Убиквитинирование — начало катаболизма внутриклеточных белков.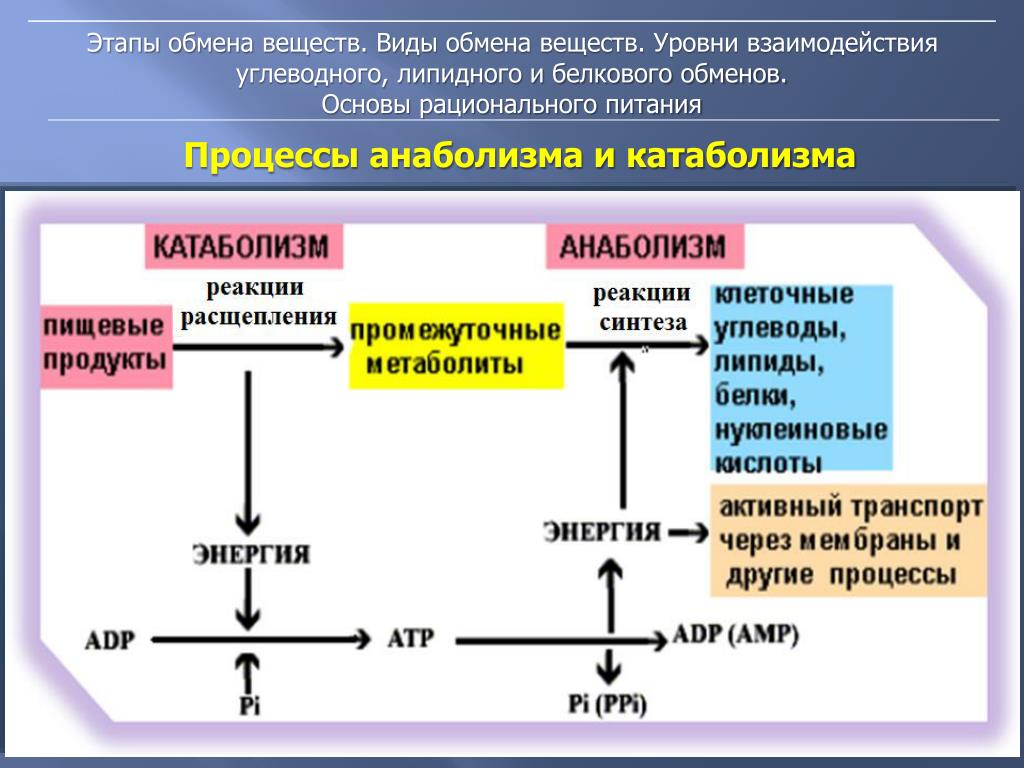 Проверка функции этого процесса для понимания конкретных патологий включает объединение культивируемых клеток с плазмидами, содержащими белок с убиквитином, меченным эпитопом. Следующие шаги включают добавление стабилизирующих буферов, лизис и обработку клеток ультразвуком с последующими раундами инкубации. Поскольку окончательная форма анализа включает иммуноблоттинг в геле SDS-PAGE, должны образовываться конъюгированные антитела против белка [20]. Существуют также способы анализа процесса убиквитинирования in vitro, а не in vivo.[20]
Проверка функции этого процесса для понимания конкретных патологий включает объединение культивируемых клеток с плазмидами, содержащими белок с убиквитином, меченным эпитопом. Следующие шаги включают добавление стабилизирующих буферов, лизис и обработку клеток ультразвуком с последующими раундами инкубации. Поскольку окончательная форма анализа включает иммуноблоттинг в геле SDS-PAGE, должны образовываться конъюгированные антитела против белка [20]. Существуют также способы анализа процесса убиквитинирования in vitro, а не in vivo.[20]
Существуют способы определения ферментов, выделяемых экзокринной поджелудочной железой, трипсина, химотрипсина и эластазы. Одним из тестов является фекальный тест на эластазу, при котором стул анализируется на концентрацию эластазы, что подтверждает проходимость панкреатического протока, секреторную функцию экзокринной поджелудочной железы и наличие активирующего трипсина. Этот анализ является наиболее широко используемым тестом из-за его высокой специфичности и неинвазивного метода. Более инвазивным тестом является эндоскопический тест функции поджелудочной железы, который доступен только в некоторых медицинских учреждениях. В этом тесте пациенту вводят седативное средство и вводят секретин перед эндоскопической процедурой.[22] Эндоскоп отсасывает другую жидкость из верхних отделов желудочно-кишечного тракта по пути в двенадцатиперстную кишку. Затем образцы секрета поджелудочной железы берут из большого сосочка и анализируют на бикарбонат в лаборатории.[22] Обычно пробы отбирают с интервалом в 15, 30, 45 и 60 минут. Оценка секреции и активности этих ферментов важна для оценки патологий мальабсорбции белков.
Более инвазивным тестом является эндоскопический тест функции поджелудочной железы, который доступен только в некоторых медицинских учреждениях. В этом тесте пациенту вводят седативное средство и вводят секретин перед эндоскопической процедурой.[22] Эндоскоп отсасывает другую жидкость из верхних отделов желудочно-кишечного тракта по пути в двенадцатиперстную кишку. Затем образцы секрета поджелудочной железы берут из большого сосочка и анализируют на бикарбонат в лаборатории.[22] Обычно пробы отбирают с интервалом в 15, 30, 45 и 60 минут. Оценка секреции и активности этих ферментов важна для оценки патологий мальабсорбции белков.
Патофизиология
Кистозный фиброз представляет собой аутосомно-рецессивную мутацию в гене CFTR, который кодирует белки, составляющие поры хлоридных каналов.[23] Тяжесть заболевания различна, но некоторые черты являются общими для всех форм, например, образование густых слизистых пробок в протоке поджелудочной железы, легких, мочеполовой системе у мужчин.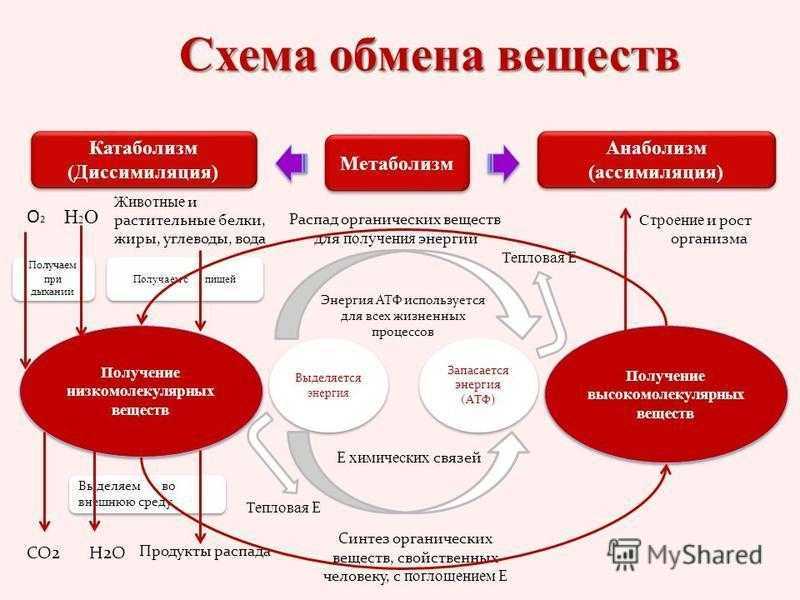 Поскольку для всасывания белки должны расщепляться, слизистая пробка, блокирующая высвобождение зимогена из экзокринной части поджелудочной железы, приводит к отсутствию катаболизма жизненно важных белков в просвете кишечника.[23] Пациенты с муковисцидозом имеют тяжелый дефицит белка и должны получать добавки экзогенных ферментов поджелудочной железы, хотя следует упомянуть, что побочные эффекты длительного приема ферментов поджелудочной железы в настоящее время неизвестны [24].
Поскольку для всасывания белки должны расщепляться, слизистая пробка, блокирующая высвобождение зимогена из экзокринной части поджелудочной железы, приводит к отсутствию катаболизма жизненно важных белков в просвете кишечника.[23] Пациенты с муковисцидозом имеют тяжелый дефицит белка и должны получать добавки экзогенных ферментов поджелудочной железы, хотя следует упомянуть, что побочные эффекты длительного приема ферментов поджелудочной железы в настоящее время неизвестны [24].
Квашиоркор — еще один серьезный дефицит белка; однако это связано с недостаточным потреблением белка, а не с генетическим заболеванием. Пищеварительные ферменты присутствуют в квашиоркоре; однако из-за того, что потребляется мало белка, присутствуют симптомы дефицита белка. У истощенных людей с квашиоркором жизненно важные реакции в организме поддерживаются за счет внутриклеточного катаболизма белков. Потребность в доступных незаменимых аминокислотах приводит к значительному снижению периферической мышечной массы из-за разрушения мышц.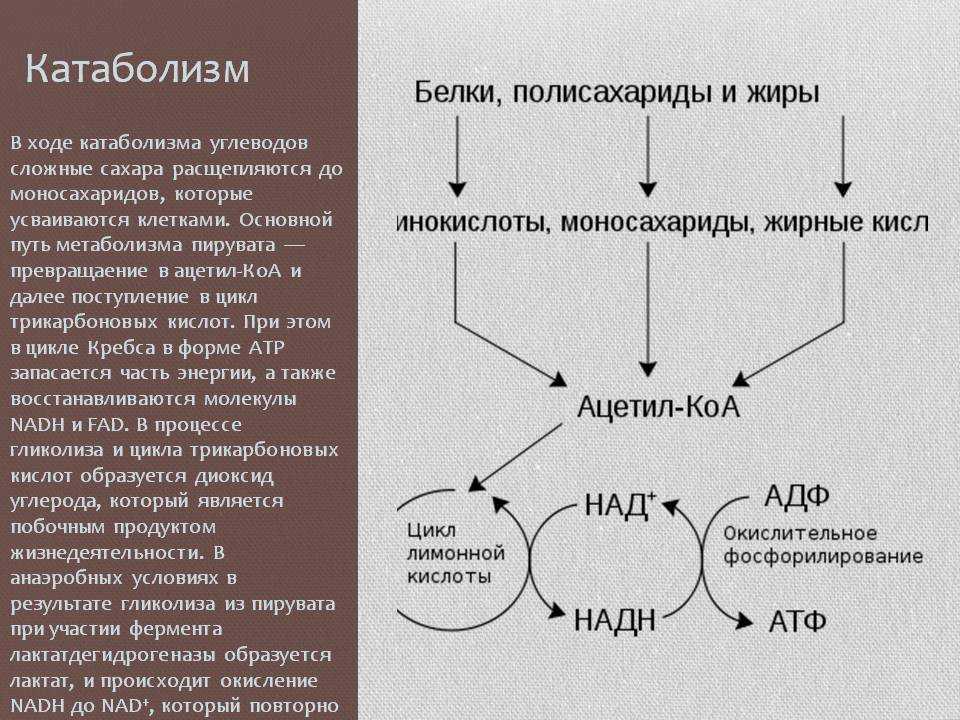 [10] Дефицит белка также приводит к снижению уровня альбумина в сыворотке, что снижает внутрисосудистое коллоидное давление, что приводит к отеку и вздутию живота. Тяжелый квашиоркор быстро ухудшается, поскольку пищеварительные ферменты перестают вырабатываться, а эпителий тонкой кишки не регенерируется.
[10] Дефицит белка также приводит к снижению уровня альбумина в сыворотке, что снижает внутрисосудистое коллоидное давление, что приводит к отеку и вздутию живота. Тяжелый квашиоркор быстро ухудшается, поскольку пищеварительные ферменты перестают вырабатываться, а эпителий тонкой кишки не регенерируется.
Дефект в механизмах облегченного и активного транспорта может привести к патологическим состояниям мальабсорбции. Цистинурия и болезнь Хартнупа являются генетическими нарушениями, затрагивающими мембранные переносчики аминокислот, но различаются по группам транспортируемых аминокислот и поэтому проявляются по-разному клинически.[9] Цистинурия — нарушение транспорта основных аминокислот через мембраны почечной и желудочно-кишечной систем. Отличительной чертой этого расстройства является образование камней в почках из-за неспособности резорбировать основную аминокислоту цистин из клубочкового фильтрата. Поскольку транспортер также присутствует в эпителии тонкой кишки, цистин и другие основные аминокислоты плохо всасываются из просвета кишечника.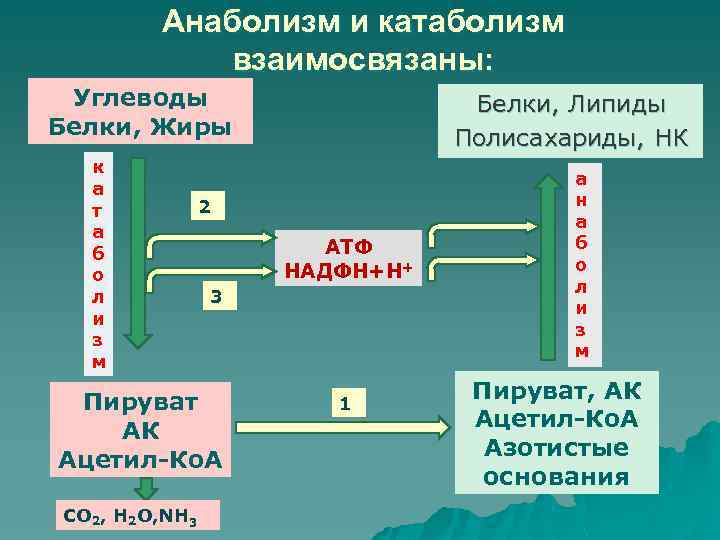 Механически похожее заболевание, болезнь Хартнупа представляет собой дефект транспорта нейтральных аминокислот через почечную и кишечную систему. Поскольку триптофан является одной из плохо усваиваемых нейтральных аминокислот, при медицинском осмотре выявляются симптомы пеллагры в виде сыпи, диареи и психических расстройств. В отличие от пеллагры, добавки с ниацином мало уменьшают симптомы и должны выявить необходимость генетического тестирования.
Механически похожее заболевание, болезнь Хартнупа представляет собой дефект транспорта нейтральных аминокислот через почечную и кишечную систему. Поскольку триптофан является одной из плохо усваиваемых нейтральных аминокислот, при медицинском осмотре выявляются симптомы пеллагры в виде сыпи, диареи и психических расстройств. В отличие от пеллагры, добавки с ниацином мало уменьшают симптомы и должны выявить необходимость генетического тестирования.
Клиническое значение
Надлежащее функционирование белкового катаболизма имеет первостепенное значение для поддержания метаболических потребностей человеческого организма. Разрушение больших полипептидных цепей с высвобождением свободных незаменимых и заменимых аминокислот обеспечивает клетки необходимыми субстратами для синтеза белка или выработки энергии. Расщепление внутриклеточного белка важно для нормального обмена веществ, а также при физиологических состояниях недоедания и истощения для мобилизации аминокислот для экспорта для поддержки энергетических потребностей жизненно важных органов. Дефекты белкового катаболизма могут привести к разнообразным клиническим проявлениям, поражающим почти все системы органов.
Дефекты белкового катаболизма могут привести к разнообразным клиническим проявлениям, поражающим почти все системы органов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Magee DF. Пепсин. Мед Клин Норт Ам. 1974 г., ноябрь; 58 (6): 1277-87. [PubMed: 4610293]
- 2.
Fruton JS. Специфичность и механизм действия пепсина. Adv Enzymol Relat Areas Mol Biol. 1970; 33:401-43. [PubMed: 4916858]
- 3.
Ji B, Logsdon CD. Переваривание новой информации о роли трипсина при панкреатите. Гастроэнтерология. 2011 декабрь; 141 (6): 1972-5. [Статья бесплатно PMC: PMC4327863] [PubMed: 22033179]
- 4.
Ma W, Tang C, Lai L. Специфичность трипсина и химотрипсина: динамическая корреляция, контролируемая движением петли, как детерминант.
 Biophys J. 2005 Aug;89(2):1183-93. [Бесплатная статья PMC: PMC1366603] [PubMed: 15923233]
Biophys J. 2005 Aug;89(2):1183-93. [Бесплатная статья PMC: PMC1366603] [PubMed: 15923233]- 5.
Дель Мар Э.Г., Ларгман С., Бродрик Дж.В., Фассет М., Геокас М.С. Субстратная специфичность эластазы поджелудочной железы человека 2. Биохимия. 1980 февраля 05;19(3):468-72. [PubMed: 6898442]
- 6.
Tobey N, Heizer W, Yeh R, Huang TI, Hoffner C. Пептидазы щеточной каймы кишечника человека. Гастроэнтерология. 1985 г., апрель 88(4):913-26. [PubMed: 3882510]
- 7.
Холмс Р., Лобли Р.В. Пересмотрена граница щетки кишечника. Кишка. 1989 декабря; 30 (12): 1667-78. [Статья бесплатно PMC: PMC1434444] [PubMed: 2693228]
- 8.
Bröer S. Транспорт аминокислот через эпителий кишечника и почек млекопитающих. Physiol Rev. 2008 Янв; 88 (1): 249-86. [PubMed: 18195088]
- 9.
Броер С., Фэйрвезер С.Дж. Транспорт аминокислот через кишечник млекопитающих. сост. физиол. 2018 13 декабря; 9 (1): 343-373.
 [PubMed: 30549024]
[PubMed: 30549024]- 10.
Сандри М. Распад белка при истощении мышц: роль аутофагии-лизосомы и убиквитин-протеасомы. Int J Biochem Cell Biol. 2013 Октябрь; 45 (10): 2121-9. [Статья PMC бесплатно: PMC3775123] [PubMed: 23665154]
- 11.
Puertollano R. mTOR и регулирование лизосом. F1000Prime Rep. 2014; 6:52. [Бесплатная статья PMC: PMC4108950] [PubMed: 25184042]
- 12.
Доэрти Ф.Дж., Доусон С., Майер Р.Дж. Убиквитин-протеасомный путь внутриклеточного протеолиза. Очерки биохим. 2002;38:51-63. [PubMed: 12463161]
- 13.
Чехановер А. Убиквитин-протеасомный путь: о гибели белков и жизни клеток. EMBO J. 15 декабря 1998 г.; 17 (24): 7151-60. [Бесплатная статья PMC: PMC1171061] [PubMed: 9857172]
- 14.
Rechsteiner M, Rogers SW. Последовательности PEST и регуляция протеолиза. Тенденции биохимических наук. 1996 июля; 21 (7): 267-71. [PubMed: 8755249]
- 15.
Брикс К., Данкхорст А., Майер К., Джорданс С. Цистеиновые катепсины: клеточная дорожная карта для различных функций. Биохимия. 2008 г., февраль; 90 (2): 194–207. [PubMed: 17825974]
- 16.
Leist M, Jäättelä M. Запуск апоптоза катепсинами. Смерть клеток 2001 Апрель; 8 (4): 324-6. [PubMed: 11550083]
- 17.
Harris RA, Joshi M, Jeoung NH, Obayashi M. Обзор молекулярных и биохимических основ катаболизма аминокислот с разветвленной цепью. Дж Нутр. 2005 г., июнь; 135 (6 доп.): 1527S-30S. [В паблике: 15930464]
- 18.
БЕЛЛАМИ Д. Эндогенные промежуточные продукты цикла лимонной кислоты и аминокислоты митохондрий. Biochem J. 1962 Jan; 82(1):218-24. [Статья бесплатно PMC: PMC1243435] [PubMed: 13866863]
- 19.
Айкава Т., Мацутака Х., Ямамото Х., Окуда Т., Исикава Э. Глюконеогенез и метаболизм аминокислот. II. Межорганные отношения и роль глютамина и аланина в метаболизме аминокислот у голодающих крыс.
 Дж Биохим. 1973 г., ноябрь; 74 (5): 1003-17. [В паблике: 4770365]
Дж Биохим. 1973 г., ноябрь; 74 (5): 1003-17. [В паблике: 4770365]- 20.
Choo YS, Zhang Z. Обнаружение убиквитинирования белка. J Vis Exp. 2009, 19 августа; (30) [бесплатная статья PMC: PMC3149903] [PubMed: 19692941]
- 21.
Löser C, Möllgaard A, Fölsch UR. Фекальная эластаза 1: новый, высокочувствительный и специфический бескамерный функциональный тест поджелудочной железы. Кишка. 1996 г., октябрь; 39 (4): 580-6. [Бесплатная статья PMC: PMC1383273] [PubMed: 8944569]
- 22.
Forsmark C, Adams PC. Тестирование функции поджелудочной железы — полезно, но используется недостаточно. Можно J Гастроэнтерол. 2009 г.авг; 23 (8): 529-30. [Бесплатная статья PMC: PMC2732171] [PubMed: 19668794]
- 23.
Ooi CY, Durie PR. Мутации гена трансмембранного регулятора проводимости (CFTR) при муковисцидозе при панкреатите. J Кистозные волокна. 2012 сен; 11 (5): 355-62. [PubMed: 22658665]
- 24.