Белки (протеины, полипептиды)
Дано определение, состав, структура и функции белков организма человека. Приведена их классификация. Описаны синтез и катаболизм белков.
Определение
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот.
Молекулярная масса белков
Белки, являясь высокомолекулярными соединениями, характеризуются большими величинами молекулярной массы. Молекулярная масса измеряется в Дальтонах (1Да=1,66 10-24 г.) Например, белок инсулин обладает молекулярной массой 6000 Да, миоглобин — 17000 Да, миозин – 500000 Да.
Состав белков
Несмотря на то, что в составе белковой молекулы могут входить десятки, сотни и тысячи аминокислот, все белки синтезируются из 20 видов аминокислот. Эти аминокислоты имеют следующие названия: глицин, аланин, серин, цистеин, треонин, метионин, валин, лейцин, изолейцин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, аргинин, фенилаланин, тирозин, триптофан, гистидин, пролин.
Более подробно строение и функции мышц описаны в моих книгах:
- Гипертрофия скелетных мышц человека
- Биомеханика опорно-двигательного аппарата человека
Структура белков
Различают четыре уровня структурной организации молекулы белка (рис.1).
Рис.1. Структуры белковПервичная структура. Аминокислоты соединяясь друг с другом пептидной связью образуют длинные неразветвленные цепи – полипептиды.
Вторичная структура. Эта структура белков характеризует их определенную пространственную организацию. Например, многие белки имеют форму спирали. Фиксируется вторичная структура дисульфидными и водородными связями.
Третичная структура. Третичная структура отражает пространственную организацию вторичной структуры. Например, вторичная структура в виде спирали может укладываться в пространстве в виде глобулы, то есть иметь шаровидную или эллипсовидную форму. Примером белка, обладающего третичной структурой является миоглобин.
Четвертичная структура. Этой структурой обладают некоторые белки. Четвертичная структура – сложное образование, состоящее из нескольких белков, имеющих свою первичную, вторичную и третичную структуры. Примером белка, обладающего четвертичной структурой является гемоглобин.
Классификация белков
Существуют разные классификации белков. Приведу две классификации.
Согласно первой классификации белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. Пример: альбумины и глобулины крови. В молекуле сложного белка, кроме аминокислот, имеется еще неаминокислотная часть. В зависимости от неаминокислотной части выделяют такие сложные белки как нуклеопротеиды (содержат нуклеиновую кислоту), липопротеиды (содержат липоид) и. т.д.
Согласно второй классификации белки делятся на группы на основе своей пространственной формы. Различают глобулярные и фибриллярные белки. Молекулы глобулярных белков имеют шаровидную или эллипсовидную форму. Примерами таких белков являются альбумины и глобулины крови. Молекулы фибриллярных белков вытянутые. Их длина значительно превышает их диаметр. Примером фибриллярного белка является белок коллаген.
Примерами таких белков являются альбумины и глобулины крови. Молекулы фибриллярных белков вытянутые. Их длина значительно превышает их диаметр. Примером фибриллярного белка является белок коллаген.
Функции белков
Функции, которые выполняют белки в организме настолько важны, что белки еще называют протеинами (от греч. слова proteus – первый, главный). Различают следующие функции белков в организме человека.
- Структурная (строительная, пластическая). Белки являются универсальным строительным материалом, из которого строятся все структурные образования организма и прежде всего все клетки и внутриклеточные органеллы (например, миофибриллы мышечного волокна).
- Каталитическая. В организме человека имеются особые белки, являющиеся катализаторами химических реакций. Эти белки получили название ферменты или энзимы.
- Сократительная. Благодаря белкам, входящих в состав миофибрилл происходит сокращение мышц человека.
- Регуляторная.
 Белки могут взаимодействовать как с кислотами, так и с основаниями, поэтому белки являются важнейшими буферами организма, поддерживающими кислотность внутренней среды организма на необходимом уровне.
Белки могут взаимодействовать как с кислотами, так и с основаниями, поэтому белки являются важнейшими буферами организма, поддерживающими кислотность внутренней среды организма на необходимом уровне. - Транспортная. Белковые молекулы достаточно большие и хорошо растворяются в воде. Поэтому они могут переносить различные нерастворимые в воде соединения. Белок гемоглобин участвует в переносе кислорода от легких к различным органам. Белки крови – альбумины переносят с током крови различные нерастворимые в воде вещества (жиры, жирные кислоты, гормоны).
- Защитная. Белки крови глобулины участвуют в свертывании крови и в обеспечении иммунитета.
- Энергетическая. Окисление белков сопровождается выделением энергии.
Перевариваривание белков в организме человека
В организм человека с пищей попадает в сутки около 100 г белков.
Расщепление белков начинается в полости желудка под воздействием желудочного сока, содержащего протеолитический фермент пепсин. Под воздействием пепсина в белках разрываются пептидные связи, образующие первичную структуру. В результате белковые молекулы превращаются в смесь полипептидов различной длины.
Под воздействием пепсина в белках разрываются пептидные связи, образующие первичную структуру. В результате белковые молекулы превращаются в смесь полипептидов различной длины.
Дальнейшее переваривание белков протекает в тонкой кишке под воздействием ферментов: трипсина, химотрипсина и эсталазы, которые синтезируются в поджелудочной железе. В результате полипептиды расщепляются до олигопептидов, состоящих из нескольких аминокислот.
Завершается переваривание белков в тонкой кишке под воздействием ферментов кишечного сока. Образовавшиеся в результате этого процесса аминокислоты всасываются в кровь и по воротной вене поступают в печень и далее попадают в большой круг кровообращения.
Синтез белков
Синтез белков протекает в четыре этапа.
Первый этап синтеза белков протекает в ядрах клеток и называется транскрипцией.
Второй этап синтеза белков протекает в цитоплазме клетки и называется рекогницией.
Третий этап синтеза белков протекает на рибосомах и называется трансляцией.
Четвертый этап синтеза белков протекает в эндоплазматической сети и комплексе Гольджи и называется процессингом.
Более подробно синтез белков в мышечных волокнах описан в отдельной статье.
Катаболизм белков
В организме человека происходят одновременно два процесса: синтез белков и их распад (катаболизм). В тканях организма катаболизм белков происходит под воздействием внутриклеточных протеиназ, которые называются катепсинами. Эти ферменты локализованы в лизосомах.
Также катаболизм белков осуществляется особыми мультиферментными комплексами, которые называются протеосомы.
По данным С.С. Михайлова (2009) в сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма. При этом при распаде как пищевых, так и собственных белков организма образуются одни и те же 20 видов аминокислот.
Литература
- Михайлов С.С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
С уважением, А.В. Самсонова
Похожие записи:
Типы конституции женщин по И.
 Б. Галанту
Б. ГалантуОписана биография известного советского психиатра И.Б.Галанта, предложившего естественную систему конституциональных типов женщин. Дана характеристика предложенных И.Б.Галантом конституциональных…
Сила тяжести
Дано определение силы тяжести. Показано, что сила тяжести является частным случаем силы гравитации. Описаны факторы, определяющие силу тяжести:…
Сила
Дано определение силы в механике. Описаны факторы, определяющие действие на тело силы: направление, точка приложения и численное значение.
Белки (протеины) | Кинезиолог
Краткое описание:
Библиографическая справка для цитирования: Сазонов В.Ф. Белки (протеины) [Электронный ресурс] // Кинезиолог, 2009-2021: [сайт]. Дата обновления: 09.02.2021. URL: http://kineziolog.su/content/belki-proteiny (дата обращения: __.__.20___). _______________Даны общие представления о белках.
Здесь даны общие представления о белках. Подробнее о строении белков можно узнать на страничке Строение белков
Определение понятия
Белки (протеины, полипептиды) — это высокомолекулярные органические гетерополимеры (нерегулярные биополимеры), состоящие из цепочки остатков L-альфа-аминокислот, последовательно соединённых друг с другом пептидными связями.
Названию «белки», принятому в отечественной литературе, соответствует международный термин «протеины» (от греч. proteios — первый).
В живых организмах состав и последовательность аминокислотнах остатков в белках определяются генетическим кодом ДНК. При биосинтезе белков в большинстве случаев используется 20+1=21 стандартных аминокислот, которые называют «белковыми аминокислотами».
Оказывается, недостаточно просто синтезировать белок на рибосоме, его нужно ещё и дополнительно сформировать в определённую структуру и модифицировать, чтобы он начал эффективно выполнять свои функции. Самой распространенной посттрансляционной модификацией свежесозданного белка является гликозилирование — «украшение» белков сахарными (углеводными) полимерами. Эти полимерные углеводные ниточки, прицепившиеся к белковым молекулам, называются гликаны. Около 50% всех белков нашего организма, оказывается, гликозилированы. Получившиеся сложные молекулы называются протеогликаны, если гликаны составляют большую часть общей массы в модифицированном белке, или гликопротеиды, если их доля будет меньше, чем собственно белка. Вообще, ни один живой организм не обходится без структурных гликанов, связанных с белками. Даже условно живые вирусы обязательно гликозилированы, не говоря уже о бактериях.
Вообще, ни один живой организм не обходится без структурных гликанов, связанных с белками. Даже условно живые вирусы обязательно гликозилированы, не говоря уже о бактериях.
Вообще-то известно уже примерно 250 способов модификации (видоизменения) белков помимо гликозилирования. Среди них, например, фосфорилирование, метилирование, сульфирование. Такие модифицированные белки могут сильно отличаться по своим свойствам от первоначального белка, синтезированного на рибосоме.
Классификация
Белки подразделяются на две группы:
1. Протеины (простые белки) — состоят только из аминокислот и при гидролизе практически не образуют других продуктов.
2. Протеиды (сложные белки) — состоят из собственно белковой части, построенной из α-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой. При гидролизе протеиды кроме α-аминокислот образуют и другие вещества, например, фосфорную кислоту, глюкозу, гетероциклические соединения и т. д.
1. Протеины
Протеины
1) Альбумины. Растворимы в воде, при нагревании свертываются. Осаждаются насыщенными растворами солей (не осаждаются насыщенным раствором хлорида натрия NaCl, но могут быть осаждены при насыщении раствора сульфатом аммония). Имеют сравнительно небольшую молекулярную массу. При гидролизе дают мало гликоколя. Входят в состав белка яйца, сыворотки крови, молока, а также ферментов и семян растений.
2) Глобулины. Нерастворимы в воде. Растворяются в разбавленных растворах солей и осаждаются концентрированными растворами солей. Свертываются при нагревании. Имеют большую молекулярную массу, чем альбумины. Входят в состав мышечных волокон (миозин), яйца, молока, крови, растительных семян (конопля, горох).
3) Проламины. Нерастворимы в воде. Растворяются в 60—80%-ном спирте. Не свертываются при кипячении. Содержат много пролина. Входят в состав растительных белков (глиадин пшеницы, гордеин ячменя, зеин кукурузы).
4) Протамины. Сильные основания. Хорошо растворимы в воде, в разбавленных кислотах и щелочах. Не свёртываются при нагревании. Не содержат серы. Имеют простой аминокислотный состав (состоят преимущественно из диаминокислот) и низкую молекулярную массу. Входят в состав спермы и икры рыб, а также в состав сложных белков – нуклеопротеидов.
5) Гистоны. Менее сильные основания. Содержат значительное количество диаминокислот со свободными аминогруппами. Растворимы в воде и в разбавленных кислотах, но нерастворимы в разбавленных щелочах. Обычно образуют собственно белковые части сложных белков. В качестве примера можно назвать глобин – белок, входящий в состав сложного белка крови – гемоглобина. Гистоны являются белковой основой хромосом.
6) Склеропротеины. Прочные и стойкие. Нерастворимы в воде, растворах солей, кислот и щелочей (они растворяются лишь при длительной обработке концентрированными кислотами и щелочами, причем с расщеплением молекул). Устойчивы к гидролизу. Характерно высокое содержание серы. У животных выполняют опорные и покровные функции; в растениях не встречаются. Представители: коллаген – белковое вещество костей, кожи, хрящей, соединительных тканей; эластин – белок стенок кровеносных сосудов, сухожилий; кератин — белок шерсти, волос, рогового вещества, ногтей, эпидермиса кожи; фиброин – белок шелка.
Устойчивы к гидролизу. Характерно высокое содержание серы. У животных выполняют опорные и покровные функции; в растениях не встречаются. Представители: коллаген – белковое вещество костей, кожи, хрящей, соединительных тканей; эластин – белок стенок кровеносных сосудов, сухожилий; кератин — белок шерсти, волос, рогового вещества, ногтей, эпидермиса кожи; фиброин – белок шелка.
2. Протеиды
1) Нуклеопротеиды. Гидролизуются на простой белок (чаще всего гистоны или протамины) и нуклеиновые кислоты. Последние в свою очередь гидролизуются с образованием углевода, фосфорной кислоты, гетероциклического азотистого основания. Растворимы в щелочах и нерастворимы в кислотах. Входят в состав протоплазмы, клеточных ядер, вирусов.
2) Фосфопротеиды. Гидролизуются на простой белок и фосфорную кислоту. Являются слабыми кислотами. Свертываются не при нагревании, а от действия кислот. К ним относятся казеин коровьего молока и вителлин – белок, входящий в состав яичного желтка.
3) Гликопротеиды. Гидролизуются на простой белок и углевод. Нерастворимы в воде. Растворяются в разбавленных щелочах. Нейтральны. Не свертываются при нагревании. Входят в состав слизей. Представитель: муцин, входящий в состав слюны.
4) Хромопротеиды. Распадаются при гидролизе на простой белок и красящее вещество. Пример: гемоглобин крови; при гидролизе он расщепляется, образуя белок глобин и красящее вещество гем красного цвета.
5) Липопротеиды. Это соединения белка с липидами. Содержатся в цитоплазме клеток, в сыворотке крови, в яичном желтке.
Белки классифицируются также по форме их молекул:
1) Фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относят фиброин шелка, кератин шерсти.
2) Глобулярные белки, молекулы которых имеют округлую форму; к ним относятся, например, альбумины, глобулины и ряд других, в том числе и сложные белки.
Видеоресурсы:
www.youtube.com/watch?v=gjW_XE0nPgI&feature=related Строение и структура белка, лекция.
Видео: О белках доступно
Белковые основы | Исследовательский центр протеомики
Что такое белок?
Белок представляет собой большую органическую молекулу, состоящую из более мелких молекул аминокислот. Хотя небольшие белки могут содержать всего 50 аминокислот, обычно они намного крупнее и состоят из сотен или даже тысяч аминокислот.
Белки иногда намеренно разрезают на более мелкие сегменты. Эти сегменты называются пептидами. Пептид может состоять от двух до 50 аминокислот.
В белке аминокислоты соединены одна за другой, образуя длинную цепь. Они удерживаются вместе пептидными связями, которые представляют собой химические связи между атомами углерода и азота аминокислот.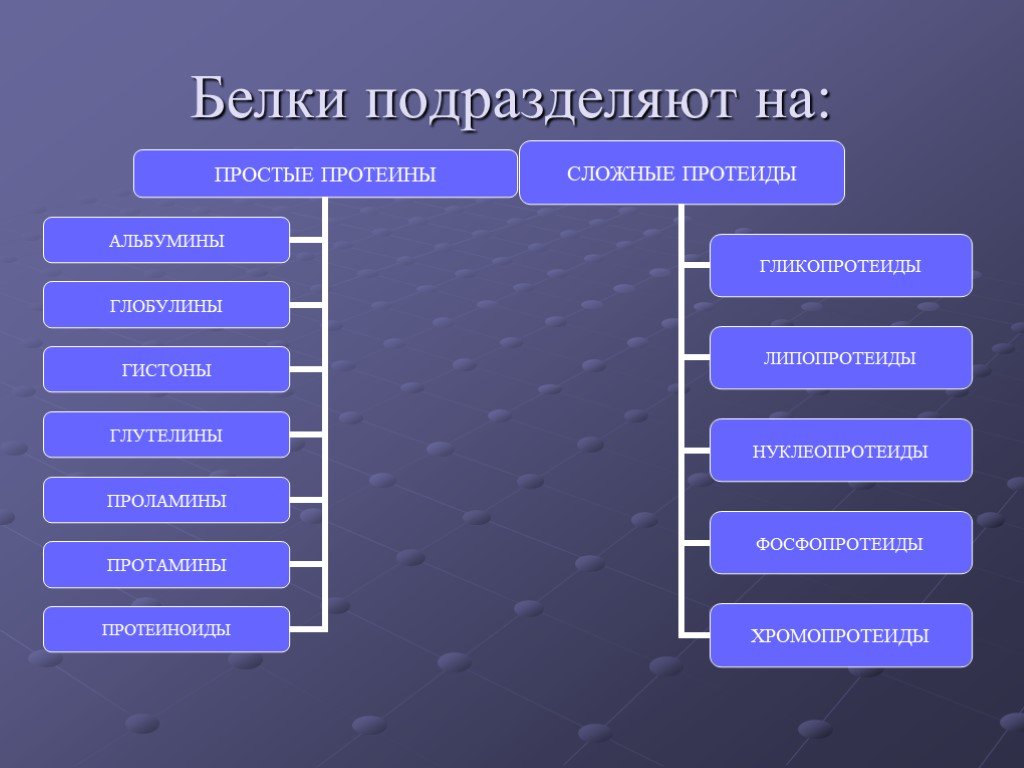 Помимо углерода и азота, аминокислоты содержат водород, кислород и иногда серу.
Помимо углерода и азота, аминокислоты содержат водород, кислород и иногда серу.
Белки содержат 20 типов аминокислот. За исключением лейцина и изолейцина, которые имеют одинаковую атомную массу в 113 дальтон, каждая аминокислота имеет уникальную массу. (Дальтон — единица измерения атомной массы. Один Дальтон равен 1/12 массы одного атома углерода 12.)
Что делают белки?
Белки, составляющие от 12 до 18 процентов худощавого взрослого тела, играют важную роль в физиологии человека. Вот некоторые из них:
- Белки образуют структурный каркас тканей и других структур в организме. Например, коллаген участвует в формировании сухожилий, связок, хрящей и других соединительных тканей.
- Белки переносят вещества по всему телу. Например, гемоглобин является переносчиком кислорода и углекислого газа.
- Белки работают как ферменты, облегчая химические реакции. В организме человека существует более 1000 известных типов ферментов.
- Белки миозин и актин позволяют мышцам сокращаться.

- Белки регулируют физиологические процессы и контролируют рост.
- Белки являются неотъемлемой частью иммунной системы. Антитела, например, состоят из белка, используемого иммунной системой.
Как гены кодируют белки?
Геном человека можно представить как одну длинную цепочку ДНК, разделенную на 46 частей, называемых хромосомами. В каждой хромосоме тысячи генов. Последовательность ДНК, из которой состоит ген, похожа на программный код, который указывает клетке, как производить белки.
Четыре типа оснований составляют цепь ДНК: аденин (А), цитозин (С), гуанин (G) и тимин (Т). Каждая основа имеет дополнение — другую основу, с которой она обычно сочетается. A соединяется с T, а C с G. В целом геном человека имеет длину 3 миллиарда пар оснований.
Три последовательных основания в цепи ДНК, называемые кодоном, могут действовать как инструкция для клетки по выбору определенного типа аминокислоты. Ряд кодонов дает указание клетке собрать воедино цепочку аминокислот, чтобы сформировать белок. Клетка знает, когда начинать и заканчивать кодирование белков, распознавая специальные стартовые и стоп-кодоны в цепи ДНК.
Клетка знает, когда начинать и заканчивать кодирование белков, распознавая специальные стартовые и стоп-кодоны в цепи ДНК.
Генетические инструкции осуществляются различными молекулами и клеточными структурами, включая транспортную РНК (тРНК), информационную РНК (мРНК) и рибосомы. Другими словами, клетка способна считывать фрагменты кода ДНК и использовать эту информацию для составления белка.
Аминокислоты бывают разных форм. Клетка, проинструктированная генами, использует это свойство и строит белки самых разных размеров и форм.
Что такое белок? | Рост белковых кристаллов на Международной космической станции
О01.
Что такое белок?
О02.
Почему важно изучение белков?
О03.
Определение структуры белка
Об04.
Белки вокруг нас
НАЧАЛО О белках
Что такое белок?
Мы не можем жить без белка.
Давайте немного поговорим о белке и о том, как он работает.
Белки играют решающую роль в жизни на Земле.
О чем вы думаете, когда слышите слово «белок»?
Может мясо или рыба? Возможно, вы знаете, что ногти, волосы и кожа состоят из белка. Наряду с углеводами и жирами белок является одним из трех основных питательных веществ, необходимых для поддержания нашей жизни.
Почему мы не можем жить без белка? Коллаген является основным структурным белком кожи, а гемоглобин является белком, переносящим кислород в крови. Это всего лишь небольшие примеры функции белка. Белки отвечают за каждый аспект жизни. Белки могут ощущать движение, свет, вкус и запах, а затем передавать эту информацию другим частям тела. Кроме того, белки являются важным компонентом иммунной системы, защищающей организм от патогенов.
Белки участвуют во многих природных явлениях, а оболочки вирусов, вызывающих такие инфекции, как грипп, Эбола, лихорадка денге и СПИД, состоят из белка. Белки также участвуют в освещении светлячков (синоним японского лета) и фотосинтезе — процессе, в котором растения производят сахара и кислород.
Как вы читали выше, белок является неотъемлемой частью жизнедеятельности. Человеческое тело использует более 100 000 видов белков, а во всем мире природы их число может достигать 10 миллиардов. Каждый из них поддерживает нашу жизнь через свою особую функцию.
Белки состоят из аминокислот.
Белки состоят из аминокислот, содержащих в основном водород, углерод, азот и кислород, соединенных вместе в цепи. Линейный ряд и порядок аминокислот закодированы в генах, сегменте ДНК. Белки содержат 20 различных аминокислот, классифицированных по свойствам. Каждый белок имеет определенную длину, компонент и порядок аминокислот.
После многих этапов белки синтезируются на фабрике по производству белков, называемой рибосомой, где интерпретируется информация, закодированная генами, и белки складываются в определенную трехмерную форму. Белки функционируют только после этой стадии. Синтез белка не всегда работает на полную мощность, но регулирует скорость синтеза, чтобы гарантировать, что белки могут быть произведены, когда и где это необходимо. Если система выйдет из-под контроля или будут вырабатываться неисправные белки, вы, скорее всего, не останетесь здоровыми.
Колонка
Подробнее по этой теме
ДНК — схема белка
За хранение генетической информации отвечают только четыре молекулы дезоксирибонуклеиновой кислоты (ДНК). Молекулы называются аденином (А), тимином (Т), гуанином (Г) и цитозином (Ц) в зависимости от того, какое основание присоединено к их общей части. Эти молекулы соединены в цепочку. Генетическая информация хранится в виде последовательности оснований в цепи нуклеиновой кислоты.
Последовательность ДНК часто называют базовой последовательностью. В последовательности оснований три основания подряд представляют одну аминокислоту: ATG представляет аминокислоту метионин, GAA представляет собой глутаминовую кислоту и т. д. Эта система называется генетическим кодом, а последовательность трех соседних нуклеотидов называется кодоном. Перестановки трех из четырех оснований дают 64 (4x4x4) различных кодона. Большинство аминокислот кодируются несколькими кодонами (рис. 1).
Рис.1 Таблица кодонов
РНК передает проект на белковую фабрику.
Синтез белка начинается с копирования гена. Последовательность ДНК белка в гене дублируется рибонуклеиновой кислотой (РНК). Этот процесс называется транскрипцией. Существует четыре компонента РНК: А, урацил (U),
G и C. В РНК U занимает место T. Транскрибированная РНК из схемы ДНК, теперь называемая матричной РНК (мРНК), передается на рибосому — фабрику по производству белка.
Существует четыре компонента РНК: А, урацил (U),
G и C. В РНК U занимает место T. Транскрибированная РНК из схемы ДНК, теперь называемая матричной РНК (мРНК), передается на рибосому — фабрику по производству белка.
Рибосома — фабрика по производству белка.
Рибосома представляет собой гигантский комплекс, состоящий из белка и формы РНК, известной как рибосомная РНК (рРНК). Другой тип РНК, называемый транспортной РНК (тРНК), также участвует. Аминокислота переносится тРНК, что указывает на комплементарную последовательность аминокислоты (антикодон). Например, UCA является одним из кодонов аминокислоты серин; таким образом, тРНК, несущая молекулу серина, имеет антикодон AGT. Здесь A связывается с U (РНК-эквивалент T), а G связывается с C. Интерпретируя мРНК, рибосома выбирает правильную тРНК, несущую соответствующую аминокислоту, для удлинения аминокислотной цепи, чтобы синтезировать белок (рис. 2). .
Рис.2 Белковый синтез
Характеристики составляющих аминокислот формируют общие характеристики белка.

20 аминокислот имеют общую часть, образующую основу или основную цепь белка. Другая часть, уникальная для каждой аминокислоты, называется боковой цепью. В зависимости от химических свойств боковой цепи эти аминокислоты подразделяются на две группы: гидрофильные (легко растворимые в воде) и гидрофобные (менее растворимые в воде) аминокислоты. Гидрофильные аминокислоты подразделяются на положительно-, отрицательно- и незаряженные аминокислоты. Эти боковые цепи также различаются по размеру. Следовательно, все функциональные различия отдельных белков обусловлены их длиной и аминокислотной последовательностью (рис. 3).
Рис. 3 Справочная таблица аминокислот
О белках
О01.
Что такое белок?
О02.
Почему важно изучение белков?
О03.


