Биологи уличили анаэробные бактерии в клеточном дыхании с помощью Rnf-насоса
Биологи доказали, что бактерии Thermotoga maritima используют мембранный белковый комплекс Rnf для клеточного дыхания — говорится в исследовании, опубликованном Communications Biology. Ученые выделили этот белок из бактериальных клеток и выяснили, что он работает как молекулярный насос — переносит через мембрану ионы Na+. Вместе с натриевой АТФ-синтазой комплекс Rnf формирует простую дыхательную цепь.
Клеточное дыхание — это последовательность химических превращений, в ходе которых клетка запасает энергию в виде молекул АТФ. В большинстве клеток эти превращения происходят при помощи ферментов дыхательной цепи. Они запасают энергию в два этапа: сначала молекулы-насосы перекачивают ионы через мембрану, создавая электрический потенциал, после чего заряды проходят обратно, сообщая энергию ферменту АТФ-синтазе, который и создает АТФ.
В эукариотических клетках дыхательная цепь расположена в мембране митохондрий и насчитывает пять комплексов. Но бактерии-анаэробы порой обходятся всего двумя: одной молекулой-насосом и АТФ-синтазой, которая тоже переносит ионы сквозь мембрану для запасания энергии. В дыхательной цепи бактерии часто используют NAD и ферредоксин — молекулы, которые переносят электроны между «звеньями». Сначала такая молекула восстанавливается, забирая электрон, а потом — окисляется, передавая его дальше в цепь.
Но бактерии-анаэробы порой обходятся всего двумя: одной молекулой-насосом и АТФ-синтазой, которая тоже переносит ионы сквозь мембрану для запасания энергии. В дыхательной цепи бактерии часто используют NAD и ферредоксин — молекулы, которые переносят электроны между «звеньями». Сначала такая молекула восстанавливается, забирая электрон, а потом — окисляется, передавая его дальше в цепь.
Гены Rnf часто встречаются в геномах бактерий и их продукты до сих пор считались участниками клеточного дыхания у прокариот. На основе биохимических и генетических данных ученые выдвинули гипотезу о том, что эти белки закрепляются в мембране и участвуют в электронном транспорте. Однако выделить фермент и доказать его свойства не удавалось: белок неизбежно деградировал.
Мартин Кухнс (Martin Kuhns) и Драган Трифунович (Dragan Trifunović) из Франкфуртского института молекулярной биологии предположили, что тот же белок термофильных бактерий может оказаться стабильнее своих молекулярных родственников у других организмов.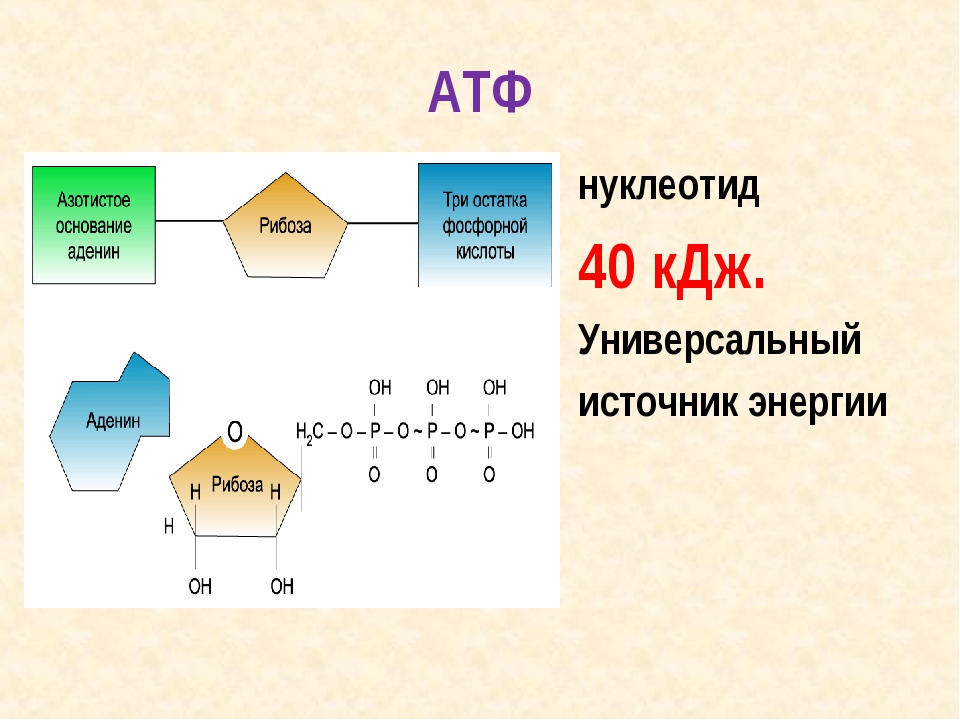 Для исследования ученые выбрали T. maritima — анаэробную бактерию, которая была впервые обнаружена в горячих водах вблизи итальянского города Вулкано. Идеальная температура для нее — около 80 градусов Цельсия.
Для исследования ученые выбрали T. maritima — анаэробную бактерию, которая была впервые обнаружена в горячих водах вблизи итальянского города Вулкано. Идеальная температура для нее — около 80 градусов Цельсия.
В строго анаэробных условиях исследователям удалось выделить фермент со специфической оксидо-редуктазной активностью. В ходе изучения его свойств оказалось, что белок обладает сразу и АТФ-азной активностью, и способностью к окислению и восстановлению NAD. То есть выделенное вещество состояло из двух ферментов: оксидоредуктазы Rnf и АТФ-азы F1F0. Результаты анализа ученые оценили при помощи гель-электрофореза белков.
Предполагаемая масса белка Rnf — 160 килодальтон, то есть в выделенной смеси оказались и мономер белка, и его димер. Масса АТФ-азы F1F0 тоже совпала с теоретической — 550 килодальтон. После разделения соответствующие полоски белков выделили из геля. Чтобы установить, действительно ли суперкомплекс из двух белков участвует в дыхании, работу его компонентов оценили при разных концентрациях ионов. Оказалось, что активность F1F0 растет пропорционально концентрации натрия, а Rnf и вовсе не работает без этого иона.
Оказалось, что активность F1F0 растет пропорционально концентрации натрия, а Rnf и вовсе не работает без этого иона.
Чтобы воссоздать работу суперкомплекса в мембране, ученые встроили его в липосому — специальный мембранный микрошарик. Это оказалось не так просто — ведь белки эффективно работают на высоких температурах, при которых липосомы теряли стабильность. Тогда решено было проводить эксперимент при температуре 45 градусов Цельсия, при которой активность АТФ-азы составляла 65% от оптимальной. В таких условиях липосома оставалась стабильной.
Биологи хотели показать, что оба белка действительно транспортируют ионы сквозь мембрану. После их встройки исследователи поместили липосомы в раствор с ионами натрия. Затем они добавили субстрат: АТФ для АТФ-азы и NAD для Rnf. В обоих случаях произошел скачок концентрации натрия внутри липосомы. Биологи объясняют это транспортной натрий-зависимой активностью белков. Так Франкфуртские исследователи доказали давнюю гипотезу о функции гена Rnf у бактерий-анаэробов.
Эти организмы обычно используют в качестве окислителя не кислород, как аэробы, а серу, железо и азот. Но недавно были обнаружены хемосинтезирующие бактерии, которые способны фиксировать углерод за счет энергии окисления марганца. Ученые считают, что они могут замыкать природные циклы марганца и влиять на круговорот других элементов.
Анна Муравьева
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.ФУНКЦИИ А) участвует в формировании новых мембранных структур Б) обеспечивает синтез органических веществ клетки В) обеспечивает синтез АТФ Г) участвует в аэробном окислении веществ Д) обеспечивает расщепление полимеров до мономеров Е) организует микротрубочки цитоскелета в клетке КОМПОНЕНТЫ КЛЕТКИ 1) 1 2) 2 3) 3 4) 4
Установите соответствие между функциями и компонентами клетки, обозначенными цифрами на схеме выше: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца. ФУНКЦИИ А) участвует в формировании новых мембранных структур Б) обеспечивает синтез органических веществ клетки В) обеспечивает синтез АТФ Г) участвует в аэробном окислении веществ Д) обеспечивает расщепление полимеров до мономеров Е) организует микротрубочки цитоскелета в клетке КОМПОНЕНТЫ КЛЕТКИ 1) 1 2) 2 3) 3 4) 4
ФУНКЦИИ А) участвует в формировании новых мембранных структур Б) обеспечивает синтез органических веществ клетки В) обеспечивает синтез АТФ Г) участвует в аэробном окислении веществ Д) обеспечивает расщепление полимеров до мономеров Е) организует микротрубочки цитоскелета в клетке КОМПОНЕНТЫ КЛЕТКИ 1) 1 2) 2 3) 3 4) 4
Учебник Курсы Книги Тесты Вопросы Личный кабинет
Учебник Курсы Книги Тесты Вопросы
Личный кабинет
Задание ЕГЭ по биологии
Наслаждайтесь интересным учебником и решайте десятки тестов на Studarium,
мы всегда рады вам! =)
Рассмотрите рисунок и выполните задания 5 и 6.
А) участвует в формировании новых мембранных структур
В) обеспечивает синтез АТФ
Г) участвует в аэробном окислении веществ
Д) обеспечивает расщепление полимеров до мономеров
Е) организует микротрубочки цитоскелета в клетке
КОМПОНЕНТЫ КЛЕТКИ
1) 1
2) 2
3) 3
4) 4
Верный ответ: 331124
На рисунке изображена животная клетка. Узнаем по отсутствию плотной клеточной стенки, в некоторых местах клеточная мембрана впячивается (образует пузырьки, фагоцитоз) — у растительной и грибной клеток такое движение цитоплазмы невозможно.
Под цифрами:
1) Митохондрия — двумембранный органоид, обеспечивающий синтез АТФ (В — АТФ это универсальный источник энергии) за счет аэробного (кислородного) окисления веществ (Г — на кристах митохондрий)
2) Лизосома (пищеварительная вакуоль) — одномембранный органоид, обеспечивает расщепление полимеров до мономеров гидролитическими ферментами (Д)
4) Центриоль — немембранный органоид, организует микротрубочки цитоскелета в клетке (Е), принимает участие в делении клетки
Под всеми цифрами:
1 — митохондрия («энергостанция» клетки)
2 — лизосома (пищеварительная вакуоль, пузырек, где происходит переваривание)
3 — эндоплазматический ретикулум (ЭПС, «конвейер» клетки)
4 — центриоль (состоит из 7 триплетов микротрубочек, формируют веретено деления при митозе/мейозе)
5 — комплекс Гольджи («почтовое отделение» клетки: накопление веществ, их модификация и упаковка в пузырьки)
6 — клеточная мембрана («стены и ворота» замка под названием клетка))
7 — ядрышко (место в ядре, где происходит активная транскрипция)
8 — ядро клетки (линия указывает на кариоплазму ядра; в ядре находится ДНК, ядро хранит, реализует и передает наследственную информацию)
P. S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 5480.
P.S. Мы нашли статью, которая относится к данной теме, изучите ее — Органоиды клетки 😉
P.S.S. Для вас готово следующее случайное задание. Мы сами не знаем, но вас ждет что-то интересное!
Митохондриальный переносчик АДФ/АТФ существует и функционирует как мономер
1. Ruprecht J.J. и Кундзи Э.Р.С. (2019) Семейство митохондриальных носителей SLC25: структура и механизм. Тенденции биохим. науч. 45, 244–258 10.1016/j.tibs.2019.11.001 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Kunji E.R.S. (2012) Структурные и механистические аспекты митохондриальных транспортных белков в комплексной биофизике (Фергюсон С., изд.), стр. 174–205, Elsevier [Google Scholar]
3. Кундзи Э.Р.С., Кинг М.С., Рупрехт Дж.Дж. и Thangaratnarajah C. (2020) Семейство носителей SLC25: важные транспортные белки в митохондриальной физиологии и патологии. Физиология, в печати [бесплатная статья PMC] [PubMed] [Google Scholar]
Кундзи Э.Р.С., Кинг М.С., Рупрехт Дж.Дж. и Thangaratnarajah C. (2020) Семейство носителей SLC25: важные транспортные белки в митохондриальной физиологии и патологии. Физиология, в печати [бесплатная статья PMC] [PubMed] [Google Scholar]
4. Palmieri F., Scarcia P. и Monne M. (2020) Болезни, вызванные мутациями в митохондриальных генах-переносчиках SLC25: обзор. Биомолекулы 10 655 10.3390/biom10040655 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Palmieri F. and Monne M. (2016) Открытия, метаболические роли и заболевания митохондриальных носителей: обзор. Биохим. Биофиз. Акта 1863, 2362–2378 гг. 10.1016/j.bbamcr.2016.03.007 [PubMed] [CrossRef] [Google Scholar]
6. Клингенберг М. (2008) Транспорт АДФ и АТФ в митохондриях и его переносчик. Биохим. Биофиз. Акта 1778 г., 1978–2021 гг. 10.1016/j.bbamem.2008.04.011 [PubMed] [CrossRef] [Google Scholar]
7. Pebay-Peyroula E. and Brandolin G. (2004) Обмен нуклеотидов в митохондриях: взгляд на молекулярном уровне. Курс. мнение Структура биол.
14, 420–425
10.1016/j.sbi.2004.06.009 [PubMed] [CrossRef] [Google Scholar]
Курс. мнение Структура биол.
14, 420–425
10.1016/j.sbi.2004.06.009 [PubMed] [CrossRef] [Google Scholar]
8. Рупрехт Дж.Дж. и Кундзи Э.Р.С. (2019) Структурные изменения в транспортном цикле митохондриального переносчика АДФ/АТФ. Курс. мнение Структура биол. 57, 135–144 10.1016/j.sbi.2019.03.029 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Aquila H., Misra D., Eulitz M. and Klingenberg M. (1982) Полная аминокислотная последовательность переносчика АДФ/АТФ из митохондрий говяжьего сердца. Хоппе Сейлерс Z Physiol. хим. 363, 345–349 10.1515/bchm2.1982.363.1.345 [PubMed] [CrossRef] [Google Scholar]
10. Aquila H., Link T.A. и Клингенберг М. (1985). Разобщающий белок митохондрий бурого жира связан с митохондриальным переносчиком АДФ/АТФ. ЭМБО Дж. 4, 2369–2376 10.1002/j.1460-2075.1985.tb03941.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
белок-носитель фосфата: структурное родство с транслоказой АДФ/АТФ и разобщающим белком митохондрий бурого жира. ЭМБО Дж.
6, 1367–1373 гг.
10.1002/j.1460-2075.1987.tb02377.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ЭМБО Дж.
6, 1367–1373 гг.
10.1002/j.1460-2075.1987.tb02377.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Saraste M. and Walker J.E. (1982) Внутренние повторы последовательности и путь полипептида в митохондриальной транслоказе ADP/ATP. ФЭБС лат. 144, 250–254 10.1016/0014-5793(82)80648-0 [PubMed] [CrossRef] [Google Scholar]
13. Walker J.E. (1992) Семейство митохондриальных транспортеров. Курс. мнение Структура биол. 2, 519–526 10.1016/0959-440X(92)-H [CrossRef] [Google Scholar]
14. Клингенберг М. (1981)Олигомерная структура мембранного белка и транспортная функция. Природа 290, 449–454 10.1038/290449a0 [PubMed] [CrossRef] [Google Scholar]
15. Kunji E.R.S. и Крайтон П.Г. (2010) Митохондриальные переносчики функционируют как мономеры. Биохим. Биофиз. Акта 1797, 817–831 10.1016/j.bbabio.2010.03.023 [PubMed] [CrossRef] [Google Scholar]
16. Кундзи Э.Р.С. и Хардинг М. (2003) Проекционная структура митохондриального переносчика АДФ/АТФ, ингибируемого атрактилозидом, Saccharomyces cerevisiae . Дж. Биол. хим.
278, 36985–36988
10.1074/jbc.C300304200 [PubMed] [CrossRef] [Google Scholar]
Дж. Биол. хим.
278, 36985–36988
10.1074/jbc.C300304200 [PubMed] [CrossRef] [Google Scholar]
17. Ruprecht J.J., Hellawell A.M., Harding M., Crichton P.G., Mccoy A.J. и Кундзи Э.Р.С. (2014)Структуры митохондриальных переносчиков АДФ/АТФ дрожжей поддерживают транспортный механизм чередующегося доступа на основе доменов. проц. Натл. акад. науч. США. 111, Е426–Е434 10.1073/пнас.1320692111 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Рупрехт Дж.Дж., Кинг М.С., Зогг Т., Александрова А.А., Пардон Э., Крайтон П.Г. и другие. (2019) Молекулярный механизм транспорта митохондриальным переносчиком АДФ/АТФ. Клетка 176, 435–447 10.1016/j.cell.2018.11.025 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Pebay-Peyroula E., Dahout-Gonzalez C., Kahn R., Trezeguet V., Lauquin G.J. и Брандолин Г. (2003) Структура митохондриального переносчика АДФ/АТФ в комплексе с карбоксиатрактилозидом. Природа 426, 39–44 10.1038/nature02056 [PubMed] [CrossRef] [Google Scholar]
20.
21. Даффорн Т.Р. (2007) Так как же узнать, что у вас есть макромолекулярный комплекс? Акта Кристаллогр. Д биол. Кристаллогр. 63, 17–25 10.1107/С0907444906047044 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Thangaratnarajah C., Ruprecht J.J. и Кундзи Э.Р.С. (2014)Вызванные кальцием конформационные изменения регуляторного домена митохондриальных носителей аспартата/глутамата человека. Нац. коммун. 5, 5491 10.1038/ncomms6491 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Harborne S.P., Ruprecht J.J. и Кундзи Э.Р.С. (2015)Вызванные кальцием конформационные изменения в регуляторном домене митохондриального носителя АТФ-Mg/Pi человека. Биохим.
24. Харборн С.П., Кинг М.С., Крайтон П.Г. и Кундзи Э.Р.С. (2017) Кальций в регуляции человеческого митохондриального носителя ATP-Mg/Pi SLC25A24 использует механизм стопорного штифта. науч. Респ. 7, 45383 10.1038/srep45383 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Harborne S.P.D. и Кундзи Э.Р.С. (2018) Регулируемые кальцием митохондриальные переносчики АТФ-Mg/Pi произошли в результате слияния регуляторного домена EF-hand с митохондриальным доменом, подобным переносчику АДФ/АТФ. МЮБМБ Жизнь 70, 1222–1232 гг. 10.1002/юб.1931 [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
26. Fiermonte G., Walker J.E. и Palmieri F. (1993)Обильная бактериальная экспрессия и восстановление внутреннего мембранного транспортного белка из бычьих митохондрий. Биохим. Дж. 294, 293–299 10.1042/bj2940293 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Kunji E.R.S., Chan K.W., Slotboom D.J., Floyd S., O’Connor R. and Monné M. (2005) Гиперпродукция эукариотических мембранных белков в 9003 3 лактококк лактис . Курс. мнение Биотехнолог.
16, 546–551
10.1016/j.copbio.2005.08.006 [PubMed] [CrossRef] [Google Scholar]
Kunji E.R.S., Chan K.W., Slotboom D.J., Floyd S., O’Connor R. and Monné M. (2005) Гиперпродукция эукариотических мембранных белков в 9003 3 лактококк лактис . Курс. мнение Биотехнолог.
16, 546–551
10.1016/j.copbio.2005.08.006 [PubMed] [CrossRef] [Google Scholar]
28. Monné M., Chan K.W., Slotboom D.J. и Кундзи Э.Р.С. (2005) Функциональная экспрессия эукариотических мембранных белков в Lactococcus lactis . Белковая наука. 14, 3048–3056 10.1110/ps.051689905 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. King M.S., Boes C. and Kunji E.R.S. (2015) Экспрессия мембранного белка в Lactococcus lactis . Методы Энзимол. 556, 77–97 10.1016/bs.mie.2014.12.009 [PubMed] [CrossRef] [Google Scholar]
30. Seigneurin-Berny D., King M.S., Sautron E., Moyet L., Catty P., Andre F. et al. (2016) Производство мембранного белка в Lactococcus lactis для функциональных исследований. Методы Мол. биол. 1432, 79–101 10.1007/978-1-4939-3637-3_6 [PubMed] [CrossRef] [Google Scholar]
31. Кинг М.С. и Кундзи Э.Р.С. (2020)Экспрессия и очистка мембранных белков в Saccharomyces cerevisiae . Методы Мол. биол.
2127, 47–61
10.1007/978-1-0716-0373-4_4 [PubMed] [CrossRef] [Google Scholar]
Кинг М.С. и Кундзи Э.Р.С. (2020)Экспрессия и очистка мембранных белков в Saccharomyces cerevisiae . Методы Мол. биол.
2127, 47–61
10.1007/978-1-0716-0373-4_4 [PubMed] [CrossRef] [Google Scholar]
32. Hashimoto M., Shinohara Y., Majima E., Hatanaka T., Yamazaki N. and Terada H. (1999) Экспрессия митохондриального переносчика АДФ/АТФ из бычьего сердца в митохондриях дрожжей : значительно усиленная экспрессия за счет замены N-концевого участка бычьего носителя соответствующими участками дрожжевого носителя. Биохим. Биофиз. Акта 1409, 113–124 10.1016/S0005-2728(98)00155-8 [PubMed] [CrossRef] [Google Scholar]
33. Fiore C., Trezeguet V., Roux P., Le Saux A., Noel F., Schwimmer C. et al. (2000)Очистка меченого гистидином митохондриального носителя АДФ/АТФ: влияние конформационных состояний С-концевой области. Белок Экспр. Очист. 19, 57–65 10.1006/prep.2000.1213 [PubMed] [CrossRef] [Google Scholar]
34. Hunte C., Screpanti E., Venturi M., Rimon A., Padan E. and Michel H. (2005) Структура Na + / H + 9 0082 антипортер и понимание механизма действия и регуляции рН. Природа
435, 1197–1202
10.1038/nature03692 [PubMed] [CrossRef] [Google Scholar]
and Michel H. (2005) Структура Na + / H + 9 0082 антипортер и понимание механизма действия и регуляции рН. Природа
435, 1197–1202
10.1038/nature03692 [PubMed] [CrossRef] [Google Scholar]
35. Ressl S., Terwisscha van Scheltinga A.C., Vonrhein C., Ott V. and Ziegler C. (2009) Молекулярные основы транспорта и регуляции симпортера Na(+)/бетаина BetP . Природа 458, 47–52 10.1038/nature07819 [PubMed] [CrossRef] [Google Scholar]
36. Arakawa T., Kobayashi-Yurugi T., Alguel Y., Iwanari H., Hatae H., Iwata M. et al. (2015) Кристаллическая структура анионообменного домена полосы 3 эритроцитов человека. Наука 350, 680–684 10.1126/science.aaa4335 [PubMed] [CrossRef] [Google Scholar]
37. Yernool D., Boudker O., Jin Y. and Gouaux E. (2004) Структура гомолога переносчика глутамата из pyrococcus horikoshii . Природа 431, 811–818 10.1038/nature03018 [PubMed] [CrossRef] [Google Scholar]
38. Duarte J.M., Biyani N., Baskaran K. and Capitani G. (2013) Анализ интерфейсов олигомеризации в трансмембранных белках. Структура БМК. биол.
13, 21
10.1186/1472-6807-13-21 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
(2013) Анализ интерфейсов олигомеризации в трансмембранных белках. Структура БМК. биол.
13, 21
10.1186/1472-6807-13-21 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Бамбер Л., Хардинг М., Батлер П.Дж.Г. и Кундзи Э.Р.С. (2006)Дрожжевые митохондриальные носители АДФ/АТФ являются мономерными в детергентах. проц. Натл. акад. науч. США. 103, 16224–16229 10.1073/pnas.0607640103 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Kunji E.R.S., Harding M., Butler P.J.G. и Akamine P. (2008) Определение молекулярной массы и размеров мембранных белков с помощью эксклюзионной хроматографии. Методы 46, 62–72 10.1016/j.ymeth.2008.10.020 [PubMed] [CrossRef] [Google Scholar]
41. Крайтон П.Г., Хардинг М., Рупрехт Дж.Дж., Ли Ю. и Кундзи Э.Р.С. (2013) Липид, детергент и кумасси синий G-250 влияют на миграцию малых мембранных белков в синих нативных гелях; митохондриальные переносчики мигрируют в виде мономеров, а не димеров. Дж. Биол. хим.
288, 22163–22173
10. 1074/jbc.M113.484329 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1074/jbc.M113.484329 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Bricker D.K., Taylor E.B., Schell J.C., Orsak T., Boutron A., Chen Y.C. и другие. (2012)Митохондриальный переносчик пирувата, необходимый для поглощения пирувата у дрожжей, дрозофилы и человека. Наука 337, 96–100 10.1126/science.1218099 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Tavoulari S., Thangaratnaraja C., Mavridou V., Harbour M.E., Martinou J.C. (2019) Митохондриальный переносчик пирувата дрожжей представляет собой гетеродимер в своем функциональном состоянии. ЭМБО Дж. 38, е100785 10.15252/embj.2018100785 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Rodriguez-Vico F., Martinez-Cayuela M., Zafra M.F., Garcia-Peregrin E. and Ramirez H. (1991) Процедура одновременного определения липидов и белков в биомембранах и других биологических образцах. Липиды 26, 77–80 10.1007/БФ02544029[PubMed] [CrossRef] [Google Scholar]
45. Riccio P. , Aquila H. и Klingenberg M. (1975) Очистка карбоксиатрактилата-связывающего белка из митохондрий. ФЭБС лат.
56, 133–138
10.1016/0014-5793(75)80127-X [PubMed] [CrossRef] [Google Scholar]
, Aquila H. и Klingenberg M. (1975) Очистка карбоксиатрактилата-связывающего белка из митохондрий. ФЭБС лат.
56, 133–138
10.1016/0014-5793(75)80127-X [PubMed] [CrossRef] [Google Scholar]
46. Лин К. С. и Клингенберг М. (1980) Выделение разобщающего белка из митохондрий бурой жировой ткани. ФЭБС лат. 113, 299–303 10.1016/0014-5793(80)80613-2 [PubMed] [CrossRef] [Google Scholar]
47. Аквила Х., Эйерманн В., Бабель В. и Клингенберг М. (1978) Выделение транслокатора АДФ/АТФ из митохондрий бычьего сердца в виде комплекса бонкрекат-белок. Евро. Дж. Биохим. 85, 549–560 10.1111/j.1432-1033.1978.tb12270.x [PubMed] [CrossRef] [Google Scholar]
48. Lee Y., Willers C., Kunji E.R.S. и Крайтон П.Г. (2015)Разобщающий белок 1 связывает один нуклеотид на мономер и стабилизируется прочно связанным кардиолипином. проц. Натл. акад. науч. США. 112, 6973–6978 10.1073/pnas.1503833112 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Lin C.S., Hackenberg H. and Klingenberg E. M. (1980) Разобщающий белок митохондрий бурой жировой ткани представляет собой димер. Гидродинамическое исследование. ФЭБС лат.
113, 304–306
10.1016/0014-5793(80)80614-4 [PubMed] [CrossRef] [Google Scholar]
M. (1980) Разобщающий белок митохондрий бурой жировой ткани представляет собой димер. Гидродинамическое исследование. ФЭБС лат.
113, 304–306
10.1016/0014-5793(80)80614-4 [PubMed] [CrossRef] [Google Scholar]
50. Хакенберг Х. и Клингенберг М. (1980) Молекулярная масса и гидродинамические параметры аденозин-5′-дифосфат-аденозин-5′-трифосфатного носителя в Triton X-100. Биохимия 19, 548–555 10.1021/bi00544a024 [PubMed] [CrossRef] [Google Scholar]
51. Nury H., Manon F., Arnou B., le Maire M., Pebay-Peyroula E. and Ebel C. (2008) Митохондриальный бычий переносчик АДФ/АТФ в детергенте является преимущественно мономерным, но также образует мультимерные виды. Биохимия 43, 12319–12331 10.1021/bi801053m [PubMed] [CrossRef] [Google Scholar]
52. Mahieu E. and Gabel F. (2018) Биологическое малоугловое рассеяние нейтронов: последние результаты и развитие. Акта Кристаллогр. D Структура. биол. 74, 715–726 10.1107/S2059798318005016 [PubMed] [CrossRef] [Google Scholar]
53. Блок М.Р., Заккай Г., Локен Г.Дж. и Винье П.В. (1982) Малоугловое рассеяние нейтронов митохондриальным белком-носителем АДФ/АТФ в детергенте. Биохим. Биофиз. Рез. коммун.
109, 471–477
10.1016/0006-291X(82)91745-4 [PubMed] [CrossRef] [Google Scholar]
Блок М.Р., Заккай Г., Локен Г.Дж. и Винье П.В. (1982) Малоугловое рассеяние нейтронов митохондриальным белком-носителем АДФ/АТФ в детергенте. Биохим. Биофиз. Рез. коммун.
109, 471–477
10.1016/0006-291X(82)91745-4 [PubMed] [CrossRef] [Google Scholar]
54. Slotboom D.J., Duurkens R.H., Olieman K. и Erkens G.B. (2008)Статическое рассеяние света для характеристики мембранных белков в растворе детергента. Методы 46, 73–82 10.1016/j.ymeth.2008.06.012 [PubMed] [CrossRef] [Google Scholar]
55. Бамбер Л., Слотбум Д.Дж. и Кундзи Э.Р.С. (2007)Дрожжевые митохондриальные переносчики АДФ/АТФ являются мономерными в детергентах, что продемонстрировано дифференциальной аффинной очисткой. Дж. Мол. биол. 371, 388–395 10.1016/j.jmb.2007.05.072 [PubMed] [CrossRef] [Google Scholar]
и другие. (2000) Роль транслокатора адениновых нуклеотидов 1 в поддержании мтДНК. Наука 289, 782–785 10.1126/science.289.5480.782 [PubMed] [CrossRef] [Google Scholar]
57. Уилки А.О. (1994) Молекулярная основа генетического доминирования. Дж. Мед. Жене.
31, 89–98
10.1136/jmg.31.2.89 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Мед. Жене.
31, 89–98
10.1136/jmg.31.2.89 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Garrett R. and Grisham C.M. (2010) Биохимия, 4-е изд., международное издание, Brooks/Cole; Cengage Learning, Австралия; Великобритания [Google Scholar]
59. Буоно М. Дж. и Колкхорст Ф. В. (2001) Оценка ресинтеза АТФ во время марафонского бега: метод представления метаболизма. Доп. Физиол. Образовательный 25, 70–71 10.1152/advanced.2001.25.2.70 [CrossRef] [Google Scholar]
60. Бамбер Л., Хардинг М., Монне М., Слотбум Д.Дж. и Кундзи Э.Р.С. (2007)Дрожжевой митохондриальный переносчик АДФ/АТФ действует как мономер в митохондриальных мембранах. проц. Натл. акад. науч. США. 104, 10830–10834 10.1073/pnas.0703969104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Kunji E.R.S. и Робинсон А.Дж. (2006)Консервативный сайт связывания субстрата митохондриальных переносчиков. Биохим. Биофиз. Акта
1757, 1237–1248 гг.
10.1016/j.bbabio.2006. 03.021 [PubMed] [CrossRef] [Google Scholar]
03.021 [PubMed] [CrossRef] [Google Scholar]
62. Робинсон А.Дж. и Кундзи Э.Р.С. (2006) Митохондриальные носители в цитоплазматическом состоянии имеют общий сайт связывания субстрата. проц. Натл. акад. науч. США. 103, 2617–2622 10.1073/pnas.0509994103 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Robinson A.J., Overy C. and Kunji E.R.S. (2008) Механизм транспорта митохондриальными переносчиками на основе анализа симметрии. проц. Натл. акад. науч. США. 105, 17766–17771 10.1073/pnas.0809580105 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Кунджи Э.Р.С., Александрова А., Кинг М.С., Маджд Х., Эштон В.Л., Серсон Э. и соавт. (2016) Транспортный механизм митохондриального переносчика АДФ/АТФ. Биохим. Биофиз. Акта 1863, 2379–2393 гг. 10.1016/j.bbamcr.2016.03.015 [PubMed] [CrossRef] [Google Scholar]
65. Davies K.M., Anselmi C., Wittig I., Faraldo-Gomez J.D. and Kühlbrandt W. (2012) Структура дрожжевой F1Fo-АТФ-синтазы ди mer и его роль в формировании митохондриальных крист. проц. Натл. акад. науч. США.
109, 13602–13607
10.1073/пнас.1204593109 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США.
109, 13602–13607
10.1073/пнас.1204593109 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Yernool D., Boudker O., Folta-Stogniew E. and Gouaux E. (2003) Стехиометрия тримерных субъединиц переносчиков глутамата из Bacillus caldotenax и 90 033 Bacillus stearothermophilus . Биохимия 42, 12981–12988 10.1021/bi030161q [PubMed] [CrossRef] [Google Scholar]
67. Walz T., Hirai T., Murata K., Heymann J.B., Mitsuoka K., Fujiyoshi Y. et al. (1997) Трехмерная структура аквапорина-1. Природа 387, 624–627 10.1038/42512 [PubMed] [CrossRef] [Google Scholar]
68. Брандолин Г., Дусьер Дж., Гулик А., Гулик-Кшивицкий Т., Лаукен Г.Дж. и Винье П.В. (1980) Кинетические, связывающие и ультраструктурные свойства белка-носителя адениновых нуклеотидов из говяжьего сердца после включения в фосфолипидные везикулы. Биохим. Биофиз. Акта 592, 592–614 10.1016/0005-2728(80)
-6 [PubMed] [CrossRef] [Google Scholar] 69. Эскандари С. , Райт Э.М., Креман М., Стараче Д.М. и Зампиги Г.А. (1998) Структурный анализ клонированных белков плазматической мембраны с помощью электронной микроскопии с замораживанием. проц. Натл. акад. науч. США.
95, 11235–11240
10.1073/pnas.95.19.11235 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Райт Э.М., Креман М., Стараче Д.М. и Зампиги Г.А. (1998) Структурный анализ клонированных белков плазматической мембраны с помощью электронной микроскопии с замораживанием. проц. Натл. акад. науч. США.
95, 11235–11240
10.1073/pnas.95.19.11235 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Кедров А., Хеллавелл А.М., Клосин А., Бродхерст Р.Б., Кунджи Э.Р.С. и Мюллер Д.Дж. (2010)Исследование взаимодействия карбоксиатрактилозида и атрактилозида с дрожжевым митохондриальным переносчиком АДФ/АТФ. Состав 18, 39–46 10.1016/j.str.2009.11.009 [PubMed] [CrossRef] [Google Scholar]
71. Хорев Д.С., Бейкер Л.А., Ву Д., Бейльстен-Эдмандс В., Роуз С.Л., Зеев-Бен-Мордехай Т. и др. (2018) Белковые сборки, выбрасываемые непосредственно из нативных мембран, дают комплексы для масс-спектрометрии. Наука 362, 829–834 10.1126/science.aau0976 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Hirst J., Kunji E.R.S. и Walker J.E. (2019) Comment on «Белковые сборки, выбрасываемые непосредственно из нативных мембран, дают комплексы для масс-спектрометрии». Наука
366, eaaw9830
10.1126/science.aaw9830 [PubMed] [CrossRef] [Google Scholar]
Наука
366, eaaw9830
10.1126/science.aaw9830 [PubMed] [CrossRef] [Google Scholar]
73. Mehmood S., Marcoux J., Gault J., Quigley A., Michaelis S., Young S.G. et al. (2016)Масс-спектрометрия фиксирует нецелевое связывание лекарств и дает представление о механизме металлопротеазы человека ZMPSTE24. Нац. хим. 8, 1152–1158 гг. 10.1038/нхим.2591 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Liko I., Allison T.M., Hopper J.T. и Робинсон С.В. (2016) Структурная биология, управляемая масс-спектрометрией. Курс. мнение Структура биол. 40, 136–144 10.1016/j.sbi.2016.09.008 [PubMed] [CrossRef] [Google Scholar]
75. Голт Дж., Донлан Дж.А., Лико И., Хоппер Дж.Т., Гупта К., Хаусден Н.Г. и другие. (2016) Масс-спектрометрия высокого разрешения малых молекул, связанных с мембранными белками. Нац. Методы 13, 333–336 10.1038/nmeth.3771 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Babel W., Wachter E., Aquila H. and Klingenberg M. (1981) Определение аминокислотной последовательности носителя АДФ, АТФ из митохондрий говяжьего сердца. Последовательность С-концевого ацидолитического фрагмента. Биохим. Биофиз. Акта
670, 176–180
10.1016/0005-2795(81)
Последовательность С-концевого ацидолитического фрагмента. Биохим. Биофиз. Акта
670, 176–180
10.1016/0005-2795(81)
-4 [PubMed] [CrossRef] [Google Scholar]
77. Клингенберг М. (1989) Молекулярные аспекты переносчика адениновых нуклеотидов из митохондрий. Арка Биохим. Биофиз. 270, 1–14 10.1016/0003-9861(89)-5 [PubMed] [CrossRef] [Google Scholar]
78. Уолпол Т.Б., Палмер Д.Н., Цзян Х., Дин С., Фернли И.М. и Уокер Дж.Е. (2015) Сохранение полного триметилирования лизина-43 в роторном кольце с-субъединиц многоклеточных аденозинтрифосфатных (АТФ) синтаз. Мол. Клетка. протеом. 14, 828–840 10.1074/mcp.M114.047456 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Malecki J.M., Willemen H., Pinto R., Ho A.Y.Y., Moen A., Eijkelkamp N. et al. (2019) FAM173A человека представляет собой митохондриальную лизин-специфическую метилтрансферазу, которая нацелена на транслоказу адениннуклеотидов и влияет на митохондриальное дыхание. Дж. Биол. хим.
294, 11654–11664
10. 1074/jbc.RA119.009045 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
1074/jbc.RA119.009045 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
80. Smith V.R., Fearnley I.M. and Walker J.E. 6′-O-флуоресцеин-атрактилозид. Биохим. Дж. 376, 757–763 10.1042/bj20030942 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Хорев Д.С., Робинсон К.В. (2019) Ответ на комментарий «Белковые сборки, выбрасываемые непосредственно из нативных мембран, дают комплексы для масс-спектрометрии». Наука 366, eaax3102 10.1126/science.aax3102 [PubMed] [CrossRef] [Google Scholar]
82. Либшнер Д., Афонин П.В., Мориарти Н.В., Пун Б.К., Соболев О.В., Тервиллигер Т.К. и другие. (2017) Карты польдера: улучшение карт OMIT за счет исключения объемного растворителя. Акта Кристаллогр. D Структура. биол. 73, 148–157 10.1107/S2059798316018210 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Mifsud J., Ravaud S., Krammer E.M., Chipot C., Kunji E.R.S., Pebay-Peyroula E. et al. (2013) Субстратная специфичность переносчика АДФ/АТФ человека AAC1. Мол. член биол.
30, 160–168
10.3109/09687688.2012.745175 [PubMed] [CrossRef] [Google Scholar]
Мол. член биол.
30, 160–168
10.3109/09687688.2012.745175 [PubMed] [CrossRef] [Google Scholar]
84. Wang Y. and Tajkhorshid E. (2008) Электростатическая воронка субстрата во внутренних мембранных носителях митохондрий. проц. Натл. акад. науч. США. 105, 9598–9603 10.1073/pnas.0801786105 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Dehez F., Pebay-Peyroula E. and Chipot C. (2008) Связывание АДФ в митохондриальном переносчике АДФ/АТФ осуществляется электростатической воронкой. Варенье. хим. соц. 130, 12725–12733 10.1021/ja8033087 [PubMed] [CrossRef] [Google Scholar]
86. Beyer K. and Klingenberg M. (1985) Белок-носитель АДФ/АТФ из митохондрий сердца говядины имеет большое количество прочно связанного кардиолипина, что было выявлено с помощью ядерного магнитного резонанса 31P. Биохимия 24, 3821–3826 10.1021/bi00336a001 [PubMed] [CrossRef] [Google Scholar]
87. Schlame M., Beyer K., Hayer-Hartl M. и Klingenberg M. (1991) Молекулярные виды кардиолипина по отношению к другим митохондриальным фосфолипидам. Существует ли ацильная специфичность взаимодействия кардиолипина с переносчиком АДФ/АТФ?
Евро. Дж. Биохим.
199, 459–466
10.1111/j.1432-1033.1991.tb16144.x [PubMed] [CrossRef] [Google Scholar]
Существует ли ацильная специфичность взаимодействия кардиолипина с переносчиком АДФ/АТФ?
Евро. Дж. Биохим.
199, 459–466
10.1111/j.1432-1033.1991.tb16144.x [PubMed] [CrossRef] [Google Scholar]
88. Хагиги А., Хаак Т.Б., Атик М., Моттаги Х., Хагиги-Кахки Х., Башир Р.А. и другие. (2014)Синдром Сенгера: шесть новых мутаций AGK в семи новых семьях и обзор фенотипического и мутационного спектра 29 пациентов. Orphanet J. Rare Dis. 9, 119 10.1186/s13023-014-0119-3 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Mayr J.A., Haack T.B., Graf E., Zimmermann F.A., Wieland T., Haberberger B. et al. (2012) Отсутствие митохондриальной протеинацилглицеролкиназы вызывает синдром Сенгера. Являюсь. Дж. Хам. Жене. 90, 314–320 10.1016/j.ajhg.2011.12.005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
(2002) Дефицит транслокатора 1 адениновых нуклеотидов, связанный с синдромом Сенгера. Анна. Нейрол. 52, 95–99 10.1002/ana.10214 [PubMed] [CrossRef] [Google Scholar]
91. Крайтон П.Г., Ли Ю., Рупрехт Дж.Дж., Серсон Э., Тангаратнараджа К., Кинг М.С. и другие. (2015) Тенденции термостабильности предоставляют информацию о природе взаимодействия субстрата, ингибитора и липидов с митохондриальными переносчиками. Дж. Биол. хим.
290, 8206–8217
10.1074/jbc.M114.616607 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Крайтон П.Г., Ли Ю., Рупрехт Дж.Дж., Серсон Э., Тангаратнараджа К., Кинг М.С. и другие. (2015) Тенденции термостабильности предоставляют информацию о природе взаимодействия субстрата, ингибитора и липидов с митохондриальными переносчиками. Дж. Биол. хим.
290, 8206–8217
10.1074/jbc.M114.616607 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
92. Kadenbach B., Mende P., Kolbe H.V., Stipani I. and Palmieri F. (1982) Митохондриальный переносчик фосфата имеет существенную потребность в кардиолипине. ФЭБС лат. 139, 109–112 93. Hoffmann B., Stockl A., Schlame M., Beyer K. and Klingenberg M. мутанты. Дж. Биол. хим. 269, 1940–1944 PMID: [PubMed] [Google Scholar]
94. Дункан А.Л., Рупрехт Дж.Дж., Кундзи Э.Р.С. и Робинсон А.Дж. (2018)Динамика кардиолипина и связывание с консервативными остатками в митохондриальном переносчике АДФ/АТФ. Биохим. Биофиз. Акта 1860, 1035–1045 гг. 10.1016/j.bbamem.2018.01.017 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Hedger G., Rouse S.L., Domanski J., Chavent M., Koldso H. and Sansom M.S. (2016)Липидолюбивые муравьи: молекулярное моделирование взаимодействия кардиолипинов и организации транслоказы адениновых нуклеотидов в модельных митохондриальных мембранах. Биохимия
55, 6238–624910.1021/acs.biochem.6b00751 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Hedger G., Rouse S.L., Domanski J., Chavent M., Koldso H. and Sansom M.S. (2016)Липидолюбивые муравьи: молекулярное моделирование взаимодействия кардиолипинов и организации транслоказы адениновых нуклеотидов в модельных митохондриальных мембранах. Биохимия
55, 6238–624910.1021/acs.biochem.6b00751 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
96. Dehez F., Schanda P., King M.S., Kunji E.R.S. и Chipot C. (2017) Митохондриальный переносчик АДФ/АТФ в додецилфосфохолине связывает кардиолипины с ненативной аффинностью. Биофиз. Дж. 113, 2311–2315 10.1016/j.bpj.2017.09.019 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97. Crichton P.G., Lee Y. and Kunji E.R.S. (2017) Молекулярные особенности разобщающего белка 1 поддерживают обычный механизм, подобный митохондриальному переносчику. Биохимия 134, 35–50 10.1016/j.biochi.2016.12.016 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
98. Harmel R. and Fiedler D. (2018) Особенности и регуляция неферментативных посттрансляционных модификаций. Нац. хим. биол.
14, 244–252
10.1038/nchembio.2575 [PubMed] [CrossRef] [Google Scholar]
Нац. хим. биол.
14, 244–252
10.1038/nchembio.2575 [PubMed] [CrossRef] [Google Scholar]
99. Гарланд П.Б., Шеперд Д. и Йейтс Д.В. (1965) Стационарные концентрации кофермента А, ацетил-коэнзима А и длинноцепочечного жирного ацил-коэнзима А в митохондриях печени крыс, окисляющих пальмитат. Биохим. Дж. 97, 587–594 10.1042/bj0970587 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
100. Drazic A., Myklebust L.M., Ree R. и Arnesen T. (2016) Мир ацетилирования белков. Биохим. Биофиз. Акта 1864, 1372–1401 гг. 10.1016/j.bbapap.2016.06.007 [PubMed] [CrossRef] [Google Scholar]
101. Вагнер Г.Р. и Пейн Р.М. (2013) Широко распространенное и независимое от ферментов Nε-ацетилирование и Nε-сукцинилирование белков в химических условиях митохондриального матрикса. Дж. Биол. хим. 288, 29036–29045 10.1074/jbc.M113.486753 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
102. Weinert B.T., Iesmantavicius V., Moustafa T., Scholz C., Wagner S.A., Magnes C. et al. (2014)Динамика ацетилирования и стехиометрия в Saccharomyces cerevisiae . Мол. Сист. биол.
10 716
10.1002/msb.134766 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
et al. (2014)Динамика ацетилирования и стехиометрия в Saccharomyces cerevisiae . Мол. Сист. биол.
10 716
10.1002/msb.134766 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
103. Weinert B.T., Scholz C., Wagner S.A., Iesmantavicius V., Su D., Daniel J.A. и другие. (2013) Сукцинилирование лизина является часто встречающейся модификацией у прокариот и эукариот и во многом совпадает с ацетилированием. Сотовый представитель 4, 842–851 10.1016/j.celrep.2013.07.024 [PubMed] [CrossRef] [Google Scholar]
104. Бриттон Л.М., Ньюхарт А., Бхану Н.В., Шридхаран Р., Гонсалес-Коуп М., Плат К. и соавт. (2013) Первоначальная характеристика 10 O-ацетилирования серина гистона h4. Эпигенетика 8, 1101–1113 гг. 10.4161/epi.26025 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
105. Mukherjee S., Keitany G., Li Y., Wang Y., Ball H.L., Goldsmith E.J. и другие. (2006) Yersinia YopJ ацетилирует и ингибирует активацию киназы, блокируя фосфорилирование.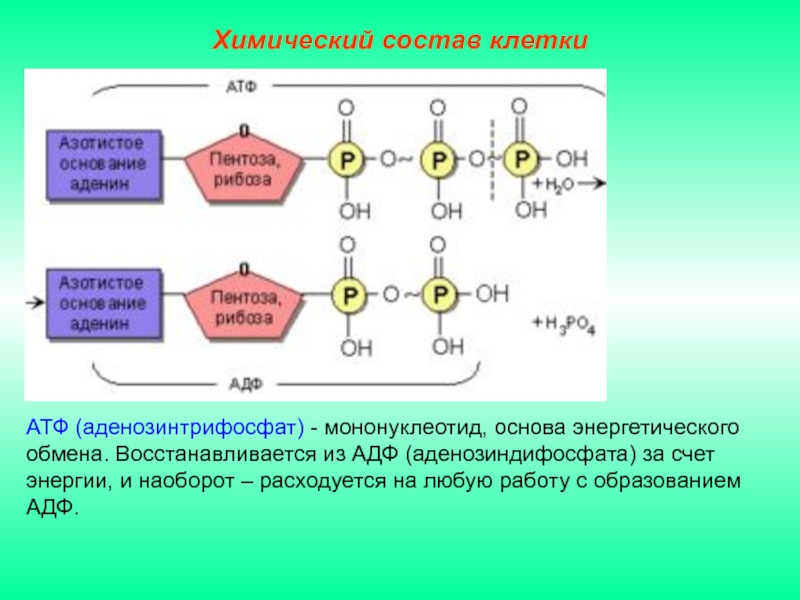 Наука
312, 1211–1214 гг.
10.1126/science.1126867 [PubMed] [CrossRef] [Google Scholar]
Наука
312, 1211–1214 гг.
10.1126/science.1126867 [PubMed] [CrossRef] [Google Scholar]
106. Хорев Д.С., Тан Х., Роуз С.Л., Болла Дж.Р., фон Кугельген А., Бейкер Л.А. и соавт. (2020)Использование липидных везикул, обработанных ультразвуком, для масс-спектрометрии комплексов мембранных белков. Нац. протокол 15, 1690–1706 гг. 10.1038/s41596-020-0303-y [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
107. Sanchez J.F., Kauffmann B., Grelard A., Sanchez C., Trezeguet V., Huc I. et al. (2012)Однозначная структура атрактилозида и карбоксиатрактилозида. биоорг. Мед. хим. лат. 22, 2973 10.1016/j.bmcl.2012.02.040 [PubMed] [CrossRef] [Google Scholar]
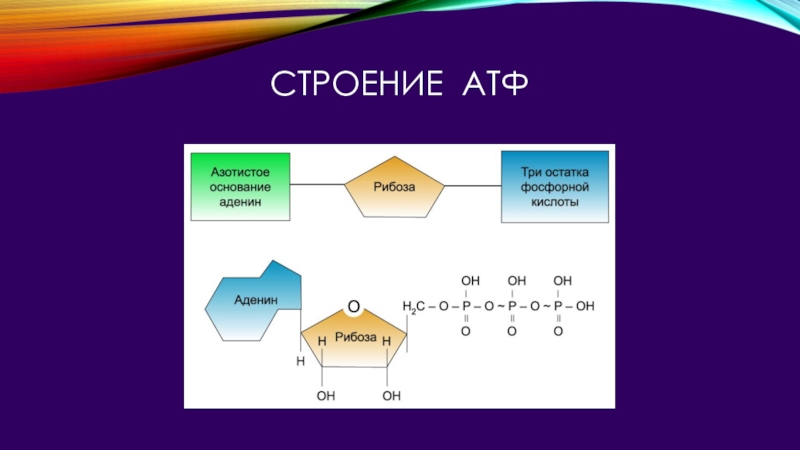
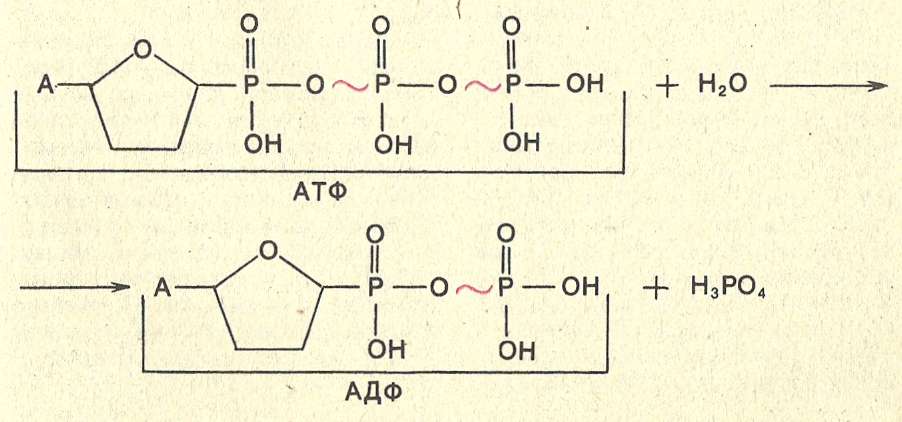
Внимательно изучите структуру ATP. В дополнение к тому, что АТФ является «энергетической валютой» для клетки, мономером какой макромолекулы является АТФ?
Биология
Амира А.
спросил 30.09.21Внимательно изучите структуру АТФ. В дополнение к тому, что АТФ является «энергетической валютой» для клетки, мономером какой макромолекулы является АТФ?
Вопрос 3 варианта:
| и | Липид |
| б | ДНК |
| с | Белок |
| д | Углеводы |
| и | РНК |
Подписаться І 1
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Тувейре О. ответил 30.09.21
ответил 30.09.21
Репетитор
Новое в ВизантеОбладает высокой квалификацией в процессе воздействия на научные знания.
Об этом репетиторе ›
Об этом репетиторе ›
Голосовать за 0 Понизить голосПодробнее
Отчет
Энрике Р. ответил 30.09.21
Репетитор
5 (2)Бакалавр биоинженерии (июнь 2017 г.) и магистр биоинженерии (в процессе)
См. таких преподавателей
Смотрите таких репетиторов
Итак, мы хотим знать, какая из макромолекул состоит из АТФ (в неточных терминах неспециалиста)
Во-первых, я думаю, что важно удалить выбор, который не имеет смысла.
Липиды и углеводы даже отдаленно не имеют структуры АТФ.

