InScience
Новости
Найдена молекула-предшественница АТФ
Автор: Елизавета Перепелица
Aaron Halpern, UCL (CC-BY 4.0, https://creativecommons.org/licenses/by/4.0/)
Британские ученые из Университетского колледжа Лондона выяснили, что предшественником АТФ, универсальной энергоемкой молекулы, до появления клеток являлся ацетилфосфат. АТФ начала синтезироваться в ходе реакции между ацетилфосфатом и АДФ в присутствии ионов железа. Исследование опубликовано в журнале PLoS Biology.
АТФ (аденозинтрифосфат) — это молекула, которая используется всеми клетками для получения энергии. Она является энергоемкой, и энергия высвобождается при отщеплении от АТФ фосфатной группировки. При этом на синтез АТФ уходит столько энергии, что в живых организмах для получения одной молекулы требуется шесть реакций, в которых также расходуется АТФ. Из-за этого ученые предполагают, что во время, когда клеток еще не существовало, АТФ была очень редкой молекулой. Вероятнее всего, медиатором для получения АТФ из АДФ (аденозиндифосфата) была некая другая молекула.
Вероятнее всего, медиатором для получения АТФ из АДФ (аденозиндифосфата) была некая другая молекула.
Британские ученые предположили, что этой молекулой был ацетилфосфат (AcP), который и сейчас встречается в бактериях и археях и играет роль промежуточного соединения в метаболизме. AcP способен присоединять фосфатную группировку к АДФ в присутствии ионов железа. Британские ученые задались вопросом, могут ли такую же роль выполнять другие малые молекулы, помимо AcP, и могут ли эту реакцию катализировать ионы других металлов. Как показали эксперименты исследователей, ионы других металлов не были так же эффективны, как железо. Что интереснее, ни одна из проверенных учеными малых молекул не была способна так же, как AcP, фосфорилировать АДФ. Единственным кандидатом, хотя и уступающим по эффективности, оказался карбамоилфосфат. Также ученые показали, что AcP не способен присоединять фосфатные группировки ни к каким нуклеозидфосфатам (например, гуанозиндифосфат, цитозиндифосфат), кроме АДФ.
С помощью молекулярного моделирования ученые попытались объяснить специфичность этой реакции. Они предположили, что для образования АТФ из АДФ в присутствии AcP и ионов железа имеют значение малый диаметр и высокая плотность заряда ионов железа, а также конформация промежуточного соединения, которое образуется при сближении всех реагентов.
«АТФ — настолько важная для метаболизма молекула, что я предполагала, что она может образовываться из АДФ вне живых организмов. Я думала, что для проведения такой реакции могут подойти и другие фосфорилирующие агенты или катализаторы на основе ионов металлов, особенно те, которые встречаются в организмах. Однако было удивительно обнаружить, что реакция настолько селективна и требовательна по отношению к субстрату, донору фосфатов и иону металла. То, что эта реакция протекает в воде в нормальных, совместимых с жизнью условиях, также важно для понимания происхождения жизни», — рассказала Сильвана Пинна, главный автор исследования из Университетского колледжа Лондона.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.
Тэги
ЛЮМИНОМЕТР.РФ — приборы и технологии для контроля биологических загрязнений, люминометры Hygiena SystemSURE Plus и EnSURE, АТФ-тесты — RABOS
Эксклюзивный импортёр мирового
лидера в области АТФ-мониторинга
компании
+7(495) 414–25-73
Используйте люминометры Hygiena
для контроля санитарного состояния
Вашего предприятия
ОЦЕНИ ЗА 10 СЕКУНД степень чистоты
любой поверхности и воды!
- Внедрение
- Обучение
- Сопровождение
Профильные специалисты со стажем работы от 10 лет
21 тип тестов под различные сферы бизнеса
Проведено более 5 000 000 исследований
Более 2000 довольных клиентов в России
Выбери свой люминометр!
EnSURE Touch
Лаборатория
5 в 1
NEW
Полноценная лаборатория
Результат за 10 секунд
Преобразование RLU в КОЕ
Множество тестов — один прибор
Облачное хранение данных
Подробнее
EnSURE
Мини
лаборатория
АТФ анализ за 15 секунд
Автоматическая калибровка
Выявление E. coli, Coliform, КМАФАнМ за 7 часов
coli, Coliform, КМАФАнМ за 7 часов
Преобразование RLU в КОЕ
Подробнее
SystemSURE Plus
HIT
АТФ анализ за 15 секунд
Программное обеспечение SureTrend
Автоматическая калибровка
Подробнее
Снижение издержек
Автоматизация процессов
Снижение рисков
Улучшение качества продуктов
Повышение
конкурентоспособности
Что такое АТФ-мониторинг?
АТФ-люминометры – Это приборы, обеспечивающие мониторинг биологических загрязнений в различных сферах: пищевой промышленности, медицине, сельском хозяйстве, HoReCa. Действие приборов основано на эффекте биолюминесценции.
Биолюминесценция – это способность живых микроорганизмов выделять энергию в форме света, в том числе в ходе определеных химических реакций. Все растительные, животные и бактериальные клетки, в том числе дрожжи и плесень, содержат аденозинтрифоcфат (АТФ). При контакте АТФ с ферментами люциферин/ люцифераза происходит выделение света.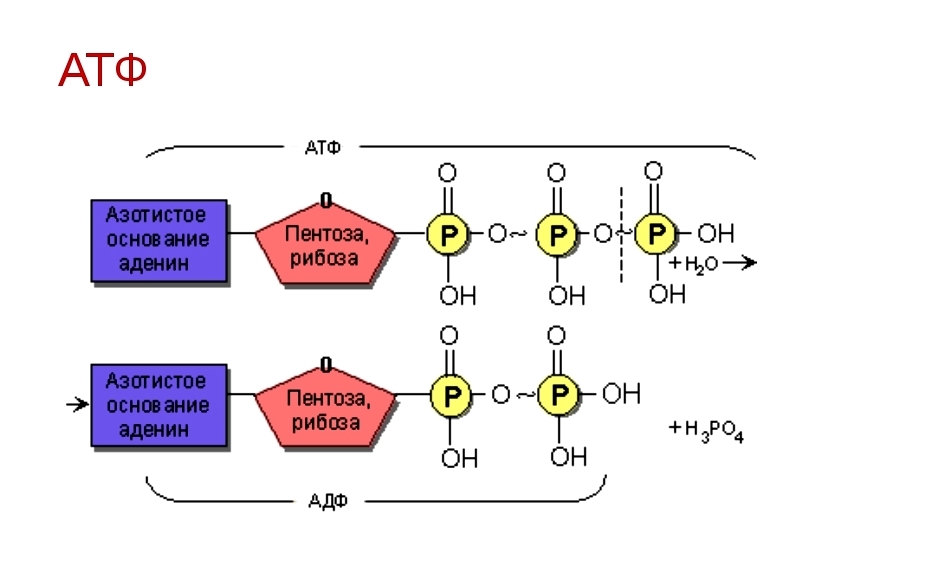
АТФ-люминометр измеряет силу указанного свечения, определяя степень биологического загрязнения образца.
Чистота означает безопасность и качество. Обеспечьте максимальную чистоту на вашем производстве.
Начните сегодня.
Тесты
АТФ-тесты
Поверхность Жидкость
UltraSnap — определение количества молекул АТФ
SuperSnap — ультрачувствительное определение молекул АТФ
AquaSnap Free — определение свободных молекул АТФ
AquaSnap Total — определение общего количества молекул АТФ (микробного и свободного типа)
Выявление микроорганизмов
Microsnap Coliform — тест на бактерии группы кишечной палочки
Microsnap E.Coli — определение бактерии E.Coli
Microsnap Enterobacteriaceae (EB) — тест на энтеробактерии
Microsnap Total Viable Count — тест на общее микробное число
Белок и аллергены
Pro-Clean – тест на остаточный белок (для пищевой промышленности).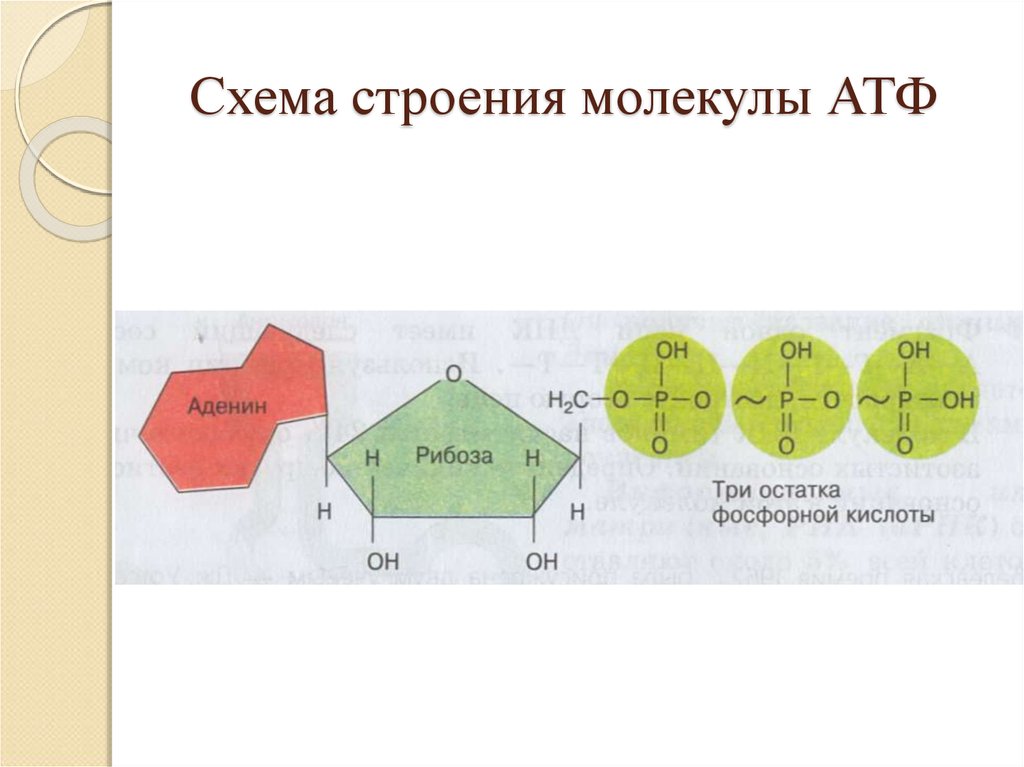
SpotCheck Plus – тест для обнаружения глюкозы и лактозы на поверхности.
MediCheck™ – тест на остаточный белок (для медицинских учреждений).
AllerSnap – тест на аллергены и остаточный белок (для пищевой промышленности и медицины).
AllerFlow Gluten – тест на остаточный глютен
Индикаторные тесты
InSite Listeria — тест для определения бактерии листерий
InSite Salmonella — тест для определения бактерий сальмонелла
InSite™ L. mono Glo — это скрининг-тест на Listeria spp. и Listeria monocytogenes (L. mono)
Сферы применения
Пищевое производство Медицина Нефтехимическая промышленность Сельское хозяйство HoReCa
В современном мире гигиена занимает важное место в повседневной жизни. Пренебрежение соблюдением санитарных норм может иметь негативные последствия, как для здоровья человека, так и оборачиваться экономическими потерями в различных сферах бизнеса. Своевременное понимание санитарной ситуации и позволяет предупредить эти последствия. АТФ-люминометрия является удобным, быстрым и надежным методом оценки качества санитарных мероприятий в любых областях применения.
Своевременное понимание санитарной ситуации и позволяет предупредить эти последствия. АТФ-люминометрия является удобным, быстрым и надежным методом оценки качества санитарных мероприятий в любых областях применения.
Обратитесь в компанию «ИнтерКлин»
для получения профессиональной
консультации!
Пищевое производство
Риски появления недопустимых микроорганизмов в пищевой продукции существуют постоянно.
Современным решением по снижению рисков микробной кон- таминации является метод АТФ-люминометрии. Он включает в себя ряд мер по устранению опасных рисков на производстве пищевых продуктов, способствуя повышению их качества и безопасности.
Данный метод распространяется на молочную, мясоперерабатывающую промышленность и индустрию напитков.
Обратитесь в компанию «ИнтерКлин»
для получения профессиональной
консультации!
Подробнее
Подробнее
Подробнее
Подробнее
Подробнее
Медицина
Риски появления недопустимых микроорганизмов в медицинских учреждениях существуют постоянно.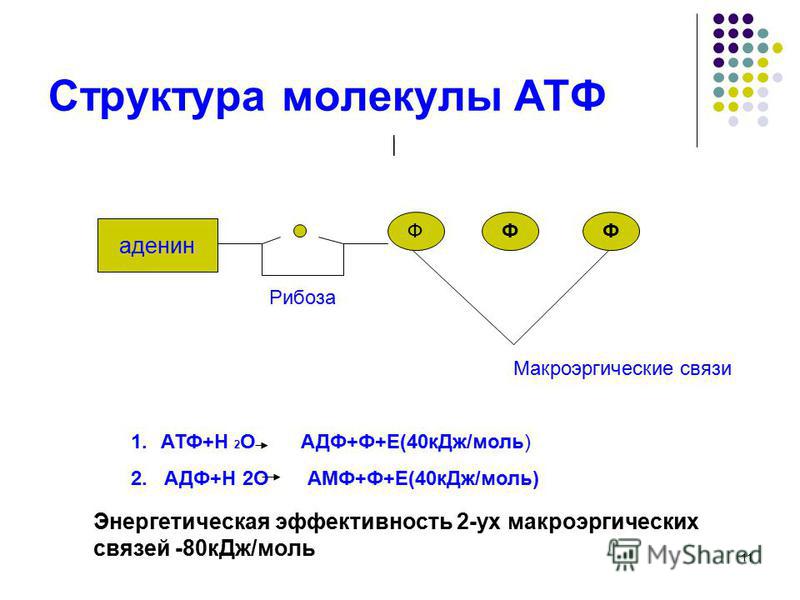
Современным решением по снижению рисков микробной контаминации является метод АТФ-люминометрии. Он включает в себя ряд мер по устранению опасных рисков на производстве пищевых продуктов, способствуя повышению их качества и безопасности.
Обратитесь в компанию «ИнтерКлин»
для получения профессиональной
консультации!
Подробнее
Подробнее
Подробнее
Нефтехимическая промышленность
Особое внимание санитарии и гигиене следует уделять в области Нефтяной промышленности. Контроль гигиены позволяет снизить риски для здоровья персонала, что особенно важно в условиях высоких нагрузок. Использование АТФ-люминометрии значительно упрощает соблюдение санитарных норм. В компании «ИнтерКлин» вам подберут подходящее решение, как только вы обратитесь.
Обратитесь в компанию «ИнтерКлин»
для получения профессиональной
консультации!
Подробнее
Подробнее
Сельское хозяйство
Соблюдение гигиены в сельском хозяйстве позволяет добиваться высоких показателей по выпуску качественных и безопасных продуктов. Но отсутствие должного и оперативного контроля приводит к накоплению критических проблемных точек на предприятиях сельской отрасли. Современное и недорогое решение контроля чистоты в сельском хозяйстве — АТФ-люминометрия.
Но отсутствие должного и оперативного контроля приводит к накоплению критических проблемных точек на предприятиях сельской отрасли. Современное и недорогое решение контроля чистоты в сельском хозяйстве — АТФ-люминометрия.
Обратитесь в компанию «ИнтерКлин»
для получения профессиональной
консультации!
Подробнее
Подробнее
Подробнее
Подробнее
Гостинично-ресторанный бизнес
В современном мире люди питаются на ходу, на улице, в транспорте и тем самым рискуют съесть небезопасную еду.
Другое дело — рестораны и кафе. Сюда приходят отдохнуть и расслабиться. Крайне важно, чтобы посетители были уверены в безопасности блюд. Отличным решением данной задачи является применение АТФ-люминометров.
Обеспечьте вашему заведению безупречную репутацию.
Обратитесь в компанию «ИнтерКлин» и получите готовое решение по биобезопасности!
Обратитесь в компанию «ИнтерКлин»
для получения профессиональной
консультации!
Подробнее
Подробнее
Подробнее
Пресса о нас
Статьи Видео Отзывы
Контакты
108817 г.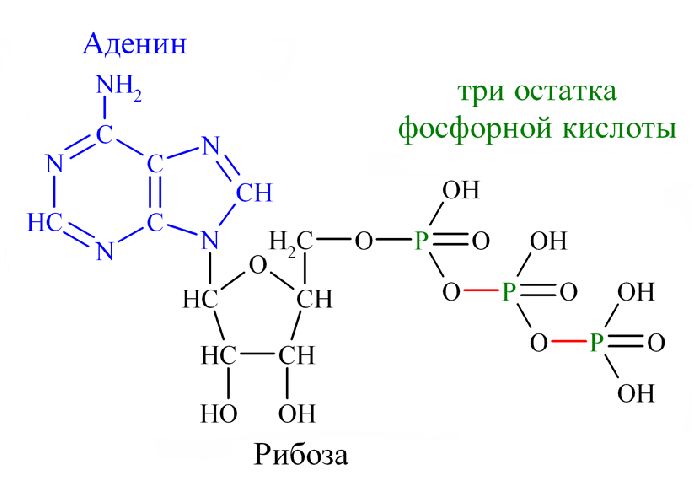
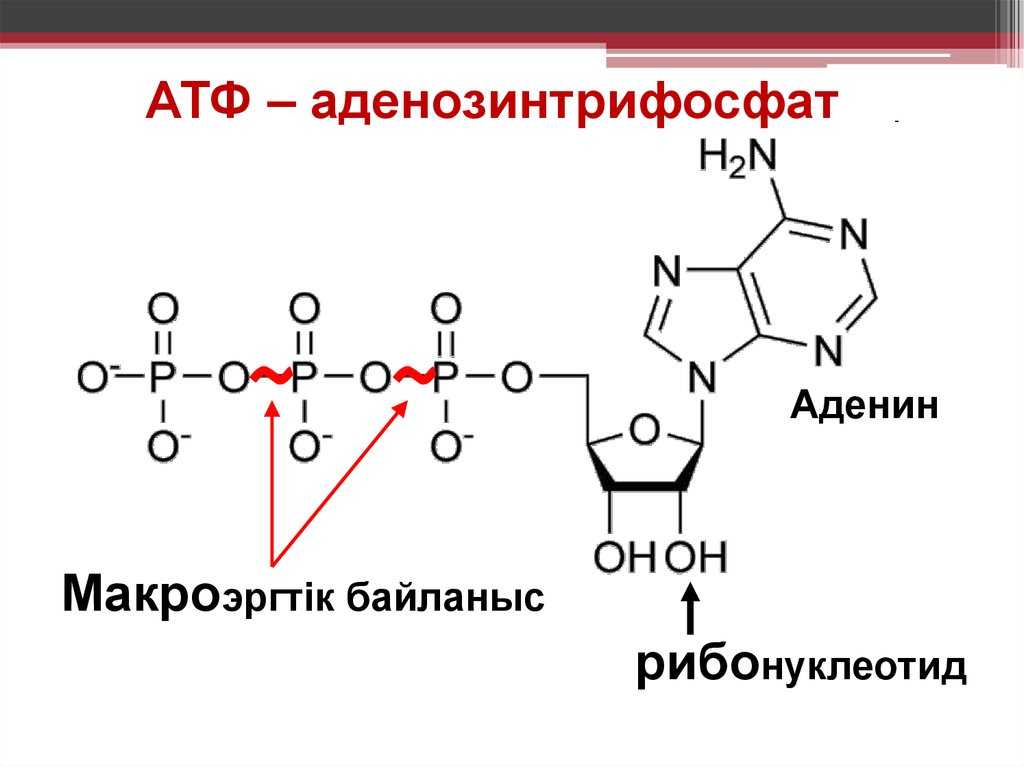
Физиология, Аденозинтрифосфат — StatPearls
Введение
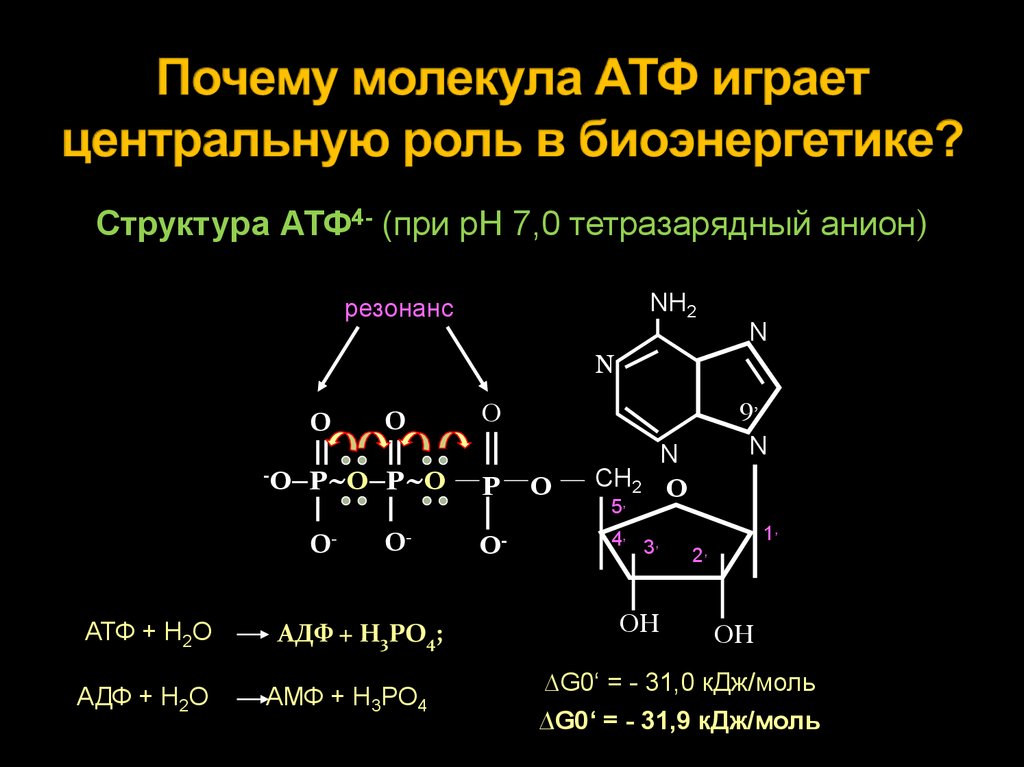
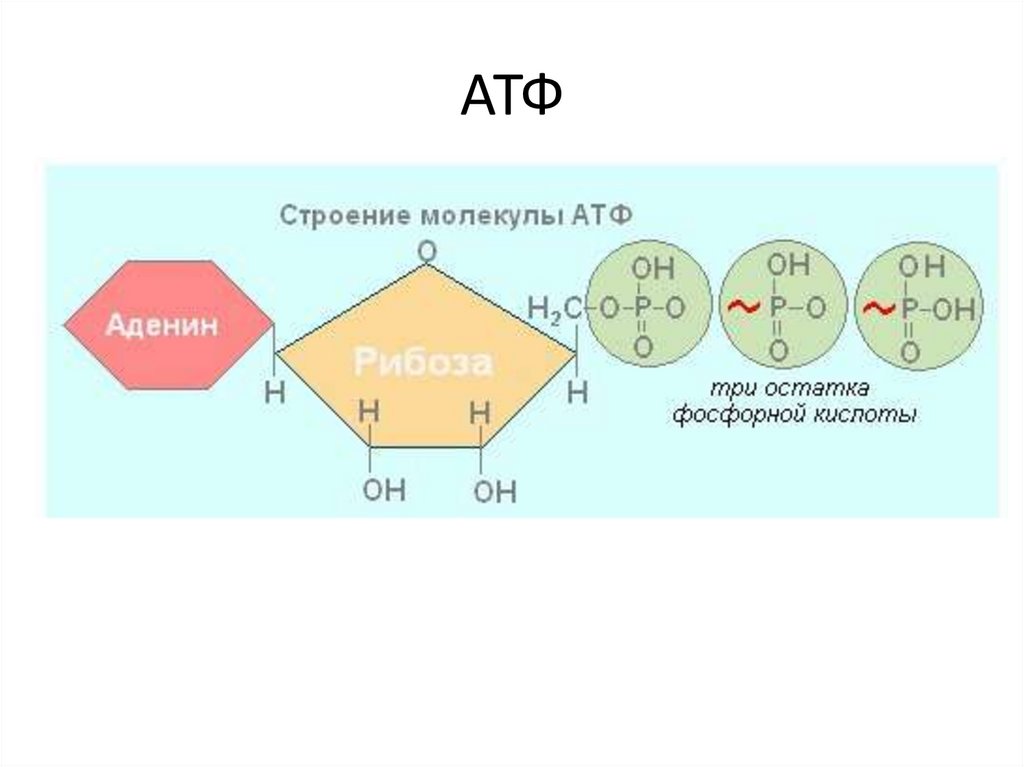
Тело представляет собой сложный организм, и поэтому ему требуется энергия для поддержания нормального функционирования. Аденозинтрифосфат (АТФ) является источником энергии для использования и хранения на клеточном уровне. Структура АТФ представляет собой нуклеозидтрифосфат, состоящий из азотистого основания (аденина), сахара рибозы и трех последовательно связанных фосфатных групп. АТФ обычно называют «энергетической валютой» клетки, поскольку он обеспечивает легко высвобождаемую энергию в связи между второй и третьей фосфатными группами. Помимо обеспечения энергией, расщепление АТФ посредством гидролиза выполняет широкий спектр клеточных функций, включая передачу сигналов и синтез ДНК/РНК. Синтез АТФ использует энергию, полученную от нескольких катаболических механизмов, включая клеточное дыхание, бета-окисление и кетоз.
Большая часть синтеза АТФ происходит при клеточном дыхании в митохондриальном матриксе: образуется примерно тридцать две молекулы АТФ на молекулу окисляемой глюкозы.
Сотовый уровень
АТФ является отличным накопителем энергии для использования в качестве «валюты» благодаря фосфатным группам, которые соединяются посредством фосфодиэфирных связей. Эти связи имеют высокую энергию из-за связанных с ними электроотрицательных зарядов, создающих силу отталкивания между фосфатными группами. Значительное количество энергии остается запасенным в фосфатно-фосфатных связях. В ходе метаболических процессов АТФ гидролизуется до АДФ или далее до АМФ и свободных неорганических фосфатных групп.
И наоборот, АДФ и АМФ могут активировать PFK1 и пируваткиназу, способствуя синтезу АТФ в периоды высокой потребности в энергии. Другие системы регулируют АТФ, например, в регуляторных механизмах, участвующих в регуляции синтеза АТФ в сердце. Новые эксперименты показали, что десятисекундные всплески, называемые митохондриальными вспышками, могут нарушить выработку АТФ в сердце. Во время этих митохондриальных вспышек митохондрии выделяют активные формы кислорода и эффективно приостанавливают синтез АТФ. Ингибирование продукции АТФ происходит во время митохондриальных вспышек. Во время низкой потребности в энергии, когда клетки сердечной мышцы получали достаточно строительных блоков, необходимых для производства АТФ, митохондриальные вспышки наблюдались чаще. С другой стороны, когда потребность в энергии высока во время быстрого сердечного сокращения, митохондриальные вспышки происходили реже. Эти результаты показали, что в периоды, когда необходимы значительные количества АТФ, митохондриальные вспышки происходят реже, чтобы обеспечить продолжение производства АТФ. И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и ингибировали выработку АТФ.[3]
Во время этих митохондриальных вспышек митохондрии выделяют активные формы кислорода и эффективно приостанавливают синтез АТФ. Ингибирование продукции АТФ происходит во время митохондриальных вспышек. Во время низкой потребности в энергии, когда клетки сердечной мышцы получали достаточно строительных блоков, необходимых для производства АТФ, митохондриальные вспышки наблюдались чаще. С другой стороны, когда потребность в энергии высока во время быстрого сердечного сокращения, митохондриальные вспышки происходили реже. Эти результаты показали, что в периоды, когда необходимы значительные количества АТФ, митохондриальные вспышки происходят реже, чтобы обеспечить продолжение производства АТФ. И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и ингибировали выработку АТФ.[3]
Функция
Гидролиз АТФ обеспечивает энергию, необходимую для многих важных процессов в организмах и клетках. К ним относятся внутриклеточная передача сигналов, синтез ДНК и РНК, пуринергическая передача сигналов, синаптическая передача сигналов, активный транспорт и сокращение мышц. Эти темы не являются исчерпывающим списком, но включают в себя некоторые жизненно важные роли, которые выполняет ATP.
Эти темы не являются исчерпывающим списком, но включают в себя некоторые жизненно важные роли, которые выполняет ATP.
АТФ во внутриклеточной передаче сигналов
Передача сигнала в значительной степени зависит от АТФ. АТФ может служить субстратом для киназ, самого многочисленного АТФ-связывающего белка. Когда киназа фосфорилирует белок, может активироваться сигнальный каскад, что приводит к модуляции различных внутриклеточных сигнальных путей.[4] Активность киназы жизненно важна для клетки и, следовательно, должна жестко регулироваться. Присутствие иона магния помогает регулировать активность киназы.[5] Регуляция осуществляется через ионы магния, находящиеся в клетке в виде комплекса с АТФ, связанного на фосфатно-кислородных центрах. В дополнение к киназной активности АТФ может функционировать как повсеместный триггер высвобождения внутриклеточного мессенджера.[6] Эти мессенджеры включают гормоны, различные ферменты, липидные медиаторы, нейротрансмиттеры, оксид азота, факторы роста и активные формы кислорода.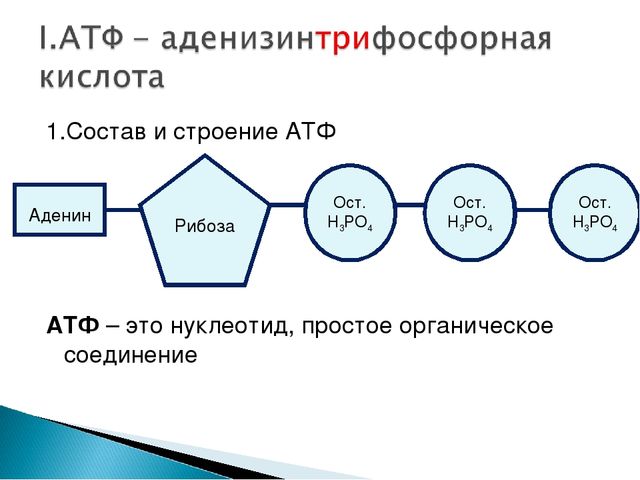 [6] Пример использования АТФ во внутриклеточной передаче сигналов можно наблюдать в АТФ, выступающем в качестве субстрата для аденилатциклазы. Этот процесс в основном происходит в сигнальных путях рецепторов, связанных с G-белком. При связывании с аденилатциклазой АТФ превращается в циклический АМФ, который способствует высвобождению кальция из внутриклеточных запасов.[7] У цАМФ есть и другие роли, в том числе вторичные мессенджеры в сигнальных каскадах гормонов, активация протеинкиназ и регуляция функции ионных каналов.
[6] Пример использования АТФ во внутриклеточной передаче сигналов можно наблюдать в АТФ, выступающем в качестве субстрата для аденилатциклазы. Этот процесс в основном происходит в сигнальных путях рецепторов, связанных с G-белком. При связывании с аденилатциклазой АТФ превращается в циклический АМФ, который способствует высвобождению кальция из внутриклеточных запасов.[7] У цАМФ есть и другие роли, в том числе вторичные мессенджеры в сигнальных каскадах гормонов, активация протеинкиназ и регуляция функции ионных каналов.
Синтез ДНК/РНК
Для синтеза ДНК и РНК требуется АТФ. АТФ является одним из четырех нуклеотид-трифосфатных мономеров, необходимых при синтезе РНК. Синтез ДНК использует аналогичный механизм, за исключением того, что при синтезе ДНК АТФ сначала трансформируется путем удаления атома кислорода из сахара с образованием дезоксирибонуклеотида, дАТФ.
Пуринергическая сигнализация
Пуринергическая передача сигналов представляет собой форму внеклеточной паракринной передачи сигналов, которая опосредована пуриновыми нуклеотидами, включая АТФ. Этот процесс обычно влечет за собой активацию пуринергических рецепторов на соседних клетках, тем самым передавая сигналы для регуляции внутриклеточных процессов. АТФ высвобождается из везикулярных запасов и регулируется IP3 и другими распространенными экзоцитотическими регуляторными механизмами. АТФ хранится и высвобождается вместе с нейротрансмиттерами, что еще раз подтверждает представление о том, что АТФ является необходимым медиатором пуринергической нейротрансмиссии как в симпатических, так и в парасимпатических нервах. АТФ может индуцировать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействие нервной глии, боль и контроль тонуса сосудов [9].][10][11][12]
Этот процесс обычно влечет за собой активацию пуринергических рецепторов на соседних клетках, тем самым передавая сигналы для регуляции внутриклеточных процессов. АТФ высвобождается из везикулярных запасов и регулируется IP3 и другими распространенными экзоцитотическими регуляторными механизмами. АТФ хранится и высвобождается вместе с нейротрансмиттерами, что еще раз подтверждает представление о том, что АТФ является необходимым медиатором пуринергической нейротрансмиссии как в симпатических, так и в парасимпатических нервах. АТФ может индуцировать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействие нервной глии, боль и контроль тонуса сосудов [9].][10][11][12]
Нейротрансмиссия
Мозг является самым большим потребителем АТФ в организме, потребляя примерно двадцать пять процентов всей доступной энергии.[13] Большое количество энергии тратится на поддержание концентрации ионов для правильной передачи сигналов нейронами и синаптической передачи.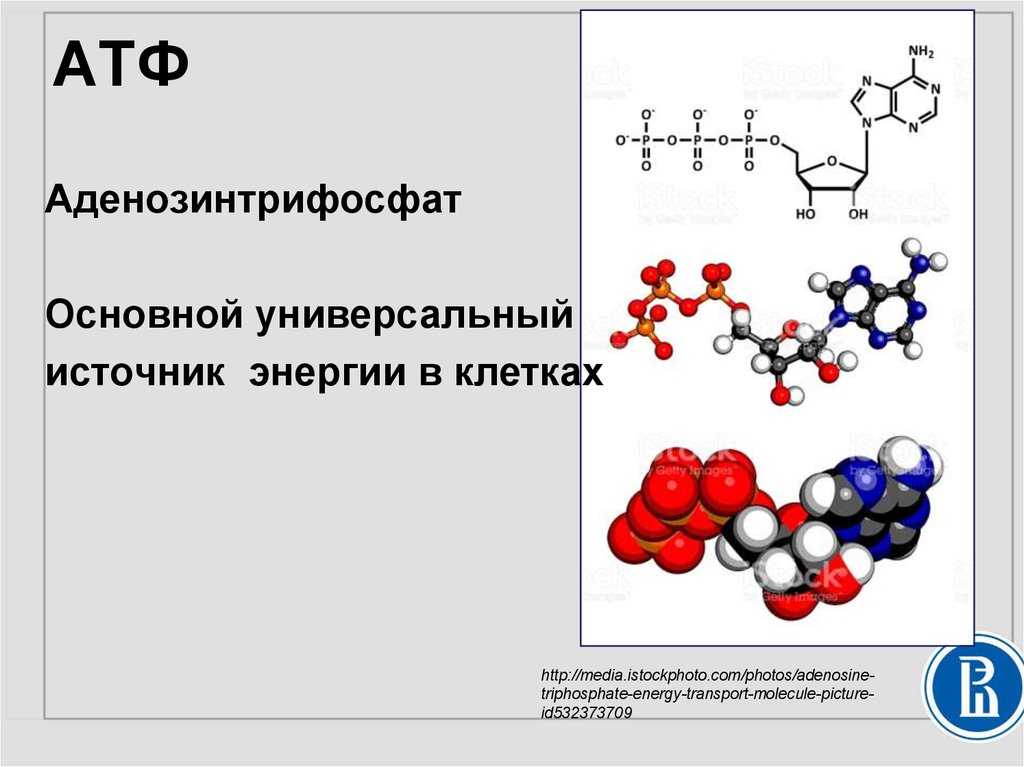 [14] Синаптическая передача является энергоемким процессом. В пресинаптических окончаниях АТФ требуется для установления ионного градиента, который перемещает нейротрансмиттеры в везикулы, и для подготовки везикул к высвобождению посредством экзоцитоза. [14] Передача сигналов нейронами зависит от потенциала действия, достигающего пресинаптических окончаний, сигнализируя о высвобождении загруженных везикул. Этот процесс зависит от того, что АТФ восстанавливает концентрацию ионов в аксоне после каждого потенциала действия, позволяя возникать другому сигналу. Активный транспорт отвечает за сброс концентраций ионов натрия и калия до исходных значений после возникновения потенциала действия через Na/K-АТФазу. В ходе этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки и два иона калия транспортируются обратно в клетку, причем оба иона движутся против градиента их концентрации.
[14] Синаптическая передача является энергоемким процессом. В пресинаптических окончаниях АТФ требуется для установления ионного градиента, который перемещает нейротрансмиттеры в везикулы, и для подготовки везикул к высвобождению посредством экзоцитоза. [14] Передача сигналов нейронами зависит от потенциала действия, достигающего пресинаптических окончаний, сигнализируя о высвобождении загруженных везикул. Этот процесс зависит от того, что АТФ восстанавливает концентрацию ионов в аксоне после каждого потенциала действия, позволяя возникать другому сигналу. Активный транспорт отвечает за сброс концентраций ионов натрия и калия до исходных значений после возникновения потенциала действия через Na/K-АТФазу. В ходе этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки и два иона калия транспортируются обратно в клетку, причем оба иона движутся против градиента их концентрации.
Потенциалы действия, проходящие по аксону, инициируют везикулярное высвобождение при достижении пресинаптического окончания.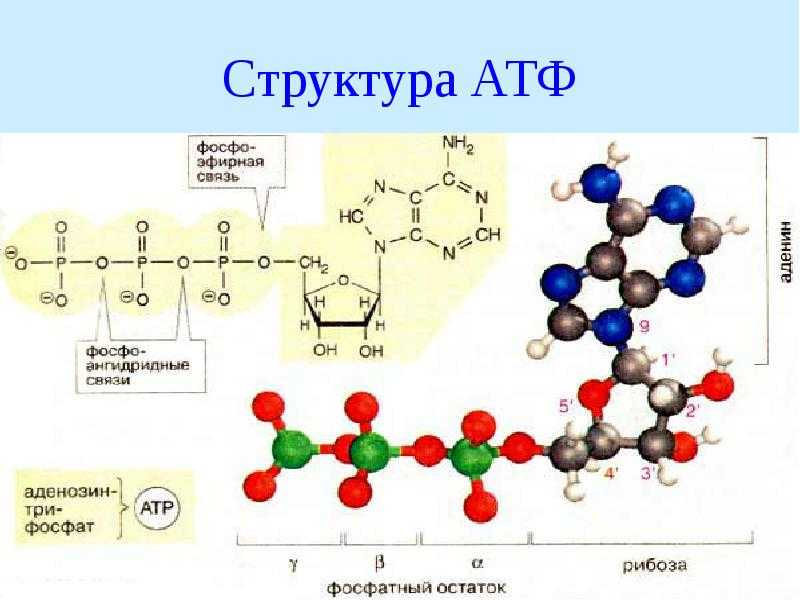 После установления ионного градиента потенциалы действия затем распространяются вниз по аксону посредством деполяризации аксона, посылая сигнал к окончанию. Приблизительно один миллиард ионов натрия необходим для распространения одного потенциала действия. Нейронам потребуется гидролизовать около миллиарда молекул АТФ, чтобы восстановить концентрацию ионов натрия/калия после каждой клеточной деполяризации.[13]Возбуждающие синапсы в значительной степени преобладают в сером веществе мозга. Везикулы, содержащие глутамат, высвобождаются в синаптическую щель, чтобы активировать постсинаптические возбуждающие глутаминергические рецепторы. Для загрузки этих молекул требуется большое количество АТФ из-за почти четырех тысяч молекул глутамата, хранящихся в одном пузырьке. Значительные запасы энергии необходимы, чтобы инициировать высвобождение везикул, управлять глутаматергическими постсинаптическими процессами и перерабатывать везикулы, а также оставшийся глутамат. Следовательно, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам.
После установления ионного градиента потенциалы действия затем распространяются вниз по аксону посредством деполяризации аксона, посылая сигнал к окончанию. Приблизительно один миллиард ионов натрия необходим для распространения одного потенциала действия. Нейронам потребуется гидролизовать около миллиарда молекул АТФ, чтобы восстановить концентрацию ионов натрия/калия после каждой клеточной деполяризации.[13]Возбуждающие синапсы в значительной степени преобладают в сером веществе мозга. Везикулы, содержащие глутамат, высвобождаются в синаптическую щель, чтобы активировать постсинаптические возбуждающие глутаминергические рецепторы. Для загрузки этих молекул требуется большое количество АТФ из-за почти четырех тысяч молекул глутамата, хранящихся в одном пузырьке. Значительные запасы энергии необходимы, чтобы инициировать высвобождение везикул, управлять глутаматергическими постсинаптическими процессами и перерабатывать везикулы, а также оставшийся глутамат. Следовательно, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам.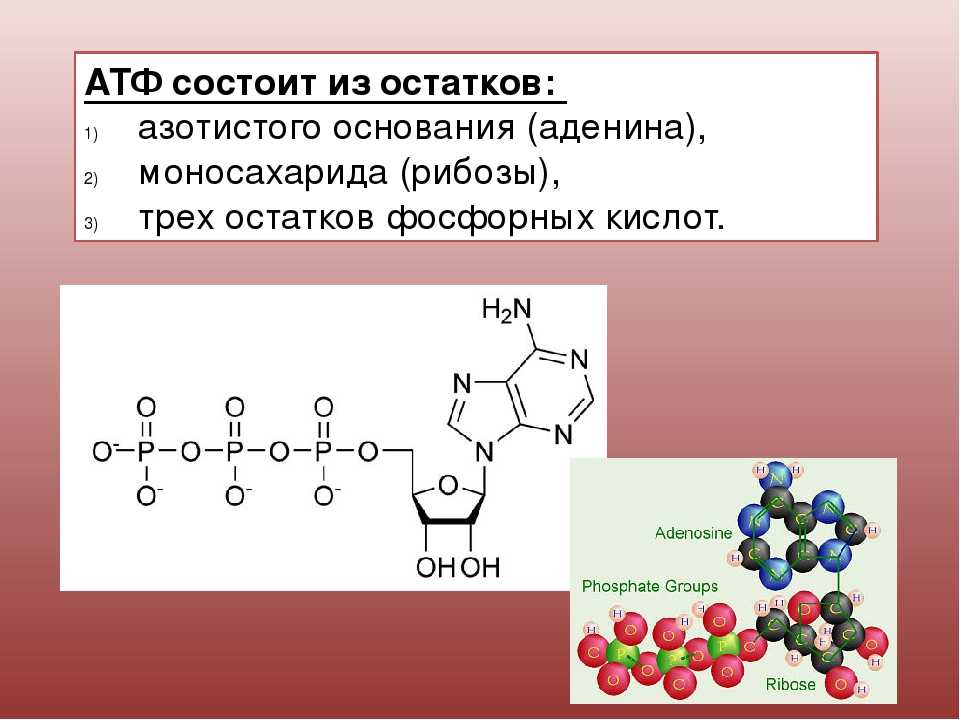
АТФ в сокращении мышц
Сокращение мышц является необходимой функцией повседневной жизни и не может происходить без АТФ. Есть три основные роли, которые АТФ выполняет в действии мышечного сокращения. Во-первых, за счет генерации силы, воздействующей на соседние актиновые филаменты, за счет циклирования миозиновых поперечных мостиков. Во-вторых, это перекачка ионов кальция из миоплазмы через саркоплазматический ретикулум против градиента их концентрации с использованием активного транспорта. Третьей функцией, которую выполняет АТФ, является активный транспорт ионов натрия и калия через сарколемму, так что ионы кальция могут высвобождаться при получении входного сигнала. Гидролиз АТФ управляет каждым из этих процессов.[16]
Механизм
Многие процессы способны производить АТФ в организме, в зависимости от текущих метаболических условий. Производство АТФ может происходить в присутствии кислорода в результате клеточного дыхания, бета-окисления, кетоза, катаболизма липидов и белков, а также в анаэробных условиях.
Клеточное дыхание
Клеточное дыхание — это процесс катаболизма глюкозы в ацетил-КоА с образованием высокоэнергетических переносчиков электронов, которые будут окисляться во время окислительного фосфорилирования с образованием АТФ. Во время гликолиза, первой стадии клеточного дыхания, одна молекула глюкозы расщепляется на две молекулы пирувата. Во время этого процесса два АТФ продуцируются путем фосфорилирования субстрата ферментами PFK1 и пируваткиназой. Также происходит образование двух восстановленных молекул переносчика электронов NADH. Затем молекулы пирувата окисляются пируватдегидрогеназным комплексом с образованием молекулы ацетил-КоА. Затем молекула ацетил-КоА полностью окисляется с образованием диоксида углерода и восстановленных переносчиков электронов в цикле лимонной кислоты. По завершении цикла лимонной кислоты общий выход составляет две молекулы диоксида углерода, один эквивалент АТФ, три молекулы НАДН и одна молекула ФАДч3. Эти высокоэнергетические переносчики электронов затем переносят электроны в цепь переноса электронов, в которой ионы водорода (протоны) переносятся против их градиента во внутреннее пространство мембраны из митохондриального матрикса.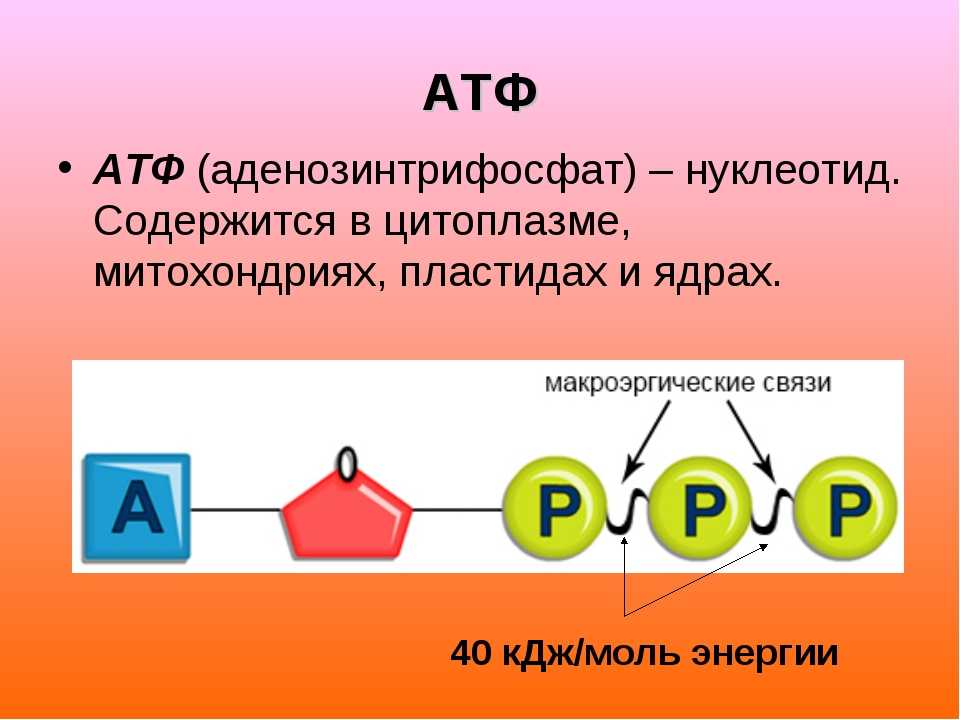 Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы.] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель пожертвовал протоны. Одна молекула NADH производит две с половиной молекулы АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы.] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель пожертвовал протоны. Одна молекула NADH производит две с половиной молекулы АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Бета-окисление
Бета-окисление — еще один механизм синтеза АТФ в организмах. Во время бета-окисления цепи жирных кислот постоянно укорачиваются, образуя молекулы ацетил-КоА. На протяжении каждого цикла бета-окисления жирная кислота восстанавливается на две длины углерода, образуя одну молекулу ацетил-КоА, которая может быть окислена в цикле лимонной кислоты, и по одной молекуле НАДН и ФАДч3, которые передают свою высокую энергию электрон в транспортную цепь.[18]
Кетоз
Кетоз – это реакция образования АТФ в результате катаболизма кетоновых тел. Во время кетоза кетоновые тела подвергаются катаболизму для производства энергии, образуя двадцать две молекулы АТФ и две молекулы ГТФ на молекулу ацетоацетата, которая окисляется в митохондриях.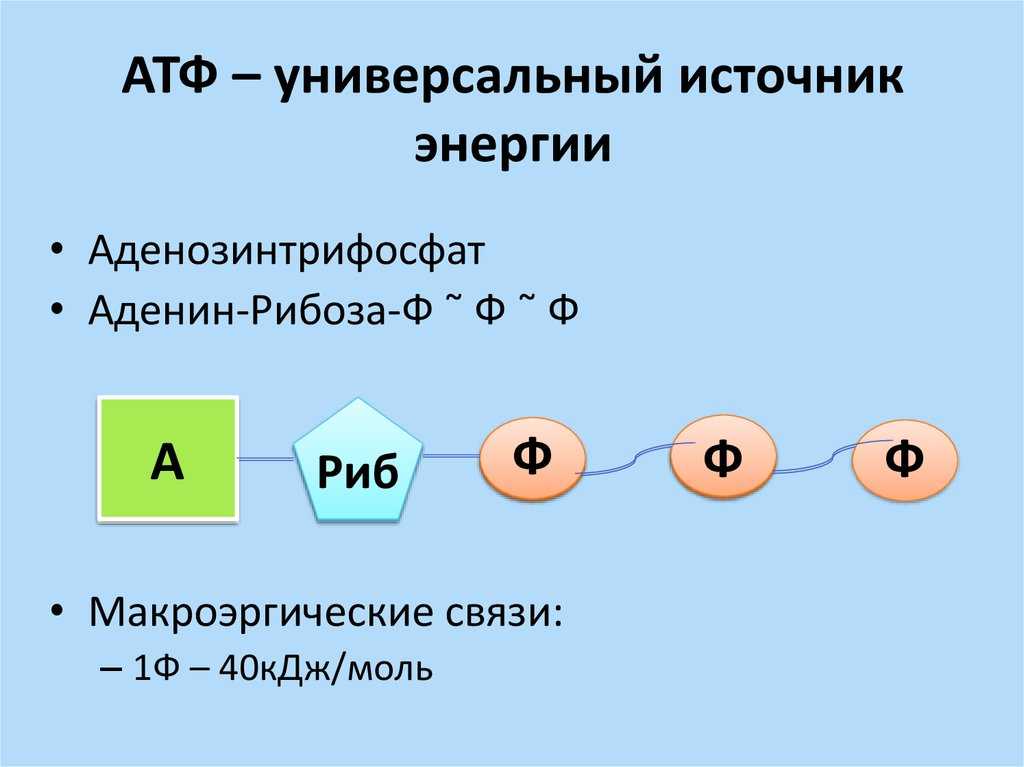
Анаэробное дыхание
Когда кислорода мало или он недоступен во время клеточного дыхания, клетки могут подвергаться анаэробному дыханию. В анаэробных условиях происходит накопление молекул НАДН из-за неспособности окислять НАДН до НАД+, что ограничивает действие ГАФД и потребление глюкозы. Для поддержания гомеостатического уровня НАДН пируват восстанавливается до лактата, что приводит к окислению одной молекулы НАДН в процессе, известном как молочнокислое брожение. При молочнокислом брожении две молекулы НАДН, образующиеся в результате гликолиза, окисляются для поддержания резервуара НАД+. Эта реакция дает только две молекулы АТФ на молекулу глюкозы.
Связанное тестирование
Многие методы позволяют рассчитать внутриклеточный уровень АТФ. Общепринятый протокол включает использование люциферазы светлячка, фермента, который вызывает окисление люциферина.[19] Эта реакция поддается количественному измерению из-за выхода энергии этой реакции, высвобождающей фотон света, известного как биолюминесценция, которая поддается количественному измерению.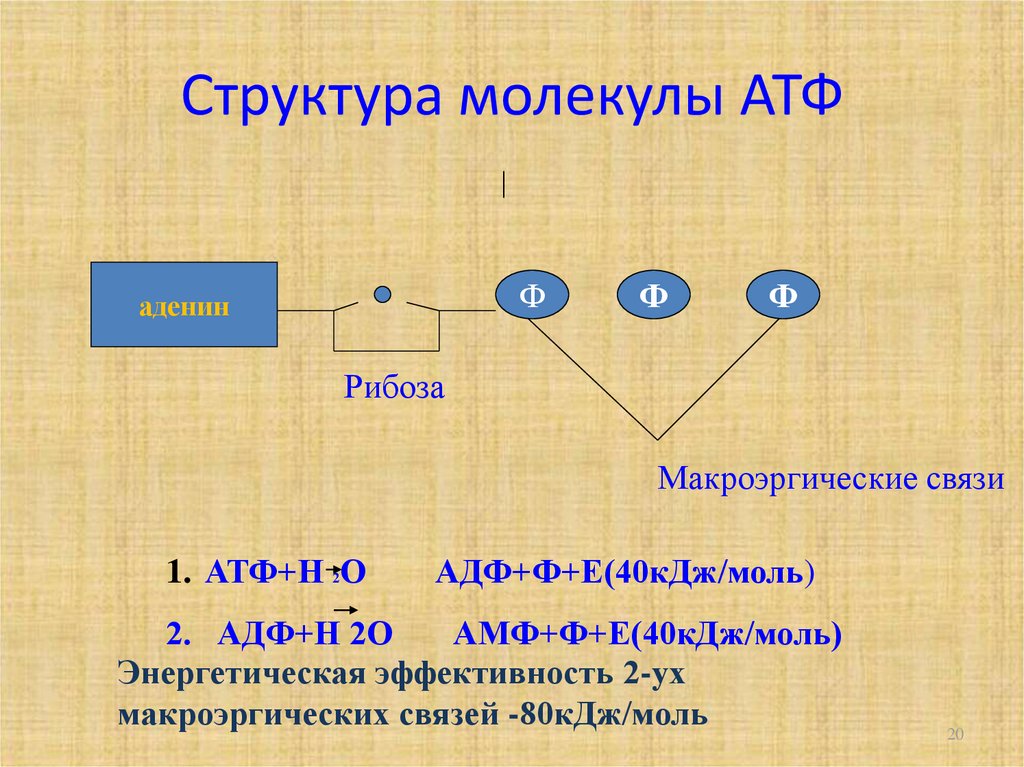
Клиническое значение
Роль АТФ в контроле боли
ATP демонстрирует уменьшение острой периоперационной боли в клинических исследованиях.[20] В этих исследованиях пациенты получали АТФ внутривенно. Внутривенная инфузия аденозина действует на аденозиновый рецептор A1, инициируя сигнальный каскад, который в конечном итоге способствует обезболивающему эффекту, наблюдаемому при воспалении. Исследования показали, что соединения аденозина уменьшают аллодинию и гипералгезию при введении в умеренных дозах.[20] Активация аденозинового рецептора A1 оказывает эффективное обезболивающее действие благодаря медленному началу и длительному действию, которое в некоторых случаях может продолжаться в течение нескольких недель.
Анестезия
Добавление АТФ дало положительные результаты во время анестезии. Имеющиеся данные показывают, что низкие дозы аденозина уменьшают невропатическую боль, ишемическую боль и гипералгезию до уровня, сравнимого с морфином. [21] Аденозин также снижал послеоперационное использование опиоидов, что свидетельствует о потенциальной длительной активации аденозиновых рецепторов А1.
[21] Аденозин также снижал послеоперационное использование опиоидов, что свидетельствует о потенциальной длительной активации аденозиновых рецепторов А1.
Кардиология и хирургия
Было показано, что АТФ является безопасным и практичным легочным сосудорасширяющим средством у пациентов с легочной гипертензией.[21] Точно так же аденозин и АТФ можно использовать во время операции, чтобы вызвать гипотензию у пациентов.[21]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Литература
- 1.
Meurer F, Do HT, Sadowski G, Held C. Стандартная энергия Гиббса метаболических реакций: II. Глюкозо-6-фосфатазная реакция и гидролиз АТФ. Биофиз хим. 2017 Апр; 223:30-38. [PubMed: 28282626]
- 2.
Beis I, Newsholme EA. Содержание адениновых нуклеотидов, фосфагенов и некоторых гликолитических интермедиатов в покоящихся мышцах позвоночных и беспозвоночных.
 Биохим Дж. 1975 октября; 152(1):23-32. [Бесплатная статья PMC: PMC1172435] [PubMed: 1212224]
Биохим Дж. 1975 октября; 152(1):23-32. [Бесплатная статья PMC: PMC1172435] [PubMed: 1212224]- 3.
Wang X, Zhang X, Wu D, Huang Z, Hou T, Jian C, Yu P, Lu F, Zhang R, Sun T, Li J, Qi W, Wang Y, Gao F, Cheng H. Митохондриальные вспышки регулируют гомеостаз АТФ в сердце. Элиф. 2017 Jul 10;6 [PMC бесплатная статья: PMC5503511] [PubMed: 28692422]
- 4.
Mishra NS, Tuteja R, Tuteja N. Передача сигналов через сети киназ MAP в растениях. Арх Биохим Биофиз. 2006 01 августа; 452 (1): 55-68. [В паблике: 16806044]
- 5.
Лин Х, Айрапетов М.К., Сун Г. Характеристика взаимодействий между активным центром протеинтирозинкиназы и активатором двухвалентного металла. БМС Биохим. 2005 23 ноября; 6:25. [Статья бесплатно PMC: PMC1316873] [PubMed: 16305747]
- 6.
Zimmermann H. Внеклеточный АТФ и другие нуклеотиды-повсеместные триггеры высвобождения межклеточного мессенджера. Пуринергический сигнал. 2016 март; 12(1):25-57.
 [Бесплатная статья PMC: PMC4749530] [PubMed: 26545760]
[Бесплатная статья PMC: PMC4749530] [PubMed: 26545760]- 7.
Каменецкий М., Миддельхауфе С., Банк Э.М., Левин Л.Р., Бак Дж., Стигборн С. Молекулярные детали образования цАМФ в клетках млекопитающих: рассказ о двух системах. Дж Мол Биол. 2006 г., 29 сентября; 362(4):623-39. [Бесплатная статья PMC: PMC3662476] [PubMed: 16934836]
- 8.
Джойс CM, Steitz TA. Структуры и функции полимеразы: вариации на тему? J Бактериол. 1995 ноябрь; 177 (22): 6321-9. [Бесплатная статья PMC: PMC177480] [PubMed: 7592405]
- 9.
Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A, Giorgi C, Marchi S, Missiroli S, Poletti F, Wieckowski MR, Pinton P. Синтез и хранение АТФ. Пуринергический сигнал. 2012 Сентябрь;8(3):343-57. [Бесплатная статья PMC: PMC3360099] [PubMed: 22528680]
- 10.
Карденас С., Миллер Р.А., Смит И., Буй Т., Молго Дж., Мюллер М., Вайс Х., Чунг К.Х., Ян Дж., Паркер И., Томпсон С.
 Б., Бирнбаум М.Дж., Халлоус К.Р., Фоскетт Дж.К. Существенная регуляция биоэнергетики клетки путем конститутивного переноса Ca2+ рецептора InsP3 в митохондрии. Клетка. 2010 23 июля; 142 (2): 270-83. [Бесплатная статья PMC: PMC2911450] [PubMed: 20655468]
Б., Бирнбаум М.Дж., Халлоус К.Р., Фоскетт Дж.К. Существенная регуляция биоэнергетики клетки путем конститутивного переноса Ca2+ рецептора InsP3 в митохондрии. Клетка. 2010 23 июля; 142 (2): 270-83. [Бесплатная статья PMC: PMC2911450] [PubMed: 20655468]- 11.
Пабло Хуидобро-Торо Дж., Вероника Доносо М. Симпатическая котрансмиссия: скоординированное действие АТФ и норадреналина и их модуляция нейропептидом Y в сосудистых нейроэффекторных соединениях человека. Евр Дж Фармакол. 2004 01 октября; 500 (1-3): 27-35. [PubMed: 15464018]
- 12.
Coco S, Calegari F, Pravettoni E, Pozzi D, Taverna E, Rosa P, Matteoli M, Verderio C. Хранение и высвобождение АТФ из астроцитов в культуре. Дж. Биол. Хим. 2003 10 января; 278 (2): 1354-62. [В паблике: 12414798]
- 13.
Аттвелл Д., Лафлин С.Б. Энергетический баланс для передачи сигналов в сером веществе головного мозга. J Cereb Blood Flow Metab. 21 октября 2001 г. (10): 1133-45.
 [PubMed: 11598490]
[PubMed: 11598490]- 14.
Harris JJ, Jolivet R, Attwell D. Использование и поставка синаптической энергии. Нейрон. 06 сентября 2012 г .; 75 (5): 762–777. [PubMed: 22958818]
- 15.
Вонг-Райли MT. Цитохромоксидаза: эндогенный метаболический маркер активности нейронов. Тренды Нейроси. 1989 марта; 12(3):94-101. [PubMed: 2469224]
- 16.
Барклай CJ. Энергетика сокращения. сост. физиол. 2015 Апрель;5(2):961-95. [PubMed: 25880520]
- 17.
Богатый PR. Молекулярный механизм дыхательной цепи Кейлина. Биохим Сок Транс. 2003 г.; 31 декабря (часть 6): 1095–105. [PubMed: 14641005]
- 18.
Ronnett GV, Kim EK, Landree LE, Tu Y. Метаболизм жирных кислот как мишень для лечения ожирения. Физиол Поведение. 2005 19 мая;85(1):25-35. [PubMed: 15878185]
- 19.
Бровко Л.Ю., Романова Н.А., Угарова Н.Н. Биолюминесцентный анализ бактериального внутриклеточного АМФ, АДФ и АТФ с использованием коиммобилизованного трехферментного реагента (аденилаткиназа, пируваткиназа и люцифераза светлячка).
 Анальная биохимия. 1994 01 августа; 220 (2): 410-4. [PubMed: 7978286]
Анальная биохимия. 1994 01 августа; 220 (2): 410-4. [PubMed: 7978286]- 20.
Хаяшида М., Фукуда К., Фукунага А. Клиническое применение аденозина и АТФ для обезболивания. Джей Анест. 2005;19(3): 225-35. [PubMed: 16032451]
- 21.
Agteresch HJ, Dagnelie PC, van den Berg JW, Wilson JH. Аденозинтрифосфат: установившееся и потенциальное клиническое применение. Наркотики. 1999 авг; 58 (2): 211-32. [PubMed: 10473017]
Физиология, Аденозинтрифосфат — StatPearls
Введение
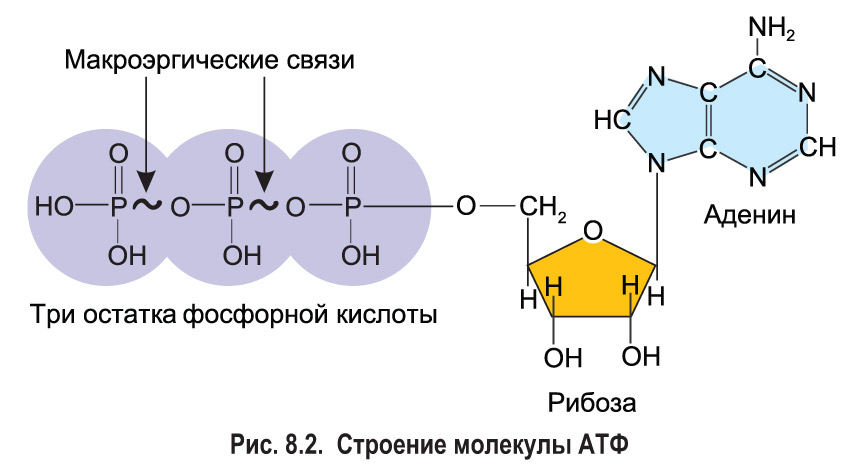
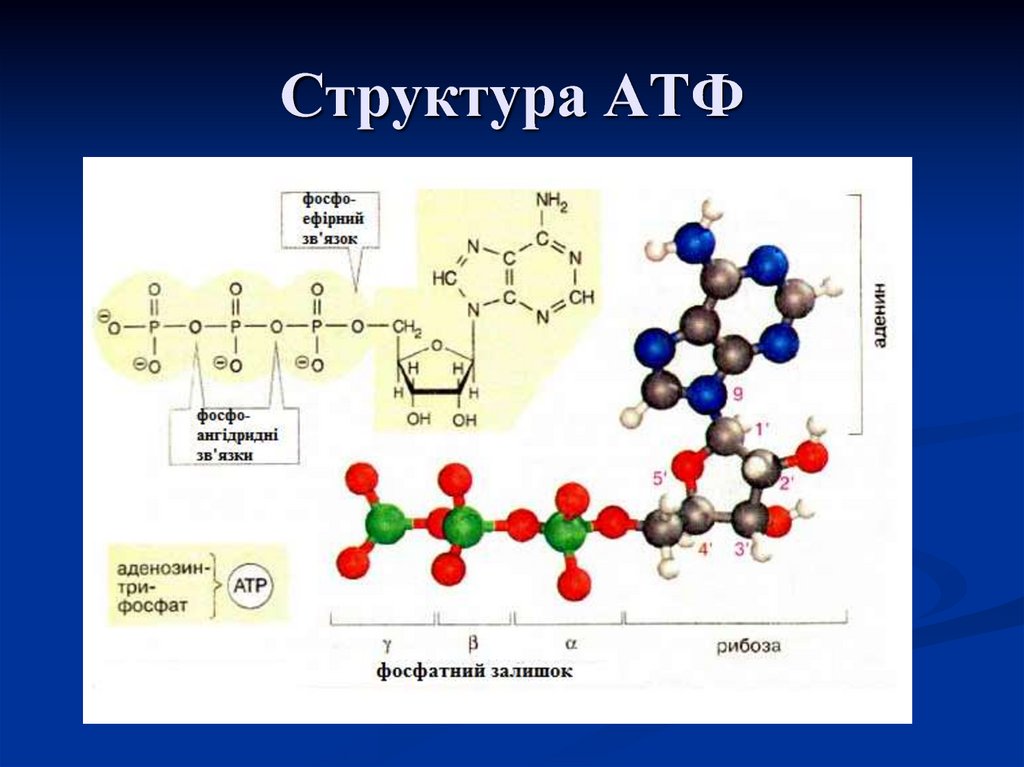
Тело представляет собой сложный организм, и поэтому ему требуется энергия для поддержания нормального функционирования. Аденозинтрифосфат (АТФ) является источником энергии для использования и хранения на клеточном уровне. Структура АТФ представляет собой нуклеозидтрифосфат, состоящий из азотистого основания (аденина), сахара рибозы и трех последовательно связанных фосфатных групп. АТФ обычно называют «энергетической валютой» клетки, поскольку он обеспечивает легко высвобождаемую энергию в связи между второй и третьей фосфатными группами.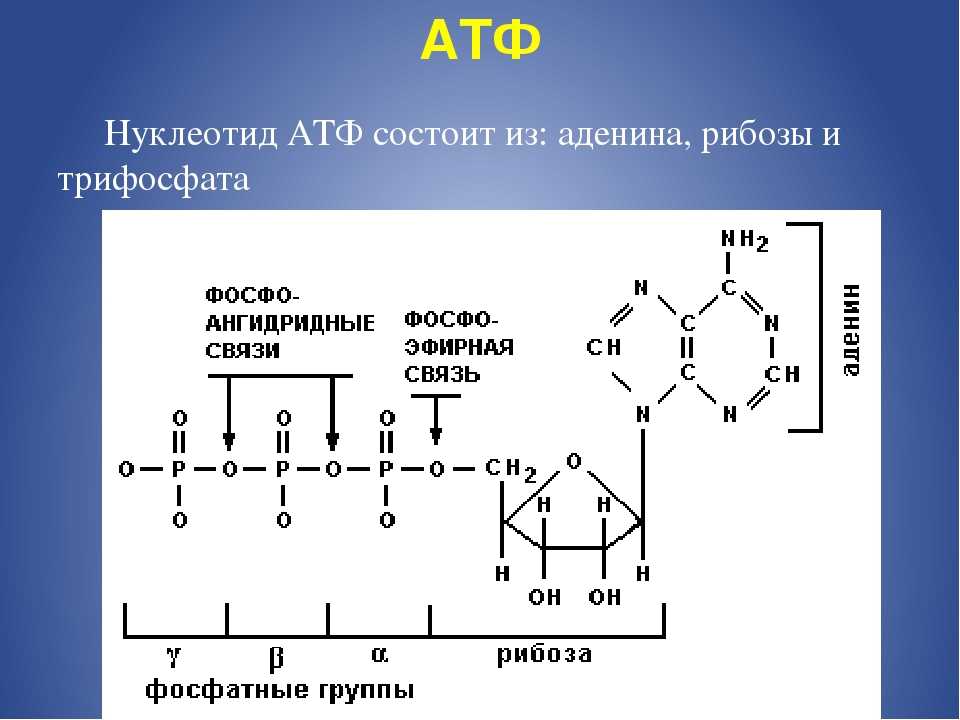 Помимо обеспечения энергией, расщепление АТФ посредством гидролиза выполняет широкий спектр клеточных функций, включая передачу сигналов и синтез ДНК/РНК. Синтез АТФ использует энергию, полученную от нескольких катаболических механизмов, включая клеточное дыхание, бета-окисление и кетоз.
Помимо обеспечения энергией, расщепление АТФ посредством гидролиза выполняет широкий спектр клеточных функций, включая передачу сигналов и синтез ДНК/РНК. Синтез АТФ использует энергию, полученную от нескольких катаболических механизмов, включая клеточное дыхание, бета-окисление и кетоз.
Большая часть синтеза АТФ происходит при клеточном дыхании в митохондриальном матриксе: образуется примерно тридцать две молекулы АТФ на молекулу окисляемой глюкозы. АТФ потребляется для получения энергии в процессах, включая перенос ионов, сокращение мышц, распространение нервных импульсов, фосфорилирование субстрата и химический синтез. Эти процессы, как и другие, создают высокий спрос на АТФ. В результате клетки в организме человека зависят от гидролиза от 100 до 150 моль АТФ в день для обеспечения правильного функционирования. В следующих разделах будет проведена дальнейшая оценка роли АТФ как ключевой молекулы в ежедневном функционировании клетки.
Сотовый уровень
АТФ является отличным накопителем энергии для использования в качестве «валюты» благодаря фосфатным группам, которые соединяются посредством фосфодиэфирных связей.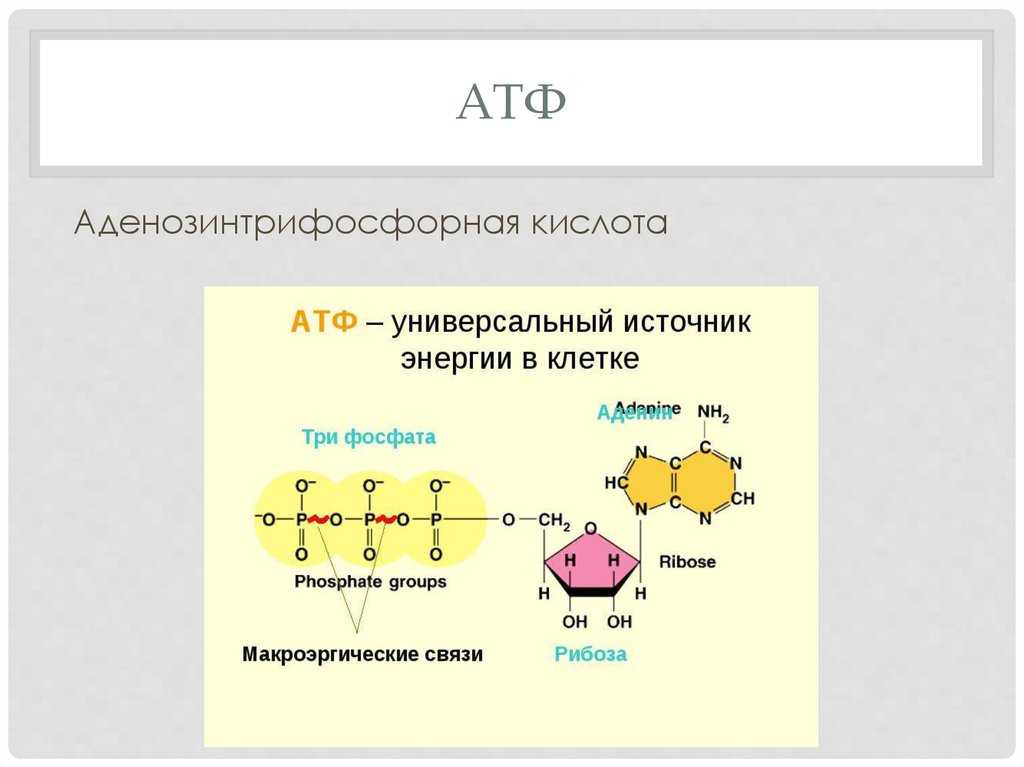 Эти связи имеют высокую энергию из-за связанных с ними электроотрицательных зарядов, создающих силу отталкивания между фосфатными группами. Значительное количество энергии остается запасенным в фосфатно-фосфатных связях. В ходе метаболических процессов АТФ гидролизуется до АДФ или далее до АМФ и свободных неорганических фосфатных групп. Процесс гидролиза АТФ до АДФ энергетически выгоден, давая свободную энергию Гиббса -7,3 кал/моль.[1] АТФ должен постоянно пополняться, чтобы питать постоянно работающую клетку. Обычная внутриклеточная концентрация АТФ составляет от 1 до 10 мкМ.[2] Существует множество механизмов обратной связи, обеспечивающих поддержание постоянного уровня АТФ в клетке. Усиление или ингибирование АТФ-синтазы является обычным регуляторным механизмом. Например, АТФ ингибирует фосфофруктокиназу-1 (PFK1) и пируваткиназу, два ключевых фермента гликолиза, эффективно действуя как петля отрицательной обратной связи для ингибирования распада глюкозы при наличии достаточного количества клеточного АТФ.
Эти связи имеют высокую энергию из-за связанных с ними электроотрицательных зарядов, создающих силу отталкивания между фосфатными группами. Значительное количество энергии остается запасенным в фосфатно-фосфатных связях. В ходе метаболических процессов АТФ гидролизуется до АДФ или далее до АМФ и свободных неорганических фосфатных групп. Процесс гидролиза АТФ до АДФ энергетически выгоден, давая свободную энергию Гиббса -7,3 кал/моль.[1] АТФ должен постоянно пополняться, чтобы питать постоянно работающую клетку. Обычная внутриклеточная концентрация АТФ составляет от 1 до 10 мкМ.[2] Существует множество механизмов обратной связи, обеспечивающих поддержание постоянного уровня АТФ в клетке. Усиление или ингибирование АТФ-синтазы является обычным регуляторным механизмом. Например, АТФ ингибирует фосфофруктокиназу-1 (PFK1) и пируваткиназу, два ключевых фермента гликолиза, эффективно действуя как петля отрицательной обратной связи для ингибирования распада глюкозы при наличии достаточного количества клеточного АТФ.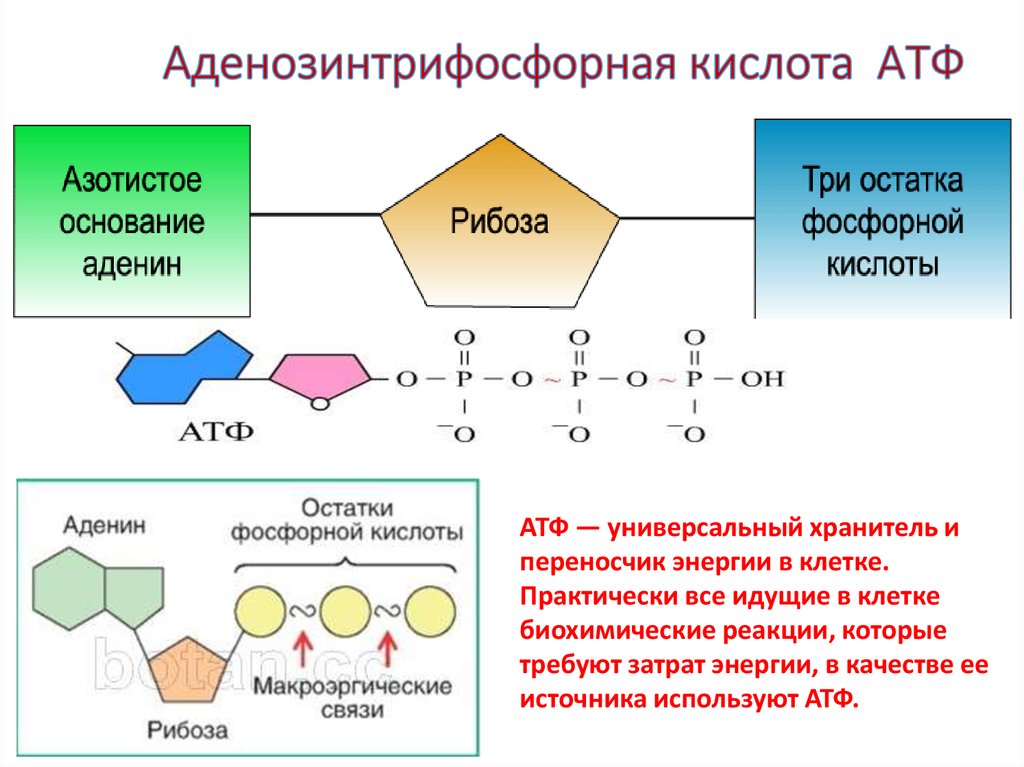
И наоборот, АДФ и АМФ могут активировать PFK1 и пируваткиназу, способствуя синтезу АТФ в периоды высокой потребности в энергии. Другие системы регулируют АТФ, например, в регуляторных механизмах, участвующих в регуляции синтеза АТФ в сердце. Новые эксперименты показали, что десятисекундные всплески, называемые митохондриальными вспышками, могут нарушить выработку АТФ в сердце. Во время этих митохондриальных вспышек митохондрии выделяют активные формы кислорода и эффективно приостанавливают синтез АТФ. Ингибирование продукции АТФ происходит во время митохондриальных вспышек. Во время низкой потребности в энергии, когда клетки сердечной мышцы получали достаточно строительных блоков, необходимых для производства АТФ, митохондриальные вспышки наблюдались чаще. С другой стороны, когда потребность в энергии высока во время быстрого сердечного сокращения, митохондриальные вспышки происходили реже. Эти результаты показали, что в периоды, когда необходимы значительные количества АТФ, митохондриальные вспышки происходят реже, чтобы обеспечить продолжение производства АТФ. И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и ингибировали выработку АТФ.[3]
И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и ингибировали выработку АТФ.[3]
Функция
Гидролиз АТФ обеспечивает энергию, необходимую для многих важных процессов в организмах и клетках. К ним относятся внутриклеточная передача сигналов, синтез ДНК и РНК, пуринергическая передача сигналов, синаптическая передача сигналов, активный транспорт и сокращение мышц. Эти темы не являются исчерпывающим списком, но включают в себя некоторые жизненно важные роли, которые выполняет ATP.
АТФ во внутриклеточной передаче сигналов
Передача сигнала в значительной степени зависит от АТФ. АТФ может служить субстратом для киназ, самого многочисленного АТФ-связывающего белка. Когда киназа фосфорилирует белок, может активироваться сигнальный каскад, что приводит к модуляции различных внутриклеточных сигнальных путей.[4] Активность киназы жизненно важна для клетки и, следовательно, должна жестко регулироваться.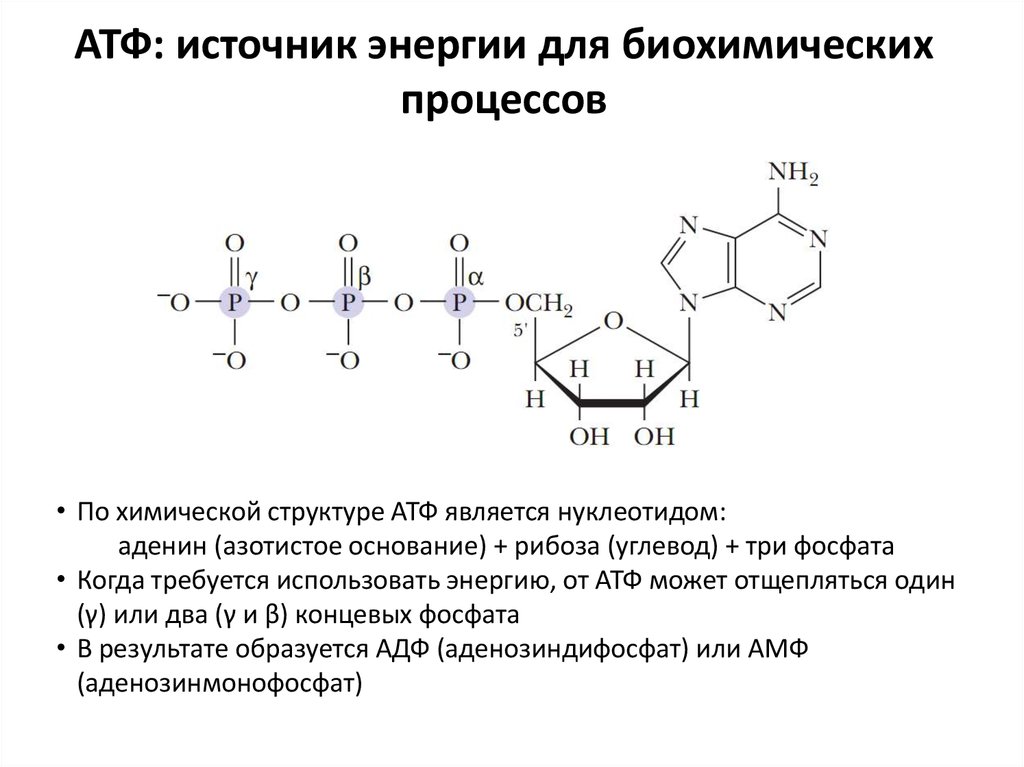 Присутствие иона магния помогает регулировать активность киназы.[5] Регуляция осуществляется через ионы магния, находящиеся в клетке в виде комплекса с АТФ, связанного на фосфатно-кислородных центрах. В дополнение к киназной активности АТФ может функционировать как повсеместный триггер высвобождения внутриклеточного мессенджера.[6] Эти мессенджеры включают гормоны, различные ферменты, липидные медиаторы, нейротрансмиттеры, оксид азота, факторы роста и активные формы кислорода.[6] Пример использования АТФ во внутриклеточной передаче сигналов можно наблюдать в АТФ, выступающем в качестве субстрата для аденилатциклазы. Этот процесс в основном происходит в сигнальных путях рецепторов, связанных с G-белком. При связывании с аденилатциклазой АТФ превращается в циклический АМФ, который способствует высвобождению кальция из внутриклеточных запасов.[7] У цАМФ есть и другие роли, в том числе вторичные мессенджеры в сигнальных каскадах гормонов, активация протеинкиназ и регуляция функции ионных каналов.
Присутствие иона магния помогает регулировать активность киназы.[5] Регуляция осуществляется через ионы магния, находящиеся в клетке в виде комплекса с АТФ, связанного на фосфатно-кислородных центрах. В дополнение к киназной активности АТФ может функционировать как повсеместный триггер высвобождения внутриклеточного мессенджера.[6] Эти мессенджеры включают гормоны, различные ферменты, липидные медиаторы, нейротрансмиттеры, оксид азота, факторы роста и активные формы кислорода.[6] Пример использования АТФ во внутриклеточной передаче сигналов можно наблюдать в АТФ, выступающем в качестве субстрата для аденилатциклазы. Этот процесс в основном происходит в сигнальных путях рецепторов, связанных с G-белком. При связывании с аденилатциклазой АТФ превращается в циклический АМФ, который способствует высвобождению кальция из внутриклеточных запасов.[7] У цАМФ есть и другие роли, в том числе вторичные мессенджеры в сигнальных каскадах гормонов, активация протеинкиназ и регуляция функции ионных каналов.
Синтез ДНК/РНК
Для синтеза ДНК и РНК требуется АТФ. АТФ является одним из четырех нуклеотид-трифосфатных мономеров, необходимых при синтезе РНК. Синтез ДНК использует аналогичный механизм, за исключением того, что при синтезе ДНК АТФ сначала трансформируется путем удаления атома кислорода из сахара с образованием дезоксирибонуклеотида, дАТФ.
Пуринергическая сигнализация
Пуринергическая передача сигналов представляет собой форму внеклеточной паракринной передачи сигналов, которая опосредована пуриновыми нуклеотидами, включая АТФ. Этот процесс обычно влечет за собой активацию пуринергических рецепторов на соседних клетках, тем самым передавая сигналы для регуляции внутриклеточных процессов. АТФ высвобождается из везикулярных запасов и регулируется IP3 и другими распространенными экзоцитотическими регуляторными механизмами. АТФ хранится и высвобождается вместе с нейротрансмиттерами, что еще раз подтверждает представление о том, что АТФ является необходимым медиатором пуринергической нейротрансмиссии как в симпатических, так и в парасимпатических нервах.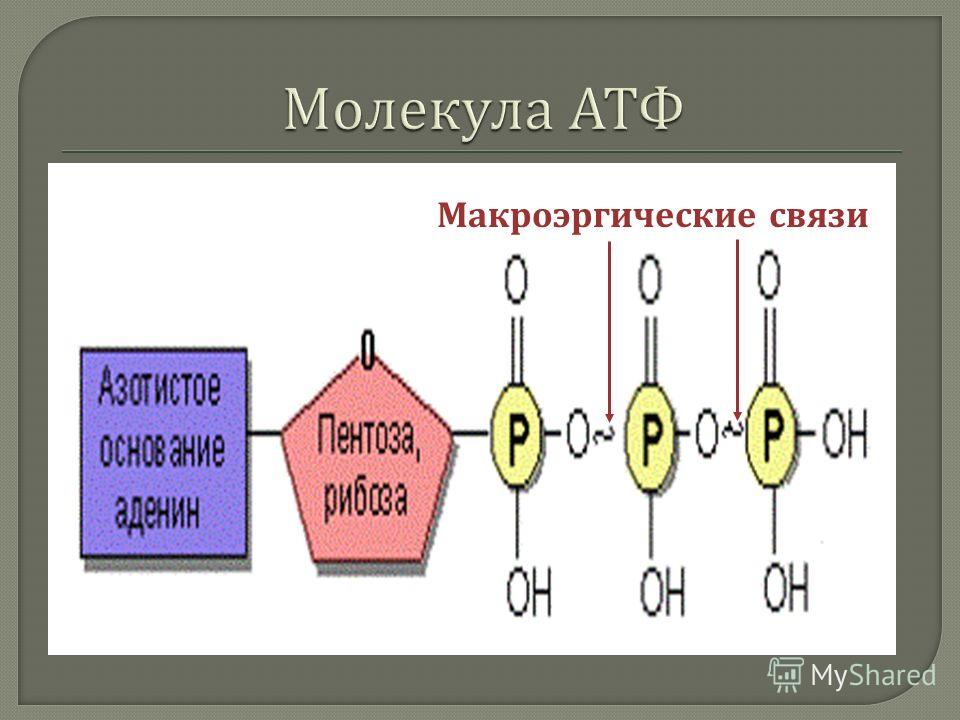 АТФ может индуцировать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействие нервной глии, боль и контроль тонуса сосудов [9].][10][11][12]
АТФ может индуцировать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействие нервной глии, боль и контроль тонуса сосудов [9].][10][11][12]
Нейротрансмиссия
Мозг является самым большим потребителем АТФ в организме, потребляя примерно двадцать пять процентов всей доступной энергии.[13] Большое количество энергии тратится на поддержание концентрации ионов для правильной передачи сигналов нейронами и синаптической передачи.[14] Синаптическая передача является энергоемким процессом. На пресинаптических окончаниях АТФ требуется для установления ионного градиента, который перемещает нейротрансмиттеры в везикулы, и для подготовки везикул к высвобождению посредством экзоцитоза. [14] Нейрональная передача сигналов зависит от потенциала действия, достигающего пресинаптических окончаний, сигнализирующего о высвобождении загруженных везикул. Этот процесс зависит от того, что АТФ восстанавливает концентрацию ионов в аксоне после каждого потенциала действия, позволяя возникать другому сигналу.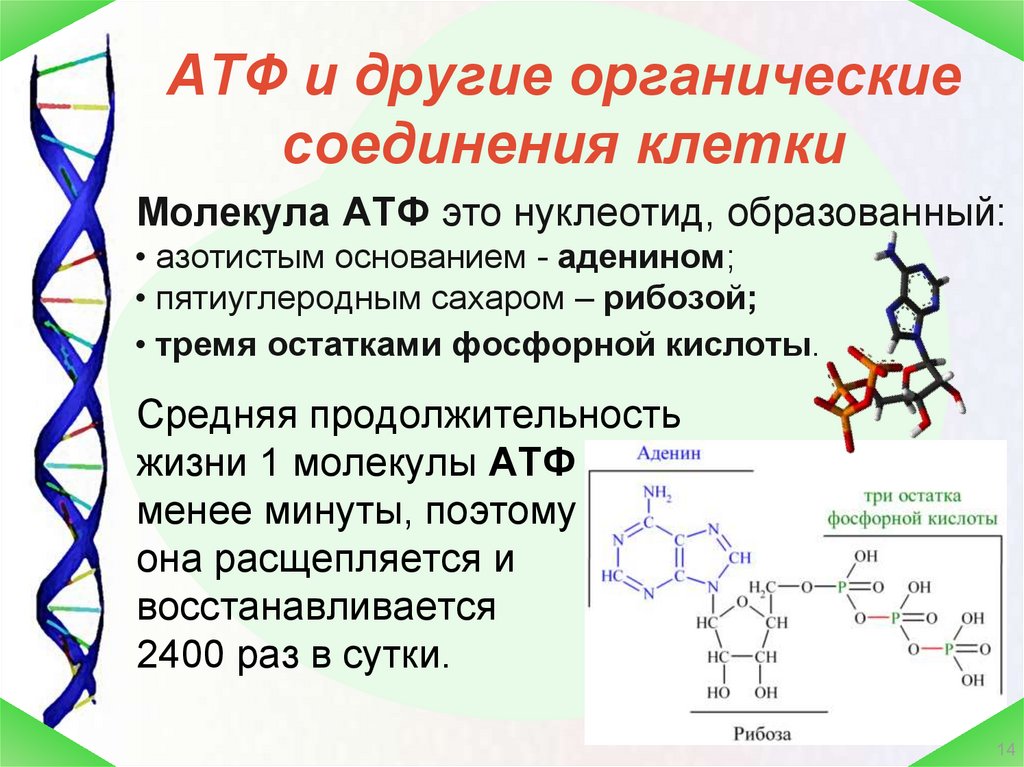 Активный транспорт отвечает за сброс концентраций ионов натрия и калия до исходных значений после возникновения потенциала действия через Na/K-АТФазу. Во время этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки и два иона калия транспортируются обратно в клетку, оба из которых движутся против градиента их концентрации.
Активный транспорт отвечает за сброс концентраций ионов натрия и калия до исходных значений после возникновения потенциала действия через Na/K-АТФазу. Во время этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки и два иона калия транспортируются обратно в клетку, оба из которых движутся против градиента их концентрации.
Потенциалы действия, проходящие по аксону, инициируют везикулярное высвобождение при достижении пресинаптического окончания. После установления ионного градиента потенциалы действия затем распространяются вниз по аксону посредством деполяризации аксона, посылая сигнал к терминалу. Приблизительно один миллиард ионов натрия необходим для распространения одного потенциала действия. Нейронам потребуется гидролизовать около миллиарда молекул АТФ, чтобы восстановить концентрацию ионов натрия/калия после каждой клеточной деполяризации.[13]Возбуждающие синапсы в значительной степени преобладают в сером веществе мозга. Везикулы, содержащие глутамат, высвобождаются в синаптическую щель, чтобы активировать постсинаптические возбуждающие глутаминергические рецепторы. Для загрузки этих молекул требуется большое количество АТФ из-за почти четырех тысяч молекул глутамата, хранящихся в одном пузырьке. Необходимы значительные запасы энергии, чтобы инициировать высвобождение везикул, управлять глутаматергическими постсинаптическими процессами и перерабатывать везикулы, а также оставшийся глутамат. Следовательно, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам.
Для загрузки этих молекул требуется большое количество АТФ из-за почти четырех тысяч молекул глутамата, хранящихся в одном пузырьке. Необходимы значительные запасы энергии, чтобы инициировать высвобождение везикул, управлять глутаматергическими постсинаптическими процессами и перерабатывать везикулы, а также оставшийся глутамат. Следовательно, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам.
АТФ в сокращении мышц
Сокращение мышц является необходимой функцией повседневной жизни и не может происходить без АТФ. Есть три основные роли, которые АТФ выполняет в действии мышечного сокращения. Во-первых, за счет генерации силы, воздействующей на соседние актиновые филаменты, за счет циклирования миозиновых поперечных мостиков. Во-вторых, это перекачка ионов кальция из миоплазмы через саркоплазматический ретикулум против градиента их концентрации с использованием активного транспорта. Третьей функцией, которую выполняет АТФ, является активный транспорт ионов натрия и калия через сарколемму, так что ионы кальция могут высвобождаться при получении входного сигнала.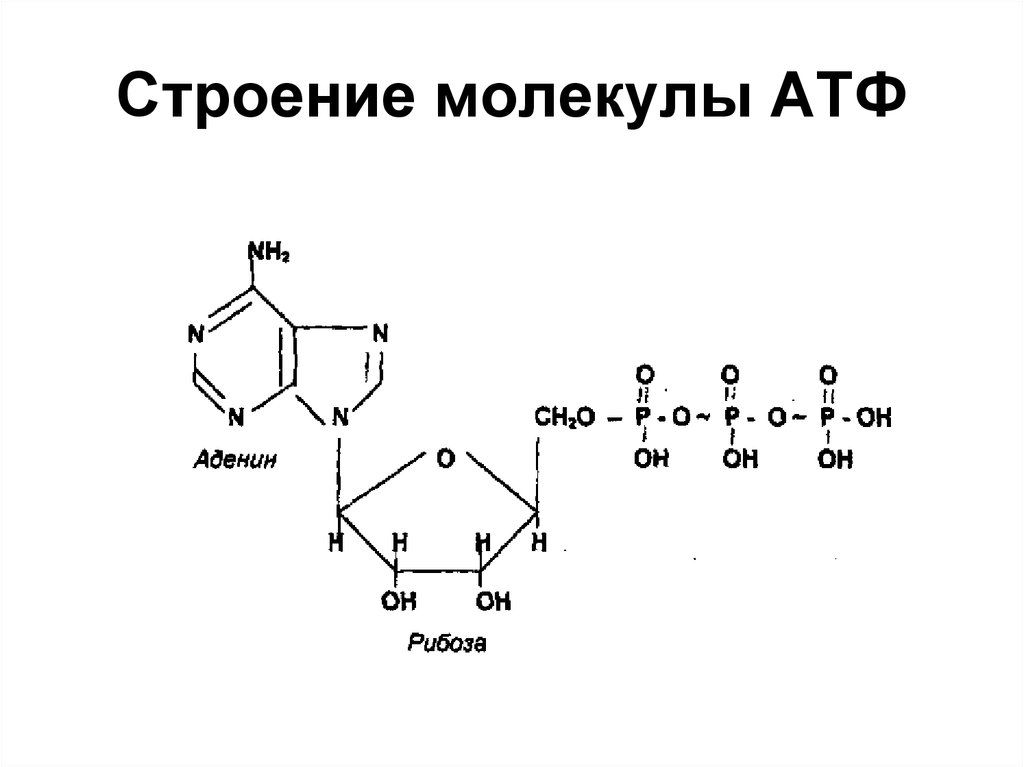 Гидролиз АТФ управляет каждым из этих процессов.[16]
Гидролиз АТФ управляет каждым из этих процессов.[16]
Механизм
Многие процессы способны производить АТФ в организме, в зависимости от текущих метаболических условий. Производство АТФ может происходить в присутствии кислорода в результате клеточного дыхания, бета-окисления, кетоза, катаболизма липидов и белков, а также в анаэробных условиях.
Клеточное дыхание
Клеточное дыхание — это процесс катаболизма глюкозы в ацетил-КоА с образованием высокоэнергетических переносчиков электронов, которые будут окисляться во время окислительного фосфорилирования с образованием АТФ. Во время гликолиза, первой стадии клеточного дыхания, одна молекула глюкозы расщепляется на две молекулы пирувата. Во время этого процесса два АТФ продуцируются путем фосфорилирования субстрата ферментами PFK1 и пируваткиназой. Также происходит образование двух восстановленных молекул переносчика электронов NADH. Затем молекулы пирувата окисляются пируватдегидрогеназным комплексом с образованием молекулы ацетил-КоА.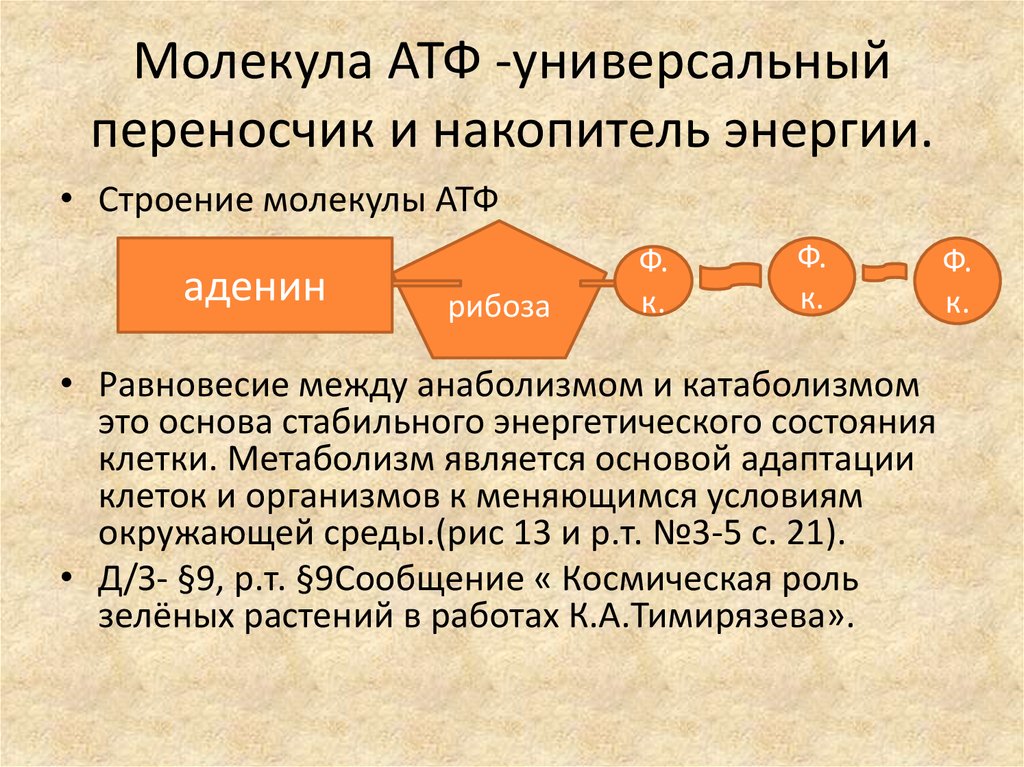 Затем молекула ацетил-КоА полностью окисляется с образованием диоксида углерода и восстановленных переносчиков электронов в цикле лимонной кислоты. При завершении цикла лимонной кислоты общий выход составляет две молекулы диоксида углерода, один эквивалент АТФ, три молекулы НАДН и одна молекула ФАДч3. Эти высокоэнергетические переносчики электронов затем переносят электроны в цепь переноса электронов, в которой ионы водорода (протоны) переносятся против своего градиента во внутреннее пространство мембраны из митохондриального матрикса. Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы.] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель пожертвовал протоны. Одна молекула NADH производит две с половиной молекулы АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Затем молекула ацетил-КоА полностью окисляется с образованием диоксида углерода и восстановленных переносчиков электронов в цикле лимонной кислоты. При завершении цикла лимонной кислоты общий выход составляет две молекулы диоксида углерода, один эквивалент АТФ, три молекулы НАДН и одна молекула ФАДч3. Эти высокоэнергетические переносчики электронов затем переносят электроны в цепь переноса электронов, в которой ионы водорода (протоны) переносятся против своего градиента во внутреннее пространство мембраны из митохондриального матрикса. Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы.] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель пожертвовал протоны. Одна молекула NADH производит две с половиной молекулы АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Бета-окисление
Бета-окисление — еще один механизм синтеза АТФ в организмах. Во время бета-окисления цепи жирных кислот постоянно укорачиваются, образуя молекулы ацетил-КоА. На протяжении каждого цикла бета-окисления жирная кислота восстанавливается на две длины углерода, образуя одну молекулу ацетил-КоА, которая может быть окислена в цикле лимонной кислоты, и по одной молекуле НАДН и ФАДч3, которые передают свою высокую энергию электрон в транспортную цепь.[18]
Во время бета-окисления цепи жирных кислот постоянно укорачиваются, образуя молекулы ацетил-КоА. На протяжении каждого цикла бета-окисления жирная кислота восстанавливается на две длины углерода, образуя одну молекулу ацетил-КоА, которая может быть окислена в цикле лимонной кислоты, и по одной молекуле НАДН и ФАДч3, которые передают свою высокую энергию электрон в транспортную цепь.[18]
Кетоз
Кетоз – это реакция образования АТФ в результате катаболизма кетоновых тел. Во время кетоза кетоновые тела подвергаются катаболизму для производства энергии, образуя двадцать две молекулы АТФ и две молекулы ГТФ на молекулу ацетоацетата, которая окисляется в митохондриях.
Анаэробное дыхание
Когда кислорода мало или он недоступен во время клеточного дыхания, клетки могут подвергаться анаэробному дыханию. В анаэробных условиях происходит накопление молекул НАДН из-за неспособности окислять НАДН до НАД+, что ограничивает действие ГАФД и потребление глюкозы.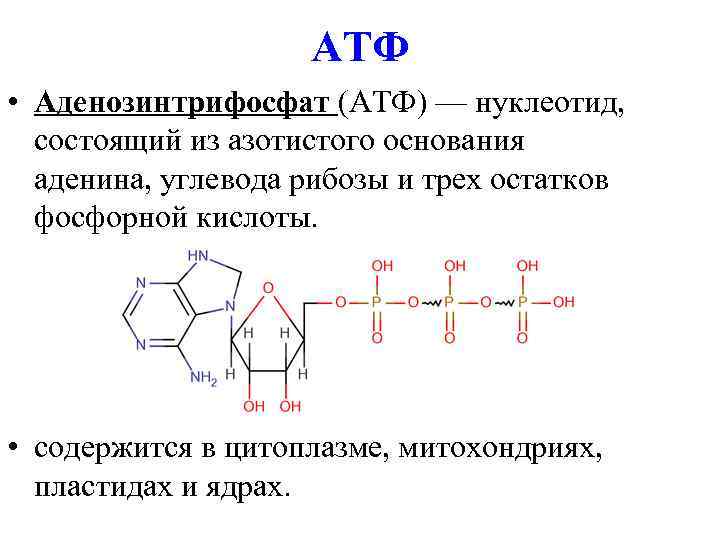 Для поддержания гомеостатического уровня НАДН пируват восстанавливается до лактата, что приводит к окислению одной молекулы НАДН в процессе, известном как молочнокислое брожение. При молочнокислом брожении две молекулы НАДН, образующиеся в результате гликолиза, окисляются для поддержания резервуара НАД+. Эта реакция дает только две молекулы АТФ на молекулу глюкозы.
Для поддержания гомеостатического уровня НАДН пируват восстанавливается до лактата, что приводит к окислению одной молекулы НАДН в процессе, известном как молочнокислое брожение. При молочнокислом брожении две молекулы НАДН, образующиеся в результате гликолиза, окисляются для поддержания резервуара НАД+. Эта реакция дает только две молекулы АТФ на молекулу глюкозы.
Связанное тестирование
Многие методы позволяют рассчитать внутриклеточный уровень АТФ. Общепринятый протокол включает использование люциферазы светлячка, фермента, который вызывает окисление люциферина.[19] Эта реакция поддается количественному измерению из-за выхода энергии этой реакции, высвобождающей фотон света, известного как биолюминесценция, которая поддается количественному измерению.
Клиническое значение
Роль АТФ в контроле боли
ATP демонстрирует уменьшение острой периоперационной боли в клинических исследованиях.[20] В этих исследованиях пациенты получали АТФ внутривенно.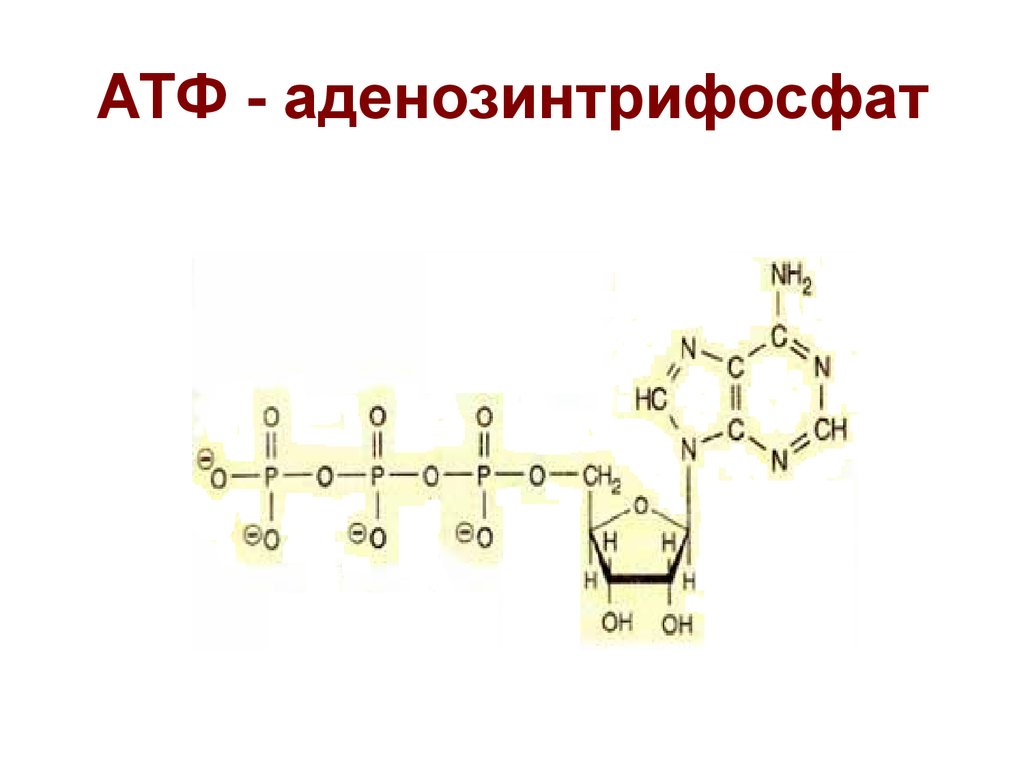 Внутривенная инфузия аденозина действует на аденозиновый рецептор A1, инициируя сигнальный каскад, который в конечном итоге способствует обезболивающему эффекту, наблюдаемому при воспалении. Исследования показали, что соединения аденозина уменьшают аллодинию и гипералгезию при введении в умеренных дозах.[20] Активация аденозинового рецептора A1 оказывает эффективное обезболивающее действие благодаря медленному началу и длительному действию, которое в некоторых случаях может продолжаться в течение нескольких недель.
Внутривенная инфузия аденозина действует на аденозиновый рецептор A1, инициируя сигнальный каскад, который в конечном итоге способствует обезболивающему эффекту, наблюдаемому при воспалении. Исследования показали, что соединения аденозина уменьшают аллодинию и гипералгезию при введении в умеренных дозах.[20] Активация аденозинового рецептора A1 оказывает эффективное обезболивающее действие благодаря медленному началу и длительному действию, которое в некоторых случаях может продолжаться в течение нескольких недель.
Анестезия
Добавление АТФ дало положительные результаты во время анестезии. Имеющиеся данные показывают, что низкие дозы аденозина уменьшают невропатическую боль, ишемическую боль и гипералгезию до уровня, сравнимого с морфином.[21] Аденозин также снижал послеоперационное использование опиоидов, что свидетельствует о потенциальной длительной активации аденозиновых рецепторов А1.
Кардиология и хирургия
Было показано, что АТФ является безопасным и практичным легочным сосудорасширяющим средством у пациентов с легочной гипертензией.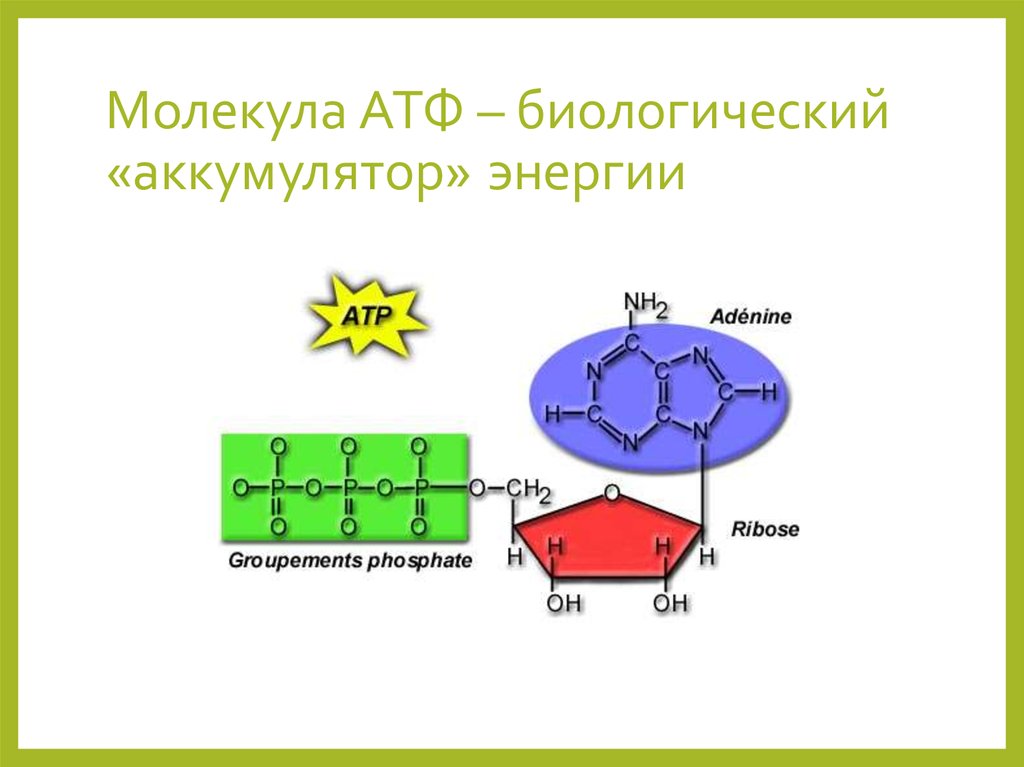 [21] Точно так же аденозин и АТФ можно использовать во время операции, чтобы вызвать гипотензию у пациентов.[21]
[21] Точно так же аденозин и АТФ можно использовать во время операции, чтобы вызвать гипотензию у пациентов.[21]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Литература
- 1.
Meurer F, Do HT, Sadowski G, Held C. Стандартная энергия Гиббса метаболических реакций: II. Глюкозо-6-фосфатазная реакция и гидролиз АТФ. Биофиз хим. 2017 Апр; 223:30-38. [PubMed: 28282626]
- 2.
Beis I, Newsholme EA. Содержание адениновых нуклеотидов, фосфагенов и некоторых гликолитических интермедиатов в покоящихся мышцах позвоночных и беспозвоночных. Биохим Дж. 1975 октября; 152(1):23-32. [Бесплатная статья PMC: PMC1172435] [PubMed: 1212224]
- 3.
Wang X, Zhang X, Wu D, Huang Z, Hou T, Jian C, Yu P, Lu F, Zhang R, Sun T, Li J, Qi W, Wang Y, Gao F, Cheng H. Митохондриальные вспышки регулируют гомеостаз АТФ в сердце.
 Элиф. 2017 Jul 10;6 [PMC бесплатная статья: PMC5503511] [PubMed: 28692422]
Элиф. 2017 Jul 10;6 [PMC бесплатная статья: PMC5503511] [PubMed: 28692422]- 4.
Mishra NS, Tuteja R, Tuteja N. Передача сигналов через сети киназ MAP в растениях. Арх Биохим Биофиз. 2006 01 августа; 452 (1): 55-68. [В паблике: 16806044]
- 5.
Лин Х, Айрапетов М.К., Сун Г. Характеристика взаимодействий между активным центром протеинтирозинкиназы и активатором двухвалентного металла. БМС Биохим. 2005 23 ноября; 6:25. [PMC бесплатная статья: PMC1316873] [PubMed: 16305747]
- 6.
Zimmermann H. Внеклеточный АТФ и другие нуклеотиды-повсеместные триггеры высвобождения межклеточного мессенджера. Пуринергический сигнал. 2016 март; 12(1):25-57. [Бесплатная статья PMC: PMC4749530] [PubMed: 26545760]
- 7.
Каменецкий М., Миддельхауфе С., Банк Э.М., Левин Л.Р., Бак Дж., Стигборн С. Молекулярные детали образования цАМФ в клетках млекопитающих: рассказ о двух системах. Дж Мол Биол. 2006 г., 29 сентября; 362(4):623-39.
 [Бесплатная статья PMC: PMC3662476] [PubMed: 16934836]
[Бесплатная статья PMC: PMC3662476] [PubMed: 16934836]- 8.
Джойс CM, Steitz TA. Структуры и функции полимеразы: вариации на тему? J Бактериол. 1995 ноябрь; 177 (22): 6321-9. [Бесплатная статья PMC: PMC177480] [PubMed: 7592405]
- 9.
Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A, Giorgi C, Marchi S, Missiroli S, Poletti F, Wieckowski MR, Pinton P. Синтез и хранение АТФ. Пуринергический сигнал. 2012 Сентябрь;8(3):343-57. [Бесплатная статья PMC: PMC3360099] [PubMed: 22528680]
- 10.
Карденас С., Миллер Р.А., Смит И., Буй Т., Молго Дж., Мюллер М., Вайс Х., Чунг К.Х., Ян Дж., Паркер И., Томпсон С.Б., Бирнбаум М.Дж., Халлоус К.Р., Фоскетт Дж.К. Существенная регуляция биоэнергетики клетки путем конститутивного переноса Ca2+ рецептора InsP3 в митохондрии. Клетка. 2010 23 июля; 142 (2): 270-83. [Бесплатная статья PMC: PMC2911450] [PubMed: 20655468]
- 11.
Пабло Хуидобро-Торо Дж.
 , Вероника Доносо М. Симпатическая котрансмиссия: скоординированное действие АТФ и норадреналина и их модуляция нейропептидом Y в сосудистых нейроэффекторных соединениях человека. Евр Дж Фармакол. 2004 01 октября; 500 (1-3): 27-35. [PubMed: 15464018]
, Вероника Доносо М. Симпатическая котрансмиссия: скоординированное действие АТФ и норадреналина и их модуляция нейропептидом Y в сосудистых нейроэффекторных соединениях человека. Евр Дж Фармакол. 2004 01 октября; 500 (1-3): 27-35. [PubMed: 15464018]- 12.
Coco S, Calegari F, Pravettoni E, Pozzi D, Taverna E, Rosa P, Matteoli M, Verderio C. Хранение и высвобождение АТФ из астроцитов в культуре. Дж. Биол. Хим. 2003 10 января; 278 (2): 1354-62. [В паблике: 12414798]
- 13.
Аттвелл Д., Лафлин С.Б. Энергетический баланс для передачи сигналов в сером веществе головного мозга. J Cereb Blood Flow Metab. 21 октября 2001 г. (10): 1133-45. [PubMed: 11598490]
- 14.
Harris JJ, Jolivet R, Attwell D. Использование и поставка синаптической энергии. Нейрон. 06 сентября 2012 г .; 75 (5): 762–777. [PubMed: 22958818]
- 15.
Вонг-Райли MT. Цитохромоксидаза: эндогенный метаболический маркер активности нейронов.
 Тренды Нейроси. 1989 марта; 12(3):94-101. [PubMed: 2469224]
Тренды Нейроси. 1989 марта; 12(3):94-101. [PubMed: 2469224]- 16.
Барклай CJ. Энергетика сокращения. сост. физиол. 2015 Апрель;5(2):961-95. [PubMed: 25880520]
- 17.
Богатый PR. Молекулярный механизм дыхательной цепи Кейлина. Биохим Сок Транс. 2003 г.; 31 декабря (часть 6): 1095–105. [PubMed: 14641005]
- 18.
Ronnett GV, Kim EK, Landree LE, Tu Y. Метаболизм жирных кислот как мишень для лечения ожирения. Физиол Поведение. 2005 19 мая;85(1):25-35. [PubMed: 15878185]
- 19.
Бровко Л.Ю., Романова Н.А., Угарова Н.Н. Биолюминесцентный анализ бактериального внутриклеточного АМФ, АДФ и АТФ с использованием коиммобилизованного трехферментного реагента (аденилаткиназа, пируваткиназа и люцифераза светлячка). Анальная биохимия. 1994 01 августа; 220 (2): 410-4. [PubMed: 7978286]
- 20.
Хаяшида М., Фукуда К., Фукунага А. Клиническое применение аденозина и АТФ для обезболивания.