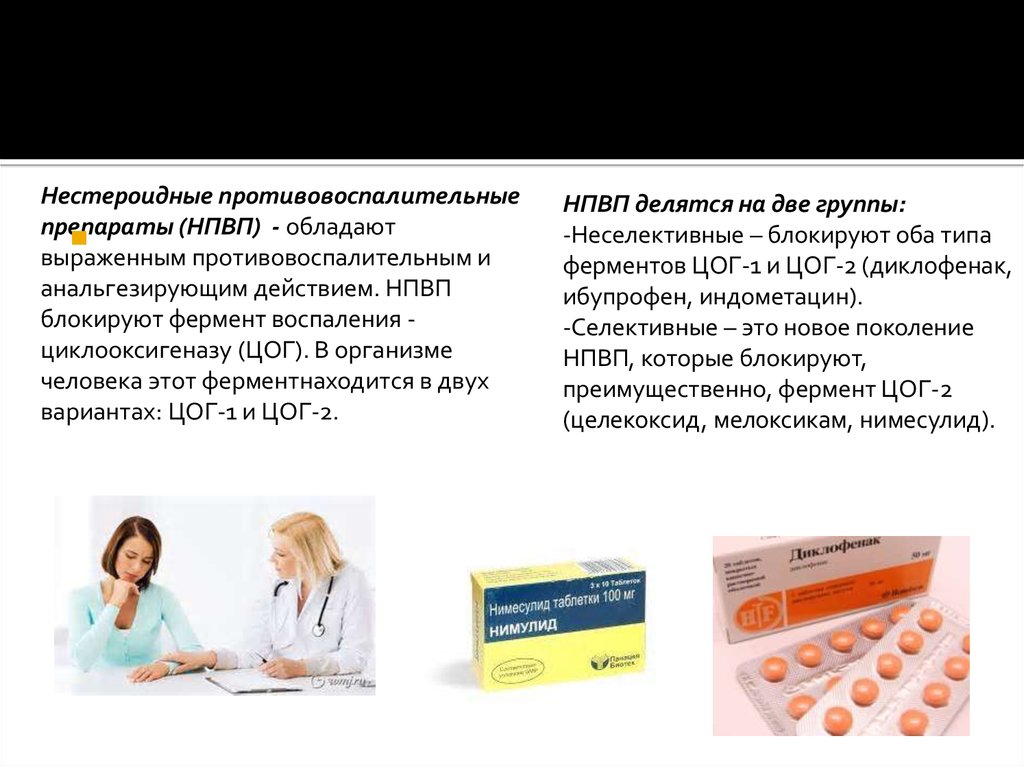
Влияние нестероидных противовоспалительных препаратов на метаболизм суставного хряща | Бадокин В.В.
Остеоартроз (ОА) является многофакторным хроническим прогрессирующим заболеванием, развивающимся в результате действия механических и биологических факторов, которые дестабилизируют в суставном хряще и субхондральной кости нормальные взаимоотношения между деградацией и синтезом компонентов матрикса хряща. Это заболевание поражает синовиальные суставы и характеризуется уменьшением массы гиалинового хряща с ремоделированием субхондральной кости, формированием остеофитов и воспалением синовиальной мембраны. ОА скорее является синдромом, чем самостоятельным заболеванием, и отдельные его субтипы имеют различные факторы риска развития и прогрессирования. В его генезе принимает участие сложный комплекс биомеханических, биохимических и/или генетических факторов.
ОА занимает первое место по распространенности среди других ревматических болезней и четко коррелирует с возрастом [1]. Рентгенологические симптомы этого заболевания встречаются у 50% населения Европы старше 65 лет, клинические – у 12,5%, а среди лиц старше 80 лет определяются почти у всех пациентов [2]. Для ОА характерно отсутствие корреляции между клинической симптоматикой, данными рентгенографии суставов, магнитно-резонансной и компьютерной томографии, ультразвуковой симптоматикой и макроскопической картиной, полученной при проведении артроскопии. Полагают, что лечение и вторичную профилактику ОА следует проводить только у лиц с наличием клинической картины заболевания, а именно боли и нарушения функции пораженных суставов. При этом заболевании поражаются в первую очередь «нагрузочные» суставы, что значительно ухудшает качество жизни больных и является серьезной социально-экономической проблемой.
Рентгенологические симптомы этого заболевания встречаются у 50% населения Европы старше 65 лет, клинические – у 12,5%, а среди лиц старше 80 лет определяются почти у всех пациентов [2]. Для ОА характерно отсутствие корреляции между клинической симптоматикой, данными рентгенографии суставов, магнитно-резонансной и компьютерной томографии, ультразвуковой симптоматикой и макроскопической картиной, полученной при проведении артроскопии. Полагают, что лечение и вторичную профилактику ОА следует проводить только у лиц с наличием клинической картины заболевания, а именно боли и нарушения функции пораженных суставов. При этом заболевании поражаются в первую очередь «нагрузочные» суставы, что значительно ухудшает качество жизни больных и является серьезной социально-экономической проблемой.
 Боль носит механический характер, усиливаясь при физической нагрузке или к концу дня. Но боль при этом заболевании может быть и воспалительного типа, что обычно наблюдается при развитии вторичного артрита (синовита). Причины ее развития чрезвычайно многообразны и обусловлены заинтересованностью в патологическом процессе кости (периостит, субхондральные переломы, повышение внутрикостного давления), синовиальной оболочки (воспаление, раздражение чувствительных нервных окончаний остеофитами) и периартикулярных тканей (мышечный спазм, нестабильность сустава). Причиной боли могут быть и другие факторы, например, снижение сопротивляемости субхондральной кости к нагрузке, неравномерное распределение нагрузки на различные отделы суставов, дегенеративные изменения в периартикулярных тканях, нарушения кровообращения суставов.
Боль носит механический характер, усиливаясь при физической нагрузке или к концу дня. Но боль при этом заболевании может быть и воспалительного типа, что обычно наблюдается при развитии вторичного артрита (синовита). Причины ее развития чрезвычайно многообразны и обусловлены заинтересованностью в патологическом процессе кости (периостит, субхондральные переломы, повышение внутрикостного давления), синовиальной оболочки (воспаление, раздражение чувствительных нервных окончаний остеофитами) и периартикулярных тканей (мышечный спазм, нестабильность сустава). Причиной боли могут быть и другие факторы, например, снижение сопротивляемости субхондральной кости к нагрузке, неравномерное распределение нагрузки на различные отделы суставов, дегенеративные изменения в периартикулярных тканях, нарушения кровообращения суставов. Важной составляющей программы лечения ОА являются симптоматические лекарственные средства медленного действия и, в первую очередь, глюкозамин сульфат или гидрохлорид и хондроитин сульфат (хотя мнение об их эффективности неоднозначно), а также внутрисуставные инъекции пролонгированных кристаллических глюкокортикоидов и препаратов гиалуроновой кислоты. Существует большой арсенал и альтернативных методов лечения, однако их доказательная база оставляет желать лучшего.
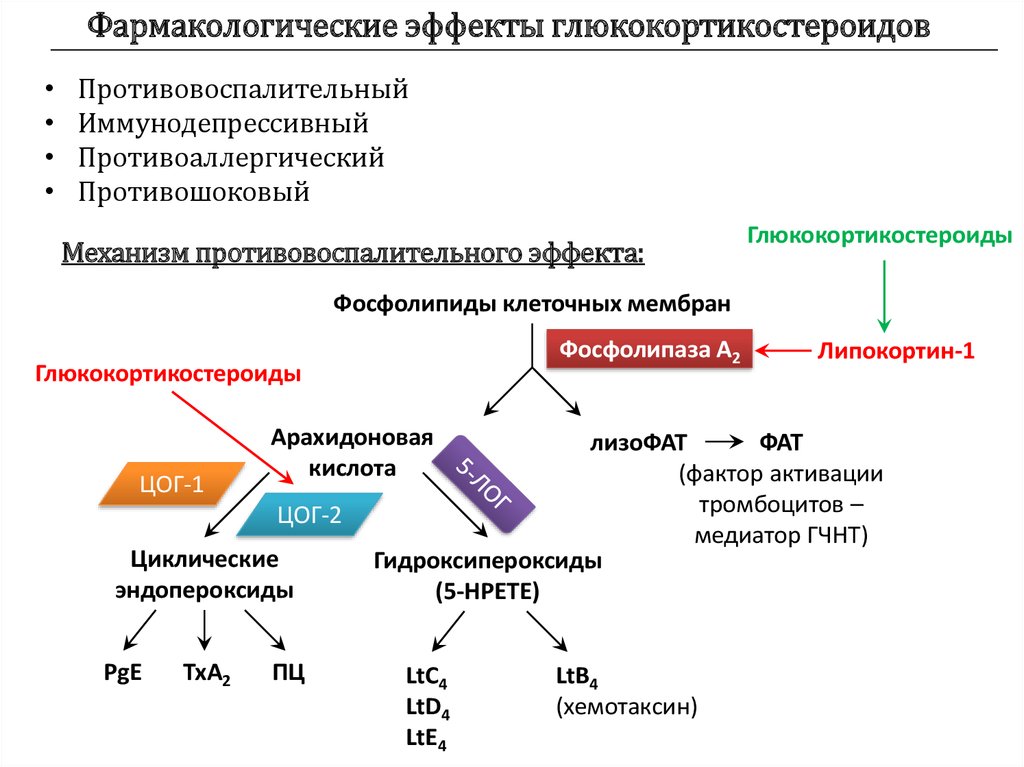
Важной составляющей программы лечения ОА являются симптоматические лекарственные средства медленного действия и, в первую очередь, глюкозамин сульфат или гидрохлорид и хондроитин сульфат (хотя мнение об их эффективности неоднозначно), а также внутрисуставные инъекции пролонгированных кристаллических глюкокортикоидов и препаратов гиалуроновой кислоты. Существует большой арсенал и альтернативных методов лечения, однако их доказательная база оставляет желать лучшего. Чем обоснована целесообразность назначения при ОА НПВП? Хотя ОА рассматривается в качестве основного дегенеративного заболевания суставов, в последнее время появились убедительные данные, позволяющие считать его заболеванием, в патогенезе которого важная, а возможно и определяющая, роль принадлежит персистирующему воспалению в тканях сустава с развитием рецидивирующего (вторичного) синовита, хондрита, остеита и периартрита. Персистирующее воспаление в тканях сустава способствует прогрессированию морфологических изменений, в т.
 ч. структурных изменений гиалинового хряща с его дегенерацией и уменьшением объема [3]. Интересно, что на Европейском конгрессе ревматологов в 2012 г. в Берлине (Германия) обсуждалась целесообразность назначения при этом заболевании низких доз преднизолона, метотрексата и применение моноклональных антител к фактору некроза опухоли-α (ФНО-α).
ч. структурных изменений гиалинового хряща с его дегенерацией и уменьшением объема [3]. Интересно, что на Европейском конгрессе ревматологов в 2012 г. в Берлине (Германия) обсуждалась целесообразность назначения при этом заболевании низких доз преднизолона, метотрексата и применение моноклональных антител к фактору некроза опухоли-α (ФНО-α).  ИЛ-1β тормозит экспрессию ингибиторов ММPs, синтез коллагена и протеогликанов, способствует синтезу активатора плазминогена и в то же время стимулирует синтез и высвобождение некоторых эйкозаноидов, включая простагландины (РGE) и лейкотриены. Он определяет уровень катаболического процесса при ОА и стимулирует продукцию других провоспалительных цитокинов (ИЛ-6, -8). Ведущая роль этого цитокина в развитии воспаления в тканях сустава подтверждается тем обстоятельством, что инъекции ИЛ-Ra способствуют разрешению клинических проявлений ОА [6].
ИЛ-1β тормозит экспрессию ингибиторов ММPs, синтез коллагена и протеогликанов, способствует синтезу активатора плазминогена и в то же время стимулирует синтез и высвобождение некоторых эйкозаноидов, включая простагландины (РGE) и лейкотриены. Он определяет уровень катаболического процесса при ОА и стимулирует продукцию других провоспалительных цитокинов (ИЛ-6, -8). Ведущая роль этого цитокина в развитии воспаления в тканях сустава подтверждается тем обстоятельством, что инъекции ИЛ-Ra способствуют разрешению клинических проявлений ОА [6].В развитии ОА участвуют и другие медиаторы воспаления, в частности ФНО-α (TNF-α), ИЛ-17, ИЛ-18, онкостатин М (OSM), фактор ингибиции лейкемии (LIF) [4]. Cодержание ФНО-α существенно ниже при ОА, чем при ревматоидном артрите, но достоверно выше, чем у здоровых лиц. OSM, член семейства ИЛ-6, играет определенную роль в воспалении. В эксперименте показано, что он способствует высвобождению из ткани хряща протеогликанов, стромелизина-1 и коллагена.

Другие медиаторы воспаления также принимают участие в патогенезе ОА. Остеоартрозный хрящ экспрессирует высокие значения оксида азота (NO), которые выявляются в сыворотке крови и синовиальной жидкости. In vitro получены веские доказательства, что этот медиатор и его окисленные метаболиты обладают антивоспалительным и катаболическим действием [7]. NO ингибирует синтез макромолекул матрикса хряща и снижает экспрессию ИЛ-1Ra хондроцитами, участвует в синтезе PGE2, способствует апоптозу хондроцитов, снижает интенсивность анаболического процесса. С другой стороны, PGЕ2 способствует повреждению тканей сустава, потенцируя другие медиаторы воспаления, влияет непосредственно на ремоделирование хряща, продукцию MMPs, остеокластическую костную резорбцию и ангиогенез [8].

Все вышеприведенное обосновывает назначение противовоспалительной терапии при ОА. Складывается впечатление, что и положительный эффект симптом-модифицирующих препаратов медленного действия, ранее называвшихся хондропротекторами, прежде всего связан с угнетением персистирующего воспаления в тканях сустава и, в первую очередь, в гиалиновом хряще.
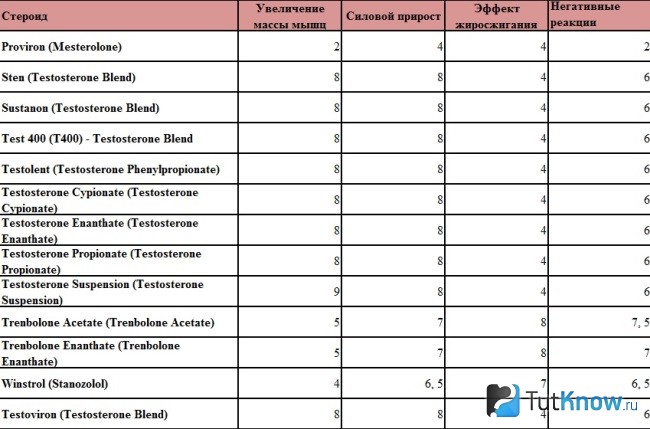
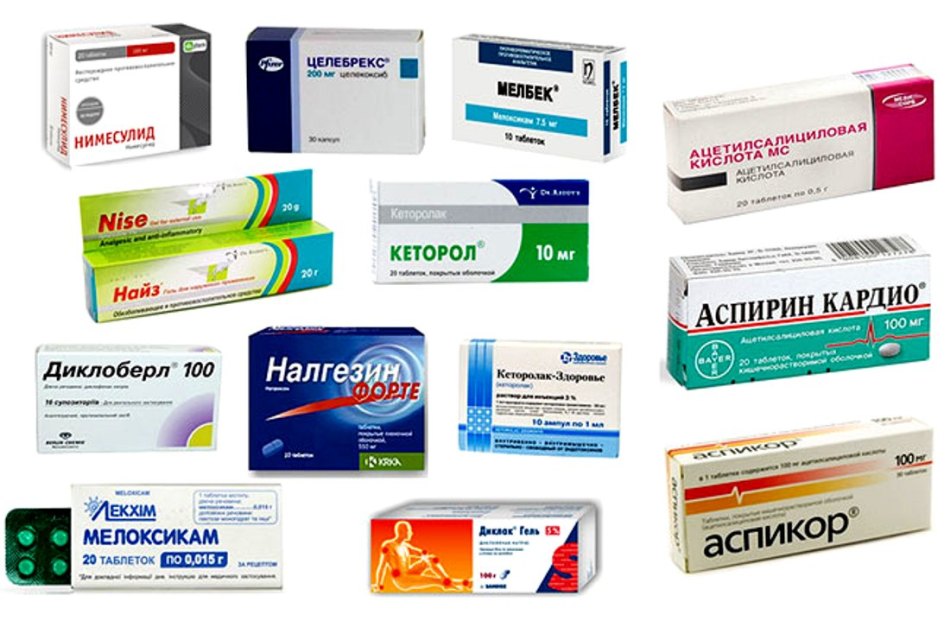
В терапии ОА основными симптом-модифицирующими препаратами быстрого действия являются простые анальгетики и НПВП. Последние занимают лидирующее положение, активно подавляют боль и нормализуют функцию пораженных суставов (табл. 1). Они показаны при наличии вторичного (реактивного) артрита или периартрита, например при синдроме «гусиной лапки», а также при выраженных болях, которые не удается купировать простыми или опиоидными анальгетиками.

НПВП характеризуются различными механизмами воздействия на гиалиновый хряща [10, 11], но в преобладающем большинстве они угнетают его метаболизм. Так, cалицилаты, ибупрофен и напроксен ингибируют синтез основных компонентов матрикса хряща, включая синтез протеогликанов, гликозаминогликанов (ГАГ) и гиалуроната, а также увеличивают их высвобождение. Индометацин ингибирует гликозилтрансферазу, которая участвует в синтезе полисахаридных цепей протеогликанов, а также нарушает скорость инкорпорирования в них сульфатов. Напроксен достоверно уменьшает содержание протеогликанов и влияет на активность металлопротеиназ в суставном хряще, как это свойственно и нимесулиду. Негативное влияние НПВП на хрящ осуществляется также за счет нарушения окислительного фосфорилирования в митохондриях, активации цАМФ-зависимой киназы А, нарушения белок-белковых взаимодействий на уровне клеточной мембраны. Преобладающее большинство НПВП ингибируют NO-индуцированный апоптоз, причем независимо от ингибиции СОХ2 и продукции РGE2.
 Следует подчеркнуть, что представленные выше данные о влиянии НПВП на метаболизм суставного хряща были получены в основном в эксперименте на модели культуры ткани суставного хряща, и это следует учитывать при оценке полученных результатов. Действие НПВП на метаболические процессы в хондроцитах в каждом конкретном случае связано с их метаболической активностью, протестированной дозой исследуемого препарата, возрастом донора, стадией ОА и степенью повреждения хряща.
Следует подчеркнуть, что представленные выше данные о влиянии НПВП на метаболизм суставного хряща были получены в основном в эксперименте на модели культуры ткани суставного хряща, и это следует учитывать при оценке полученных результатов. Действие НПВП на метаболические процессы в хондроцитах в каждом конкретном случае связано с их метаболической активностью, протестированной дозой исследуемого препарата, возрастом донора, стадией ОА и степенью повреждения хряща. Представленные данные дали основание экспертам European Group for the Respect and of Ethics and Exellence in Science (GREES) сделать заключение о том, что пока нет достаточно убедительных данных, свидетельствующих о благоприятном действии на хрящевую ткань широко применяющихся НПВП (диклофенак, напроксен) и селективных ингибиторов циклооксигеназы-2 (ЦОГ-2) [13]. По мнению экспертов этой группы, «идеальный» НПВП не должен негативно влиять на здоровый контралатеральный хрящ и в то же время должен стимулировать синтез хрящевой ткани, замедлять резорбцию хряща и ингибировать синтез катаболических цитокинов.
Представленные данные дали основание экспертам European Group for the Respect and of Ethics and Exellence in Science (GREES) сделать заключение о том, что пока нет достаточно убедительных данных, свидетельствующих о благоприятном действии на хрящевую ткань широко применяющихся НПВП (диклофенак, напроксен) и селективных ингибиторов циклооксигеназы-2 (ЦОГ-2) [13]. По мнению экспертов этой группы, «идеальный» НПВП не должен негативно влиять на здоровый контралатеральный хрящ и в то же время должен стимулировать синтез хрящевой ткани, замедлять резорбцию хряща и ингибировать синтез катаболических цитокинов.По влиянию на метаболизм гиалинового хряща НПВП можно классифицировать препараты, обладающие хондронегативным, хондронейтральным и хондропротективным действием. Хондронегативным влиянием на хрящ обладают индометацин, пироксикам, напроксен и некоторые другие традиционные НПВП, хондронейтральным – ибупрофен, диклофенак, хондропротективным – ацеклофенак, кетопрофен и мелоксикам.
Ацеклофенак (Аэртал) зарекомендовал себя как препарат, обладающий высокой антивоспалительной активностью и хорошей переносимостью.
 Он является производным фенилацетиловой кислоты (2-[2,6 – дихлорфенил) амино] фенилацетоуксусная кислота) и по своей структуре близок к диклофенаку. Препарат не обладает кумулятивной активностью, а его фармакокинетика не зависит от возраста пациентов, что имеет значение при лечении больных с ОА. Антивоспалительное действие ацеклофенака, как и других НПВП, реализуется путем подавления синтеза медиаторов воспаления и прежде всего РGE2. Показано, что у больных ОА с проявлениями вторичного артрита ацеклофенак, по сравнению с диклофенаком, в большей степени снижает уровень РGE2 в синовиальной жидкости, селективно подавляя экспрессию ЦОГ-2. Его терапевтическое действие также связано с ингибированием провоспалительных цитокинов (ИЛ-1, ФНО-a) и повышением уровня синтеза ИЛ-1Ra (антагониста рецепторов к ИЛ-1), снижением экспрессии молекул адгезии, антиоксидантными свойствами ацеклофенака, реализуется влиянием на свободные радикалы, подавлением продукции NO в хондроцитах здоровых и больных ОА, торможением пролиферации синовиоцитов [14–16].
Он является производным фенилацетиловой кислоты (2-[2,6 – дихлорфенил) амино] фенилацетоуксусная кислота) и по своей структуре близок к диклофенаку. Препарат не обладает кумулятивной активностью, а его фармакокинетика не зависит от возраста пациентов, что имеет значение при лечении больных с ОА. Антивоспалительное действие ацеклофенака, как и других НПВП, реализуется путем подавления синтеза медиаторов воспаления и прежде всего РGE2. Показано, что у больных ОА с проявлениями вторичного артрита ацеклофенак, по сравнению с диклофенаком, в большей степени снижает уровень РGE2 в синовиальной жидкости, селективно подавляя экспрессию ЦОГ-2. Его терапевтическое действие также связано с ингибированием провоспалительных цитокинов (ИЛ-1, ФНО-a) и повышением уровня синтеза ИЛ-1Ra (антагониста рецепторов к ИЛ-1), снижением экспрессии молекул адгезии, антиоксидантными свойствами ацеклофенака, реализуется влиянием на свободные радикалы, подавлением продукции NO в хондроцитах здоровых и больных ОА, торможением пролиферации синовиоцитов [14–16].
Как известно, при ОА наблюдается диссонанс между процессами синтеза и деградации хряща, что является одним из характерных проявлений его патогенеза. При изучении образцов хрящевой ткани, полученных при эндопротезировании тазобедренных суставов от больных ОА и лиц без данной патологии, оценивали влияние диклофенака и напроксена на синтез ГАГ. При ОА базальный синтез ГАГ был ниже, чем в образцах нормальной ткани, а степень уменьшения их продукции коррелировала с выраженностью патологического процесса. Ацеклофенак (0,4–10 мкг/мл) значительно увеличивал выработку ГАГ в пораженной ОА хрящевой ткани, в то время как диклофенак в таком же диапазоне концентраций не вызывал никакого эффекта, а напроксен существенно угнетал синтез ГАГ в хрящевой ткани пациентов с ОА (рис. 1).
Особенностью фармакологической активности ацеклофенака и его основного метаболита – 4′-гидроксиацеклофенака является преимущественно подавление ЦОГ-2 и, в меньшей степени, ЦОГ-1 [17]. Другой его метаболит – диклофенак угнетает как ЦОГ-1, так и ЦОГ-2.
 Это и объясняет не только его выраженный антивоспалительный потенциал, но и высокую безопасность. При приеме ацеклофенака соотношение ЦОГ-2 к ЦОГ-1 выше, чем при приеме стандартных НПВП, таких как пироксикам, индометацин, теноксикам и кетопрофен. Преимущественное ингибирование ЦОГ-2 показано, в частности, в культуре нормальных и пораженных ОА хондроцитов при их инкубировании с ацеклофенаком [18].
Это и объясняет не только его выраженный антивоспалительный потенциал, но и высокую безопасность. При приеме ацеклофенака соотношение ЦОГ-2 к ЦОГ-1 выше, чем при приеме стандартных НПВП, таких как пироксикам, индометацин, теноксикам и кетопрофен. Преимущественное ингибирование ЦОГ-2 показано, в частности, в культуре нормальных и пораженных ОА хондроцитов при их инкубировании с ацеклофенаком [18].Рациональность использования ацеклофенака у больных ОА находит свое объяснение не только благодаря его антивоспалительному и анальгетическому свойствам, но и особенностям влияния на метаболизм основного вещества гиалинового хряща (табл. 2). Ацеклофенак стимулирует хондроциты к выработке межклеточного вещества хряща – протеогликанов, ГАГ и коллагена, необходимых для полноценной функции хряща. Он также стимулирует синтез ГАГ в хряще, полученном от больных ОА, в то время как диклофенак и напроксен не обладают такими свойствами. Кроме того, он тормозит преждевременную гибель хондроцитов.
 В эксперименте ацеклофенак демонстрирует хондропротективные свойства, супрессируя ИЛ-1 – опосредованную продукцию MMPs, подавляет экспрессию ИЛ-6 хондроцитами. Он посредством своего основного метаболита 4-гидроксиацеклофенака подавляет проколлагеназу/проММР–1 и простромелизин/проММР-3.
В эксперименте ацеклофенак демонстрирует хондропротективные свойства, супрессируя ИЛ-1 – опосредованную продукцию MMPs, подавляет экспрессию ИЛ-6 хондроцитами. Он посредством своего основного метаболита 4-гидроксиацеклофенака подавляет проколлагеназу/проММР–1 и простромелизин/проММР-3. По своей антивоспалительной активности ацеклофенак при основных воспалительных заболеваниях суставов и позвоночника эквивалентен диклофенаку, пироксикаму, индометацину и теноксикаму. Симптом-модифицирующие его свойства были изучены в нескольких двойных слепых контролируемых исследованиях. Эффективность ацеклофенака в плане подавления основных проявлений ОА, а именно уменьшения интенсивности боли в суставах и нормализации функциональной способности пораженных суставов, существенно выше по сравнению с плацебо и эквивалентна эффективности диклофенака, пироксикама и напроксена. При сравнительной оценке ацеклофенака и диклофенака у 397 больных с гонартрозом достоверная положительная динамика наблюдалась в 2-х группах спустя 12 нед.
 от начала лечения. Однонаправленность изменений касалась не только интенсивности болей или функции суставов, но и глобальной активности болезни [19]. Но все же боль в суставе по оценке пациента при лечении ацеклофенаком уменьшилась более значительно, чем при лечении диклофенаком (снижение на 71 и 59% соответственно).
от начала лечения. Однонаправленность изменений касалась не только интенсивности болей или функции суставов, но и глобальной активности болезни [19]. Но все же боль в суставе по оценке пациента при лечении ацеклофенаком уменьшилась более значительно, чем при лечении диклофенаком (снижение на 71 и 59% соответственно).Симптоматическое действие ацеклофенака при ОА сравнивали и с действием других НПВП. В мультицентровом двойном слепом рандомизированном исследовании изучали эффективность ацеклофенака (200 мг/сут) и напроксена (1000 мг/сут) у 374 больных [20]. В обеих группах к концу 12 нед. наблюдались достоверное снижение интенсивности боли в покое, боли при движении или пальпации сустава, а также разрешение экссудативных явлений в коленных суставах и улучшение их функции. Анализ динамики основных показателей патологического процесса не выявил достоверного различия между группами больных, хотя быстрее положительная динамика отмечалась у больных, которые лечились ацеклофенаком. В другом исследовании ацеклофенак сравнивали с пироксикамом у больных гонартрозом [21].
 По суммарной оценке эффективность этих 2-х препаратов была практически одинаковой, но если ацеклофенак демонстрировал существенное уменьшение боли и нормализацию функции коленного сустава спустя 2 нед. от начала терапии, то пироксикам – только к концу 1-го мес.
По суммарной оценке эффективность этих 2-х препаратов была практически одинаковой, но если ацеклофенак демонстрировал существенное уменьшение боли и нормализацию функции коленного сустава спустя 2 нед. от начала терапии, то пироксикам – только к концу 1-го мес.Рациональность использования ацеклофенака в терапии ОА определяется не только его позитивным действием на метаболизм хрящевой ткани и выраженным антивоспалительным действием, но и его хорошей переносимостью. Это представляется особенно важным, учитывая, что ОА болеют в основном лица пожилого и старческого возраста, которые хуже переносят НПВП, чем лица молодого возраста. Имеют значение и большое количество коморбидных состояний у данной категории пациентов, а также вероятность полипрагмазии и рациональность сочетания отдельных лекарственных препаратов, которыми пациенты регулярно пользуются.
О хорошей переносимости Аэртала свидетельствуют результаты большого 12-месячного проспективного открытого многоцентрового исследования SAMM (Safety Assessment of Marketed Medicines), в котором оценивалась безопасность ацеклофенака и диклофенака у больных с ревматическими заболеваниями [22].
 Это исследование основано на изучении 10 142 больных, причем у преобладающего большинства (91,4%) имелся ОА. Больные 1-й группы (7890 человек) принимали 200 мг/сут ацеклофенака, 2-й группы (2252 человека) – 150 мг/сут диклофенака. Средняя продолжительность приема лекарств в обеих группах была примерно одинаковой и составила для Аэртала 168,1 дня, для диклофенака – 170 дней. Общее число нежелательных явлений (НЯ) было достоверно ниже у больных, принимающих ацеклофенак, по сравнению с больными, которые лечились диклофенаком (р<0,001), что в равной степени относится и к числу больных, прекративших прием препарата из-за его непереносимости. У больных 1-й группы было меньше желудочно-кишечных реакций, чем у больных 2-й группы, причем частота развития тошноты, боли в животе и диареи, приведших к прекращению лечения, была соответственно на 46, 65 и 41% ниже в группе ацеклофенака, чем в группе диклофенака.
Это исследование основано на изучении 10 142 больных, причем у преобладающего большинства (91,4%) имелся ОА. Больные 1-й группы (7890 человек) принимали 200 мг/сут ацеклофенака, 2-й группы (2252 человека) – 150 мг/сут диклофенака. Средняя продолжительность приема лекарств в обеих группах была примерно одинаковой и составила для Аэртала 168,1 дня, для диклофенака – 170 дней. Общее число нежелательных явлений (НЯ) было достоверно ниже у больных, принимающих ацеклофенак, по сравнению с больными, которые лечились диклофенаком (р<0,001), что в равной степени относится и к числу больных, прекративших прием препарата из-за его непереносимости. У больных 1-й группы было меньше желудочно-кишечных реакций, чем у больных 2-й группы, причем частота развития тошноты, боли в животе и диареи, приведших к прекращению лечения, была соответственно на 46, 65 и 41% ниже в группе ацеклофенака, чем в группе диклофенака. Метаанализ результатов 13 двойных слепых рандомизированных исследований безопасности ацеклофенака, в которых приняли участие 3574 больных с ОА, ревматоидным артритом или анкилозирующим спондилоартритом, продемонстрировал лучший профиль безопасности этого препарата по сравнению с таковым классических НПВП, включая диклофенак, индометацин, напроксен, пироксикам и теноксикам [23].
 При лечении ацеклофенаком НЯ встречались в 1,38 раза реже, чем у группы больных, лечившихся традиционными НПВП (р<0,001), при этом отмена терапии в связи с токсичностью ацеклофенака была также достоверно реже, чем у больных группы сравнения.
При лечении ацеклофенаком НЯ встречались в 1,38 раза реже, чем у группы больных, лечившихся традиционными НПВП (р<0,001), при этом отмена терапии в связи с токсичностью ацеклофенака была также достоверно реже, чем у больных группы сравнения.Заслуживает внимания мультицентровое исследование по анализу кровотечений из желудка и двенадцатиперстной кишки, в т.ч. и при приеме НПВП [24]. В результате проведенного исследования оказалось, что 38% всех случаев кровотечений из верхних отделов пищеварительного тракта у лиц старше 18 лет были связаны с приемом НПВП, что составляет 152 случая на 1 млн населения в год. Наиболее высокий риск кровотечения был при приеме кеторолака – 24,7. При приеме рофекоксиба он составлял 7,2, мелоксикама – 5,7, декскетопрофена – 4,9, нимесулида – 3,2, целекоксиба – 0,3 и ацеклофенака – 1,4 (95% СI 0,6, 3,3). Авторы не подтвердили, что селективные ЦОГ-2 НПВП имеют меньший риск развития кровотечений, чем традиционные препараты, и отметили низкий риск этого осложнения у лиц, принимающих ацеклофенак.

Таким образом, ацеклофенак (Аэртал) является НПВП, который по своей антивоспалительной и анальгезирующей активности не уступает стандартным лекарственным препаратам этого класса. Его применение целесообразно при ОА, что обусловлено способностью стимулировать клетки хряща к выработке полноценных протеогликанов, ГАГ, гиалуроновой кислоты и тормозить апоптоз хондроцитов, что является особенно важным в свете современных представлений об ОА как заболевании, которое развивается вследствие преждевременной гибели хондроцитов на самых ранних этапах его развития. Преимущественное влияние ацеклофенака на ЦОГ-2 обеспечивает его хорошую переносимость и высокую безопасность. Позитивные свойства этого препарата повышают уровень комплаентности лечения по сравнению со стандартными НПВП.
Литература
1. Perrot S., Menkes C.J. Nonpharmacological approaches to pain in osteoarthritis. Available options // Drugs. 1996. Vol. 52. Р. 21–26.
2. Sangha O. Epidemiology of rheumatic disease // Rheumatology. 2000. 39 (Suppl. 2). Р. 3–12.
2000. 39 (Suppl. 2). Р. 3–12.
3. Van den Berg W.B. Pathophisiology of osteoarthritis // Joint Bone Spine. 2000. Vol. 67. Р. 555–556.
4. Martel-Pelletier J., Pelletier J.-P. Inflammatory factors involved in osteoarthritis. In: Osteoarthritis, Inflammation and Degradation: A Continuum. IOS Press. 2007. Р. 3–13.
5. HenrotinY., Reginster T. In vitro difference among nonsteroidal antiinflammatory drug in their activities related to osteoarthritis pathophysiology // Osteoarthritis Cartilage. 1999. Vol. 7. Р. 355–357.
6. Huskinsson E.C., Berry P., Gishen P. Effects of antiinflammatory drugs on the progression of osteoarthritis of the knee // J Rheumatol. 1995. Vol. 22. Р. 1941–1946.
7. Abramson S.B. Osteoarthritis and nitric oxide // Osteoarthritis and Cartilage. 2008. Vol. 16 (Suppl 2). Р. 15–20.
8. Herrero-Beaumont G., Rovati L.C. Use of crystalline sulfate in osteoarthritis // Future Rheumatology. 2006. Vol. 1 (4). Р. 397–414.
9. Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. М.: Литтерра, 2003.
Насонова В.А., Насонов Е.Л. Рациональная фармакотерапия ревматических заболеваний. М.: Литтерра, 2003.
10. Ding C. Do NSAID affect the progression of osteoarthritis? // Inflammation. 2002. Vol. 26. Р. 139–142.
11. Mastbergen S.C., Biijlsma J.W., Lefeber F.P. Selective COX-2 inhibition is favorable to human early and latestage osteoarthritis cartilage: a human in vitro study // Osteoarthritis Cartilage. 2005. Vol. 13. Р. 519–526.
12. Kalbhen D.A. The influence of NSAIDs on morphology of articular cartilage // Scand J Rheumatol. 1988. Vol. 77 (Suppl). Р. 13–22.
13. Recommendations for the registration of drug used in the treatment of osteoarthritis // Ann Rheum Dis. 1996. Vol. 55. Р. 552–557.
14. Aceclofenac. Almirall Prodespharma S.A. Barselona, 2003. 120 p.
15. Grau M., Guash J., Montero J.l. et al. Pharmacology of the potent new non-steroidal inflammatory agent aceclofenac // Arzneimittelforschung. 1991. Vol. 41. Р. 1265–1276.
16. Murherjee P., Rachita C., Aisen P.S., Pasinetti G.M. Non-steroidal anti-inflammatory drugs protect against chondrocyte apoptotic death // Clin Eхp Rheumatol. 2001. Vol. 19 (Suppl. 22). Р. 7–11.
17. Henrotin Y., De Leval Х, Mathy-Hartet M et al. In vitro effects of aceclofenac and its metabolites on the production by chondrocytes of inflammatory mediators // Inflamm Res. 2001. Vol. 50. Р. 391–399.
18. Blanco F.J., Maneiro E., de Toro F.J. et al. Effect of NSAIDs on synthesis of IL-1 receptor by human articular chondrocytes // Lab Invest Rheumatol. 2000. THO 17.
19. Ward D.E., Veys E.M., Bowdler J.M., Roma J. Comparison of aceclofenac with diclofenac in the treatment of osteoarthris // Clin Rheumatol. 1995. Vol. 14. Р. 656–662.
20. Korsanoff D., Frerick H., Bowdler J., Montull E. Aceclofenac is well-tolerated alternative to naproхen in the treatment osteoarthritis // Clin Rheumatol. 1997. Vol. 16. Р. 32–38.
21. Perez Busquer M. , Calero E., Rodriguez M. et al. Comparison of aceclofenac with рiroхicam in the treatment of osteoarthritis // Clin Rheumatol. 1997. Vol. 16. Р. 154–159.
, Calero E., Rodriguez M. et al. Comparison of aceclofenac with рiroхicam in the treatment of osteoarthritis // Clin Rheumatol. 1997. Vol. 16. Р. 154–159.
22. Huskisson E., Irani M., Murray F. A large prospective open-label, multicentre SAMM study, comparing the safety of aceclofenac in patients with rheumatic disease // Eur J Rheumatol Inflamm. 2000. Vol. 7. Р. 1–7.
23. Peris F., Bird H.A., Serni U. et al. Treatment compliance and safety of aceclofenac versus NSAIDs in patients with common arthritis disorders: a meta-analysis // Eur J Rheumatol Inflamm. 1996. Vol. 16. Р. 37–45.
24. Laporte J.-R., Ibanez L., Vidal Х. et al. Upper gastrointestinal bleedng accociated with the use NSAIDs. Newer versus older agents // Drug Safety. 2004. Vol. 27 (6). Р. 411–420.
Нестероидные противовоспалительные препараты в лечении при остеоартрозе: оптимизация применения с учетом факторов риска сердечно-сосудистых и гастроинтестинальных осложнений
Введение
Остеоартроз является одним из наиболее частых заболеваний опорно-двигательного аппарата.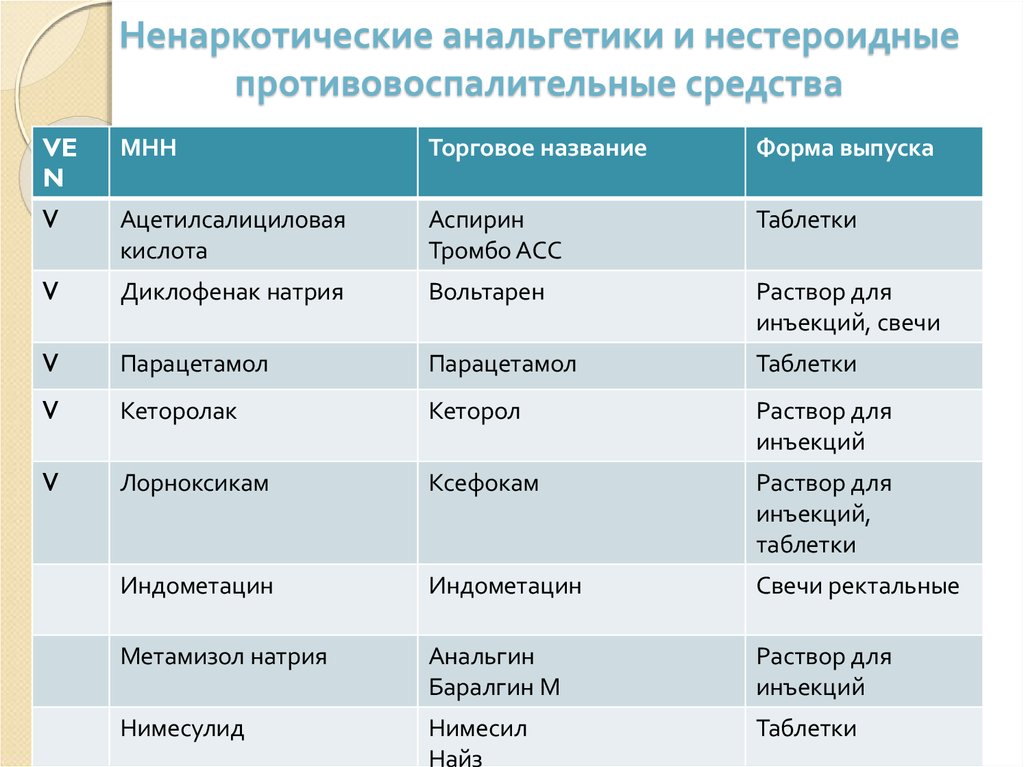 При этом распространенность данной патологии значительно варьирует в географическом разрезе. Данный показатель в Украине составляет 2,2% (2200 на 100 тыс. населения), заболеваемость — 497 человек на 100 тыс. населения, что значительно меньше, чем в США, что, возможно, обусловлено гиподиагностикой остеоартроза в нашей стране (Поворознюк В.В., Быстрицкая М.А., 2011). При этом поражение компонентов опорно-двигательного аппарата чаще отмечают у женщин, чем у мужчин, и у лиц старшего возраста (Чичасова Н.В., 2011).
При этом распространенность данной патологии значительно варьирует в географическом разрезе. Данный показатель в Украине составляет 2,2% (2200 на 100 тыс. населения), заболеваемость — 497 человек на 100 тыс. населения, что значительно меньше, чем в США, что, возможно, обусловлено гиподиагностикой остеоартроза в нашей стране (Поворознюк В.В., Быстрицкая М.А., 2011). При этом поражение компонентов опорно-двигательного аппарата чаще отмечают у женщин, чем у мужчин, и у лиц старшего возраста (Чичасова Н.В., 2011).
Как известно, остеоартроз относится к дегенеративным поражениям суставов, тем не менее для его течения также характерно развитие синовита, что является показанием для назначения препаратов, купирующих воспалительный процесс. Кроме того, воспалительным процессам, протекающим в суставе, часто сопутствует болевой синдром, который, однако, не всегда коррелирует по своей интенсивности с выраженностью воспаления (Чичасова Н.В., 2011).
В патогенезе остеоартроза важную роль играет воспаление и дисрегуляция цитокинового каскада, которая способствует нарушению баланса между анаболическими и катаболическими процессами. В исследованиях in vitro и in vivo показана роль провоспалительных цитокинов — интерлейкина-1 и фактора некроза опухоли-α в развитии патологических изменений хряща, а также оксида азота и различных металлопротеиназ, которые деградируют межклеточный матрикс (Goldring M.B., Berenbaum F., 2004; Kobayashi M. et al., 2005; Bondeson J. et al., 2006; Goldring M.B. et al., 2008). Не менее важное значение в развитии остеоартроза имеют возрастные изменения и биомеханическое воздействие.
В исследованиях in vitro и in vivo показана роль провоспалительных цитокинов — интерлейкина-1 и фактора некроза опухоли-α в развитии патологических изменений хряща, а также оксида азота и различных металлопротеиназ, которые деградируют межклеточный матрикс (Goldring M.B., Berenbaum F., 2004; Kobayashi M. et al., 2005; Bondeson J. et al., 2006; Goldring M.B. et al., 2008). Не менее важное значение в развитии остеоартроза имеют возрастные изменения и биомеханическое воздействие.
В терапии при остеоартрозе широко применяют нестероидные противовоспалительные препараты (НПВП), которые, согласно рекомендациям OARSI (2008) по лечению остеоартроза коленного и тазобедренного суставов, характеризуются наибольшей доказательностью (степень доказательности 93% из 100% возможных) (Zhang W. et al., 2008; Поворознюк В.В., Быстрицкая М.А., 2011).
Таким образом, НПВП являются препаратами первого ряда симптоматического лечения при остеоартрозе. Анальгезирующий и противовоспалительный эффект НПВП обусловлен неселективным ингибированием циклооксигеназы (ЦОГ) — фермента, катализирующего синтез простаноидов, в том числе простагландинов, простациклинов и тромбоксанов. Простаноиды — медиаторы воспаления, боли, терморегуляции; они имеют большое значение для регулирования функций сосудов, почек, костной ткани, желудочно-кишечного тракта и других органов и тканей. Известны три изоформы ЦОГ, наибольшее значение имеют ЦОГ-1 и -2. ЦОГ-1 выявляют во всех тканях, и ее продукция не зависит от воспаления. Экспрессия ЦОГ-2 связана с воспалением и индуцируется медиаторами воспаления — липополисахаридами, интерлейкином-1, фактором некроза опухоли-α в клетках и тканях (Rainsford K.D., 2007; Лапина Т.Л., 2013).
Простаноиды — медиаторы воспаления, боли, терморегуляции; они имеют большое значение для регулирования функций сосудов, почек, костной ткани, желудочно-кишечного тракта и других органов и тканей. Известны три изоформы ЦОГ, наибольшее значение имеют ЦОГ-1 и -2. ЦОГ-1 выявляют во всех тканях, и ее продукция не зависит от воспаления. Экспрессия ЦОГ-2 связана с воспалением и индуцируется медиаторами воспаления — липополисахаридами, интерлейкином-1, фактором некроза опухоли-α в клетках и тканях (Rainsford K.D., 2007; Лапина Т.Л., 2013).
Необходимо учитывать, что терапия пациентов с остеоартрозом осложняется тем, что большинство из них — люди пожилого возраста, для которых характерно наличие широкого спектра сопутствующих заболеваний и, соответственно, применение препаратов для их лечения. Указанные аспекты являются факторами риска развития побочных эффектов при применении НПВП. Сегодня проблема коморбидности в различных терапевтических направлениях чрезвычайно актуальна, что во многом обусловлено постарением населения во всем мире.
В последнее время проблема коморбидности в контексте терапии при остеоартрозе нашла широкое развитие. В частности проведено несколько исследований, позволяющих всесторонне оценить распространенность сопутствующих заболеваний и их структуру в группе пациентов с заболеваниями опорно-двигательного аппарата, в том числе больных остеоартрозом.
Результаты анализа данных о более 9 тыс. пациентов, у 60% из которых была сопутствующая патология, выявили среди наиболее частых сопутствующих заболеваний артериальную гипертензию, сердечную недостаточность, сахарный диабет, ишемическую болезнь сердца, заболевания почек, инсульт, инфаркт миокарда (ИМ) и заболевания печени (Чичасова Н.В., 2011).
В другом исследовании при сравнении частоты развития сопутствующих заболеваний у 11 375 пациентов с остеоартрозом по сравнению с 11 780 пациентами без данной патологии показано повышение частоты развития на фоне остеоартроза ожирения (в 2,25 раза), гастрита (в 1,98 раза), флебита (в 1,8 раза), грыжи диафрагмы (в 1,8 раза), ишемической болезни сердца (в 1,73 раза), дивертикулеза кишечника (в 1,63 раза ) (Kadam U. T. et al., 2004).
T. et al., 2004).
Известно, что применение некоторых НПВП связано с развитием побочных эффектов, которые могут усугублять течение артериальной гипертензии, снижать эффективность антигипертензивной терапии, негативно влиять на состояние пациентов с застойной сердечной недостаточностью (Heerdink E.R. et al., 1998; Page J., Henry D., 2000; Warksman J.C., 2007; Чичасова Н.В., 2011).
Таким образом, необходимо принимать во внимание как достаточно частое развитие побочных эффектов при применении НПВП при остеоартрозе, так и их возможное влияние на характер течения сопутствующей патологии, особенно у пациентов пожилого возраста. Особенного внимания заслуживает этот вопрос в свете того, что такие пациенты принимают НПВП в 4 раза чаще, чем лица молодого возраста (Балабанова Р.М., Егорова О.Н., 2011).
В этом контексте для лечения при хроническом болевом синдроме, в том числе при остеоартрозе, особенно у пациентов пожилого возраста, препаратами выбора являются частично селективные ингибиторы ЦОГ-2, поскольку они обладают более низким риском развития гастроинтестинальных осложнений по сравнению с неселективными НПВП (например диклофенак) и более низким риском кардиоваскулярных осложнений по сравнению с селективными НПВП (различные коксибы).
Одним из наиболее изученных препаратов этой группы является мелоксикам, применяемый с 1995 г. (Поворознюк В.В., Быстрицкая М.А., 2011). Мелоксикам обладает противовоспалительным, обезболивающим и жаропонижающим свойствами, связанными с селективным ингибированием ЦОГ-2. При этом он структурно отличается от других ингибиторов ЦОГ-2, например коксибов, в связи с чем связывается с верхней частью канала ЦОГ-2, а не с боковой, как целекоксиб (Чичасова Н.В., 2011). Мелоксикам легко проникает в синовиальную жидкость, где его концентрация составляет 45–57% таковой в плазме крови (Warksman J.C., 2007).
Эффективность мелоксикама
Эффективность мелоксикама при лечении пациентов с остеоартрозом доказана в ходе многих клинических исследований. Так, согласно результатам 11 рандомизированных двойных слепых клинических исследований, проанализированных в рамках систематического обзора, в котором оценивали эффективность частично селективных НПВП по сравнению с неселективными НПВП, достоверных различий в эффективности мелоксикама (7,5; 15 или 22,5 мг) у пациентов с остеоартритом коленных суставов в сравнении с другими НПВП (диклофенак 100–150 мг/сут, пироксикам 20 мг/сут, напроксен 750 мг/сут) не отмечено (Chou R. et al., 2011). Аналогичные результаты получены в 12-недельном двойном слепом плацебо-контролируемом клиническом исследовании эффективности и безопасности применения мелоксикама при остеоартрозе. Показано, что мелоксикам также эффективен в лечении при остеоартрозе, как и неселективные НПВП (диклофенак, пироксикам) (Dekueker J. et al., 1998; Yocum D. et al., 2000).
et al., 2011). Аналогичные результаты получены в 12-недельном двойном слепом плацебо-контролируемом клиническом исследовании эффективности и безопасности применения мелоксикама при остеоартрозе. Показано, что мелоксикам также эффективен в лечении при остеоартрозе, как и неселективные НПВП (диклофенак, пироксикам) (Dekueker J. et al., 1998; Yocum D. et al., 2000).
Что касается сравнения эффективности мелоксикама и селективных НПВП, то имеется достаточно ограниченное количество крупных клинических исследований, проведенных с целью прямого сравнения терапевтического потенциала этих препаратов. Тем не менее, например в исследовании с участием пациентов с ревматоидным артритом, эффективность мелоксикама (15 мг) и целекоксиба (200 мг) была сопоставима (Shi W. et al., 2004).
Таким образом, мелоксикам не уступает в эффективности как неселективным, так и селективным НПВП. В этих условиях на первый план выходит профиль безопасности — вероятность развития побочных эффектов, переносимость и взаимодействие с другими лекарственными средствами.
Особенности профиля безопасности мелоксикама в сравнении с неселективными и селективными НПВП
При длительном применении мелоксикама, особенно у пациентов старшего возраста, особое внимание необходимо уделить профилю его безопасности.
Среди наиболее распространенных побочных эффектов, характерных для НПВП, выделяют гастроинтестинальные и сердечно-сосудистые осложнения.
Риск развития гастроинтестинальных побочных эффектов (как основных для группы НПВП) зависит от влияния препарата на ЦОГ-1, то есть его ЦОГ-2- селективности. Мелоксикам обладает высокой ЦОГ-2-селективностью (индекс ЦОГ-2- селективности составляет 0,09), которая обусловливает более низкий риск развития побочных эффектов со стороны желудочно-кишечного тракта) (Поворознюк В.В., Быстрицкая М.А., 2011).
Так, наряду с сопоставимой эффективностью, по сравнению с диклофенаком и пироксикамом, мелоксикам характеризуется лучшей переносимостью, что доказано в ряде клинических исследований, в том числе с наивысшим уровнем доказательности (Dekueker J. et al., 1998; Yocum D. et al., 2000). Согласно результатам двух крупных 4-недельных рандомизированных клинических исследований MELISSA и SELECT, в которых суммарно приняли участие почти 18 тыс. пациентов, мелоксикам (7,5 мг/сут) обладал более благоприятным профилем безопасности в отношении развития гастроинтестинальных побочных эффектов по сравнению с неселективными НПВП (Dekueker J. et al., 1998; Hawkey C. et al., 1998). Результаты исследования MELISSA продемонстрировали, что применение мелоксикама достоверно реже, чем диклофенака, приводило к развитию побочных эффектов со стороны желудочно-кишечного тракта — 13,3 и 18,7% соответственно. В клиническом исследовании SELECT мелоксикам показал достоверное преимущество, по сравнению с пироксикамом, относительно риска развития серьезных побочных реакций со стороны желудочно-кишечного тракта. Также при применении мелоксикама реже по сравнению с пироксикамом отмечены такие побочные эффекты, как диспепсия: 10,3 и 15,4 соответственно.
et al., 1998; Yocum D. et al., 2000). Согласно результатам двух крупных 4-недельных рандомизированных клинических исследований MELISSA и SELECT, в которых суммарно приняли участие почти 18 тыс. пациентов, мелоксикам (7,5 мг/сут) обладал более благоприятным профилем безопасности в отношении развития гастроинтестинальных побочных эффектов по сравнению с неселективными НПВП (Dekueker J. et al., 1998; Hawkey C. et al., 1998). Результаты исследования MELISSA продемонстрировали, что применение мелоксикама достоверно реже, чем диклофенака, приводило к развитию побочных эффектов со стороны желудочно-кишечного тракта — 13,3 и 18,7% соответственно. В клиническом исследовании SELECT мелоксикам показал достоверное преимущество, по сравнению с пироксикамом, относительно риска развития серьезных побочных реакций со стороны желудочно-кишечного тракта. Также при применении мелоксикама реже по сравнению с пироксикамом отмечены такие побочные эффекты, как диспепсия: 10,3 и 15,4 соответственно.
Таким образом, в отношении частоты гастроинтестинальных побочных эффектов мелоксикам обладает выраженным преимуществом по сравнению с неселективными НПВП, в том числе диклофенаком, обладая при этом сопоставимой эффективностью.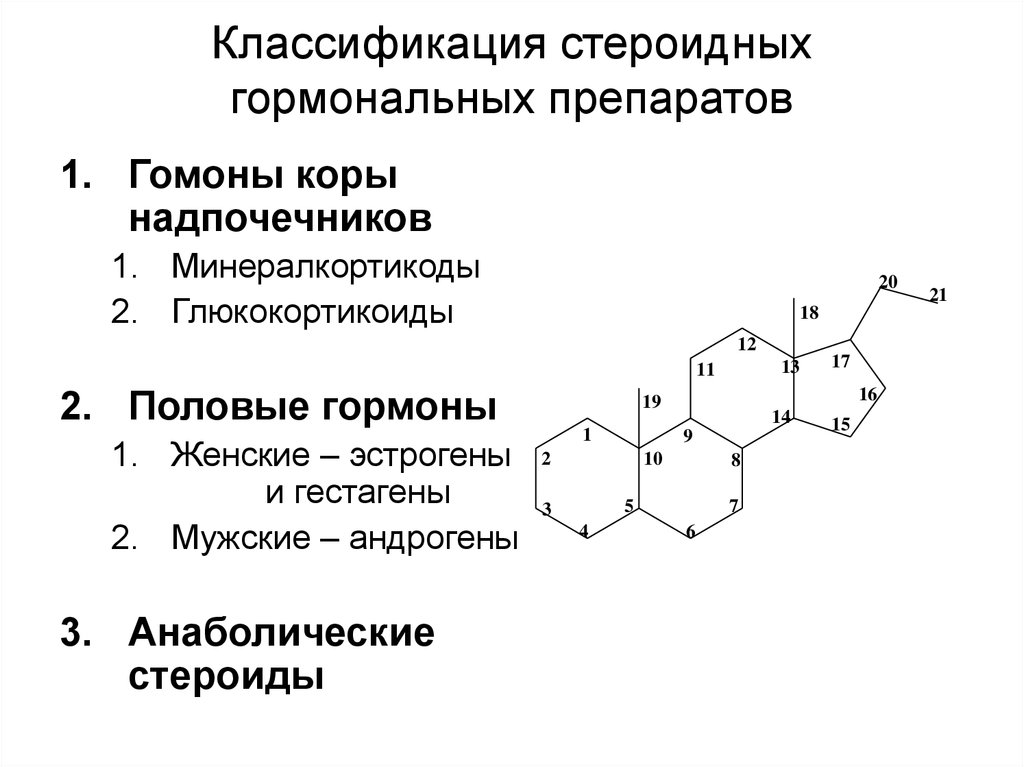
Оценка кардиоваскулярных рисков при выборе НПВП приобретает чрезвычайно важное значение в терапии пациентов старшего возраста, у которых часто ревматическая патология сопровождается развитием атеросклероза и высоким риском смертности от кардиоваскулярных осложнений (Елисеев М.С., Барскова В.Г., 2010). Особый интерес к этой группе побочных реакций НПВП возник после исследований VIGOR, CLASS (Bombardier C. et al., 2000; Silverstein F.E. et al., 2000), в которых высокий относительный риск кардиоваскулярных осложнений получен у препаратов с низким гастроинтестинальным риском, к которым, как известно, относятся селективные НПВП. Так, результаты исследования VIGOR продемонстрировали значительно большую частоту развития ИМ у пациентов с ревматоидным артритом, применявших селективный НПВП рофекоксиб, по сравнению с неселективным НПВП напроксеном. Такой высокий уровень кардиоваскулярных осложнений при применении селективных НПВП может быть связан с тем, что некоторые из них подавляют синтез простациклина и недостаточно влияют на продукцию тромбоксанов, регулирующих агрегацию тромбоцитов и время кровотечения. При этом может нарушаться равновесие между синтезом тромбоксанов, оказывающего протромбогенное действие, и «антитромбогенных» эйкозаноидов (простациклин), что ведет к повышению риска развития тромбоза (Елисеев М.С., Барскова В.Г., 2010).
При этом может нарушаться равновесие между синтезом тромбоксанов, оказывающего протромбогенное действие, и «антитромбогенных» эйкозаноидов (простациклин), что ведет к повышению риска развития тромбоза (Елисеев М.С., Барскова В.Г., 2010).
Отметим, что в этом аспекте свойства мелоксикама в значительной степени отличаются от селективных НПВП. В частности, согласно результатам клинического исследования, у пациентов с ревматоидным артритом применение мелоксикама в дозе 7,5 мг/сут в течение 14 дней не оказывало существенного влияния на агрегацию тромбоцитов, длительность кровотечения и уровень тромбоксанов. При этом применение напроксена в дозе 500 мг/сут приводило к более чем 2-кратному снижению уровня тромбоксанов — с 228 до 117 пг/мл по сравнению с 246 пг/мл при применении мелоксикама (Knijff-Dutmer E.A. et al., 2002). Также прием напроксена способствовал подавлению агрегации тромбоцитов, что значительно увеличивало время кровотечения.
В другом исследовании показано, что мелоксикам, в отличие от неселективного НПВП индометацина, не оказывает влияния на индуцированную коллагеном или арахидоновой кислотой агрегацию тромбоцитов (De Meijer A. et al., 1999). Приведенные данные свидетельствуют в пользу частичной селективности мелоксикама в отношении ЦОГ-2 по сравнению селективными НПВП.
et al., 1999). Приведенные данные свидетельствуют в пользу частичной селективности мелоксикама в отношении ЦОГ-2 по сравнению селективными НПВП.
Согласно результатам метаанализа, включившего данные о более чем 20 тыс. пациентов из почти 30 исследований, риск сердечно-сосудистых осложнений при применении мелоксикама (в дозе 7,5 и 15 мг/сут) значительно ниже такового для неселективных НПВП (Singh G. et al., 2004).
Это подтверждают данные еще одного исследования, в котором сравнивали профиль цереброваскулярной безопасности мелоксикама и селективного НПВП целекоксиба. Согласно полученным результатам, уже спустя 3 мес лечения частота развития цереброваскулярных тромбоэмболических побочных эффектов при применении целекоксиба была достоверно выше, чем при лечении мелоксикамом, и тенденция к увеличению этих различий сохранялась на протяжении 9 мес наблюдения (Layton D. et al., 2003). Согласно данным другого исследования, риск развития ИМ при применении мелоксикама сопоставим с таковым для целекоксиба и ибупрофена (Каратеев А. Е., 2013).
Е., 2013).
Еще в одном исследовании изучена вероятность развития инсульта у пациентов с артритом при применении различных НПВП. Согласно полученным данным, относительный риск развития инсульта при применении мелоксикама был наиболее низким — 0,88 — по сравнению с таковым при применении других препаратов: для рофекоксиба он составил 1,26, метиндола —1,26, пироксикама — 1,25, напроксена — 1,24, вальдекоксиба — 1,22, ибупрофена — 1,19, набуметона — 1,01, диклофенака — 0,98 и целекоксиба — 0,97 (Елисеев М.С., Барскова В.Г., 2010).
Еще более интересными представляются результаты рандомизированного проспективного клинического исследования, проведенного R. Altman и соавторами (2002), которые позволяют предположить, что применение мелоксикама может оказывать благоприятное действие при остром коронарном синдроме. Так, при применении мелоксикама в сочетании со стандартной антитромботической терапией (ацетилсалициловая кислота и гепарин) у пациентов с острым коронарным синдромом (без подъема сегмента ST) отмечено снижение частоты кардиоваскулярных катастроф по сравнению с пациентами, не получавшими мелоксикам. Кроме того, по сравнению с группой получавших только ацетилсалициловую кислоту и гепарин, в группе дополнительно принимавших мелоксикам зарегистрирована более низкая частота приступов стенокардии (15% против 35%), потребности в реваскуляризации миокарда, ИМ и смерти (10% против 26,7%).
Кроме того, по сравнению с группой получавших только ацетилсалициловую кислоту и гепарин, в группе дополнительно принимавших мелоксикам зарегистрирована более низкая частота приступов стенокардии (15% против 35%), потребности в реваскуляризации миокарда, ИМ и смерти (10% против 26,7%).
Другим важным вопросом, которому часто не уделяют достаточно внимания, являются побочные эффекты НПВП, приводящие к нарушениям функции почек. Профиль безопасности мелоксикама изучен в 4-недельном клиническом исследовании с участием пациентов старшего возраста с ревматическими заболеваниями и сопутствующим поражением почек. Показано, что применение мелоксикама в дозе 15 мг/сут не сопровождается значительными изменениями клиренса креатинина и повышением уровня креатинина, мочевины и калия в плазме крови. При этом гастроинтестинальные побочные эффекты отмечены лишь у 5% пациентов (Bevis P.J. et al., 1996).
Взаимодействие мелоксикама с другими лекарственными средствами
Как правило, пациенты старшего возраста наряду с НПВП нередко применяют и другие лекарственные средства для коррекции в том числе сопутствующей патологии. Важно учитывать совместимость применения данных препаратов с НПВП.
Важно учитывать совместимость применения данных препаратов с НПВП.
Отметим, что мелоксикам в организме человека не вступает во взаимодействие с другими лекарственными средствами, включая цитостатики, сердечные гликозиды, диуретики и др. Такие свойства препарата имеют решающее значение наряду с профилем безопасности при выборе рациональной терапии пациентов с сопутствующими заболеваниями, особенно если это лица пожилого возраста (Балабанова Р.М., Егорова О.Н., 2011).
Выводы
1. Представленные результаты многочисленных клинических исследований, в том числе с наивысшим уровнем доказательности, свидетельствуют о том, что мелоксикам является препаратом выбора у пациентов с остеоартрозом, особенно лиц пожилого возраста, благодаря особенностям его фармакокинетики, приемлемому профилю безопасности и совместимости с другими лекарственными средствами.
2. Применение мелоксикама целесообразно у пациентов, особенно старшего возраста, с высоким риском развития нарушений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы в связи с наличием коморбидной патологии.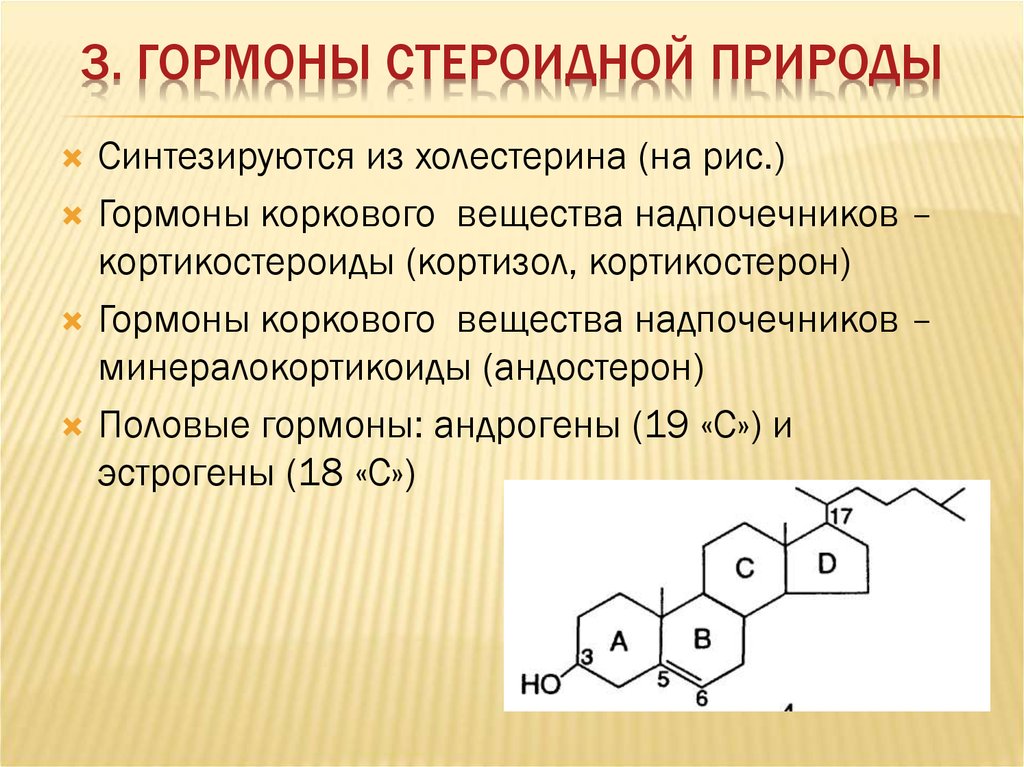
Список использованной литературы
Влияние анаболических стероидов на физиологические процессы и упражнения
Оригинальный редактор — Лестер Райан Ведущие участники — Кайли Волк , Мэтью Вульф , Кристин Коловски0 ,
Райан Лестер , Мэддисен Коулман , Эмили Норт , Роберт Лонг , Люсинда Хэмптон , Челси Миллер , Лэндон Эндрюс , Брэнди Киндигер , Ванда ван Никерк , Кайл Калвер , Саманта МакГроу , Грэм Макинтайр , Тейлор Ледфорд и Кэти Сандерс Содержание 046
- 1 Введение
- 2 осложнения
- 2.1 Влияние на сердечно-сосудистую систему
- 3 Мышечные эффекты
- 4 Неврологические эффекты
- 5 Сдерживание и обучение пациентов
- 6 Каталожные номера
Злоупотребление анаболическими андрогенными стероидами (ААС) часто связано с широким спектром побочных эффектов. Подростки и спортсмены часто злоупотребляют этими препаратами в эстетических целях, а также для повышения выносливости и работоспособности [1] .
Подростки и спортсмены часто злоупотребляют этими препаратами в эстетических целях, а также для повышения выносливости и работоспособности [1] .
Анаболические андрогенные стероиды (ААС) представляют собой группу синтетических соединений, которые имитируют действие тестостерона на организм [2] . Злоупотребление ААС может иметь серьезные последствия для сердечно-сосудистой системы, функции печени, надпочечников и почек [3] . Как следует из названия, ААС имеет два основных эффекта: андрогенный и анаболический. Андрогенные эффекты увеличивают вторичные мужские половые признаки, тогда как анаболические эффекты увеличивают синтез белка [3] . Последний эффект является причиной того, что многие люди злоупотребляют ААС с целью увеличения сухой мышечной массы.
Это интересное 7-минутное видео обобщает тему
[4]
- Андрогены имеют различные побочные эффекты.
 Осложнения включают:
Осложнения включают:- Гипертрофия сердца
- Снижение холестерина ЛПВП в сыворотке
- Гипогонадизм после прекращения приема экзогенных андрогенов
- Нейропсихиатрические проблемы
Многие исследования показывают связь между немедицинским использованием андрогенов и увеличением рискованного и преступного поведения среди лиц, злоупотребляющих приемом андрогенов. При опросе 10 000–15 000 студентов колледжей употребление андрогенов сильно коррелировало с вождением в нетрезвом виде, курением сигарет, незаконным употреблением наркотиков и злоупотреблением алкоголем.
- Анаболические стероиды полностью запрещены в спорте как во время соревнований, так и вне их. Следующие организации запрещают прием анаболических стероидов в спорте:
- Национальная студенческая спортивная ассоциация (NCAA)
- Международный олимпийский комитет (МОК)
- Антидопинговое агентство США (USADA)
- Всемирное антидопинговое агентство (ВАДА)
- Злоупотребление анаболическими стероидами происходит на спортивных соревнованиях и в тренажерных залах; эти наркотики можно купить на улице или заказать по почте.
 Большая часть нелегального использования андрогенов связана с анаболическими стероидами, которые контрабандой ввозятся в США. [5]
Большая часть нелегального использования андрогенов связана с анаболическими стероидами, которые контрабандой ввозятся в США. [5]
Длительное применение ААС в сверхфизиологических дозах связано с развитием патологических изменений в сердечно-сосудистой системе. Пользователи ААС подвержены повышенному риску инфаркта миокарда, кардиомиопатии, внезапной смерти, сердечно-сосудистых заболеваний и смертности по сравнению с теми, кто не принимает [6] .
Злоупотребление ААС бодибилдерами связано с:
- инфаркт миокарда
- кардиомиопатия
- внезапная смерть
- повышенное кровяное давление и повышенный риск тромбоза [7] [8] .
- вариабельность сердечного ритма (ВСР) ниже, чем у не употребляющих наркотики, что подвергает их повышенному риску вегетативной сердечно-сосудистой дисфункции и желудочковой аритмии [9] .

- Мерцательная аритмия (ФП) [10] — Это может быть связано с меж- и внутрипредсердной электромеханической задержкой.
- снижение вагусной и парасимпатической активности сердца [9] [11] . Снижение парасимпатической активности сердца замедляет восстановление частоты сердечных сокращений после физической нагрузки. [9] Однако точный механизм того, как злоупотребление ААС способствует электромеханической задержке предсердий, плохо изучен [12]
- дисфункция левого желудочка. В исследовании 2007 года, опубликованном в Британском журнале спортивной медицины, с использованием допплеровского анализа миокарда и деформационной визуализации было обнаружено, что хроническое злоупотребление ААС приводит к гораздо более низкой ранней диастолической пиковой скорости на уровне боковой стенки левого желудочка и межжелудочковой перегородки [13] .
- Гипертония
- ремоделирование желудочков и
- ишемия миокарда [14] .

Нормальные адаптивные механизмы сердца в ответ на физическую нагрузку подвергаются негативному воздействию как экзогенных, так и эндогенных стероидов, что приводит к клеточным изменениям, подобным тем, которые проявляются при сердечной недостаточности и кардиомиопатии [14] . Эти эффекты сохраняются долгое время после прекращения использования и оказывают значительное влияние на последующую заболеваемость и смертность [14] .
ААС используют три физиологических механизма в мышечной системе, чтобы оказывать свое действие.
- На клеточном уровне ААС увеличивает синтез белка посредством транскрипции генов после связывания с андрогенными рецепторами [15] .
- ААС препятствует связыванию глюкокортикоидов с их рецепторами. Это важно, потому что глюкокортикоиды вызывают катаболические эффекты, подавляя синтез белка [15] .
- ААС оказывает психологическое воздействие на пользователей, вызывая эйфорию, побуждая пользователей работать усерднее во время тренировок [15] .
 В свою очередь, использование ААС может привести к рабдомиолизу, вызывая перенапряжение [16] [17] [18] [19] [20] .
В свою очередь, использование ААС может привести к рабдомиолизу, вызывая перенапряжение [16] [17] [18] [19] [20] .
Спортсмены используют ААС для улучшения результатов, поскольку ААС вызывают гипертрофию мышц и синтез белка [особенно в сочетании с упражнениями с отягощениями] [21] .
- Станозолол значительно увеличил размер мышечных волокон I типа [22] , гипотетически гипертрофия волокон I типа позволяет спортсменам тренироваться дольше, что, в свою очередь, вызывает гипертрофию волокон II типа [22] .
- Стероиды не повышают концентрацию креатина в мышцах [23] .
- Инъекция 600 мг тестостерона взрослым мужчинам, которые не занимались физическими упражнениями, привела к большему увеличению силы и безжировой массы, чем у лиц, которые включали тренировки с отягощениями, но принимали только плацебо [23] .
- ААС повышает переносимость физических нагрузок, мышечную выносливость и беговую выносливость у крыс.
 В исследовании 2001 года измерялось общее количество поднятых весов, общее количество подходов, 10 повторений на максимум (ПМ) и количество полных подходов при 10ПМ 9.0079 [21] . Крысы в группе стероидов работали на 47%, 12%, 22% и 81% лучше в этих областях соответственно [21] . Исследование показало , что прием ААС перед однократным изнурительным упражнением по поднятию тяжестей повышает устойчивость задействованных мышц к утомлению и увеличивает синтез белка [21] .
В исследовании 2001 года измерялось общее количество поднятых весов, общее количество подходов, 10 повторений на максимум (ПМ) и количество полных подходов при 10ПМ 9.0079 [21] . Крысы в группе стероидов работали на 47%, 12%, 22% и 81% лучше в этих областях соответственно [21] . Исследование показало , что прием ААС перед однократным изнурительным упражнением по поднятию тяжестей повышает устойчивость задействованных мышц к утомлению и увеличивает синтез белка [21] . - Лечение ААС в сочетании с физическими упражнениями отсрочивает утомление во время субмаксимальных упражнений, возможно, из-за вызванной ААС трансформации мышечных волокон [24] .
- ААС могут способствовать развитию мышц и силы у пожилых людей. Использование ААС может принести пользу тем, кто восстанавливается после операции на бедре [25] . Рандомизированное контролируемое исследование 274 пожилых мужчин с ослабленным здоровьем пришло к выводу, что введение тестостерона может улучшить качество жизни за счет улучшения силы, физических функций и состава тела.
 [26] ААС могут увеличить силу четырехглавой мышцы бедра после тотальной атропластики коленного сустава (ТКА), но не было изменений в результатах, связанных с повседневной деятельностью, такой как сила подколенного сухожилия, тест в положении сидя или стоя или скорость ходьбы. [27] Доказательства в поддержку применения ААС после ТЭК незначительны, но есть некоторые предположения, что применение ААС может принести пользу тем, кто перенес хирургическое вмешательство. [27]
[26] ААС могут увеличить силу четырехглавой мышцы бедра после тотальной атропластики коленного сустава (ТКА), но не было изменений в результатах, связанных с повседневной деятельностью, такой как сила подколенного сухожилия, тест в положении сидя или стоя или скорость ходьбы. [27] Доказательства в поддержку применения ААС после ТЭК незначительны, но есть некоторые предположения, что применение ААС может принести пользу тем, кто перенес хирургическое вмешательство. [27]
Существует корреляция между применением ААС и разрывом сухожилия верхней конечности.
- Из 88 пользователей ААС в одном исследовании у 17% были подтверждены разрывы сухожилий трицепса или бицепса, по сравнению с теми, кто не принимал ААС [28] . Между двумя группами не было обнаружено существенных различий в отношении разрывов сухожилий нижних конечностей [28] . Механизм разрыва сухожилия, связанного с ААС, изучен недостаточно.
 Одна из гипотез состоит в том, что использование ААС в сочетании с интенсивными физическими упражнениями может вызвать структурное повреждение сухожилий. Большинство доказательств, подтверждающих эту гипотезу, получено в исследованиях на животных [28] . В одном исследовании были обнаружены ультраструктурные изменения в сухожилиях мышей, получавших ААС [29] , но убедительных доказательств структурных изменений в сухожилиях человека не было продемонстрировано [28] . В исследовании случай-контроль сравнивали ультраструктуру коллагена, метаболизм и механические свойства сухожилий надколенника у 24 человек, распределенных по трем группам: тренирующиеся с отягощениями пользователи ААС (RTS), тренирующиеся с отягощениями пользователи без ААС (RT) и контрольная группа. группа, которая не использовала ни ААС, ни тренировку с отягощениями (CTRL). Более высокая жесткость надколенника и модуль упругости были обнаружены в группе RTS, но не было существенной разницы в механических и материальных свойствах сухожилий между группами RTS и RT [30] .
Одна из гипотез состоит в том, что использование ААС в сочетании с интенсивными физическими упражнениями может вызвать структурное повреждение сухожилий. Большинство доказательств, подтверждающих эту гипотезу, получено в исследованиях на животных [28] . В одном исследовании были обнаружены ультраструктурные изменения в сухожилиях мышей, получавших ААС [29] , но убедительных доказательств структурных изменений в сухожилиях человека не было продемонстрировано [28] . В исследовании случай-контроль сравнивали ультраструктуру коллагена, метаболизм и механические свойства сухожилий надколенника у 24 человек, распределенных по трем группам: тренирующиеся с отягощениями пользователи ААС (RTS), тренирующиеся с отягощениями пользователи без ААС (RT) и контрольная группа. группа, которая не использовала ни ААС, ни тренировку с отягощениями (CTRL). Более высокая жесткость надколенника и модуль упругости были обнаружены в группе RTS, но не было существенной разницы в механических и материальных свойствах сухожилий между группами RTS и RT [30] . Конкурирующая гипотеза предполагает, что использование ААС вызывает гипертрофию мышц, не вызывая соответствующих изменений в ткани сухожилий. Внезапное или максимальное напряжение может привести к повреждению сухожилий [28] . Наконец, исследование бывших игроков Национальной футбольной лиги (НФЛ) выявило связь между приемом ААС и повышенной вероятностью скелетно-мышечных травм, особенно травм связок [31] .
Конкурирующая гипотеза предполагает, что использование ААС вызывает гипертрофию мышц, не вызывая соответствующих изменений в ткани сухожилий. Внезапное или максимальное напряжение может привести к повреждению сухожилий [28] . Наконец, исследование бывших игроков Национальной футбольной лиги (НФЛ) выявило связь между приемом ААС и повышенной вероятностью скелетно-мышечных травм, особенно травм связок [31] .
Использование ААС связано как с положительными, так и с отрицательными психологическими эффектами. Злоупотребление и зависимость от ААС являются потенциальной проблемой среди пользователей ААС, особенно тех, кто использует их в целях повышения производительности или в эстетических целях.
ААС могут повышать уровень бета-эндорфина, снижать уровень кортизола и повышать уровень АКТГ, что может привести к усилению положительных ассоциаций с физическими упражнениями [32] . Повышение уровня эндорфинов и подкрепление упражнений могут способствовать зависимости от ААС и злоупотреблению ими [32] .
Зависимость от ААС характеризуется увеличением количества циклов ААС, более высокими дозами и усилением психологических расстройств, таких как повышенная агрессия [33] . Депрессия и самоубийство могут быть вызваны выходом из цикла приема ААС или прекращением приема ААС. Риск депрессии и суицида может быть вызван снижением уровня эндорфинов и изменениями в системе вознаграждения мозга. ААС могут вызывать или усугублять тревожные расстройства, шизофрению и расстройства пищевого поведения [33] . Предполагается, что психопатология ААС вызывается прямыми или косвенными изменениями в центральной нервной системе, включая изменения внутриклеточных рецепторов и рецепторов нейротрансмиттеров. Эти изменения могут влиять на уровни гормонов и нейротрансмиттеров, таких как серотонин или ГАМК, и приводить к изменениям депрессии, гнева или стресса [33] . Использование ААС может способствовать мотивации и положительному опыту занятий спортом, но может привести к негативным последствиям, которые сохранятся надолго и снизят мотивацию к занятиям спортом.
Потенциальные неблагоприятные сердечно-сосудистые эффекты от длительного использования анаболических стероидов значительны, и поставщики медицинских услуг должны повышать осведомленность пациентов и внедрять протоколы, чтобы помочь выявить пациентов из группы риска. [5]
- ↑ Bertozzi G, Sessa F, Albano GD, Sani G, Maglietta F, Roshan MH, Volti GL, Bernardini R, Avola R, Pomara C, Salerno M. Роль анаболических андрогенных стероидов в разрушении физиологических функций отдельных участков центральной нервной системы. Молекулярная нейробиология. 2018 июль 1; 55 (7): 5548-56. Доступно по ссылке: https://link.springer.com/article/10.1007/s12035-017-0774-1 (последнее обращение 20.12.2019).)
- ↑ Национальный институт по борьбе со злоупотреблением наркотиками. Анаболические стероиды. http://www.drugabuse.gov/publications/drugfacts/anabolic-steroids (по состоянию на 10 ноября 2015 г.
 )
) - ↑ 3.0 3.1 Модлински Р., Филдс К.Б. Влияние анаболических стероидов на желудочно-кишечный тракт, почки и надпочечники. Текущие отчеты спортивной медицины. 2006; 5(2):104-9.http://link.springer.com/article/10.1007/s11932-006-0039-7
- ↑ BBC Earth lab Что происходит, когда вы принимаете стероиды)
- ↑ 5.0 5.1 AlShareef S, Marwaha R. Расстройство, связанное с употреблением анаболических стероидов. InStatPearls [Интернет] 5 февраля 2019 г. Издательство StatPearls. Доступно по адресу: https://www.statpearls.com/sp/cns/73/17498/ (последний доступ 20.12.2019).
- ↑ Ачар С., Ростамян А., Нараян С.М. Сердечные и метаболические эффекты злоупотребления анаболическими андрогенными стероидами на липиды, артериальное давление, размеры левого желудочка и ритм. Американский журнал кардиологии. 2010;106(6):893-901. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4111565/
- ↑ Kuipers H, Wijnen JA, Hartgens F, Willems SM.
 Влияние анаболических стероидов на состав тела, артериальное давление, липидный профиль и функции печени у бодибилдеров. Int J Sports Med 1991;12(4):413-8. http://europepmc.org/abstract/med/1917227
Влияние анаболических стероидов на состав тела, артериальное давление, липидный профиль и функции печени у бодибилдеров. Int J Sports Med 1991;12(4):413-8. http://europepmc.org/abstract/med/1917227 - ↑ Laroche GP. Стероидные анаболики и артериальные осложнения у спортсмена – история болезни. Ангиология 1990;41(11):964-9. http://ang.sagepub.com/content/41/11/964.short
- ↑ 9,0 9,1 9.2 Maior A, Carvalho A, Marques-Neto S, Menezes P, Soares P, Nascimento J. Сердечная вегетативная дисфункция у пользователей анаболических стероидов. Скандинавский журнал медицины и науки в спорте. 2013;23(5):548-55. http://onlinelibrary.wiley.com/doi/10.1111/j.1600-0838.2011.01436.x/полный
- ↑ Лау Д.Х., Стайлз М.К., Джон Б., Янг Г.Д., Сандерс П. Мерцательная аритмия и злоупотребление анаболическими стероидами. Международный журнал кардиологии. 2007;117(2):e86-e7. http://www.researchgate.net/profile/Martin_Stiles/publication/6469883_Предсердная_фибрилляция_и_анаболические_стероиды_злоупотребление/ссылки/00b49528eb236dea4
00.
 pdf
pdf - ↑ Hedman A, Hartikainen J, Tahvanainen K, Hakumäki M. Высокочастотный компонент вариабельности сердечного ритма отражает скорее парасимпатическую модуляцию сердца, чем парасимпатический «тонус». Acta Physiologica Scandinavica. 1995;155(3):267-73. http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+8619324
- ↑ Акчакоюн М., Ализаде Э., Гюндогду Р., Булут М., Табакджи М.М., Ачар Г. и др. Длительное использование анаболических андрогенных стероидов связано с повышенной электромеханической задержкой предсердий у бодибилдеров-мужчин. Биомед Рез Инт. 2014;2014:8. http://www.hindawi.com/journals/bmri/2014/451520/abs/
- ↑ Д’Андреа А., Касо П., Салерно Г., Скарафиле Р., Де Корато Г., Мита С. и др. Ранняя дисфункция миокарда левого желудочка после хронического злоупотребления анаболическими андрогенными стероидами: анализ допплеровской визуализации миокарда и деформации. Британский журнал спортивной медицины. 2007;41(3):149-55. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2465218/
- ↑ 14,0 14,1 14,2 Салливан М.
 , Мартинес С., Геннис П., Галлахер Э. Кардиотоксичность анаболических стероидов. Прога Кардиоваск Дис 1998;41(1). дои: 10.1016/S0033-0620(98)80019-4
, Мартинес С., Геннис П., Галлахер Э. Кардиотоксичность анаболических стероидов. Прога Кардиоваск Дис 1998;41(1). дои: 10.1016/S0033-0620(98)80019-4 - ↑ 15,0 15,1 15,2 Haupt HA, Rovere GD. Анаболические стероиды: обзор литературы. Am J Sport Med 1984; 12:469-84 http://europepmc.org/abstract/med/6391216
- ↑ Фаркаш У., Шабшин Н., Прич М. Рабдомиолиз дельтовидной мышцы у бодибилдера, использующего анаболические андрогенные стероиды: клинический случай. Журнал спортивной подготовки. 2009 г.; 44(1): 98–100.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2629047/
- ↑ Адамсон Р., Рамбаран С., Д’Круз Д. Рабдомиолиз, вызванный анаболическими стероидами. Британский журнал больничной медицины (2005 г.). 2005;66(6):362. http://www.magonlinelibrary.com/doi/abs/10.12968/hmed.2005.66.6.18414
- ↑ Braseth N, Allison Jr E, Gough J. Рабдомиолиз при физической нагрузке у бодибилдера, злоупотребляющего анаболическими андрогенными стероидами.
 Европейский журнал экстренной медицины. 2001;8(2):155-7. http://journals.lww.com/euro-emergencymed/Abstract/2001/06000/Exertional_rhabdomyolysis_in_a_body_builder.15.aspx
Европейский журнал экстренной медицины. 2001;8(2):155-7. http://journals.lww.com/euro-emergencymed/Abstract/2001/06000/Exertional_rhabdomyolysis_in_a_body_builder.15.aspx - ↑ Daniels JM, van Westerloo DJ, de Hon OM, Frissen PH. Рабдомиолиз у бодибилдера, принимающего стероиды. [Абстрактный]. Nederlands tijdschrift voor geneeskunde. 2006;150(19):1077-80. http://europepmc.org/abstract/med/16733985
- ↑ Хьюз М., Ахмед С. Некротизирующая миопатия, вызванная анаболическими андрогенными стероидами. Международная ревматология. 2001 г.; 31(7): 915-917. https://hal.archives-ouvertes.fr/hal-00615341/документ
- ↑ 21,0 21,1 21,2 21.3 Тамаки Т., Утияма С., Утияма Ю., Акацука А., Рой Р.Р., Эдгертон В.Р. Анаболические стероиды повышают толерантность к физическим нагрузкам. Американский журнал физиологии-эндокринологии и метаболизма. 2001;280(6):E973-E81.http://ajpendo.physiology.org/content/280/6/E973.short
- ↑ 22,0 22,1 Хоузгуд Дж.
 Л., Фрэнкс А. Дж. Реакция скелетных мышц человека на анаболический стероид станозолол. БМЖ. 1988;297(6655):1028-9.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1834821/pdf/bmj00308-0040.pdf
Л., Фрэнкс А. Дж. Реакция скелетных мышц человека на анаболический стероид станозолол. БМЖ. 1988;297(6655):1028-9.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1834821/pdf/bmj00308-0040.pdf - ↑ 23,0 23,1 Бхасин С., Сторер Т.В., Берман Н., Каллегари С., Клевенджер Б., Филлипс Дж. и др. Влияние супрафизиологических доз тестостерона на размер и силу мышц у нормальных мужчин. Сокращенная версия: NEJM 1996; 335:1–7. Полная версия: 28 октября 2015 г.).
- ↑ Van Zyl CG, Noakes TD, Lambert MI. Анаболико-андрогенный стероид увеличивает беговую выносливость у крыс. Med Sci Sport Exer, 1995; 27 (10): 1385-9.. http://europepmc.org/abstract/med/8531609
- ↑ Farooqi V, Van Den Berg M, Cameron I. Анаболические стероиды для реабилитации после перелома бедра у пожилых людей. Кокрановское сотрудничество. 2013:
- ↑ Сринивас-Шанкар У., Робертс С.А., Коннолли М.Дж., О’Коннелл М.Д.Л., Адамс Дж.Е., Олдхэм Дж.А., Ву ФКВ. Влияние тестостерона на мышечную силу, физическую функцию, состав тела и качество жизни у пожилых мужчин со средней степенью слабости и слабости: рандомизированное двойное слепое плацебо-контролируемое исследование.
 Дж. Клин Эндокринол Метаб 2010; 95(2):639-50. http://press.endocrine.org/doi/full/10.1210/jc.2009-1251
Дж. Клин Эндокринол Метаб 2010; 95(2):639-50. http://press.endocrine.org/doi/full/10.1210/jc.2009-1251 - ↑ 27.0 27.1 Metcalfe D., Watts E., Masters JP., Smith N. Анаболические стероиды у пациентов, перенесших тотальное эндопротезирование коленного сустава. Открытый БМЖ. 2011 г.; 2(5): Дой: 10.1136/bmjopen-2012-001435
- ↑ 28,0 28,1 28,2 28,3 28,4 Канаяма Г., ДеЛука Дж., Михан В.П., Хадсон Д.И., Асакс С., Баггишаль. Разрывы сухожилий у пользователей анаболических и андрогенных стероидов. 2015;43(11):2638-44. http://ajs.sagepub.com/content/43/11/2638.short
- ↑ Michna H. Повреждения сухожилий, вызванные физическими упражнениями и анаболическими стероидами у экспериментальных мышей. Int Orthop 1987; 11 (2): 157-62. http://link.springer.com/article/10.1007/BF00266702
- ↑ Сейннес О.Р., Камандулис С., Кайрайтис Р., Хелланд С., Кэмпбелл Э.Л., Бразайтис М. и др. Влияние андрогенно-анаболических стероидов и тяжелой силовой тренировки на морфологические и механические свойства сухожилия надколенника.
 J Appl Physiol 2013;115(1):84-9. http://jap.physiology.org/content/115/1/84.short
J Appl Physiol 2013;115(1):84-9. http://jap.physiology.org/content/115/1/84.short - ↑ Хорн С., Грегори П., Гускевич К.М. Самооценка употребления анаболических андрогенных стероидов и скелетно-мышечных травм: результаты опроса здоровья вышедших на пенсию игроков НФЛ, проведенного центром изучения спортсменов-пенсионеров. Am J Phys Med Rehab 2009;88(3):192-200. http://www.ncbi.nlm.nih.gov/pubmed/19847128
- ↑ 32,0 32,1 Hildebrandt T, Shope S, Varangis E, Klein D, Pfaff DW, Yehuda R. Подкрепление упражнений, стресс и β-эндорфины: начальное исследование упражнений при анаболически-андрогенной стероидной зависимости. Наркотическая и алкогольная зависимость. 2014;139: 86-92. http://www.drugandalcoholdependence.com/article/S0376-8716%2814%2
4-4/abstract
- ↑ 33,0 33,1 33,2 Пьячентино Д., Д. Котзалидис Г., Дель Казале А., Розария Ароматарио М., Помара С., Жирарди П. и др. Применение анаболо-андрогенных стероидов и психопатология у спортсменов.
 Систематический обзор. Современная нейрофармакология. 2015;13(1):101-21. http://www.ingentaconnect.com/content/ben/cn/2015/00000013/00000001/art00011
Систематический обзор. Современная нейрофармакология. 2015;13(1):101-21. http://www.ingentaconnect.com/content/ben/cn/2015/00000013/00000001/art00011
Диссоциация андрогенной и другой гормональной активности от белково-анаболических эффектов стероидов
- DOI:10.1007/978-3-642-66353-6_11
- Идентификатор корпуса: 85726469
title={Отделение андрогенной и другой гормональной активности от белково-анаболических эффектов стероидов},
автор = {Гордон О. Поттс, Аарон Арнольд и Артур Л. Бейлер},
год = {1976}
} - Г. О. Поттс, А. Арнольд, А. Л. Бейлер
- Опубликовано в 1976 г.
- Биология, медицина
За последние два десятилетия в лабораториях по всему миру было проведено много исследований в поисках молекулы, обладающей всеми анаболические свойства мужского гормона тестостерона, но не вызывают реакций, обычно характеризуемых как вирилизирующие. Эти усилия были оправданы тем, что ожидается, что «чистый» анаболический агент найдет гораздо больше клинических применений и будет более широко принят медицинскими специалистами, чем тестостерон и его…
Эти усилия были оправданы тем, что ожидается, что «чистый» анаболический агент найдет гораздо больше клинических применений и будет более широко принят медицинскими специалистами, чем тестостерон и его…
View via Publisher
Фармакология анаболических стероидов
Анаболические стероиды рассматриваются для лечения кахексии, связанной с хроническими болезненными состояниями, и для решения проблемы потери мышечной массы у пожилых людей, но, тем не менее, их эффективность еще предстоит продемонстрировать в с точки зрения улучшения физических функций и качества жизни.
Синтетические анаболические средства: стероиды и нестероидные селективные модуляторы андрогенных рецепторов.
Были разработаны нестероидные альтернативы ААС, которые избирательно активируют рецепторы андрогенов либо в мышечной ткани, либо в костях, и эти соединения обладают высоким потенциалом неправильного использования в спорте и в будущем станут предметом допинг-контроля.
Графики относительной андрогенной и миотропной активности 19-нортестостерона.
Побочные эффекты анаболических стероидов
В настоящее время нет доказательств в поддержку утверждения о том, что спортсмены менее восприимчивы к побочным эффектам, чем лица, получающие гормональную терапию в клинических условиях, и существует необходимость в разработке всеобъемлющей батареи специфических и чувствительных маркеров побочных эффектов.
Комментарий: андрогены и «анаболические стероиды»: одноголовый янус.
- Дэвид Хандельсман
Биология, медицина
Эндокринология
- 2011
Послевоенный поиск анаболического стероида потребовал измерения биотропной активности миотрофической мышцы, и в конечном итоге был выбран метод Гершани, который стал стандартом для миотрофической активности леватора. сказать благодаря чему миотропную (анаболическую) активность можно отделить от андрогенной активности синтетических андрогенов.
сказать благодаря чему миотропную (анаболическую) активность можно отделить от андрогенной активности синтетических андрогенов.
Влияние анаболических андрогенных стероидов на мышечную силу.
В восьми исследованиях с участием нетренированных здоровых добровольцев не было обнаружено никаких доказательств в поддержку увеличения мышечной силы при использовании стероидов, а анаболические стероиды могут незначительно увеличивать мышечную силу у ранее тренированных спортсменов.
Профилирование анаболических андрогенных стероидов и селективных модуляторов андрогенных рецепторов для вмешательства в стероидогенез надпочечников.
Нестероидные селективные модуляторы андрогенных рецепторов (SARM): диссоциация анаболической и андрогенной активности андрогенных рецепторов для достижения терапевтического эффекта.
В этом адресе для награждения делается попытка вести хронику важных открытий, систематизировать ландшафт SARM по клинически значимым ячейкам и дать представление о клинических перспективах SARM.
Психологические и поведенческие эффекты уровня эндогенного тестостерона и анаболических андрогенных стероидов у мужчин
- M. Bahrke, C. Yesalis, J. Wright
Биология, медицина
Спортивная медицина 100045 2
Можно Можно сделать вывод, что, хотя использование экзогенных анаболо-андрогенных стероидов может иметь психологические и поведенческие эффекты у некоторых пациентов и спортсменов, эти эффекты вариабельны, преходящи при прекращении приема препаратов и, по-видимому, связаны с типом (17α-алкалированные, а не 17β-этерифицированный), но не доза анаболика
Фитоэкдистероиды и анаболические-андрогенные стероиды – структура и воздействие на человека.
Сообщается о наиболее важных структурных различиях между андрогенными гормонами, их синтетическими аналогами и экдистероидами.
Миотрофические и андрогенные эффекты 17-этил-19-нортестостерона и родственных соединений.

- F. J. Saunders, V. Drill
Биология, медицина
Эндокринология
- 1956
53), используя модификацию этого метода, показали, что 19-нортестостерон, хотя и проявляет по существу такую же миотрофическую активность, что и тестостерон, обладает лишь относительно слабыми андрогенными эффектами.
Сравнение миотрофической и андрогенной активности тестостерона пропионата с 19-нортестостероном и его эфирами.
- Л. Э. Барнс, Р. О. Стаффорд, М. Гилд, Л. Тоул, К. Дж. Олсон
Биология
Эндокринология
- 1954
Мышца, поднимающая задний проход, сравнительно легко поддается диссекции, дает устойчивые ответы при повторных анализах и, по-видимому, не подвергается чрезмерному влиянию андрогенных стероидов в качестве вторичного полового признака.
Влияние андрогенных гормонов на атрофию надпочечников, вызванную инъекциями кортизона, и на противовоспалительное действие кортизона.
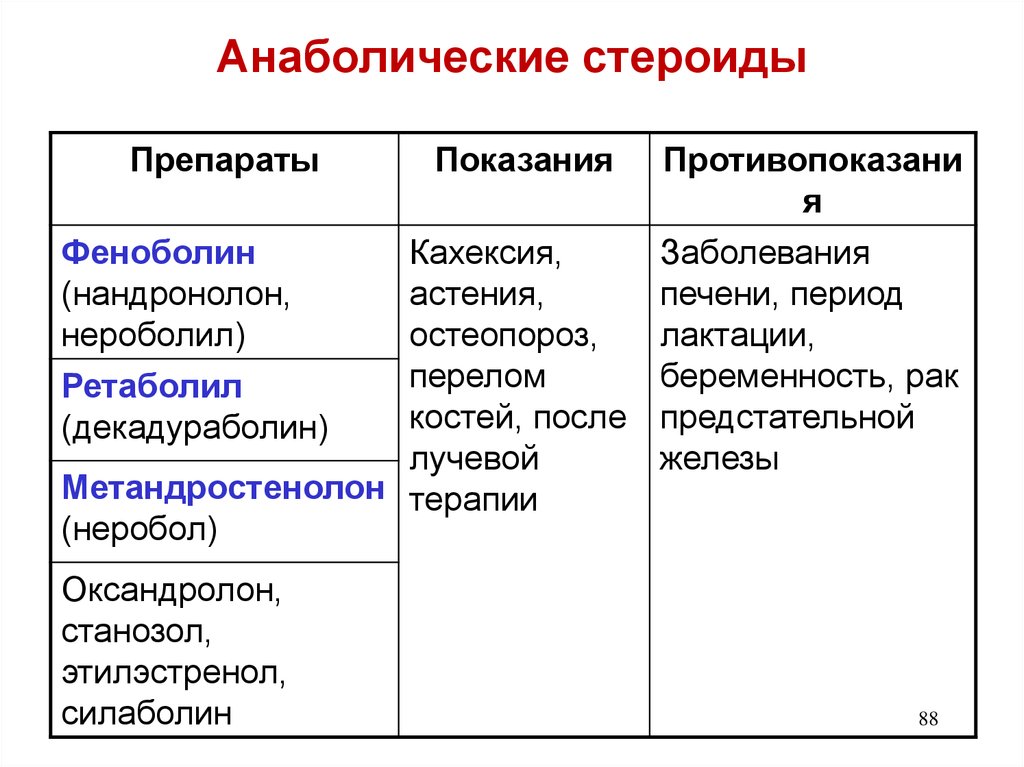
- К. Винтер, Х. Холлингс, Р. Стеббинс
Биология, медицина
Эндокринология
- 1953
Эффект тестостерона у крыс, получавших кортизон, определяли, чтобы определить, будут ли андрогенные гормоны противодействовать этому эффекту кортизона.
Оценка белковых анаболических свойств некоторых перорально активных анаболических средств на основе исследований баланса азота у крыс.
- A. Arnold, G. O. Potts, A. L. Beyler
Биология
- 1963
отделение желаемой анаболической активности от нежелательной маскулинизирующей активности метилландростанолона.
Миотрофическая (анаболическая) активность 4-замещенных аналогов тестостерона. Общество экспериментальной биологии и медицины
Резюме 1) Замещенные С-4 аналоги тестостерона обладают мощной миотрофической и слабой андрогенной активностью, что измеряется увеличением веса мышцы, поднимающей задний проход, и вентральной предстательной железы,…
Прогестероноподобное действие тестостерона и некоторых родственных соединений
- M.
 Klein, A.S. Parkes
Klein, A.S. Parkes Биология, медицина
- 1937
и косвенно указывает на абсолютную специфичность прогестерона.
Метаболические и клинические эффекты метиландростендиола у людей.
Метиландростендиол был впервые синтезирован Ружицкой, Гольдбергом и Розенбергом в 1935, и оказалось, что он составляет одну десятую от тестостерона и половину от метилтестостерона.
Анаболически-андрогенная активность различных стероидов в анализе на кастрированных крысах Андрогенный анализ с использованием Кастрированная крыса1
- Р. Дорфман, Ф. Кинкл
Биология, медицина
- 1963
Описаны и обсуждены изменения активности молекул тестостерона, 17α-метилтестостерона, 5α-дигидротестостерона и δ2-(5α)-андростен-17β-ола при добавлении различных функциональных групп.

