Биоорганическая химияАминокислоты.Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные (-COOH) и аминные группы (-NH2). Строение аминокислот можно выразить приведённой ниже общей формулой, (где R – углеводородный радикал, который может содержать и различные функциональные группы). Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы (-Nh3). В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту или аланин: Химические свойства аминокислотАминокислоты – амфотерные соединения, т.е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства. За счёт карбоксильной группы (-COOH) они образуют соли с основаниями. За счёт аминогруппы (-NH2) образуют соли с кислотами. Ион водорода, отщепляющийся при диссоциации от карбоксила (-ОН) аминокислоты, может переходить к её аминогруппе с образованием аммониевой группировки (NH3+). Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей). Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию. Альфа-аминокислотыИз молекул аминокислот строятся молекулы белковых веществ или белков, которые при полном гидролизе под влиянием минеральных кислот, щелочей или ферментов распадаются, образуя смеси аминокислот. Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки. Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот. Альфа-аминокислоты – кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Это свойство нашло отражение в названии первого гомолога в ряду альфа-аминокислот – глицина, явившегося также первой альфа-аминокислотой, обнаруженной в природном материале. Ниже приведена таблица с перечнем альфа-аминокислот:
Незаменимые аминокислотыОсновным источником альфа-аминокислот для животного организма служат пищевые белки. Многие альфа-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков альфа-аминокислоты в организме не синтезируются и должны поступать извне, с продуктами питания. Такие аминокислоты называют незаменимыми. Вот их список:
При некоторых, часто врождённых, заболеваниях перечень незаменимых кислот расширяется. Например, при фенилкетонурии человеческий организм не синтезирует ещё одну альфа-аминокислоту — тирозин, который в организме здоровых людей получается при гидроксилировании фенилаланина. Использование аминокислот в медицинской практикеАльфа-аминокислоты занимают ключевое положение в Так, глутаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин – лечения и предупреждения заболеваний печени, цистеин – глазных болезней. | ОглавлениеОрганическая химияКосметическая химияКоллоидная химияБиохимияБелки• Аминокислоты • Белки и пептиды • Нуклеиновые кислоты — Строение нуклеиновых кислот. Нуклеотиды и нуклеозиды. — Структура и простран- ственная организация нуклеиновых кислот Углеводы. Их роль и классификация.• Моносахариды (глюкоза и фруктоза). • Олигосахариды (сахароза).• Полисахариды (крахмал и целлюлоза). Липиды. Классификация.• Структурные компоненты липидов — Жирные кислоты и спирты, — Полиспирты, глицерин. • Простые омыляемые липиды: — Воски, — Жиры и масла. • Сложные омыляемые липиды. Классификация. — Фосфолипиды, лецитин, — Сфинголипиды, церамиды, — Гликолипиды. • Неомыляемые липиды: — Терпены, — Стероиды — стерины, холестерин, — желчные кислоты, — стероидные гормоны, — сердечные гликозиды. — Низкомолекулярные био- регуляторы липидной природы — Жирорастворимые витамины, — Простагландины. | |
— протеиногенные — Биохимия
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами и на их примере можно показать дополнительные способы классификации.
По строению бокового радикала
Выделяют
- алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин),
- ароматические (фенилаланин, тирозин, триптофан),
- серусодержащие (цистеин, метионин),
- содержащие ОН-группу (серин, треонин, опять тирозин),
- содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты),
- дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
Обычно названия аминокислот сокращаются до 3-х буквенного обозначения. Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
Строение протеиногенных аминокислот
По полярности бокового радикала
Существуют неполярные аминокислоты и полярные.
К неполярным относят аминокислоты, имеющие алифатические углеводородные цепи (аланин, валин, лейцин, изолейцин, метионин, пролин) и ароматические кольца (фенилаланин, триптофан).
К полярным незаряженным относятся аминокислоты, имеющие гидроксильные группы (серин, треонин, тирозин), амидные группы (аспарагин, глутамин), тиольную группу (цистеин) и глицин. Аспарагиновая и глутаминовая аминокислоты имеют в радикале дополнительную карбоксильную группу, отрицательно заряжены и, соответственно, полярны. К аминокислотам с полярными
По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
По незаменимости
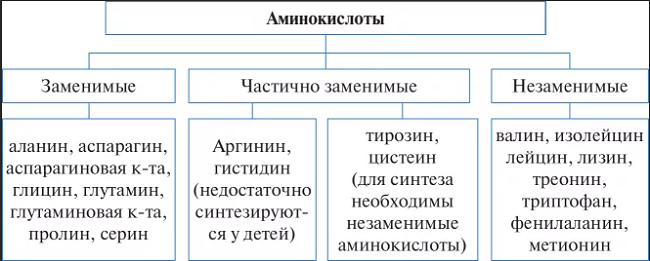
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е. их синтез происходит в недостаточном количестве, особенно это касается детей.
аминокислоты заменимые и незаменимые: список, потребность, видео
Хотите узнать, что такое заменимые и незаменимые аминокислоты? Тогда вам сюда. Дочитайте статью до конца, и вы узнаете, что такое аминокислоты, почему аминокислоты заменимые и незаменимые, какова потребность человека в незаменимых аминокислотах, и из каких продуктов питания их можно получить. С вами Галина Баева и заменимые и незаменимые аминокислоты.
Аминокислоты — это химические соединения, имеющие кислотный карбоксильный хвост С-О-ОН и аминогруппу -Nh3, куда обязательно входит азот.
Заменимые и незаменимые аминокислоты
В синтезе белка принимают участие чуть больше 20 аминокислот. Иногда их называют «магическими» или «чудесными». Белки всех живых организмов на Земле имеют в своем составе только эти 20 соединений, именно поэтому мы можем употреблять в пищу все, что растет и двигается, и аминокислоты пищи становятся нашими аминокислотами, естественно после некоторой модернизации.
Аминокислоты, которые организм может синтезировать самостоятельно, называют заменимыми. Полностью и в достаточном количестве в организме образуются пять аминокислот: серин, аланин, аспартат, аспарагин, глутамат.
Другие аминокислоты, хотя и могут образовываться в организме, но этот синтез энергетически затратен и не все запчасти могут оказаться в наличии. При ослаблении, например во время болезни или стресса, организм не сможет покрывать свои потребности за счет внутренних резервов. Эти аминокислоты относят к условно-заменимым. Таких аминокислот тоже пять. Это глицин, пролин, глутамин, тирозин, цистеин
Гистидин и аргинин для младенцев является незаменимыми аминокислотами, а во взрослом возрасте эти аминокислоты относят к условно-заменимым, ибо из синтез чрезвычайно сложен.
Для синтеза аминокислот необходим аминный азот — та самая аминная голова, источником которой чаще всего выступают аспартат и глутамат — аминокислоты-посредники, одно из предназначений которых транспорт аминного азота в организме. Изначальным источником аминного азота является пищевой белок. Нет пищевого белка — нет жизни.
Незаменимые аминокислоты не синтезируются в организме человека и должны поступать с пищей во избежание неприятностей в виде болезней. Полностью незаменимых аминокислот восемь. Это валин, лейцин, изолейцин, лизин, треонин, триптофан, фенилаланин, метионин.
Синтез аминокислот
Имеется 3 пути синтеза аминокислот:
- Из глюкозы и продуктов ее переработки в Цикле Кребса
- Из α-кетокислоты
- Из других аминокислот, как заменимых, так и незаменимых.
Глюкоза, а также ее производные: 3-фосфоглицерат, пируват (пировиноградная кислота), оксалацетат (щавелево-уксусная кислота) дают углеродный скелет для синтеза ряда аминокислот. Аминную голову поставляют другие аминокислоты, чаще всего глутамат. Реакции называются трансаминирование, ибо аминная голова переходит с одной аминокислоты на углеродный скелет, в результате образуется другая аминокислота.
Из глюкозы через ряд превращений образуется серин, а уже из него глицин. Понятно, почему серин — полностью заменимая аминокислота, а глицин — уже условно-заменимая, ведь серин образуется из глюкозы, которой полно, а глицин — уже из серина через дополнительные энергозатратные реакции.
Из пирувата, прихватив аминную голову у глутамата с помощью фермента аланинаминотрансферазы (ALT) образуется аланин, еще одна полностью заменимая аминокислота.
Из оксалацетата, также прихватив аминную голову у глутамата с помощью фермента аспартатаминотрансферазы (AST) образуется полностью заменимый аспартат, а из него — аспарагин.
Следующий путь синтеза: из α-кетокислоты, которая является источником углеродного скелета. Чаще всего в реакции задействован α-кетоглутарат. Аминную голову поставляет молекула аммиака Nh4. Это реакция называется восстановительное аминирование. Таким путем образуется полностью заменимый глутамат, а из него синтезируется условно-заменимый глутамин, и далее через ряд превращений — пролин и оксипролин.
Еще один путь синтеза — из незаменимых аминокислот. Так как ресурс незаменимых аминокислот ограничен питанием, синтезируются условно-заменимые аминокислоты. Из незаменимого фенилаланина синтезируется заменимый тирозин, а из незаменимого метионина и заменимого серина синтезируется заменимый цистеин.
Условно-заменимая аминокислота аргинин образуется в организме в процессе обезвреживания аммиака Nh4, который через ряд превращений присоединяется к непротеиногенной аминокислоте орнитину и далее, еще через ряд превращений, задействуя еще одну аминокислоту — аспартат, получается аргинин. Итак, источником аргинина выступают две аминокислоты орнитин и аспартат, а также аммиак, ядовитое вещество, образующееся при распаде других аминокислот. Весь прикол в том, что сам орнитин образуется из аргинина, т.е. без внешнего источника не обойтись.
Условно-заменимая аминокислота гистидин образуется в процессе сложной реакции. Изначальными заготовками для ее углеродного скелета выступает глюкоза, которая превращается в пятичленный углерод — рибозу, и молекула АТФ. Аминную голову дает заменимый глутамат. Каскад реакций состоит из 9 ступеней. Неудивительно, что организм предпочитает получать гистидин в готовом виде из пищи.
Функции аминокислот
Аминокислоты обеспечивают синтез белков и пептидов, а также участвуют в процессе выработки энергии.
По выполняемым в организме функциям аминокислоты делятся на следующие группы:
- Протеиногенные – являются структурными единицами белка. Это 20 «магических» аминокислот
- Иммуноактивные – участвуют в реакциях иммунитета
- Гликогенные и кетогенные – участвуют в реакциях биосинтеза
- Медиаторные – участвуют в проведении нервного импульса и регуляции реакций организма
Потребность в аминокислотах
При определенных условиях синтез заменимых аминокислот может отставать от их потребности, и тогда они становятся функционально-незаменимыми. Такими условиями являются:
- Детство. В детском возрасте идет бурный рост и развитие. Организму требуется много белка для формирования органов и тканей, роста костей, связок, мышц. Для детей аминокислоты аргинин и гистидин являются полностью незаменимыми, а синтез других аминокислот может не покрывать их потребности, поэтому детям особенно важно получать полноценное белковое питание. Недостаток белка в детском возрасте приводит не только к физическому недоразвитию, но и к умственной отсталости, ибо белок требуется для развития мозга и формирования интеллекта.
- Беременность и лактация. Полноценный белок нужен для нормального формирования плода и сохранения здоровья женщины, ибо все ресурсы ее организма пойдут на нужды растущего ребенка.
- Заболевания, травмы. Для борьбы с инфекциями вырабатываются особые белки-иммуноглобулины, что увеличивает потребность в аминокислотах. Заболевания истощают энергетические резервы организма, поэтому требуется дополнительный приток ресурсов извне для ликвидации последствий и налаживания нормальной работы биохимического конвейера.
- Стрессы. Стресс — это реакция организма на экстремальные условия существования, во время стресса организм работает с усиленной нагрузкой и дополнительное белковое питание необходимо, чтобы с этой нагрузкой справиться.
- Физическая и умственная нагрузка. Понятно, что физическая нагрузка требует увеличенного белкового питания для роста мышц, укрепления связок, костей, сухожилий. Умственная нагрузка тоже увеличивает потребность в белке, ибо работу мозга обеспечивают белковые молекулы — нейротрансмиттеры, а согласованная работа нервных центров обеспечивается балансом возбуждающих и тормозных аминокислот.
- Пожилой возраст. В пожилом возрасте белковая пища усваивается хуже вследствие перестройки ферментных систем желудочно-кишечного тракта, всасывание свободных аминокислот через стенки кишечника замедляется. Синтез белков в организме изменяется, причем неравномерно, уменьшаются возможности ферментных систем, что ведет к потере белка и возрастной инволюции органов и тканей.
Наличие заменимых аминокислот в пище может снижать потребность в незаменимых. Так, чем больше в пище цистеина, тем меньше нужно метионина.
При дефиците в питании некоторых заменимых аминокислот, они становятся незаменимыми, так как организм не может синтезировать их в достаточном количестве. Так недостаток цистеина приводит к торможению роста клеток даже при наличии всех других аминокислот.
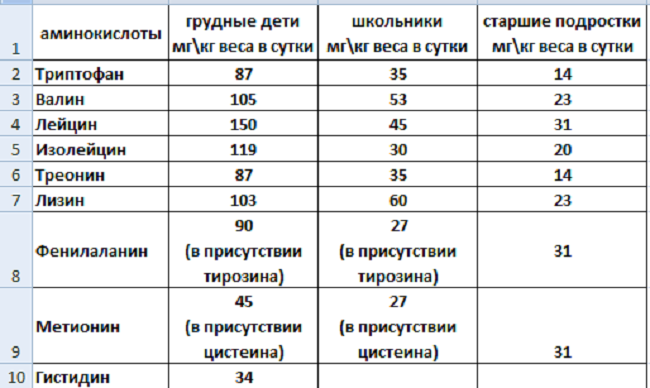
Потребность в незаменимых аминокислотах у детей и подростков
Детям незаменимых аминокислот нужно больше, чем взрослым, ибо в их организме идет бурных рост и развитие, которые обеспечиваются синтезом белка. У детей гистидин относится к незаменимым аминокислотам.
Природные источники аминокислот
- Аланин: говядина, свинина, яйца, молоко, рис, соя, овес, кукуруза
- Аргинин можно получить из, мяса, рыбы, орехов, сои, овса, пшеницы, риса
- Аспарагиновая кислота и аспарагин: яйца, мясо, арахис, картофель, кокос
- Валин – незаменимая аминокислота, в большом количестве содержится в сое, мясе, рыбе, яйцах, молоке, лесных орехах, овсе, рисе
- Гистидин. В организме человека гистидин синтезируется в ограниченном количестве. Он содержится в бананах, рыбе, говядине
- Глицин. Источниками являются говядина, печень, арахис, овес
- Глутаминовая кислота и глутамин содержится в пшенице, ржи, молоке, картофеле, грецком орехе, мясе, сое
- Изолейцин – незаменимая аминокислота. Источники: соя, мясо, рыба, яйца, молоко, лесной орех
- Лейцин – протеиногенная незаменимая аминокислота. Источники: соя, мясо, рыба, овес, яйца, молоко, лесной орех, кукуруза, просо
- Лизин – незаменимая аминокислота. В растительных белках лизина мало. Источники: соя, мясо, рыба, яйца, молоко, чечевица, пшеница
- Метионин – незаменимая протеиногенная аминокислота. Источники: мясо, рыба, печень, яйца, кукуруза
- Пролин – незаменимая протеиногенная аминокислота. Источники: молоко, пшеница, фрукты, в больших количествах содержится во фруктовых соках (до 2,5 г\л апельсинового сока)
- Серин – протеиногенная заменимая аминокислота. Источники: молоко, яйца, овес, кукуруза
- Тирозин – протеиногенная заменимая аминокислота. Источники: молоко, горох, яйца, арахис, фасоль.
- Треонин – незаменимая протеиногенная аминокислота, потребность в которой особенно велика у детей. Источники: молоко, яйца, горох, пшеница, говядина, рыба
- Триптофан – незаменимая аминокислота. В растительных белках триптофана мало. Источники: соя, мясо (особенно печень), рыба, яйца, молоко
- Фенилаланин – незаменимая протеиногенная аминокислота. Источники: соя, мясо, рыба, яйца, молоко, лесной орех, арахис,
- Цистеин, цистин – заменимая протеиногенная аминокислота. Источники: яйца, овес, кукуруза
Биологическая ценность продуктов питания и содержание в них незаменимых аминокислот (мг\100 г.)
При поступлении в желудочно-кишечный тракт белки распадаются на составные части и всасываются в кровь уже в виде отдельных мелких фрагментов. В организме из отдельных аминокислот, на которые распались белки пищи, образуются свои собственные белки. Белки человеческого организма существенно различаются по составу с пищевыми белками, именно поэтому пища должна быть разнообразной, чтобы удовлетворить потребность организма во всех питательных элементах.
Аминокислотный состав некоторых простых белков
Яичный альбумин и молочный казеин считаются самыми сбалансированными белками по аминокислотному составу, но насколько различается их состав от состава различных белков организма человека. Так для синтеза белка тимуса и глобулина крови не хватит содержащегося в яйцах и молоке триптофана и валина, для синтеза инсулина – не хватит фенилаланина и валина, для образования альбумина крови – не хватит лизина и фенилаланина и опять же валина. Это значит, что при употреблении одних яиц и молока в качестве источников незаменимых аминокислот, организм все равно будет их недополучать, и чтобы восполнить недостачу он начнет разрушать собственные белки, т.е. пожирать сам себя, что неминуемо приведет к снижению иммунитета, уменьшению мышечной массы, а в перспективе – к преждевременному старению.
Видео 3 мин
Понравилась статья? Оставляйте комментарий, делитесь информацией в социальных сетях. Галина Баева.
Функции аминокислот в организме человека
У большинства людей слово аминокислоты ассоциируется с разновидностью спортивного питания. И действительно, одним из основных товаров в этом сегменте являются комплексы аминокислот и в частности – аминокислоты ВСАА. Возникает закономерный вопрос: для чего нужны аминокислоты, кому и откуда их можно получить? Чтобы в этом разобраться, нужно сначала определиться с тем, что из себя изначально представляют эти вещества.
Что такое аминокислоты?
Аминокислоты – это органические соединения, являющиеся структурным компонентом белка. Т.е. когда мы говорим, о том, что белок является основным строительным материалом тканей организма, что он необходим для роста мышечной массы и незаменим при жиросжигании – всё это, на самом деле, об аминокислотах, из которых и состоит белок. Утрированно, можно сказать, что аминокислоты – это белки.
В природе существует огромное количество разновидностей аминокислот и, соответственно, их классификаций. Однако всё это из области химии. Как правило, выделяют 20 «основных» аминокислот. Именно их имеют в виду, затрагивая тему питания, фитнеса и т.д.
Почему в качестве «важнейших» аминокислот выбрали именно их не совсем понятно. Однако для нас важно, что эти двадцать аминокислот делят на два класса в зависимости от того, может ли организм самостоятельно их синтезировать (производить): заменимые и незаменимые.
Виды аминокислот: заменимые и незаменимые
Заменимые аминокислоты – это те, которые организм может получить двумя способами: либо в готовом виде из продуктов питания, либо производить самостоятельно из других видов аминокислот и веществ, поступающих в организм.
К заменимым аминокислотам относятся: аргинин, аспарагин, глутамин, глутаминовая кислота, глицин, карнитин, орнитин, таурин (иногда в этот список вносят пролин и серин).
Незаменимые аминокислоты – эти аминокислоты организм не в состоянии синтезировать сам и может получать только из продуктов питания. Если говорить более точно, то этот класс делится на незаменимые и условно незаменимые аминокислоты – на самом деле, они производятся в организме, но в ничтожно маленьких количествах и поэтому их дополнительное поступление крайне необходимо.
К незаменимым аминокислотам относятся: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
К условно незаменимым аминокислотам относятся: тирозин, цистеин, гистидин, аланин.
В разных источниках аминокислоты в этих классификациях могут немного отличаться. Иногда этот список дополняют несколькими другими элементами. Иногда «степень важности» некоторых ставят под сомнение, но, тем не менее, этот перечень можно назвать основным.
Источники аминокислот
Естественно, главным источником аминокислот являются продукты питания, богатые белком. Однако на основании содержания тех или иных аминокислот белки, содержащиеся в пище, можно разделить на полноценные и неполноценные.
Полноценные белки содержат в себе все незаменимые аминокислоты. К таким продуктам относятся, главным образом, продукты животного происхождения: мясо, птица, рыба, яйца, молочные продукты. К растительным источникам полноценного белка относится соя.
Среди всех продуктов наиболее качественным источником полноценных белков считается куриное яйцо, так как в нём не только полный набор незаменимых аминокислот, но и лучшее их соотношение.
Неполноценные белки – в их составе отсутствует хотя бы одна незаменимая кислота. Соответственно, по своему «качеству» неполноценные белки могут сильно отличаться. Ведь к одной и той же группе «неполноценных» будет относится тот белок, в котором только одна незаменимая аминокислота, и тот, в котором их семь. Источником неполноценных белков являются главным образом продукты растительного происхождения: бобовые, злаки, орехи и семечки.
Хочу обратить внимание на один нюанс, который обычно становится камнем преткновения в спорах вегетарианцев и тех, кто ест мясо и продукты животного происхождения: белок содержится практически во всех продуктах. А если учитывать даже его микродозы, то, скорее всего, во всех. Вопрос в другом: в качестве белка (полноценный или неполноценный) и его количестве. Белок есть и в брокколи и в куриной грудке. Просто в капусте его 3 г на 100 г продукта, а в курином мясе 23 г.
Чтобы эта информация была более наглядной, я приведу пример. Допустим, есть человек, который занимается спортом и весит 70 кг. Ему необходимо, допустим, 1,5 г белка на кг массы тела, соответственно хотя бы 105 г. Он может получить их из 450-ти г курицы, либо из 3, 5 кг брокколи. И это только количественный показатель. Качество животного белка будет Выше.
Функции аминокислот в организме
В широком смысле, аминокислоты, из которых состоит белок, являются строительным материалом всех структур организма. Каждая аминокислота в отдельности выполняет свою незаменимую роль. Однако, обобщив, можно выделить следующие основные функции аминокислот:
- синтез белка
- поддержание активности умственных процессов (аминокислоты выполняют функцию нейромедиаторов, являясь проводниками нервных импульсов)
- регуляция работы ЦНС (центральной нервной системы)
- формирование мышечных волокон
- восстановление тканей и органов после травм
- являясь основным компонентом ферментов, регулируют обменные процессы в организме (в том числе углеводный и липидный обмены)
- регулируют гормональный фон
И это только основные из них. Я не преувеличу, если скажу, что аминокислоты участвуют абсолютно во всех процессах, происходящих в организме.
Оптимальное соотношение аминокислот
Мне так и не удалось найти более-менее достоверного источника информации о том, каким всё-таки должно быть соотношение белков в рационе человека. Упоминается диапазон соотношения животных белков к растительным от 65:35 до 45:55. Думаю, что стоит ровняться на золотую середину и придерживаться пропорции 50:50.
Но важно также понимать, что такой подсчёт не обязательно даст Вам полный спектр необходимых аминокислот. Ведь даже если мы говорим о полноценном белке, содержащем все незаменимые аминокислоты, то играет роль также количество и пропорции этих аминокислот в данном продукте. Они могут быть там все, но просто в малом количестве или наблюдаться дефицит какой-то конкретной аминокислоты.
Безусловно, немногие из нас будут сидеть и скрупулёзно подсчитывать количество всех аминокислот и их пропорции в своём рационе. Именно поэтому достаточное употребление белка и соблюдение соотношения 50:50 животных к растительным белкам, предположительно, должно покрыть Вашу норму в аминокислотах. К слову, сочетание гречки с мясом даёт примерно такое соотношение. И не стоит забывать, что животный белок усваивается организмом намного лучше, чем растительный.
Намного более сложная ситуация складывается у вегетарианцев. Им нужно очень серьёзно продумывать свой рацион, чтобы более-менее восполнить недостаток незаменимых аминокислот из растительных источников.
Растительный и животный белок: какой лучше?
Именно такая формулировка вопроса очень часто появляется при обсуждении животного и растительного белка, и она в корне не верна. Нет «плохого» или «хорошего» белка, они разные и организму нужны и первые и вторые в достаточном количестве. Как говорилось выше, все белки имеют разный аминокислотный состав. И нам нужны ВСЕ аминокислоты. Каждая из них выполняет свою функцию и, соответственно, недостаток какой-либо из них рано или поздно негативно скажется на работе организма.
Кто-то скажет, что полноценные белки важнее, потому что содержат незаменимые аминокислоты. Но если кушать только белок животного происхождения, человек всё равно будет испытывать недостаток тех кислот, которые в них не содержатся. Кроме того польза продуктов определяется не только наличием аминокислот. Огромную роль также играет соотношение белков, «хороших» и «плохих» жиров и углеводов. Ведь если продукт будет богат незаменимыми аминокислотами, но при этом содержать много животных жиров – его «полезность» существенно уменьшится даже для тех, кто не следит за фигурой. Поэтому вывод один — рацион должен быть максимально разнообразным, чтобы полностью покрыть потребность в аминокислотах.
Количество аминокислот необходимых человеку, занимающемуся спортом, резко увеличивается. Соответственно нужно либо строго контролировать их поступление с пищей, либо принимать дополнительные порции аминокислот в виде добавок спортивного питания (например, ВСАА).
Но это не значит, что добавки являются обязательными. Свой рацион вполне можно выстроить таким образом, чтобы покрыть все потребности в аминокислотах. У спортивного питания есть свои плюсы, но если Вы не соревнующийся спортсмен, его приём не является сверхнеобходимостью.
Ниже в таблицах Вы можете найти информацию об основных аминокислотах, их функциях и источниках получения. Среди продуктов, указаны только те, в которых каждая из аминокислот встречается в более-менее значимых количествах.
| Аминокислота | Функции | Источники |
|---|---|---|
| Тирозин |
|
|
| Цистеин |
|
|
| Гистидин |
|
|
Понравилась статья? Скажите «спасибо» автору и поделитесь ей в социальных сетях, нажав на соответствующую иконку в правом нижнем углу.
А чтобы получать больше полезной информации каждый день, подпишитесь на наш instagram.
Незаменимые аминокислоты. Справка — РИА Новости, 11.04.2011
Валин необходим для метаболизма в мышцах, он активно участвует в процессах восстановления поврежденных тканей. Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Лизин необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Лейцин защищает мышечные ткани и может являться источником энергии. Его наличие способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина. К пищевым источникам лейцина относятся бурый рис, бобовые, мясо, орехи.
Изолейцин
Треонин способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим организму для правильной работы иммунной системы. Содержится в яйцах, молочных продуктах, бобах и орехах.
Метионин способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров, защищает от воздействия радиации. Метионин содержится в бобовых, яйцах, чесноке, луке, йогурте мясе.
Фенилаланин является нейромедиатором для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Не усваивается организмом, которому не хватает витамина С. Содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя — аспартама.
Триптофан используется организмом для синтеза в головном мозге серотонина, который в свою очередь является важнейшим нейромедиатором. Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Потребность человека в незаменимых аминокислотах составляет от 250 до 1100 миллиграммов в сутки. Существуют биологически активные добавки, содержащие необходимые дозы этих веществ. Особо внимание восполнению их в организме рекомендуется уделять вегетарианцам (поскольку некоторые незаменимые аминокислоты в необходимых количествах содержатся только в продуктах животного происхождения), беременным женщинам и спортсменам.
Материал подготовлен на основе информации открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Пища для мозга, или Что надо есть, чтобы ничего не забывать» >>
Заменимые и незаменимые аминокислоты, значение и потребность в них. Общая гигиена: конспект лекций
Заменимые и незаменимые аминокислоты, значение и потребность в них
В настоящее время известно 80 аминокислот, наибольшее значение в питании имеют 30, которые наиболее часто встречаются в продуктах и чаще всего потребляются человеком. К ним относятся следующие.
1. Алифатические аминокислоты:
а) моноаминомонокарбоновые – глицин, аланин, изолейцин, лейцин, валин;
б) оксимоноаминокарбоновые – серин, треонин;
в) моноаминодикарбоновые – аспаргиновая, глютаминовая;
г) амиды моноаминодикарбоновых кислот – аспарагин, глутамин;
д) диаминомонокарбоновые – аргинин, лизин;
е) серосодержащие – гистин, цистеин, метионин.
2. Ароматические аминокислоты: фенилаланин, тирозин.
3. Гетероциклические аминокислоты: триптофан, гистидин, пролин, оксипролин.
Наибольшее значение в питании представляют незаменимые аминокислоты, которые не могут синтезироваться в организме и поступают только извне – с продуктами питания. К их числу относят 8 аминокислот: метионин, лизин, триптофан, треонин, фенилаланин, валин, лейцин, изолейцин. В эту группу входят и аминокислоты, которые в детском организме не синтезируются или синтезируются в недостаточном количестве. Прежде всего это гистидин. Предметом дискуссий является также вопрос о незаменимости в детском возрасте глицина, цистина, а у недоношенных детей также глицина и тирозина. Биологическая активность гормонов АКТГ, инсулина, а также коэнзима А и глютатиона определена наличием в их составе SH-групп цистина. У новорожденных детей из-за недостатка цистеназы лимитирован переход метионина в цистин. В организме взрослого человека тирозин легко образуется из фенилаланина, а цистин – из метионина, однако обратной заменяемости нет. Таким образом, можно считать, что число незаменимых аминокислот составляет 11—12.
Поступающий белок считается полноценным, если в нем присутствуют все незаменимые аминокислоты в сбалансированном состоянии. К таким белкам по своему химическому составу приближаются белки молока, мяса, рыбы, яиц, усвояемость которых около 90 %. Белки растительного происхождения (мука, крупа, бобовые) не содержат полного набора незаменимых аминокислот и поэтому относятся к разряду неполноценных. В частности, в них содержится недостаточное количество лизина. Усвоение таких белков составляет, по некоторым данным, 60 %.
Для изучения биологической ценности белков используют две группы методов: биологические и химические. В основе биологических лежит оценка скорости роста и степени утилизации пищевых белков организмом. Данные методы являются трудоемкими и дорогостоящими.
Химический метод колоночной хроматографии позволяет быстро и объективно определить содержание аминокислот в пищевых белках. На основании этих данных биологическую ценность белков определяют путем сравнения аминокислотного состава изучаемого белка со справочной шкалой аминокислот гипотетического идеального белка или аминограмм высококачественных стандартных белков. Этот методический прием получил название аминокислотного СКОРА = отношению количества АК в мг в 1 г исследуемого белка к количеству АК в мг в 1 г идеального белка, умноженного на 100 %.
Белки животного происхождения имеют наибольшую биологическую ценность, растительные – лимитированы по ряду незаменимых аминокислот, прежде всего по лизину, а в пшенице и рисе – также и по треонину. Белки коровьего молока отличаются от белков грудного дефицитом серосодержащих аминокислот (метионина, цистина). К «идеальному белку» по данным ВОЗ приближается белок грудного молока и яиц.
Важным показателем качества пищевого белка служит также степень его усвояемости. По степени переваривания протеолитическими ферментами пищевые белки располагаются следующим образом:
1) белки рыбы и молока;
2) белки мяса;
3) белки хлеба и круп.
Белки рыбы лучше усваиваются из-за отсутствия в их составе белка соединительной ткани. Белковая полноценность мяса оценивается по соотношению между триптофаном и оксипролином. Для мяса высокого качества это соотношение составляет 5,8.
Каждая аминокислота из группы эссенциальных играет определенную роль. Их недостаток или избыток ведет к каким-либо изменениям в организме.
Биологическая роль незаменимых аминокислот
Гистидин играет важную роль в образовании гемоглобина крови. Недостаток гистидина приводит к снижению уровня гемоглобина в крови. При декарбоксилировании гистидин превращается в гистамин – вещество, имеющее большое значение в расширении сосудистой стенки и ее проницаемости, влияет на выделение желудочного пищеварительного сока. Недостаток гистидина, так же как и избыток, ухудшает условно-рефлекторную деятельность.
Валин – физиологическая роль данной НАК недостаточно ясна. При недостаточном поступлении у лабораторных животных отмечаются расстройства координации движений, гиперестезия.
Изолейцин наряду с лейцином входит в состав всех белков организма (за исключением гемоглобина). В плазме крови содержится 0,89 мг% изолейцина. Отсутствие изолейцина в пище приводит к отрицательному азотистому балансу, к замедлению процессов роста и развития.
Лизин относится к одной из наиболее важных незаменимых аминокислот. Он входит в триаду аминокислот, особенно учитываемых при определении общей полноценности питания: триптофан, лизин, метионин. Оптимальное соотношение этих аминокислот составляет: 1 : 3 : 2 или 1 : 3 : 3, если взять метионин + цистин (серосодержащие аминокислоты). Недостаток в пище лизина приводит к нарушению кровообращения, снижению количества эритроцитов и уменьшению в них гемоглобина. Также отмечаются нарушение азотистого баланса, истощение мышц, нарушение кальцификации костей. Происходит также ряд изменений в печени и легких. Потребность в лизине составляет 3—5 г в сутки. В значительных количествах лизин содержится в твороге, мясе, рыбе.
Метионин играет важную роль в процессах метилирования и трансметилирования. Это основной донатор метильных групп, которые используются организмом для синтеза холина (витамина группы В). Метионин относится к липотропным веществам. Он оказывает влияние на обмен жиров и фосфолипидов в печени и таким образом играет важную роль в профилактике и лечении атеросклероза. Установлена связь метионина с обменом витамина В12 и фолиевой кислотой, которые стимулируют отделение метильных групп метионина, обеспечивая таким образом синтез холина в организме. Метионин имеет большое значение для функции надпочечников и необходим для синтеза адреналина. Суточная потребность в метионине составляет около 3 г. Основным источником метионина следует считать молоко и молочные продукты: в 100 г казеина содержится 3 г метионина.
Триптофан, так же как и треонин, – фактор роста и поддержания азотистого равновесия. Участвует в образовании сывороточных белков и гемоглобина. Триптофан необходим для синтеза никотиновой кислоты. Установлено, что из 50 мг триптофана образуется около 1 мг ниацина, в связи с чем 1 мг ниацина или 60 мг триптофана могут быть приняты как единый «ниациновый эквивалент». Суточная потребность в никотиновой кислоте в среднем определена в количестве 14—28 ниациновых эквивалентов, а в расчете на сбалансированную мегакалорию – 6,6 ниациновых эквивалентов. Потребность организма в триптофане составляет 1 г в сутки. В продуктах питания триптофан распределен неравномерно. Так, например, 100 г мяса эквивалентно по содержанию триптофана 500 мл молока. Из растительных продуктов необходимо выделить бобовые. Очень мало триптофана в кукурузе, поэтому в тех районах, где кукуруза является традиционным источником питания, следует проводить профилактические осмотры для определения обеспеченности организма витамином PP.
Фенилаланин связан с функцией щитовидной железы и надпочечников. Он дает ядро для синтеза тироксина – основной аминокислоты, образующей белок щитовидной железы. Из фенилаланина может синтезироваться тирозин и далее адреналин. Однако обратного синтеза из тирозина-фенилаланин не происходит.
Существуют стандарты сбалансированности НАК, разработанные с учетом возрастных данных. Для взрослого человека (г/сутки): триптофана – 1, лейцина 4—6, изолейцина 3—4, валина 3—4, треонина 2—3, лизина 3—5, метионина 2—4, фенилаланина 2—4, гистидина 1,5—2.
Заменимые аминокислоты
Потребность организма в заменимых аминокислотах удовлетворяется в основном за счет эндогенного синтеза, или реутилизации. За счет реутилизации образуется 2/3 собственных белков организма. Ориентировочная суточная потребность взрослого человека в основных заменимых аминокислотах следующая (г/сутки): аргинин – 6, цистин – 2—3, тирозин – 3—4, аланин – 3, серин – 3, глутаминовая кислота – 16, аспирагиновая кислота – 6, пролин – 5, глюкокол (глицин) – 3.
Заменимые аминокислоты выполняют в организме весьма важные функции, причем некоторые из них (аргинин, цистин, тирозин, глутаминовая кислота) играют физиологическую роль не меньшую, чем незаменимые (эссенциальные) аминокислоты.
Интересны некоторые аспекты использования заменимых аминокислот в пищевой промышленности, например глутаминовой кислоты. В наибольших количествах она содержится только в свежих пищевых продуктах. По мере хранения или консервирования пищевых продуктов глутаминовая кислота в них разрушается, и продукты теряют свойственные им ароматы и вкус. В промышленности чаще используют натриевую соль глутаминовой кислоты. В Японии глутаминат натрия называют «Аджино мотто» – сущность вкуса. Пищевые продукты опрыскивают 1,5—5%-ным раствором глутамината натрия, и они долго сохраняют аромат свежести. Поскольку глутаминат натрия обладает антиокислительными свойствами, то пищевые продукты могут храниться более длительные сроки.
Потребность в белках зависит от возраста, пола, характера трудовой деятельности, климатических и национальных особенностей и т. д. Исследованиями установлено, что азотистое равновесие в организме взрослого человека поддерживается при поступлении не менее 55—60 г белка, однако эта величина не учитывает стрессовые ситуации, болезни, интенсивные физические нагрузки. В связи с этим в нашей стране установлена оптимальная потребность взрослого человека в белке 90—100 г/сутки. При этом в пищевом рационе за счет белка должно обеспечиваться в среднем 11—13 % общей его энергетической ценности, а в процентном отношении белок животного происхождения должен составлять не менее 55 %.
Американскими и шведскими учеными установлены ультраминимальные нормы потребления белков на основании эндогенного распада тканевых белков при безбелковых диетах: 20—25 г/сутки. Однако такие нормы при постоянном использовании не удовлетворяют потребности организма человека и не обеспечивают нормальной работоспособности, так как при распаде тканевых белков образующиеся аминокислоты, используемые в дальнейшем для ресинтеза белка, не могут обеспечить должную замену животного белка, поступающего с пищей, и это приводит к отрицательному азотистому балансу.
Энергетическая потребность людей первой группы интенсивности труда (группа умственного труда) составляет 2500 ккал. 13 % от этой величины составляет 325 ккал. Таким образом, потребность в белке у студентов составляет приблизительно 80 г (325 ккал: 4 ккал = 81,25 г) белка.
У детей потребность в белках определяется возрастными нормами. Количество белка из-за преобладания в организме пластических процессов на 1 кг массы тела увеличено. В среднем эта величина составляет 4 г/кг у детей от 1 до 3 лет жизни, 3,5 —4 г/кг для детей 3—7 лет, 3 г/кг – для детей 8—10 лет и детей старше 11 лет – 2,5—2 г/кг, в то время как в среднем у взрослых 1,2—1,5 г/кг в сутки.
Данный текст является ознакомительным фрагментом.Читать книгу целиком
Поделитесь на страничке31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота
Среди пищевых веществ есть такие, которые не образуются в организме человека. Эти пищевые вещества называются незаменимыми, или эссенциальными.Они обязательно должны поступать с пищей. Отсутствие в рационе любого из них приводит к заболеванию, а при длительном недостатке – и к смерти. В настоящее время науке о питании известно около 50 незаменимых пищевых веществ, которые не могут образоваться в организме и единственным источником их является пища. К незаменимым элементампищичеловекаотносят следующие четыре категории:незаменимые жирные кислоты,незаменимые аминокислоты,витаминыи минеральные соли.
В ходе эволюции человек утратил способность синтезировать почти половину из двадцати аминокислот, входящих в состав белков. К их числу относят те аминокислоты, синтез которых включает много стадий и требует большого количества ферментов, кодируемых многими генами. Следовательно, те аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят:
Валин (содержится в зерновых,мясе,грибах, молочных продуктах,арахисе,сое)
Изолейцин(содержится в миндале, кешью, курином мясе, турецком горохе (нут), яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое.)
Лейцин(содержится в мясе, рыбе, буром рисе, чечевице, орехах, большинстве семян.)
Лизин(содержится в рыбе, мясе, молочных продуктах, пшенице, орехах.)
Метионин(содержится вмолоке, мясе, рыбе, яйцах, бобах,фасоли, чечевице и сое.)
Треонин(содержится в молочных продуктах и яйцах, в умеренных количествах в орехах и бобах.)
Триптофан(содержится в овсе,бананах, сушёныхфиниках, арахисе, кунжуте, кедровых орехах, молоке,йогурте, твороге, рыбе, курице, индейке, мясе.)
Фенилаланин(содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке. Также является составной частью синтетического сахарозаменителя —аспартама, активно используемого в пищевой промышленности.)
Аргинин(содержится в семенах тыквы, свинине, говядине, арахисе, кунжуте, йогурте, швейцарском сыре.)
Две аминокислоты — аргинин и гистидин — у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты — тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин.
Как было показано выше, основным источником аминокислот для клеток организма являются белки пищи. В различных пищевых продуктах содержание белка колеблется в широких пределах. Распространённые продукты растительного происхождения содержат мало белка (кроме гороха и сои). Наиболее богаты белками продукты животного происхождения (мясо, рыба, сыр). Белки не являются незаменимыми пищевыми факторами, они являются источниками содержащихся в них незаменимых аминокислот, необходимых для нормального питания.
Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Белки значительно различаются по аминокислотному составу. Некоторые их них содержат полный набор незаменимых аминокислот в оптимальных соотношениях, другие не содержат одной или нескольких незаменимых аминокислот. Растительные белки, особенно пшеницы и других злаковых, полностью не перевариваются, так как защищены оболочкой, состоящей из целлюлозы и других полисахаридов, которые не гидролизуются пищеварительными ферментами. Некоторые белки по аминокислотному составу близки к белкам тела человека, но не используются в качестве пищевых, так как имеют фибриллярное строение, малорастворимы и не расщепляются протеазами ЖКТ. К ним относят белки волос, шерсти, перьев и другие. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы (биологическая ценность — 36) содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот.
Линолевая кислота(ω-6 жирная кислота), а такжеарахидоновая кислотаилиноленовая кислотаотносятся к так называемым незаменимымжирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов —триглицеридовифосфатидов. В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многихрастительных масели животных жиров, напримерсоевого,хлопкового,подсолнечного,льняного,конопляногомасел,китового жира. Линолевая кислота является незаменимым питательным веществом, без которого организм не может вырабатывать простагландин Е1(простагландин Е1 -одно из важнейших средств защиты организма от преждевременного старения, заболеваний сердца, различных форм аллергии, рака и многих-многих других).
Базовый
Структура Гли к Leu Asp к Gln Ала к Трп Тест
себя Автор
из 1 буквенных кодов | Химия аминокислот Введение Аминокислоты играют центральную роль как строительные блоки белков и как промежуточные звенья в метаболизме. 20 аминокислот, которые содержатся в белки передают широкий спектр химической универсальности. В точное содержание аминокислот и последовательность этих аминокислот конкретный белок, определяется последовательностью оснований в ген, кодирующий этот белок.Химические свойства аминокислот белков определяют биологическую активность белка. Белки не только катализируют все (или большую часть) реакций в живых клетках, они контролировать практически все клеточные процессы. Кроме того, белки содержат в их аминокислотных последовательностях необходимая информация для определения как этот белок сворачивается в трехмерную структуру, и устойчивость полученной конструкции.Поле сворачивания белка и стабильность была критически важной областью исследований в течение многих лет, и остается сегодня одной из величайших неразгаданных загадок. Однако это активно исследуются, и прогресс наблюдается каждый день. Когда мы узнаем об аминокислотах, важно помнить, что из наиболее важных причин для понимания структуры и свойств аминокислот уметь понимать структуру и свойства белка.Мы будем увидеть, что чрезвычайно сложные характеристики даже небольшого, относительно Простые белки — это совокупность свойств аминокислот, которые содержат белок. Верх 10 аминокислот, которые мы можем производить, это аланин, аспарагин, аспарагиновая кислота. кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин. Тирозин вырабатывается из фенилаланина, поэтому при его дефиците в фенилаланине также потребуется тирозин.Незаменимая аминокислота кислоты: аргинин (необходим для молодых, но не для взрослых), гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Эти аминокислоты необходимы в рационе. Растения, конечно, должен уметь производить все аминокислоты. С другой стороны, люди делают не иметь всех ферментов, необходимых для биосинтеза всех аминокислоты. Зачем изучать эти структуры
и свойства? | Атомов
в аминокислотах |
Биосинтез аминокислот
По большей части это делают растения и свободноживущие микроорганизмы. Тот факт, что люди не могут их синтезировать, кроме как путем разложения белка, имеет практические последствия. Любая отдельная аминокислота может быть ограничивающей в рационе. Таким образом, например, человек, который не получает достаточного количества триптофана в рационе, не может компенсировать это, потребляя больше метионина. Единственный способ получить достаточно триптофана — это разрушить мышцы, чтобы высвободить достаточно триптофана для поддержания жизни.Это означает, что человек может буквально умереть от голода, получая при этом достаточное количество калорий и белка. В 1970-х годах появилась мода на употребление в пищу только гидролизованного жидкого коллагена и витаминов в попытке похудеть. Эти коммерческие продукты были сняты с продажи после того, как несколько человек умерли от проблем с сердцем. Причина проста: коллаген очень беден ароматическими аминокислотами. Люди разрушали свои мышцы, в том числе сердечную, чтобы обеспечить этими аминокислотами синтез незаменимых белков.В конце концов они умерли от сердечной недостаточности. Белки животного происхождения и молочные продукты обычно содержат сбалансированное количество аминокислот. То есть это полноценные белки. Растительные белки не всегда являются полноценными, поэтому люди, которые едят в основном растительные источники белка, должны есть прикорм, чтобы обеспечить полный набор аминокислот. Это причина сосуществования риса и бобов во многих кухнях. Комбинация обеспечивает все незаменимые аминокислоты, в то время как ни одна пища не делает этого самостоятельно.
Биосинтез ароматических аминокислот
Ароматические аминокислоты, фенилаланин, триптофан и тирозин, все производятся из общего промежуточного продукта: хорисминовой кислоты . Хорисминовая кислота образуется путем конденсации эритрозо-4-фосфата и фосфоенолпирувата с последующим дефосфорилированием и замыканием цикла, дегидратацией и восстановлением с образованием шикимовой кислоты . Шикимовая кислота фосфорилируется АТФ и конденсируется с другим пируватом фосфоенола, а затем дефосфорилируется с образованием хорисминовой кислоты.

Рисунок 1
Конденсация фосфошикимовой кислоты с фосфоенолпируватом катализируется ферментом 3-еноилпирувоилхикимат-5-фосфат-синтазой, или сокращенно EPSP-синтазой . Эта реакция специфически ингибируется гербицидом глифосатом .
Глифосат токсичен для растений и свободноживущих микроорганизмов, потому что он подавляет биосинтез ароматических аминокислот. С другой стороны, он чрезвычайно нетоксичен для людей и животных, потому что люди получают свои аминокислоты с пищей.Кроме того, он расщепляется в почве, поэтому он неустойчив. Единственная проблема с гербицидами на основе глифосата заключается в том, что они убивают культурные растения так же легко, как сорняки. Недавно были введены генно-инженерные сорта сельскохозяйственных культур, которые устойчивы к гербициду, что позволяет преимущественно уничтожать сорняки.
После того, как хоризмат продуцируется, он может быть преобразован в триптофан, тирозин или фенилаланин разными путями. Кроме того, многие организмы могут гидроксилировать фенилаланин до тирозина.Эта реакция объясняет, почему тирозин не является незаменимой аминокислотой для человека, хотя люди не могут производить ароматические аминокислоты из простых предшественников.
Определение пути биохимической генетикой
Использование генетических мутантов определило сложные пути, ведущие к аминокислотам. Мутант — это организм, последовательность ДНК которого отличается от последовательности ДНК его родителя (ей). Мутантные бактерии, которым для роста требуется определенное соединение, называются ауксотрофами .Первый шаг в определении пути — собрать большую коллекцию ауксотрофных мутантов, которые не могут образовать интересующее соединение.
Путь биосинтеза триптофана иллюстрирует общий процесс. Во-первых, ауксотрофные мутанты должны быть организованы в классы, соответствующие биохимическим стадиям пути. Мутантные штаммы проверяли на их способность выделять соединения, которые позволяли расти другим мутантам. Эти экспериментов по перекрестному вскармливанию были проведены для пар мутантов.Таким образом, соединение, выделяемое из одной группы мутантов, называемой Группой A, было способно поддерживать рост других мутантов, включая группу E. С другой стороны, мутанты группы E не могли выделять соединение, которое позволяло мутантам группы A расти. Тот факт, что мутанты группы A выделяли продукт, который позволял мутантам группы E расти, но не наоборот, означает, что соединение, выделяемое мутантами группы A, происходит через после соединения, выделяемого мутантами группы E (если таковые имеются). Это фундаментальная идея для определения биохимических путей.
Чтобы понять эту идею, представьте, что биохимический путь похож на серию въездов на шоссе. Обычно на шоссе можно выехать с любого съезда и добраться до места назначения. Но что произойдет, если между входами A и E произойдет крушение? Авария блокирует движение, и незадачливые водители, выехавшие на шоссе перед аварией (те, кто сели на E), не могут добраться до места назначения. С другой стороны, те, кто сели в пункте А, могут путешествовать и даже не заметят задержки.См. Рисунок 2.

Рисунок 2
Та же самая логика была использована для идентификации групп мутантов, которые позволяли рост других мутантов или которые были способны расти на соединениях, выделяемых другими группами мутантов. В случае триптофана существовало пять таких групп комплементации .
Из этих данных должно быть довольно легко вывести, что группа комплементации E идет последней на пути, а группа комплементации A идет первой.
Это не установило путь полностью. Следующим шагом была идентификация выводимых соединений и обеспечение роста других мутантов. Затем путь был установлен биохимически путем идентификации и очистки отдельных белков, которые выполняют стадии, соответствующие каждой группе комплементации, показывая, что ферменты ведут себя кинетически так, как предсказывали другие анализы, что было необходимо. Эти исследования показали, что белки, кодируемые группами A и B, являются частью комплекса (называемого триптофансинтазой).Точно так же генные продукты групп D и E связываются с образованием первого фермента, антранилатсинтетазы. Общий путь следующий:

Рисунок 3
Запрет обратной связи
Как видите, биосинтез аминокислот — сложный, энергоемкий процесс. Почти все биосинтетические пути регулируются, поэтому они не производят слишком много продукта. Этот процесс , ингибирование обратной связи , происходит на первом коммитированном этапе биохимического пути .В биосинтезе триптофана первым обязательным этапом является синтез антраниловой кислоты из хоризмата. Когда избыток триптофана доступен в результате биосинтетических реакций или из окружающей среды, он может связываться с участком антранилатсинтетазы. Это связывание с аллостерическим регуляторным сайтом делает фермент менее активным. Это означает, что хоризмат попадает в тирозиновый и фенилаланиновый пути. Более высокий уровень триптофана может частично подавлять синтез хоризмата, тем самым еще больше сберегая энергетические резервы клетки.
Катаболизм аминокислот
Избыточные аминокислоты разлагаются, а не хранятся почти во всех биологических системах. Основными исключениями являются формирование семян у растений и синтез желтка и белков в яйцах. Таким образом, диета с высоким содержанием белка обычно приносит мало пользы. Большинству здоровых людей требуется относительно небольшое количество диетического белка, если только они не растут дети. Типичная «западная диета» с большим потреблением мяса не нужна для здоровья.
Продукты распада аминокислот бывают двух видов. Кетоновые тела, то есть ацетоацетат и гидроксибутират, образуются в результате катаболизма аминокислот с разветвленной цепью, лизина и некоторых ароматических аминокислот. Промежуточные продукты цикла трикарбоновых кислот (TCA), включая пируват и глутамат, образуются из большинства других алифатических и ароматических аминокислот. Аминокислоты, метаболизм которых производит кетоновые тела, такие как ацетоацетат, называются кетогенными ; аминокислоты, метаболизм которых производит промежуточные продукты цикла TCA, называются глюкогенными , потому что промежуточные продукты цикла TCA являются субстратами для глюконеогенеза.Отдельные аминокислоты могут быть исключительно кетогенными, исключительно глюкогенными или и тем, и другим. Только лейцин и лизин считаются исключительно кетогенными, и остается некоторое подозрение, что они также могут вызывать промежуточные соединения цикла TCA.
Аминокислоты также являются предшественниками биологически важных соединений. У животных удаление группы карбоновой кислоты из аминокислот создает множество нейротрансмиттеров.
Допамин, необходимый для контроля движений, производится из тирозина (или фенилаланина, поскольку тирозин является прямым продуктом метаболизма фенилаланина).
Серотонин, передатчик, вызывающий сон, производится из триптофана.
γ-аминомасляная кислота (ГАМК) производится из глутамата.
Врожденные ошибки обмена аминокислот
Неспособность разлагать аминокислоты вызывает множество генетических заболеваний у людей. Эти заболевания включают фенилкетонурию (ФКУ), которая возникает в результате неспособности превращать фенилаланин в тирозин. Вместо этого фенилаланин трансаминируется в фенилпировиноградную кислоту, которая выводится с мочой, хотя и недостаточно быстро, чтобы предотвратить вред.Ранее ФКУ была основной причиной тяжелой умственной отсталости. Однако теперь лаборатории общественного здравоохранения проверяют мочу каждого новорожденного ребенка в Соединенных Штатах на наличие фенилпирувата и помещают детей с генетическим заболеванием на синтетическую диету с низким содержанием фенилаланина для предотвращения неврологических повреждений.
Биосинтез гема
Гемоглобин и миоглобин переносят кислород крови. Гем связан железом с кольцом из порфирина . Биосинтез порфирина начинается с δ-аминолевулиновой кислоты, продукта конденсации аминокислоты глицина с сукцинил-КоА.Кольцо образовано конденсацией «голова к хвосту» двух молекул δ-аминолевулиновой кислоты с образованием порфобилиногена.
Обратите внимание на образование основания Шиффа, которое образует 5-членное кольцо.
Гем содержит четыре таких кольца. Четыре порфобилиногена конденсируются голова к хвосту с образованием первых тетрапиррольных разновидностей, которые затем циркулируют, образуя порфириновый скелет. Дальнейшие модификации с последующим добавлением Fe (II) приводят к гему.

Рисунок 4
Врожденные болезни обмена веществ, которые препятствуют биосинтезу гема, называются порфириями. Порфирии имеют множество симптомов. Дефицит фермента, ответственного за конденсацию порфобилиногена в 4-членной кольцевой системе, приводит к состоянию, называемому острой перемежающейся порфирией, , которое характеризуется периодическими эпизодами боли в животе и психиатрическими симптомами. Дефекты более поздних ферментов этого метаболического пути приводят к избыточному накоплению уропорфобилиногенов в тканях, где они вызывают различные симптомы, включая волосатую кожу, аномалии скелета, светочувствительность и красную мочу.Люди с этим заболеванием все еще страдают анемией — состояние, которое можно несколько облегчить с помощью гема, полученного при употреблении крови. Эта комбинация черт похожа на легенды об оборотнях и вампирах Европы, в основе которых лежит это редкое биохимическое заболевание.
.
Краткое руководство по двадцати распространенным аминокислотам — сложный процент
нажмите, чтобы увеличитьБелки, из которых состоят живые организмы, представляют собой огромные молекулы, но они состоят из более мелких строительных блоков, известных как аминокислоты. В природе содержится более 500 аминокислот, однако из них генетический код человека напрямую кодирует только 20. Каждый белок в вашем теле состоит из некоторой связанной комбинации этих аминокислот — на этом графике показана структура каждой, а также дает небольшую информацию об обозначениях, используемых для их представления.
В общих чертах эти двадцать аминокислот можно разделить на две группы: незаменимые и несущественные. Незаменимые аминокислоты — это те аминокислоты, которые человеческий организм способен синтезировать, тогда как незаменимые аминокислоты должны быть получены с пищей. Заменимые аминокислоты — это аланин, аргинин, аспарагин, аспартат, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин; некоторые из них также можно назвать «условно незаменимыми», что означает, что они могут потребоваться из рациона во время болезни или в результате проблем со здоровьем.Эта подкатегория включает аргинин, глицин, цистеин, тирозин, пролин и глутамин. Незаменимыми аминокислотами являются гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Аминокислоты не могут храниться в организме так же, как жир и крахмал, поэтому важно, чтобы мы получали те, которые мы не можем синтезировать из своего рациона. Несоблюдение этого правила может привести к подавлению синтеза белка в организме, что может иметь широкий спектр последующих последствий для здоровья.Аминокислоты получаются в результате расщепления белка в рационе, поэтому диета с дефицитом белка может повлиять на потребление незаменимых аминокислот.
Поскольку белки, образованные аминокислотами, могут быть невероятно большими молекулами, потребуется очень много времени и сложно определить их химическую структуру так же, как мы делаем для более мелких молекул. По этой причине общие аминокислоты, из которых состоят белки, имеют коды, которые можно использовать для их представления, когда они встречаются в молекулах, чтобы упростить описание структуры белков.Существуют как трехбуквенные, так и однобуквенные коды; происхождение однобуквенных кодов было связано с требованием, когда компьютеры были старше и неуклюже, уменьшить размер файлов, используемых для описания последовательностей аминокислот, составляющих белки. Эти однобуквенные коды были разработаны доктором Маргарет Окли Дейхофф, которая считается пионером в области биоинформатики (использующей программное обеспечение и информационные системы для хранения, организации и интерпретации биологических данных).
Хотя на этой диаграмме показаны 20 аминокислот, которые непосредственно кодирует генетический код человека, были некоторые споры о том, следует ли другую аминокислоту классифицировать как 21-ю.Селеноцистеин — это аминокислота, которая содержится в небольшом количестве белков человека; Однако в отличие от 20, изображенного здесь, он кодируется не напрямую, а особым образом. Еще один, пирролизин, кодируется аналогичным образом и считается 22-й аминокислотой.
(Примечание. Другой способ разделения аминокислот основан на их физических свойствах. Краткое изложение этого метода категоризации аминокислот можно увидеть здесь.)
Вы также можете загрузить версию рисунка, на котором показаны кодоны ДНК для каждой из аминокислот, а также структуры при физиологическом (физиологическом) pH.
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
.Chem4Kids.com: Биохимия: двадцать аминокислот
Для существования человека необходимы двадцать аминокислот. Взрослым нужно девять незаменимых аминокислот, которые они не могут синтезировать и должны получать с пищей. Остальные одиннадцать могут быть произведены в наших телах. В дополнение к двадцати аминокислотам, которые мы вам показываем, есть другие, которые встречаются в природе (и некоторые в очень небольших количествах у нас).Эти двадцать являются самыми важными для нашего вида и определены как стандартных аминокислот.
| Тип : неполярный | Тип: Ionic |
| Тип : Полярный | Тип: Ionic |
| Тип : Полярный | Тип: Ionic |
| Тип : Полярный | Тип: Неполярный |
| Тип : Ионный | Тип: Неполярный |
| Тип : неполярный | Тип: Ionic |
| Тип : неполярный | Тип: Неполярный |
| Тип : неполярный | Тип: Полярный |
| Тип : Полярный | Тип: Неполярный |
| Тип : Полярный | Тип: Неполярный |
Аминокислоты в астероидах? (Наука @ НАСА Видео)
Chem4Kids Разделы
Сеть сайтов по науке и математике Рейдера
.

