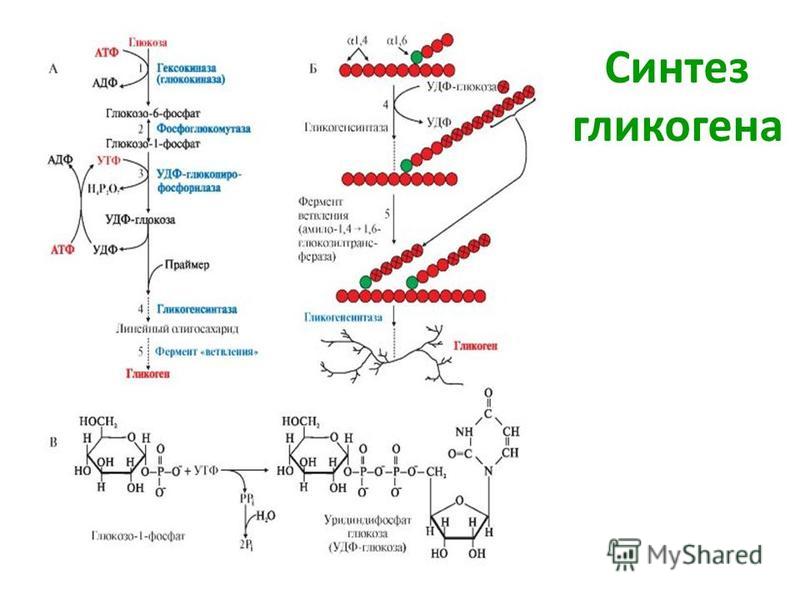
3. Нарушение синтеза и расщепления гликогена в организме. Гликогенозы.
Гликоген является депонированной формой глюкозы и не обладает осмотическим
эффектом.
Снижение синтеза гликогена наблюдается при тяжелом поражении печеночных
клеток, например при гепатитах, когда нарушается их глико-генообразовательная
функция. Синтез гликогена снижается при гипоксии, так как в условиях гипоксии
уменьшается образование АТФ, необходимой для синтеза гликогена.
Усиление распада гликогена (гликогенолиз)
происходит при стрессе, эмоциональном
напряжении (активации симпатических
нервных путей), тяжелой мышечной работе,
голодании, повышении активности
контринсулярных гормонов (глюкагон,
адреналин, и др.), стимулирующих
гликогенолиз, диабетическом кетоацидозе.
При уменьшении в организме гликогена
наблюдается гипогликемия, а энергетический
обмен обеспечивается за счет жирового
и белкового обмена (глюконеогенез). В
результате развиваются накопление
кетоновых тел, кетоацидоз, интоксикация
и потеря пластического материала
клетками.
болезни), в основе которых лежит врожденный дефицит ферментов, катализирующих
распад или синтез гликогена. Гликогенозы наследуются по аутосомно-рецессивному типу
и, как правило, проявляются вскоре после рождения. Описано 12 типов гликогенозов, но
часть из них наблюдается очень редко. Чаще всего встречаются следующие типы:
Гликогеноз I типа(болезнь фон Гирке) — врожденный дефицит в печени и почках
фермента глюкозо-6-фосфатазы, который отщепляет свободную глюкозу от глюкозо-6-
фосфата, что делает возможным ее трансмембранный переход из клеток печени и почек в
кровь. При недостаточности глюкозо-6-фосфатазы в клетках печени и почек (особенно в
ядре клеток) накапливается гликоген. Печень и почки увеличиваются в размере.
Развивается гипогликемия. Больные
вынуждены очень часто принимать пищу.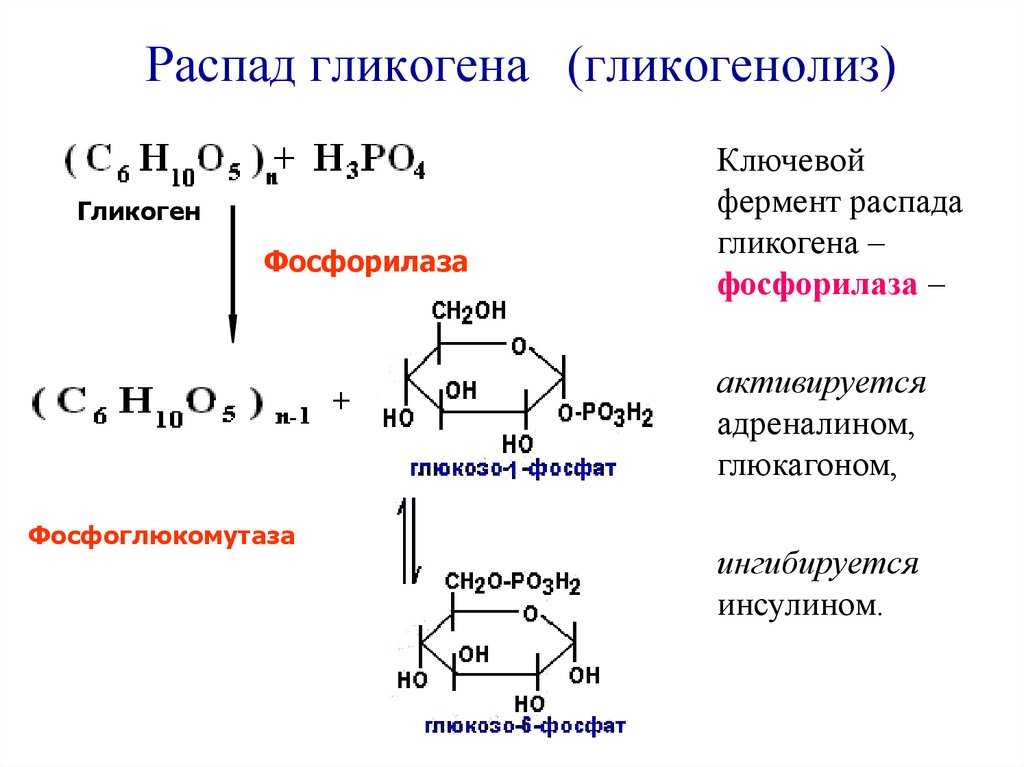 В крови
В крови
возрастает содержание молочной кислоты, в которую при дефиците глюкозо-6-фосфатазы
усиленно переходит глюкозо-6-фосфат. Развивается метаболический ацидоз. Больные
дети отстают в физическом развитии и, как правило, рано умирают от интерферентных
заболеваний или от ацидотической комы.
Гликогеноз II типа(болезнь Помпе) составляет 10% от всех гликогенозов,
наблюдается при врожденном дефиците кислой а-1,4-глюкозидазы. Этот фермент
содержится в лизосомах. Он отщепляет глюкозные остатки от молекул гликогена и
расщепляет мальтозу. В лизосомах клеток различных тканей и органов накапливается
гликоген, который оттесняет цитоплазму, заполняет всю клетку и разрушает ее.
Симптомы гликогеноза появляются через несколько суток или недель после рождения.
Отложение гликогена в языке ведет к его увеличению, в диафрагме — к нарушению
дыхания и т.д. Ведущим симптомом является увеличение сердца (кардиомегалия)
вследствие отложения в нем гликогена. Эта форма гликогеноза наиболее
злокачественная
Эта форма гликогеноза наиболее
злокачественная
и больные дети рано умирают от сердечной недостаточности, но может быть
диагностирована путем амниоцентеза в пренатальном периоде.
Гликогеноз III типа(болезнь Форбса-Кори) возникает при полной или частичной
недостаточности фермента амило-1,6-глюкозидазы, его проявления (гипогликемия,
мышечная слабость, кетоз) напоминают гликогеноз I типа. Однако прогноз
благоприятный, так как в пубертатном периоде развитие болезни замедляется. Данное
заболевание составляет 1А всех случаев гликогенозов, протекающих с гепатомегалией.
Гликогеноз IV типа(болезнь Андерсена) — диффузный гликогеноз с циррозом
печени. В его основе лежит врожденный дефицит фермента D-1,4-гаюкаи- а-глюкозил-трансферазы, обеспечивающего ветвление гликогена. В печени, селезенке и других тканях
накапливается измененный гликоген — с малым числом точек ветвления. Функция
органов, в особенности печени, нарушается.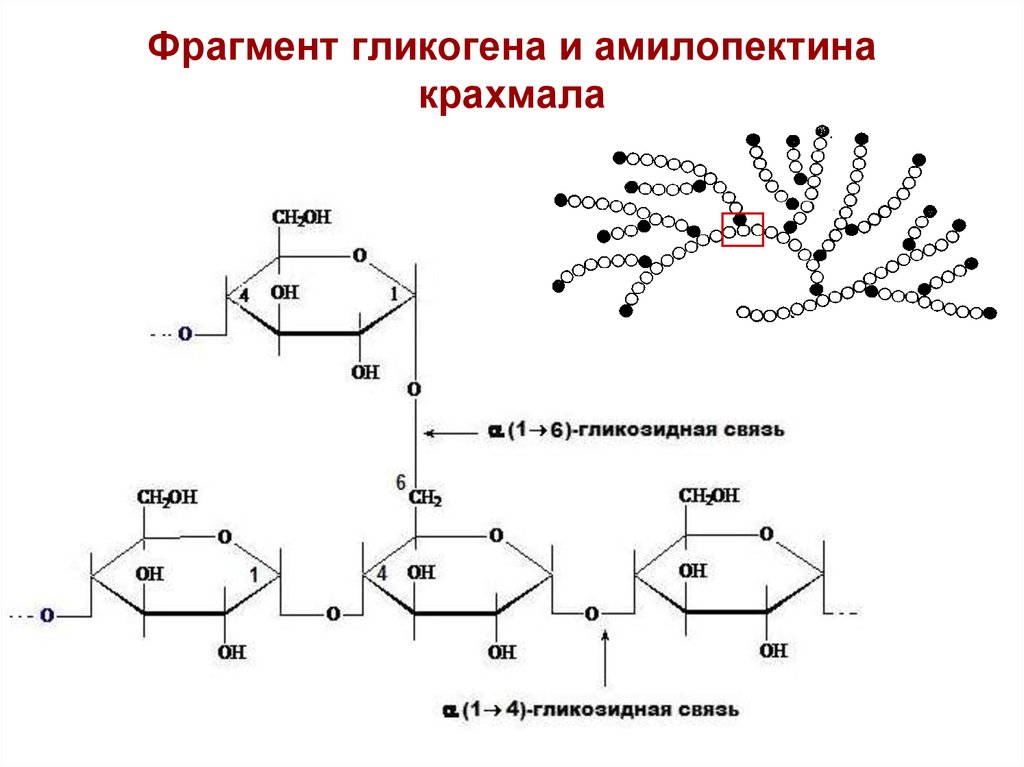 Признаки гликогеноза проявляются вскоре
Признаки гликогеноза проявляются вскоре
после рождения. Развиваются цирроз печени и желтуха, выражена гипогликемия. Больные
дети обычно погибают на первом году жизни, так как в отличии от выше описанных
гликогенозов практически не поддается лечению.
Указанные виды гликогенозов развиваются либо с нарушением структуры
гликогена (Ш, IV типы), либо без таковой (1, II типы). Кроме приведенных, описаны более
редкие, а также смешанные формы гликогенозов — V тип-болезнь Марк-Ардль (дефект-
мышечной фосфорилазы — отложение гликогена в мышцах, судороги при физической
нагрузки), VI-Геру (Херса) (фосфорилазы печени — гипогликемия, но легчем чем при
болезни Гирке).
В настоящее время доминирует классификация гликогенозов по патогенезу. В ней
их делят на: печеночные, мышечные и смешанные формы.
Статьи – АКАДЕМИЯ-Т
Medikal-biological aspects of creation and application of special-purpose protein-carbohydrateproducts for sportsmen.
I.A. Bastrikov
The article briefly sheds light on problems of creation and application of special – purpose protein-carbohydrate products – nutritional cocktails – in nutrition for sportsmen in different stages of the training and contents. Possessing a higher biological and nutritive value, these products permit fast hardworking and initializing repair process of the human body after heavy and intensive muscle loading.
Для корреспонденции:
Бастриков Иван Александрович – аспирант Московского государственного университета прикладной биотехнологии.
Адрес: 109316, г. Москва, ул. Талалихина, д. 33
Тел.: (495) 677-03-81
Питание для спортсменов.
Аспирант: Бастриков И.А.
Медико-биологические аспекты создания и применения специализированных белково-углеводных продуктов питания для спортсменов.
Московский Государственный Университет Прикладной Биотехнологии
Ни один фактор, за исключением наследственности и адаптации к физическим нагрузкам при тренировках, не оказывает столь сильного влияния на спортивный результат, как питание. Эффективность развития силовых и скоростно-силовых качеств спортсменов связана с активизацией синтеза тканевых белков в работающих мышцах и восполнения уровня гликогена в мышцах и печени. Содержание гликогена в мышцах при интенсивных упражнениях можно снизить менее чем за час, но восстановить его до прежнего уровня за счет повседневной пищи удается лишь за несколько дней [1,3,14]. Помимо этого традиционное повседневное питание не обеспечивает поступление в организм достаточного количества легкоусвояемых белков, особенно незаменимых аминокислот, а также не гарантирует необходимое их соотношение. Поэтому восстановление уровня гликогена и усиление синтеза новых мышечных волокон поддерживается дополнительным поступлением в организм спортсмена углеводов и белков, что чаще достигается включением в рацион питания спортсменов специализированных белково-углеводных пищевых смесей, характеризующихся повышенной биологической ценностью[13,22].
Такие пищевые продукты обладают рядом особенностей. Они производятся из комплекса углеводов с разной длиной цепи, белкового сырья, могут содержать среднецепочечные триглицериды, богаты различными микронутриентами (витаминными, минеральными веществами), которые стимулируют энергетический обмен и синтез белка в организме. Ассортимент белково-углеводных продуктов, используемых в питании спортсменов, с каждым годом расширяется [1,2,5].
В данной статье приводится краткий обзор имеющихся в настоящее время на рынке специализированных белково-углеводных продуктов и смесей, применяющихся в питании спортсменов, основное внимание уделяется медико-биологическим аспектам создания и использования этих пищевых продуктов и смесей.
Основными факторами, влияющими на скорость восстановления гликогена после физической нагрузки, являются: количество и качество углеводов, их тип, время и кратность употребления, тип физической нагрузки[17,22].
Согласно данным литературы, скорость ресинтеза гликогена мышц максимальна, если прием углеводов происходит непосредственно после завершения физической нагрузки. Таковой она поддерживается в течение 2 часов. Если прием углеводов происходит спустя 2 часа после физической нагрузки, то скорость образования гликогена снижается на 50%, несмотря на высокие концентрации глюкозы в крови и инсулина. Объяснение этому факту кроется в снижении чувствительности мышц к инсулину в этот период [3,20,25].
Таковой она поддерживается в течение 2 часов. Если прием углеводов происходит спустя 2 часа после физической нагрузки, то скорость образования гликогена снижается на 50%, несмотря на высокие концентрации глюкозы в крови и инсулина. Объяснение этому факту кроется в снижении чувствительности мышц к инсулину в этот период [3,20,25].
Достаточно действенным для ресинтеза гликогена признается частый прием небольших количеств углеводов после физической нагрузки, так как в таком случае поддерживаются высокие концентрации инсулина и глюкозы в крови и эффект от употребления углеводов продлевается[18,19,20].
В соответствии с международной практикой, а также в связи с тем, что специализированные белково-углеводные продукты не единственный для спортсмена источник белков и углеводов, можно полагать, что ежедневная порция специализированного белково-углеводного продукта должна обеспечивать 40-70% суточной потребности спортсмена в рациональном питании [1,3,5]. При этом чрезвычайно важно определить содержание белков и углеводов в рационе, необходимое для обеспечения потребностей спортсмена в зависимости от его специализации и уровня подготовки. При занятиях видами спорта, требующими выносливости (бег, плавание, лыжные гонки), рекомендуется рацион, в котором доля углеводов суточного рациона составляет 70-75%, доля белков суточного рациона – 14-15%, при занятиях игровыми видами спорта (баскетбол, хоккей, теннис и др.) доля углеводов суточного рациона снижается до 55-60%, а белка возрастает до 15-16%, при занятиях скоростно-силовыми видами спорта (метание, прыжки, спринтерские дистанции) и силовые виды спорта (тяжелая атлетика, силовое троеборье, бодибилдинг) потребность в белках возрастает до 18-20%, в углеводах — до 60-70% [3, 6, 12,15].
При занятиях видами спорта, требующими выносливости (бег, плавание, лыжные гонки), рекомендуется рацион, в котором доля углеводов суточного рациона составляет 70-75%, доля белков суточного рациона – 14-15%, при занятиях игровыми видами спорта (баскетбол, хоккей, теннис и др.) доля углеводов суточного рациона снижается до 55-60%, а белка возрастает до 15-16%, при занятиях скоростно-силовыми видами спорта (метание, прыжки, спринтерские дистанции) и силовые виды спорта (тяжелая атлетика, силовое троеборье, бодибилдинг) потребность в белках возрастает до 18-20%, в углеводах — до 60-70% [3, 6, 12,15].
Рассматривая влияние вида физической нагрузки на синтез гликогена, стоит вспомнить об эндогенном субстрате для синтеза гликогена – лактате. Если физическая нагрузка приводит к быстрому снижению концентрации гликогена, то это вызывает увеличение лактата в крови и мышцах, и синтез гликогена в этом случае может быть весьма интенсивным. В свою очередь, продолжительные физические нагрузки истощают запасы лактата, что приводит к возрастающей роли экзогенных источников углеводов [4,6].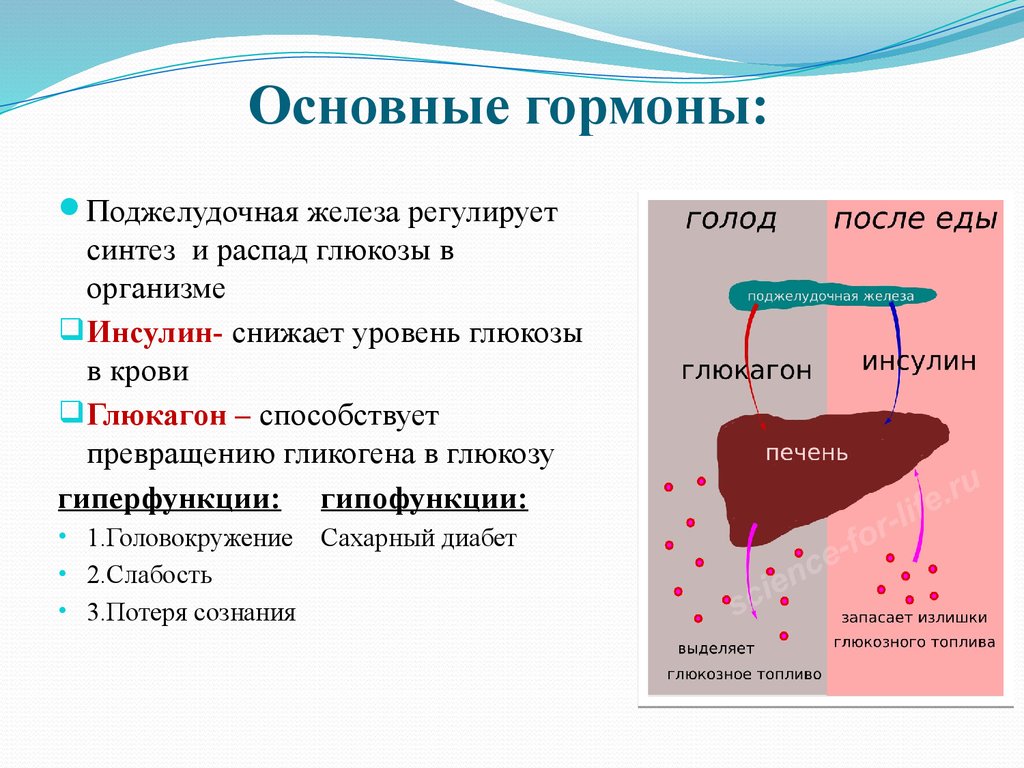
Потребность организма в белке в среднем составляет 1,3-2,3 г на 1 кг массы тела. При интенсивных тренировках, в связи с физиологическими потерями азота вследствие продолжительной мышечной деятельности, содержание белка в рационе должно быть повышенно до 2,3 г/кг [3,6,9]. Однако это не означает отсутствия потенциальной возможности отрицательных эффектов от потребления высокого количества белка. Считается, что избыточное потребление белка (свыше 2,3 г/кг) не целесообразно, так как при этом количестве ухудшается усвоение белка, в результате образуются продукты обмена – аммиак и мочевина, которые, в свою очередь, повышают нагрузку на печень и почки. Повышенное количество аммиака оказывает токсическое воздействие на клетки головного мозга, что может вызвать на фоне происходящего при этом замедления скорости передачи нервных импульсов заметное снижение реакции спортсмена. Высокий уровень аммиака оказывает также губительное воздействие на микробиоценоз толстой кишки, снижая содержание в ней бифидо- и лактобактерий [2,6,11].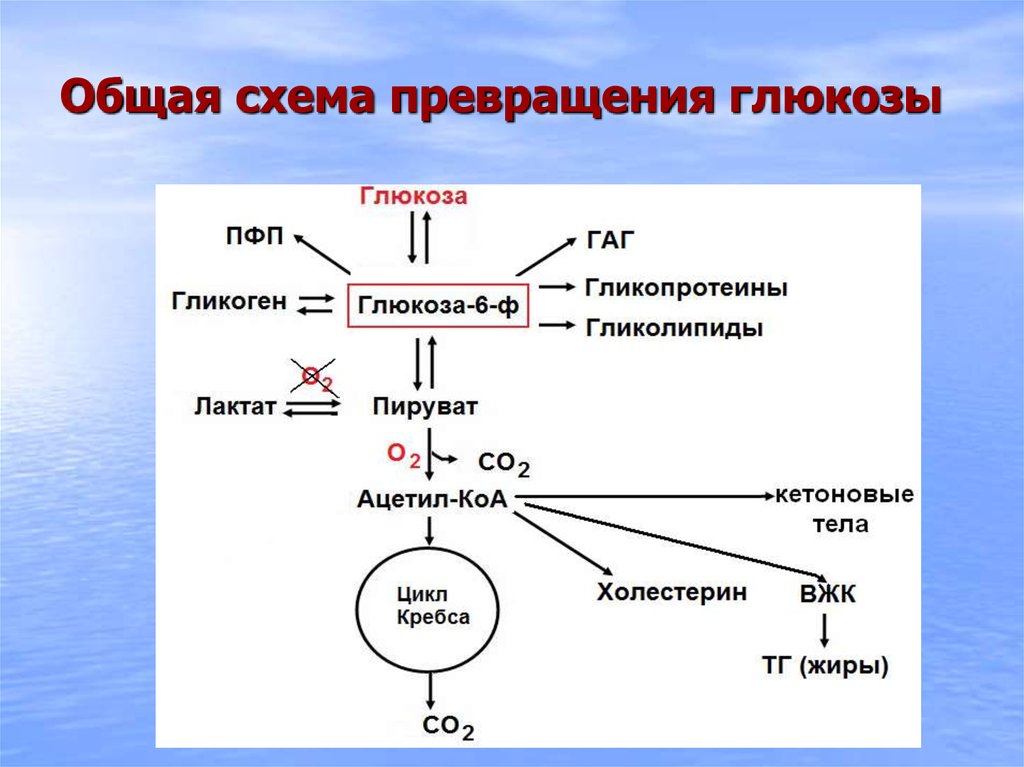
Стоит подчеркнуть, что не зависимо от количества белка обязательным является присутствие в рационе спортсмена углеводов, без адекватного количества которых снижается образование АТФ (аденозинтрифосфорной кислоты), усиливается катаболизм мышц (через глюконеогенез). В целях максимального восстановления мышечного гликогена после физической нагрузки и/или оптимизации его запасов перед соревнованиями спортсмен ежедневно должен употреблять 7-10 г углеводов на кг массы тела, причем тип употребляемых углеводов имеет весомое значение[22,24]. Употребление «простых» углеводов (моно-, ди-, и олигосахариды), вызывают значительный и кратковременный подъем концентраций глюкозы в крови. Они имеют сладкий вкус, расщепляются полностью, к насыщению, как правило, не приводят. Применение в рационе питания «сложных» углеводов (полисахариды) приводит к сглаженному и более продолжительному ответу со стороны глюкозы крови, тем самым способствуя насыщению гликогена мышц [3,5].
Углеводы, поступившие с пищей в организм, служат, в первую очередь, для обеспечения глюкозой скелетных мышц, как во время выполнения физических упражнений, так и в восстановительном периоде.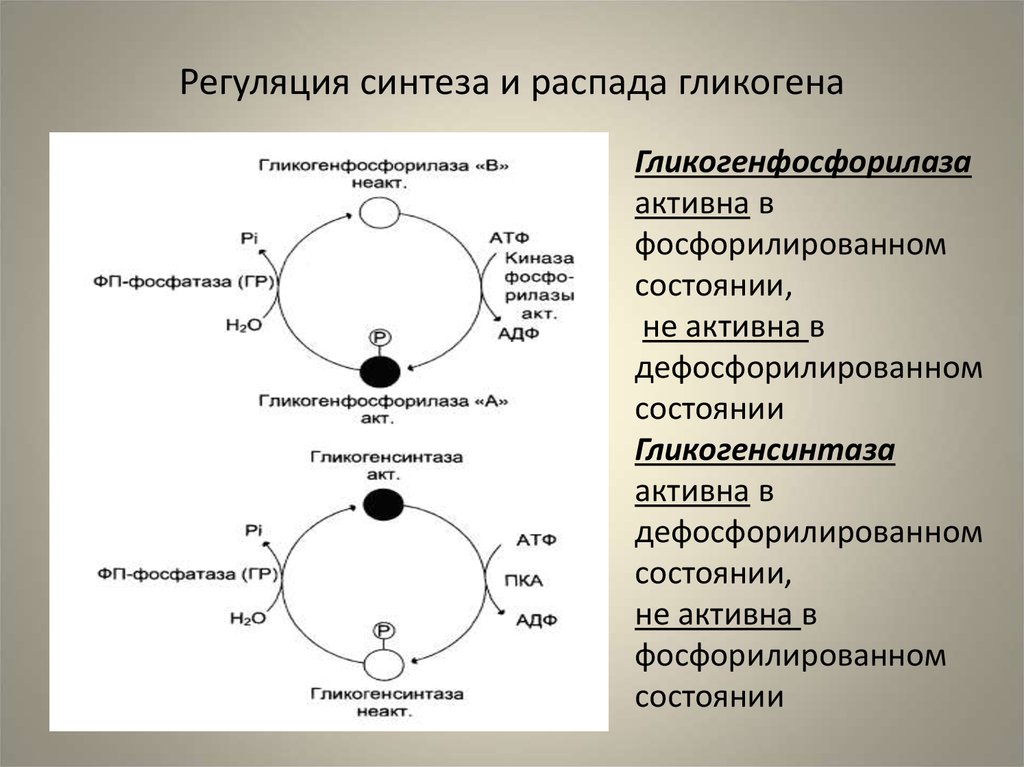 И только во вторую очередь наличие глюкозы и фруктозы в печени используется для синтеза в этом органе гликогена [1,4].
И только во вторую очередь наличие глюкозы и фруктозы в печени используется для синтеза в этом органе гликогена [1,4].
С точки зрения представлений об изменении концентрации глюкозы крови в ответ на употребление различных углеводсодержащих продуктов более предпочтительным является разделение продуктов по принципу «гликемического индекса». Это понятие появилось в начале 80-х годов и, согласно исследованиям, вполне подходит для характеристики продуктов комплексной природы, содержащих углеводы [22].
Применение информации о гликемическом индексе углеводсодержащих продуктов в питании спортсменов важно для оптимизации процессов восстановления гликогена. В период после продолжительной физической нагрузки спортсменам рекомендуется употребление продуктов с высоким и средним гликемическим индексом, так как они увеличивают запасы мышечного гликогена в большей степени, чем углеводные продукты, характеризующиеся низким гликемическим индексом[3, 22].
Некоторые различия в метаболизме простых углеводов, в частности большой выброс инсулина после потребления полимеров глюкозы, чем фруктозы, ведут к предпочтительному использованию полимеров глюкозы для восстановления мышечного гликогена. Согласно данным литературы применение смеси мальтодекстрина и фруктозы (смесь углеводов с высоким и низким гликемическим индексом) приводит к повышению скорости окисления экзогенных углеводов по сравнению с использованием каждого углевода в отдельности [9,17].
Согласно данным литературы применение смеси мальтодекстрина и фруктозы (смесь углеводов с высоким и низким гликемическим индексом) приводит к повышению скорости окисления экзогенных углеводов по сравнению с использованием каждого углевода в отдельности [9,17].
К одному из важных факторов, способствующих усилению в мышцах синтеза белка, необходимого для обеспечения высокой тренированности мышечной системы и адаптации организма к силовым нагрузкам, можно отнести высокую биологическую ценность пищевого белка и его усвояемость. Как известно, биологическую ценность белков можно охарактеризовать, как способность удовлетворять в количественном и качественном соотношении потребности организма в азотистых веществах. Этот процесс зависит от сбалансированности аминокислотного состава рациона, прежде всего по незаменимым аминокислотам. Для биосинтеза белка в организме человека требуется, как известно, наличие всех 8 незаменимых аминокислот, которые при этом должны находиться в определенном соотношении, максимально приближенном к эталонному белку ФАО/ВОЗ [12,14].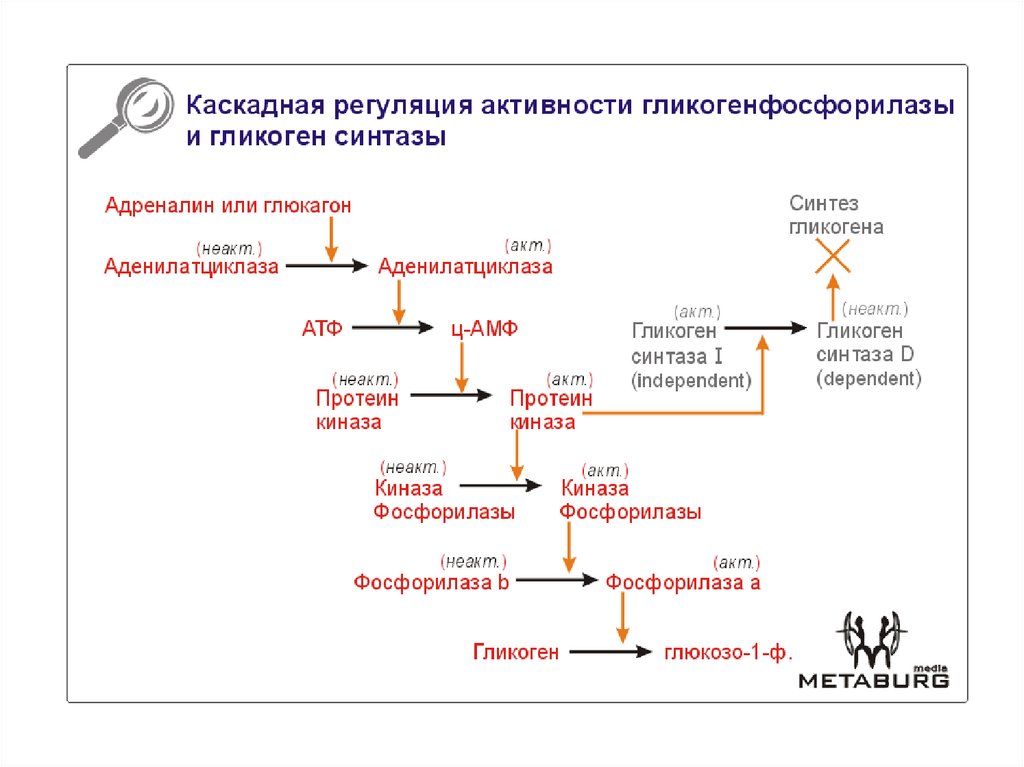 Нарушение сбалансированности аминокислотного состава белка, поступающего с пищей, приводит к изменению синтеза собственных белков в организме спортсмена. Недостаток той или иной незаменимой аминокислоты лимитирует использование других аминокислот в процессе построения белка, а значительный избыток ведет к образованию высокотоксичных продуктов обмена, не использованных для синтеза аминокислот. Не менее важна степень усвояемости белка, которая отражает его расщепление в желудочно-кишечном тракте, а также последующее всасывание аминокислот в кровь и далее – в мышцы [1,3,10].
Нарушение сбалансированности аминокислотного состава белка, поступающего с пищей, приводит к изменению синтеза собственных белков в организме спортсмена. Недостаток той или иной незаменимой аминокислоты лимитирует использование других аминокислот в процессе построения белка, а значительный избыток ведет к образованию высокотоксичных продуктов обмена, не использованных для синтеза аминокислот. Не менее важна степень усвояемости белка, которая отражает его расщепление в желудочно-кишечном тракте, а также последующее всасывание аминокислот в кровь и далее – в мышцы [1,3,10].
В настоящее время наилучшими источниками высококачественного белка для спортсменов являются молочные белки. Молочные белки состоят из казеина (85%) и сывороточных белков (15%). Они переваривается и усваиваются равномерно: сначала – низкомолекулярные белки сыворотки, затем – высокомолекулярный казеин. Такое свойство молочного белка особенно важно при его использовании в диетических целях и для восстановления мышц после физической нагрузки различной интенсивности [2,7].
Белки молочной сыворотки (лактальбумин, лактоглобулин и иммуноглобулин) имеют наивысшие среди цельных белков скорость расщепления и степень усвояемости. Особую ценность представляют биологически активные низкомолекулярные микрофракции сывороточных беков – гликомакропептиды, составляющие 20% сывороточных белков. Они снижают риск возникновения вирусных инфекций, улучшают пищеварение и усвоения белка и кальция, способствуют развитию нормальной микрофлоры кишечника[1,4,7].
Сывороточные протеины различают по способам обработки на концентраты, изоляты и гидролизаты. Концентраты и изоляты сывороточных белков получают путем микрофильтрации творожной или подсырной сыворотки; после этого при необходимости проводят отдельную очистку белка от остатков лактозы, жира и минеральных солей. Главное требование к технологическим методам – сохранение в белковом продукте натуральной формы белковых молекул, обеспечивающих максимальное сохранение их биохимических свойств. Происходящий при производстве частичный гидролиз (расщепление) молекул дополнительно повышает ценность конечного продукта – образующиеся пептиды способны увеличивать уровень инсулинподобного фактора роста IGF-1, снижать содержание холестерина в крови и т.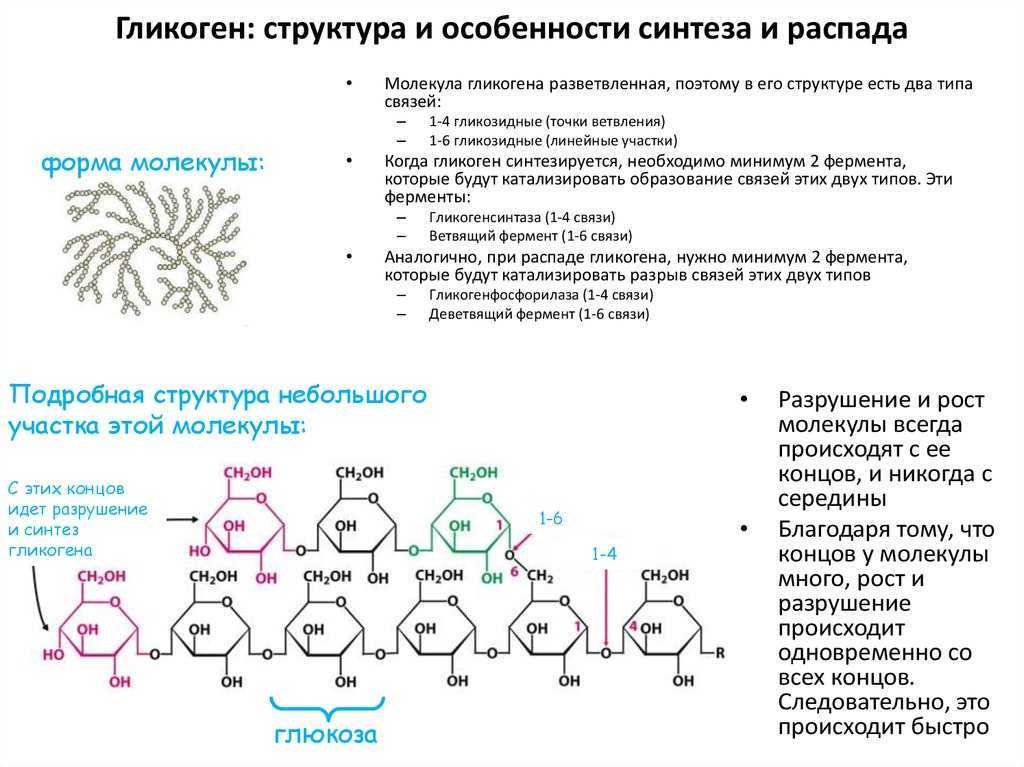 д. [4,7,14,15]
д. [4,7,14,15]
Для лучшего обеспечения организма аминокислотами до, во время и после тренировок в состав специализированных белково-углеводных продуктов, предназначенных для питания спортсменов, рекомендуется включать – концентраты, изоляты и гидролизаты сывороточного белка. Во многих указанных продуктах (в частности, «Complete Gainer Power» от ISS и «Pro Complex Gainer» от Optimum Nutrition) белок входящий в их состав, частично разложен на пептиды (соединения длинно- и короткоцепочечных аминокислот).
До недавнего времени считалось, что организм может усвоить до 50 г белка за один прием, но согласно данным литературы, добавление такого количества белка и более замедляет усвояемость углеводов, соответственно замедляет скорость восстановления мышечного гликогена. Однако сегодня хорошо известно, что скорость усвоения белков и углеводов достаточно условная величина, и она определяется, прежде всего, возможностями собственной ферментативной системы организма спортсмена. В связи с этим многие производители (в частности, Bioplex, Next Proteins и др.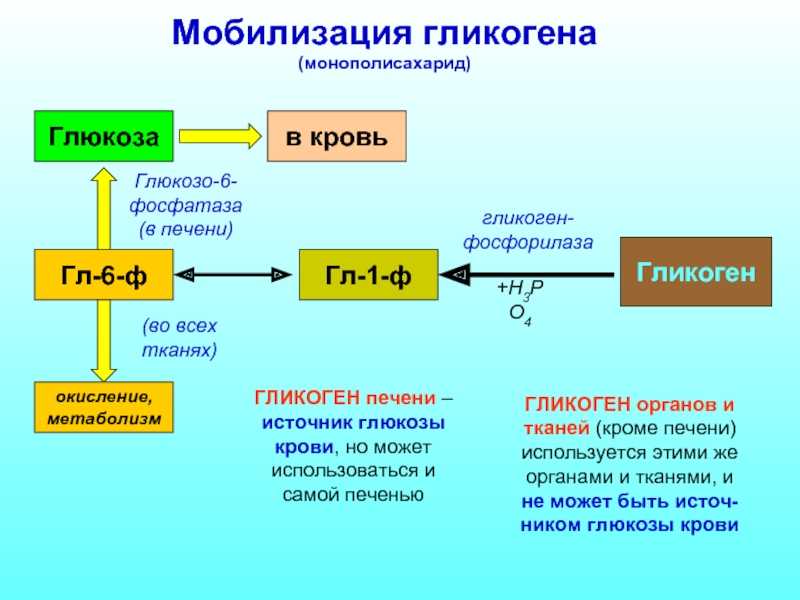 ) обогащают белково-углеводные смеси, используемые в питании спортсменов, различными комплексами пищеварительных энзимов (например, патентованные композиции энзимов «AminoGen» и «CarboGen»), что способствует ускорению процессов усвоения белков и углеводов и предупреждает побочные эффекты (вздутие живота, запор и другие признаки расстройства пищеварительной системы) [9,12].
) обогащают белково-углеводные смеси, используемые в питании спортсменов, различными комплексами пищеварительных энзимов (например, патентованные композиции энзимов «AminoGen» и «CarboGen»), что способствует ускорению процессов усвоения белков и углеводов и предупреждает побочные эффекты (вздутие живота, запор и другие признаки расстройства пищеварительной системы) [9,12].
Как правило, в состав специализированных белково-углеводных композиций входят смеси, приготовленные из нескольких видов белков, что обуславливает улучшение аминокислотного профиля (этого добиваются с помощью гармоничного сочетания взаимодополняющих белков и/или добавлением пептидов или отдельных аминокислот) [1,3].
Углеводный комплекс в специализированных белково-углеводных пищевых смесях для питания спортсменов (в частности, «Anator P70» от Muscletech, «Muscle Supergainer» от Multipower Sportsfood, и др.) представлен несколькими видами углеводов – мальтодекстрин, полимеры глюкозы, фруктоза. Разная скорость усвоения углеводов способствует обеспечению организма спортсмена энергией в течение длительного времени, улучшают процесс восполнения гликогена и поддерживают стабильный уровень сахара в крови [5,9,21].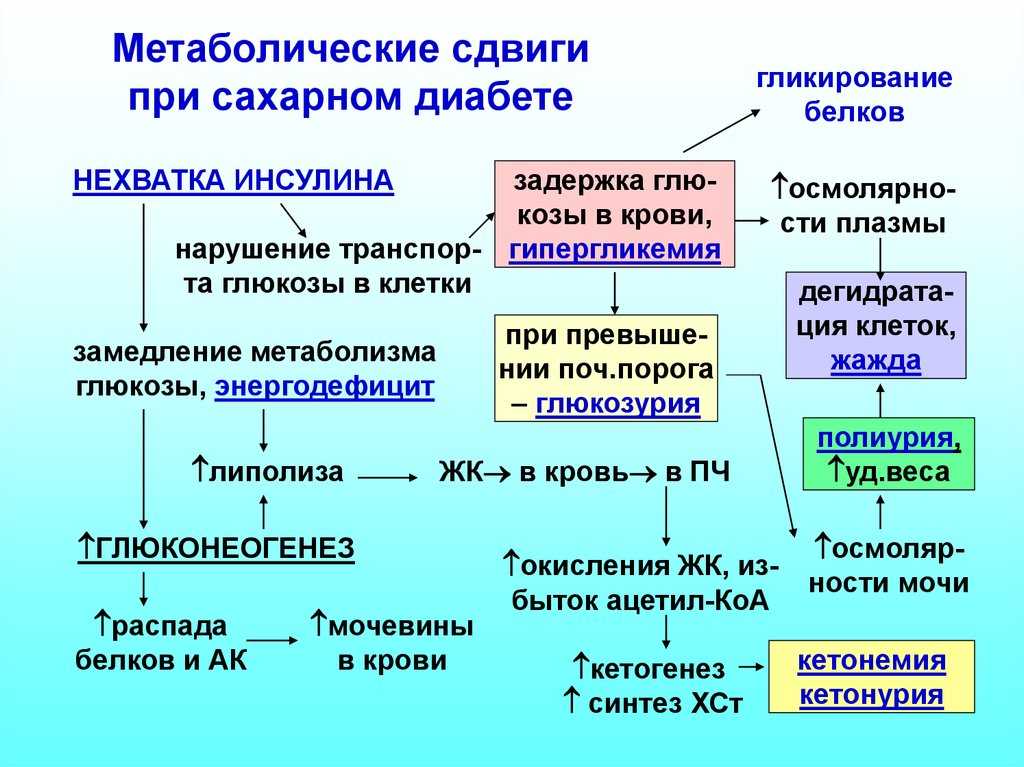
Наиболее популярны на рынке специализированные белково-углеводные продукты, содержащие в своем составе сывороточный, соевый, молочный белки и яичный альбумин (например, «Super Mass Gainer» от Dymatize Nutrition, «Muscle Juice 2544» от Ultimate Nutrition и др.). Многие из таких продуктов (в частности, «Goliath» от Syntrax и «Muscle XGF» от AST) содержат также гидролизованный белок пшеничной клейковины. Подобная комбинация различных видов белка обеспечивает медленное и продолжительное высвобождение аминокислот, поступающих в кровообращение, что улучшает весь синтез белков и, как было доказано, уменьшает разрушение мышечной ткани на 34 % [9,14].
Для дополнительного стимулирования в организме синтеза мышечных волокон в специализированные белково-углеводные продукты обычно добавляют различные микронутриенты, прежде всего витамины, минеральные вещества и др. В их состав входят не отдельно взятые витамины и минералы, а, как правило, правильно подобранные комбинации – витаминные и минеральные премиксы в определенном количественном соотношении между собой и другими пищевыми веществами. Последнее связано и с тем, что многие химические процессы в организме катализируются одновременно несколькими взаимодействующими витаминами, макро- и микроэлементами [8,16,23].
Последнее связано и с тем, что многие химические процессы в организме катализируются одновременно несколькими взаимодействующими витаминами, макро- и микроэлементами [8,16,23].
Очень многие специализированные белково-углеводные продукты, предназначенные для питания спортсменов, обогащены витаминами и минеральными веществами. Например, в составе продуктов «Volumass 35» (от Sci Tec Nutrition) и «Anabolic Evolution» (от Weider) содержат запатентованный комплекс «ZMA», который включает в себя аспартатно-метионовый комплек цинка, аспартат магния и витамин В6, что значительно снижает секрецию кортизола (гормон катаболизма), повышая усвоение и синтез белка в организме [2,3,23].
Многие производители питания для спортсменов уделяют большое внимание содержанию в специализированных белково-углеводных продуктах антиоксидантов, пищевых иммуномодуляторов, добавляя их в заведомо большем количестве. Так, во многих специализированных белково-углеводных продуктах (например, «After Shock» от Myogenix, «Myodrive» от SAN и др. ) увеличено содержание глютатиона, выполняющего роль первичного антиоксиданта в организме, а также содержится повышенное содержание креатина, глютамина и аргинина, ускоряющих энергообмен и стимулирующих синтез гормона роста. Более 50% белково-углеводных смесей обогащены витаминами (А, С, Е, РР и др.) и минеральными веществами (цинк, селен), обладающими антиоксидантными свойствами. Также для усиления иммунной системы организма в белково-углеводные смеси вносят молозиво (например, «Anabolic Trigger» от Nutrabolics, «Gain Fast 3100» от Universal Nutrition, «Whey Colostrum 185» от Sponser). Также молозиво содержит в своем составе IGF-1 и IGF-2 (инсулиноподобные факторы роста) – вещества, которые способствуют регулированию холестерина и сахара в крови, участвуют в метаболизме белков, жиров и углеводов в организме и способствуют построению качественной мускулатуры [1,3,5,14].
) увеличено содержание глютатиона, выполняющего роль первичного антиоксиданта в организме, а также содержится повышенное содержание креатина, глютамина и аргинина, ускоряющих энергообмен и стимулирующих синтез гормона роста. Более 50% белково-углеводных смесей обогащены витаминами (А, С, Е, РР и др.) и минеральными веществами (цинк, селен), обладающими антиоксидантными свойствами. Также для усиления иммунной системы организма в белково-углеводные смеси вносят молозиво (например, «Anabolic Trigger» от Nutrabolics, «Gain Fast 3100» от Universal Nutrition, «Whey Colostrum 185» от Sponser). Также молозиво содержит в своем составе IGF-1 и IGF-2 (инсулиноподобные факторы роста) – вещества, которые способствуют регулированию холестерина и сахара в крови, участвуют в метаболизме белков, жиров и углеводов в организме и способствуют построению качественной мускулатуры [1,3,5,14].
Одним из важных критериев качества специализированных белково-углеводных продуктов для спортсменов, являются их хорошие органолептические свойства (вкус, цвет, аромат и др. ). Для обеспечения указанных свойств в состав рассматриваемых продуктов добавляют натуральные и идентичные натуральным вкусоароматические композиции (ваниль, шоколад, клубника и др.), а также подсластители, что обеспечивает не только высокие органолептические свойства готовых продуктов, но и скрывает специфический вкус входящих в состав белково-углеводных продуктов некоторых витаминов, аминокислот, минеральных солей и других компонентов.
). Для обеспечения указанных свойств в состав рассматриваемых продуктов добавляют натуральные и идентичные натуральным вкусоароматические композиции (ваниль, шоколад, клубника и др.), а также подсластители, что обеспечивает не только высокие органолептические свойства готовых продуктов, но и скрывает специфический вкус входящих в состав белково-углеводных продуктов некоторых витаминов, аминокислот, минеральных солей и других компонентов.
Специализированные белково-углеводные продукты выпускаются для спортсменов в форме порошков и применяются в виде коктейлей. Для приготовления коктейля производители рекомендуют использовать воду, нежирное молоко или сок. Для приготовления одной порции коктейля обычно 70-150 г продукта разводят в 300-400 мл жидкости. Продукт должен хорошо размешиваться ложкой или в шейкере, не оседать на стенках и не оставлять комков. Готовый коктейль не следует хранить более 1-2 ч. В готовом коктейле не допускается наличие песчинок и прочих неоднородностей. Допустим небольшой осадок в виде минеральных солей и креатина. Используемый коктейль должен питься легко и не оставлять неприятного послевкусия. Помимо компактности и минимальных усилий на приготовление, преимуществом специализированных белково-углеводных продуктов для питания спортсменов является известный их состав. Возможность получить в любой ситуации необходимое количество белков и углеводов делает белково-углеводные смеси весьма популярными среди спортсменов.
Используемый коктейль должен питься легко и не оставлять неприятного послевкусия. Помимо компактности и минимальных усилий на приготовление, преимуществом специализированных белково-углеводных продуктов для питания спортсменов является известный их состав. Возможность получить в любой ситуации необходимое количество белков и углеводов делает белково-углеводные смеси весьма популярными среди спортсменов.
Таким образом, анализ специализированных белково-углеводных продуктов, используемых для питания спортсменов, показал, что существующий на российском рынке выбор указанных продуктов весьма широк. Достижения современной медицины и технологии способствует разработке все более новых пищевых продуктов, обеспечивающих организм спортсмена всеми необходимыми макро- и микронутриентами, способствуя, таким образом, сохранению высокой работоспособности и готовности к выполнению очередных физических нагрузок в предсоревноватеьный и в соревновательный период.
Литература
- Арансон М.
 В. Питание для спортсменов. – М.: ФиС, 2001. – 215 с.
В. Питание для спортсменов. – М.: ФиС, 2001. – 215 с. - Буланов Ю.В. Питание мышц. – М.: ФиС, 2002. -258 с.
- Борисова О.О. Питание спортсменов: зарубежный опыт и практические рекомендации. – М.: Советский спорт, 2007. – 132с.
- Волков Н.И. Биохимия мышечной деятельности. – Киев.: Олимпийская литература, 2000. – 503 с.
- Василенко А. Тренинг, питание, спортивная фармакология в бодибилдинге. –М.: Real Pump, 2004. -223 с.
- Волгарев М.Н., Коровников К.А., Яловая Н.И. Особенности питания спортсменов. // Теория и практика физической культуры. -1985 — №1. -34-39 с.
- Горбатова К.К. Химия и физика белков молока. – М.: Колос, 1993. — 192 с.
- Дидур М.Д. Современные подходы к применению витаминных и иммунологических препаратов в спортивной медицине и программах физической реабилитации: Пособие для врачей // Под ред. М.Д. Дидура. –СПб.: Комитет по здравоохранению СПб, СПбГМУ им. Акад. И.П. Павлова, 2002. -48-49 с.
- Дубровский В.И. Спортивная медицина: учеб. Для студентов вузов, обучающихся по педагогическим специальностям: 3-е изд., доп. – М: Гуманитар. изд. центр ВЛАДОС, 2005 – 520 с.
- Дьяконов М. //Культура тела. -2003. -№ 9. С. 14-18
- Макарова Г.А., Локтев С.А. Медицинский справочник тренера. – М.: Сов. Спорт, 2005. – 575 с.
- Михайлов С.С. Спортивная биохимия: Учебное пособие для студентов высших и средних учебных заведений. – М.: ФиС, 2004. -210-220
- Полиевский С.А. Основы индивидуального и коллективного питания спортсменов. – М.: ФиС, 2005. – 387
- Пшендин П.И. Рациональное питание спортсменов. – СПб.: ГИОРД, 2000. – 150-178
- Суздальницкий Р.С., Левандо В.А. Теория и практика физической культуры. – 1998. -№10. –С. 18-25
- Тутельян В.А., Спиричев В.Б., Суханов Б.П., Кудашева В.А. Микронутриенты в питании здорового и больного человека (справочное руководство по витаминам и минеральным веществам).
 – М.: Колос, 2002. -420 с.
– М.: Колос, 2002. -420 с. - Burke L.M., Dietery Carbohydrates // Nutritions in Sport. — 2000 – p. 73-84
- Burke L.M., Collier G.R. Muscle glycogen storage after prolonged exercise: effect of the glycaemic index of carbohydrate feedings // Jornal of Applied Physiology. – 1993. – 75. – Р.1019-1023.
- Coyle E.F. Timing and method of increased carbohydrate uptake to copy with heavy training, competition and recovery // Jornal of Sports Science. – 1991. -9 (Suppl.).- P.29-52
- Ivy J.L. Optimization of Glycogen Stores // Nutrition in Sport/Maughan R.M. (Ed). –Blackwell Science Ltd., 2000. –P.97-111.
- Maehlum S., Felig P. & Wahren J. Splanchnic glucose and muscle glycogen metabolism after glucose feeding post-exercise recovery //American Jornal of Physiology. -1978. -235. –P. 255-260
- Truswell A.S. Glicaemic index of foods // European Jornal of Clinical Nutrition. – 1992. -46 (Suppl. 2). – P. 91-101
- Van der Beek E.
 J. Vitamin supplementation and physical exercise performance // Journal of Sport Science. – 1991. – 9. – P.79-89.
J. Vitamin supplementation and physical exercise performance // Journal of Sport Science. – 1991. – 9. – P.79-89. - Varnier M. Stimulatory effect of glutamine on glycogen accumulation in human skeletal muscle // Am J Physiol. – 1995. – 262. – P.309.
- Volpi E. Oral amino acids stimulate muscle protein anabolism in the elderly despite higher first-pass splanchnic extraction // Am J Physiol. – 1999. – 277. – P. 513-520.
Влияние повышения скорости синтеза мышечного гликогена на скорость оборота АТФ в скелетных мышцах при диабете 2 типа
1. Байпейи С., Пасарика М., Моро С., Конли К., Джубриас С., Середа О., Берк Д.Х., Чжан З., Гупта А., Кемс Л., Смит С.Р. Емкость митохондрий скелетных мышц и резистентность к инсулину при диабете 2 типа. J Clin Эндокринол Метаб 96: 1160–1168, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
2.
Брем А., Крсак М., Шмид А.И., Новотны П., Вальдхаусл В., Роден М.
Резкое повышение уровня липидов в плазме не влияет на синтез АТФ в скелетных мышцах человека.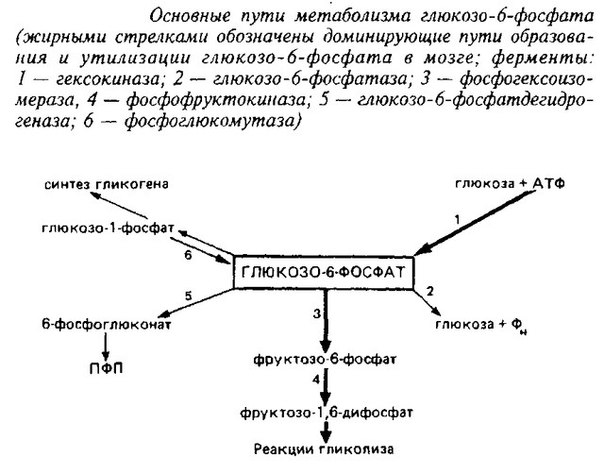 Am J Physiol Endocrinol Metab
299: E33–E38, 2010 [PubMed] [Google Scholar]
Am J Physiol Endocrinol Metab
299: E33–E38, 2010 [PubMed] [Google Scholar]
3. Брем А., Крсак М., Шмид А.И., Новотны П., Вальдхаусл В., Роден М. Повышенная доступность липидов ухудшает стимулированный инсулином синтез АТФ в скелетных мышцах человека. Диабет 55: 136–140, 2006 [PubMed] [Google Scholar]
4. Кальво Дж.А., Дэниелс Т.Г., Ван Х, Пол А., Лин Дж., Шпигельман Б.М., Стивенсон С.К., Рангвала С.М. Специфичная для мышц экспрессия коактиватора-1α PPARγ улучшает физическую работоспособность и увеличивает пиковое потребление кислорода. J Appl Physiol 104: 1304–1312, 2008 [PubMed] [Google Scholar]
5. Шансом Э., Морио Б. Потенциальные механизмы мышечной митохондриальной дисфункции при старении и ожирении и клеточные последствия. Int J Mol Sci 10: 306–324, 2009 [бесплатная статья PMC] [PubMed] [Google Scholar]
6.
Хоментовский П., Коэн П.М., Радикова З., Гудпастер Б.Х., Толедо Ф.Г.
Митохондрии скелетных мышц при резистентности к инсулину: различия между межмиофибриллярными и субсарколемными субпопуляциями и связь с метаболической гибкостью.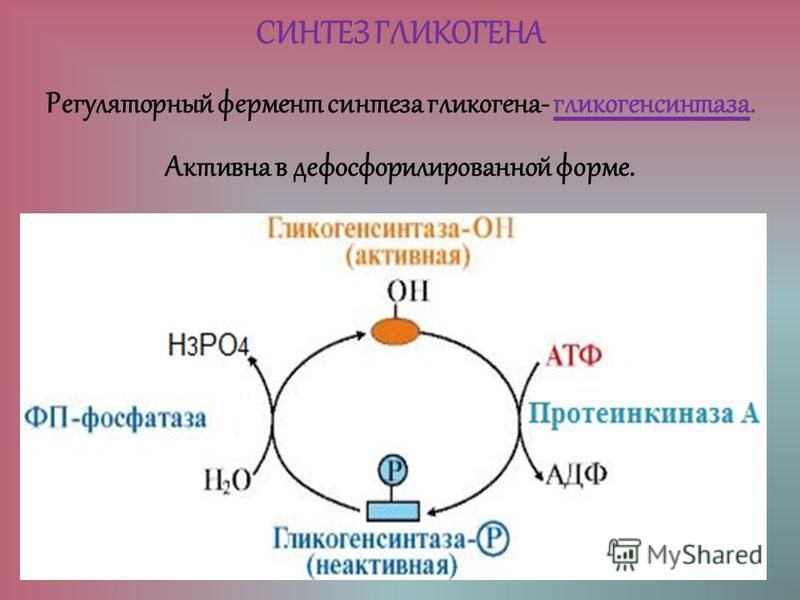 J Clin Эндокринол Метаб
96: 494–503, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
J Clin Эндокринол Метаб
96: 494–503, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
7. Клайн Г.В., Петерсен К.Ф., Крссак М., Шен Дж., Хундал Р.С., Траджаноски З., Инзукки С., Дреснер А., Ротман Д.Л., Шульман Г.И. Нарушение транспорта глюкозы как причина снижения синтеза мышечного гликогена, стимулированного инсулином, при диабете 2 типа. N Engl J Med 341: 240–246, 1999 [PubMed] [Google Scholar]
8. Де Фейтер Х.М., ван ден Брук Н.М., Прает С.Ф., Николай К., ван Лун Л.Дж., Промперс Дж.Дж. Диабет 2 типа на ранней или поздней стадии не сопровождается in vivo митохондриальной дисфункцией скелетных мышц. Евр Дж Эндокринол 158: 643–653, 2008 [PubMed] [Google Scholar]
9. Де Фронзо Р.А., Тобин Д.Д., Андрес Р. Техника клэмп-глюкозы: метод количественной оценки секреции и резистентности к инсулину. Am J Physiol Endocrinol Metab Gastrointest Physiol 237: E214–E223, 1979 [PubMed] [Google Scholar]
10.
Форсен Ф., Хоффман Р.А.
Изучение умеренно быстрых реакций химического обмена с помощью двойного ядерного магнитного резонанса.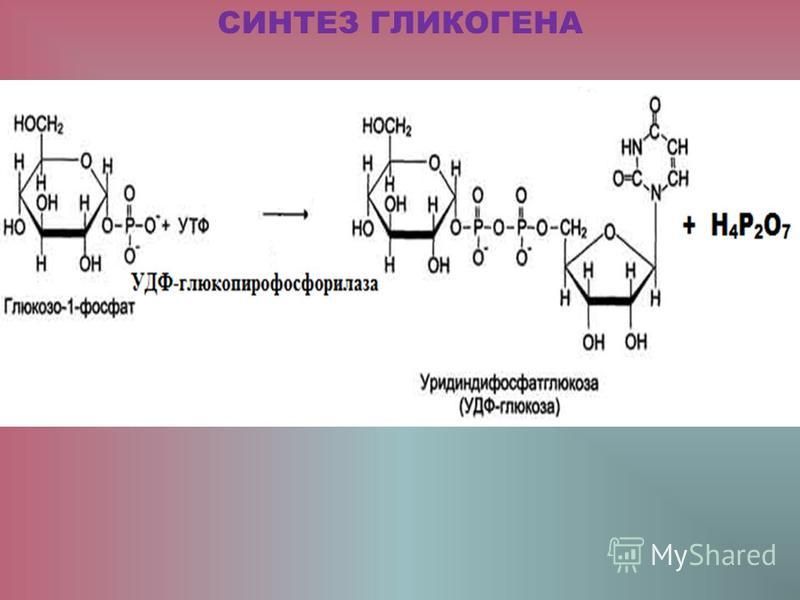 J Chem Phys
39: 2892–2901, 1963 [Google Scholar]
J Chem Phys
39: 2892–2901, 1963 [Google Scholar]
11. Франсила-Каллунки А.И., Эрикссон Дж.Г., Груп Л.С. Зависимое от времени влияние гипергликемии и гиперинсулинемии на окислительный и неокислительный метаболизм глюкозы у больных ИНСД. Акта Эндокринол 127: 100–106, 1992 [PubMed] [Google Scholar]
12. Handschin C, Choi CS, Chin S, Kim S, Kawamori D, Kurpad AJ, Neubauer N, Hu J, Mootha VK, Kim YB, Kulkarni RN, Shulman GI, Spiegelman BM. Аномальный гомеостаз глюкозы у мышей с нокаутом PGC-1α, специфичных для скелетных мышц, обнаруживает перекрестные помехи между скелетными мышцами и бета-клетками поджелудочной железы. Джей Клин Инвест 117: 3463–3474, 2007 [бесплатная статья PMC] [PubMed] [Google Scholar]
13. Хе Дж., Уоткинс С., Келли Д.Е. Содержание липидов в скелетных мышцах и активность окислительных ферментов в зависимости от типа мышечных волокон при диабете 2 типа и ожирении. Диабет 50: 817–823, 2001 [PubMed] [Google Scholar]
14.
Хукс Дж., Ван Херпен Н. А., Менсинк М., Мунен-Корнипс Э., ван Берден Д., Хесселинк М.К., Шраувен П.
Длительное голодание идентифицирует митохондриальную дисфункцию скелетных мышц как следствие, а не как причину инсулинорезистентности человека. Диабет
59: 2117–2125, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
А., Менсинк М., Мунен-Корнипс Э., ван Берден Д., Хесселинк М.К., Шраувен П.
Длительное голодание идентифицирует митохондриальную дисфункцию скелетных мышц как следствие, а не как причину инсулинорезистентности человека. Диабет
59: 2117–2125, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
15. Ирвинг Б.А., Шорт К.Р., Наир К.С., Стамп К.С. Девять дней интенсивных тренировок улучшают функцию митохондрий, но не действие инсулина у взрослых потомков матерей с диабетом 2 типа. J Clin Эндокринол Метаб 96: E1137–E1141, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
16. Джуэ Т., Ротман Д.Л., Шульман Г.И., Тавитян Б.А., Де Фронзо Р.А., Шульман Р.Г. Прямое наблюдение за синтезом гликогена в мышцах человека с помощью 13 С ЯМР. Proc Natl Acad Sci USA 86: 4489–4491, 1989 [бесплатная статья PMC] [PubMed] [Google Scholar]
17.
Кацеровски-Билеш Г., Хмелик М., Линг С., Покан Р., Сендроеди Дж., Фарукуойе М., Кацеровский М., Шмид А.И., Грубер С., Вольцт М. , Мозер Э., Пачини Г., Смекал Г., Груп Л., Роден М.
Кратковременные физические упражнения не стимулируют синтез АТФ в скелетных мышцах у родственников людей с диабетом 2 типа. Диабет
58: 1333–1341, 2009 г.[Бесплатная статья PMC] [PubMed] [Google Scholar]
, Мозер Э., Пачини Г., Смекал Г., Груп Л., Роден М.
Кратковременные физические упражнения не стимулируют синтез АТФ в скелетных мышцах у родственников людей с диабетом 2 типа. Диабет
58: 1333–1341, 2009 г.[Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Келли Д.Е., Хе Дж., Меньшикова Е.В., Ритов В.Б. Дисфункция митохондрий в скелетных мышцах человека при сахарном диабете 2 типа. Диабет 51: 2944–2950, 2002 [PubMed] [Google Scholar]
19. Лоран Д., Йерби Б., Дикон Р., Гао Дж. Индуцированная диетой модуляция митохондриальной активности в мышцах крыс. Am J Physiol Endocrinol Metab 293: E1169–E1177, 2007 [PubMed] [Google Scholar]
20. Лебон В., Дюфур С., Петерсен К.Ф., Рен Дж., Юкер Б.М., Слезак Л.А., Клайн Г.В., Ротман Д.Л., Шульман Г.И. Влияние трийодтиронина на митохондриальную энергетическую связь в скелетных мышцах человека. Джей Клин Инвест 108: 733–737, 2001 [бесплатная статья PMC] [PubMed] [Google Scholar]
21.
Лим Э.Л., Холлингсворт К.Г., Смит Ф. Е., Телуолл П.Е., Тейлор Р.
Ингибирование липолиза при диабете 2 типа нормализует утилизацию глюкозы без изменения скорости синтеза мышечного гликогена. Clin Sci (Лондон)
121: 169–177, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
Е., Телуолл П.Е., Тейлор Р.
Ингибирование липолиза при диабете 2 типа нормализует утилизацию глюкозы без изменения скорости синтеза мышечного гликогена. Clin Sci (Лондон)
121: 169–177, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
22. Лим Э.Л., Холлингсворт К.Г., Телуолл П.Е., Тейлор Р. Измерение острого эффекта инфузии инсулина на скорость оборота АТФ в скелетных мышцах человека с использованием магнитно-резонансной спектроскопии переноса насыщения фосфора-31. ЯМР Биомед 23:952–957, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
23. Meex RC, Schrauwen-Hinderling VB, Moonen-Kornips E, Schaart G, Mensink M, Phielix E, van de Weijer T, Sels JP, Schrauwen P, Hesselink MK. Восстановление функции митохондрий мышц и метаболической гибкости при диабете 2 типа с помощью физических упражнений сопровождается увеличением накопления миоцеллюлярного жира и улучшением чувствительности к инсулину. Диабет 59: 572–579, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
24. Меньшикова Е.В., Ритов В.Б., Толедо Ф.Г., Феррелл Р.Е., Гудпастер Б.Х., Келли Д.Е.
Влияние потери веса и физической активности на митохондриальную функцию скелетных мышц при ожирении. Am J Physiol Endocrinol Metab
288: E818–E825, 2005 [PubMed] [Google Scholar]
Меньшикова Е.В., Ритов В.Б., Толедо Ф.Г., Феррелл Р.Е., Гудпастер Б.Х., Келли Д.Е.
Влияние потери веса и физической активности на митохондриальную функцию скелетных мышц при ожирении. Am J Physiol Endocrinol Metab
288: E818–E825, 2005 [PubMed] [Google Scholar]
25. Миньо Д., Сент-Онж М., Карелис А.Д., Эллисон Д.Б., Рабаса-Лорет Р. Оценка портативного браслета HealthWear Armband: устройства для измерения общего ежедневного расхода энергии у свободно живущих людей с диабетом 2 типа. Уход за диабетом 28: 225–227, 2005 [PubMed] [Google Scholar]
26. Молина А.Дж., Викстром Дж.Д., Стайлз Л., Лас Г., Мохамед Х., Элорза А., Уолцер Г., Твиг Г., Кац С., Корки Б.Е., Ширихай О.С. Митохондриальные сети защищают бета-клетки от апоптоза, вызванного питательными веществами. Диабет 58: 2303–2315, 2009 г.[Бесплатная статья PMC] [PubMed] [Google Scholar]
27.
Мутха В.К., Линдгрен С.М., Эрикссон К.Ф., Субраманиан А., Сихаг С., Лехар Дж., Пуигсервер П., Карлссон Э., Риддерстрале М., Лаурила Э.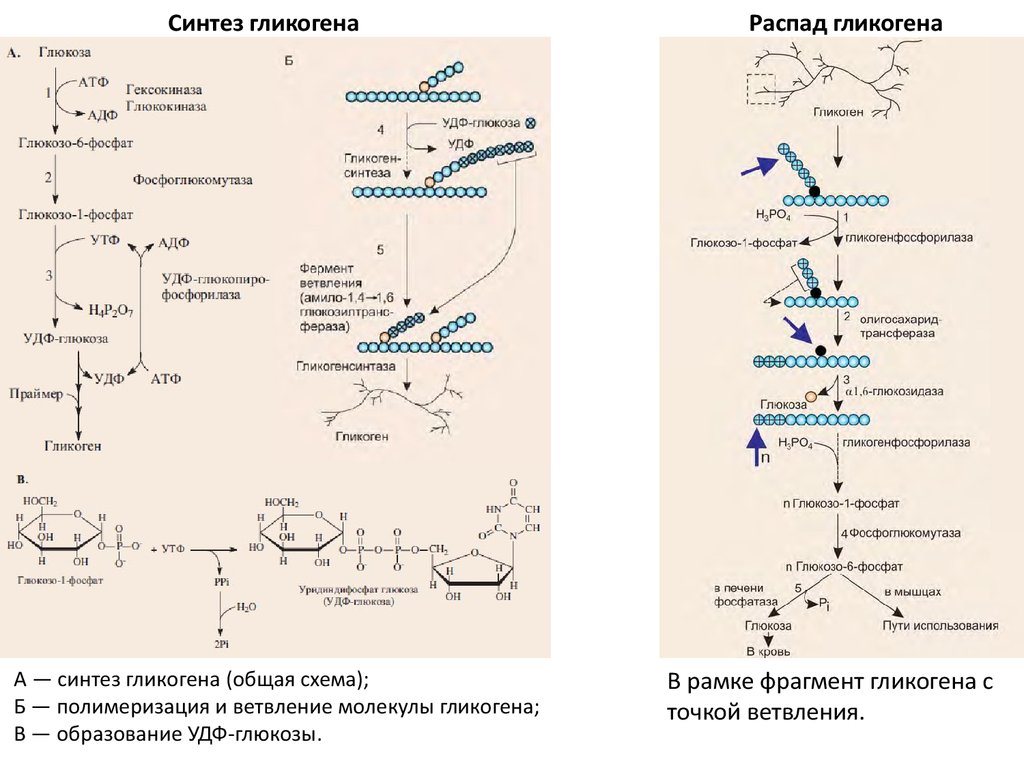 , Хустис Н., Дейли М.Дж., Паттерсон Н., Месиров Дж.П., Голуб Т.Р., Тамайо П., Шпигельман Б. , Ландер Э.С., Хиршхорн Ю.Н., Альтшулер Д., Груп Л.С.
Гены, реагирующие на PGC-1α, участвующие в окислительном фосфорилировании, скоординировано подавляются при диабете человека. Нат Жене
34: 267–273, 2003 [PubMed] [Google Scholar]
, Хустис Н., Дейли М.Дж., Паттерсон Н., Месиров Дж.П., Голуб Т.Р., Тамайо П., Шпигельман Б. , Ландер Э.С., Хиршхорн Ю.Н., Альтшулер Д., Груп Л.С.
Гены, реагирующие на PGC-1α, участвующие в окислительном фосфорилировании, скоординировано подавляются при диабете человека. Нат Жене
34: 267–273, 2003 [PubMed] [Google Scholar]
28. Наресси А., Кутюрье С., Кастанг И., де Бир Р., Граверон-Демили Д. Графический пользовательский интерфейс на основе Java для MRUI, программного пакета для количественного анализа сигналов in vivo/медицинской магнитно-резонансной спектроскопии. Компьютер Биол Мед 31: 269–286, 2001 [PubMed] [Google Scholar]
29. Пагель-Лангеникель I, Бао Дж. Дж., Панг Л. И., Сак М. Н. Роль митохондрий в патофизиологии инсулинорезистентности скелетных мышц. Эндокр Рев. 31: 25–51, 2010 [бесплатная статья PMC] [PubMed] [Google Scholar]
30.
Патти М.Э., Бьютт А.Дж., Кранкхорн С., Куси К., Берриа Р., Кашьяп С., Миядзаки Ю., Кохане И., Костелло М., Сакконе Р., Ландакер Э.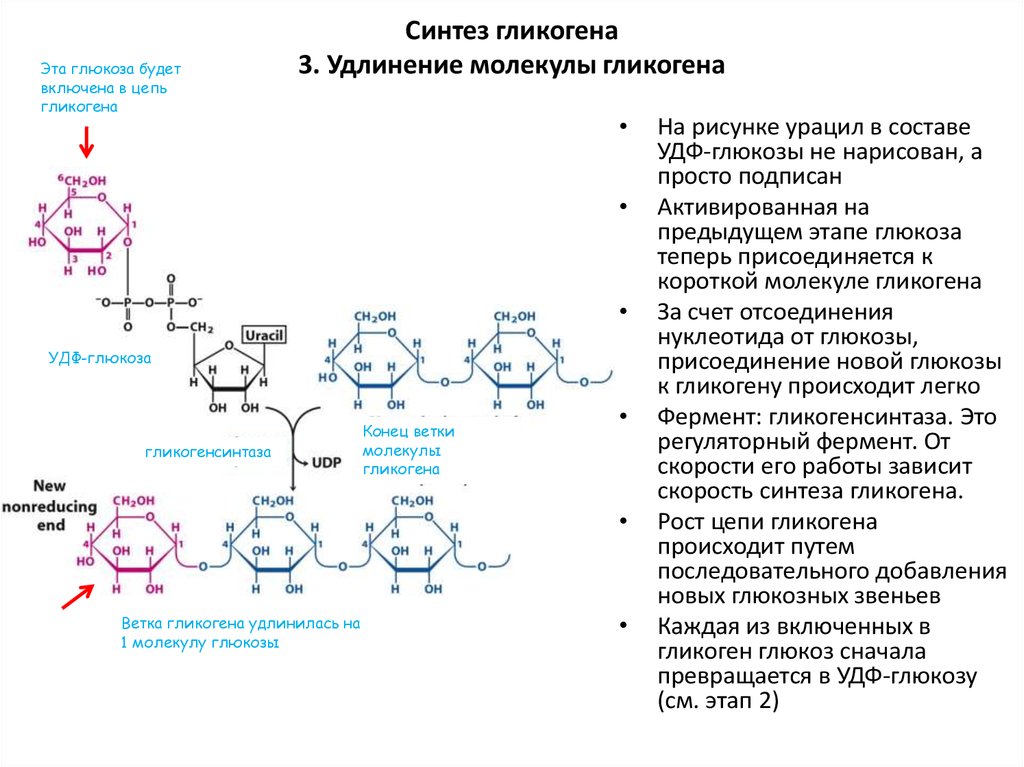 Дж., Голдфайн А.Б., Мун Э., Де Фронзо Р., Финлейсон Дж., Кан Ч.Р., Мандарино ЖЖ.
Скоординированное снижение генов окислительного метаболизма у людей с инсулинорезистентностью и диабетом: потенциальная роль PGC1 и NRF1. Proc Natl Acad Sci USA
100: 8466–8471, 2003 [бесплатная статья PMC] [PubMed] [Google Scholar]
Дж., Голдфайн А.Б., Мун Э., Де Фронзо Р., Финлейсон Дж., Кан Ч.Р., Мандарино ЖЖ.
Скоординированное снижение генов окислительного метаболизма у людей с инсулинорезистентностью и диабетом: потенциальная роль PGC1 и NRF1. Proc Natl Acad Sci USA
100: 8466–8471, 2003 [бесплатная статья PMC] [PubMed] [Google Scholar]
31. Петерсен К.Ф., Дюфур С., Бефрой Д., Гарсия Р., Шульман Г.И. Нарушенная митохондриальная активность у резистентного к инсулину потомства больных сахарным диабетом 2 типа. N Engl J Med 350: 664–671, 2004 [бесплатная статья PMC] [PubMed] [Google Scholar]
32. Петерсен К.Ф., Дюфур С., Шульман Г.И. Снижение стимулированного инсулином синтеза АТФ и транспорта фосфатов в мышцах резистентного к инсулину потомства родителей с диабетом 2 типа. ПЛОС Мед 2: e233, 2005 [бесплатная статья PMC] [PubMed] [Google Scholar]
33. Филикс Э., Менсинк М. Сахарный диабет 2 типа и метаболическая функция скелетных мышц. Физиол Поведение 94: 252–258, 2008 [PubMed] [Google Scholar]
34. Филикс Э., Шраувен-Хиндерлинг В.Б., Менсинк М., Ленарс Э., Мекс Р., Хукс Дж., Коой М.Е., Мунен-Корнипс Э., Селс Дж.П., Хесселинк М.К., Шраувен П.
Снижение внутреннего АДФ-стимулированного митохондриального дыхания лежит в основе in vivo митохондриальной дисфункции в мышцах у мужчин с диабетом 2 типа. Диабет
57: 2943–2949, 2008 [бесплатная статья PMC] [PubMed] [Google Scholar]
Филикс Э., Шраувен-Хиндерлинг В.Б., Менсинк М., Ленарс Э., Мекс Р., Хукс Дж., Коой М.Е., Мунен-Корнипс Э., Селс Дж.П., Хесселинк М.К., Шраувен П.
Снижение внутреннего АДФ-стимулированного митохондриального дыхания лежит в основе in vivo митохондриальной дисфункции в мышцах у мужчин с диабетом 2 типа. Диабет
57: 2943–2949, 2008 [бесплатная статья PMC] [PubMed] [Google Scholar]
35. Прикошович Т., Винцер С., Шмид А.И., Сендроеди Дж., Хмелик М., Пачини Г., Крссак М., Мозер Э., Фунахаши Т., Вальдхаусль В., Каутски-Виллер А., Роден М. Жировая масса тела и печени, а не функция митохондрий мышц определяют метаболизм глюкозы у женщин с гестационным сахарным диабетом в анамнезе. Уход за диабетом 34: 430–436, 2011 [бесплатная статья PMC] [PubMed] [Google Scholar]
36.
Рабол Р., Бушель Р., Алмдал Т., Хансен К.Н., Плауг Т., Хаугард С.Б., Пратс С., Мадсбад С., Дела Ф.
Противоположные эффекты пиоглитазона и розиглитазона на митохондриальное дыхание в скелетных мышцах у больных сахарным диабетом 2 типа. Диабет Ожирение Метаб
12: 806–814, 2010 [PubMed] [Google Scholar]
Диабет Ожирение Метаб
12: 806–814, 2010 [PubMed] [Google Scholar]
37. Равикумар Б., Джеррард Дж., Далла Мэн С., Фирбанк М.Дж., Лейн А., Инглиш П.Т., Кобелли С., Тейлор Р. Пиоглитазон снижает выработку эндогенной глюкозы натощак и после приема пищи пропорционально снижению содержания триглицеридов в печени. Диабет 57: 2288–2295, 2008 [бесплатная статья PMC] [PubMed] [Google Scholar]
38. Ритов В.Б., Меньшикова Е.В., Хе Дж., Феррелл Р.Е., Гудпастер Б.Х., Келли Д.Е. Дефицит субсарколеммальных митохондрий при ожирении и сахарном диабете 2 типа. Диабет 54: 8–14, 2005 [PubMed] [Google Scholar]
39. Рицца Р.А., Мандарино Л.Дж., Герич Дж.Е. Дозозависимые характеристики эффектов инсулина на выработку и утилизацию глюкозы у человека. Am J Physiol Endocrinol Metab 240: E630–E639, 1981 [PubMed] [Google Scholar]
40.
Шраувен-Хиндерлинг В.Б., Кои М.Е., Хесселинк М.К., Дженесон Дж.А., Бакес В.Х., ван Эхтельд С.Дж., ван Энгельсховен Дж.М., Менсинк М., Шраувен П.
Нарушенная функция митохондрий in vivo, но сходное содержание внутримиоцеллюлярных липидов у пациентов с сахарным диабетом 2 типа и контрольных субъектов с ИМТ.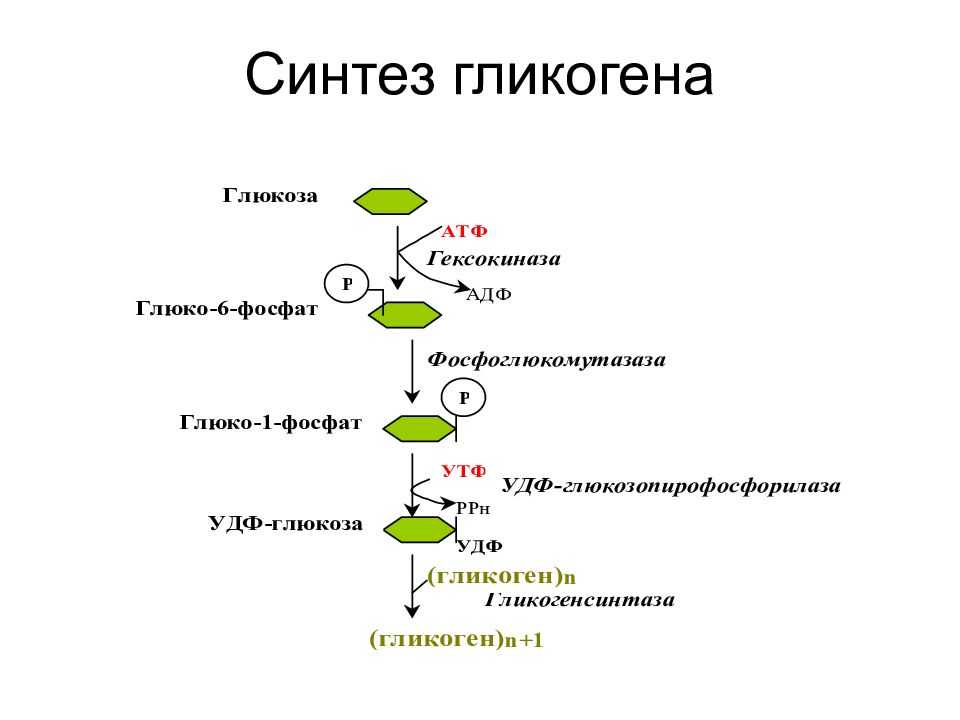 Диабетология
50: 113–120, 2007 [PubMed] [Google Scholar]
Диабетология
50: 113–120, 2007 [PubMed] [Google Scholar]
41. Шраувен-Хиндерлинг В.Б., Менсинк М., Хесселинк М.К., Селс Дж.П., Коой М.Е., Шраувен П. Инсулиносенсибилизирующий эффект розиглитазона у пациентов с сахарным диабетом 2 типа не требует улучшения функции митохондрий мышц in vivo. J Clin Эндокринол Метаб 93: 2917–2921, 2008 [PubMed] [Google Scholar]
42. Шульман Г.И., Ротман Д.Л., Джуэ Т., Штейн П., Де Фронцо Р.А., Шульман Р.Г. Количественное определение синтеза мышечного гликогена у здоровых людей и у больных инсулиннезависимым диабетом на 13 C Спектроскопия ядерного магнитного резонанса. N Engl J Med 322: 223–228, 1990 [PubMed] [Google Scholar]
43. Пень С.С., Шорт К.Р., Бигелоу М.Л., Шимке Д.М., Наир К.С. Влияние инсулина на продукцию митохондриальной АТФ в скелетных мышцах человека, синтез белка и транскрипты мРНК. Proc Natl Acad Sci USA 100: 7996–8001, 2003 [бесплатная статья PMC] [PubMed] [Google Scholar]
44.
Сендроди Дж., Роден М. Митохондриальная приспособленность и чувствительность к инсулину у людей. Диабетология
51: 2155–2167, 2008 [PubMed] [Google Scholar]
Митохондриальная приспособленность и чувствительность к инсулину у людей. Диабетология
51: 2155–2167, 2008 [PubMed] [Google Scholar]
45. Сендроеди Дж., Шмид А.И., Хмелик М., Тот С., Брем А., Крссак М., Новотны П., Вольцт М., Вальдхаусль В., Роден М. Мышечный митохондриальный синтез АТФ и транспорт/фосфорилирование глюкозы при диабете 2 типа. ПЛОС Мед 4: e154, 2007 [бесплатная статья PMC] [PubMed] [Google Scholar]
46. Толедо Ф.Г., Меньшикова Е.В., Азума К., Радикова З., Келли СА, Ритов В.Б., Келли Д.Э. Митохондриальная способность скелетных мышц не стимулируется потерей веса, несмотря на усиление действия инсулина и снижение содержания внутримиоцеллюлярных липидов. Диабет 57: 987–994, 2008 [PubMed] [Google Scholar]
47. Вааг А., Дамсбо П., Хотер-Нильсен О., Бек-Нильсен Х. Гипергликемия компенсирует дефекты инсулинопосредованного метаболизма глюкозы и активации гликогенсинтазы в скелетных мышцах у больных сахарным диабетом 2 типа (инсулинозависимым). Диабетология 35: 80–88, 1992 [PubMed] [Google Scholar]
48. Ванхамм Л., Ван Хаффель С., Ван Хекке П., ван Ормондт Д.
Количественная оценка во временной области серии сигналов биомедицинской магнитно-резонансной спектроскопии. Джей Магн Резон
140: 120–130, 1999 [PubMed] [Google Scholar]
Ванхамм Л., Ван Хаффель С., Ван Хекке П., ван Ормондт Д.
Количественная оценка во временной области серии сигналов биомедицинской магнитно-резонансной спектроскопии. Джей Магн Резон
140: 120–130, 1999 [PubMed] [Google Scholar]
49. Вульф РР. Индикаторы в метаболических исследованиях: радиоизотопные и стабильные изотопные/масс-спектрометрические методы. Лабораторные методы Res Biol Med 9: 1–287, 1984 [PubMed] [Google Scholar]
50. Ян JY, Е ХИ, Лин К, Ван ПХ. Инсулин стимулирует транслокацию Akt в митохондрии: влияние на нарушение регуляции митохондриального окислительного фосфорилирования в диабетическом миокарде. J Mol Cell Кардиол 46: 919–926, 2009 [бесплатная статья PMC] [PubMed] [Google Scholar]
51. Юки-Ярвинен Х. Острые и хронические эффекты гипергликемии на метаболизм глюкозы. Диабетология 33: 579–585, 1990 [PubMed] [Google Scholar]
52.
Yki-Jarvinen H, Young AA, Lamkin C, Foley JE.
Кинетика утилизации глюкозы во всем теле и через предплечье у человека. Джей Клин Инвест
79: 1713–1719, 1987 [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест
79: 1713–1719, 1987 [Бесплатная статья PMC] [PubMed] [Google Scholar]
Регуляция синтеза и распада гликогена — Принципы метаболической регуляции MCAT Wiki
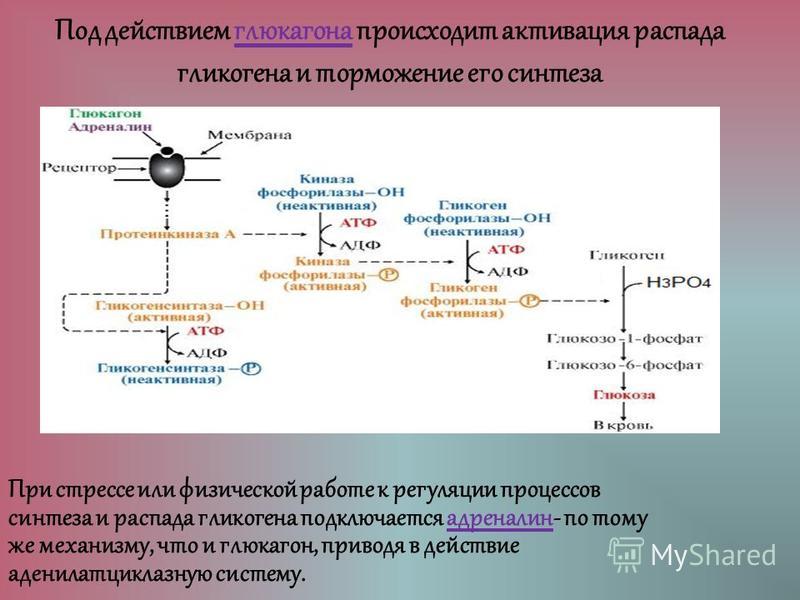
Аллостерическая регуляция синтеза и распада гликогена осуществляется путем регуляции ферментов гликогена синтазы и гликогенфосфорилазы. Гормональная регуляция синтеза и распада гликогена осуществляется гормонами инсулином и глюкагоном.
Гликогенсинтаза стимулирует синтез гликогена. Всякий раз, когда уровень глюкозы в крови повышается, уровень глюкозо-6-фосфата повышается. Глюкозо-6-фосфат стимулирует гликогенсинтазу и, таким образом, происходит синтез гликогена. Когда синтез гликогена не нужен, происходит фосфорилирование гликогенсинтазы, которое препятствует действию фермента за счет изменения его структуры.
Гликогенфосфорилаза вызывает фосфорилирование гликогена, что приводит к образованию глюкозо-1-фосфата при распаде гликогена. Затем фосфоглюкомутаза может приступить к превращению глюкозо-1-фосфата в глюкозо-6-фосфат.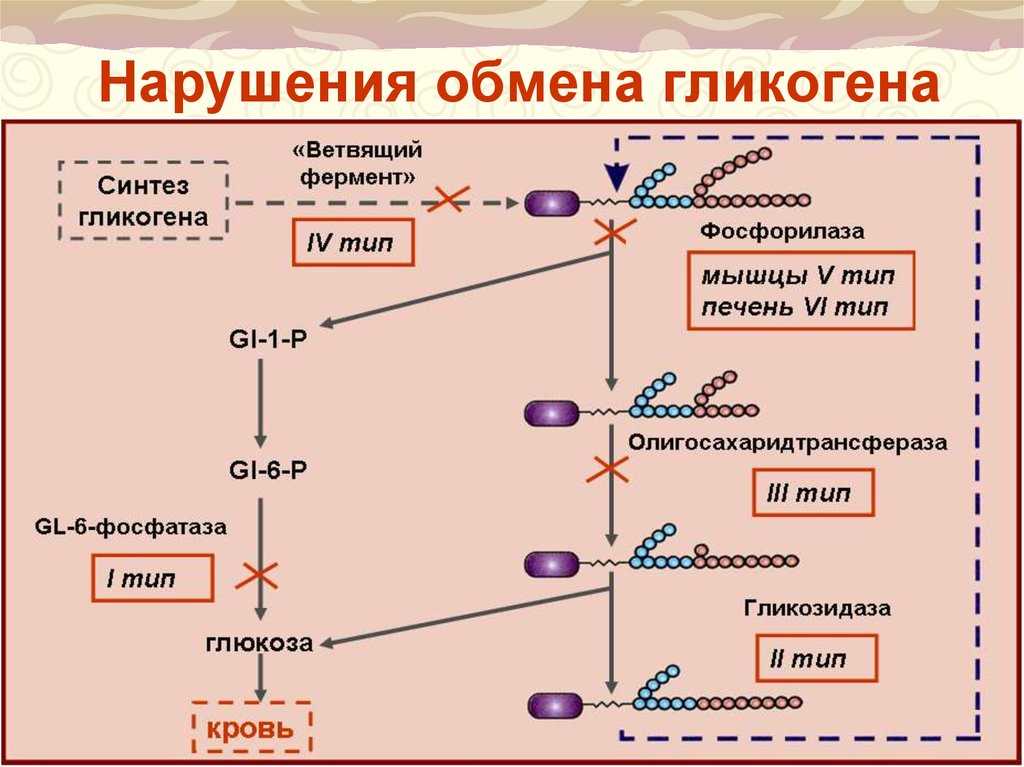 Глюкозо-6-фосфат затем может либо направляться в гликолиз, пентозофосфатный путь, либо превращаться в глюкозу. Таким образом, аллостерическая регуляция синтеза и распада гликогена осуществляется ферментами гликогенсинтазой и гликогенфосфорилазой.
Глюкозо-6-фосфат затем может либо направляться в гликолиз, пентозофосфатный путь, либо превращаться в глюкозу. Таким образом, аллостерическая регуляция синтеза и распада гликогена осуществляется ферментами гликогенсинтазой и гликогенфосфорилазой.
Инсулин Гормон стимулирует синтез гликогена. Когда уровень глюкозы в крови повышается, инсулин стимулирует гликогенсинтазу для образования гликогена из глюкозы. Глюкагон действует противоположно инсулину и стимулирует расщепление гликогена всякий раз, когда уровень глюкозы в крови падает.
Practice Questions
Khan Academy
MCAT Official Prep (AAMC)
Section Bank B/B Section Passage 2 Question 11
Section Bank B/B Section Passage 11 Вопрос 83
Раздел Банк В/В Раздел Прохождение 11 Вопрос 84
Образец Теста В/В Раздел Прохождение 4 Вопрос 22
Практический Экзамен 4 В/В Раздел Прохождение 2 Вопрос 16
Практический Экзамен 4 В/В Раздел Прохождение 2 Вопрос 17
Ключевые моменты
• Гликогенсинтаза стимулирует синтез гликогена, тогда как гликогенфосфорилаза стимулирует расщепление гликогена посредством аллостерической регуляции.