Структура билета по медицинской биологии
Структура экзаменационной работы
Каждый вариант экзаменационной работы состоит из 4-х частей. Задания каждой части отличаются по уровню сложности и, соответственно, оцениваются разным количеством баллов.
Часть 1 содержит задания из разделов Ботаника и Зоология. При выполнении заданий части 1 нужно выбрать один правильный ответ.
Каждое задание оценивается в 1 балл.
Часть 2 содержит задания из разделов Общая биология (Клетка, Деление клетки, Размножение организмов, Онтогенез) Ботаника и Зоология. Каждое задание оценивается в 1 балл или 2 балла. В некоторых заданиях имеются рисунки или схемы, к которым заданы вопросы. Необходимо проанализировать рисунок и выбрать правильный ответ из предложенных.
Часть 3 содержит задания из разделов Анатомия и физиология человека, Общая биология (Обмен веществ, Экология, Эволюционное учение).
Часть 4 содержит задачи:
§ генетическая задача
§ задача по молекулярной биологии
§ Задача из раздела энергетический обмен
Далее представлены некоторые задания по структуре варианта.
Часть 1
При выполнении заданий части 1 выберите один правильный ответ. Номер выбранного ответа внесите в бланк.
1. Группа организмов, использующая для жизнедеятельности энергию окисления неорганических веществ – это:
1) хемотрофы
2) симбионты
4) гетеротрофы
2. У человека дыхательными мышцами являются:
У человека дыхательными мышцами являются:
1) внутренняя косая мышца живота и диафрагма
2) наружные и внутренние межреберные мышцы и прямая мышца живота
3) наружные и внутренние межреберные мышцы и диафрагма
4) большая и малая грудные мышцы и диафрагма
3. Цевка у птиц — это часть конечности, образованная:
1) сросшейся частью голени и стопы
2) сросшейся частью стопы и костей пальцев
3) сросшимися костями предплюсны и плюсны
4) сросшейся частью голени и бедра
4. Локусы аллельных генов расположены в:
1) одной из сестринских хроматид
2) гомологичных хромосомах
4) одной из гомологичных хромосом
5. У человека наблюдаются чешуйчатые высыпания на коже, воспаления кишечника и серьёзные нарушения работы нервной системы при недостатке витамина:
1) А
2) В
3) РР
4) Д
6. Две популяции животных нельзя отнести к одному виду, если особи этой популяции:
Две популяции животных нельзя отнести к одному виду, если особи этой популяции:
1) не скрещиваются друг с другом
2) имеют общего ареала обитания
3) отличаются друг от друга размерами
4) населяют разные ярусы
7. Почечные чешуи являются:
1) зачатком побега
2) видоизменением семядолей
3) видоизменением пробки побега
4) видоизменением листьев
Часть 2
При выполнении заданий части 2 выберите все правильные ответы. Номера выбранных ответов внесите в бланк.
1. Вторичноротыми животными являются:
1) хордовые
2) круглые черви
3) насекомые
4) иглокожие
5) моллюски
2. Поперечнополосатая мышечная ткань входит в состав стенок:
1) кровеносных сосудов
2) желудка
3) тонкого кишечника
4) сердца
5) глотки
3. Если у организма изменение признака не наследуется потомством, то значит:
1) гены не изменились
2) только гены, а не хромосомы
3) изменились только хромосомы, а не гены
4) изменились и гены, и хромосомы
5) хромосомы не изменились
4. Зародышевый мешок цветковых растений – это:
Зародышевый мешок цветковых растений – это:
1) мужской заросток
2) клетка с 8 гаплоидными ядрами
3) место, где происходит двойное оплодотворение
5) место образования пыльцы
5. В желчных ходах и печени паразитирует:
1) Амеба кишечная
2) Токсоплазма
3) Балантидий кишечный
4) Лямблия тонкокишечная
5) Фасциола
Часть 3
При выполнении заданий части 3 выберите все правильные ответы или установите соответствие. Ответы внесите в бланк.
1. В темновую фазу фотосинтеза осуществляются процессы:
1) фотолиз воды
2) карбоксилирование
3) образование АТФ
4) распад АТФ
5) синтез углеводов
2. При Х-сцепленном рецессивном типе наследования:
1) отец может передавать признак только дочерям
2) признак обнаруживается в каждом поколении
3) отец может передавать признак только сыновьям
4) мать может передавать признак только дочерям
3. К особенностям скелета человека, которые являются результатом антропогенеза, относятся:
К особенностям скелета человека, которые являются результатом антропогенеза, относятся:
1) наличие подвижного поясничного отдела позвоночника
2) S-образный изгиб позвоночника
3) выраженные надбровные валики
4) сводчатая стопа, широкая и плоская грудная клетка
5) подбородочный выступ
4. Установите соответствие между формой биотической связи и их характеристикой:
Биотическая связь | Характеристика |
1) конкуренция | а) взаимоотношения организмов одного трофического уровня, которые используют одинаковые ресурсы |
2) симбиоз | б) взаимовыгодные отношения между организмами разных трофических уровней |
3) комменсализм | в) взаимоотношения организмов, когда только один партнер получает выгоду |
4) мутуализм | г) взаимовыгодное сотрудничество между организмами |
5. Установите соответствие между группой животных и особенностями строения их кровеносной системы:
Установите соответствие между группой животных и особенностями строения их кровеносной системы:
Группы животных | Строение кровеносной системы |
1) Земноводные | а) двухкамерное сердце и незамкнутая кровеносная система |
2) Бесчерепные | б) трехкамерное сердце и 2 круга кровообращения |
3) Моллюски | в) четырехкамерное сердце и 2 круга кровообращения |
4) Кольчатые черви
| г) замкнутая кровеносная система сердце отсутствует, пульсирующая брюшная аорта |
5) Птицы
| д) замкнутая кровеносная система, функцию сердца выполняют крупные кольцевые сосуды |
Часть 4
Решите предложенные задачи. Решения и ответы внесите в бланк.
Решения и ответы внесите в бланк.
1. У дрозофилы рецессивный ген желтой окраски тела находится в Х-хромосоме. В лаборатории получено потомство от скрещивания гомозиготной серой самки и желтого самца. Серая самка из этого потомства в свою очередь скрещивается с серым самцом. Каковы генотипы и фенотипы гибридов, полученных в результате первого и второго скрещивания? Какова вероятность появления в F
2. Фрагмент гена имеет следующую последовательность: АТЦ ГАГ ЦАТ ГЦГ ТАТ. Определите последовательность аминокислот в белке, кодируемого этим фрагментом гена. Как изменится белок, если третий нуклеотид удвоится?
3. Какие продукты образуются в ходе гликолиза в клетках молочнокислых бактерий? Сколько молекул АТФ запасается при молочнокислом брожении 25 молекул глюкозы?
Гепоксилины — активаторы АТФ-зависых К+-каналов В-клеток поджелудочной железы в норме и при патологии | Бабичев
Секреция инсулина из р-клеток поджелудочной железы, специфическим стимулятором которой являются глюкоза и продукты ее метаболизма, определяется состоянием АТФ-зависимых К+-каналов [1, 2, 4, 5, 7].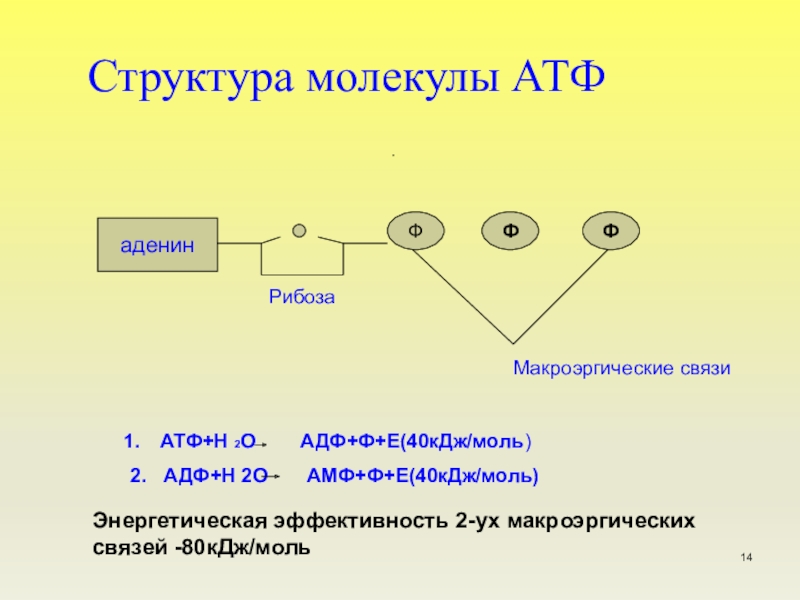 Глюкоза вызывает деполяризацию клеточной мембраны р-клеток за счет притока Са2+ и его накопления в цитозольной фракции, вызывая тем самым запуск секреции инсулина. Аналогичным образом действуют и сульфаниламидные препараты, широко используемые в лечебной практике диабета II типа (ин- сулиннезависимого) [9, 10, 14—16].
Глюкоза вызывает деполяризацию клеточной мембраны р-клеток за счет притока Са2+ и его накопления в цитозольной фракции, вызывая тем самым запуск секреции инсулина. Аналогичным образом действуют и сульфаниламидные препараты, широко используемые в лечебной практике диабета II типа (ин- сулиннезависимого) [9, 10, 14—16].
Обнаружение нового класса соединений — ге- поксилинов, являющихся продуктами метаболических превращений арахидоновой кислоты в островках Лангерганса, а также их способности к стимуляции секреции инсулина вызвало интерес у специалистов-эндокринологов с точки зрения их применения в клинической практике при лечении инсулиннезависимого диабета [6, 12, 13]. Однако в литературе практически отсутствуют данные, расшифровывающие механизм действия гепокси- линов.
Целью нашего исследования было оценить состояние АТФ-зависимых К+-каналов р-клеток поджелудочной железы и охарактеризовать их реакцию в ответ на введение гепоксилина НхВ3 на интактных клетках и на клетках, частично пораженных под влиянием различных доз стрептозотоцина.
Основным методом исследования в нашей работе был метод ”пэтч-клампф», позволяющий оценивать активность отдельных каналов в условиях регистрации от целой клетки [8, 11].
Материалы и методы
Работа проведена на культуре островковых клеток поджелудочной железы крыс. Выделение и культивирование клеток проводили по ранее описанному методу S. Misler и соавт. [И]. Клетки высевали на 35-миллиметровые пластиковые чашки Петри со средой RPMI и выдерживали минимум 24 ч при 37°С в атмосфере с 5% СО2 с целью прикрепления их ко дну. Перед началом электрофизиологических исследований в культуральную среду добавляли стрептозотоцин в различных концентрациях (1, 2, 5 ммолей), растворенный в цитратном буфере. Этот препарат подавали в камеру с помощью локальной микроперфузии. Время воздействия составляло 30 мин, после чего проводили отмывание и дальнейшую инкубацию. В инкубате до и после воздействия стрептозотоцина определяли концентрацию инсулина, что и было показателем степени поражения [3-клеток.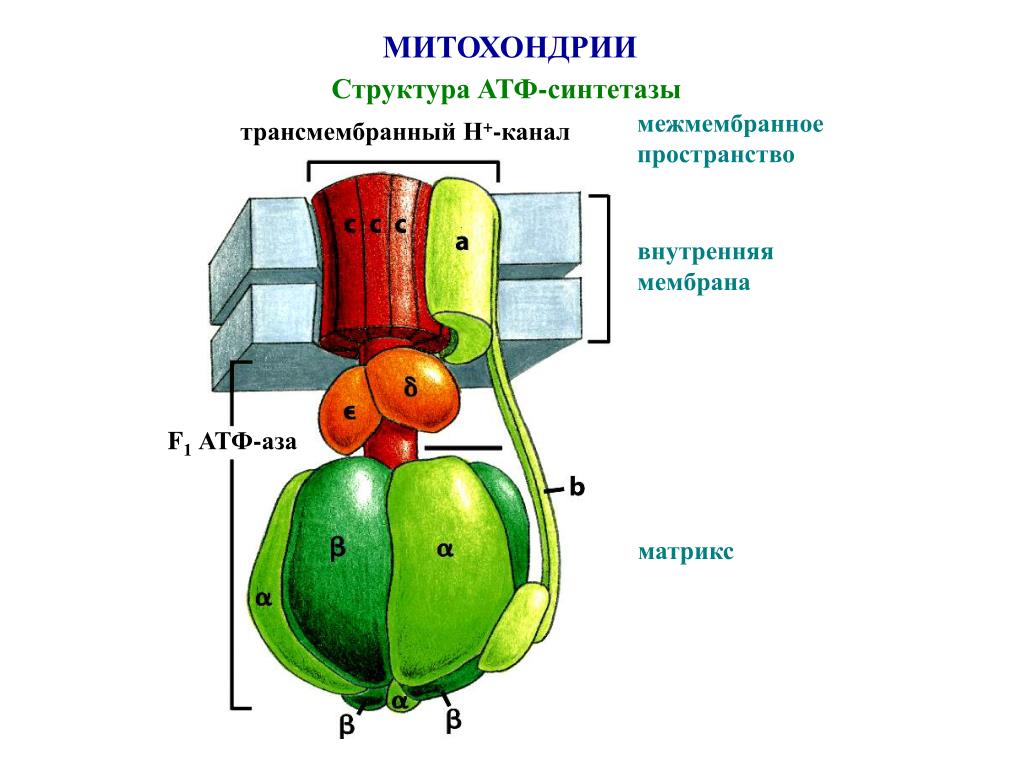 Для проведения электрофизиологических анализов культуральную среду меняли на изотонический раствор, который содержал 140 мМ NaCl, 1 мМ СаС12, 2 мМ MgCl2, 2,8 мМ КС1, 10 мМ HEPES pH 7,4. Стеклянные микропипетки заполняли изотоническим раствором, имитирующим состав цитоплазмы: 140 мМ КС1, 10 мМ HEPES, 3 мМ MEGTA, 0,5 мкМ СаС12, 2 мМ MgCl2 pH 7,4. Пипетки имели сопротивление около 5 МОм и подсоединялись к усилителю ЕРС-5 («LIST Electronic», ФРГ). В эксперименте использовали только одиночные клетки. Интеграционные токи регистрировали с помощью усилителя, имеющего цепи компенсации емкостных переходных процессов. Ионные токи регистрировали на запоминающем осциллографе и магнитографе. В ходе опыта подсчитывали среднее число каналов, открытых в фиксированной части клеточной мембраны. Анализ кинетических процессов проводили с момента регистрации, когда был активен только 1 канал [8, 9]. После этого составляли гистограммы, которые отражали суммарный эффект действия того или иного препарата на функционирование отдельно анализируемого ионного канала.
Для проведения электрофизиологических анализов культуральную среду меняли на изотонический раствор, который содержал 140 мМ NaCl, 1 мМ СаС12, 2 мМ MgCl2, 2,8 мМ КС1, 10 мМ HEPES pH 7,4. Стеклянные микропипетки заполняли изотоническим раствором, имитирующим состав цитоплазмы: 140 мМ КС1, 10 мМ HEPES, 3 мМ MEGTA, 0,5 мкМ СаС12, 2 мМ MgCl2 pH 7,4. Пипетки имели сопротивление около 5 МОм и подсоединялись к усилителю ЕРС-5 («LIST Electronic», ФРГ). В эксперименте использовали только одиночные клетки. Интеграционные токи регистрировали с помощью усилителя, имеющего цепи компенсации емкостных переходных процессов. Ионные токи регистрировали на запоминающем осциллографе и магнитографе. В ходе опыта подсчитывали среднее число каналов, открытых в фиксированной части клеточной мембраны. Анализ кинетических процессов проводили с момента регистрации, когда был активен только 1 канал [8, 9]. После этого составляли гистограммы, которые отражали суммарный эффект действия того или иного препарата на функционирование отдельно анализируемого ионного канала. Идентификацию АТФ-зависимых К+-кана- лов проводили с помощью избирательной блокады других каналов Na+ и Са2+ тетрадоксином и хлоридом кадмия. Все эксперименты проводили при комнатной температуре. Исследуемый препарат — гепоксилин — добавляли непосредственно во внеклеточный раствор. Всего было проанализировано 56 клеток, потенциал покоя которых в среднем составлял 59,8 ± 1,7 мВ.
Идентификацию АТФ-зависимых К+-кана- лов проводили с помощью избирательной блокады других каналов Na+ и Са2+ тетрадоксином и хлоридом кадмия. Все эксперименты проводили при комнатной температуре. Исследуемый препарат — гепоксилин — добавляли непосредственно во внеклеточный раствор. Всего было проанализировано 56 клеток, потенциал покоя которых в среднем составлял 59,8 ± 1,7 мВ.
Результаты и их обсуждение
- Электрофизиологическая оценка состояния АТФ- чувствителъных -каналов $-клеток, функционально ослабленных под влиянием стрептозотоцина.
В I серии исследований нами была проведена идентификация АТФ-чувствительных К+-кана- лов к глюкозе в фиксированных мембранах клеток. Каналы интактных клеток характеризовались устойчивой величиной потенциала покоя, который колебался в пределах 60—62 мВ. Популяция этих каналов закрывалась через 2—5 мин после начала перфузии клеток раствором, содержащим 5—10 мМ глюкозы.
Аналогичные исследования на р-клетках, предварительно перфузируемых различными дозами стрептозотоцина, показали сниженную функциональную активность. Электрофизиологически это выражалось в снижении величины потенциала покоя на 10—25 мВ в зависимости от степени поражения. Наиболее демонстративными были изменения исследованных нами показателей после перфузии 2 мМ стрептозотоцина. Период закрытия каналов после воздействия на эти клетки раствора, содержащего 5—10 мМ глюкозы, задерживался и составлял 5—7 мин (в контроле 2—5 мин). Это приводило к удлинению латентного периода возникновения спайковой активности. Аналогичную картину наблюдали и после отмывания глюкозы: необходимо было 6—7 мин, чтобы вновь произошло открытие каналов и исчезла спайковая активность.
- Функциональная оценка состояния АТФ-чув- ствителъных К*-каналов fi-клеток, частично пораженных стрептозотоцином, под воздействием гепоксилина НхВ3
В таблице представлены полученные результаты исследований по анализу ряда электрофизиологических показателей состояния АТФ-зависимых К+-каналов интактных и функционально-ослабленных стрептозотоцином р-клеток после аппликации глюкозы и гепоксилина. Наиболее типичной реакцией исследуемых каналов в этих экспериментальных условиях было их полное закрытие под влиянием испытуемых веществ. Однако в отличие от интактных клеток для достижения аналогичного эффекта необходимы были дозы в 2,5—3 раза выше. Процесс закрытия канала происходит значительно медленнее, чем в норме, достигая устойчивого состояния в течение 35—55 с, и длится такой эффект до 12—14 мин. Отмывание культуры восстанавливало активность этих каналов до исходного уровня, однако этот процесс шел очень инерционно.
Сравнительный анализ действия глюкозы и гепоксилина показал, что гепоксилин в концентрации 10 мМ способен стимулировать секрецию инсулина. Это подтверждается данными, свидетельствующими о более быстрых темпах закрытия каналов, и началом возникновения спайковой активности. Эти показатели обычно отражают деполяризацию клеточной мембраны и возникновение потенциала действия, вслед за которым происходит вхождение ионов кальция внутрь клетки; совместно со свободным кальцием в цитозоле они достигают необходимого уровня для активации экзоцитоза секреторных гранул инсулина.
Это подтверждается данными, свидетельствующими о более быстрых темпах закрытия каналов, и началом возникновения спайковой активности. Эти показатели обычно отражают деполяризацию клеточной мембраны и возникновение потенциала действия, вслед за которым происходит вхождение ионов кальция внутрь клетки; совместно со свободным кальцием в цитозоле они достигают необходимого уровня для активации экзоцитоза секреторных гранул инсулина.
Влияние глюкозы и гепоксилина НхВ3 на некоторые электрофизиологические показатели АТФ-зависимых К+ -каналов интактных р-клеток, а также р-клеток, функционально-ослабленных под воздействием стрептозотоцина (2 мМ)
Показатель | Глюкоза | Гепоксилин НхВ3 | ||||||
0 | 3 мМ | 0 | 3,2 мМ | отмывание | 0 | 10 мМ | отмывание | |
Средняя продолжительность разряда (пачки), мс: интактные р-клетки | 212 | 16,4 | 43 | 13,0 | 164 | 320 | 105 | 280 |
пораженные р-клетки | 181 | 14,3 | 37,2 | 11,8 | 160 | 304 | 83 | 258 |
Средняя продолжительность интервала между пачками, мс: интактнные р-клетки | 29,1 | 221 | 78,0 | 520 | 60,0 | 30,8 | 860 | 160 |
пораженные р-клетки | 23,2 | 192 | 54,0 | 470 | 38,2 | 24,9 | 610 | 104 |
Время открытия , мс: интактные р-клетки | 1,90 | 1,50 | 1,60 | 1,50 | 1,60 | 1,78 | 1,51 | 1,59 |
пораженные р-клетки | 1,80 | 1,17 | 0,95 | 1,32 | 1,69 | 1,50 | 1,31 | 1,40 |
Средняя продолжительность интервала в разряде, мс: интактные р-клетки | 0,45 | 0,40 | 0,45 | 0,41 | 0,44 | 0,45 | 0,42 | 0,39 |
пораженные р-клетки | 0,34 | 0,29 | 0,31 | 0,35 | 0,36 | 0,39 | 0,40 | 0,35 |
В предыдущих исследованиях [1, 2] по расшифровке механизма действия сульфаниламидных препаратов как на интактных, так и на функционально-ослабленных р-клетках показано, что эти препараты оказывают специфическое действие на характер биоэлектрической активности АТФ-зависимых К+-каналов, точнее, на временный характер ее распределения. Обычно активность анализируемых нами каналов проявляется пачковыми разрядами стандартной амплитуды, чередующимися с паузами длительностью несколько секунд. Структура биоэлектрической активности АТФ-зависимых К+-каналов р-клеток со сниженной активностью не менялась. Добавление гепоксилина вызывало сокращение длительности разрядов с одновременным увеличением интервала между пачками. Аналогичный эффект наблюдали и после добавления глюкозы.
Обычно активность анализируемых нами каналов проявляется пачковыми разрядами стандартной амплитуды, чередующимися с паузами длительностью несколько секунд. Структура биоэлектрической активности АТФ-зависимых К+-каналов р-клеток со сниженной активностью не менялась. Добавление гепоксилина вызывало сокращение длительности разрядов с одновременным увеличением интервала между пачками. Аналогичный эффект наблюдали и после добавления глюкозы.
Детальный анализ динамики протекающих в ионном канале процессов, таких как средняя продолжительность закрытия канала в пачковом разряде, средняя продолжительность интервала в разряде, как наиболее типичных и информативных показателей при оценке действия стрептозотоцина, показал следующие результаты (см. таблицу). Добавление стрептозотоцина в дозе 2 мМ приводит к снижению средней продолжительности разряда на 15% от исходной, а продолжительность интервала между пачками сокращается на 29%. Снижаются продолжительность времени открытия на 4,5%, а также средняя продолжительность интервала в разряде на 25%. Эти данные свидетельствуют о том, что р-клетки в наших экспериментальных условиях, несмотря на снижение используемых нами электрофизиологических показателей, сохраняют свою функциональную активность. Об этом также свидетельствуют данные ответной реакции пораженных р-клеток на введение глюкозы. Так, добавление 3,2 мМ глюкозы сокращает время открытия канала на 8,8% от исходного, а средняя продолжительность интервала в разряде уменьшается на 8%. Средняя продолжительность разряда сокращается в 3 раза, а интервал между пачками увеличивается в 8 раз. Это свидетельствует о специфической ответной реакции функционально-ослабленных р-клеток на введение глюкозы, наиболее четко проявляющейся в сниженной способности каналов к открытию за счет сокращения длительности разрядов и увеличения продолжительности интервала между ними.
Эти данные свидетельствуют о том, что р-клетки в наших экспериментальных условиях, несмотря на снижение используемых нами электрофизиологических показателей, сохраняют свою функциональную активность. Об этом также свидетельствуют данные ответной реакции пораженных р-клеток на введение глюкозы. Так, добавление 3,2 мМ глюкозы сокращает время открытия канала на 8,8% от исходного, а средняя продолжительность интервала в разряде уменьшается на 8%. Средняя продолжительность разряда сокращается в 3 раза, а интервал между пачками увеличивается в 8 раз. Это свидетельствует о специфической ответной реакции функционально-ослабленных р-клеток на введение глюкозы, наиболее четко проявляющейся в сниженной способности каналов к открытию за счет сокращения длительности разрядов и увеличения продолжительности интервала между ними.
Аналогичные результаты получены нами в опытах с аппликацией гепоксилина. Добавление 10 мМ гепоксилина к р-клетке, частично пораженной стрептозотоцином, вызывало снижение показателей возможности открытия канала на 25—28%, время открытия уменьшалось на 13—15%, средняя продолжительность разряда сокращалась в 3,5 раза, а продолжительность межимпульсных интервалов увеличивалась в 2,5 раза.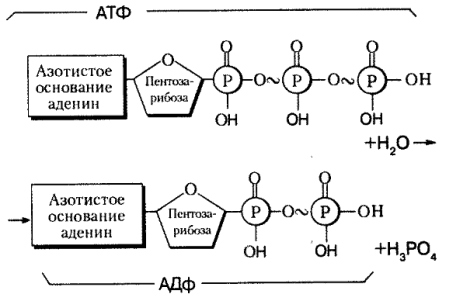
Полученные нами данные свидетельствуют о том, что АТФ-зависимые К+-каналы р-клеток после воздействия стрептозотоцина сохраняют в основном свои функциональные свойства и способны адекватно реагировать на специфические раздражители, какими являются глюкоза и гепоксилин. Следует обратить внимание на факт более медленного закрытия АТФ-зависимых К+-кана- лов и тем самым увеличения латентного периода секреции инсулина начиная с момента воздействия глюкозы и гепоксилина до экзоцитоза кванта инсулина. Процесс приобретает более инерционный характер. В этом случае нельзя исключить нарушения внутриклеточного метаболизма р-кле- ток, способных привести и к нарушениям их структуры. Хорошо известно, что добавление АТФ в культуру клеток быстро восстанавливает активность АТФ-чувствительных К+-каналов, которые являются стратегически важной точкой в реализации эффекта гепоксилина в системе стимул — секреция.
Вышеприведенные данные подтверждают также результаты, полученные В.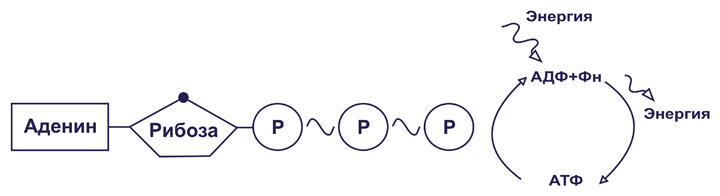 П. Федотовым и соавт. [3], которые на изолированных культивируемых клетках аденогипофиза, островков Лангерганса и гепатоцитах крыс исследовали влияние эпимеров гепоксилина НхВ3 на секрецию пролактина, инсулина и альбумина соответственно. Показано, что оба эпимера НхВ3 стимулируют секрецию инсулина в культуре островковых клеток и накопление иммунореактивного альбумина в среде культивируемых гепатоцитов. Отмечено ингибирующее действие НхВ3 в отношении пролактина. Инсулинотропное действие НхВ3 осуществляется при физиологических концентрациях глюкозы, а также в среде, не содержащей глюкозы, что может служить доказательством прямого действия гепоксилинов на секрецию инсулина, а ионные каналы являются ответственными за проявление прямого фармакологического действия на процессы электрогенеза, приводящие к секреции инсулина р-клетками. Весьма серьезным показателем, отмеченным нами, является то, что как глюкоза, так и гепоксилин НхВ3 оказывают обратимое влияние на функционирование каналов.
П. Федотовым и соавт. [3], которые на изолированных культивируемых клетках аденогипофиза, островков Лангерганса и гепатоцитах крыс исследовали влияние эпимеров гепоксилина НхВ3 на секрецию пролактина, инсулина и альбумина соответственно. Показано, что оба эпимера НхВ3 стимулируют секрецию инсулина в культуре островковых клеток и накопление иммунореактивного альбумина в среде культивируемых гепатоцитов. Отмечено ингибирующее действие НхВ3 в отношении пролактина. Инсулинотропное действие НхВ3 осуществляется при физиологических концентрациях глюкозы, а также в среде, не содержащей глюкозы, что может служить доказательством прямого действия гепоксилинов на секрецию инсулина, а ионные каналы являются ответственными за проявление прямого фармакологического действия на процессы электрогенеза, приводящие к секреции инсулина р-клетками. Весьма серьезным показателем, отмеченным нами, является то, что как глюкоза, так и гепоксилин НхВ3 оказывают обратимое влияние на функционирование каналов. Наблюдаемые нами эффекты снимались после отмывания активного начала.
Наблюдаемые нами эффекты снимались после отмывания активного начала.
Вопрос, поставленный нами в изучении особенностей функционирования ионных каналов в р-клетках, частично ослабленных под влиянием стрептозотоцина, весьма актуален для специали- стов-диабетологов при выборе препаратов для терапии конкретного больного диабетом II типа. Еще более актуальным следует считать вопрос о возможном использовании препаратов гепоксилина в чистом виде или в сочетании с введением глюкозы или сульфаниламидных препаратов для лечения больных диабетом II типа. Наши поисковые исследования в этом отношении создают благоприятный фон для серьезных клинических испытаний эффекта действия гепоксилинов.
Выводы
- АТФ-зависимые К+-каналы р-клеток поджелудочной железы (как интактных, так и функционально-ослабленных под влиянием стрептозотоцина) проявляют специфическую реакцию под действием глюкозы и гепоксилина НхВ3.
- Гепоксилин НхВ3 обладает свойством прямого влияния на функцию инсулинсекретирую- щих клеток через АТФ-зависимые К+-каналы Р-клеток.
 Dunne M. J., Jllot F. C., Peterson 0. J. // Membr. Biol.— 1987. — Vol. 99. — P. 215-224.
Dunne M. J., Jllot F. C., Peterson 0. J. // Membr. Biol.— 1987. — Vol. 99. — P. 215-224.
1. Бабичев В. И., Игнатьев И. С., Балаболкин М. И. // Пробл. эндокринол.— 1993. — № 5. — С. 43—46.
2. Бабичев В. Н., Игнатьев И. С., Балаболкин М. И. // Там же. — 1995. — № 5. — С. 28-30.
3. Федотов В. П., Садовникова И. В., Гудошников В. И. и др. // Актуальные проблемы эндокринологии. — М., 1996. — С 26
4. Boyd А. Е. // Diabetes. — 1988. -Vol. 37. — Р. 847-850.
5. Cook D„ Ikeuchi M. // Ibid. — 1989. — Vol. 38. — P. 416-421.
6. Dho S., Grinstein S., Corey E. J. et al. // Biochem. J. — 1990. — Vol. 266. — P. 63-68.
7. Dunne M. J., Jllot F. C., Peterson O. J. // Membr. Biol.— 1987. — Vol. 99. — P. 215—224.
8. Gillis K. D, Gee W. M, Hammond A. et al. // Amer. J. Physiol. — 1989. — Vol. 257. — P. 1118-1127.
9. Henguin J. C., Meissner H. P. // Biochem. Pharmacol. — 1982. — Vol. 31. — P. 1407-1415.
10. Loubatieres A. // The Diabetic Pancreas/Eds B. W. Wolk, E. Wellman. — London, 1977. — P. 489—515.
W. Wolk, E. Wellman. — London, 1977. — P. 489—515.
11. Misler S., Falke L., Gillis K. et al. // Proc nat. Acad. Sei. USA. — 1986. — Vol. 83. — P. 7119-7123.
12. Pace-Asciak C. R., Martin J. M. // Prostagland. Leucotr. Med. — 1984. — Vol. 16. — P. 173-180.
13. Pace-Asciak C. R. // Biochim. biophys. Acta. — 1994. — Vol. 1215. — P. 1-8.
14. Rossman P., Trübe G. Potassium Channels: Structure, Classfi- cation and Therapeutic Potential./Ed. N. S. Cook. — Chichester, 1990. — P. 96-116.
15. Rossman P., Berggren P. O., Bokvist K., Efendic S. News physiol. Sei. — 1990. — Vol. 5. — P. 143—147.
16. Tabcharami J. A., Misler S. // Biochim. biophys. Acta. — 1989. — Vol. 982. — P. 62-72.
Мант-АТФ, внутренне флуоресцентные аденозины — Jena Bioscience
Вы здесь: Нуклеотиды и нуклеозиды | Нуклеотиды по структуре | Флуоресцентные нуклеотиды | Аденозины — флуоресцентные по своей природе | Mant-ATP
2’/3′-O-(N-метилантранилоил)-аденозин-5′-трифосфат, триэтиламмониевая соль
MSDS (PDF) Спецификация (PDF)
Кат.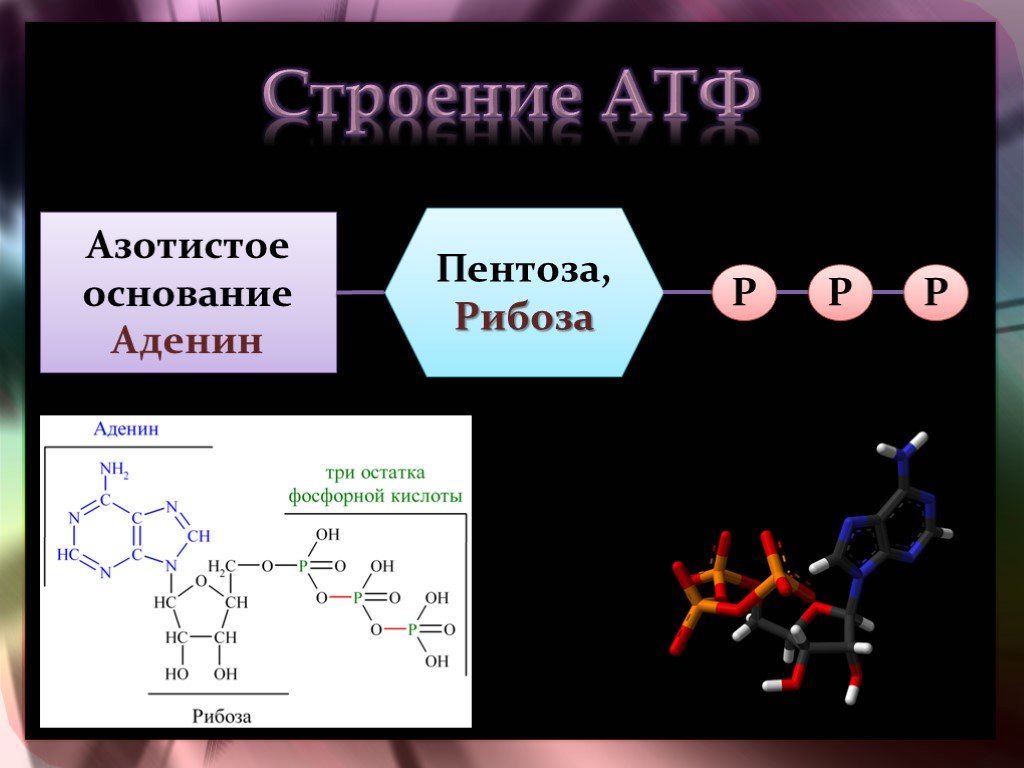 № № | Сумма | Цена (евро) | Купить / Примечание |
|---|---|---|---|
| НУ-202С | 150 мкл (10 мМ) | 122,60 | Добавить в корзину/Цитировать Добавить в Блокнот |
| НУ-202Л | 5 x 150 мкл (10 мМ) | 359,00 | Добавить в корзину/Цитировать Добавить в Блокнот |
Для общелабораторного использования.
Доставка: поставляется в гелевых упаковках
Условия хранения: хранить при -20 °C
Возможно кратковременное воздействие (в совокупности до 1 недели) при температуре окружающей среды.
Срок годности: 12 месяцев с даты поставки
Молекулярная формула: C 18 H 23 N 6 O 14 P 3 (свободная кислота)
Молекулярный вес: 640,33 г/моль (свободная кислота)
Точная масса: 640,05 г/моль (свободная кислота)
CAS#: 151481-86-6
Чистота: ≥ 95 % (ВЭЖХ)
Форма: раствор в воде
Цвет : от бесцветного до слегка желтого
Концентрация: 10 мМ — 11 мМ
pH: 7,5 ±0,5
Спектроскопические свойства: λ макс.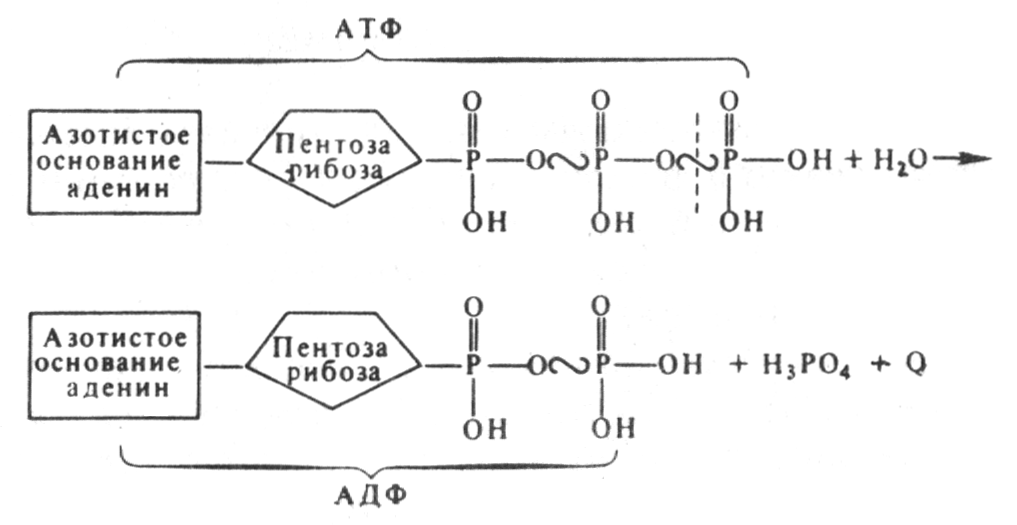 255/355 нм, ε 23,3/5,8 л ммоль -1 см -1 (трис-HCl pH 7,5) , λ отл 355 нм, λ em 448 нм
255/355 нм, ε 23,3/5,8 л ммоль -1 см -1 (трис-HCl pH 7,5) , λ отл 355 нм, λ em 448 нм
Области применения:
Конформационная динамика: DnaB/C-белок [1] , Csk [2]
Ингибирование AC-изоформ [3]
Флуоресцентный стоп-поток кинетика: ПКА [4]
FRET: AC [5] , миозин V [6]
Специфические лиганды:
DnaC-белок [7] 9000 5
Factor Rho [8]
Цитаты на продукцию BIOZ :
Щелкните стрелку справа, чтобы развернуть список ссылок. Нажмите на название публикации, чтобы увидеть полный текст.
Избранные ссылки:
[1] Roychowdhury et al. (2009) Взаимодействие белкового комплекса DnaB-DnaC Escherichia coli с нуклеотидными кофакторами. 1. Аллостерические конформационные переходы комплекса. Биохимия 48 :6712.
[2] Шаффер и др.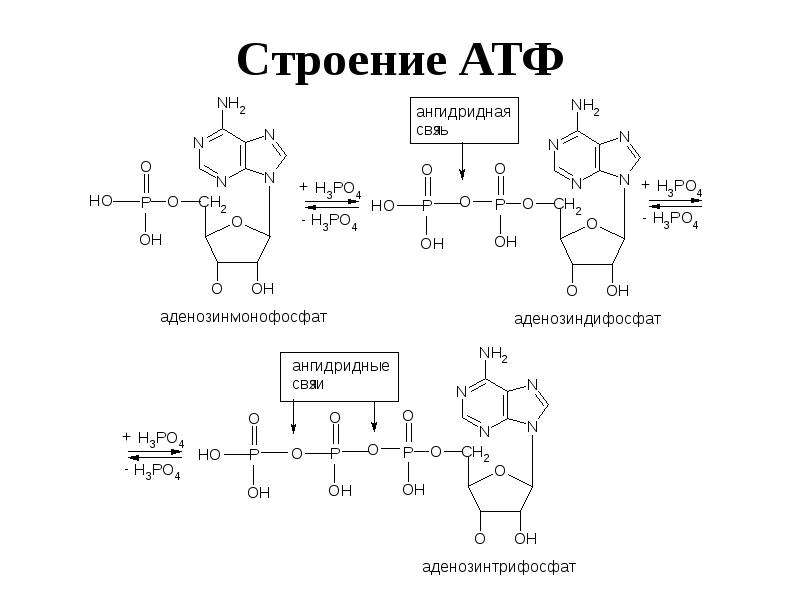 (2001) Высвобождение нуклеотидов и связанные с ними конформационные изменения регулируют функцию СООН-концевой киназы Src, Csk. Биохимия 40 :11149.
(2001) Высвобождение нуклеотидов и связанные с ними конформационные изменения регулируют функцию СООН-концевой киназы Src, Csk. Биохимия 40 :11149.
[3] Гилле и др. (2004) Дифференциальное ингибирование изоформ аденилатциклазы и растворимой гуанилатциклазы пуриновыми и пиримидиновыми нуклеотидами. Дж. Биол. хим. 279 :19955.
[4] Ni и др. (2000) Изучение связывания нуклеотидов в протеинкиназе А с использованием флуоресцентных производных аденозина. Наука о белках 9 :1818.
[5] Goettle и др. (2007) Молекулярный анализ взаимодействия аденилатциклазы Bordetella pertussis с флуоресцентными нуклеотидами. Молекулярная фармакология 72 (3) :526.
[6] Sun и др. (2006) Динамика верхнего домена 50 кДа миозина V исследована с переносом энергии флуоресцентного резонанса. Дж. Биол. хим. 281 :5711.
[7] Galletto и др. (2005) Сайт связывания нуклеотидов белка DnaC Escherichia coli: молекулярная топография комплекса белок-нуклеотид кофактора DnaC.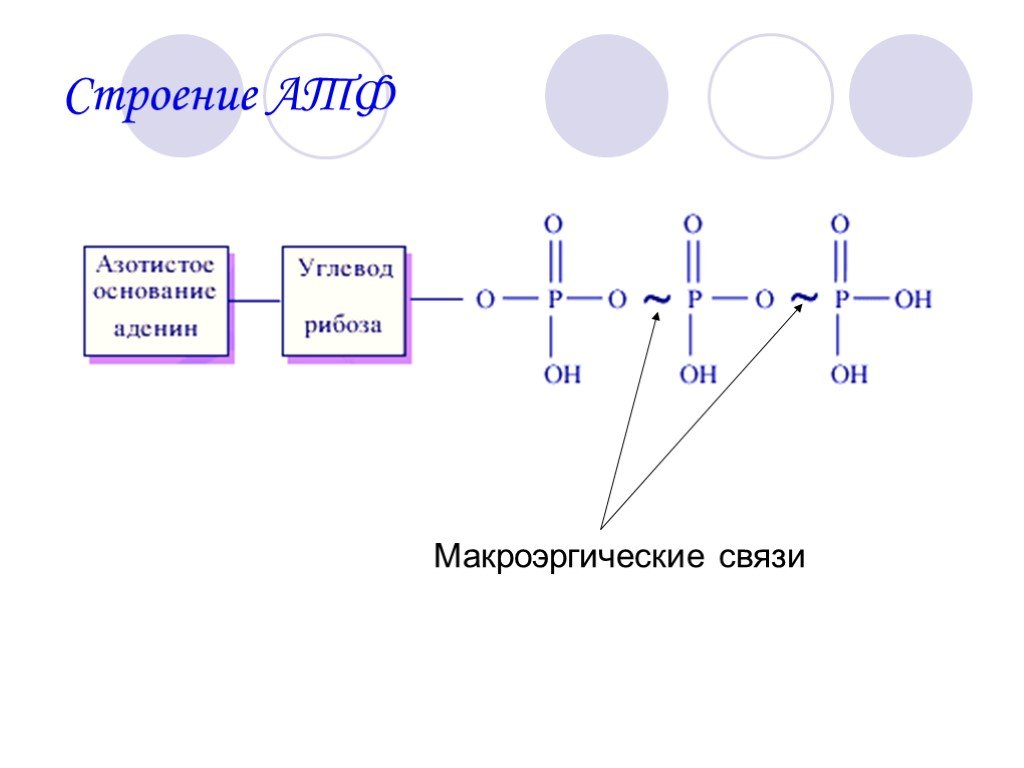 Клеточная биохимия. И Биофиз. 43 :331.
Клеточная биохимия. И Биофиз. 43 :331.
[8] Чон и др. (2004) Связывание нуклеотидов индуцирует конформационные изменения в факторе терминации транскрипции Escherichia coli Rho. Дж. Биол. хим. 279 :1837.
Зайферт и др. (2012) Ингибиторы мембранных аденилатциклаз. Trends Pharmacol. науч. 33 (2) :64.
Ван и др. (2011) Изомеры заряда основного белка миелина: структура и взаимодействие с мембранами, аналогами нуклеотидов и кальмодулином. PLoS Один. 6 (5) :e19915.
Пинто и др. (2011) Зависимости структура-активность для взаимодействий 2′- и 3′-(О)-(N-метил)антранилоилзамещенных пуриновых и пиримидиновых нуклеотидов с аденилатциклазами млекопитающих. Биохим. Фармакол. 82 (4) :358.
Hübner и др. (2011) Влияние MANT-нуклеотидов на токи кальция L-типа в кардиомиоцитах мыши. Арка Й. Наунина Шмидеберга. Фармакол. 383 (4) :573.
Spangler и др. (2011) Взаимодействие дигуанилатциклазы YdeH Escherichia coli с 2′, (3′)-замещенными пуриновыми и пиримидиновыми нуклеотидами. J. Pharmacol. Эксп. тер. 336 (1) :234.
Эрдорф и др. (2011) Фармакологическая характеристика изоформ аденилатциклазы в мембранах почек кролика. Арка Й. Наунина Шмидеберга. Фармакол. 383 (4) :357.
Goettle и др. (2010)Цитидилил- и уридилилциклазная активность фактора отека Bacillus anthracis и Bordetella pertussis CyaA. Биохимия 49 (26) :5494.
Чен и др. (2009) Структурные основы механохимического взаимодействия в гексамерном молекулярном двигателе. Дж. Биол. хим. 283 (6) :3607.
Каинов и др. (2008) Диссоциация АДФ, но не Pi способствует ограничению скорости для Escherichia coli Rho. Дж. Биол. хим. 284 (49) :33773.
Камбах и др. (2007) OLA1 человека Определяет подсемейство АТФаз в семействе Obg GTP-связывающих белков.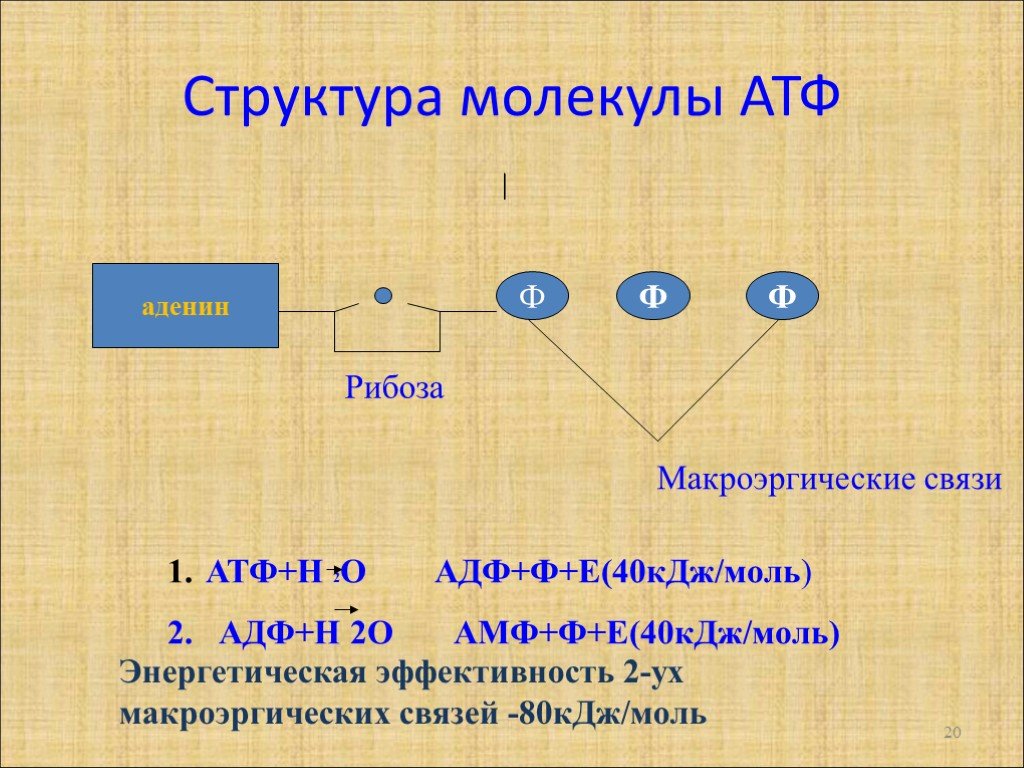 Дж. Биол. хим. 282 (27) :19928.
Дж. Биол. хим. 282 (27) :19928.
Скотт и др. (2006) Динуклеозидтетрафосфаты с обрывом цепи являются субстратами для полимеризации ДНК с помощью обратной транскриптазы вируса иммунодефицита человека типа 1 с повышенной активностью в отношении устойчивых к аналогу тимидина мутантов. ААС 50 (11) :3607.
Lísal и др. (2005) Совместный механизм двигателя упаковки РНК. Дж. Биол. хим. 280 (24) :23157.
Тунг-Чунг Моу и др. (2005) Структурные основы ингибирования аденилатциклазы мембраны млекопитающих с помощью 2′(3′)-O-(N-метилантранилоил)-гуанозин 5′-трифосфата. Дж. Биол. хим. 280 (8) :7253.
Fujita и др. (1999) Изменения флуоресценции метки, прикрепленной вблизи активного центра миозина, при связывании нуклеотидов в волокнах скелетных мышц крыс. J. Physiol. 515 :869.
Thoenges и др. (1999) Плотное связывание объемных флуоресцентных производных аденозина с низкоаффинным сайтом Е2АТФ приводит к ингибированию Na+/K+-АТФазы. Анализ структурных требований флуоресцентных производных АТФ с помощью модели Кошланда-Немети-Филмера двух взаимодействующих сайтов АТФ. Дж. Биол. хим. 274 :1971.
Анализ структурных требований флуоресцентных производных АТФ с помощью модели Кошланда-Немети-Филмера двух взаимодействующих сайтов АТФ. Дж. Биол. хим. 274 :1971.
Ченг и др. (1998) Взаимодействие мант-аденозиновых нуклеотидов и магния с кинезином. Биохимия 37 :5288.
Mocz и др. (1998) Исследование сайтов связывания нуклеотидов аксонемного динеина с помощью флуоресцентного аналога нуклеотида 2′(3′)-O-(-N-метилантранилоил)-аденозин 5′-трифосфата. Биохимия 37 :9862.
Джеймсон и др. (1997) Флуоресцентные аналоги нуклеотидов: синтез и применение. Методы Фермент. 278 :363.
Hiratsuka (1983) Новые модифицированные рибозой флуоресцентные аналоги адениновых и гуаниновых нуклеотидов, доступные в качестве субстратов для различных ферментов. Биохим. Биофиз. Acta 742 :496.
- CS-101L, JBScreen Classic 1
- CS-110L, JBScreen Classic 10
- NU-1001, дАТФ — раствор
- NU-1005, Комплект dNTP
- NU-1006, dNTP Mix — раствор 10 мМ
- NU-1007, dITP — раствор
- NU-101, 2′-Йодо-дАТФ
- NU-1101, N 6 -Метил-АТФ
- НУ-1103, Этено-АТФ (ε-АТФ)
- NU-1115, 5-фтор-UTP
Структура, синтез, гидролиз, функции и краткое изложение
Быстрая навигация
[скрыть]
Введение
В каждой живой клетке постоянно происходит множество процессов. Некоторые из этих процессов требуют энергии, в то время как другие ее генерируют. Должны существовать какие-то переносчики или молекулы для хранения, передачи и легкой доставки этой энергии туда, где она нужна.
Некоторые из этих процессов требуют энергии, в то время как другие ее генерируют. Должны существовать какие-то переносчики или молекулы для хранения, передачи и легкой доставки этой энергии туда, где она нужна.
АТФ является таким переносчиком энергии и молекулой-аккумулятором. Это нуклеотид, который действует как энергетическая валюта внутри клеток. Все передачи энергии внутри клетки происходят в форме АТФ. В этой статье мы подробно изучим структуру, синтез и функции АТФ. Итак, продолжайте читать.
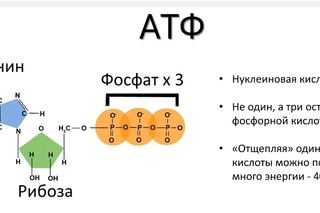
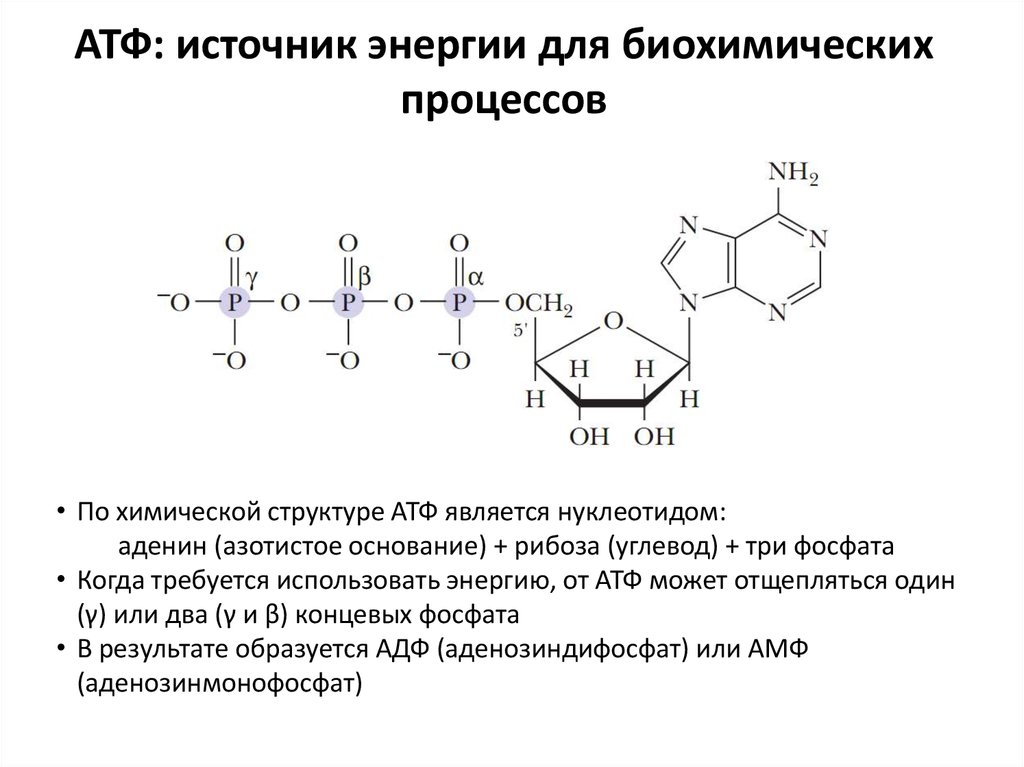
Структура
Аденозинтрифосфат (АТФ) представляет собой нуклеотид с тремя присоединенными фосфатными группами. Как и другие нуклеотиды, он состоит из следующих трех частей;
- Пентозный сахар
- Азотистое основание
- Фосфатные группы
Пентозный сахар
Пентозный сахар в случае АТФ представляет собой рибозу. Он присутствует в форме пятиугольного кольца или пятиугольника, называемого рибофураноза. Первый углерод связан с кислородом и является частью кольца. Пятый углерод находится вне кольца и направлен над плоскостью пятиугольника. Гидроксильные группы, присоединенные к атомам углерода, направлены ниже плоскости кольца.
Пятый углерод находится вне кольца и направлен над плоскостью пятиугольника. Гидроксильные группы, присоединенные к атомам углерода, направлены ниже плоскости кольца.
Азотистое основание
Азотистое основание в случае АТФ представляет собой аденин. Это пуриновое основание с двумя кольцами. Большее кольцо имеет шестиугольную форму, а меньшее — пятиугольное. Он соединен с первым углеродом рибозного сахара N-гликозидной связью. Аминогруппа в третьем положении аденина реагирует с гидроксильной группой у первого атома углерода рибозы с образованием этой N-гликозидной связи.
Полученное соединение представляет собой нуклеозид под названием аденозин.
Фосфатные группы
АТФ представляет собой трифосфатное соединение, имеющее три фосфата, присоединенных к пятому углероду рибозы. Первая фосфатная группа связана через сложноэфирную связь, образованную реакцией гидроксильной группы и кислой фосфатной группы. Две другие фосфатные группы присоединены через фосфоангидридные связи.
Синтез
АТФ может быть синтезирован различными способами. Цепь переноса электронов как у животных, так и у растений является наиболее важным источником АТФ в клетках. В этом разделе мы обсудим различные способы, используемые живыми клетками для производства АТФ.
Синтез АМФ и АДФ
Аденозинмонофосфат (АМФ) является предшественником АДФ и АТФ. Он синтезируется в клетках в процессе синтеза нуклеозидов. На молекуле рибозо-5-фосфата пуриновое кольцо образуется с использованием углекислого газа и различных аминокислот. Непосредственным продуктом является инозинмонофосфат (ИМФ).
Эта молекула ИМФ превращается в АМФ в два этапа;
- На первом этапе ИМФ конденсируется с аспартатом с образованием аденилосукцината с использованием энергии, выделяемой ГТФ. Эта реакция катализируется ферментом аденилосукцинатсинтетазой.
- На втором этапе аденилосукцинат теряет фумарат с образованием аденозинмонофосфата. Эта реакция катализируется ферментом аденилосукциназой.

После образования АМФ он фосфорилируется с образованием АДФ с помощью фермента аденилаткиназы. АДФ действует как непосредственный предшественник АТФ.
Клетки имеют большой пул АДФ, который может быть преобразован в АТФ с помощью фермента АТФ-синтазы. Этот процесс фосфорилирования требует энергии, которая может быть обеспечена различными процессами. Два наиболее важных процесса:
- Окислительное фосфорилирование
- Z-реакция
Окислительное фосфорилирование
Это фосфорилирование АДФ в АТФ, связанное с цепью переноса электронов. Окислительное фосфорилирование является основным путем получения энергии в виде АТФ с использованием различных видов топлива.
Электронно-транспортная цепь (ЭТЦ) представляет собой ряд ферментных комплексов, организованных в порядке убывания восстановительной способности. Он присутствует на внутренней митохондриальной мембране и является основным источником синтеза АТФ в клетках животных.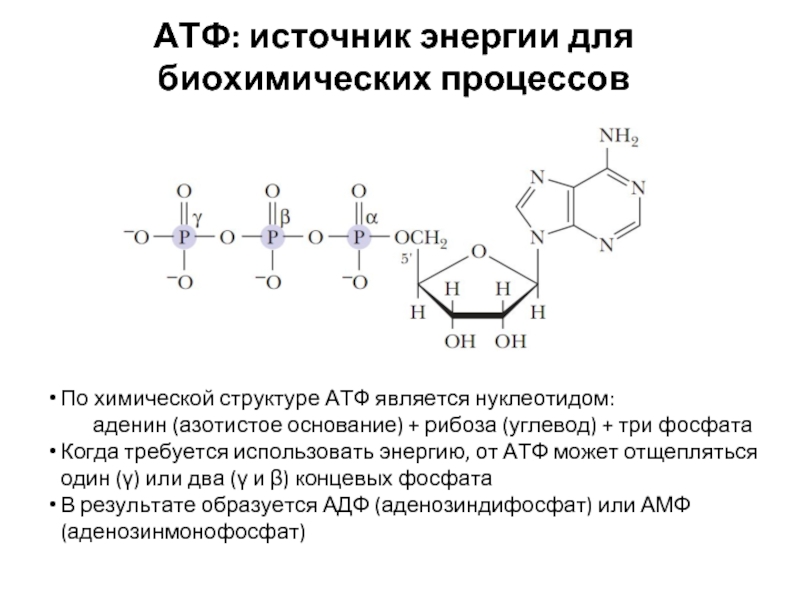 Клетки растений используют митохондриальный источник для выработки энергии из глюкозы и других видов топлива в ночное время.
Клетки растений используют митохондриальный источник для выработки энергии из глюкозы и других видов топлива в ночное время.
Электроны, полученные из различных видов энергетического топлива в клетках, таких как глюкоза, жирные кислоты и т. д., переносятся в цепь переноса электронов переносчиками, такими как НАДН и ФАДН 2 . Когда электроны проходят по электрон-транспортной цепи, они высвобождают большое количество энергии. Эта энергия используется для перекачки протонов (H + ) из митохондриального матрикса в межмембранное пространство (пространство между внутренней и внешней митохондриальными мембранами)
Протоны в митохондриальном межмембранном пространстве уже имеют более высокую концентрацию. Они имеют тенденцию двигаться вниз по градиенту концентрации в митохондриальный матрикс. Они делают это, проходя через протонный канал.
Протонный канал является частью фермента АТФ-синтазы. Когда протон проходит через этот канал, он высвобождает энергию.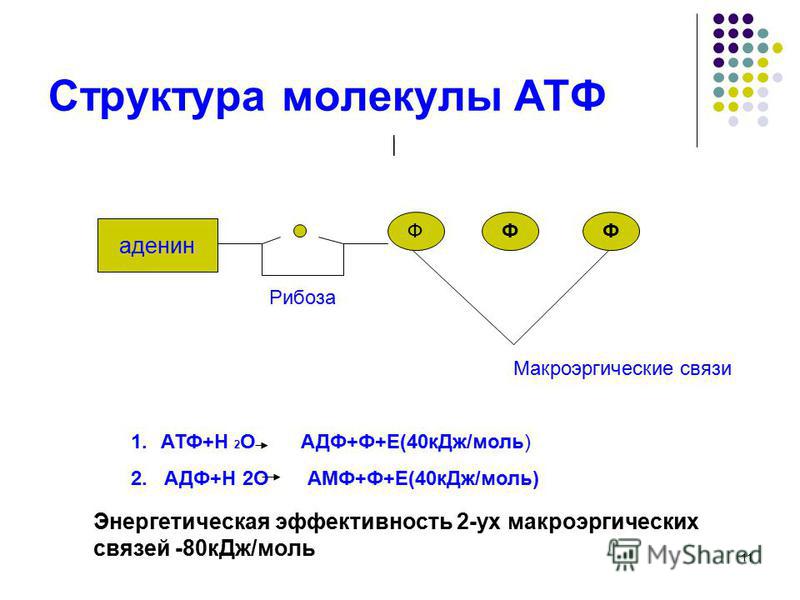 Эта энергия используется для фосфорилирования АДФ с образованием АТФ.
Эта энергия используется для фосфорилирования АДФ с образованием АТФ.
Z-реакция
Другое название световых реакций фотосинтеза. В этой реакции энергия для фосфорилирования обеспечивается солнечным светом. Это происходит на тилакоидных мембранах хлоропластов.
Это серия химических реакций, в которых энергия световых фотонов используется для перевода электронов в более высокое восстановительное состояние. Электроны получаются из воды, а их восстановительная способность усиливается за счет энергии света. Эти электроны позже направляются из более высокого восстановительного состояния в электрон-транспортную цепь (ЭТЦ).
Когда эти электроны проходят по цепи переноса электронов на мембранах тилакоидов, они высвобождают энергию, которая используется для перекачки протонов из стромы хлоропластов в просвет тилакоидов против градиента их концентрации.
Эти протоны имеют тенденцию перемещаться по градиенту концентрации обратно в строму, проходя через протонный канал АТФ-синтазы, также присутствующей в тилакоидной мембране хлоропластов. Когда протоны движутся, они высвобождают энергию, которая используется для фосфорилирования АДФ в АТФ.
Когда протоны движутся, они высвобождают энергию, которая используется для фосфорилирования АДФ в АТФ.
Другие реакции
Окислительное фосфорилирование и Z-реакция являются двумя основными источниками энергии для фосфорилирования АДФ в АТФ.
В дополнение к этим реакциям некоторые экзергонические реакции высвобождают энергию, достаточную для фосфорилирования АТФ в АДФ. Некоторые примеры таких реакций приведены ниже.
Гликолиз
Это процесс окисления кислорода до пировиноградной кислоты. Вторая фаза гликолитической реакции дает достаточно энергии для превращения двух молекул АДФ в АТФ.
Цикл Кребса
В каждом цикле Кребса одна молекула GDP превращается в GTP, который, в свою очередь, обеспечивает энергию для фосфорилирования АДФ в АТФ.
Следует иметь в виду, что в дополнение к получению энергии для прямого фосфорилирования эти реакции также генерируют переносчики электронов, такие как NADH и FADH 2 . Эти переносчики электронов вызывают синтез АТФ через цепь переноса электронов, как упоминалось выше.
Эти переносчики электронов вызывают синтез АТФ через цепь переноса электронов, как упоминалось выше.
Гидролиз АТФ
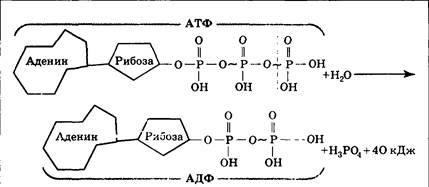
Как упоминалось ранее в этой статье. АТФ действует как энергоноситель. Синтез АТФ дает представление о том, как энергия, присутствующая в различных видах топлива, используемых организмом, высвобождается и сохраняется в виде высокоэнергетических фосфатных связей АТФ. Эта энергия становится доступной для клеточных процессов гидролизом АТФ.
Две концевые фосфатные группы АТФ связаны с остальной частью молекулы высокоэнергетическими фосфатными связями. Каждая из этих связей при гидролизе выделяет 7,3 ккал/моль энергии.
Гидролиз АТФ представляет собой двухстадийный процесс. На первом этапе он превращается в АДФ путем разрыва одной концевой связи, при этом выделяется 7,3 ккал/моль энергии.
Образованная таким образом молекула АДФ может быть либо повторно использована для образования АТФ, либо может быть расщеплена до АМФ путем гидролиза фосфатной связи с высвобождением 7,6 ккал энергии вместе с неорганическим фосфатом.
Функции ATP
Список функций, выполняемых ATP, бесконечен. Он необходим почти для всех процессов, происходящих в живых клетках. Некоторые из широко известных функций обсуждаются ниже.
- Глюконеогенез
Это процесс получения глюкозы из неуглеводных источников. Глюконеогенез обеспечивает организм глюкозой, когда запасы гликогена истощаются во время голодания. Для синтеза каждой молекулы глюкозы используются четыре молекулы АТФ. Тяжелая гипогликемия и другие сопутствующие клинические состояния могут возникнуть, если глюконеогенез не происходит должным образом.
- Активный транспорт
Активный транспорт – это процесс, при котором вещества перемещаются из области с более низкой концентрацией в область с более высокой концентрацией. Для этого транспорта требуется энергия против градиента концентрации, который обеспечивается АТФ. Активный транспорт осуществляется через специальные каналы белков-переносчиков, для работы которых требуется АТФ. Таким белкам присуща АТФазная активность, позволяющая расщеплять АТФ до АДФ и использовать высвобожденную энергию для транспорта.
Таким белкам присуща АТФазная активность, позволяющая расщеплять АТФ до АДФ и использовать высвобожденную энергию для транспорта.
Примерами таких белков-переносчиков являются натрий-калиевый насос, кальциевый насос и т. д.
- Клеточная передача сигналов
АТФ необходима для активации молекул, участвующих в процессах передачи сигналов внутри клетки. Различные киназы, участвующие в каскадах передачи сигнала, активируются только при фосфорилировании АТФ. Примером таких киназ является митоген-активируемая протеинкиназа или MAP-киназа. Он участвует в сигнальном каскаде, который регулирует деление клеток.
АТФ также является вторичным мессенджером в некоторых сигнальных путях. Аденилатциклаза представляет собой фермент, который действует на АТФ при активации рецепторами, связанными с G-белком, с образованием циклической АМО (цАМФ), которая осуществляет различные внутриклеточные реакции.
- Синтез нуклеиновой кислоты
Синтез ДНК включает две стадии;
- Синтез нуклеотидов
- Образование полинуклеотидов
Синтез ДНК включает дополнительную стадию сборки полинуклеотидов с образованием двойной спирали. Все эти процессы зависят от АТФ. Он используется не на лимитирующей стадии синтеза нуклеотидов, а на последующих стадиях.
Все эти процессы зависят от АТФ. Он используется не на лимитирующей стадии синтеза нуклеотидов, а на последующих стадиях.
Кроме того, он действует как мономер для синтеза нуклеиновых кислот, таких как ДНК и РНК.
- Синтез белка
Синтез белка — энергозависимый процесс, происходящий на рибосомах. Энергия для синтеза белка также обеспечивается АТФ. Транспортная РНК переносит аминокислоты на рибосомы для их сборки. Для активации аминокислоты и ее присоединения к тРНК требуется АТФ. Комплекс аминоацил-тРНК-синтетазы использует АТФ и тРНК для образования комплекса АМФ-тРНК, при этом высвобождается пирофосфат. Затем аминокислота связывается с этим комплексом AMP-тРНК и переносится на рибосомы.
- Движение и сокращение мышц
Движение частей тела или перемещение человека из одного места в другое происходит в результате сокращения мышц, которое также зависит от АТФ. Сокращение мышц происходит в результате взаимодействия белков актина и миозина в мышечных волокнах. Каждый раз используется молекула АТФ, чтобы разорвать актин-миозиновые поперечные мостики и снова продолжить цикл. В отсутствие АТФ актиновые и миозиновые мостики не будут разорваны, и мышцы останутся в состоянии постоянной контрактуры, как это бывает после смерти. Скованность тела после смерти из-за недостатка АТФ называется трупное окоченение .
Каждый раз используется молекула АТФ, чтобы разорвать актин-миозиновые поперечные мостики и снова продолжить цикл. В отсутствие АТФ актиновые и миозиновые мостики не будут разорваны, и мышцы останутся в состоянии постоянной контрактуры, как это бывает после смерти. Скованность тела после смерти из-за недостатка АТФ называется трупное окоченение .
- Фагоцитоз
Фагоцитоз – это процесс поглощения патогенных инородных частиц макрофагами. Это чрезвычайно важно для защиты организма от вредных патогенов. Для этой цели также требуется АТФ. Фагоциты поглощают чужеродные частицы, вытягивая вокруг себя мембранные отростки, образуя фагоцитарную чашечку. АТФ требуется для полимеризации актина, чтобы распространить эти мембранные процессы наружу.
- Нейротрансмиттер 9TP, эти мышцы сокращаются.
Резюме
АТФ представляет собой органическую молекулу, имеющую первостепенное значение в живых структурах.
Это нуклеотид, который действует как переносчик энергии, захватывая энергию в одних реакциях и обеспечивая ее для других.

Состоит из;
- Сахар рибоза
- Адениновое основание
- Три фосфатные группы
Его предшественником является аденозинмонофосфат (АМФ), который образуется из ИМФ при синтезе нуклеотидов. АМФ может быть преобразован в АДФ с помощью аденозинкиназ.
Для фосфорилирования АДФ в АТФ требуется энергия, которая обеспечивается цепью переноса электронов во время,
- Гликолиз
- Цикл Кребса
АТФ имеет две высокоэнергетические фосфатные связи, которые высвобождают энергию при гидролизе.
Эта энергия используется в различных процессах. Некоторые из этих процессов включают;
- Глюконеогенез
- Активный транспорт веществ через мембраны
- Синтез ДНК и других нуклеиновых кислот
- Синтез белков
- Фагоцитоз инородных частиц
- Сокращение мышц и движения 903 61
Кроме того, АТФ также является предшественником вторичный мессенджер цАМФ, активатор сигнальных киназ, таких как киназа MAP, а также нейротрансмиттер для некоторых клеток, таких как некоторые гладкие мышцы.

Часто задаваемые вопросы
Что такое АТФ?
АТФ означает аденозинтрифосфат, богатую энергией фосфатсодержащую молекулу, обнаруженную в живых клетках. Он играет решающую роль в преобразовании энергии в клетках.
Как синтезируется АТФ?
АТФ синтезируется из АДФ в ходе различных реакций выделения энергии в организме. АДФ происходит из АМФ, синтезируемого из инозинмонофосфата (ИМФ) во время метаболизма нуклеотидов.
Сколько энергии выделяется при гидролизе АТФ?
Одна молекула АТФ содержит две высокоэнергетические фосфатные связи. Гидролиз одной высокоэнергетической фосфатной связи АТФ дает 7,3 ккал/моль энергии.
Каковы функции АТФ?
АТФ является первичной богатой энергией молекулой, участвующей в биохимических процессах организма, таких как метаболизм глюкозы, метаболизм аминокислот, метаболизм нуклеотидов и т. д. Он также действует как нейротрансмиттер.
Ссылки
- Рис, Джейн Б. (31 октября 2013 г.