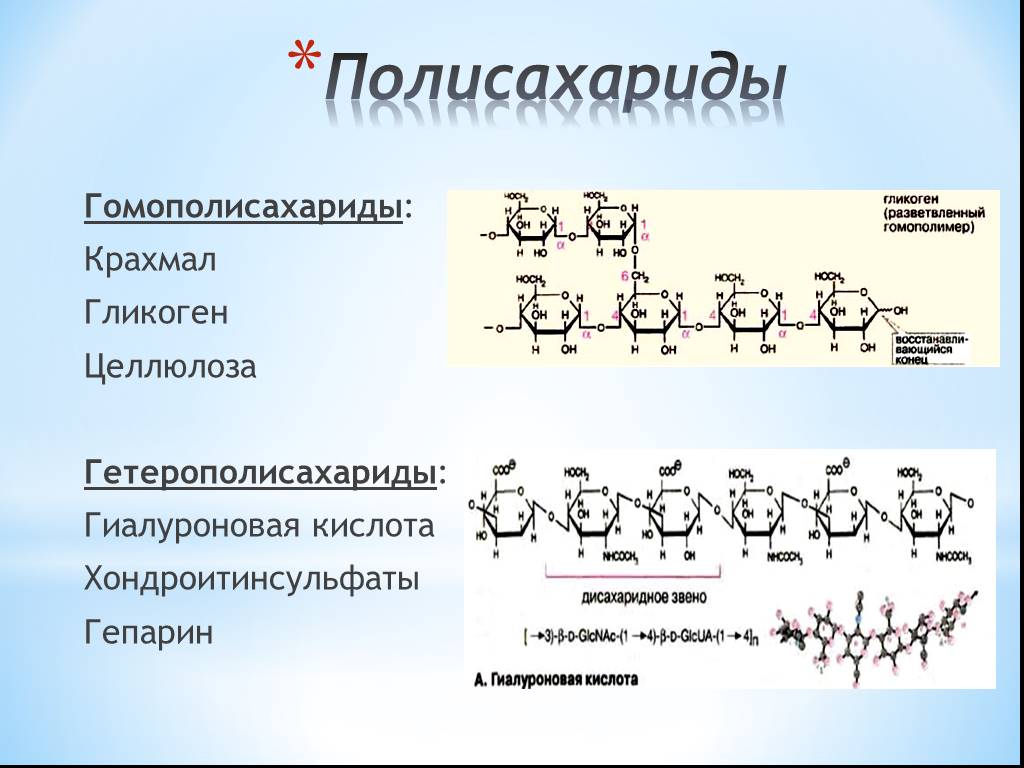
4. Гликоген. Строение, биороль. Синтез и распад, ключевые ферменты, регуляция процесса.
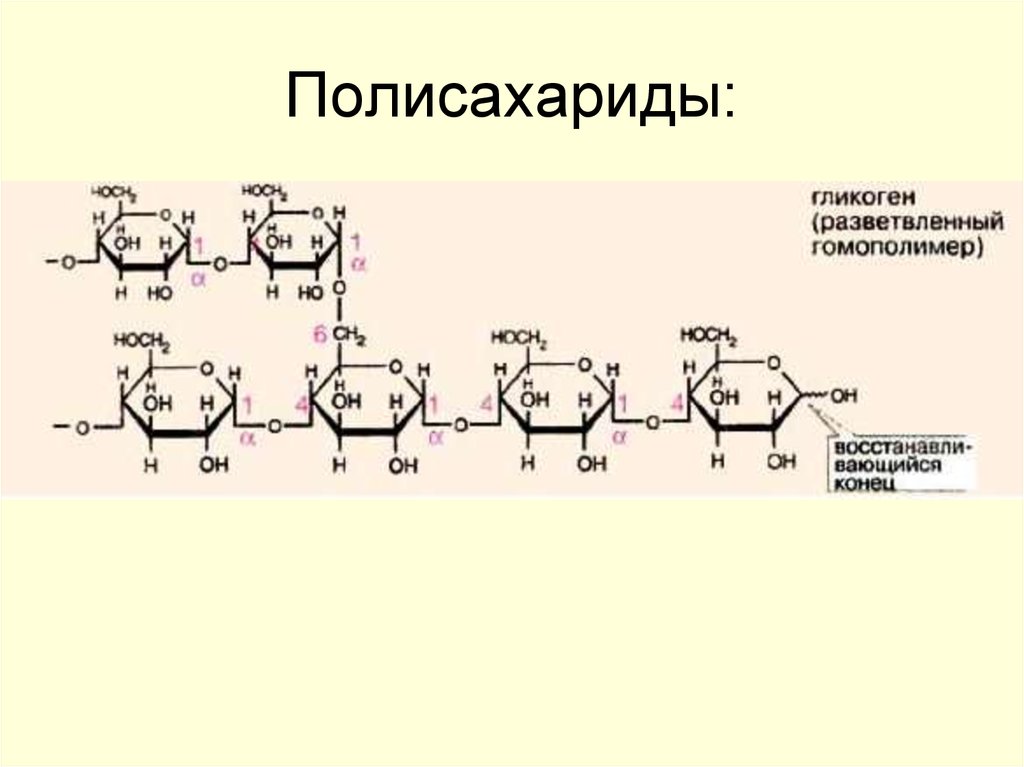
Гликоген — полисахарид животных и человека. Так же, как крахмал в растениях, гликоген в клетках животных выполняет резервную функцию, но, так как в пище содержится лишь небольшое количество гликогена, он не имеет пищевого значения.
Гликоген представляет собой структурный аналог крахмала, но имеет большую степень ветвления: примерно на каждые 10 остатков глюкозы приходится одна α-1,6-гликозидная связь.
Распад гликогена – гликогенолиз:
1) При снижении глюкозы в крови или когда резко возрастает потребность в энергии:
(гликоген)n глюкоза-1-фосфат + (гликоген)n-1
2) Под действием ферм.фосфогдюкомутаза:
глюкоза-1-фосфат глюкоза-6-фосфат
3) В мышцах на этом распад гликогена заканчивается.
В
печени есть ферм. глюкоза-6-фосфатаза
(имеется также в почках и кишечнике, но
меньше), которая отсутствует в мышцах,
функция которой, поддерживать уровень
глюкозы в крови.
Печень высвобождает глюкозу в период мышечной активности.
Энергетических выход гликогеногенеза 3 молекулы АТФ.
Синтез гликогена — гликогеногенез:
1) Фосфорилирование глюкозы до глюкозо-6-фосфат (ферм: гексокиназа)
2) Изомеразация глюкоза-6-фосфата в глюкоза-1-фосфат (ферм: фосфоглюкомутаза)
3) Образование уридиндифосфоглюкозы (УДФ-глюкозы) из глюкоза-1-фосфата и уридинтрифосфоглюкозы (УТФ-глюкозы)
4) УДФ-глюкоза взаимодействует с затравочным гликогеном и происходит нарастание цепи гликогена (ферм: гликогенсинтаза) : (гликоген)n + УДФ-глюкоза (гликоген)n+1 + УДФ
!!! n – кол-во остатков глюкозы.
Аэробный распад – до СО2 и Н2О:
Распад глюкозы – гликолиз ОБЩАЯ СХЕМА:
1) Фосфорилирование глюкозы до глюкозо-6-фосфат (ферм: гексокиназа — ключевая реакция )
2) Изомеризация глюкозо-6-фосфата во фруктозо-6-фосфат (ферм: глюкозофосфатизомераза)
3) Фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-бифосфата(ферм:фосфофруктокиназа-ключевая реакция)
4)
Расщепление фруктозо-1,6-бифосфата на
ФГА (фосфоглицеральдегид) и ФДА
(фосфодиоксиацетон) при участии ферм. альдолазы
альдолазы
5) Взаимопревращения ФДА в ФГА и обратно (ферм: триозофосфатизомераза)
6) Окисление ФГА в 1,3-бифосфоглицерат (ферм: глицеральдегид-3-фосфатдегидрогеназа)
7) субстратное фосфорилирование, превращение 1,3-бифосфоглицерат в 3-фосфоглицерат (ферм:фосфоглицераткиназа).
8) изомеразация 3-фосфоглицерат в 2-фосфоглицерат (ферм: фосфоглицератмутаза)
9) дегидратация 2-фосфоглицерата до фосфоенолпирувата (ферм:енолгидратаза)
Далее аэробный и анаэробный идут по разным путям.
Аэробный:
11) Пируват СО2 + Н2О
Биороль аэробного гликолиза:
— происходит во многих органах и тканях и служит основным источником энергии
— Клетки мозга расходуют до 100г глюкозы в сутки, окисляя ее аэробным путем.
Суммарное ур-е: С6Н12О6 + 6 О2 6СО2 + Н2О + 2820 кДж/моль (38 АТФ)
Пояснение, реакции:
1) – 1 молекула АТФ
2) —
3) – 1 молекула АТФ
4) расщепление, которое дает удвоение всех последующих продуктов!! важно для 10 реакции!
5) —
6) + 2 молекулы НАДН (2х3 АТФ=6 АТФ)
7) + 2 АТФ
8) —
9) + 2 АТФ
10)
2 пирувата (т.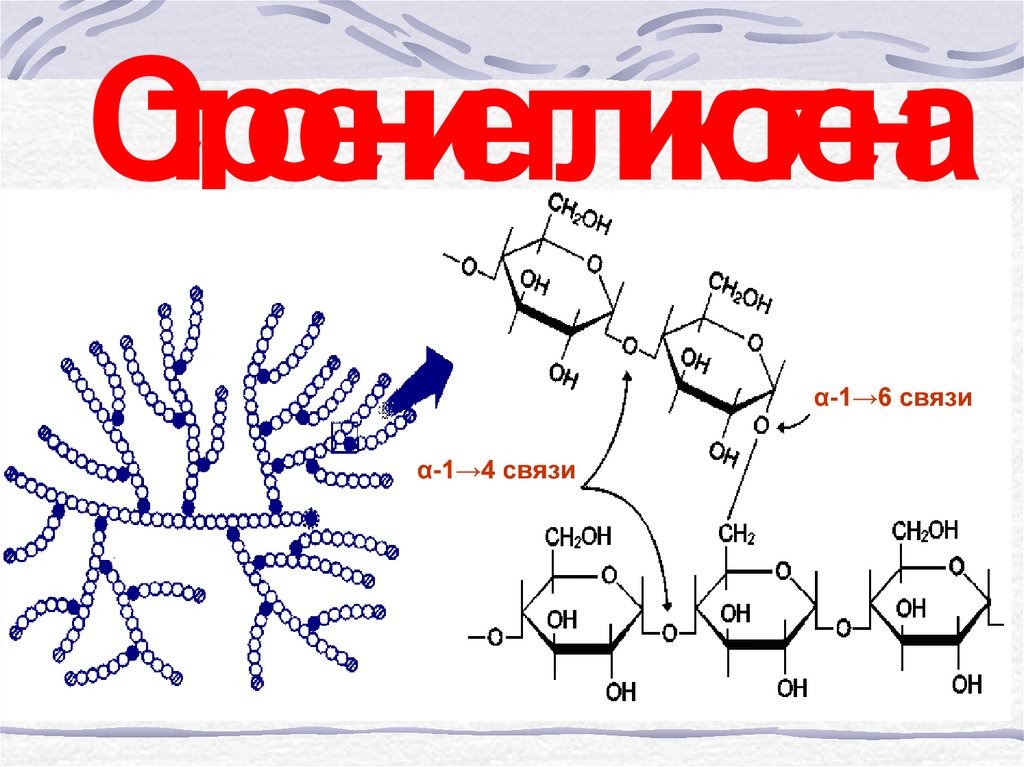
Итого: 38 АТФ
Гликоген, вещество, синтез и расщепление
Гликоген, вещество, синтез и расщепление.
Поделиться в:
Гликоген – полисахарид со сложным строением, образованный остатками глюкозы, соединёнными α-(1→4) гликозидными связями, а в местах разветвления – α-(1→6) гликозидными связями.
Гликоген, формула, молекула, строение, состав, вещество
Гликоген в организме. Биологическая роль гликогена. Синтез и расщепление гликогена
Физические свойства гликогена
Химические свойства гликогена. Химические реакции (уравнения) гликогена
Гликоген, формула, молекула, строение, состав, вещество:
Гликоген – полисахарид со сложным строением, образованный остатками глюкозы, соединёнными α-(1→4) гликозидными связями, а в местах разветвления – α-(1→6) гликозидными связями.
Гликоген представляет собой разветвленный биополимер, состоящий из линейных цепей глюкозных остатков с дальнейшими цепями, разветвляющимися каждый 8-12 остатков глюкоз или около того. Остатки глюкозы связаны линейно с помощью α-(1→4) глюкозидных связей от одной глюкозы к следующей. Ветви связаны с цепями, от которых они отделяются глюкозидными связями α-(1→6) между первой глюкозой новой ветви и глюкозой в цепочке стволовых клеток. Ядро биополимера состоит из гликогенинового белка.
Остатки глюкозы связаны линейно с помощью α-(1→4) глюкозидных связей от одной глюкозы к следующей. Ветви связаны с цепями, от которых они отделяются глюкозидными связями α-(1→6) между первой глюкозой новой ветви и глюкозой в цепочке стволовых клеток. Ядро биополимера состоит из гликогенинового белка.
Рис. 1. Строение гликогена (в центре — молекула гликогенина)
@ https://ru.wikipedia.org/wiki/Гликоген
Гликоген – это многоразветвленный полисахарид глюкозы, который служит формой накопления энергии у животных, грибов и бактерий.
В клетках животных гликоген служит основным запасным углеводом и основной формой хранения глюкозы в организме.
Гликоген иногда называют животным крахмалом, так как его строение похоже на амилопектин – компонент растительного крахмала. Гликоген отличается от крахмала более разветвлённой и компактной структурой и не дает синего цвета при окраске йодом. Водные растворы гликогена окрашиваются йодом в фиолетово-коричневый, фиолетово-красный цвет.
Водные растворы гликогена окрашиваются йодом в фиолетово-коричневый, фиолетово-красный цвет.
Химическая формула гликогена (C6H10O5)n.
Строение молекулы гликогена, структурная формула гликогена:
Гликоген содержит от 6 000 до 30 000 остатков глюкозы.
По внешнему виду гликоген представляет собой белое аморфное вещество без вкуса и запаха.
Гликоген растворяется в воде.
Гликоген в организме. Биологическая роль гликогена. Синтез и расщепление гликогена:
Гликоген функционирует как одна из двух форм долгосрочных энергетических резервов животного организма, причем другая форма – это триглицериды, которые хранятся в жировой ткани (т.е. жировые отложения).
Гликоген образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы. Гликогеновый запас, однако, не столь ёмок в калориях на грамм, как запас триглицеридов (жиров).
Гликогеновый запас, однако, не столь ёмок в калориях на грамм, как запас триглицеридов (жиров).
Гликоген содержится во всех клетках и тканях организма животного в двух формах: стабильный гликоген, прочно связанный в комплексе с белками, и лабильный в виде гранул, прозрачных капель в цитоплазме в клетках многих типов.
У человека гликоген вырабатывается и хранится преимущественно в клетках печени (гепатоцитах) и скелетных мышцах. В клетках печени гликоген может составлять 5-6 % от массы органа, а печень взрослого человека весом 1,5 кг может хранить примерно 100-120 граммов гликогена. В скелетных мышцах гликоген находится в меньшей концентрации – 1-2 % от массы мышцы. В скелетных мышцах взрослого человека весом 70 кг хранится примерно 400 граммов гликогена. Количество гликогена, хранящегося в организме – особенно в мышцах и печени – в основном зависит от его физической подготовки, метаболизма и привычек питания. Однако только гликоген, запасённый в клетках печени (гепатоцитах), может быть переработан в глюкозу для питания всего организма. В организм человека гликоген из клеток печени поступает через кровь. В то время как в скелетных мышцах гликоген перерабатывается в глюкозу исключительно для локального потребления. Небольшие количества гликогена также присутствуют в других тканях и клетках организма, в том числе в почках, эритроцитах, лейкоцитах и глиальных клетках в головном мозге.
В организм человека гликоген из клеток печени поступает через кровь. В то время как в скелетных мышцах гликоген перерабатывается в глюкозу исключительно для локального потребления. Небольшие количества гликогена также присутствуют в других тканях и клетках организма, в том числе в почках, эритроцитах, лейкоцитах и глиальных клетках в головном мозге.
При недостатке в организме глюкозы гликоген под воздействием ферментов расщепляется до глюкозы, которая поступает в кровь. И наоборот, излишки глюкозы запасаются в виде гликогена. Регуляция синтеза и распада гликогена осуществляется нервной системой и гормонами.
Гликоген печени служит прежде всего для поддержания более или менее постоянного уровня глюкозы в крови, а гликоген мышц, наоборот, не участвует в регуляции уровня глюкозы в крови. В связи с этим колебания уровня гликогена в печени варьируются в широких пределах. При длительном голодании (например, через 12-18 часов после приема пищи) уровень гликогена в печени падает до нуля.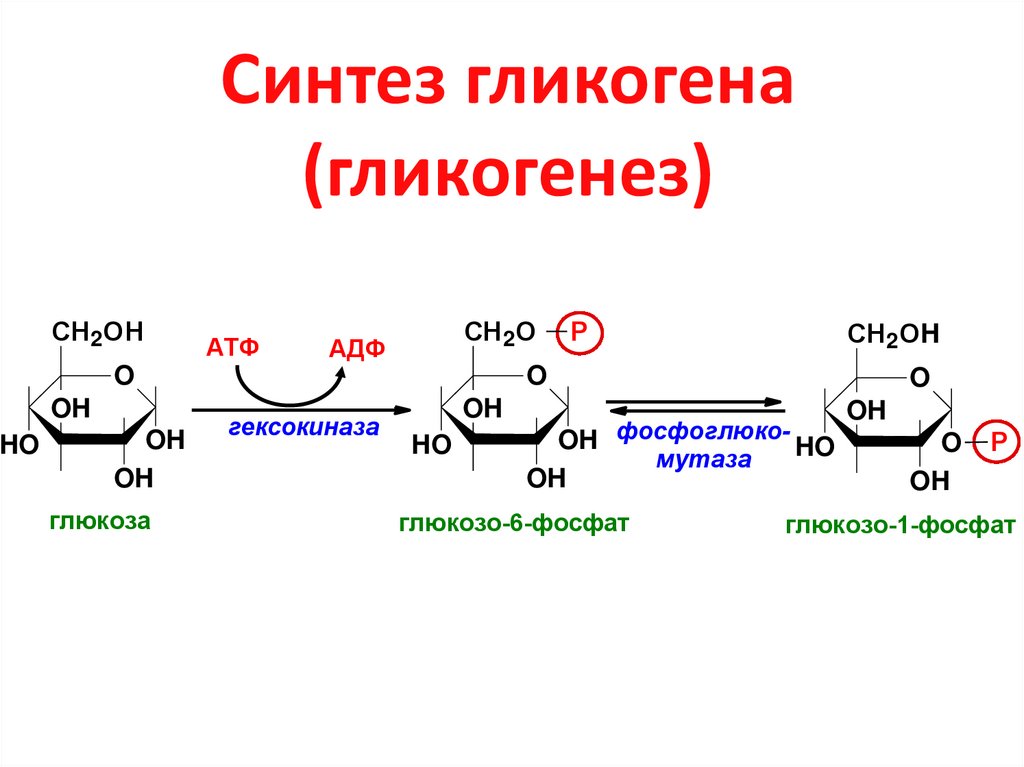 Содержание мышечного гликогена заметно снижается после продолжительной и напряженной физической работы.
Содержание мышечного гликогена заметно снижается после продолжительной и напряженной физической работы.
Следует иметь в виду, что запасы гликогена в мышцах ограничены. Результатом недостатка гликогена может быть усталость и снижение выносливости.
Физические свойства гликогена:
| Наименование параметра: | Значение: |
| Цвет | белый |
| Запах | без запаха |
| Вкус | без вкуса |
| твердое аморфное вещество |
Химические свойства гликогена. Химические реакции (уравнения) гликогена:
Основные химические реакции гликогена следующие:
- 1. реакция гидролиза гликогена в кислой среде:
(C6H10O5)n → (C6H10O5)y → C6H12O6 (H2O, Н+).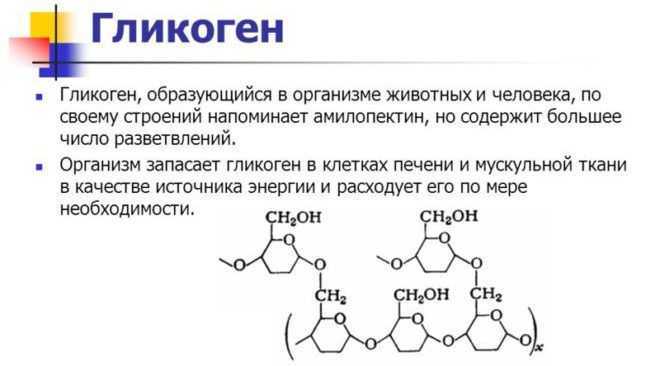
Важнейшее свойство гликогена – способность подвергаться гидролизу в водных растворах кислот.
Гидролиз протекает ступенчато. Из гликогена ((C6H10O5)n) сначала образуется декстрин ((C6H10O5)y, при этом y < n), который гидролизуется до глюкозы (С6Н12O6
).- 2. качественная реакция на гликоген (реакция гликогена с йодом):
В результате реакции раствора гликогена с раствором йода происходит окрашивание гликогена в фиолетово-коричневый, фиолетово-красный цвет.
Источник: https://ru.wikipedia.org/wiki/Гликоген
Примечание: © Фото https://www.pexels.com, https://pixabay.com, https://ru.wikipedia.org/wiki/Гликоген
Коэффициент востребованности 4 305
Как эволюционировала структура гликогена, чтобы удовлетворить потребность в быстрой мобилизации глюкозы? Проблема физических ограничений в построении структур
Абдель-Ахер М. , Смит Ф. (1951) Повторяющаяся единица гликогена. J Am Chem Soc 73: 994–996
, Смит Ф. (1951) Повторяющаяся единица гликогена. J Am Chem Soc 73: 994–996
Статья КАС Google Scholar
Алонсо М.Д., Ломако Дж., Ломако В.М., Уилан В.Дж. (1995) Новый взгляд на биогенез гликогена. FASEB J 9: 1126–1137
ПабМед КАС Google Scholar
Baldwin E, Bell DJ (1940) Гликоген
PubMed КАС Google Scholar
Barry C, Gavard R, Milhaud G, Aubert JP (1953) Etude du glycogene extrait de Bacillus megatherium . Энн Инст Пастер 84: 605–613
CAS Google Scholar
Bathgate GN, Manners DJ (1966) Множественное разветвление гликогенов. Biochem J 101: 3c-5c
PubMed КАС Google Scholar
Bell DJ (1944) Анализ смесей 2:3:4:6-тетраметилглюкозы с 2:3:6-триметил- и диметилглюкозой путем распределения на колонке с кремнеземом и водой: мелкомасштабный метод исследования структуры глюкополисахаридов. J Chem Soc 473–476
J Chem Soc 473–476
Bell DJ, Manners DJ (1952) Действие кристаллической β-амилазы на некоторые гликогены. J Chem Soc 3641–3645
Blows JMH, Calder PC, Geddes R, Willis PR (1988) Структура плацентарного гликогена. Плацента 9: 493–500
Статья пабмед КАС Google Scholar
Boyer C, Preiss J (1977) Биосинтез бактериального гликогена. Очистка и свойства Escherichia coli B α-1,4-глюкан:α-1,4-глюкан 6-гликозилтрансферазы. Биохимия 16: 3693–3699
Артикул пабмед КАС Google Scholar
Brown BI, Brown DH (1966) α-1,4-глюкан-6-гликозилтрансфераза из мышц млекопитающих. Методы Enzymol 8: 395–403
Артикул КАС Google Scholar
Bullivant HM, Geddes R, Willis PR (1983) Тонкая структура гликогена. Biochem Int 6: 497–506
CAS Google Scholar
 Кандидат наук. Диссертация, Оклендский университет, Новая Зеландия
Кандидат наук. Диссертация, Оклендский университет, Новая ЗеландияGoogle Scholar
Calder PC (1991) Структура гликогена и биогенез. Int J Biochem 23: 1335–1352
Статья пабмед КАС Google Scholar
Calder PC, Geddes R (1985) Протеогликановая природа мышечного гликогена млекопитающих. Гликоконъюгат J 2: 365–373
КАС Google Scholar
Calder PC, Geddes R (1986) Переваривание белка, связанного с гликогенами мышц и печени. Carbohydr Res 148: 173–177
Артикул пабмед КАС Google Scholar
Camici M, DePaoli-Roach AA, Roach PJ (1984)Гликогенсинтаза печени кролика. Очистка и сравнение свойств глюкозо-6-Ф-зависимой и глюкозо-6-Ф-независимой форм фермента. Дж Биол Хим 259: 3429–3434
ПабМед КАС Google Scholar
Caudwell FB, Cohen P (1980) Очистка и субъединичная структура фермента, разветвляющего гликоген, из мышц кролика. Eur J Biochem 109: 391–394
Eur J Biochem 109: 391–394
Статья пабмед КАС Google Scholar
Дарвин К.Р. (1859) О происхождении видов путем естественного отбора, или о сохранении привилегированных рас в борьбе за жизнь. Джон Мюррей, Лондон. Факсимильный репринт первого издания. Издательство Гарвардского университета, Бостон, Массачусетс
Google Scholar
Докинз Р. (1986) Слепой часовщик. Пингвин, Лондон
Google Scholar
Докинз Р. (1994) Глаз в мгновение ока. Nature 368: 690–691
Артикул пабмед КАС Google Scholar
Добжанский Т. (1973) Ничто в биологии не имеет смысла, кроме как в свете эволюции. Амер Биол Учитель 35: 125–129
Google Scholar
Farkas I, Hardy TA, Goeb MG, Roach PJ (1991) Две изоформы гликогенсинтазы у Saccharomyces cerevisiae кодируются разными генами, которые по-разному контролируются. J Biol Chem 266: 15602–15607
J Biol Chem 266: 15602–15607
PubMed КАС Google Scholar
Gilman A, Ross J (1995) Генетический алгоритм выбора регуляторной структуры, которая направляет поток в простой метаболической модели. Биофиз J 69: 1321–1333
Артикул пабмед КАС Google Scholar
Golden S, Wals PA, Katz J (1977) Усовершенствованная методика анализа гликогенсинтазы и фосфорилазы в гомогенатах печени крыс. Anal Biochem 77: 436–445
Статья пабмед КАС Google Scholar
Goldsmith E, Sprang S, Fletterick R (1982) Структура мальтогептаозы с помощью разностных методов Фурье и модель гликогена. Дж. Мол. Биол. 156: 411–427 9.0004
Артикул пабмед КАС Google Scholar
Greenwood CT, Manners DJ (1957) Устойчивость к щелочам и молекулярный размер гликогенов.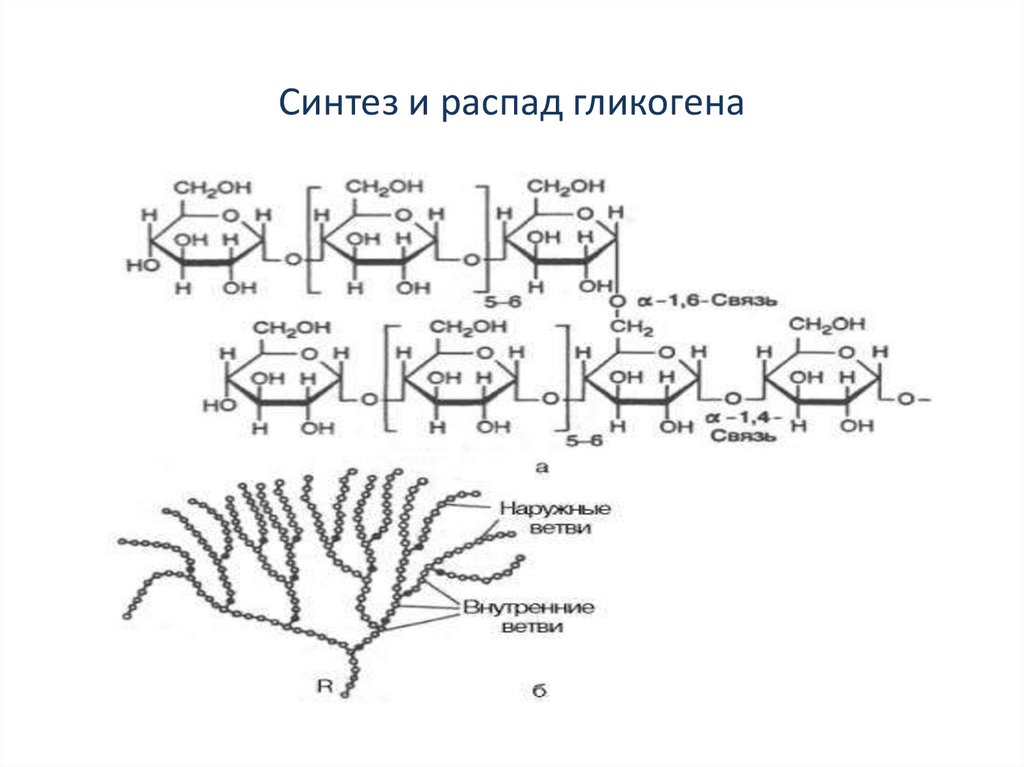 Proc Chem Soc 26–27
Proc Chem Soc 26–27
Gunja-Smith Z, Marshall JJ, Mercier C, Smith EE, Whelan WJ (1970) Пересмотр модели гликогена и амилопектина Мейера-Бернфельда. FEBS Lett 12: 101–104
Статья пабмед Google Scholar
Gunja-Smith Z, Marshall JJ, Smith EE (1971) Ферментативное определение длины единичной цепи гликогена и родственных полисахаридов. FEBS Letter 13: 309–311
Статья КАС Google Scholar
Harrap BS, Manners DJ (1952) Молекулярная масса гликогенов, определенная методами светорассеяния. Природа 170: 419–420
Артикул пабмед КАС Google Scholar
Хассид В.З., Чайков И.Л. (1938) Молекулярная структура гликогена печени собаки. J Biol Chem 123: 755–759
CAS Google Scholar
Haworth WN, Hirst EL, Smith F (1939) Полисахариды. Часть XXXVIII. Состав гликогена из печени рыб и мидий рыб. J Chem Soc 1914–1922
Часть XXXVIII. Состав гликогена из печени рыб и мидий рыб. J Chem Soc 1914–1922
Heinrich R, Holzhutter HG, Schuster S (1987) Теоретический подход к эволюции и структурному дизайну ферментативных сетей: линейные ферментативные цепи, разветвленные пути и гликолиз эритроцитов. Бык Математика Биол 49: 539–595
Артикул пабмед КАС Google Scholar
Генрих Р., Хоффманн Э. (1991) Кинетические параметры ферментативных реакций в состояниях максимальной активности: эволюционный подход. J Theor Biol 151: 249–283
Статья пабмед КАС Google Scholar
Генрих Р., Шустер С., Хольцюттер Х.Г. (1991) Математический анализ ферментных реакционных систем с использованием принципов оптимизации. Евр. Дж. Биохим 201: 1–21
Артикул пабмед КАС Google Scholar
Heinrich R, Montera F, Klipp E, Waddell TG, Meléndez-Hevia E (1997) Теоретические подходы к эволюционной оптимизации гликолиза.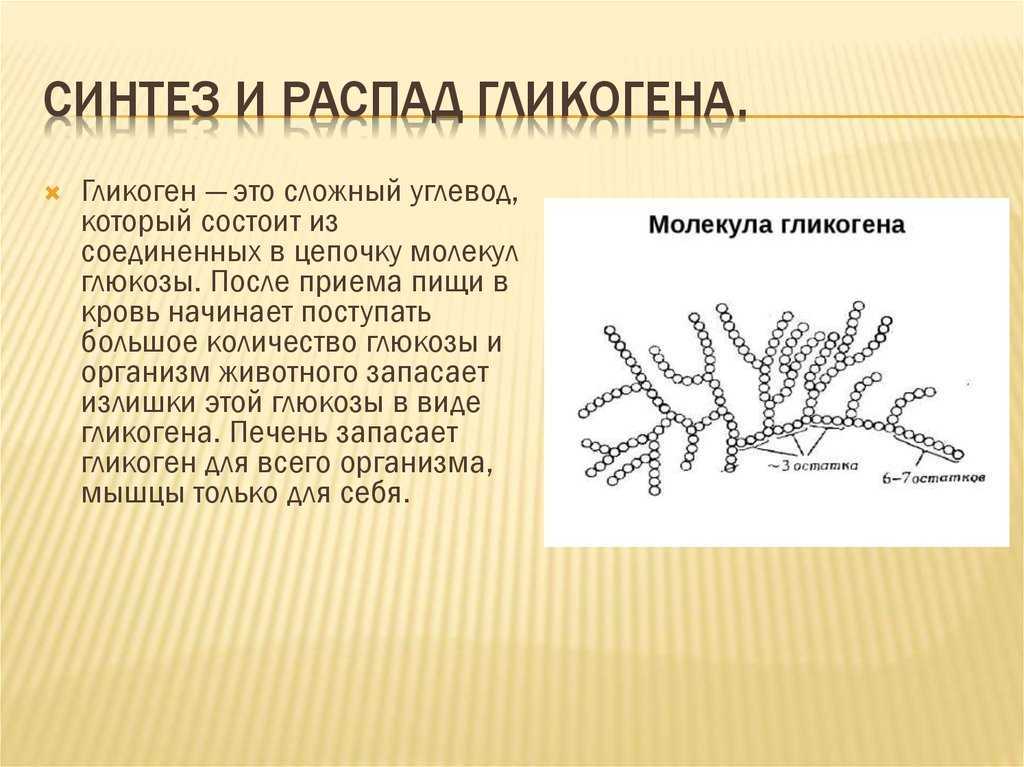 Кинетические и термодинамические ограничения. Eur J Biochem 243: 191–201
Кинетические и термодинамические ограничения. Eur J Biochem 243: 191–201
Статья пабмед КАС Google Scholar
Hue L, Bontemps F, Hers HG (1975) Влияние глюкозы и ионов калия на взаимное превращение двух форм гликогенфосфорилазы и гликогенсинтетазы в изолированных препаратах печени крысы. Биохим Дж. 152: 105–114
ПабМед КАС Google Scholar
Иллингворт Б., Ларнер Дж., Кори Г.Т. (1952) Структура гликогенов и амилопектинов. I, Ферментативное определение длины цепи. J Biol Chem 199: 631–640
PubMed КАС Google Scholar
Kjolberg O, Manners DJ, Wright A (1963) α-1,4-глюкозаны. XVII, Молекулярная структура некоторых гликогенов. Comp Biochem Physiol 8: 353–365
Артикул Google Scholar
Krisman CR (1962) α-1,4-Глюкан: α-1,4-глюкан 6-гликозилтрансфераза из печени.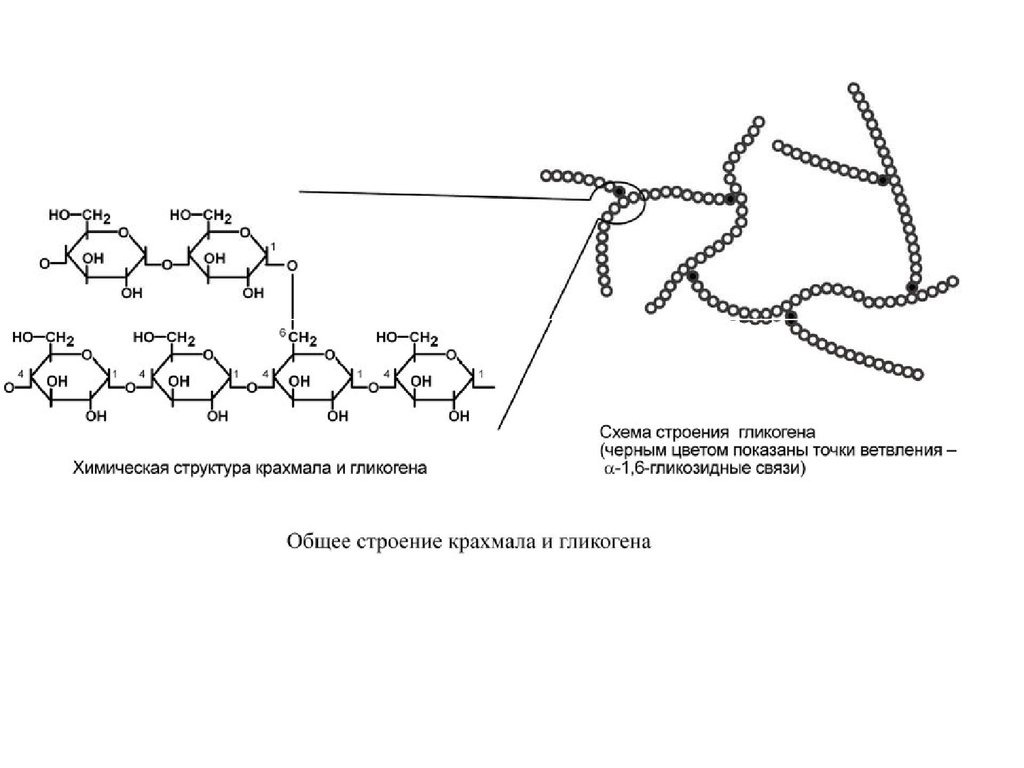 Биохим Биофиз Акта 65: 307–315
Биохим Биофиз Акта 65: 307–315
Артикул пабмед КАС Google Scholar
Larner J (1955) Ветвящийся фермент печени. Методы Enzymol1: 222–225
Артикул КАС Google Scholar
Liddle AM, Manners DJ (1957) α-1,4-глюкозаны. VIII Множественное разветвление в гликогене и амилопектине. J Chem Soc 4708–4711
Ломако Дж., Ломако В.М., Уилан В.Дж. (1991) Прогликоген: низкомолекулярная форма мышечного гликогена. FEBS Lett 279: 223–228
Статья пабмед КАС Google Scholar
Ломако Дж., Ломако В.М., Уилан В.Дж., Домбро Р.С., Нири Дж.Т., Норенберг М.Д. (1993)Синтез гликогена в астроцитах: от гликогенина к прогликогену и к гликогену. FASEB J 7: 1386–1393
ПабМед КАС Google Scholar
Lupiáñez JA, García-Salgero L, Torres NV, Peragon J, Meléndez-Hevia E (1996) Метаболическая поддержка скорости полета птиц.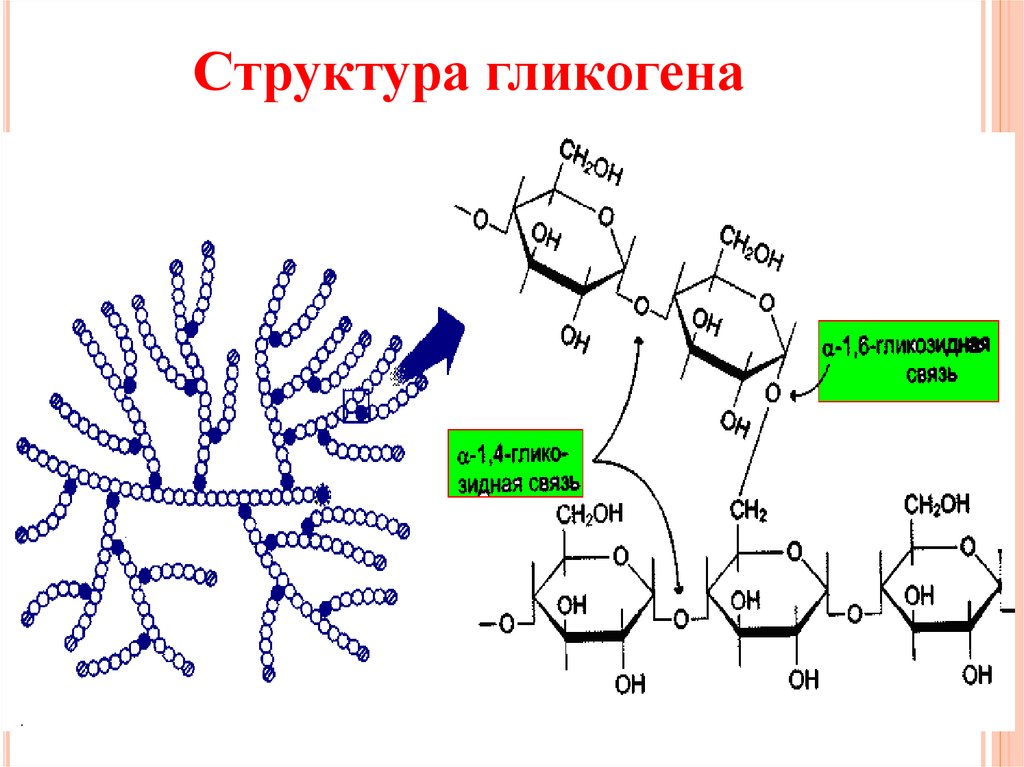 Comp Biochem Physiol 113B: 439–443
Comp Biochem Physiol 113B: 439–443
Google Scholar
Madsen NB, Cori CF (1958) Связывание гликогена и фосфорилазы. J Biol Chem 233: 1251–1254
PubMed КАС Google Scholar
Маннерс DJ (1957) Молекулярная структура гликогенов. Adv Carbohydrate Chem 12: 261–298
CAS Google Scholar
Manners DJ, Maung K (1955)α-1,4-глюкозаны. III, Молекулярная структура гликогенов пивных дрожжей. J Chem Soc 867–870
Manners DJ, Ryley JF (1952) Метаболизм простейших. II, Гликоген инфузории, Tetrahymena pyriformis (Glaucoma piriformis). Биохим J 52: 480–482
ПабМед КАС Google Scholar
Manners DJ, Ryley JF (1955) Метаболизм простейших. VI Гликоген паразитических жгутиконосцев Trichomonas fetus и Trichomonas gallinae .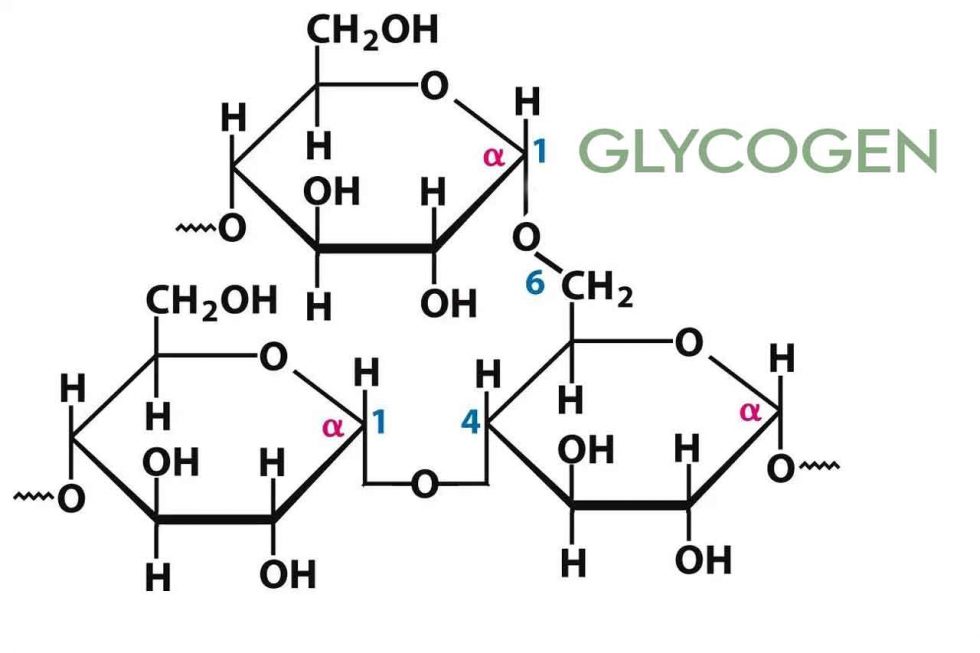 Biochem J 59: 369–372
Biochem J 59: 369–372
PubMed КАС Google Scholar
Manners DJ, Wright A (1962) α-1,4-глюкозаны. XIII. Определение средней длины цепи гликогенов методом α-амилолиза. J Chem Soc 1597–1602
Мелендес-Хевиа Э. (1990) Игра пентозофосфатного цикла: математический подход к изучению оптимизации конструкции метаболических путей в ходе эволюции. Биомед Биохим Акта 49: 903–916
PubMed Google Scholar
Мелендес-Хевиа Э., Исидоро А. (1985) Игра пентозофосфатного цикла. J Theor Biol 117: 251–263
Статья пабмед Google Scholar
Мелендес-Хевиа Э., Торрес Н.В. (1988) Экономика дизайна в метаболических путях: дальнейшие замечания об игре пентозофосфатного цикла. J Theor Biol 132: 97–111
Статья пабмед Google Scholar
Meléndez-Hevia E, Waddell TG, Shelton DE (1993) Оптимизация молекулярного дизайна в эволюции метаболизма: молекула гликогена.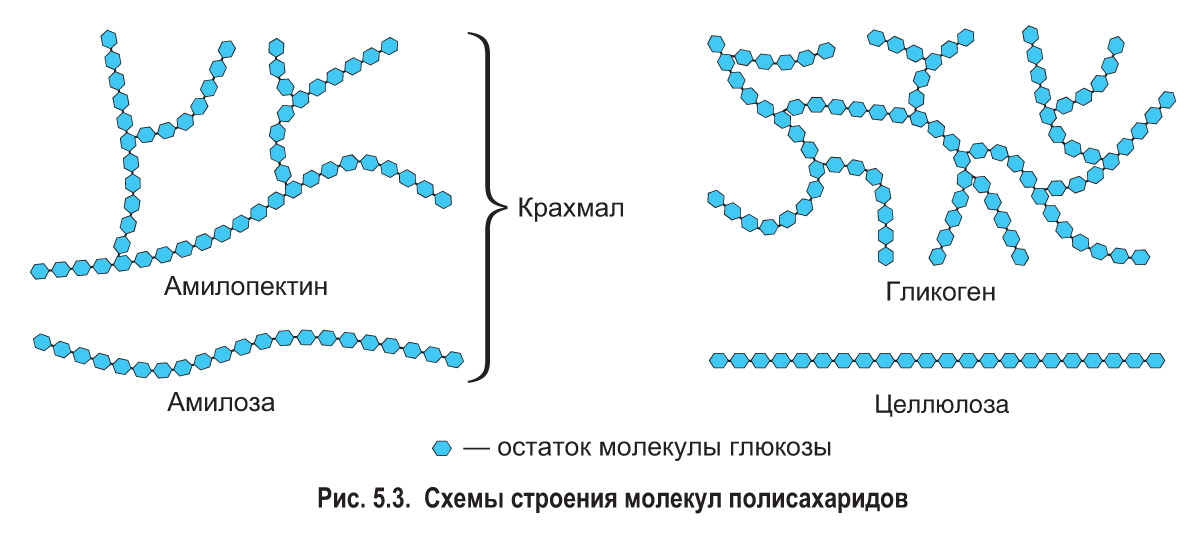 Biochem J 295: 477–483
Biochem J 295: 477–483
PubMed Google Scholar
Meléndez-Hevia E, Waddell TG, Montero F (1994) Оптимизация метаболизма: эволюция метаболических путей к простоте через игру пентозофосфатного цикла. J Theor Biol 166: 201–220
Статья Google Scholar
Meléndez-Hevia E, Waddell TG, Raposo RR, Lupiáñez JA (1995) Эволюция метаболизма: оптимизация структуры гликогена. J Biol Syst 3: 177–186
Статья Google Scholar
Meléndez-Hevia E, Waddell TG, Cascante M (1996) Загадка цикла лимонной кислоты Кребса: сборка частей химически возможных реакций и оппортунизм в разработке метаболических путей в ходе эволюции. J Mol Evol 43: 293–303
Артикул пабмед Google Scholar
Мелендес-Хевиа Э., Уодделл Т.Г., Генрих Р., Монтеро Ф. (1997a) Теоретические подходы к эволюционной оптимизации гликолиза.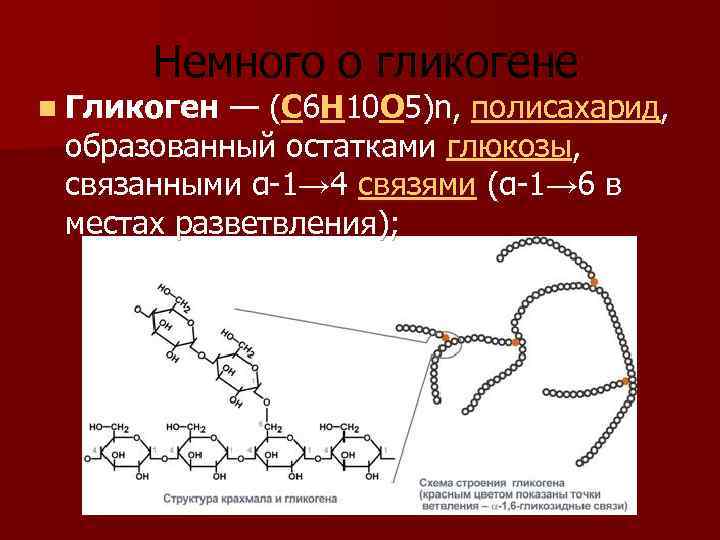 Химический анализ. Евр. Дж. Биохим 244: 527–543
Химический анализ. Евр. Дж. Биохим 244: 527–543
Артикул пабмед Google Scholar
Meléndez-Hevia E, Guinovart JJ, Cascante M (1997b) Роль каналов в метаболизме гликогена. В: Agius L, Sherratt HSA (ред.) Направление в промежуточном метаболизме. Портленд Пресс, Лондон
Google Scholar
Mercier C, Whelan W (1970) Тонкая структура гликогена при болезни накопления гликогена IV типа. Евро J Биохим 16: 579–583
Артикул пабмед КАС Google Scholar
Монтеро Ф., Нуньо Х.С., Андраде М.А., Перес-Иратксета С., Моран Ф., Мелендес-Хевиа Э. (1996) Роль естественного отбора и эволюции в игре пентозофосфатного цикла. В: Гиста Д.Н. (ред.) Биомедицинская физика и физика жизни. Vieweg, Мюнхен, стр. 158–168
Google Scholar
Ньюсхолм Э.А., Лич А.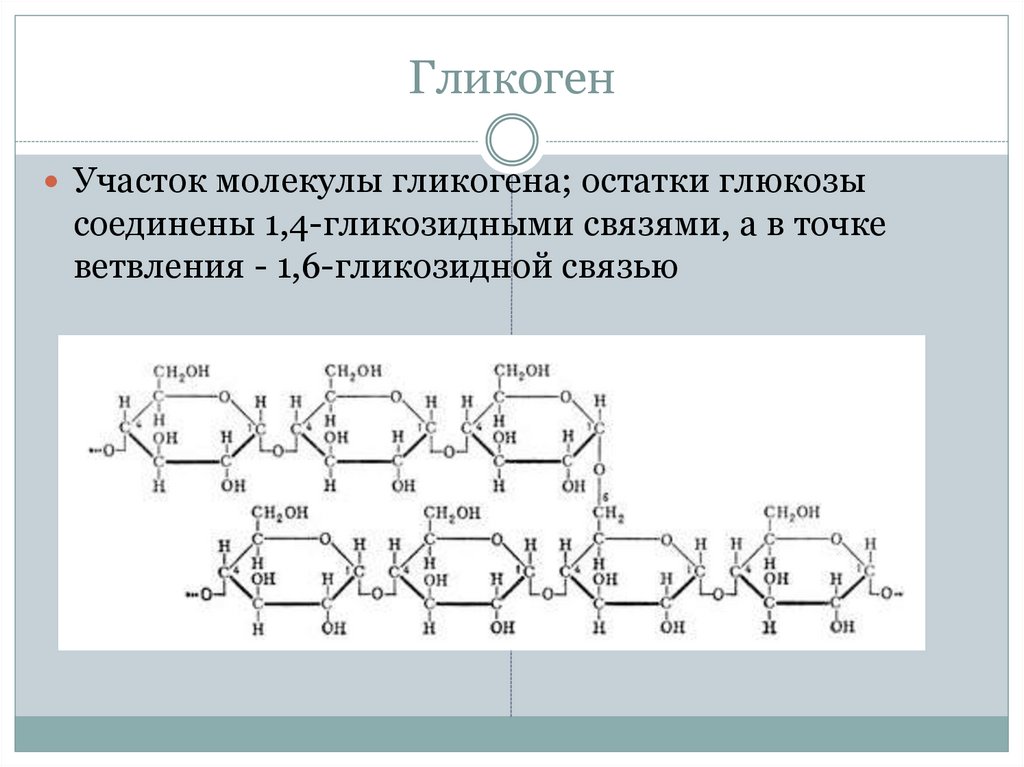 Р. (1983) Биохимия для медицинских наук. Уайли, Чичестер
Р. (1983) Биохимия для медицинских наук. Уайли, Чичестер
Google Scholar
Northcote DH (1953) Молекулярная структура и форма дрожжевого гликогена. Biochem J 53: 348–352
PubMed КАС Google Scholar
Peter JB, Barnard RJ, Edgerton VR, Gillespie CA, Stempel KE (1972) Метаболические профили трех типов волокон скелетных мышц морских свинок и кроликов. Биохимия 11: 2627–2633
Статья пабмед КАС Google Scholar
Ридли М. (1993) Эволюция. Научные публикации Блэквелла, Оксфорд
Google Scholar
Ryman BE, Whelan WJ (1971) Новые аспекты метаболизма гликогена. Adv Enzymol Relat Areas Mol Biol 34: 285–443
Статья пабмед КАС Google Scholar
Скурат А.В., Пэн Х.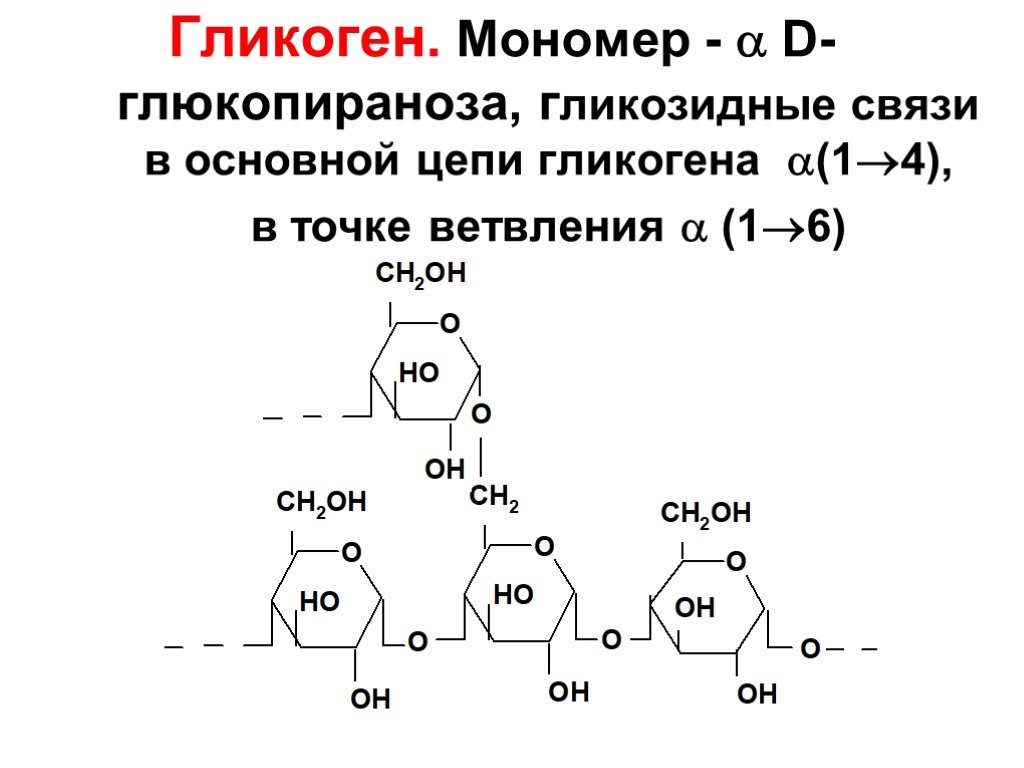 Л., Чанг Х.И., Кэннон Дж.Ф., Роуч П.Дж. (1996) Определение скорости этапов биосинтеза гликогена в клетках COS. Arch Biochem Biophys 328: 283–288
Л., Чанг Х.И., Кэннон Дж.Ф., Роуч П.Дж. (1996) Определение скорости этапов биосинтеза гликогена в клетках COS. Arch Biochem Biophys 328: 283–288
Артикул пабмед КАС Google Scholar
Smith EE (1968) Ферментативный контроль структуры гликогена. В: Whelan WJ (ed) Контроль метаболизма гликогена. Universitetsforlaget, Осло. Academic Press, Нью-Йорк, стр. 203–213
. Google Scholar
Stalmans W, De Wulf H, Hue L, Hers H-G (1974) Последовательная инактивация гликогенфосфорилазы и активация гликогенсинтазы в печени после введения глюкозы мышам и крысам. Механизм печеночного порога к глюкозе. Евр. Дж. Биохим 41: 127–134
Артикул КАС Google Scholar
Страйер Л. (1995) Биохимия. В.Х. Фриман и Ко, Нью-Йорк
Google Scholar
Thayer RE, Rice CL, Pettigrew FP, Noble EG, Taylor AW (1993) Состав волокон скелетных мышц.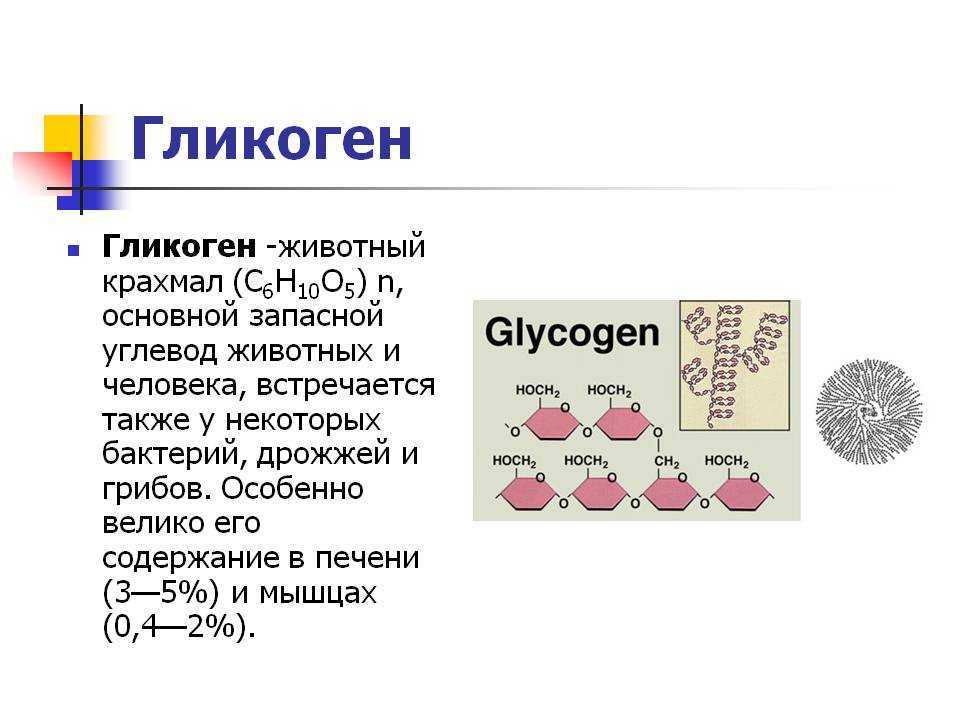 В: Poortmans JR (ed) Принципы биохимии упражнений, 2-е изд. Каргер, Базель, стр. 25–50
В: Poortmans JR (ed) Принципы биохимии упражнений, 2-е изд. Каргер, Базель, стр. 25–50
Google Scholar
Walker GJ, Whelan WJ (1960) Механизм действия карбогидразы. 8. Структуры мышечной фосфорилазы ограничивают декстрины гликогена и амилопектина. Biochem J 76: 264–268
PubMed КАС Google Scholar
Westphal SA, Nuttal FQ (1992) Сравнительная характеристика гликогенсинтазы печени человека и крысы. Arch Biochem Biophys 292: 479–486
Статья пабмед КАС Google Scholar
PDB-101: Молекула месяца: гликогенфосфорилаза
Молекула месяца
| По категориям | По дате | По названию |
Гликогенфосфорилаза высвобождает сахар из своего клеточного хранилища
Два вида гликогенфосфорилазы, с сахарной цепью (желтая) в месте хранения и нуклеотидом (красный) в активном центре.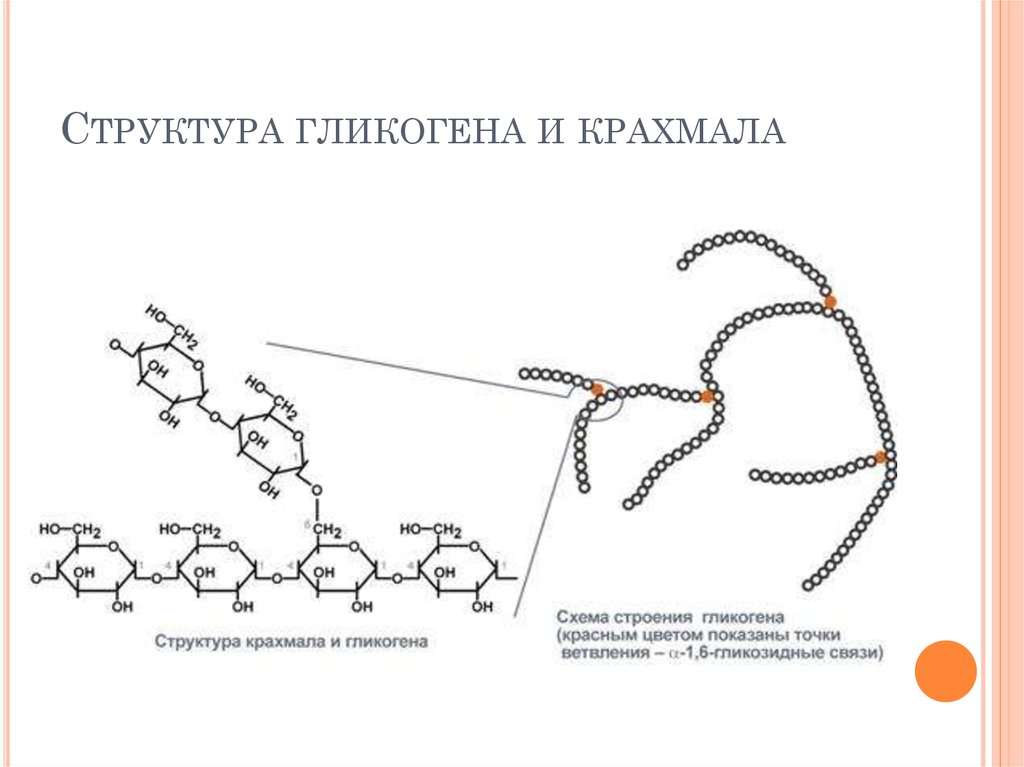
Загрузить изображение в формате TIFF высокого качества
Хотя это может показаться не так во время курортного сезона, нам не нужно постоянно есть в течение дня. Наши клетки нуждаются в постоянном поступлении сахара и других питательных веществ, но, к счастью, в нашем организме есть механизм для хранения сахара во время еды, а затем дозирования его на остаток дня. Сахара хранятся в гликогене, большой молекуле, которая содержит до 10 000 молекул глюкозы, соединенных в плотный клубок разветвленных цепей. Ваши мышцы хранят достаточное количество гликогена для обеспечения вашей повседневной деятельности, а ваша печень хранит достаточно, чтобы питать вашу нервную систему и другие ткани в течение дня и ночи.
Сладкоежка
Сахар высвобождается из гликогена ферментом гликогенфосфорилазой. Он отрывает глюкозу от цепей на поверхности гранулы гликогена. Фермент представляет собой димер из двух идентичных субъединиц (окрашенных здесь в структуре зеленым и синим цветом, из записи PDB 6gpb ). На верхнем рисунке два нуклеотида, выделенные красным, связаны в активном центре, расположенном в глубокой щели. Желтые молекулы представляют собой короткие цепочки сахаров, похожие на концы цепей гликогена, которые связываются с другой щелью, которую фермент использует для захвата гранулы гликогена. В реакции расщепления гликогенфосфорилаза использует молекулу фосфата, соединяя ее с сахаром по мере его высвобождения. Затем второй фермент, фосфоглюкомутаза, сдвигает положение фосфата к соседнему атому углерода в сахаре, делая сахар готовым к расщеплению путем гликолиза.
На верхнем рисунке два нуклеотида, выделенные красным, связаны в активном центре, расположенном в глубокой щели. Желтые молекулы представляют собой короткие цепочки сахаров, похожие на концы цепей гликогена, которые связываются с другой щелью, которую фермент использует для захвата гранулы гликогена. В реакции расщепления гликогенфосфорилаза использует молекулу фосфата, соединяя ее с сахаром по мере его высвобождения. Затем второй фермент, фосфоглюкомутаза, сдвигает положение фосфата к соседнему атому углерода в сахаре, делая сахар готовым к расщеплению путем гликолиза.
Модерация
Как вы понимаете, этот процесс строго регламентирован. Перемещение сахара в хранилище гликогена и из него используется для контроля уровня глюкозы в крови, поэтому гликогенфосфорилаза должна активироваться, когда необходим сахар, и быстро отключаться, когда сахара много. Он контролируется несколькими способами. Во-первых, фермент активируется путем добавления молекулы фосфата к сериновой аминокислоте (серин 14) на обратной стороне фермента, показанной ярко-зеленым и синим цветом на нижнем рисунке. Фосфат вызывает большой сдвиг в форме фермента (как показано в следующем разделе), переводя его в активную конформацию. Два специальных фермента контролируют добавление и удаление этого фосфата в зависимости от уровней гормонов инсулина и глюкагона, контролирующих уровень сахара, и других гормонов, таких как эпинефрин (адреналин).
Фосфат вызывает большой сдвиг в форме фермента (как показано в следующем разделе), переводя его в активную конформацию. Два специальных фермента контролируют добавление и удаление этого фосфата в зависимости от уровней гормонов инсулина и глюкагона, контролирующих уровень сахара, и других гормонов, таких как эпинефрин (адреналин).
Кроме того, связывание других молекул может изменить активность молекулы. Например, АМФ (аденинмонофосфат) связывается с другим участком на обратной стороне молекулы (показан красным на нижнем рисунке), вызывая такой же сдвиг в активную конформацию. Это полезно, потому что АМФ является продуктом распада АТФ и будет более обильным, когда уровень энергии низкий и требуется больше сахара.
Аллостерическое движение гликогенфосфорилазы: неактивное состояние T (слева) и активное состояние R (справа).
Скачать изображение в формате TIFF в высоком качестве
Изменение формы
Гликогенфосфорилаза активируется изменением формы. Структура слева (запись PDB 8gpb ) находится в неактивном состоянии T, а структура справа (запись PDB 1gpa ) находится в активном состоянии R. По сравнению с изображениями в предыдущем разделе, мы смотрим сбоку, а активные сайты находятся слева. (T означает напряжение, а R — расслабление; это обозначение появилось при изучении первых аллостерических ферментов, хотя структуры, подобные этим, показали, что идея напряжения на самом деле неприменима на молекулярном уровне). Сдвиг между двумя формами контролируется фосфорилированием серина 14 или связыванием AMP с регуляторным участком. Показанная здесь структура R-состояния имеет фосфаты, присоединенные к серинам (окрашены розовым цветом), и сульфатную группу в месте, которое связывается с AMP (окрашено желтым цветом).
Структура слева (запись PDB 8gpb ) находится в неактивном состоянии T, а структура справа (запись PDB 1gpa ) находится в активном состоянии R. По сравнению с изображениями в предыдущем разделе, мы смотрим сбоку, а активные сайты находятся слева. (T означает напряжение, а R — расслабление; это обозначение появилось при изучении первых аллостерических ферментов, хотя структуры, подобные этим, показали, что идея напряжения на самом деле неприменима на молекулярном уровне). Сдвиг между двумя формами контролируется фосфорилированием серина 14 или связыванием AMP с регуляторным участком. Показанная здесь структура R-состояния имеет фосфаты, присоединенные к серинам (окрашены розовым цветом), и сульфатную группу в месте, которое связывается с AMP (окрашено желтым цветом).
Изучение структуры
Гликоген используется во многих организмах, от человека до дрожжей. Большая часть научной работы по ферменту была проделана с кроличьей гликогенфосфорилазой, которая была показана на предыдущих двух страницах. Вы можете посмотреть на немного отличающийся от дрожжей фермент в записи PDB 1ygp . Этот файл содержит две белковые цепи (обозначенные здесь синим и зеленым цветом) и несколько небольших молекул. Молекула, помеченная PLP, представляет собой кофактор пиридоксальфосфат, реактивную молекулу, которая прочно связывается в активном центре и используется для содействия реакции. Фосфат связан в каждой субъединице рядом с ключевой аминокислотой треонином, которая используется для регуляции, контролируя аллостерические изменения подобно серину 14 в кроличьей форме. Глядя на этот фермент, обратите внимание, как две белковые цепи обвивают друг друга. Это позволяет субъединицам работать вместе, реагируя на небольшие изменения формы, которые используются для управления.
Вы можете посмотреть на немного отличающийся от дрожжей фермент в записи PDB 1ygp . Этот файл содержит две белковые цепи (обозначенные здесь синим и зеленым цветом) и несколько небольших молекул. Молекула, помеченная PLP, представляет собой кофактор пиридоксальфосфат, реактивную молекулу, которая прочно связывается в активном центре и используется для содействия реакции. Фосфат связан в каждой субъединице рядом с ключевой аминокислотой треонином, которая используется для регуляции, контролируя аллостерические изменения подобно серину 14 в кроличьей форме. Глядя на этот фермент, обратите внимание, как две белковые цепи обвивают друг друга. Это позволяет субъединицам работать вместе, реагируя на небольшие изменения формы, которые используются для управления.
Эта иллюстрация была создана с помощью RasMol. Вы можете создавать похожие изображения, нажав на код доступа выше и выбрав один из вариантов просмотра в 3D.
Ссылки
- Луиза Н. Джонсон и Дэвид Барфорд (1990): Гликогенфосфорилаза.