Блог
Блог Читать подробнееАЭРОЙОГА в гамаках. Новое направление групповых программ в D’Athletics пр. Науки 71
Лучшая новость марта!!!В D’ATHLETICS пр. Науки 71 стартует новое направление, такое долгожданное нашими клиентами,
аэройога в гамаках.
admin
66 просмотров
Читать подробнееНовая секция Бразильское джиу-джитсу для детей от 5 лет и взрослых в D’ATHLETICS ул. Политехническая 17/2
ВНИМАНИЕ!
Новая секция Бразильское джиу-джитсу для детей от 5 лет и взрослых в D’ATHLETICS ул. Политехническая 17/2 под руководством Дарьи Набокиной!
Дарья победительница и призер многочисленных престижных соревнований
Дарья Набокина
101 просмотров
Читать подробнееadmin
342 просмотров
Читать подробнееОдин из крупнейших клубов по тхэквондо итф Shamanin club открывает новый филиал в фитнес-клубе D’ATHLETICS на ул. Политехнической 17/2
Политехнической 17/2
Тренировки будет проводить Чемпионка России и Чемпионка Кубка Мира Попова Мария Станиславовна (I дан).
Руководитель клуба — Шаманин Антон Валерьевич (V дан, международный инструктор) , многократный Чемпионом Мира, Европы и России.
admin
463 просмотров
Читать подробнееМастер-класс от Боевой школы «Будущие лидеры» 30.09. в D’ATHLETICS ул. Политехническая 17/2
30.09.2022 г.
«БОЕВАЯ ШКОЛА И БУДУЩИЕ ЛИДЕРЫ» приглашает на мастер-класс родителей с детьми от 5 до 15 летНа мастер-классе будет:
— спарринги на мечах
— дети увидят несколько видов мечей: катана,щит, лук и другие
Мы искренне хотим, чтобы эти ребята сделали больше чем мы, шагнули дальше
чем мы, стали успешнее чем мы, и — счастливее.
Приходите и берите друзей!
Билет 300₽, если пришёл с другом, то бесплатно!
Расписание:
30. 09.2022
09.2022
17:00-18:00 5-7 лет
18:00-19:00 8+
admin
258 просмотров
Читать подробнееКлассический бокс в D’Athletics!
Отличные новости, друзья! Знаем, вы ждали!В D’Athletics Fitness на пр. Науки, 71 открыта секция классического БОКСА!
Занятия проводит КМС по боксу, призёр турниров класса А и В Хохлов Виктор Александрович.
Тренировки проходят по вторникам и четвергам с 16:00 до 17:30 и по субботам с 12:00 до 13:30.
Все подробности можно узнать по телефону: 467-49-17.
admin
227 просмотров
Поиск по блогу
Рубрики Блога
- Рекомендации от экспертов
- Мероприятия и новости
Выбор Редакции
dathletics беговая дорожка беременность бодибилдинг восстановление групповые тренировки девушкам дети детский фитнес йога крепатура ошибки пилатес питание похудение развитие рекомендации руки советы соревнования СПб спина спорт спортзал спортивное питание танцы тренажер тренировки тренировки дома упражнения фитнес
Сеть фитнес клубов в Санкт-Петербурге
8 (812) 748-27-57
Остались вопросы?
Укажите ваш номер телефона, менеджер перезвонит и с радостью ответит на все вопросы о тренировках у нас.
Подтверждаю согласие с правилами обработки персональных данных.
Разработка и продвижение – Samodelov.com
Заказть
обратный звонок
Блог
Блог Читать подробнееАЭРОЙОГА в гамаках. Новое направление групповых программ в D’Athletics пр. Науки 71
В D’ATHLETICS пр. Науки 71 стартует новое направление, такое долгожданное нашими клиентами,
аэройога в гамаках.
admin
66 просмотров
Читать подробнееНовая секция Бразильское джиу-джитсу для детей от 5 лет и взрослых в D’ATHLETICS ул. Политехническая 17/2
ВНИМАНИЕ!
Новая секция Бразильское джиу-джитсу для детей от 5 лет и взрослых в D’ATHLETICS ул. Политехническая 17/2 под руководством Дарьи Набокиной!
Дарья победительница и призер многочисленных престижных соревнований
Дарья Набокина
101 просмотров
Читать подробнееD’ATHLETICS fitness принимает Кубок Балтики WPC/AWPC/WAA!
admin
342 просмотров
Читать подробнееОдин из крупнейших клубов по тхэквондо итф Shamanin club открывает новый филиал в фитнес-клубе D’ATHLETICS на ул. Политехнической 17/2
Политехнической 17/2
Тренировки будет проводить Чемпионка России и Чемпионка Кубка Мира Попова Мария Станиславовна (I дан).
Руководитель клуба — Шаманин Антон Валерьевич (V дан, международный инструктор) , многократный Чемпионом Мира, Европы и России.
admin
463 просмотров
Читать подробнееМастер-класс от Боевой школы «Будущие лидеры» 30.09. в D’ATHLETICS ул. Политехническая 17/2
30.09.2022 г.
«БОЕВАЯ ШКОЛА И БУДУЩИЕ ЛИДЕРЫ» приглашает на мастер-класс родителей с детьми от 5 до 15 летНа мастер-классе будет:
— спарринги на мечах
— навыки самообороны
Мы искренне хотим, чтобы эти ребята сделали больше чем мы, шагнули дальше
чем мы, стали успешнее чем мы, и — счастливее.
Приходите и берите друзей!
Билет 300₽, если пришёл с другом, то бесплатно!
Расписание:
30. 09.2022
09.2022
17:00-18:00 5-7 лет
18:00-19:00 8+
admin
258 просмотров
Читать подробнееКлассический бокс в D’Athletics!
Отличные новости, друзья! Знаем, вы ждали!В D’Athletics Fitness на пр. Науки, 71 открыта секция классического БОКСА!
Занятия проводит КМС по боксу, призёр турниров класса А и В Хохлов Виктор Александрович.
Тренировки проходят по вторникам и четвергам с 16:00 до 17:30 и по субботам с 12:00 до 13:30.
Все подробности можно узнать по телефону: 467-49-17.
admin
227 просмотров
Поиск по блогу
Рубрики Блога
- Рекомендации от экспертов
- Мероприятия и новости
Выбор Редакции
dathletics беговая дорожка беременность бодибилдинг восстановление групповые тренировки девушкам дети детский фитнес йога крепатура ошибки пилатес питание похудение развитие рекомендации руки советы соревнования СПб спина спорт спортзал спортивное питание танцы тренажер тренировки тренировки дома упражнения фитнес
Сеть фитнес клубов в Санкт-Петербурге
8 (812) 748-27-57
Остались вопросы?
Укажите ваш номер телефона, менеджер перезвонит и с радостью ответит на все вопросы о тренировках у нас.
Подтверждаю согласие с правилами обработки персональных данных.
Разработка и продвижение – Samodelov.com
Заказть
обратный звонок
Белок Методы и методы конъюгации белков
Методы конъюгации зависят от двух взаимосвязанных химических процессов: функциональных групп, присутствующих на макромолекулах-мишенях, которые необходимо модифицировать, и функциональных групп сшивающих агентов, используемых для их связывания. Без наличия и химической совместимости обоих типов функциональных групп процесс дериватизации был бы невозможен. В этой статье мы обсуждаем различные методы конъюгации белков с использованием различных функциональных групп.
Белково-белковая конъюгация относится к методам, которые используются для ковалентного связывания двух белков друг с другом. Как правило, сшивающие агенты связываются с функциональными группами каждого белка, образуя ковалентные связи. Белок-белковые конъюгаты можно использовать для различных применений, включая вестерн-блоты, ИФА и иммунотоксины для доставки лекарств.
Как правило, белок-белковая конъюгация осуществляется с использованием сшивающих агентов.
Сшивание — это процесс химического соединения двух или более молекул ковалентной связью. Сшивающие реагенты (или сшивающие агенты) представляют собой молекулы, которые содержат два или более реакционноспособных конца, способных химически присоединяться к определенным функциональным группам (первичным аминам, сульфгидрилам и т. д.) на белках или других молекулах. Эти сшивающие агенты могут быть гомобифункциональными или гетеробифункциональными по своей природе. Мы обсуждали гетеро- и гомобифункциональные линкеры в нашей статье о химии белковых конъюгаций.
Конъюгаты часто получают путем присоединения фермента, флуорофора или другой молекулы к белку, имеющему сродство к какой-либо другой биологической молекуле. Например, ферменты, такие как щелочная фосфатаза и пероксидаза, связанные с первичными и вторичными антителами, относятся к наиболее широко используемым белково-белковым конъюгациям.
Существует множество методов конъюгации белка с белком. Схематическая диаграмма конъюгации простого белка с белком приведена ниже.
Гетеробифункциональные сшивающие агенты, возможно, являются лучшим выбором для межбелкового сшивания. Использование правильного гетеробифункционального линкера приводит к лучшему выходу и меньшему количеству фоновых реакций. Здесь для получения конъюгата белок-антитело используется один сшивающий агент с малеимидной и NHS-группами. Изображение с сайта NativeAntigen.Статьи по теме:
- Как биоконъюгировать белки с пегилированными наночастицами? Узнайте больше в нашей статье
Применение белково-белковых конъюгатов
Применение белково-белковых конъюгатов включает изучение белковых взаимодействий, создание многофункциональных ферментов путем связывания двух или более белков вместе или создание конъюгатов для доставки лекарств, таких как иммунотоксины.
Методы, обсуждаемые в этой статье, также могут быть использованы для химии белков с малыми молекулами или белков с флуорофорами. Например, вы можете использовать реагенты, реагирующие с аминами, карбоксилами или сульфгидрилами, для идентификации и количественного определения определенных аминокислот или для определения количества, местоположения и размера субъединиц. Вы также можете поэкспериментировать с разными длинами идентичных в остальном перекрестных линкеров, чтобы выявить молекулярное расстояние между конкретными функциональными группами во вторичной, третичной или четвертичной структуре белка.
Например, вы можете использовать реагенты, реагирующие с аминами, карбоксилами или сульфгидрилами, для идентификации и количественного определения определенных аминокислот или для определения количества, местоположения и размера субъединиц. Вы также можете поэкспериментировать с разными длинами идентичных в остальном перекрестных линкеров, чтобы выявить молекулярное расстояние между конкретными функциональными группами во вторичной, третичной или четвертичной структуре белка.
Большинство белков и антител содержат легкодоступные амины и карбоксилы. Вы можете маркировать белки и антитела с помощью этих наборов для конъюгации, чтобы сэкономить время и повысить согласованность между экспериментами.
ELISA (иммуноферментный анализ) ELISA — это метод анализа на планшетах, предназначенный для обнаружения и количественного определения растворимых веществ, таких как пептиды, белки, антитела и гормоны. Другие названия, такие как иммуноферментный анализ (ИФА), также используются для описания той же технологии.
В ELISA антиген (макромолекула-мишень) иммобилизуется на твердой поверхности (микропланшет) и затем образует комплекс с антителом, связанным с репортерным ферментом. Обнаружение осуществляется путем измерения активности репортерного фермента посредством инкубации с соответствующим субстратом для получения измеряемого продукта.
Наиболее важным элементом ELISA является высокоспецифичное взаимодействие антитело-антиген. Ранее мы подробно обсуждали протоколы и методы ELISA.
В ELISA вторичное антитело конъюгируется с ферментом (показан зеленым), который затем можно обнаружить, поскольку он создает измеряемый продукт. Изображение от Абнова. Вестерн-блоттинг Вестерн-блоттинг — важный метод, используемый в клеточной и молекулярной биологии. Используя вестерн-блоттинг, исследователи могут идентифицировать определенные белки из сложной смеси белков, извлеченных из клеток. Вестерн-блоттинг часто используется в исследованиях для разделения и идентификации белков.
В этом методе смесь белков разделяют по молекулярной массе с помощью гель-электрофореза. Эти результаты затем переносятся на мембрану, производя полосу для каждого белка. Затем мембрану инкубируют с первичным антителом, специфичным к интересующему белку. Несвязанное антитело смывают, оставляя только связанное антитело с интересующим белком. Связанные антитела затем выявляют путем связывания вторичного антитела, имеющего репортерный фермент (аналогично ИФА), и репортер выявляют на пленке. Вот наше подробное руководство по методам и протоколам вестерн-блоттинга.
Как мы обсуждали выше, вторичное антитело, используемое в Вестерн-блоттинге, требует, чтобы репортерный фермент был конъюгирован с антителом. Эта белок-белковая конъюгация обычно выполняется производителем антител, но вы также можете сделать это самостоятельно!
В вестерн-блоттинге вторичное антитело (выделено синим цветом) конъюгировано с ферментами ALP или HRP или непосредственно с флуорофором. Изображение из BioLegend.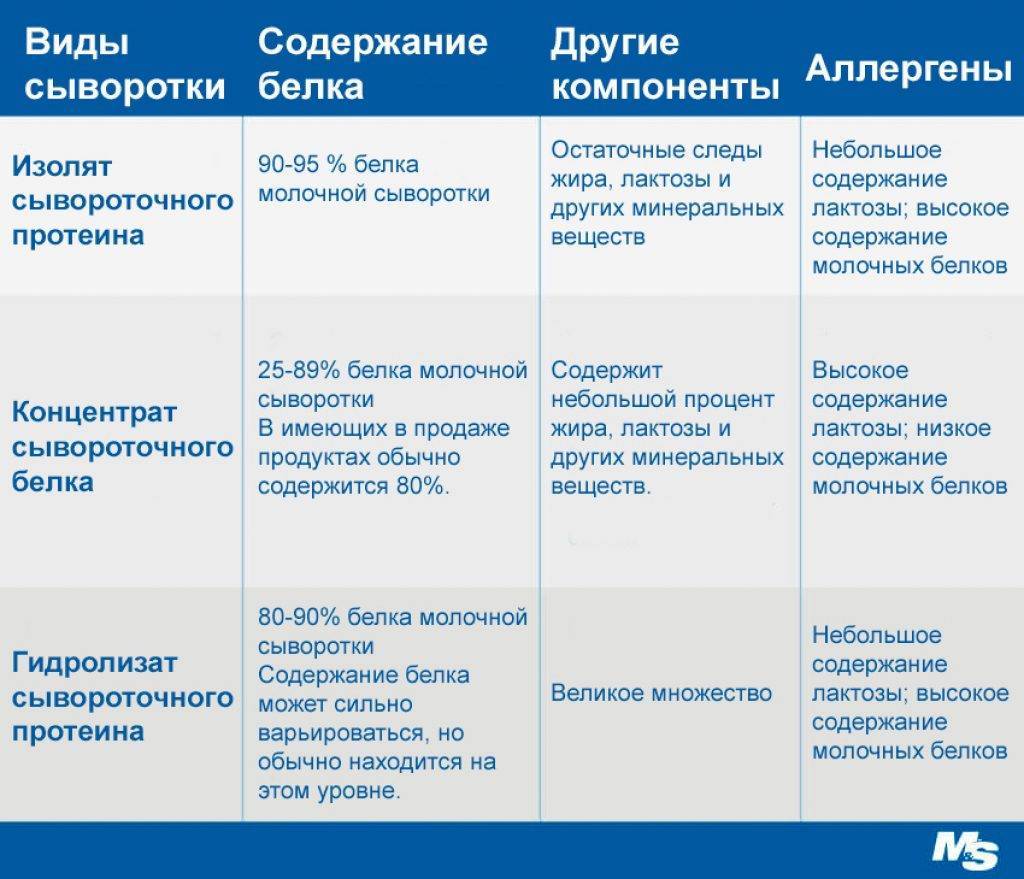 Иммунотоксины для доставки лекарств
Иммунотоксины для доставки лекарств Специфические антитела могут быть ковалентно связаны с токсическими молекулами или белками, а затем использоваться для нацеливания на антигены на клетках – они называются иммунотоксины . Часто антитела, используемые для иммунотоксинов, специфичны для опухолеассоциированных антигенов.
Иммунотоксины попадают в клетку с поверхностными антигенами и после интернализации начинают убивать клетку путем инактивации рибосом или другими способами.
Тип сшивающего агента, используемого для производства иммунотоксина, может повлиять на его способность находить и уничтожать соответствующие клетки. Чтобы иммунотоксины были эффективными, конъюгат должен быть стабильным in vivo. Кроме того, как только иммунотоксин достигает своей цели, антитело должно отделяться от токсина, чтобы токсин мог убить клетку. Было показано, что расщепляемые тиолами конъюгаты белков, содержащих дисульфиды, более цитотоксичны для опухолевых клеток, чем нерасщепляемые конъюгаты.
Типы химических манипуляций с белками для химии белок-белковых конъюгаций
Со временем белки стали наиболее ценными биомолекулами среди огромного разнообразия клеточных компонентов. Поскольку белки имеют высокую коммерческую ценность из-за их использования в медицине, химики разрабатывают множество новых методов модификации белков. Повышенная биодоступность, флуоресцентное отслеживание, вставки посттрансляционной модификации (PTM) и адресная доставка — это лишь некоторые из многочисленных возможных применений белок-белковых конъюгатов.
Химические дескрипторы белков для белок-белковой конъюгации включают N-конец, С-конец, аминокислоты лизина и аминокислоты цистеина. Для связывания каждой из этих функциональных групп можно использовать различные сшивающие реагенты.
Способность сохранять функцию белка в первую очередь зависит от места и размера модификации белка. Для успешной конъюгации белок-белок используются различные химические манипуляторы, некоторые из которых обсуждаются ниже.
Для успешной конъюгации белок-белок используются различные химические манипуляторы, некоторые из которых обсуждаются ниже.
Примечание. Возможно, вам также будет интересно узнать о методах биоконъюгации метионина!
N-концевая белковая конъюгацияN-конец — это первая часть белка, которая выходит из рибосомы во время биосинтеза белка. N-концевые α-амины могут быть как нейтральными, так и положительно заряженными в зависимости от рН раствора и химических модификаций. Мы обсудим, как реагировать с аминами на белки позже в этой статье.
N-концевые α-амины являются отличными химическими посредниками для реакций конъюгации белков, поскольку они легкодоступны и реакционноспособны.
Наиболее заметной терминальной модификацией белка является N α-ацетилирование, катализируемое N-ацетилтрансферазами, которые также обладают способностью формилировать и пропионилировать N-концы белка.
Пироглутамат, обычно наблюдаемый в антителах и делающий их более устойчивыми к аминопептидазам, образуется путем циклизации N-концевого глутамина или глутамата либо спонтанно, либо ферментативно глутаминилциклазами. Пальмитоилирование и миристоилирование могут происходить по свободным N-концевым глицинам, а N-концевые цистеины могут быть пальмитоилированы (S-пальмитоилирование) по их боковой цепи.
Пальмитоилирование и миристоилирование могут происходить по свободным N-концевым глицинам, а N-концевые цистеины могут быть пальмитоилированы (S-пальмитоилирование) по их боковой цепи.
Наконец, N-концевые модификации моно-, ди- и триметилирования важны для белок-белковых взаимодействий.
Пытаетесь соединить молекулы? Здесь вы можете ознакомиться с наборами для конъюгации, которые помогут вам быстро и многократно соединить биомолекулы.
Распространенные модификации N-конца белков. Изображение из позиционной протеомики. Химическая модификация С-конца белковC-конец (также известный как Карбоксил-конце , Карбокси-конце , C-концевой хвост , C-концевой конец , или COOH-конце. свободная карбоксильная группа (-СООН).
С-конец содержит доступную карбоксильную группу, которую можно использовать для реакций конъюгации белок-белок.
С-конец белка может быть модифицирован на допереходном уровне на основе экспрессированных генов.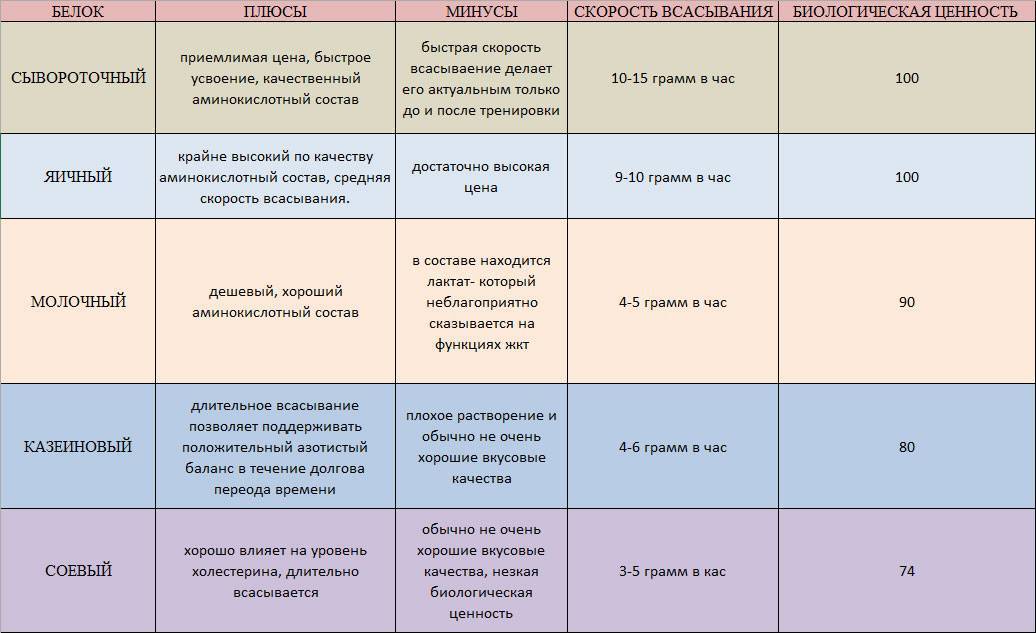 С-конец также подвержен посттрансляционной модификации посредством фосфорилирования, гликозилирования, ацетилирования и т. д.
С-конец также подвержен посттрансляционной модификации посредством фосфорилирования, гликозилирования, ацетилирования и т. д.
С-концевое α-амидирование нейтрализует отрицательный заряд карбоксильной группы на С-конце, улучшая стабильность и способность связывания рецепторов пептидов и пептидных гормонов.
Изображение с белковых концов и их модификаций, выявленных с помощью позиционной протеомикиБолее низкая реакционная способность С-конца по сравнению с N-концом является причиной того, что модификации С-конца встречаются реже. Низкая реакционная способность может быть одной из распространенных проблем с методами биоконъюгации белков.
В общем, вам следует пытаться модифицировать белки на N- или C-конце, потому что они более доступны, реактивны и не требуют какой-либо генной инженерии для включения в белок. Вот более подробная статья, которую мы написали о протоколах биоконъюгации С-конца.
Белково-белковая конъюгация с использованием остатков лизина Аминокислоты лизина на белках широко используются в химии конъюгации, поскольку они содержат реакционноспособные первичные амины.
Могут реагировать с активированными эфирами, сульфонилхлоридами, изотиоцианатами, 2-амино-2-метоксиэтиловой и скваровой кислотами, а также подвергаться восстановительному алкилированию с использованием альдегидов в присутствии борциангидрида натрия.
Лизины содержат первичные амины, которые можно легко модифицировать различными способами. Изображение из диссертации в Университете Сетон ХоллКак правило, лизины в изобилии присутствуют на поверхности белков. Это делает сайт-селективную модификацию, направленную на конкретный Lys, более сложной с помощью обычных методов модификации.
С другой стороны, если в вашем белке много остатков лизина, их модификация также может привести к гетерогенности продукта, поскольку будут модифицированы только некоторые из них.
Таким образом, реакции, нацеленные на остатки Lys, как часть методов белково-белковой конъюгации дают смесь гетерогенно модифицированных продуктов.
Статьи по теме:
- Вы также можете использовать лизины для конъюгации белков с поверхностями! Узнайте больше о методах поверхностной биоконъюгации.

- В качестве более селективного метода реакции с аминами следует использовать опосредованную трансглютаминазой биоконъюгацию. Мы предоставили протоколы и подробности в нашей статье.
Вы можете использовать высокую нуклеофильность тиоловых групп аминокислот цистеина для химической модификации белков.
Большинство остатков цистеина в белках окисляются в составе дисульфидных связей и придают белку структурную стабильность.
Обычно химики используют малеимиды для реакции с тиолами на цистеинах, потому что реакция эффективна и селективна. Однако также разрабатываются некоторые более новые реагенты с тиол-специфической реакционной способностью, как показано на рисунке ниже. Эти реакции приводят к необратимым, стабильным конъюгатам и столь же эффективны, как реакции с малеимидом. Мы подробно рассмотрели методы и протоколы биоконъюгации цистеина в другой статье.
Для добавления Михаэля аминокислота цистеин также может быть преобразована в дегидроаланин (Dha), чтобы ввести электрофильную ручку.
Вы не можете легко модифицировать белки, используя их цистеиновые остатки, если цистеины участвуют в каталитической функции белка или если они участвуют в укладке белка или структурной стабильности.
Статьи по теме:
- Используя методы ортогональной биоконъюгации, вы можете реагировать с несколькими дескрипторами белков
Методы белково-белковой конъюгации
Белково-белковая конъюгация осуществляется с помощью перекрестных линкеров, которые могут быть как гомобифункциональными, так и гетеробифункциональными.
Например, если два белка содержат сульфгидрилы, для их связывания можно использовать гомобифункциональные сульфгидрильные сшивающие агенты. Также можно использовать другие гомобифункциональные сшивающие агенты, такие как NHS-эфиры или имидоэфиры.
Также можно использовать другие гомобифункциональные сшивающие агенты, такие как NHS-эфиры или имидоэфиры.
Гомобифункциональные сшивающие агенты потенциально могут самоконъюгировать и полимеризоваться. Также возможно, что чрезмерное самосопряжение может привести к образованию нерастворимых комплексов, состоящих из полимеров с очень высокой молекулярной массой.
Гетеробифункциональные сшивающие агенты, с другой стороны, не представляют риска самоконъюгации и являются отличным выбором для конъюгаций антитело-фермент и других белок-белковых конъюгаций.
Существует множество методов, которые используются для образования конъюгатов белок-белок.
Конъюгация, опосредованная глутаральдегидом
Глутаровый альдегид был одним из первых сшивающих агентов и до сих пор остается одним из наиболее часто используемых сшивающих агентов для создания конъюгатов антитело-фермент.
Типичный механизм использования глутарового альдегида для конъюгации антитело-фермент включает образование основания Шиффа с возможной перегруппировкой в стабильный продукт или реакцию присоединения по типу Михаэля.
В водных растворах при щелочном pH глутаровый альдегид может образовывать большую полимерную структуру в результате реакций альдольной конденсации с самим собой, содержащим α,β-ненасыщенные альдегиды. Другим недостатком реагента является склонность к образованию высокомолекулярных конъюгатов из-за неконтролируемой полимеризации в процессе сшивки. Полученные конъюгаты часто содержат значительное количество нерастворимого полимера, что вызывает потери выхода и активности при получении конъюгата антитело-фермент.
Глутаровый альдегид можно использовать для белково-белковых конъюгаций, но это может привести к образованию больших нерастворимых комплексов. Изображение из 3-го издания Bioconjugate Techniques Грега Т. ХермансонаКонъюгация, опосредованная редуктивным аминированием
Для использования редуктивного аминирования белковой конъюгации или конъюгации белка антитела необходим по крайней мере один гликопротеин. Во-первых, окислите углеводные части вашего гликопротеина. Затем соедините альдегиды вашего углевода с амином другого целевого белка.
Затем соедините альдегиды вашего углевода с амином другого целевого белка.
Эта процедура называется восстановительным алкилированием или аминированием. Эти конъюгаты часто дают меньший фон в иммуноферментных анализах, и их относительно легко приготовить. Однако может происходить некоторая самоконъюгация антитела.
Чтобы окислить полисахарид на гликопротеине или антителе, обработайте его перйодатом натрия. Полученные альдегиды на вашем белке можно легко соединить с аминами или молекулами, содержащими гидразиды, посредством восстановительного аминирования.
Вы можете выборочно выбирать, какой углевод окислять, регулируя концентрацию перйодата в реакционной среде.
Восстановительное аминирование можно использовать для создания белково-белковых конъюгатов. Изображение из Справочника по кросслинкинговым реагентамКонъюгация белка, опосредованного эфиром и малеимидом, NHS
Гетеробифункциональные реагенты, содержащие реагирующий с амином сложный эфир NHS на одном конце и малеимидную группу, реагирующую с сульфгидрилом, на другом конце, обычно очень полезны для получения конъюгатов антитело-фермент. Сшивающие агенты, содержащие эти реакционноспособные группы, могут использоваться в строго контролируемых многостадийных процедурах, которые дают конъюгаты определенного состава и высокой активности. Наиболее широко используемыми сшивающими агентами этого типа являются SMCC и его водорастворимый аналог, сульфо-SMCC, которые обладают наиболее стабильными малеимидными функциональными группами. Эта повышенная устойчивость к гидролизу затрудненной малеимидной группы SMCC позволяет активировать либо фермент, либо антитело через амин-реактивный эфирный конец NHS, что приводит к промежуточному продукту, активируемому малеимидом. Затем промежуточные соединения могут быть очищены от избытка сшивающего агента и побочных продуктов реакции перед смешиванием со вторым белком, подлежащим конъюгации. Благодаря многостадийности этого процесса полимеризация конъюгированных белков в значительной степени снижается и обеспечивается контроль над степенью и местами сшивания.
Сшивающие агенты, содержащие эти реакционноспособные группы, могут использоваться в строго контролируемых многостадийных процедурах, которые дают конъюгаты определенного состава и высокой активности. Наиболее широко используемыми сшивающими агентами этого типа являются SMCC и его водорастворимый аналог, сульфо-SMCC, которые обладают наиболее стабильными малеимидными функциональными группами. Эта повышенная устойчивость к гидролизу затрудненной малеимидной группы SMCC позволяет активировать либо фермент, либо антитело через амин-реактивный эфирный конец NHS, что приводит к промежуточному продукту, активируемому малеимидом. Затем промежуточные соединения могут быть очищены от избытка сшивающего агента и побочных продуктов реакции перед смешиванием со вторым белком, подлежащим конъюгации. Благодаря многостадийности этого процесса полимеризация конъюгированных белков в значительной степени снижается и обеспечивается контроль над степенью и местами сшивания.
 Изображение из Bioconjugate Techniques 3-е издание Грега Т. Хермансона
Изображение из Bioconjugate Techniques 3-е издание Грега Т. ХермансонаВосстановление дисульфидных связей в шарнирной области молекулы IgG приводит к образованию молекул половинного антитела, содержащих тиоловые группы. Реакция этих восстановленных антител с ферментом, активируемым малеимидом, создает конъюгат за счет образования тиоэфирной связи.
Сульгидрильный реактивный фермент из предыдущего изображения теперь может реагировать с восстановленными дисульфидными связями на антителе. Изображение из Bioconjugate Techniques 3rd Edition Грега Т. ХермансонаКонъюгация с SATA-модифицированными антителами
N-сукцинимидил-S-ацетилтиоацетат (SATA) представляет собой реагент тиолирования, который реагирует с первичными аминами через сложный эфир NHS с образованием стабильных амидных связей. Ацетилированная сульфгидрильная группа стабильна до деацетилирования гидроксиламином. Таким образом, молекулы антител могут быть тиолированы с помощью SATA для создания сульфгидрильных целевых групп, необходимых для соединения с ферментом, активируемым малеимидом.
С помощью этого реагента можно приготовить маточные препараты SATA-модифицированных антител и при необходимости деацетилировать их. В отличие от процедур тиолирования, при которых сразу же образуется свободный сульфгидрильный остаток, защищенная сульфгидрильная группа SATA-модифицированных белков стабильна при длительном хранении без деградации.
Лизиновые группы на антителах также могут быть использованы для конъюгации белок-белок между антителами и ферментами. Изображение из Bioconjugate Techniques 3-е издание Грега Т. ХермансонаДоступные аминогруппы в молекуле антитела могут быть модифицированы NHS-эфирным концом SATA для получения производных амидной связи, содержащих концевые защищенные сульфгидрилы. С ацетилированных тиолов можно снять защиту обработкой гидроксиламином при щелочном рН. Реакция тиолированного антитела с ферментом, активируемым малеимидом, приводит к образованию тиоэфирных поперечных связей.
Методы конъюгации иммунотоксина
Базовая конструкция конъюгата иммунотоксина состоит из компонента, нацеленного на антитело, сшитого с молекулой токсина. Этот метод включает дисульфидную связь между частью антитела и цитотоксическим компонентом конъюгата, что позволяет высвобождать токсин внутриклеточно. На этой иллюстрации интактный белок токсина A–B обеспечивает необходимый дисульфид.
Этот метод включает дисульфидную связь между частью антитела и цитотоксическим компонентом конъюгата, что позволяет высвобождать токсин внутриклеточно. На этой иллюстрации интактный белок токсина A–B обеспечивает необходимый дисульфид.
В-цепь содержит участок связывания для стыковки с клеточной поверхностью, а А-цепь содержит каталитический сайт, который оказывает внутриклеточное цитотоксическое действие. Две субъединицы соединены дисульфидной связью, которая редуктивно расщепляется на клеточном уровне, и после этого расщепления субъединица А вызывает гибель клеток.
Доставка токсина в клетку вызывает расщепление линкера и гибель клетки. Изображение из 3-го издания Bioconjugate Techniques Грега Т. Хермансона. Конъюгаты иммунотоксина состоят из антитела, ковалентно сшитого с молекулой токсина таким образом, что сохраняются уникальные свойства обоих белков. Компонент антитела состоит из моноклонального антитела, обладающего специфичностью к антигенной детерминанте на поверхности определенного типа клеток. Чаще всего клетки-мишени представляют собой опухоли, которые экспрессируют уникальный маркер клеточной поверхности, который может быть распознан моноклональными. Антитело работает как пассивное такси, доставляя токсиновый компонент к клеткам-мишеням. Когда он достигает места расположения опухоли, компонент токсина воздействует на намеченную рибосому, в конечном итоге вызывая гибель клеток и разрушение опухоли.
Чаще всего клетки-мишени представляют собой опухоли, которые экспрессируют уникальный маркер клеточной поверхности, который может быть распознан моноклональными. Антитело работает как пассивное такси, доставляя токсиновый компонент к клеткам-мишеням. Когда он достигает места расположения опухоли, компонент токсина воздействует на намеченную рибосому, в конечном итоге вызывая гибель клеток и разрушение опухоли.
Помимо антител, вы также можете конъюгировать токсины с углеродными нанотрубками для нацеливания на опухоль с помощью эффекта ЭПР.
Новые инструменты освещают белок-белковые взаимодействия
Белково-белковые взаимодействия лежат в основе всех клеточных процессов. Чтобы понять, как работают клетки, и разработать эффективные меры, когда клеточные процессы идут наперекосяк, исследователям нужны эффективные инструменты для наблюдения и мониторинга взаимодействий между белками. Попытки наблюдать за клеточной динамикой неизбежно вводят в систему искусственный элемент либо путем иммобилизации, маркировки, либо иным образом нарушая естественную деятельность клетки. Но новые инновации продолжают улучшать эти усилия. Четыре компании, упомянутые в этой статье, разработали новые методы, позволяющие приблизиться к наблюдению за взаимодействием белков в режиме реального времени.
Но новые инновации продолжают улучшать эти усилия. Четыре компании, упомянутые в этой статье, разработали новые методы, позволяющие приблизиться к наблюдению за взаимодействием белков в режиме реального времени.
«Наш метод отличается от обычного иммуноокрашивания тем, что мы применяем два антитела одновременно», — говорит Агата Зиба-Вичер, доктор философии, директор по исследованиям и разработкам, Navinci. «Он идеально подходит для обнаружения взаимодействующих белков, фосфорилирования белков или самих белков в качестве отдельных мишеней».
Navinci’s Navenibodies включают антитело, конъюгированное с олигонуклеотидом ДНК. После того, как первичные антитела связывают интересующие белки, навенитела связывают эти антитела и сближают олигонуклеотиды. Разрезание олигонуклеотидов позволяет сформировать кольцевую ДНК, которая амплифицируется с использованием флуоресцентно меченных нуклеотидов. Навенитела соединяются только на расстоянии 40 нм или менее, гарантируя высокую специфичность за счет снижения неспецифического фонового окрашивания.
После того, как первичные антитела связывают интересующие белки, навенитела связывают эти антитела и сближают олигонуклеотиды. Разрезание олигонуклеотидов позволяет сформировать кольцевую ДНК, которая амплифицируется с использованием флуоресцентно меченных нуклеотидов. Навенитела соединяются только на расстоянии 40 нм или менее, гарантируя высокую специфичность за счет снижения неспецифического фонового окрашивания.Во-первых, первичные антитела связываются с каждым интересующим белком. Затем идут антитела Навена, которые связываются с первичными антителами. Навенитела конъюгированы с одноцепочечными олигонуклеотидами ДНК. Эти олигонуклеотиды могут гибридизоваться друг с другом, и они являются ключом к повышению специфичности системы.
По отдельности олигонуклеотиды образуют шпильки, и каждая шпилька может быть расщеплена другим ферментом. Когда пищеварительный фермент разрезает первую шпильку, ее концы высвобождаются, но только что освобожденный фрагмент остается гибридизованным с участком, который все еще прикреплен к антителу. Когда другой олигонуклеотид переваривается, эта шпилька высвобождается, создавая одноцепочечный фрагмент, который гибридизуется со свободными концами первого олигонуклеотида. Это образует круг. Эта кольцевая ДНК амплифицируется, включая флуоресцентно меченные нуклеотиды для обнаружения.
Когда другой олигонуклеотид переваривается, эта шпилька высвобождается, создавая одноцепочечный фрагмент, который гибридизуется со свободными концами первого олигонуклеотида. Это образует круг. Эта кольцевая ДНК амплифицируется, включая флуоресцентно меченные нуклеотиды для обнаружения.
Олигонуклеотиды образуют круг только в том случае, если два интересующих белка взаимодействуют, в результате чего Навенитела находятся в пределах 40 нм друг от друга. В случае связывания нецелевого антитела риск ложноположительных результатов низок. Связывание антитела и олигонуклеотида вместе в Навенителах также сводит к минимуму количество этапов и повышает чувствительность анализа. «Каждый шаг в дополнение к предыдущим будет снижать эффективность метода», — отмечает Зиеба-Вичер. «Теперь мы видим увеличение мощности сигнала до 10 раз по сравнению с исходным PLA».
Одним из примеров работы платформы Naveni является обнаружение зарождающихся метастазов в раковых клетках. Белковые комплексы, образующиеся между b-катенином и Е-кадгерином, удерживают соседние клетки вместе. Когда они перестают взаимодействовать, и клетки теряют контакт друг с другом, начинается миграция. Изменение флуоресценции, на которое указывают антитела Навена, когда β-катенин и Е-кадгерин больше не взаимодействуют, соответствует началу миграции. Поскольку метастазирование вызывается изменением этого взаимодействия, а не просто уровнями экспрессии белков, недостаточно просто пометить их.
Когда они перестают взаимодействовать, и клетки теряют контакт друг с другом, начинается миграция. Изменение флуоресценции, на которое указывают антитела Навена, когда β-катенин и Е-кадгерин больше не взаимодействуют, соответствует началу миграции. Поскольку метастазирование вызывается изменением этого взаимодействия, а не просто уровнями экспрессии белков, недостаточно просто пометить их.
«Экспрессия этих белков не говорит нам всего, — объясняет Зиба-Вичер. «Глядя на взаимодействие между двумя разными белками в двух разных клетках, можно увидеть, когда происходит этот переход».
Метод также может определять фосфорилирование белка. Когда антитело к общему белку используется вместе с антителом, обнаруживающим, скажем, фосфотирозин, только фосфорилированный белок будет генерировать сигнал, потому что именно здесь будут взаимодействовать оба антитела.
«На самом деле можно обнаружить специфическое фосфорилирование, не имея специфического антитела», — говорит Зиба-Вичер. «Качество фосфоантител не всегда самое лучшее. Существует много перекрестной реакции. Но этот подход можно использовать с любой мишенью, если существует антитело против общего белка».
«Качество фосфоантител не всегда самое лучшее. Существует много перекрестной реакции. Но этот подход можно использовать с любой мишенью, если существует антитело против общего белка».
В 2012 году компания Promega представила NanoLuc, люциферазу с молекулярной массой 19 кДа, полученную из креветок и спроектированную так, чтобы светиться в 100 раз ярче, чем предыдущие люциферазы. Он служил люминесцентным донором для анализов биолюминесцентного резонансного переноса энергии (BRET), которые измеряют близость молекул. Например, Promega использовала NanoLuc для создания двух высокочувствительных анализов для обнаружения белок-белковых взаимодействий, NanoBRET (NanoLuc BRET) и NanoBiT (NanoLuc Binary Technology).
Люцифераза NanoLuc светится в 100 раз ярче, чем люциферазы Renilla или светлячка. Его небольшой размер гарантирует, что слияние с интересующим белком не будет мешать нормальной функции или локализации белка. Когда NanoLuc и HaloTag приближаются друг к другу, энергия, передаваемая от NanoLuc к HaloTag, генерирует сигнал с красным смещением.
Когда NanoLuc и HaloTag приближаются друг к другу, энергия, передаваемая от NanoLuc к HaloTag, генерирует сигнал с красным смещением.В NanoBRET NanoLuc сливают с интересующим белком, а взаимодействующий белок сливают с HaloTag, бактериальным ферментом, несущим флуорофор с красным смещением. Когда две молекулы соединяются, энергия, передаваемая от NanoLuc к HaloTag, активирует флуорофор, генерируя сигнал.
«BRET очень похож на FRET, — говорит Эрик Бонке, доктор философии, специалист по приложениям, Promega. «Разница в том, что вместо двух флуорофоров у нас есть люцифераза в качестве донора».
В более ранней версии, названной BRET1, длины волн донора и акцептора значительно перекрывались, что ограничивало чувствительность анализа. Акцепторный флуорофор NanoBRET с красным смещением в три раза увеличивает расстояние между длинами волн донорного и акцепторного пиков. «В результате в акцепторный канал поступает меньше донорского сигнала», — объясняет Бонке. «Это позволяет нам значительно улучшить отношение сигнала к фону и повысить чувствительность анализа».
NanoBRET хорошо работает при изучении динамических взаимодействий, поскольку сигнал является обратимым. «Если белки снова диссоциируют, мы теряем сигнал BRET», — отмечает Бонке. «Эта технология действительно позволяет вам смотреть на динамику, потому что вы можете измерить как ассоциацию, так и диссоциацию».
В ходе проверочных испытаний NanoBRET успешно обнаружил взаимодействие между белками FKBP и FKR при более низких концентрациях, чем in vivo. «На самом деле мы можем снизить уровень эндогенной экспрессии и по-прежнему обнаруживать взаимодействие этих двух белков», — утверждает Бонке. «NanoBRET — очень надежная и чувствительная технология».
В ходе другой демонстрации NanoBRET количественно определил активность лекарственного средства IBET151 в отношении взаимодействия между BRD4 и двумя разными гистоновыми белками. Слияние с HaloTag не препятствует нормальному включению гистонов в хроматин, указывает Бонке. Когда эксперимент был проведен, данные флуоресценции показали, что IBET151 нарушал взаимодействие BRD4-гистон 4 более сильно, чем взаимодействие BRD4-гистон 3.
NanoBiT использует версию NanoLuc, разделенную на большую и малую части. Каждая субъединица слита с интересующим белком, так что, когда белки взаимодействуют, субъединицы соединяются, образуя функциональную люциферазу. Субъединицы были оптимизированы по стабильности и низкому сродству.
«Эти две субъединицы в растворе не будут самопроизвольно дополняться», — подчеркивает Бонке. «Они будут дополнять друг друга только тогда, когда их соберут вместе и удержат в физическом контакте другими способами».
В анализе NanoBiT используется NanoLuc, разделенный на большие и малые субъединицы. Субъединицы имеют низкое сродство, поэтому они не будут спонтанно воссоединяться. Когда они собираются вместе, они образуют полную люциферазу и испускают флуоресцентный сигнал. Как и NanoBRET, сигнал обратим, поскольку субъединицы можно разделить. «Это невозможно с расщепленными автофлуоресцентными белками, такими как расщепленный GFP», — советует Бонке. «Как только эти фрагменты собраны, созревание флуорофора означает, что они не будут диссоциировать. С NanoBiT вы можете проводить измерения в обоих направлениях».
С NanoBiT вы можете проводить измерения в обоих направлениях».
В то время как NanoBRET требует специального оборудования для считывания флуоресцентного сигнала, NanoBiT работает с обычным люминометром. Хотя эта разница, казалось бы, играет в пользу NanoBiT, есть и разница, которая играет роль в пользу NanoBRET. То есть в случае с NanoBiT две метки должны физически взаимодействовать, тогда как с NanoBRET им нужно только приблизиться друг к другу. Таким образом, в зависимости от изучаемого белок-белкового взаимодействия эти различия могут определять, какой анализ предпочтительнее.
Анализ связывания GTP Gi выявляет активацию GPCR нерадиоактивно Рецепторы, связанные с G-белком (GPCR), составляют большое и разнообразное семейство трансмембранных белков, и они играют важную роль в многочисленных сигнальных путях. Компания PerkinElmer недавно представила новые наборы для анализа, предназначенные для дальнейшего терапевтического открытия GPCR и ингибиторов GPCR. Одним из этих новых анализов является набор для связывания HTRF GTP Gi, первый в отрасли анализ на основе TR-FRET для связывания GTP.
Одним из этих новых анализов является набор для связывания HTRF GTP Gi, первый в отрасли анализ на основе TR-FRET для связывания GTP.
Набор использует гомогенную флуоресценцию с временным разрешением (HTRF), которая сочетает в себе технологию переноса энергии резонанса флуоресценции (FRET) с измерением с временным разрешением для обнаружения молекулярных взаимодействий. Ключевой особенностью HTRF является то, что он очень стабилен во времени, что позволяет проводить повторные измерения в течение нескольких часов или дней.
Когда лиганд связывается с внеклеточной поверхностью GPCR, сигнальный каскад начинается с обмена GDP на GTP. В наборе для анализа связывания HTRF GTP Gi используется аналог GTP, помеченный флуоресцентной донорной молекулой, и антитело против Gi, помеченное флуоресцентным акцептором. При активации GPCR меченый аналог GTP связывается с G-белком, сближая донора и акцептора и генерируя флуоресцентный сигнал. Интенсивность сигнала пропорциональна активности GPCR, обеспечивая прямое чтение активации GPCR. Соединения, ингибирующие активацию, уменьшат сигнал.
Соединения, ингибирующие активацию, уменьшат сигнал.
«Это чрезвычайно мощно, поскольку GPCR участвуют в сигнальных путях, связанных со многими заболеваниями», — говорит Матис Лаффенетре, руководитель платформы реагентов для медико-биологических технологий, PerkinElmer. «В случае с этим новым набором для анализа связывание GTP Gi, например, связано с болевыми путями, поэтому такое исследование может помочь в разработке новых методов лечения хронических болевых состояний».
В качестве первого теста TR-FRET для связывания GTP Gi набор обеспечивает эффективный нерадиоактивный вариант изучения активации GPCR.
«В настоящее время единственным широко используемым методом мониторинга связывания GTP Gi является подход, основанный на радиоактивности», — отмечает Лаффенетр. «Теперь ученые, которые либо не знакомы с радиоактивностью, либо не хотят использовать радиоактивные материалы, могут изучать связывание GTP Gi с использованием технологии на основе флуоресценции».
Анализ GTP Gi можно комбинировать с другими наборами PerkinElmer для GPCR, чтобы полностью охарактеризовать изучаемый GPCR. Например, набор cAMP Gi выявляет изменения в накоплении цАМФ при активации GPCR, чтобы выявить активность вторичных мессенджеров. Усиление передачи сигналов может происходить во многих точках каскада. Вот почему, объясняет Лаффенетре, важно измерять как источник сигнала, так и конечные результаты.
Например, набор cAMP Gi выявляет изменения в накоплении цАМФ при активации GPCR, чтобы выявить активность вторичных мессенджеров. Усиление передачи сигналов может происходить во многих точках каскада. Вот почему, объясняет Лаффенетре, важно измерять как источник сигнала, так и конечные результаты.
«Анализ связывания ГТФ и цАМФ — это линзы, которые соответственно смотрят на источник сигнала и на реку, в которую он превращается, перемещаясь внутри клетки и собирая входные данные из других биологических систем», — отмечает он. «Таким образом, использование двойной системы связывания GTP/цАМФ позволяет получить более полное представление о сигнале, поскольку оно учитывает разницу между источником сигнала и конечными результатами». Он добавляет, что препарат-кандидат, который блокирует GPCR, может быть менее привлекательным, если последующие усиления составляют больший процент конечного сигнала.
Обмен нуклеотидов может выявить повороты пути Kras Мутации KRas часто встречаются при раке, но этот белок долгое время считался «не поддающимся лечению», поскольку у него нет четко определенного кармана для связывания, на который можно воздействовать небольшими молекулами. Однако недавно были идентифицированы новые карманы связывания, что возродило интерес к поиску потенциальных ингибиторов KRas.
Однако недавно были идентифицированы новые карманы связывания, что возродило интерес к поиску потенциальных ингибиторов KRas.
В этом году Lumakras от Amgen стал первым ингибитором KRas, одобренным FDA, и вскоре за ним могут последовать другие. Но прямое ингибирование KRas — не единственный вариант: изучаются альтернативные подходы, включающие ингибирование белков обменных факторов или ингибирование взаимодействия с эффекторными белками.
«Мы произвели белки и утвердили набор анализов для обнаружения и характеристики соединений, которые нацелены на различные этапы пути KRas, — говорит Екатерина Кузнецова, к.б.н., научный сотрудник отдела биологии реакций.
KRas зависит от эффекторных белков, включая SOS1 и SOS2, которые опосредуют превращение GDP в GTP. Набор анализов Reaction Bio включает анализ обмена нуклеотидов, который выявляет опосредованный SOS1/2 обмен флуоресцентно меченого GDP на GTP, а также анализы белок-белковых взаимодействий для выявления соединений, которые блокируют взаимодействие между KRas и белками SOS1 или cRAF.
В анализе обмена нуклеотидов KRas метят флуоресцентной молекулой GDP. Когда SOS1/2 заменяет GDP на немеченый GTP и активируется KRas, уровень флуоресценции снижается. Таким образом, измерение уровня флуоресценции сводится к измерению активации KRas.
Анализ можно использовать для скрининга соединений, которые ингибируют активацию KRas или различных мутантов KRas. В присутствии ингибиторов уровень флуоресценции остается стабильным, что указывает на то, что обмен GDP-GTP не произошел и что KRas остается «выключенным». Анализ также полезен в качестве инструмента селективности для сравнения эффектов ингибирующих соединений на различные мутанты KRas.
Компания Reaction Bio также предлагает анализы на основе HTRF для обнаружения нарушений белок-белковых взаимодействий. Успешное связывание между KRas, связанными с GDP, и SOS1 будет генерировать флуоресцентный сигнал, а активность ингибиторов можно количественно оценить по падению флуоресцентных сигналов. Анализ cRAF использует KRas, связанные с GTP, но работает так же. «Мы наблюдаем ингибирование этого взаимодействия как у KRas дикого типа, так и у мутантов G12», — отмечает Кузнецова.
«Мы наблюдаем ингибирование этого взаимодействия как у KRas дикого типа, так и у мутантов G12», — отмечает Кузнецова.
Reaction Bio также предлагает биофизический анализ, использующий поверхностный плазмонный резонанс (SPR) для количественного определения аффинности связывания с KRas и SOS1. KRas дикого типа или мутантный KRas связывается с чипом, и соединение течет по нему. «Поскольку он взаимодействует с белком, измерения выполняются в режиме реального времени, поэтому он позволяет рассчитать скорость ассоциации и диссоциации», — объясняет Кузнецова. «Основываясь на этих показателях, можно рассчитать сродство к связыванию».
«Вы не ограничены связыванием малых молекул, — продолжает Кузнецова. «Также можно изучить связывание пептидов и белок-белковые взаимодействия». Связывание SOS1 с чипом и протекание KRas плюс ингибирующее соединение BAY-293 позволяют проводить количественную оценку ингибирования связывания при различных концентрациях соединения.
Ряд инновационных инструментов и методов позволяет исследователям наблюдать, характеризовать и количественно определять прежде непостижимые межбелковые взаимодействия.

