это химия? Разбираемся вместе с фитнес экспертом Bombbar!
Фитнес-эксперт Bombbar и телеведущий Эдуард Каневский, рассказал, что такое порошковый протеин и зачем он нужен.
Спортивное питание в России существует уже больше тридцати лет. И когда оно только начинало появляться, большинство людей были уверены, что это все опасная для здоровья “химия”. На самом деле в те далекие годы спортивное питание действительно могло нанести вред здоровью, чаще отравление, так как большое количество продукции было откровенным контрафактом. Да и продавалось оно буквально в нескольких магазинах в Москве.
В наше время таких рисков уже нет, а словосочетание “спортивное питание” не вызывает никакого отторжения у обывателей. Хотя все еще остаются те, кто уверен, что если уж спортивное питание и не вредно, то все равно это “химия”. Они думают, что сырье, из которого делаю продукцию, создается искусственным путем. Разрушим этот миф на примере самого популярного вида спортивного питания — сывороточного протеина от Bombbar.
Что такое протеин? Это научное название белка — органического соединения, которое состоит из углерода, водорода, кислорода, серы и азота. А из белка состоят все наши ткани, в том числе и мышцы. Когда человек регулярно тренируется с целью увеличения мышечной массы, ему нужно больше строительного материала, которым и является белок (протеин). При интенсивных тренировках, запрос организма на получение белка из пищи вырастает до 2 гр белка на килограмм веса тела. Набрать эту норму из обычных продуктов достаточно сложно, так как нужно все время есть. Именно с целью закрыть запрос по белку и не перегружать пищеварительную систему, и был придуман порошковый протеин.
Так как его делают?
Все просто.
На производстве берут сыворотку молока, которую очищают от всего лишнего, а полученный порошок просто фасуют по упаковкам. Никакой химии. Для вкуса добавляют натуральные ароматизаторы, и вы получаете вкусный напиток.
Все очень просто.
Я не зря упомянул, что протеин лучше употреблять два, иногда три раза в день, в зависимости от ваших нагрузок и режима питания, но не чаще! Ведь ни протеин, ни какой-либо другой вариант спортивного питания не заменяет традиционные приемы пищи, они их только дополняют!
Еще важно на каждые сто граммов употребляемого белка в сутки выпивать не меньше литра чистой, питьевой воды. Это необходимо для нормального усвоения белка и правильной работы почек.
Это необходимо для нормального усвоения белка и правильной работы почек.
Кстати, протеиновые коктейли от Bombbar не только обладают прекрасными характеристиками по составу и усвоению, они еще и очень вкусные. Он подойдёт тем, кто постоянно тренируется и тем, кто просто ищет полезный перекус! Да! С порошковым протеином от Bombbar можно делать великолепные белковые молочные коктейли, которые можно даже детям. Так что смело употребляйте порошковый протеин и другую продукцию Bombbar. Именно сывороточный протеин является вариантом, который хорошо усваивается нашим организмом, поэтому лучше отдать предпочтение именно ему.
По коду b15 дарим постоянную скидку 15% на все протеиновые коктейли!
Химия или нет – вот в чём вопрос
«Protein» с английского языка означает «белок».
Собственно это и есть протеин, который стоит на полках в спортивных комплексах. Основным сырьем для его производства выступает молоко, из которого получают как сывороточный протеин, так и казеиновый. Первый быстрее усваивается, второй питает мышцы дольше и рекомендуется для употребления перед сном, но сейчас не об этом. Сейчас моя цель донести тот простой факт, что протеин — это натуральный продукт, полученный из молочной сыворотки или же казеина методом фильтрации и концентрации.
Первый быстрее усваивается, второй питает мышцы дольше и рекомендуется для употребления перед сном, но сейчас не об этом. Сейчас моя цель донести тот простой факт, что протеин — это натуральный продукт, полученный из молочной сыворотки или же казеина методом фильтрации и концентрации.
Кроме того, может использоваться и другое сырье, например, яйца, соя, белок из круп или даже пшеничная клейковина (последние три продукта зачастую применяются для удешевления производства), но в любом случае все это натуральные продукты. Таким образом, в пластиковой банке или же пакете, на которых большими буквами красуется слово «Protein», вы покупаете концентрированный пищевой белок и ничего более. Для сравнения: в 100-граммовой пачке чипсов «химии» будет больше, чем в 2,2-киллограммовой банке протеина, даже, если в нём применяют искусственные ароматизаторы и сахарозаменители.
Продолжая тему спортивного питания, стоит вспомнить об аминокислотах, которые являются составными элементами белка. В усвоении они еще быстрее, чем протеин и могут попасть в кровь чуть ли не через 10–15 минут после приема. Вывод — основой большинства спортивных аминокислот являются все те же натуральные продукты питания, упомянутые выше, но используются более сложные методы обработки.
Вывод — основой большинства спортивных аминокислот являются все те же натуральные продукты питания, упомянутые выше, но используются более сложные методы обработки.
Так что, не волнуйтесь по поводу того, что протеин или аминокислоты — это какая-то фармацевтическая «химия», которая нанесет вред организму или излишне его нагрузит. Это хорошее дополнение к общему рациону питания, так называемый БАД, причем ключевым словом в данном случае является именно «дополнение»/«добавка». Не стоит бояться спортивного питания, но и не надо слишком уж рассчитывать на него. Во всем хороша мера и разумный подход, но главное понимать, для чего конкретно нужен тот или иной продукт спортивного питания. Следует четко понимать, что каждый продукт спортивного питания создан с определенной целью и на 100% универсальных решений, которые дают все и сразу, не существует.
Например, протеин или белковый концентрат создавался в качестве источника высококачественного белка, который позволяет добрать нужное количество этого нутриента (1,5–3 г на килограмм веса тела в зависимости от потребностей и целей), если вам не удается этого сделать из обычной пищи. Допустим, просто физически не можете впихнуть в себя столько еды, либо ЖКТ не справляется с нагрузкой. Кроме того, за счет быстрой усвояемости протеин является хорошим источником питательных веществ сразу после тренировки или же незадолго до нее, если не успели нормально поесть за 1–1,5 часа до похода в тренажерный зал.
Допустим, просто физически не можете впихнуть в себя столько еды, либо ЖКТ не справляется с нагрузкой. Кроме того, за счет быстрой усвояемости протеин является хорошим источником питательных веществ сразу после тренировки или же незадолго до нее, если не успели нормально поесть за 1–1,5 часа до похода в тренажерный зал.
Соответственно, вопрос, который не раз поступал от новичков, типа: «А на сколько сантиметров вырастет бицепс с одной упаковки протеина?», — совершенно бессмысленный. Дружище, ни насколько ты не накачаешь свою «бицуху» с упаковки протеина, потому что это лишь пищевая добавка, которая сама по себе ничего не даст. А вот при разумном ее применении для улучшения общего качества питания — эффект будет.
Итак, протеин позволяет:
* скорректировать питание для получения требуемого суточного количества белка;
* иногда заменить прием пищи, если не успели приготовить или нет времени/возможности спокойно покушать;
* быстро наполнить кровь необходимыми для восстановления после тренировки аминокислотами (не факт, что в этом есть необходимость сразу же после физической нагрузки, но подобная практика широко используется).
Протеин не способен:
* сам по себе накачивать мышцы;
* давать моментальный прирост в силовых показателях (прирост будет за счет роста мышц, в котором протеин принимает участие точно так же, как и обычная еда).
BCAA, они же аминокислоты с разветвленными боковыми цепями, помогают быстрее восстанавливаться после физически нагрузок за счёт того, что предотвращают излишнее разрушение мышечных волокон, плюс способны выступать в качестве источника энергии. Кроме того, BCAA очень эффективны во время «сушки», когда хочется избавиться от лишнего жира, но нет желания при этом терять с таким трудом накачанные мышцы. Хотя сами по себе аминокислоты с разветвленными боковыми цепями вам мышцы не накачают.
Итак, BCAA позволяют:
* быстрее восстанавливаться во время и после физических нагрузок;
* лучше сохранять мышцы в период «сушки»
BCAA не способны:
* накачать мышцы сами по себе;
* дать быстрый и заметный прирост в силовых показателях;
У комплексных аминокислот примерно тот же принцип действия, что и у протеина, а усваиваются они еще быстрее, так как это, по сути, уже разложенный на составные части протеин. На чудо не рассчитывайте, но быстро наполнить кровь полезными веществами сразу после тренировки они смогут.
На чудо не рассчитывайте, но быстро наполнить кровь полезными веществами сразу после тренировки они смогут.
24.9: Белки — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25624
Цели обучения
- Распознавать аминокислоты и классифицировать их на основе характеристик их боковых цепей.
Белки всех живых существ, от бактерий до человека, построены из одного и того же набора 20 аминокислот, названных так потому, что каждая из них содержит аминогруппу, присоединенную к карбоновой кислоте. Аминокислоты в белках представляют собой α-аминокислоты, что означает, что аминогруппа присоединена к α-углероду карбоновой кислоты. Люди могут синтезировать только около половины необходимых аминокислот; остальные должны быть получены из рациона и известны как незаменимые аминокислоты. Однако две дополнительные аминокислоты были обнаружены в белках в ограниченном количестве: селеноцистеин был открыт в 1986, а пирролизин был открыт в 2002 году.
Люди могут синтезировать только около половины необходимых аминокислот; остальные должны быть получены из рациона и известны как незаменимые аминокислоты. Однако две дополнительные аминокислоты были обнаружены в белках в ограниченном количестве: селеноцистеин был открыт в 1986, а пирролизин был открыт в 2002 году.
Аминокислоты представляют собой бесцветные нелетучие кристаллические вещества, плавящиеся и разлагающиеся при температуре выше 200°C. Эти температуры плавления больше похожи на температуры плавления неорганических солей, чем на амины или органические кислоты, и указывают на то, что структуры аминокислот в твердом состоянии и в нейтральном растворе лучше всего представлены как имеющие как отрицательно заряженную группу, так и положительно заряженную группу. Такой вид известен как цвиттерион.
Классификация
В дополнение к амино и карбоксильной группе аминокислоты имеют боковую цепь или группу R, присоединенную к α-углероду. Каждая аминокислота имеет уникальные характеристики, обусловленные размером, формой, растворимостью и свойствами ионизации ее R-группы.
| Общее имя | Аббревиатура | Структурная формула (при pH 6) | Молярная масса | Отличительный признак |
|---|---|---|---|---|
| Аминокислоты с неполярной группой R | ||||
| глицин | гли (Г) | 75 | единственная аминокислота без хирального углерода | |
| аланин | аля (А) | 89 | — | |
| валин | вал (В) | 117 | аминокислота с разветвленной цепью | |
| лейцин | лей (л) | 131 | аминокислота с разветвленной цепью | |
| изолейцин | иль (я) | 131 | незаменимая аминокислота, поскольку большинство животных не могут синтезировать аминокислоты с разветвленной цепью | |
| фенилаланин | 165 | также классифицируется как ароматическая аминокислота | ||
| триптофан | тп (Вт) | 204 | также классифицируется как ароматическая аминокислота | |
| метионин | мет (М) | 149 | боковая цепь действует как донор метильной группы | |
| пролин | про (П) | 115 | содержит вторичную аминогруппу; упоминается как α-иминокислота | |
| Аминокислоты с полярной, но нейтральной группой R | ||||
| серин | сер (С) | 105 | обнаружен в активном центре многих ферментов | |
| треонин | тр (Т) | 119 | ||
| цистеин | цис (К) | 121 | окисление двух молекул цистеина дает цистин | |
| тирозин | тыр (Я) | 181 | также классифицируется как ароматическая аминокислота | |
| аспарагин | asn (н) | 132 | амид аспарагиновой кислоты | |
| глутамин | Глн (Q) | 146 | амид глутаминовой кислоты | |
| Аминокислоты с отрицательно заряженной группой R | ||||
| аспарагиновая кислота | аспид (Д) | 132 | карбоксильные группы ионизируются при физиологических значениях рН; также известный как аспартат | |
| глутаминовая кислота | клей (E) | 146 | карбоксильные группы ионизируются при физиологических значениях рН; также известный как глутамат | |
| Аминокислоты с положительно заряженной группой R | ||||
| гистидин | его (H) | 155 | единственная аминокислота, R-группа которой имеет pK a (6,0) близкий к физиологическому pH | |
| лизин | лиз (К) | 147 | — | |
| аргинин | аргумент (R) | 175 | почти такое же сильное основание, как гидроксид натрия | |
Первой аминокислотой, выделенной в 1806 году, была аспарагин.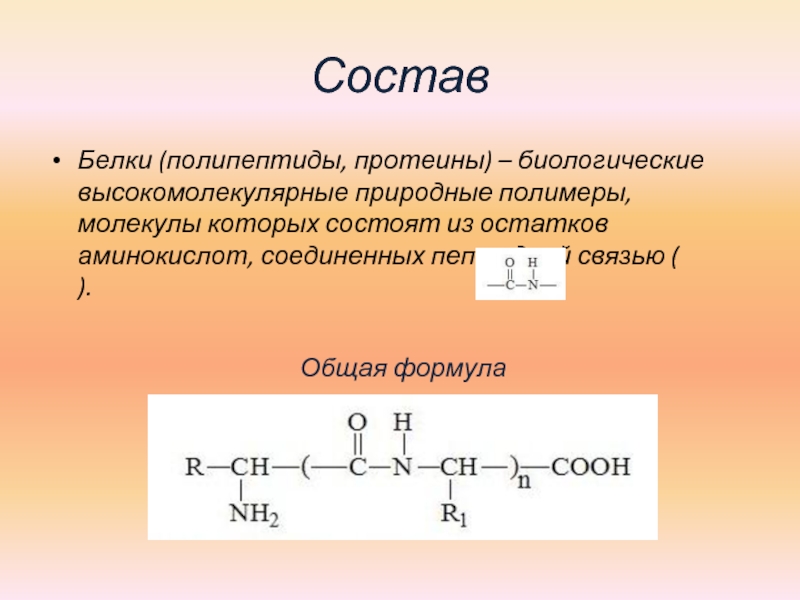 Она была получена из белка, содержащегося в соке спаржи (отсюда и название). Глицин, основная аминокислота, содержащаяся в желатине, была названа в честь его сладкого вкуса (греч. glykys , что означает «сладкий»). В некоторых случаях аминокислота, содержащаяся в белке, на самом деле является производным одной из 20 обычных аминокислот (одна из таких производных — гидроксипролин). Модификация происходит
Она была получена из белка, содержащегося в соке спаржи (отсюда и название). Глицин, основная аминокислота, содержащаяся в желатине, была названа в честь его сладкого вкуса (греч. glykys , что означает «сладкий»). В некоторых случаях аминокислота, содержащаяся в белке, на самом деле является производным одной из 20 обычных аминокислот (одна из таких производных — гидроксипролин). Модификация происходит
Конфигурация
Обратите внимание, что в таблице \(\PageIndex{1}\) глицин является единственной аминокислотой, у которой α-углерод , а не хиральный. Следовательно, за исключением глицина, аминокислоты теоретически могут существовать либо в D-, либо в L-энантиомерной форме и вращать плоскополяризованный свет. Как и в случае с сахарами, химики использовали L-глицериновый альдегид в качестве эталонного соединения для определения абсолютной конфигурации аминокислот. Его структура очень напоминает структуру аминокислоты, за исключением того, что в последней аминогруппа занимает место группы ОН на хиральном углероде L-глицеральдегида, а карбоновая кислота заменяет альдегид. Современные определения стереохимии с использованием правил приоритета Кана-Ингольда-Прелога, повсеместно используемых в химии, показывают, что все встречающиеся в природе хиральные аминокислоты представляют собой S, за исключением Cys, который представляет собой R.
Современные определения стереохимии с использованием правил приоритета Кана-Ингольда-Прелога, повсеместно используемых в химии, показывают, что все встречающиеся в природе хиральные аминокислоты представляют собой S, за исключением Cys, который представляет собой R.
Мы узнали, что все встречающиеся в природе сахара относятся к серии D. Интересно поэтому, что почти все известные растительные и животные белки полностью состоят из L-аминокислот. Однако некоторые бактерии содержат D-аминокислоты в своих клеточных стенках, а некоторые антибиотики (например, актиномицин D и грамицидины) содержат различные количества D-лейцина, D-фенилаланина и D-валина.
Резюме
Аминокислоты можно классифицировать на основе характеристик их характерных боковых цепей как неполярные, полярные, но незаряженные, отрицательно заряженные или положительно заряженные. Аминокислоты, содержащиеся в белках, представляют собой L-аминокислоты.
Цели обучения
- Описать четыре уровня структуры белка.

- Определите типы взаимодействий притяжения, которые удерживают белки в их наиболее стабильной трехмерной структуре.
- Объясните, что происходит при денатурации белков.
- Определите, как можно денатурировать белок.
Каждый из тысяч встречающихся в природе белков имеет свой характерный аминокислотный состав и последовательность, что приводит к уникальной трехмерной форме. С 19В 50-х годах ученые определили аминокислотные последовательности и трехмерную структуру множества белков и, таким образом, получили важные сведения о том, как каждый белок выполняет свою специфическую функцию в организме.
Белки представляют собой соединения с высокой молекулярной массой, состоящие в основном или полностью из цепочек аминокислот. Из-за их большой сложности белковые молекулы не могут быть классифицированы на основе определенного структурного сходства, как классифицируются углеводы и липиды. Две основные структурные классификации белков основаны на гораздо более общих характеристиках: является ли белок (1) нитевидным и нерастворимым или (2) глобулярным и растворимым..jpg) Некоторые белки, например те, из которых состоят волосы, кожа, мышцы и соединительная ткань, подобны волокнам. Эти волокнистые белки нерастворимы в воде и обычно выполняют структурную, соединительную и защитную функции. Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина. Соединительные ткани содержат коллаген. Миозины являются мышечными белками и способны сокращаться и растягиваться. Эластины находятся в связках и эластичной ткани стенок артерий.
Некоторые белки, например те, из которых состоят волосы, кожа, мышцы и соединительная ткань, подобны волокнам. Эти волокнистые белки нерастворимы в воде и обычно выполняют структурную, соединительную и защитную функции. Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина. Соединительные ткани содержат коллаген. Миозины являются мышечными белками и способны сокращаться и растягиваться. Эластины находятся в связках и эластичной ткани стенок артерий.
Глобулярные белки, другой основной класс, растворимы в водной среде. В этих белках цепи свернуты так, что молекула в целом имеет примерно сферическую форму. Знакомые примеры включают яичный альбумин из яичных белков и сывороточный альбумин в крови. Сывороточный альбумин играет важную роль в транспортировке жирных кислот и поддержании надлежащего баланса осмотического давления в организме. Гемоглобин и миоглобин, важные для связывания кислорода, также являются глобулярными белками.
Уровни белковой структуры
Структура белков обычно описывается как имеющая четыре организационных уровня. Первым из них является первичная структура, которая представляет собой количество и последовательность аминокислот в полипептидной цепи или цепях белка, начиная со свободной аминогруппы и поддерживаемой пептидными связями, соединяющими каждую аминокислоту со следующей. Первичная структура инсулина, состоящая из 51 аминокислоты, показана на рисунке \(\PageIndex{1}\).
Рисунок \(\PageIndex{1}\): Первичная структура человеческого инсулина. Инсулин человека, аминокислотная последовательность которого показана здесь, является гормоном, необходимым для правильного метаболизма глюкозы. Молекула белка не является случайным клубком полипептидных цепей. Вместо этого цепи расположены в уникальных, но специфических конформациях. Термин «вторичная структура» относится к фиксированному расположению полипептидного остова. На основе рентгеновских исследований Лайнус Полинг и Роберт Кори предположили, что определенные белки или их части закручиваются в спираль или спираль. Эта спираль стабилизирована внутрицепочечной водородной связью между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты вверх по цепи (расположенным на следующем витке спирали) и известна как правосторонняя α- спираль. Рентгеновские данные показывают, что эта спираль делает один оборот на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из спирального остова (рис. \(\PageIndex{2}\)). α-кератины, обнаруженные в волосах и шерсти, имеют исключительно α-спиральную конформацию. Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, практически не имеют спиральной структуры. Другие, такие как гемоглобин и миоглобин, имеют спиральную форму в одних областях, но не в других.
Эта спираль стабилизирована внутрицепочечной водородной связью между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты вверх по цепи (расположенным на следующем витке спирали) и известна как правосторонняя α- спираль. Рентгеновские данные показывают, что эта спираль делает один оборот на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из спирального остова (рис. \(\PageIndex{2}\)). α-кератины, обнаруженные в волосах и шерсти, имеют исключительно α-спиральную конформацию. Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, практически не имеют спиральной структуры. Другие, такие как гемоглобин и миоглобин, имеют спиральную форму в одних областях, но не в других.
 Обратите внимание, что боковые цепи (представленные зелеными сферами) направлены от спирали.
Обратите внимание, что боковые цепи (представленные зелеными сферами) направлены от спирали.Другой распространенный тип вторичной структуры, называемый конформацией β-складчатого листа , представляет собой листообразную структуру, в которой две или более вытянутых полипептидных цепей (или отдельные участки одной цепи) выровнены бок о бок. Выровненные сегменты могут идти параллельно или антипараллельно, то есть N-концы могут быть обращены в одном и том же направлении на соседних цепях или в разных направлениях, и соединены 9водородная связь 0169 между цепями (рис. \(\PageIndex{3}\)). β-складчатый лист особенно важен для структурных белков, таких как фиброин шелка. Он также наблюдается в частях многих ферментов, таких как карбоксипептидаза А и лизоцим.
Рисунок \(\PageIndex{3}\): Шаровидная модель β-складчатой структуры белков. Боковые цепи простираются выше или ниже листа и чередуются вдоль цепи. Белковые цепи удерживаются вместе за счет межцепочечных водородных связей.
Третичная структура относится к уникальной трехмерной форме белка в целом, которая является результатом складывания и изгиба остова белка. Третичная структура тесно связана с правильным биохимическим функционированием белка. На рисунке \(\PageIndex{4}\) показана трехмерная структура инсулина.
Рисунок \(\PageIndex{4}\): Ленточная модель трехмерной структуры инсулина. Спиральные участки представляют собой участки полипептидной цепи, имеющие α-спиральную структуру, а широкие стрелки представляют собой β-складчатые пластинчатые структуры.Четыре основных типа взаимодействий притяжения определяют форму и стабильность третичной структуры белков. Вы уже изучали несколько из них.
- Ионная связь. Ионные связи возникают в результате электростатического притяжения между положительно и отрицательно заряженными боковыми цепями аминокислот. Например, взаимное притяжение между ионом карбоксилата аспарагиновой кислоты и ионом аммония лизина помогает поддерживать определенную складчатую область белка (часть (a) рисунка \(\PageIndex{5}\)).

- Водородная связь. Водородная связь образуется между сильно электроотрицательным атомом кислорода или атомом азота и атомом водорода, присоединенным к другому атому кислорода или атому азота, например, в боковых цепях полярных аминокислот. Водородные связи (а также ионные притяжения) чрезвычайно важны как для внутримолекулярных, так и для межмолекулярных взаимодействий белков (часть (b) рисунка \(\PageIndex{5}\)).
- Дисульфидные связи. Две аминокислотные единицы цистеина могут сближаться по мере того, как молекула белка складывается. Последующее окисление и соединение атомов серы в высокореакционноспособных сульфгидрильных (SH) группах приводит к образованию цистина (часть (c) рисунка \(\PageIndex{5}\)). Внутрицепочечные дисульфидные связи обнаружены во многих белках, включая инсулин (желтые столбцы на рисунке \(\PageIndex{1}\)) и оказывают сильное стабилизирующее действие на третичную структуру.
- Силы рассеивания. Дисперсионные силы возникают, когда обычно неполярный атом становится на мгновение полярным из-за неравномерного распределения электронов, что приводит к мгновенному диполю, который вызывает сдвиг электронов в соседнем неполярном атоме.
 Дисперсионные силы слабы, но могут быть важны, когда другие типы взаимодействий либо отсутствуют, либо минимальны (часть (d) рисунка \(\PageIndex{5}\)). Так обстоит дело с фиброином, основным белком шелка, в котором значительная доля аминокислот в белке имеет неполярные боковые цепи. Срок гидрофобное взаимодействие часто ошибочно используют как синоним дисперсионных сил. Гидрофобные взаимодействия возникают из-за того, что молекулы воды вступают в водородные связи с другими молекулами воды (или группами белков, способными образовывать водородные связи). Поскольку неполярные группы не могут образовывать водородные связи, белок сворачивается таким образом, что эти группы погребены во внутренней части белковой структуры, сводя к минимуму их контакт с водой.
Дисперсионные силы слабы, но могут быть важны, когда другие типы взаимодействий либо отсутствуют, либо минимальны (часть (d) рисунка \(\PageIndex{5}\)). Так обстоит дело с фиброином, основным белком шелка, в котором значительная доля аминокислот в белке имеет неполярные боковые цепи. Срок гидрофобное взаимодействие часто ошибочно используют как синоним дисперсионных сил. Гидрофобные взаимодействия возникают из-за того, что молекулы воды вступают в водородные связи с другими молекулами воды (или группами белков, способными образовывать водородные связи). Поскольку неполярные группы не могут образовывать водородные связи, белок сворачивается таким образом, что эти группы погребены во внутренней части белковой структуры, сводя к минимуму их контакт с водой.

Когда белок содержит более одной полипептидной цепи, каждая цепь называется субъединицей . Расположение нескольких субъединиц представляет собой четвертый уровень структуры, четвертичную структуру белка. Гемоглобин с четырьмя полипептидными цепями или субъединицами является наиболее часто упоминаемым примером белка, имеющего четвертичную структуру (рис. \(\PageIndex{6}\)). Четвертичная структура белка создается и стабилизируется посредством тех же взаимодействий, которые создают и поддерживают третичную структуру. Схематическое изображение четырех уровней структуры белка показано на рисунке \(\PageIndex{7}\).
Рисунок \(\PageIndex{6}\) Четвертичная структура гемоглобина. Гемоглобин — это белок, который переносит кислород по всему телу. Источник: Изображение из PDB RCSB (www.pdb.org(opens in new window)) PDB ID 1I3D (R.D. Kidd, H.M. Baker, A.J. Mathews, T. Brittain, E.N. Baker (2001) Олигомеризация и связывание лиганда в гомотетрамерный гемоглобин: две кристаллические структуры высокого разрешения гемоглобина Барта (гамма (4)), маркер альфа-талассемии. Protein Sci. 1739–1749).
Protein Sci. 1739–1749).
Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может закручиваться в α-спираль, которая является одним из типов вторичной структуры . Этот спиральный сегмент включен в третичную структуру свернутой полипептидной цепи. Одиночная полипептидная цепь представляет собой субъединицу, которая составляет четвертичную структуру белка, такого как гемоглобин, который имеет четыре полипептидные цепи.
Денатурация белков
Высокоорганизованные структуры белков — поистине шедевры химической архитектуры. Но высокоорганизованные структуры, как правило, обладают определенной деликатностью, и это относится к белкам. Денатурация — это термин, используемый для обозначения любого изменения трехмерной структуры белка, которое делает его неспособным выполнять возложенную на него функцию. Денатурированный белок не может выполнять свою работу. (Иногда денатурацию приравнивают к осаждению или коагуляции белка; наше определение немного шире.) Широкий спектр реагентов и условий, таких как тепло, органические соединения, изменения pH и ионы тяжелых металлов, могут вызывать денатурацию белка (рис. \(\PageIndex{1}\)).
(Иногда денатурацию приравнивают к осаждению или коагуляции белка; наше определение немного шире.) Широкий спектр реагентов и условий, таких как тепло, органические соединения, изменения pH и ионы тяжелых металлов, могут вызывать денатурацию белка (рис. \(\PageIndex{1}\)).
| Метод | Влияние на структуру белка |
|---|---|
| Нагрев выше 50°C или ультрафиолетовое (УФ) излучение | Тепловое или УФ-излучение придает кинетическую энергию белковым молекулам, заставляя их атомы вибрировать быстрее и разрушая относительно слабые водородные связи и дисперсионные силы. |
| Использование органических соединений, таких как этиловый спирт | Эти соединения способны образовывать межмолекулярные водородные связи с белковыми молекулами, разрушая внутримолекулярные водородные связи внутри белка. |
| Соли ионов тяжелых металлов, таких как ртуть, серебро и свинец | Эти ионы образуют прочные связи с карбоксилатными анионами кислых аминокислот или SH-группами цистеина, разрушая ионные и дисульфидные связи. |
| Алкалоидные реагенты, такие как дубильная кислота (используемая при дублении кожи) | Эти реагенты объединяются с положительно заряженными аминогруппами в белках, разрушая ионные связи. |
Любой, кто жарил яйцо, наблюдал денатурацию. Прозрачный яичный белок становится непрозрачным по мере денатурации и коагуляции альбумина. Никто еще не обратил вспять этот процесс. Однако при соответствующих обстоятельствах и достаточном количестве времени белок, развернувшийся в достаточно щадящих условиях, может снова свернуться и снова проявить биологическую активность (рис. \(\PageIndex{8}\)). Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Данная последовательность аминокислот, по-видимому, естественным образом принимает свое конкретное трехмерное расположение, если условия правильные.
\(\PageIndex{8}\)). Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Данная последовательность аминокислот, по-видимому, естественным образом принимает свое конкретное трехмерное расположение, если условия правильные.
Первичные структуры белков достаточно прочны. Как правило, для гидролиза пептидных связей необходимы довольно энергичные условия. Однако на вторичном и четвертичном уровнях белки весьма уязвимы для атаки, хотя их уязвимость к денатурации различается. Аккуратно свернутые глобулярные белки гораздо легче денатурировать, чем жесткие волокнистые белки волос и кожи.
Резюме
Белки можно разделить на две категории: волокнистые, которые обычно нерастворимы в воде, и глобулярные, которые лучше растворяются в воде. Белок может иметь до четырех уровней структуры. Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы. Четыре основных типа взаимодействий притяжения определяют форму и стабильность свернутого белка: ионная связь, водородная связь, дисульфидные связи и дисперсионные силы. Широкий спектр реагентов и условий может вызвать разворачивание или денатурацию белка.
Белок может иметь до четырех уровней структуры. Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы. Четыре основных типа взаимодействий притяжения определяют форму и стабильность свернутого белка: ионная связь, водородная связь, дисульфидные связи и дисперсионные силы. Широкий спектр реагентов и условий может вызвать разворачивание или денатурацию белка.
24.9: Proteins распространяется под лицензией CC BY-NC-SA 3.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- аминокислота
- Денатурация
- дисульфидная связь
- волокнистый белок
- глобулярный белок
- основная конструкция
- белок
- четвертичная структура
- вторичная структура
- третичная структура
- цвиттерион
Белок | Определение, структура и классификация
пептид
Посмотреть все средства массовой информации
- Ключевые люди:
- Джон Б.
 Фенн
Ричард Хендерсон
Джордж П. Смит
Тасуку Хондзё
Уильям Г. Кэлин-младший
Фенн
Ричард Хендерсон
Джордж П. Смит
Тасуку Хондзё
Уильям Г. Кэлин-младший
- Похожие темы:
- фермент интерферон фактор транскрипции прион фосфорилирование белка
- Выдающиеся лауреаты:
- Родни Роберт Портер
Просмотреть весь связанный контент →
Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для последующего использования у животных. Когда животное потребляет избыточное количество белков, они превращаются в жиры (глюкозу или триглицериды) и используются для получения энергии или создания запасов энергии. Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной активности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
белки
Посмотреть все видео к этой статье белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных друг с другом в длинные цепи, подобно тому, как бусины расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка исходя из его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, входящих в состав белков.
Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, например, жвачным животным (например, коровам), требуется очень большое количество растительного материала, чтобы удовлетворить свои потребности в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0169 см. питание человека).
Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, например, жвачным животным (например, коровам), требуется очень большое количество растительного материала, чтобы удовлетворить свои потребности в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0169 см. питание человека).
Содержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Викторина «Британника»
Викторина «Медицинские термины и пионеры»
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые наиболее важные белки, такие как ферменты и гормоны, встречаются в очень малых количествах. Важность белков связана главным образом с их функцией. Все ферменты, идентифицированные до сих пор, являются белками. Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму накапливать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.


