Нарушение баланса стероидных гормонов при ожирении и метаболическом синдроме у мужчин моложе 40 лет
Исследования последних лет свидетельствуют о связи между нарушениями метаболизма кортикостероидов и развитием ожирения и метаболического синдрома (МС) [1, 2]. Альдостерон рассматривается в качестве важного фактора в патогенезе сердечно-сосудистой патологии и формировании инсулинорезистентности [3—5]. Продемонстрированы положительное влияние блокаторов рецепторов и антагонистов минералокортикоидов на течение сердечно-сосудистой и почечной патологии при ожирении, МС и диабете [6]. Эффекты альдостерона реализуются посредством минералокортикоидных рецепторов (МР), которые представлены не только в известных органах-мишенях (почки, толстая кишка, слюнные и потовые железы), но и в адипоцитах, кардиомиоцитах, фибробластах, скелетной мускулатуре, гладкомышечных элементах и эндотелии сосудистой оболочки. Они обладают высокой аффинностью как к альдостерону, так и к кортизолу [7, 8].
Важно отметить, что на фоне успешных поисков молекулярных механизмов реализации неблагоприятного влияния альдостерона на чувствительность к инсулину и сердечно-сосудистую систему вопрос о сопряжении этих эффектов с повышенным уровнем альдостерона в крови при МС и ожирении остается дискуссионным.
В задачу нашего исследования входило выяснить: изменяется ли профиль стероидных гормонов в крови у молодых мужчин в узком возрастном диапазоне (20—40 лет) с избыточной массой тела и ожирением, а также насколько эти изменения ассоциированы с формированием МС.
Материал и методы
Обследовали 84 молодых мужчин в возрасте 19— 40 лет с избыточной массой тела и ожирением — индекс массы тела (ИМТ) 27,1—35,5 кг/м2. Из них у 34 (ИМТ 28,1—35,7 кг/м2) выявлены 3 признака МС и более (группа 1 МС+): абдоминальное ожирение — окружность талии (ОТ) >102 см; триглицериды (ТГ) ≥1,7 ммоль/л; липопротеины высокой плотности (ЛПВП) <1 ммоль/л; артериальная гипертензия — артериальное давление (АД) ≥ 130/85 мм рт.ст.; гликемия натощак ≥6,1 ммоль/л.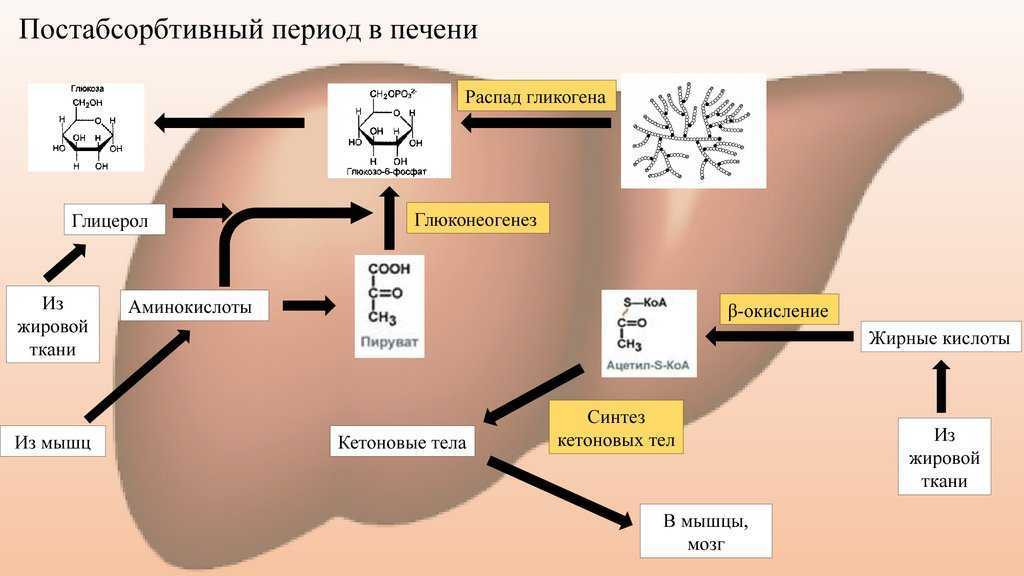
В группу 2 (МС–) входили 26 мужчин с избыточной массой тела и ожирением, у которых отсутствовал комплекс соответствующих признаков.
Группа 3 (контроль) состояла из 24 здоровых мужчин в возрасте 22—38 лет с ИМТ 21—24,1 кг/м2.
Критериями исключения являлись сахарный диабет, нарушения функции щитовидной железы, булимия, тяжелые заболевания печени и почек, прием гормональных препаратов за 3 мес до начала исследования.
Определение гормонов и биохимических показателей у мужчин проводили в утренних пробах сывороток (8.00—9.30 ч).
Площадь висцеральной и подкожной жировой ткани на уровне L4—L5 оценивали методом магнитно-резонансной томографии (аппарат Magnetom Impact, фирмы «Siemens», Германия).
Биохимические исследования натощак включали определение глюкозы и липидов в сыворотке — общего холестерина, липопротеинов низкой плотности ЛПНП, ЛПВП, ТГ (автоматический анализатор Hitachi 912 фирмы «Roche», Франция).
Тестостерон и кортизол определяли методом усиленной хемилюминесценции (Ortho-Clinical Diagnostics, «J&J») на автоматическом анализаторе Vitros Eci. Глобулин, связывающий половые гормоны (ГСПГ) и инсулин определяли методом отсроченной во времени флюоресценции (Delfia) на анализаторе Autodelfia, ДГЭА-сульфат — твердофазным иммуноферментным методом (IBL, Германия), альдостерон — РИА-методом (IMMUNOTECH, Франция).
Данные представлены в виде медианы и 10-й и 90-й процентили. Нормальность распределения оценивали по критерию Шапиро-Уилка. Анализ различий исследуемых показателей в трех группах проводили методом Краскела—Уоллиса. Значимость различий между отдельными группами оценивали с помощью критерия Манна—Уитни. Различия считали достоверными при р<0,05. Связь исследованных показателей определяли регрессионным анализом с предварительным Log-преобразованием числовых значений. Ассоциированность уровней стероидных гормонов с МС проводили методом логистического регрессионного анализа./17/17_2.jpg)
Результаты и обсуждение
Клинико-лабораторная характеристика мужчин трех групп представлена в табл. 1.
Возрастных различий между группами не было.
Показатели ИМТ, от площади висцеральной и подкожной жировой ткани, АД, ТГ, ЛПНП, глюкозы, инсулина, расчетного индекса инсулинорезистентности HOMA, систолического АД (САД) и дистолического АД (ДАД) прогрессивно увеличивались в направлении контроль→ожирение→МС (диапазон оценки линии тренда: r=0,329—0,875; p=0,002—0,000). Относительно ЛПВП зарегистрирована обратная зависимость (r=–0,503; p=0,000).
В группе пациентов без МС содержание альдостерона было на 23% выше, чем в контрольной группе — 327 (124—841) и 224 (149—447) пмоль/л соответственно (p=0,071). В группе пациентов с МС наблюдали дальнейшее повышение его уровня — 422 (186—1049) пмоль/л и различия с контрольной группой достигали статистической значимости (рис. 1).Рисунок 1. Содержание альдостерона в сыворотке мужчин разных групп. Линия тренда в направлении групп контроль-ожирение — МС: r=0,414, р=0,0009).
1).Рисунок 1. Содержание альдостерона в сыворотке мужчин разных групп. Линия тренда в направлении групп контроль-ожирение — МС: r=0,414, р=0,0009).
Динамика уровня андрогенов характеризуется противоположной направленностью: максимальные значения отмечены в контрольной группе, а минимальные — у мужчин с МС (рис. 2).Рисунок 2. Содержание тестостерона в сыворотке мужчин разных групп. Линия тренда: r=–0,603; p=0,000. Содержание Т у мужчин с ожирением без МС ниже (р=0,037), чем в группе контроля. У мужчин с МС наблюдали дальнейшее понижение уровня Т (р=0,001), и у 44% мужчин данной группы уровень Т был за пределами нижней границы референсных значений гормона (11—33 нмоль/л). Аналогичный показатель у мужчин с ожирением без МС составляет 23%.
Средние показатели надпочечникового андрогена ДГЭА-сульфата также проявляют устойчивую тенденцию к снижению в направлении контроль →МС–→МС+ (рис. 3).Рисунок 3. Содержание ДГЭА-сульфата в сыворотке мужчин разных групп. У пациентов с избыточной массой тела и ожирением содержание гормона в сравнении с контролем падает на 23%, а в группе МС+ — на 40%, отличия от контроля достигают значимости только в группе МС+ (р=0,047).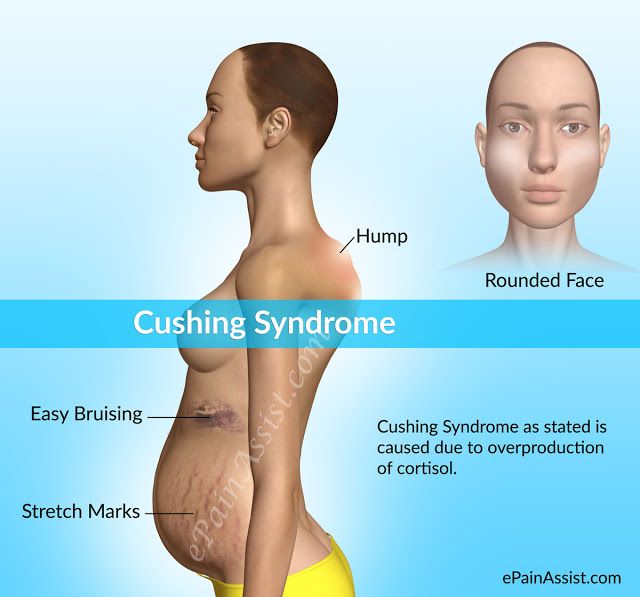
С нарастанием концентрации альдостерона повышается АД (r=0,312, p=0,011), увеличивается ОТ (r=0,320, p=0,003), уровень ТГ (r=0,284, p=0,009), ИМТ (r=0,339, p=0,001) и снижаются ЛПВП (r=0,292, p=0,019). Связи альдостерона, а также кортизола с инсулином и показателями HOMA не достигают значимых величин.
Результаты обратной пошаговой многофакторной регрессионной модели с включением всех указанных факторов показывают, что все эти связи опосредованы прежде всего прямой взаимосвязью уровня альдостерона и ИМТ (r=0,476, p=0,0001). Уровни альдостерона ассоциируются с МС (относительный шанс — ОШ — 0,43, 95%, доверительный интервал — ДИ — 0,21—0,89, р=0,024). Однако при поправке на ИМТ ассоциация альдостерона с МС утрачивает независимую значимость (ОШ 0,98, 95% ДИ 0,93—1,02, р=0,432).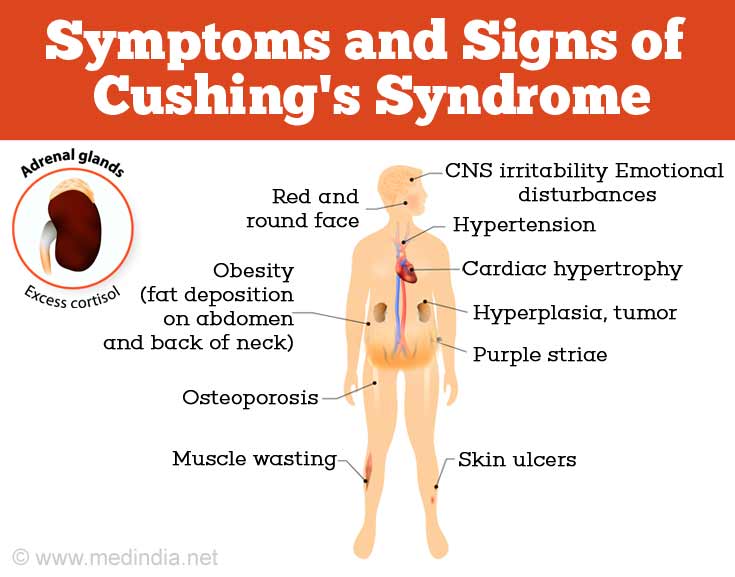
Снижение уровня Т коррелируется с увеличением ОТ (r=0,621, p=0,000), САД (r=–0,456, p=0,000), ИМТ (r=–0,579, p=0,000), содержанием ТГ (r=–0,508, p=0,000), инсулина (r=–0,558, p=0,000), инсулинорезистентностью (r=–0,581, p=0,000), площадью висцеральной жировой ткани (r=–0,455, p=0,0003) и снижением ЛПВП (r=0,292, p=0,002). Пошаговый мультифакторный анализ взаимосвязи Т и совокупности перечисленных факторов (r=0,689, р=0,000) показал, что основными независимыми предикторами динамики Т в процессе формирования ожирения и МС у молодых мужчин остаются показатели инсулина (r=–0,379, р=0,0002) и ИМТ (r=–0,414, р=0,000). Снижение уровня Т ассоциировано с формированием МС (ОШ 1,33, 95% ДИ 1,28—1,52, р=0,001). При включении в логистическую модель основных независимых предикторов динамики Т (ИМТ и инсулин) сохраняется значимая независимая ассоциация Т и МС, но не инсулина (ОШ 1,25, 95% ДИ 1,11—1,41, р=0,006), а при включении в модель ИМТ сохраняются значимые независимые ассоциации и для Т, и для ИМТ.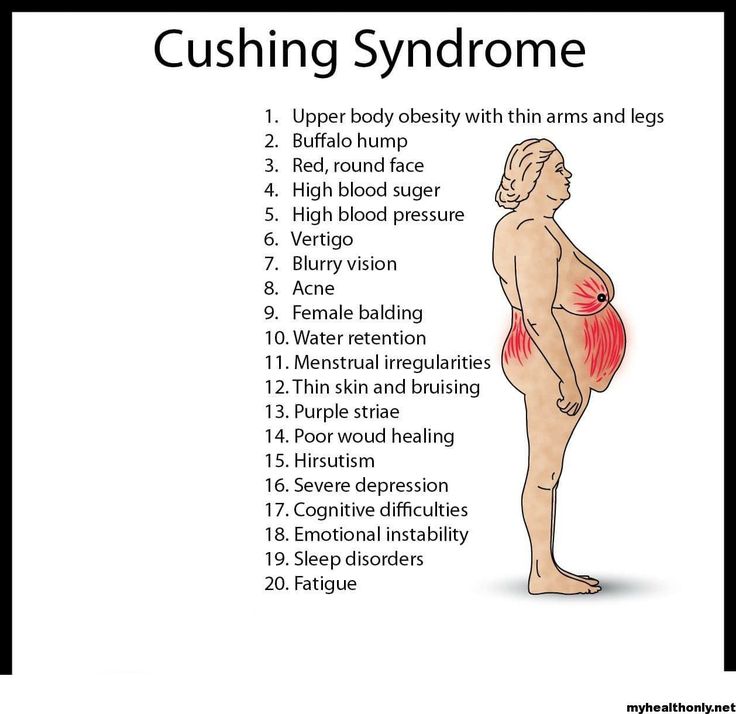
Тенденция к снижению содержания ДГЭАС коррелируется с повышением АД (r=–0,299, р=0,006), уровня триглицеридов (r=–0,221, р=0,045 и инсулинорезистентностью (r=–0,274, р=0,016). Результаты многофакторного анализа по совокупности предикторных факторов и с поправкой на ИМТ показали, что основной значимой связью ДГЭАС в данной модели являются показатели инсулинорезистентности HOMA. Уровень ДГЭАС ассоциируется с МС (ОШ 3,28, 95% ДИ 1,18—9,09, р=0,014). Однако включение в логистическую модель показателя инсулинорезистентности HOMA, основного предиктора ДГЭАС, нивелирует статистическую значимость ассоциации.
Таким образом, у молодых мужчин в возрасте 20—40 лет в процессе формирования избыточной массы тела, ожирения и МС наблюдается устойчивый тренд к смещению показателей альдостерона к верхней границе нормы и за ее пределы в направлении контроль→ожирение→МС.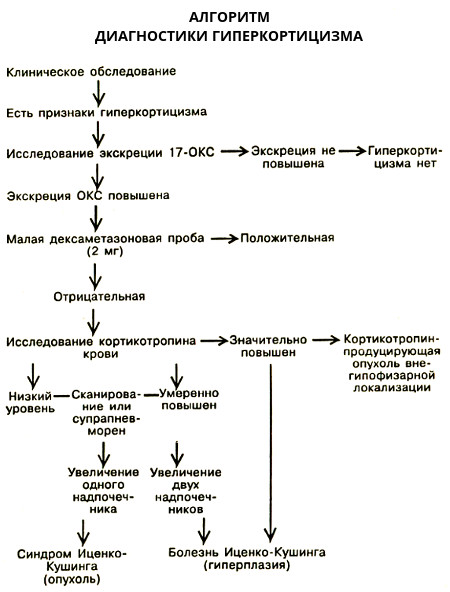 При этом наблюдается прямая связь динамики альдостерона с такими критериями МС, как АД, ОТ, ТГ, и обратная — с ЛПВП. Однако независимым предиктором динамики альдостерона является ИМТ; последний служит предиктором экскреции альдостерона и у пациентов без повышения АД, но с ожирением и при солевой нагрузке [11].
При этом наблюдается прямая связь динамики альдостерона с такими критериями МС, как АД, ОТ, ТГ, и обратная — с ЛПВП. Однако независимым предиктором динамики альдостерона является ИМТ; последний служит предиктором экскреции альдостерона и у пациентов без повышения АД, но с ожирением и при солевой нагрузке [11].
Мы не обнаружили существенного увеличения в содержании альдостерона у пациентов с МС в сравнении с пациентами с ожирением без МС. Возможно, что в процессе формирования избыточной жировой ткани постепенно нарастает концентрация альдостерона, которая в совокупности с динамикой других предрасполагающих факторов способствует возникновению кластера метаболических нарушений. Полученные нами результаты подтверждаются данными клинических наблюдений, в которых регистрируется повышение уровня альдостерона у пациентов с ожирением, особенно висцеральным [12, 13].
В физиологических условиях ангиотензин II, конечный продукт ренин-ангиотензиновой системы, рассматривается как главный гормональный фактор, стимулирующий секрецию альдостерона клубочковой зоной коры надпочечников.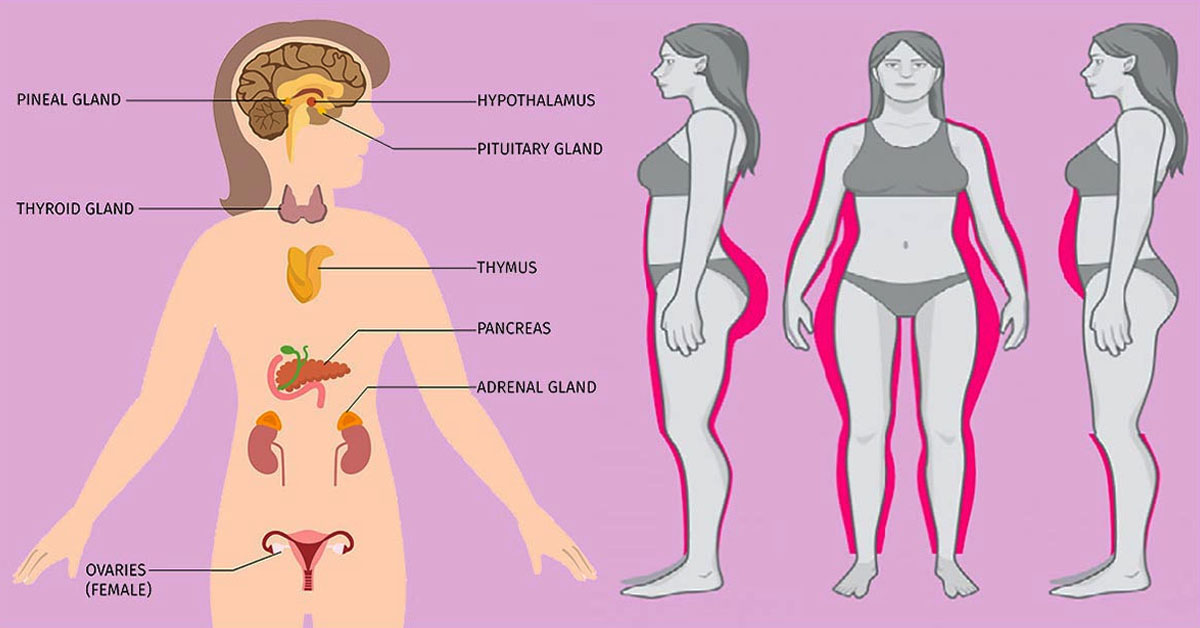 Эффект реализуется посредством адреналовых рецепторов ангиотензина II подтип АТ1Р [14, 15]. Причиной повышения уровня альдостерона при ожирении и МС, возможно, является сопутствующая ожирению активация ренин-ангиотензиновой системы. При наличии избыточной массы тела и ожирения ответная реакция альдостерона на стимуляцию ангиотензином II и солевую нагрузку значительно возрастает. Уменьшение массы тела снижает содержание альдостерона в плазме и улучшает чувствительность к инсулину у пациентов с повышенным и нормальным АД, что подтверждает прямую связь альдостерона с ИМТ [16, 17].
Эффект реализуется посредством адреналовых рецепторов ангиотензина II подтип АТ1Р [14, 15]. Причиной повышения уровня альдостерона при ожирении и МС, возможно, является сопутствующая ожирению активация ренин-ангиотензиновой системы. При наличии избыточной массы тела и ожирения ответная реакция альдостерона на стимуляцию ангиотензином II и солевую нагрузку значительно возрастает. Уменьшение массы тела снижает содержание альдостерона в плазме и улучшает чувствительность к инсулину у пациентов с повышенным и нормальным АД, что подтверждает прямую связь альдостерона с ИМТ [16, 17].
Сложный вопрос о причинно-следственной связи уровня альдостерона и инсулинорезистентности остается нерешенным. Существует точка зрения, что наряду с ангиотензином II, уровень инсулина и степень инсулинорезистентности участвуют в активации секреции альдостерона при ожирении [18]. С другой стороны, избыток альдостерона подавляет действие инсулина в тканях-мишенях и, тем самым, способствует повышению инсулинорезистентности [19], а блокада МР снижает инсулинорезистентность и улучшает поглощение глюкозы мышечной тканью [6].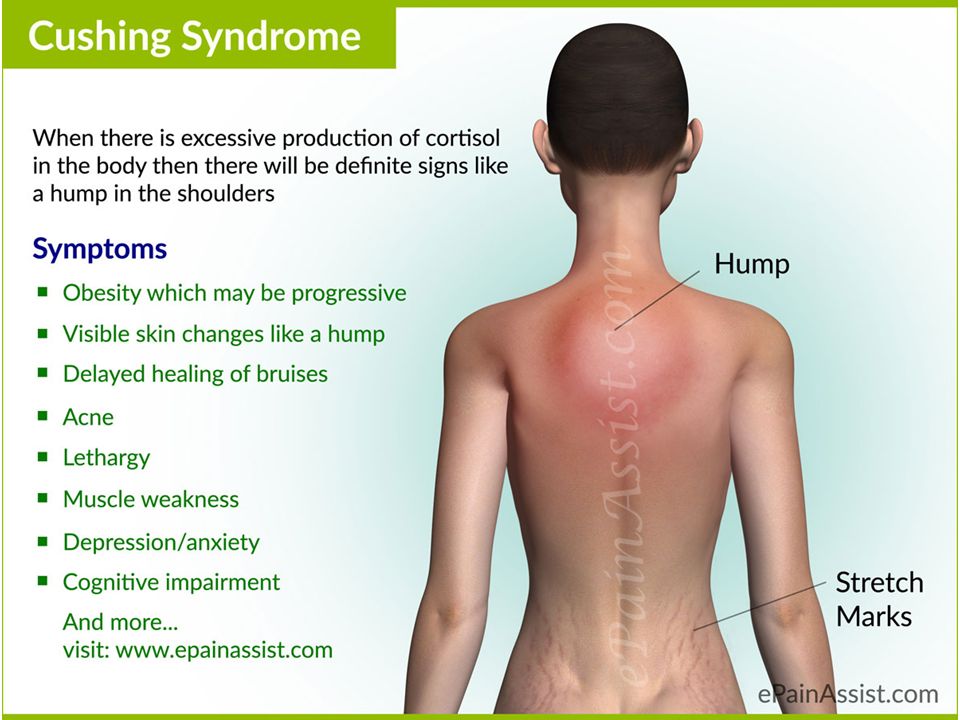 У обследованных молодых мужчин с диапазоном ИМТ 20—36 кг/м2 мы не обнаружили значимой связи между уровнями альдостерона и инсулина. Возможно различия обусловлены возрастными особенностями обследованной нами популяции (20—40 лет, а в подавляющем большинстве работ 40—70 лет), а также отсутствием клинически выраженных нарушений АД.
У обследованных молодых мужчин с диапазоном ИМТ 20—36 кг/м2 мы не обнаружили значимой связи между уровнями альдостерона и инсулина. Возможно различия обусловлены возрастными особенностями обследованной нами популяции (20—40 лет, а в подавляющем большинстве работ 40—70 лет), а также отсутствием клинически выраженных нарушений АД.
В предшествующей публикации мы проводили анализ возможных механизмов взаимосвязи уровня Т и нарушений антропометрических и метаболических показателей, включая все компоненты кластера МС [20]. В продолжении этих исследований в представленной работе показана высокая степень ассоциации уровня Т с МС. Более того, как показали результаты проспективного исследования, сниженный уровень Т является информативным предиктором риска развития МС, особенно в группе лиц 20—39 лет [21]. Результаты цитируемой работы свидетельствуют о том, что снижение уровня Т может предшествовать формированию МС, т.е. указывают на возможный вклад низкого уровня Т в формирование МС. Одновременно нельзя исключить, что снижение уровня Т является ранним признаком уже включившихся патогенетических механизмов, которые в конечном итоге приводят к ожирению и МС. Имеются аргументы в пользу обоих предположений. Уменьшение массы тела у пациентов с ожирением и МС сопровождается повышением концентрации Т и ГСПГ [22]. На рис. 5Рисунок 5. Динамика содержания тестостерона в крови у пациента Б., 25 лет, с ожирением в процессе уменьшения массы тела. представлена разнонаправленная динамика показателей Т и массы тела у молодого мужчины (25 лет) до и после 6 нед терапии ксеникалом в комбинации с диетой. Масса тела снизилась на 8 кг, а содержание Т в крови увеличилось с 7,7 до 13,3 нмоль/л. Возможно, у молодых пациентов избыточная масса тела вызывает обратимую дисфункцию клеток Лейдига семенников и целевая комплексная терапия с уменьшением массы тела способствует нормализации секреции Т.
Одновременно нельзя исключить, что снижение уровня Т является ранним признаком уже включившихся патогенетических механизмов, которые в конечном итоге приводят к ожирению и МС. Имеются аргументы в пользу обоих предположений. Уменьшение массы тела у пациентов с ожирением и МС сопровождается повышением концентрации Т и ГСПГ [22]. На рис. 5Рисунок 5. Динамика содержания тестостерона в крови у пациента Б., 25 лет, с ожирением в процессе уменьшения массы тела. представлена разнонаправленная динамика показателей Т и массы тела у молодого мужчины (25 лет) до и после 6 нед терапии ксеникалом в комбинации с диетой. Масса тела снизилась на 8 кг, а содержание Т в крови увеличилось с 7,7 до 13,3 нмоль/л. Возможно, у молодых пациентов избыточная масса тела вызывает обратимую дисфункцию клеток Лейдига семенников и целевая комплексная терапия с уменьшением массы тела способствует нормализации секреции Т.
С другой стороны, по данным ряда авторов, компенсация дефицита Т экзогенными препаратами снижает ИМТ, нивелирует дислипидемию и инсулинорезистентность [23—25].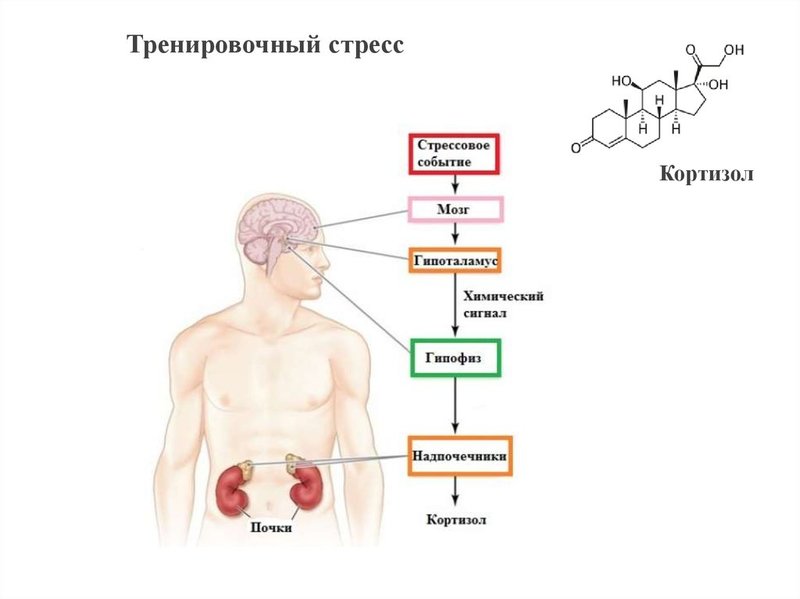 В любом случае ожирение и МС сопряжены со снижением уровня Т, но вопрос о том, является ли низкий уровень Т следствием или причиной данного тандема, остается невыясненным.
В любом случае ожирение и МС сопряжены со снижением уровня Т, но вопрос о том, является ли низкий уровень Т следствием или причиной данного тандема, остается невыясненным.
Выявленная нами тенденция к снижению уровня ДГЭАС ассоциирует с формированием МС у молодых мужчин. Однако включение в логистическую модель показателя инсулинорезистентности HOMA нивелирует статистическую значимость ассоциации. Отсутствие значимой самостоятельной ассоциации сниженной концентрации ДГЭАС с МС согласуется с результатами единичных исследований у мужчин старших возрастных групп [21, 26].
Таким образом, из всех исследованных нами стероидных гормонов только Т независимо ассоциируется с МС. Нарастание концентрации альдостерона при ожирении протекает параллельно с увеличением показателей ИМТ, и увеличение уровня альдостерона при МС опосредовано именно ИМТ, увеличение которого является одним из первых диагностических критериев МС [27]. Снижение уровня ДГЭАС у молодых людей связано с нарастанием показателей инсулинорезистентности в направлении контроль→ожирение→МС.
Выводы
1. У молодых мужчин в возрасте 20—40 лет в процессе формирования избыточной массы тела, ожирения и МС наблюдается устойчивый тренд к смещению показателей альдостерона к верхней границе нормы и за ее пределы в направлении контроль→ожирение→МС. Однако при поправке на ИМТ ассоциация альдостерона с МС утрачивает независимую значимость.
2. Содержание Т у молодых мужчин смещается к нижней границе нормы и за ее пределы в направлении контроль→ожирение→МС. Основными предикторами динамики Т в процессе формирования ожирения и МС у молодых мужчин являются показатели инсулина и ИМТ.
3. Содержание ДГЭАС проявляет тенденцию к снижению, которое достигает значимости у мужчин с МС. Основным предиктором динамики ДГЭАС у молодых мужчин является нарастание инсулинорезистентности в направлении контроль→ожирение→МС.
4. У молодых людей с ожирением и МС отсутствуют изменения в показателях кортизола в периферической крови.
Блокада ровно одного белка справилась с ожирением, тревогой и хроническими болями.
 Это белок, который связывается с рецепторами кортизола в гипоталамусе и снижает их эффективность — Наука
Это белок, который связывается с рецепторами кортизола в гипоталамусе и снижает их эффективность — НаукаБелок FKBP51 участвует в регуляции системы «гипоталамус — гипофиз — надпочечники». Работа этой системы непосредственно связана с эффектом стресса. В ответ на стресс гипоталамус вырабатывает кортиколиберин. Это вещество вызывает выработку адренокортикотропного гормона в гипофизе, а под действием этого гормона надпочечники синтезируют гормон стресса — кортизол. Под действием кортизола учащается сердцебиение, растет кровяное давление, уменьшается потребление глюкозы, чтобы ее как можно дольше хватало (это может пригодиться в условиях, вызвавших стресс).
Хотя стресс — это механизм адаптации к сложным условиям, он сам может стать проблемой. Например, вызвать ожирение, так как организм под его действием стремится запасать, а не тратить глюкозу. Стрессовое состояние — один из маркеров тревожного расстройства, когда ответ на угрозу происходит без реальной угрозы. Кроме того, кортизол подавляет иммунную систему, что тоже может быть чревато, если стресс частый.
Кроме того, кортизол подавляет иммунную систему, что тоже может быть чревато, если стресс частый.
Система «гипоталамус — гипофиз — надпочечники» регулируется по принципу отрицательной обратной связи. Это значит, что ее работу запускает низкий уровень кортизола. Если этого гормона мало, гипоталамус начинает вырабатыватьь кортиколиберин и так далее, по цепочке. Кортизол связывается со специальными рецепторами в гипоталамусе, и если его становится слишком много, то гипоталамус перестает «варить» кортизол, пока уровень гормона снова не упадет.
Белок FKBP51, как оказалось, связывается с рецепторами, специфическими для кортизола в гипоталамусе, и снижает их эффективность. Это значит, что под действием белка гипоталамус не успокоится и кортизола меньше не станет, что приведет к неприятным последствиям постоянного стресса, описанным выше.
Ученые изучили белок и определили его активный центр, то есть то место, которым он умеет связываться с рецептором. Они нашли лиганд — вещество под названием SAFit2, которое тоже подходит к активному центру фермента FKBP51. Таким образом, можно заместить белок и не допустить его до рецепторов, чувствительных к кортизолу.
Они нашли лиганд — вещество под названием SAFit2, которое тоже подходит к активному центру фермента FKBP51. Таким образом, можно заместить белок и не допустить его до рецепторов, чувствительных к кортизолу.
На собрании Американского химического общества автор исследований по этой теме рассказал про уже практические успехи, которых ему с коллегами удалось достичь за последние годы, изучая FKBP51.
Во-первых, — и это самое последнее открытие — удалось уменьшить стресс у мышей. Животных лечили SAFit2 и эсциталопрамом, распространенным препаратом от депрессии и тревожного расстройства, который блокирует обратный захват серотонина. Чтобы выяснить, как сработают лекарства, мышей опускали в сосуд с водой, из которого нельзя выбраться, и ждали, когда те сдадутся и перестанут грести. Дольше всего упирались как раз те, кого лечили обоими препаратами, причем эффект был синергическим, то есть такие мыши были стрессоустойчивее, чем другие, которых лечили только антидепрессантом или SAFit2.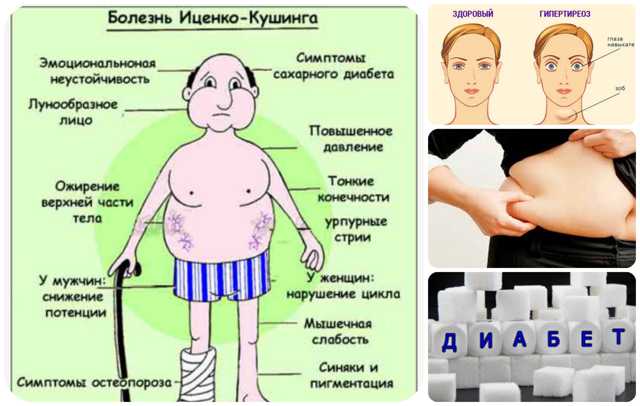
Во-вторых, выяснилось, что отключение FKBP51 сдерживает ожирение. Мыши, которые сидели на диете, богатой жирами, не набирали массу, если у них блокировали белок FKBP51 с помощью лиганда. Как пишут ученые, такая диета — сама по себе стресс-фактор, а кортизол еще и уменьшал усвоение глюкозы и накопление жира, что приводило к ожирению. Заблокированный же FKBP51 не мешал нормальному усвоению глюкозы, так что грызуны оставались в форме.
В-третьих, блокада белка FKBP51 снизила чувствительность к боли у грызунов. Мышам делали разрез кожи на ноге, а затем испытывали их с помощью нитей фон Фрея — под прямым углом прижимали нить к коже, как бы кололи ей, пока нить не начнет сгибаться. Нити фон Фрея разной жесткости, и по жесткости нити, от которой мышь отдернет лапу, можно понять, как сильна ее чувствительность к боли. Животные, которых лечили блокадой с помощью SAFit2, переносили боль намного лучше контрольных — чувствительность снизилась более, чем в два раза. По мнению авторов работы, блокада FKBP51 поможет людям, страдающим от хронических болей.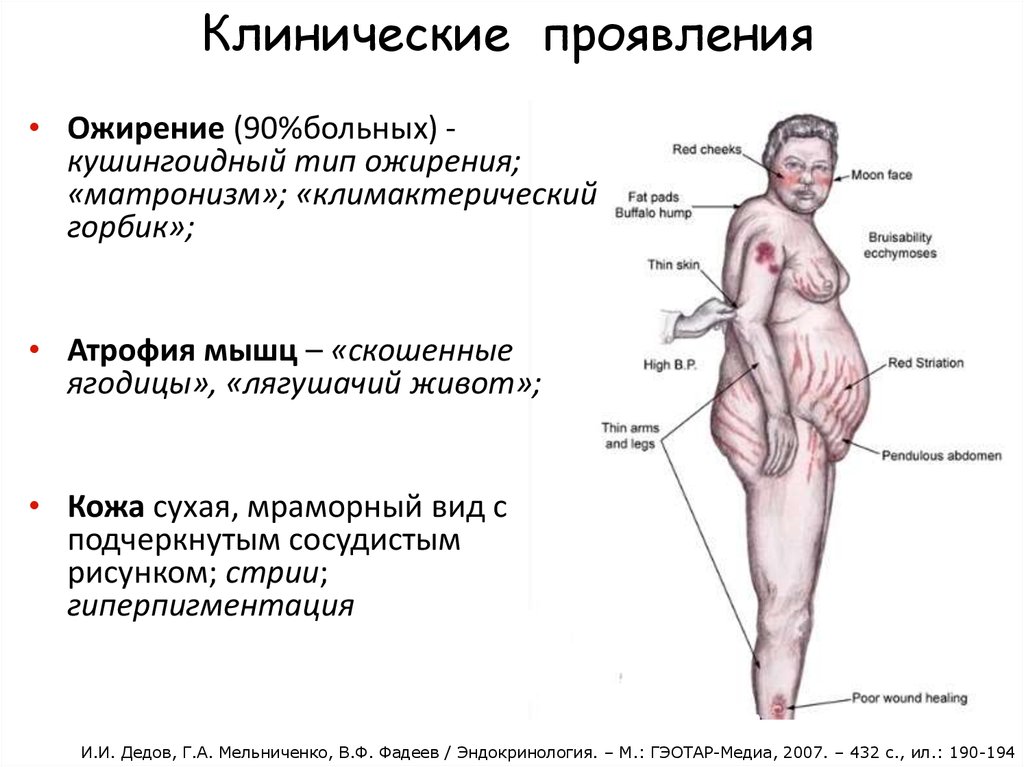
По словам ведущего автора исследований ингибитора белка FKBP51, SAFit2 пока не годится для лечения людей. Ученые работают над его модификацией, потому что, как сказано в заключении одной из их статей, «показатели растворимости, метаболической стабильности и пероральной биодоступности SAFit2 далеки от желаемых для лекарственного средства для центральной нервной системы».
Максим Абдулаев
Роль утреннего кортизола плазмы в ожирении: двунаправленное менделевское рандомизированное исследование | Журнал клинической эндокринологии и метаболизма
Журнальная статья
Получить доступ
Сяохуэй Ци,
Сяохуэй Ци
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Бин Цуй,
Бин Цуй
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Мин Цао
Мин Цао
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Журнал клинической эндокринологии и метаболизма , том 107, выпуск 5, май 2022 г. , страницы e1954–e1960, https://doi.org/10.1210/clinem/dgac008
, страницы e1954–e1960, https://doi.org/10.1210/clinem/dgac008
Опубликовано:
209 января История статьи
Получено:
17 сентября 2021 г.
Решение редакции:
05 января 2022 г.
Опубликовано:
09 января 2022 г.
9 Исправлено и набрано:0003
21 января 2022 года
Фильтр поиска панели навигации The Journal of Clinical Endocrinology & MetabolismThis issueEndocrine Society JournalsClinical MedicineEndocrinology and DiabetesMedicine and HealthBooksJournalsOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации The Journal of Clinical Endocrinology & MetabolismThis issueEndocrine Society JournalsClinical MedicineEndocrinology and DiabetesMedicine and HealthBooksJournalsOxford Academic Введите поисковый запрос
Advanced Search
Abstract
Context
Кортизол, важный гормон, регулируемый гипоталамо-гипофизарно-надпочечниковой осью, связан с ожирением. Однако неясно, является ли связь между кортизолом и ожирением причинно-следственной или ее можно объяснить обратной причинно-следственной связью.
Однако неясно, является ли связь между кортизолом и ожирением причинно-следственной или ее можно объяснить обратной причинно-следственной связью.
Цель
Эта работа направлена на оценку роли утреннего кортизола плазмы в клинических классах ожирения.
Методы
В этом двунаправленном менделевском рандомизированном (MR) исследовании с двумя выборками кортизол-ассоциированные генетические варианты были получены от консорциума CORtisol NETwork (n = 12 597). Первичными исходами были ожирение I степени (индекс массы тела [ИМТ] ≥ 30), II степени (ИМТ ≥ 35) и III степени (ИМТ ≥ 40). В качестве основного анализа использовался метод взвешивания обратной дисперсии, а в качестве анализа чувствительности – взвешенная медиана, MR-Egger и остаточная сумма плейотропии MR и выброс (MR-PRESSO). И наоборот, генетические варианты, предсказывающие клинические классы ожирения, были применены к исследованию ассоциации всего генома кортизола.
Результаты
Генетически предсказанный уровень кортизола был связан со снижением риска ожирения I степени (OR = 0,905; 95% ДИ, 0,865–0,946; P < ,001). Данные двунаправленного магнитно-резонансного анализа показали, что степень ожирения II и III степени была связана с более низкими уровнями кортизола ([класс II-кортизол OR = 0,953; 95% ДИ, 0,923-0,983; P = ,002]; [класс III-кортизол OR = ,002]; = 0,955; 95% ДИ, 0,942-0,967; P < ,001]), что указывает на обратную причинно-следственную связь между кортизолом и ожирением.
Данные двунаправленного магнитно-резонансного анализа показали, что степень ожирения II и III степени была связана с более низкими уровнями кортизола ([класс II-кортизол OR = 0,953; 95% ДИ, 0,923-0,983; P = ,002]; [класс III-кортизол OR = ,002]; = 0,955; 95% ДИ, 0,942-0,967; P < ,001]), что указывает на обратную причинно-следственную связь между кортизолом и ожирением.
Заключение
Это исследование демонстрирует отрицательную связь кортизола с ожирением и наоборот. В совокупности эти данные свидетельствуют о том, что притупление утренней секреции кортизола в плазме может быть причиной тяжелого ожирения. Регулирование утренней секреции кортизола плазмы может быть профилактической мерой для людей с ожирением.
кортизол, ожирение, менделевская рандомизация
© Авторы, 2022 г. Опубликовано Oxford University Press от имени Эндокринного общества. Все права защищены. За разрешениями обращайтесь по электронной почте: journals.permissions@oup. com
com
Раздел выпуска:
Статья о клинических исследованиях
В настоящее время у вас нет доступа к этой статье.
Скачать все слайды
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- При посещении сайта учреждения используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. См. ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
д.
Покупка
Стоимость подписки и заказ этого журнала
Варианты покупки книг и журналов в Oxford Academic
Кратковременный доступ
Чтобы приобрести краткосрочный доступ, пожалуйста, войдите в свой личный аккаунт выше.
У вас еще нет личного кабинета? регистр
Роль утреннего кортизола плазмы в ожирении: двунаправленное менделевское рандомизированное исследование — 24-часовой доступ
ЕВРО €36,00
32 фунта стерлингов
39 долларов США.
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Последний
Самые читаемые
Самые цитируемые
Центральная чувствительность к свободному трийодтиронину с MAFLD и его прогрессированием в фиброз печени у эутиреоидных взрослых
Молекулярная генетика диффузного склерозирующего папиллярного рака щитовидной железы
Еженедельный прием сомапацитана при дефиците гормона роста: 4-летняя эффективность, безопасность и результаты лечения/бремени болезни из REAL 3
Узлы щитовидной железы Bethesda III и IV лечатся консервативно после молекулярного тестирования с помощью Afirma GSC или Thyroseq v3
Подход к пациенту: оценка и ведение мужчин ≥ 50 лет с низкой концентрацией тестостерона в сыворотке
Реклама
Кортизол и увеличение веса: есть ли связь?
Кортизол — это один из многих гормонов, вырабатываемых в вашем организме, которые служат химическими посредниками.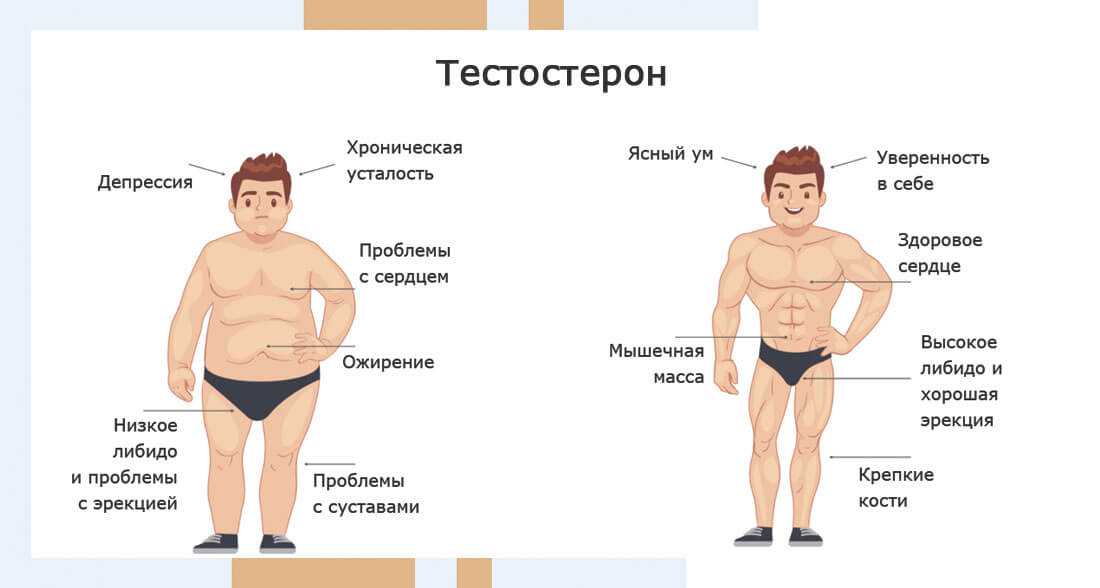
Хотя его обычно называют гормоном стресса из-за его роли в реакции организма на стресс, он выполняет ряд других важных функций.
Некоторые люди задаются вопросом, влияет ли уровень кортизола на массу тела.
В этой статье подробно описывается потенциальное влияние кортизола на увеличение веса, включая некоторые способы снижения его уровня в организме.
Кортизол является важным стероидным гормоном, принадлежащим к классу гормонов, называемых глюкокортикоидами.
Он вырабатывается надпочечниками, расположенными прямо над почками.
Помимо помощи в реакции организма на стресс, его другие роли включают (1, 2, 3, 4):
- повышает уровень сахара в крови
- уменьшает воспаление
- подавляет иммунную систему
- способствует метаболизму питательных веществ минут бодрствования, а затем уровни падают в течение дня (5).
Его производство и высвобождение регулируются гипофизом и гипоталамусом, расположенными в головном мозге.

Во время повышенного стресса надпочечники выделяют кортизол и адреналин. Это вызывает увеличение частоты сердечных сокращений и уровня энергии, подготавливая ваше тело к потенциально опасной ситуации.
Хотя эта реакция является нормальной, продолжающееся повышение уровня кортизола может привести к негативным побочным эффектам.
Резюме
Кортизол — необходимый гормон, выполняющий важные функции в организме, в том числе повышение уровня сахара в крови, уменьшение воспаления, подавление иммунной системы и помощь в метаболизме питательных веществ.
Среди многочисленных факторов, влияющих на массу тела, важным является гормональная регуляция.
Несмотря на то, что гормоны, такие как кортизол, обычно удерживаются эндокринной системой вашего организма в узких пределах, существуют определенные ситуации, в которых они могут стать низкими или повышенными.
Высокие уровни могут способствовать перееданию
Небольшое повышение уровня кортизола в ответ на стресс является нормальным явлением и вряд ли вызовет негативные побочные эффекты.

Тем не менее, в некоторых случаях уровень кортизола может оставаться хронически повышенным.
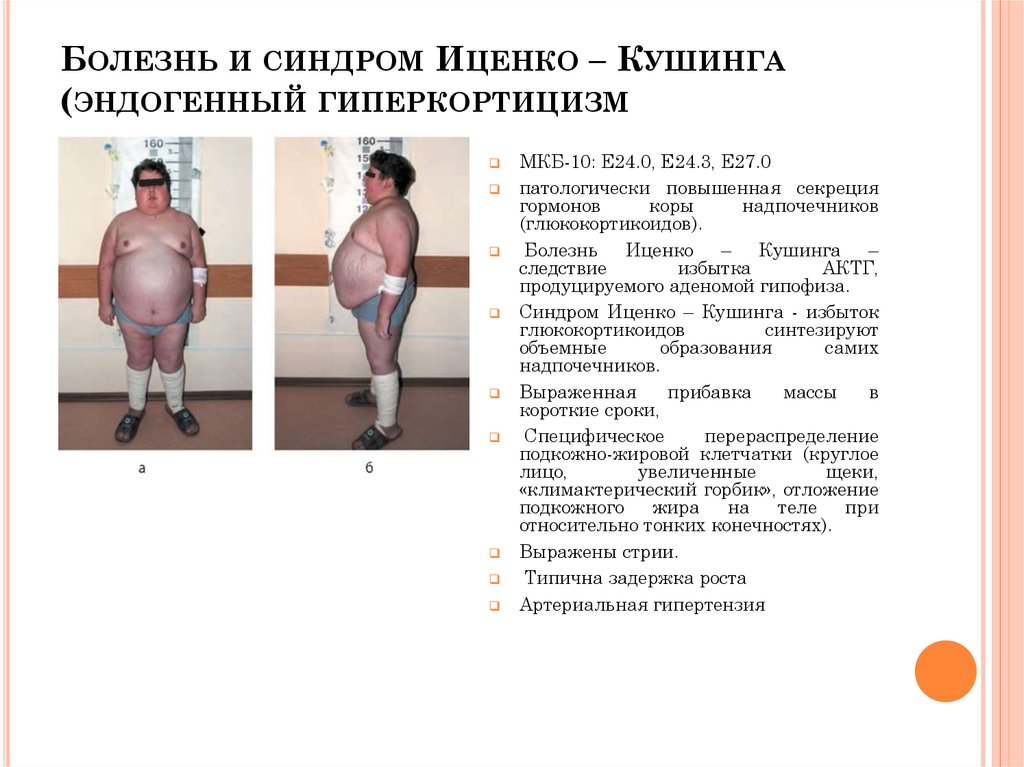
Обычно это происходит из-за стресса или состояния, подобного синдрому Кушинга, при котором уровень кортизола в крови остается высоким (6).
Когда уровни кортизола остаются повышенными, могут возникнуть следующие побочные эффекты (7):
- Прибавка веса
- Высокое кровяное давление
- Усталость
- Изменения в настроении
- 70068
- . Сменьшин
- 2
- Фотовая поверхность
- 2
8. концентрация - резистентность к инсулину
В условиях хронического стресса может быть трудно поддерживать здоровые привычки питания.
Одно исследование с участием 59 здоровых женщин выявило связь между повышенным уровнем кортизола и повышением аппетита, что потенциально может способствовать увеличению веса (8).
Кроме того, другое исследование обнаружило связь между более высоким уровнем кортизола и большим количеством жира на животе в группе из 172 мужчин и женщин, предполагая, что более высокий уровень кортизола может привести к перееданию (9).
Тем не менее, уровни стресса и кортизола не всегда напрямую связаны, поэтому для установления прямой зависимости требуется больше данных (10).
Низкий уровень кортизола может привести к потере веса
Так же, как высокий уровень кортизола может вызвать увеличение веса, низкий уровень в некоторых случаях может привести к потере веса.
Самый крайний пример — болезнь Аддисона, состояние, при котором ваш организм не вырабатывает достаточно кортизола (11, 12).
Наиболее заметные симптомы низкого уровня кортизола включают (13):
- снижение аппетита и потеря веса
- усталость
- низкий уровень сахара в крови
- тяга к соли
- головокружение
- тошнота, рвота или боль в животе важно также знать о последствиях низкого кортизола.

Резюме
Хронически повышенный уровень кортизола может способствовать перееданию и увеличению веса, тогда как низкий уровень кортизола в некоторых случаях может привести к потере веса. Тем не менее, необходимы дополнительные исследования.
Хотя в вашей жизни может быть много факторов стресса, которые могут способствовать повышению уровня кортизола, существует несколько эффективных методов контроля его уровня и предотвращения или борьбы с увеличением веса.
Оставайтесь активными
Одним из основных способов борьбы с лишним весом является регулярная физическая активность.
Регулярные физические упражнения связаны со снижением уровня стресса и позволяют вам быть более устойчивыми к стрессовым факторам (14, 15, 16).
В одном исследовании с участием 3425 участников, сообщивших об эмоциональном переедании, была обнаружена связь между уровнем их физической активности и ИМТ (индексом массы тела) (17).

Более того, физические упражнения стимулируют высвобождение эндорфинов — химических веществ хорошего самочувствия, которые способствуют счастью и помогают справиться со стрессом (18).
Регулярная физическая активность также может способствовать снижению или контролю веса за счет сжигания калорий во время тренировки (19, 20).
Практикуйте осознанное питание
Еще один мощный инструмент для управления увеличением веса из-за стресса — осознанное или интуитивное питание.
Внимательность исходит из буддийской концепции, означающей полное присутствие и осознание того, что вы делаете в данный момент (21).
Внимательное питание применяет эту концепцию к еде, побуждая вас полностью осознавать свой опыт еды, включая определенные сигналы, такие как голод, сытость, вкус и текстура (21, 22).
В одном крупном перекрестном исследовании была обнаружена связь между практикой интуитивного питания и меньшей массой тела (23).
Простой способ начать практиковать осознанное питание — избавиться от отвлекающих факторов во время еды, что позволит вам полностью осознавать сигналы голода и сытости.

Если вам интересно узнать об осознанном питании, но вы не знаете, с чего начать, примите участие в нашем бесплатном 21-дневном соревновании по осознанному питанию.
Обратитесь к терапевту или диетологу
Еще один возможный способ справиться с увеличением веса, который может быть связан с высоким уровнем кортизола, — это поговорить с квалифицированным практикующим врачом, например, с психологом или зарегистрированным диетологом.
Терапевт может помочь вам разработать стратегии снижения общего стресса, что, в свою очередь, может помочь вам справиться с эмоциональным перееданием (24).
С другой стороны, диетолог может провести обучение по вопросам питания, чтобы вооружить вас инструментами, необходимыми для принятия более здоровых решений, связанных с едой.
Двунаправленный подход к улучшению ваших пищевых привычек и эмоционального благополучия является отличным шагом в предотвращении или борьбе с увеличением веса.
Больше спать
Сон — часто упускаемая из виду переменная, которая оказывает значительное влияние на уровень кортизола и потенциальное увеличение веса.

Нарушения режима сна — хронические или острые — могут способствовать нездоровому повышению уровня кортизола (25).
Со временем это может оказать негативное влияние на ваш метаболизм и вызвать повышение уровня определенных гормонов, связанных с голодом и аппетитом, что может привести к увеличению веса (26, 27, 28).
Таким образом, обеспечение достаточного сна каждую ночь может иметь большое значение для поддержания здорового уровня кортизола.
Общая рекомендуемая продолжительность сна составляет 7–9 часов в сутки, хотя это зависит от возраста и других факторов (29).
Практика медитации
Еще одним потенциальным инструментом для управления уровнем кортизола является медитация.
Цель медитации — научить ваш разум концентрировать и перенаправлять ваши мысли.
Несмотря на то, что существует несколько типов медитации, наиболее распространенными из них являются осознанность, духовность, концентрация, движение, мантра и трансцендентальная.

Независимо от того, что вы выберете, практика медитации связана со снижением уровня кортизола у различных групп населения (30, 31).
Кроме того, медитация может даже помочь улучшить качество вашего сна (32).
Резюме
Существует множество способов помочь снизить уровень кортизола и предотвратить возможное увеличение веса. Наиболее эффективные методы включают в себя физические упражнения, осознанное питание, достаточный сон и практику медитации.
Кортизол является важным гормоном надпочечников, который выполняет множество важных функций в организме, в том числе контролирует уровень сахара в крови, уменьшает воспаление и регулирует обмен веществ.
Небольшое повышение уровня кортизола в ответ на стресс является нормальным явлением, однако, когда уровень остается хронически повышенным, могут возникать побочные эффекты, одним из которых является увеличение веса.
Тем не менее, существует несколько эффективных методов предотвращения или борьбы с увеличением веса, таких как физические упражнения, медитация или обращение к диетологу.


 , страницы e1954 –e1960, https://doi.org/10.1210/clinem/dgac008
, страницы e1954 –e1960, https://doi.org/10.1210/clinem/dgac008