ATP Citrate Lyase (ACLY) — Цитратлиаза АТФ
Цитратлиаза АТФ является основным ферментом, ответственным за синтез цитозольного ацетил-КоА во многих тканях. Фермент представляет собой тетрамер, состоящий из идентичных субъединиц. У животных продукт, ацетил-КоА, используется в нескольких важных биосинтетических путях, включая липогенез и холестерогенез. Активируется инсулином. Цитратлиаза АТФ отвечает за катализ превращения цитрата и кофермента А (КоА) в ацетил-КоА и оксалоацетат за счет гидролиза АТФ. В присутствии АТФ и КоА цитратлиаза катализирует расщепление цитрата с образованием ацетил-КоА, оксалоацетата, аденозиндифосфата (АДФ) и ортофосфата (P i). Цитратлиаза АТФ млекопитающих имеет N-концевой цитрат-связывающий домен, который принимает складку Россмана, за которой следуют CoA-связывающий домен и CoA-лигазный домен и, наконец, C-концевой домен цитрат-синтазы. Разрыв между доменами связывания CoA и цитрат-синтазы образует активный сайт фермента, где связываются как цитрат, так и ацетил-кофермент A.
Организм
Артикул
Наименование
В наличии
Human ATP-cite synthase (ACLY) ELISA kit
Организм:
ЧеловекАртикул:
E01A1192Human ATP-cite synthase (ACLY) ELISA kit
В наличии:
Sandwich ELISA for ATP Citrate Lyase (ACLY)
Организм:
ЧеловекАртикул:
SEJ686HuSandwich ELISA for ATP Citrate Lyase (ACLY)
В наличии:
УточнитьSandwich ELISA for ATP Citrate Lyase (ACLY)
Организм:
МышьАртикул:
SEJ686MuSandwich ELISA for ATP Citrate Lyase (ACLY)
В наличии:
УточнитьSandwich ELISA for ATP Citrate Lyase (ACLY)
Организм:
КрысаАртикул:
SEJ686RaSandwich ELISA for ATP Citrate Lyase (ACLY)
В наличии:
УточнитьОрганизм
Артикул
Наименование
В наличии
Sandwich CLIA for ATP Citrate Lyase (ACLY)
Организм:
ЧеловекАртикул:
SCJ686HuSandwich CLIA for ATP Citrate Lyase (ACLY)
В наличии:
УточнитьSandwich CLIA for ATP Citrate Lyase (ACLY)
Организм:
МышьАртикул:
SCJ686MuSandwich CLIA for ATP Citrate Lyase (ACLY)
В наличии:
УточнитьSandwich CLIA for ATP Citrate Lyase (ACLY)
Организм:
КрысаАртикул:
SCJ686RaSandwich CLIA for ATP Citrate Lyase (ACLY)
В наличии:
УточнитьОрганизм
Артикул
Наименование
В наличии
Phospho-ATP citrate lyase (Ser455/457) AntibodyПрименение:
вестерн-блот; иммуноферментный анализ
Организм:
Человек, Крыса, МышьАртикул:
AF4368В наличии:
Phospho-ATP-Citrate Lyase (Ser447) AntibodyПрименение:
вестерн-блот; иммуноферментный анализ
Организм:
Человек, Крыса, МышьАртикул:
AF7323В наличии:
ACLY AntibodyПрименение:
вестерн-блот; иммуногистохимия, иммунофлюоресценция/ иммуноцитохимия, иммуноферментный анализ, проточная цитометрия
Организм:
Человек, Мышь, Макака резусАртикул:
BF0008В наличии:
ATP citrate lyase AntibodyПрименение:
вестерн-блот; иммуноферментный анализ
Организм:
Человек, Мышь, КрысаАртикул:
AF4668В наличии:
ATP-Citrate Lyase AntibodyПрименение:
вестерн-блот; иммуноферментный анализ
Организм:
Человек, Мышь, КрысаАртикул:
AF7823В наличии:
Polyclonal Antibody to ATP Citrate Lyase (ACLY)Применение:
Организм:
ЧеловекАртикул:
PAJ686Hu01Polyclonal Antibody to ATP Citrate Lyase (ACLY)
В наличии:
УточнитьMonoclonal Antibody to ATP Citrate Lyase (ACLY)Применение:
Организм:
ЧеловекАртикул:
MAJ686Hu21Monoclonal Antibody to ATP Citrate Lyase (ACLY)
В наличии:
УточнитьPolyclonal Antibody to ATP Citrate Lyase (ACLY)Применение:
Организм:
МышьАртикул:
PAJ686Mu01Polyclonal Antibody to ATP Citrate Lyase (ACLY)
В наличии:
УточнитьMonoclonal Antibody to ATP Citrate Lyase (ACLY)Применение:
Организм:
МышьАртикул:
MAJ686Mu21Monoclonal Antibody to ATP Citrate Lyase (ACLY)
В наличии:
УточнитьPolyclonal Antibody to ATP Citrate Lyase (ACLY)Применение:
Организм:
КрысаАртикул:
PAJ686Ra01Polyclonal Antibody to ATP Citrate Lyase (ACLY)
В наличии:
УточнитьMonoclonal Antibody to ATP Citrate Lyase (ACLY)Применение:
Организм:
КрысаАртикул:
MAJ686Ra21Monoclonal Antibody to ATP Citrate Lyase (ACLY)
В наличии:
УточнитьОрганизм
Артикул
Наименование
В наличии
Recombinant protein ATP Citrate Lyase (ACLY)
Организм:
ЧеловекАртикул:
RPJ686Hu01Recombinant protein ATP Citrate Lyase (ACLY)
В наличии:
УточнитьRecombinant protein ATP Citrate Lyase (ACLY)
Организм:
МышьАртикул:
RPJ686Mu01Recombinant protein ATP Citrate Lyase (ACLY)
В наличии:
УточнитьRecombinant protein ATP Citrate Lyase (ACLY)
Организм:
КрысаАртикул:
RPJ686Ra01Recombinant protein ATP Citrate Lyase (ACLY)
В наличии:
УточнитьЕсли вы не увидели здесь нужный Вам продукт — это значит, что он доступен для изготовления на заказ.
Обратный звонок
Чат со специалистом
Напишите нам
Московский государственный университет
Исследовательский центр им.Алмазова
НЦ вирусологии и биотехнологии «Вектор»
Институт медико-биологических проблем РАН
Институт Цитологии и Генетики СО РАН
Институт физиологии им. Павлова
Сеченовский Университет
МНТК Микрохирургии глаза им.Федорова
МФТИ
Институт экспериментальной медицины
Исследовательский центр им. Дмитрия Рогачева
НИЦ Курчатовский институт
Петербургский институт ядерной физики им. Б.П.Константинова
НИИ глазных болезней им. Гельмгольца
НЦ акушерства, гинекологии и перинатологии им.Кулакова
ИЭФБ РАН им.Сеченова
Национальный исследовательский университет Лобачевского
Томский научный исследовательский медицинский центр
Казанский Федеральный Университет
СЗГМУ им.Мечникова
Балтийский федеральный университет
Научный центр неврологии
Северо-Кавказский федеральный университет
Дальневосточный федеральный университет
ФНКЦ физико-химической медицины
ФНКЦ реаниматологии и реабилитологии
Сибирский федеральный университет
Институт биологии гена РАН
ФИЦ Питания и биотехнологий
Сибирский медицинский университет
Институт биофизики клетки РАН
НИПИ им. Бехтерева
Бехтерева
Институт Фундаментальных Проблем Биологии РАН
Институт токсикологии ФМБА России
НИИ Акушерства и гинекологии им. Отта
НИИ Психического здоровья
РМАПО
Красноярский медицинский университет им. Войно-Ясенецкого
Алтайский медицинский университет
Ниармедик
Волгоградский медицинский университет
Новосибирский медицинский университет
РНИОИ
ИБХ РАН им. акад. Шемякина и Овчинникова
Петровакс Фарм
Южно-Уральский государственный университет
ПИМУ
ФНЦ Пищевых систем им.Горбатова РАН
Пресс-релиз: Нобелевская премия по химии 1997 г.
- Пол Д. Бойер
- Джон Э. Уокер
- Йенс С. Скоу
Шведский
15 октября 1997 г.
Шведская королевская академия наук приняла решение присудить Нобелевскую премию по химии 1997 года с половиной против
Профессор Пол Д.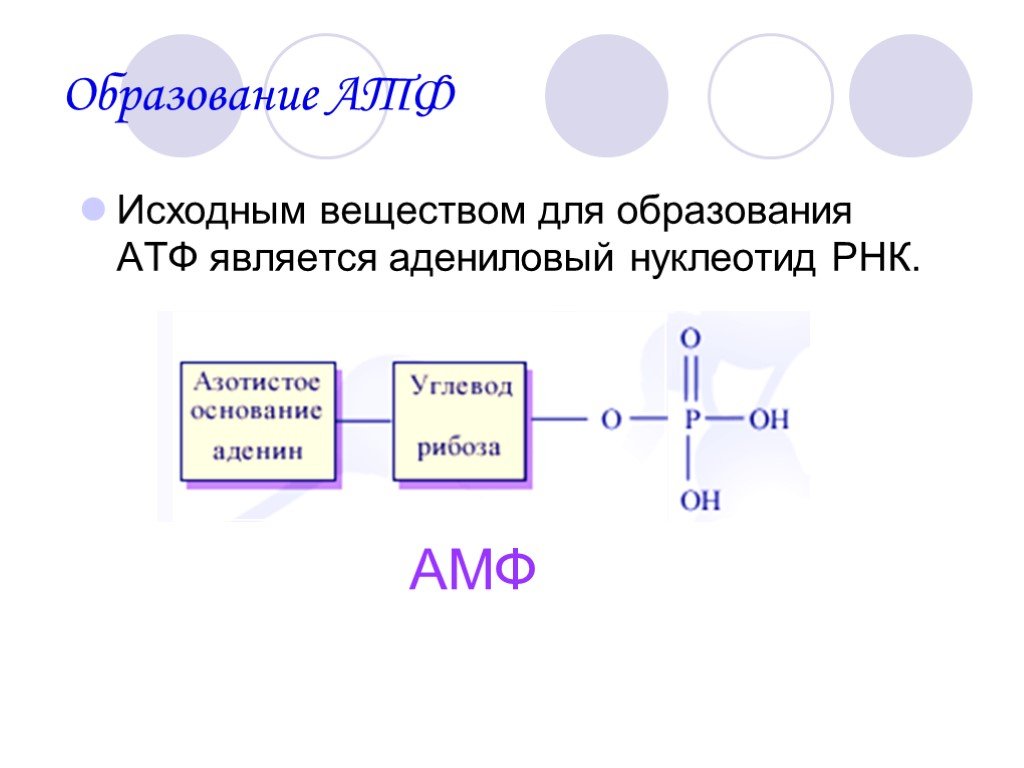 Бойер , Калифорнийский университет, Лос-Анджелес, США, и
Бойер , Калифорнийский университет, Лос-Анджелес, США, и
Dr. John E. Walker , Лаборатория молекулярной биологии Совета медицинских исследований, Кембридж, Соединенное Королевство
за выяснение ферментативного механизма, лежащего в основе синтеза аденозинтрифосфата (АТФ)
и с половиной до
Профессор Йенс С. Скоу , Орхусский университет, Дания
за первое открытие фермента, переносящего ионы, Na
Трое лауреатов выполнили новаторскую работу над ферментами, участвующими в преобразовании «высокоэнергетического» соединения аденозинтрифосфата (АТФ).
Paul D. Boyer и John E. Walker получают половину приза за свою работу о том, как фермент АТФ-синтаза катализирует образование АТФ. Бойер и его сотрудники на основе биохимических данных предложили механизм образования АТФ из аденозиндифосфата (АДФ) и неорганического фосфата. Уокер и его сотрудники установили структуру фермента и проверили механизм, предложенный Бойером.
Йенс С. Скоу получает свою половину приза за открытие фермента натрия, стимулируемой калием аденозинтрифосфатазы (Na + , K + -АТФаза). Этот фермент поддерживает баланс ионов натрия и калия в живой клетке.
Оба фермента связаны с клеточными мембранами и связаны с транспортом ионов через них, но по разным причинам.
АТФ – универсальный энергоноситель в живой клетке
Немецкий химик Карл Ломан открыл АТФ в 1929 году. Несколько лет спустя его структура была выяснена, а в 1948 году шотландский лауреат Нобелевской премии 1957 года Александр Тодд синтезировал АТФ химическим путем. Важную роль сыграл лауреат Нобелевской премии по медицине 1953 года Фриц Липман, когда он в 1939-41 годах показал, что АТФ является универсальным переносчиком химической энергии в клетке, и ввел выражение «богатые энергией фосфатные связи».
АТФ функционирует как переносчик энергии во всех живых организмах, от бактерий и грибов до растений и животных, включая человека. АТФ улавливает химическую энергию, высвобождаемую при сгорании питательных веществ, и передает ее на реакции, требующие энергии, например, на биохимию. построение клеточных компонентов, сокращение мышц, передача нервных сообщений и многие другие функции. АТФ называют энергетической валютой клетки.
АТФ улавливает химическую энергию, высвобождаемую при сгорании питательных веществ, и передает ее на реакции, требующие энергии, например, на биохимию. построение клеточных компонентов, сокращение мышц, передача нервных сообщений и многие другие функции. АТФ называют энергетической валютой клетки.
Аденозин три фосфат (A T P) состоит из нуклеозида аденозина, связанного с тремя фосфатными группами. При удалении самой внешней фосфатной группы образуется аденозин ди фосфат (A D P), в то время как высвобождаемая энергия может быть использована для других реакций. И наоборот, с помощью энергии неорганическая фосфатная группа может быть связана с АДФ и образовать АТФ. Образуются и расходуются значительные количества АТФ. В покое взрослый ежедневно превращает количество АТФ, соответствующее примерно половине массы тела, а при тяжелой работе это количество может возрасти почти до тонны. Большая часть синтеза АТФ осуществляется ферментом АТФ-синтазой.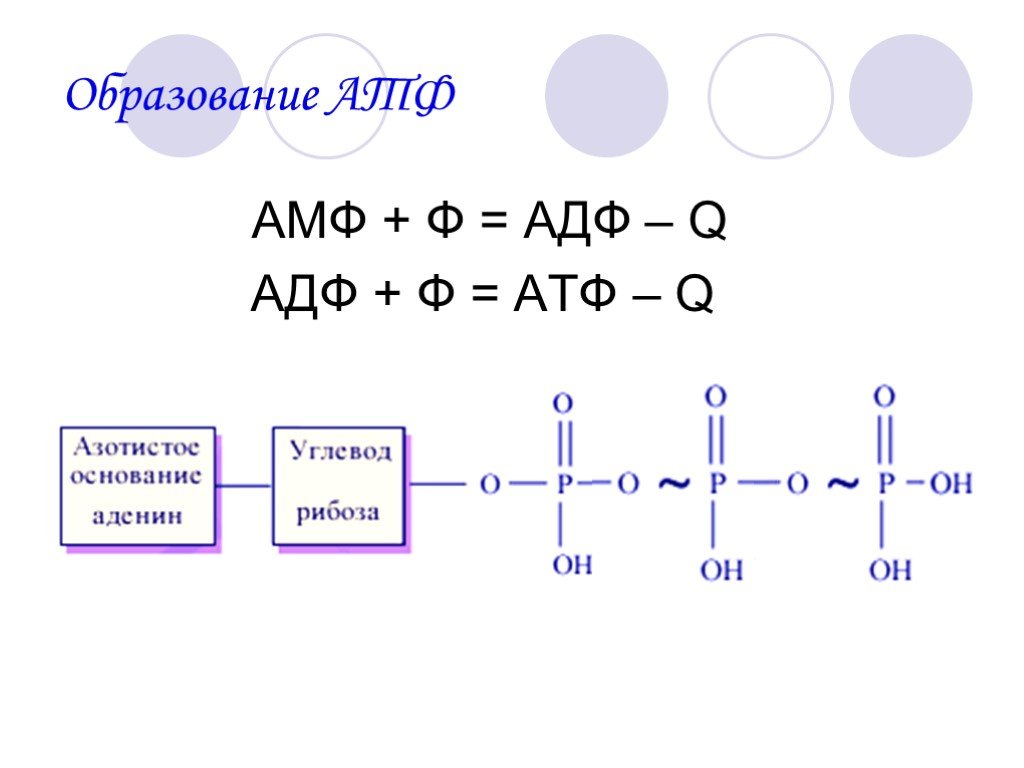
АТФ-синтаза – уникальная молекулярная машина
В 1940-х и 1950-х годах было выяснено, что основная часть АТФ образуется при клеточном дыхании в митохондриях и фотосинтезе в хлоропластах растений. В 1960 году американский ученый Эфраим Рэкер и его сотрудники выделили из митохондрий фермент «F o F 1 АТФаза», который мы теперь называем АТФ-синтазой. Фермент можно разделить на F 9Часть 0092 1 , содержащая каталитический центр, и часть F или часть , соединяющая часть F 1 с мембраной. Один и тот же фермент существует в хлоропластах и бактериях. В 1961 году Питер Митчелл представил так называемую хемиосмотическую гипотезу, за которую он получил Нобелевскую премию в 1978 году. Он показал, что клеточное дыхание приводит к разнице в концентрации ионов водорода (pH) внутри и снаружи митохондриальной мембраны, и что поток водорода ионы стимулируют образование АТФ.
Пол Д. Бойер начал свои исследования образования АТФ в начале 1950-х годов и до сих пор ведет активную научную деятельность. Его главный интерес заключался в том, чтобы с помощью изотопных методов выяснить, как функционирует АТФ-синтаза и, в частности, как она использует энергию для создания новой АТФ. Его работа в последние годы увенчалась необычайным успехом. АТФ-синтаза имеет способ функционирования, необычный для ферментов, и для его установления потребовалось много времени и обширных исследований. Джон Э. Уокер провел свои первые исследования АТФ-синтазы в начале 1980-х годов. Его отправной точкой было то, что для подробного понимания того, как он функционирует, необходимы подробные химические и структурные знания о ферменте. Поэтому он определил аминокислотные последовательности в составляющих белковых единицах. В 1990-х годах он сотрудничал с кристаллографами, чтобы прояснить трехмерную структуру АТФ-синтазы.
Рис. 1. Упрощенное изображение АТФ-синтазы Часть Fo, через которую проходит поток ионов водорода (H+), находится в мембране. Часть F1, которая синтезирует АТФ, находится вне мембраны. Когда ионы водорода проходят через мембрану через диск из с-субъединиц в части Fo, диск вынужден закручиваться. Гамма-субъединица в части F1 прикреплена к диску и поэтому вращается вместе с ним. Однако три альфа- и три бета-субъединицы в части F1 не могут вращаться. Они фиксируются в фиксированном положении b-субъединицей. Это, в свою очередь, закреплено в мембране. Таким образом, гамма-субъединица вращается внутри цилиндра, образованного шестью альфа- и бета-субъединицами. Поскольку гамма-субъединица асимметрична, бета-субъединица подвергается структурным изменениям.
Как упоминалось выше, АТФ-синтаза (рис. 1) состоит из связанной с мембраной части, F o , которая транспортирует ионы водорода, и выступающей части (F 1 ), которая может высвобождаться из мембраны. (Термины являются историческими, и F 1 означает фактор 1, а F o — фактор, чувствительный к олигомицину). Каждая часть F o состоит из трех типов субъединиц в разном количестве, белков а (1), b (2) и с (9-12). Часть F 1 состоит из пяти субъединиц: альфа, бета, гамма, дельта и эпсилон. В то время как альфы и беты по три, каждая из остальных есть только по одной единице. Было показано, что именно на бета-звеньях происходит синтез АТФ. Анализ аминокислотных последовательностей, проведенный Уокером и его сотрудниками в начале XIX в.80-е годы показали, что субъединицы гамма, дельта и эпсилон не симметричны, что важно для нашего понимания того, как функционирует АТФ-синтаза.
Наиболее подробные исследования АТФ-синтазы касаются части F 1 и того, как она функционирует. Бойер и его коллеги пояснили, что фермент функционирует очень особым образом. Они обнаружили, что, в отличие от общепринятого мнения, стадия, требующая энергии, заключалась не в синтезе АТФ из АДФ и неорганического фосфата, а в том, что энергия требовалась для связывания АДФ и фосфата с ферментом и высвобождения АТФ. Тем не менее избыток энергии запасался в АТФ. В этом отношении АТФ-синтаза отличается от большинства всех ферментов, которые спонтанно связывают и высвобождают субстраты и продукты, но для общей каталитической реакции которых требуется энергия. Еще одним наблюдением было то, что, несмотря на асимметричный характер F  Это вращение вызывает структурные изменения бета, которые приводят к различиям в связывающей способности во время циклического течения (см. рис. 2). Этот механизм называется «механизм изменения связывания» Бойера. Бойер также предположил, что это вращение вызывается вышеупомянутым потоком ионов водорода через мембрану.
Это вращение вызывает структурные изменения бета, которые приводят к различиям в связывающей способности во время циклического течения (см. рис. 2). Этот механизм называется «механизм изменения связывания» Бойера. Бойер также предположил, что это вращение вызывается вышеупомянутым потоком ионов водорода через мембрану.
Рисунок 2. «Механизм изменения связывания» Бойера На рисунке показан цилиндр с чередующимися альфа- и бета-субъединицами на четырех разных стадиях синтеза АТФ. В центре видна асимметричная гамма-субъединица, вызывающая изменения в структуре бета-субъединиц. Эти структуры называются открытым бета-О (светло-серый сектор), рыхлым бета-L (серый сектор) и плотным бета-Т (черный сектор). На стадии А мы видим уже полностью сформированную молекулу АТФ, связанную с бетаТ. На стадии B betaL связывает АДФ и неорганический фосфат (Pi). На следующем этапе С мы видим, как закрутилась гамма-субъединица за счет потока ионов водорода (см. рис. 1). Это вызывает изменения в структуре трех бета-субъединиц.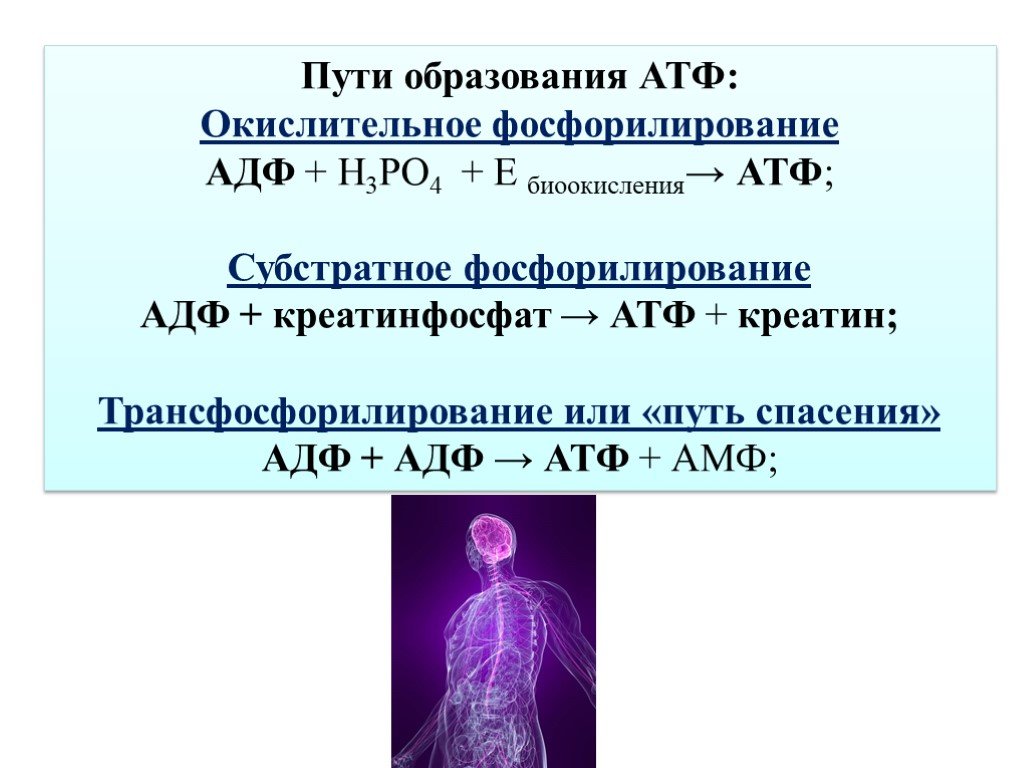
Бойер назвал АТФ-синтазу молекулярной машиной. Его можно сравнить с водяным молотом, чеканящим монеты. Часть F или — это колесо, поток протонов — это водопад, а структурные изменения в F 1 приводят к тому, что за каждый оборот колеса чеканится три монеты в валюте АТФ.
Уокер прояснил структурные условия молекулярного механизма фермента и тем самым подтвердил механизм Бойера. Кристаллографическая структура F 1 часть АТФ-синтазы коров, определенная главным образом в сотрудничестве с голландцем Дж. П. Абрахамсом и англичанином А. Лесли, частично показывает, что альфа- и бета-субъединицы родственны с точки зрения структуры и эволюции, а частично — что они имеют явно различающиеся структуры. и, следовательно, разные способности связывать АДФ и АТФ. Гамма-субъединица расположена в виде асимметричной оси в цилиндре, образованном тремя альфа- и тремя бета-субъединицами, и имеет уникальные контакты с бета-субъединицами и заставляет их активные поверхности принимать различные трехмерные структуры. Эти результаты можно интерпретировать в соответствии с механизмом Бойера, что означает, что фермент функционирует посредством вращения гамма-субъединиц. Было трудно продемонстрировать это вращение экспериментально, но нескольким группам это удалось. Вольфганг Юнге в Германии использовал спектроскопические методы, а американский ученый Ричард Кросс — химическую перекрестную связь. Недавно японской группе под руководством Масасуке Ёсида удалось визуализировать вращение в F 9.0092 1 часть АТФ-синтазы. Они прикрепили волокно мышечного белка актина к гамма-субъединице, а бета-единицы прикрепили к субстрату. В зависимости от концентрации АТФ в окружающей жидкости под микроскопом можно было показать, как актиновое волокно вращается с возрастающей скоростью при увеличении концентрации АТФ.
и, следовательно, разные способности связывать АДФ и АТФ. Гамма-субъединица расположена в виде асимметричной оси в цилиндре, образованном тремя альфа- и тремя бета-субъединицами, и имеет уникальные контакты с бета-субъединицами и заставляет их активные поверхности принимать различные трехмерные структуры. Эти результаты можно интерпретировать в соответствии с механизмом Бойера, что означает, что фермент функционирует посредством вращения гамма-субъединиц. Было трудно продемонстрировать это вращение экспериментально, но нескольким группам это удалось. Вольфганг Юнге в Германии использовал спектроскопические методы, а американский ученый Ричард Кросс — химическую перекрестную связь. Недавно японской группе под руководством Масасуке Ёсида удалось визуализировать вращение в F 9.0092 1 часть АТФ-синтазы. Они прикрепили волокно мышечного белка актина к гамма-субъединице, а бета-единицы прикрепили к субстрату. В зависимости от концентрации АТФ в окружающей жидкости под микроскопом можно было показать, как актиновое волокно вращается с возрастающей скоростью при увеличении концентрации АТФ.
Na + , K + -АТФаза, первый обнаруженный молекулярный насос
Еще в 1920-х годах было известно, что ионный состав в живых клетках отличается от ионного состава в окружающей среде. Внутри клеток концентрация натрия ниже, а концентрация калия выше, чем в жидкости снаружи. Благодаря работам англичан Ричарда Кейнса и Алана Ходжкина в начале XIX в.50-х годов (Ходжкин получил Нобелевскую премию в 1963 г.) было известно, что при стимуляции нерва ионы натрия вливаются в нервную клетку. Разница в концентрации восстанавливается за счет повторного выноса натрия. То, что для этого транспорта требовался АТФ, было вполне вероятным, поскольку в живой клетке этот транспорт можно ингибировать путем ингибирования образования АТФ.
Взяв это за отправную точку Jens C. Skou искал фермент, разлагающий АТФ, в мембране нерва, который мог бы быть связан с переносом ионов. В 1957 г. он опубликовал первую статью об АТФазе, активируемой ионами натрия и калия (Na + , К + -АТФаза). Он был первым, кто описал фермент, который может способствовать направленному (векторному) транспорту веществ через клеточную мембрану, что является фундаментальным свойством всех живых клеток. С тех пор было продемонстрировано, что многие ферменты имеют по существу сходные функции.
Он был первым, кто описал фермент, который может способствовать направленному (векторному) транспорту веществ через клеточную мембрану, что является фундаментальным свойством всех живых клеток. С тех пор было продемонстрировано, что многие ферменты имеют по существу сходные функции.
Скоу использовали в качестве экспериментального материала тонкоизмельченные нервные оболочки крабов. Фермент, разлагающий АТФ, обнаруженный в препарате, требовал присутствия ионов магния и стимулировался увеличением количества ионов натрия до определенного предела. Более того, Скоу смог получить дополнительную стимуляцию, если добавил небольшое количество ионов калия. Признаком того, что фермент был связан с ионным насосом, было то, что максимальная стимуляция была получена при концентрациях натрия и калия, которые обычно присутствуют в нерве. В своих дальнейших исследованиях механизма фермента Скоу показал, что ионы натрия и ионы калия связываются с высоким сродством с разными местами фермента. Кроме того, он показал, что фосфатная группа, отделенная от АТФ, также связывается с АТФазой. Это описывается как фосфорилирование фермента. Фермент зависит от ионов натрия, когда он фосфорилируется, и от ионов калия, когда он дефосфорилируется. Вещества, которые, как известно, ингибируют перенос натрия/калия, представляют собой некоторые алкалоиды наперстянки, например убаин и Скоу показали, что убаин препятствует активации фермента натрием.
Это описывается как фосфорилирование фермента. Фермент зависит от ионов натрия, когда он фосфорилируется, и от ионов калия, когда он дефосфорилируется. Вещества, которые, как известно, ингибируют перенос натрия/калия, представляют собой некоторые алкалоиды наперстянки, например убаин и Скоу показали, что убаин препятствует активации фермента натрием.
Картина, которая медленно вырисовывалась из работы Скоу и других, состоит в том, что фермент состоит из двух субъединиц, альфа и бета. Первый несет активность фермента, а второй предположительно стабилизирует структуру. Молекулы фермента расположены в клеточной мембране, часто по две, и выставляют поверхности как наружу, так и внутрь. Три иона натрия и АТФ связываются с внутренней поверхностью. Затем фосфат переносится с АТФ на аминокислоту фермента, аспарагиновую кислоту, после чего высвобождается АДФ, и форма фермента изменяется, так что ионы натрия переносятся наружу. Здесь они высвобождаются, и вместо них присоединяются два иона калия. Когда фосфор, связанный с ферментом, удаляется, ионы калия транспортируются в клетку, а когда новый АТФ связывается с ферментом, они отторгаются.
Когда фосфор, связанный с ферментом, удаляется, ионы калия транспортируются в клетку, а когда новый АТФ связывается с ферментом, они отторгаются.
В результате действия Na + , K + -АТФазы клетка сохраняет внутри себя высокую концентрацию калия. Поскольку клеточная мембрана довольно проницаема для ионов калия, некоторые из этих ионов калия просачиваются наружу, оставляя непроницаемые отрицательные заряды внутри клетки. Поэтому внутренняя часть клеточной мембраны становится электрически отрицательно заряженной по сравнению с внешней.
Эта разница потенциалов на мембране необходима для распространения стимуляции нерва по нервному волокну или мышечной клетке. Вот почему нехватка питания или кислорода в мозгу быстро приводит к потере сознания, поскольку прекращается образование АТФ и останавливается ионный насос. Насос также важен для поддержания объема клеток. Если насос останавливается, клетка набухает. Разница в концентрации натрия внутри и снаружи является движущей силой в поглощении важных питательных веществ, необходимых для клетки, например. глюкоза и аминокислоты. Его также можно использовать для транспорта других ионов через клеточную мембрану. Таким образом, входящие ионы натрия могут быть заменены выходящими ионами кальция.
глюкоза и аминокислоты. Его также можно использовать для транспорта других ионов через клеточную мембрану. Таким образом, входящие ионы натрия могут быть заменены выходящими ионами кальция.
После открытия Na + , K + -АТФазы были обнаружены другие ионные насосы со сходными структурами и функциями. Примерами являются Са 2+ > -АТФаза в скелетных мышцах, которая участвует в контроле мышечного сокращения, и Н + , К + -АТФаза, которая продуцирует соляную кислоту в желудке. Именно последний фермент специфически ингибируется при современном лечении язвы желудка. Соответствующие ферменты обнаружены и у низших организмов, например у дрожжей, где H + -АТФаза секретирует ионы водорода, образующиеся при брожении. В качестве общего названия эти ферменты в настоящее время называются АТФазами Р-типа, поскольку они фосфорилируются в ходе реакции.
| Дополнительная литература |
Пол Д. Бойер и Джон Э. Уокер Бойер и Джон Э. Уокер |
| Boyer, P.D., Механизм изменения связывания АТФ-синтазы – некоторые вероятности и возможности , Biochimica et Biophysica Acta (1993) 1140, 215-250. |
| Абрахамс Дж.П., Лесли А.Г., Луттер Р. и Уокер Дж.Е., Структура при разрешении 2,8 Å F 1 -АТФаза из митохондрий бычьего сердца , Nature (1994) 370, 621-6 28. |
| Boyer, PD, АТФ-синтаза – великолепная молекулярная машина , Annual Review in Biochemistry (1997) 66, 717-749. |
| Йенс С. Скоу |
| Skou, J.C., Влияние некоторых катионов на аденозинтрифосфатазу из периферических нервов , Biochimica et Biophysica Acta (1957) 23, 394-401. |
| Скоу, Дж. К., и Эсманн, М., Na, K-АТФаза , Journal of Bioenergetics and Biomembranes (1992) 24, 249-261. |
Лингрел, Дж. Б., Na-K-АТФаза: изоформа, структура, функция и экспрессия , Journal of Bioenergetics and Biomembranes (1992) 24, 263-270. |
| Möller, J.V., Juul, B., and le Maire, M., Структурная организация, перенос ионов и передача энергии АТФаз Р-типа , Biochimica et Biophysica Acta (1996) 1286, 1-51. |
| Луценко С. и Каплан Дж. Х., Организация АТФаз Р-типа: значение структурного разнообразия , Биохимия (1996) 34, 15607-15613. |
Профессор Пол Д. Бойер родился в 1918 году в Прово, штат Юта, США. Кандидат наук. в биохимии 1943, Университет Висконсина, Мэдисон, США. С 1963 по 1989 год он был профессором химии на факультете химии и биохимии Калифорнийского университета в Лос-Анджелесе (UCLA), а с 1965 по 1983 год — директором Института молекулярной биологии UCLA. С 1990 года он является почетным профессором кафедры химии и биохимии Калифорнийского университета в Лос-Анджелесе. Бойер является членом Национальной академии наук с 1970 года. В 1919 году он получил звание почетного доктора Стокгольмского университета. 74, а в 1989 году он был награжден премией Роуза Американского общества биохимии и молекулярной биологии.
74, а в 1989 году он был награжден премией Роуза Американского общества биохимии и молекулярной биологии.
Профессор Пол Д. Бойер
Факультет химии и биохимии
Калифорнийский университет
Лос-Анджелес, Калифорния , США
Доктор Джон Э. Уокер родился в 1941 году в Галифаксе, Великобритания. Он получил степень магистра и доктора философии. в Оксфордском университете, Великобритания. С 1982 года Уокер является старшим научным сотрудником лаборатории молекулярной биологии Совета медицинских исследований в Кембридже, Великобритания. Он был избран в Королевское общество в Лондоне в 1995.
Dr. John E. Walker
Лаборатория молекулярной биологии Совета медицинских исследований
Hills Road
Cambridge, CB2 2QH
UK
Профессор Йенс С. Скоу родился в 1918 году в Дании. Получил медицинское образование в Копенгагенском университете. В 1954 году Скоу получил докторскую степень в Орхусском университете, где в 1963 году стал профессором физиологии. В 1977 году он был назначен профессором биофизики в том же университете. Скоу является членом Датской академии наук.
В 1977 году он был назначен профессором биофизики в том же университете. Скоу является членом Датской академии наук.
Профессор Йенс С. Скоу
Орхусский университет
Нордре Ринггаде
DK-8000 Орхус
Дания
Чтобы процитировать этот раздел
стиль MLA: Пресс-релиз. Нобелевская премия.org. Нобелевская премия по распространению информации AB 2023. Пн. 19 июня 2023 г.
Наверх Back To TopВозвращает пользователей к началу страницы
Четырнадцать лауреатов были удостоены Нобелевской премии в 2022 году за достижения, которые принесли наибольшую пользу человечеству. Их работа и открытия варьируются от палеогеномики и клик-химии до документирования военных преступлений.См. все представленные здесь.
Выберите категорию или категории, по которым вы хотите отфильтровать Физика Химия Лекарство Литература Мир Экономические науки
Выберите категорию или категории, которые вы хотите отфильтровать поФизика
Химия
Лекарство
Литература
Мир
Экономические науки
Уменьшить год на один Выберите год, в котором вы хотите искать Увеличить год на один
Молекула АТФ образуется при переходе электрона из
Вопрос
Обновлено: 06. 13.2023
13.2023A2Z-ДЫХАНИЕ В РАСТЕНИЯХ-Раздел D: Тест в конце главы
20 видеоРЕКЛАМА
90 342 текстовое решениеA
Cyt c к Cyt aB
Cyt b к Cyt cC
Cyt a к Cyt cD
Cyt c к Cyt bОтвет
Правильный ответ BРешение
(B) Молекула АТФ образуется при переходе электрона от Cyt b к Cyt c.Ответ
Пошаговое решение с видео, текстом и изображением для Молекула АТФ образуется при прохождении электрона экспертами по биологии, чтобы помочь вам в сомнениях и получить отличные оценки на экзаменах в 11 классе.
Ab Padhai каро бина объявления ке
Khareedo DN Pro и дехо сари видео бина киси объявление ки rukaavat ке!
Похожие видео
Молекула АТФ образуется при переходе электрона из
23762172
Количество молекул АТФ, образованных из 8 молекул воды за счет нециклического переноса электронов и последующего фотофосфорилирования, составляет
30698842
АТФ в не- циклическая фотофосфорляция образуется при переходе электрона из
70059693
Сколько молекул АТФ образуется в цепной реакции переноса электрона?
119575001
Text Solution
Химически АТФ представляет собой молекулы трифосфата, образованные из ______.


