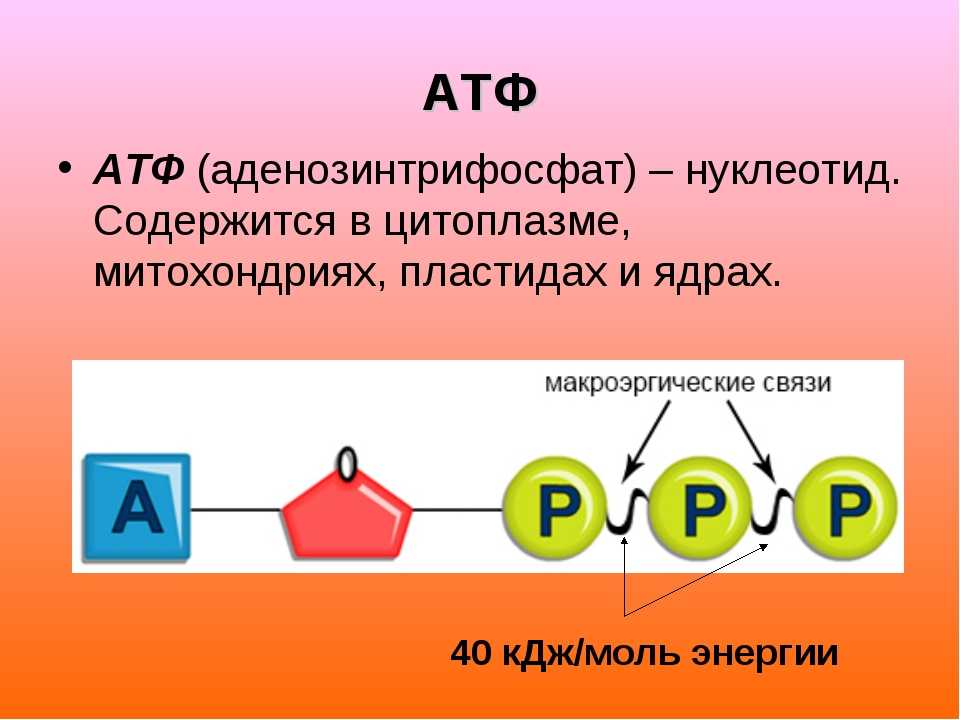
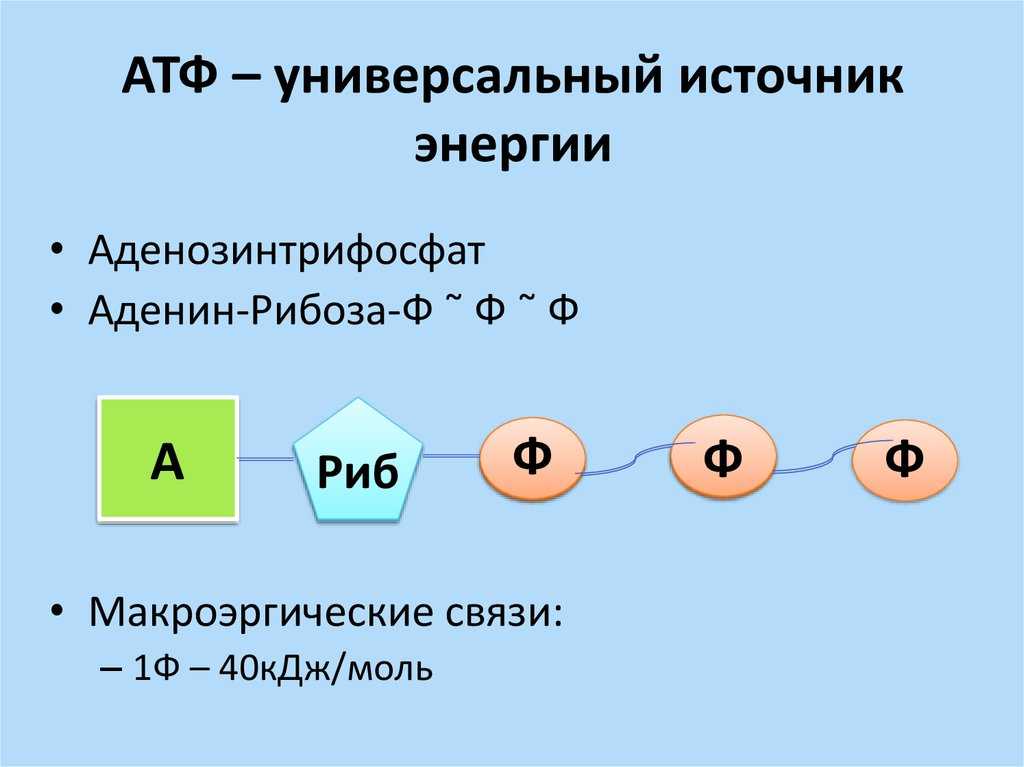
АТФ
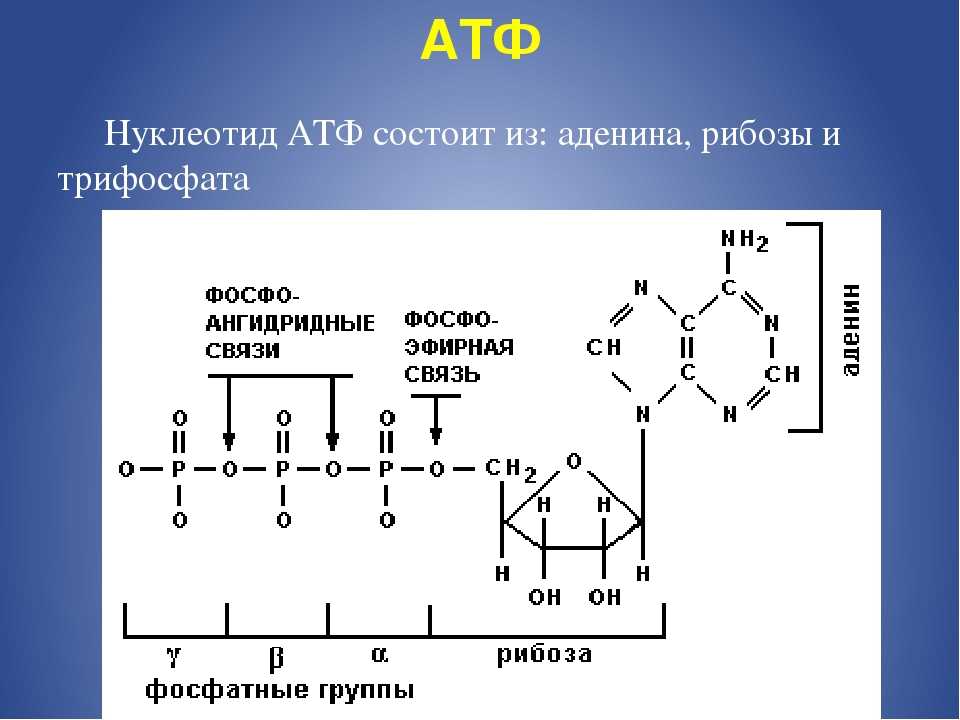
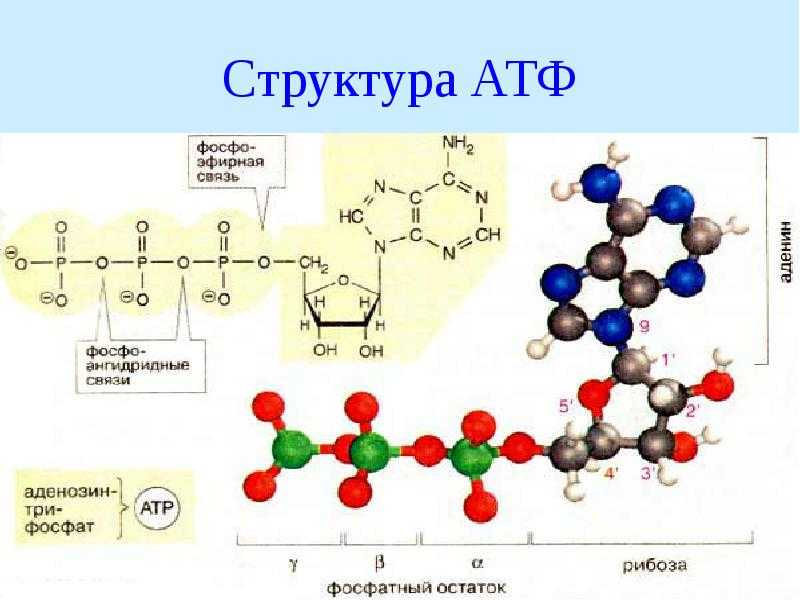
Структура АТФ
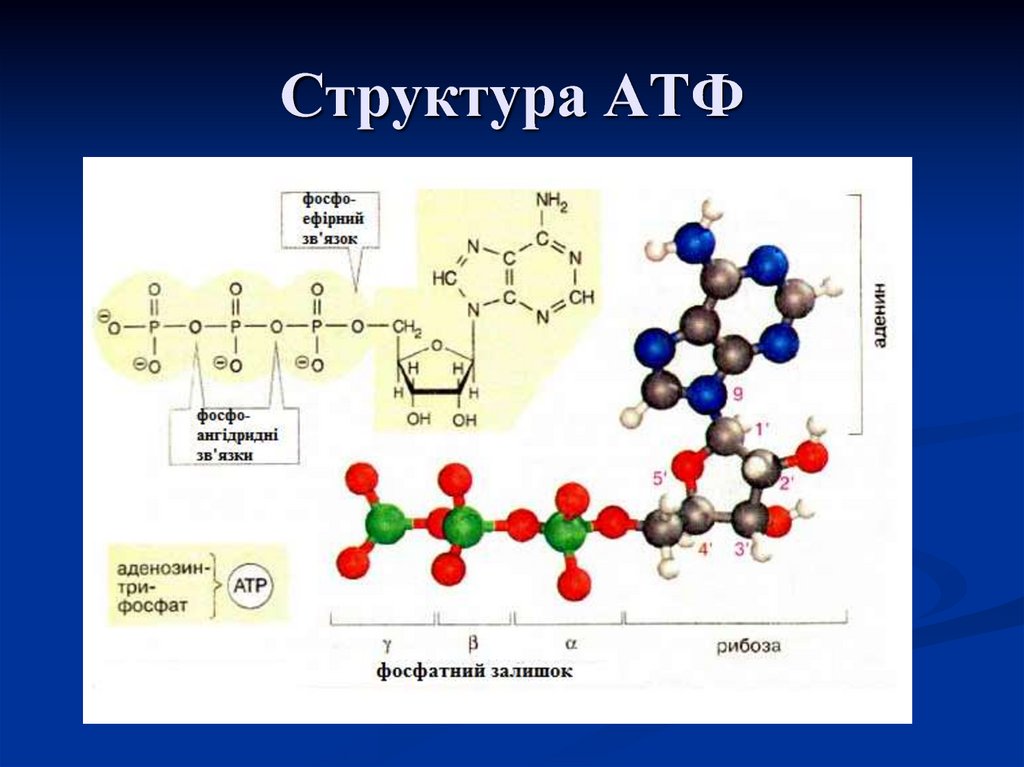
На рис. 9.2 представлены два способа изображения структуры АТФ. Аденозинмонофосфат (АМФ), аденозиндифосфат (АДФ) и аденозин- трифосфат (АТФ) относятся к классу соединений, называемых нуклеотидами.
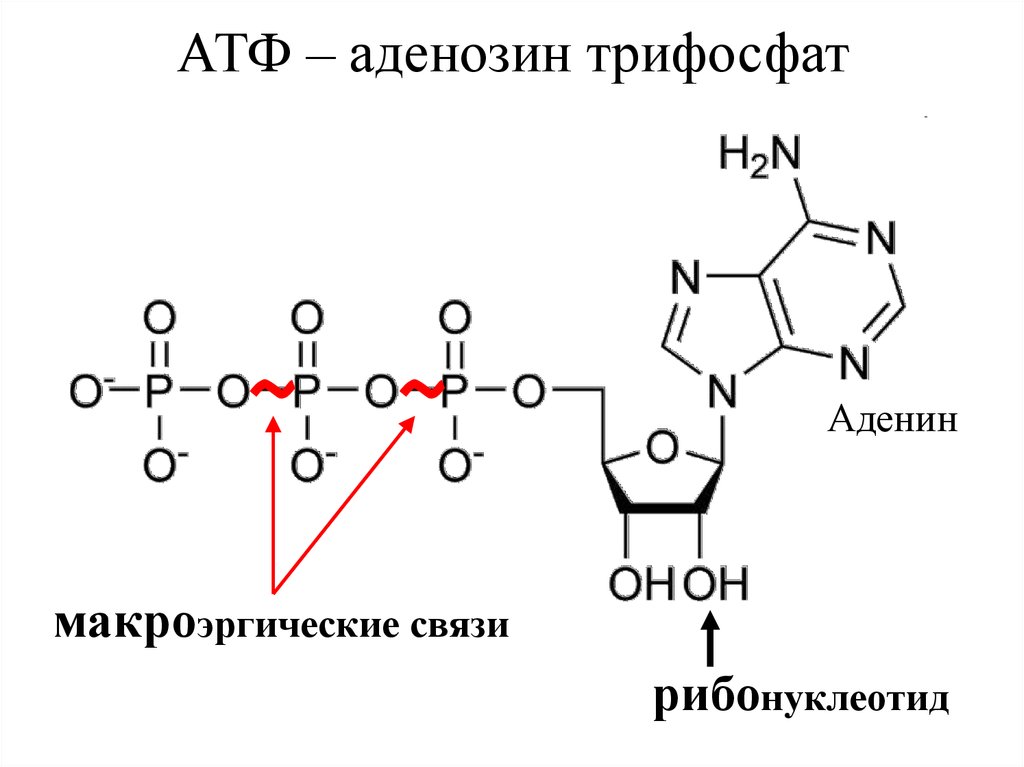
Молекула нуклеотида состоит из пятиуглеродного сахара, азотистого основания и фосфорной кислоты (разд. 5.6.1). В молекуле АМФ сахар представлен рибозой, а основание — аденином. В молекуле АДФ две фосфатные группы, а в молекуле АТФ — три.
Значение АТФ
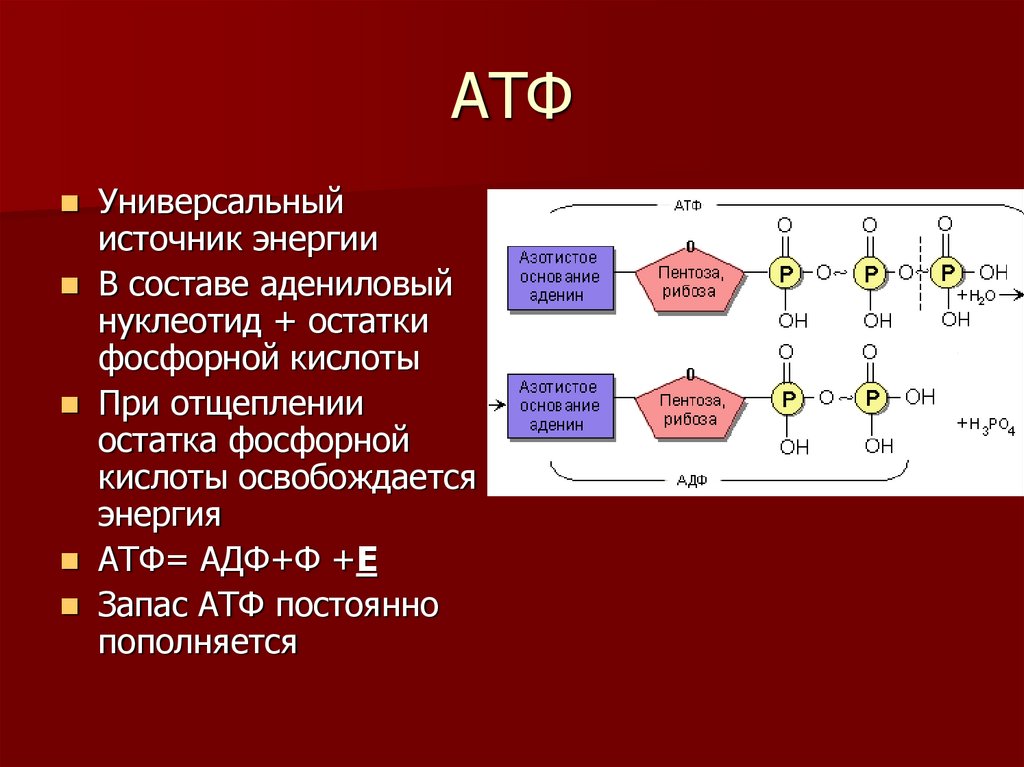
При расщеплении АТФ на АДФ и неорганический фосфат (Фн) высвобождается энергия:
Реакция идет с поглощением воды, т. е. представляет собой гидролиз (в гл. 3 мы много раз встречались с этим весьма распространенным типом биохимических реакций). Отщепившаяся от АТФ третья фосфатная группа остается в клетке в виде неорганического фосфата (Фн).
Выход свободной энергии при этой реакции составляет 30,6 кДж на 1 моль АТФ.
В этой реакции, называемой реакцией конденсации, вода выделяется. Присоединение фосфата к АДФ называется реакцией фосфорилирования. Оба приведенных выше уравнения можно объединить:
Катализирует данную обратимую реакцию фермент, называемый АТФазой. Всем клеткам, как уже было сказано, для выполнения их работы необходима энергия и для всех клеток любого организма источником этой энергии служит АТФ.
Поэтому АТФ называют «универсальным носителем энергии» или «энергетической валютой» клеток. Подходящей аналогией служат электрические батарейки. Вспомните, для чего только мы их не используем.
Мы можем получать с их помощью в одном случае свет, в другом звук, иногда механическое движение, а иногда нам нужна от них собственно электрическая энергия. Удобство батареек в том, что один и тот же источник энергии — батарейку — мы можем использовать для самых разных целей в зависимости от того, куда мы ее поместим.
Он поставляет энергию для таких различных процессов, как мышечное сокращение, передача нервных импульсов, активный транспорт веществ или синтез белков, и для всех прочих видов клеточной активности. Для этого он должен быть просто «подключен» к соответствующей части аппарата клетки.
Аналогию можно продолжить. Батарейки требуется сначала изготовить, а некоторые из них (аккумуляторные) так же, как и АТФ, можно перезарядить. При изготовлении батареек на фабрике в них должно быть заложено (и тем самым израсходовано фабрикой) определенное количество энергии.
Для синтеза АТФ тоже требуется энергия; источником ее служит окисление органических веществ в процессе дыхания. Поскольку для фосфорилирования АДФ энергия высвобождается в процессе окисления, такое фосфорилирование называют окислительным. При фотосинтезе АТФ образуется за счет световой энергии.
Этот процесс называют фотофосфорилированием (см. разд. 7.6.2). Есть в клетке и «фабрики», производящие большую часть АТФ. Это митохондрии; в них размещаются химические «сборочные линии», на которых образуется АТФ в процессе аэробного дыхания.
разд. 7.6.2). Есть в клетке и «фабрики», производящие большую часть АТФ. Это митохондрии; в них размещаются химические «сборочные линии», на которых образуется АТФ в процессе аэробного дыхания.
Наконец, в клетке происходит и перезарядка разрядившихся «аккумуляторов»: после того как АТФ, высвободив заключенную в нем энергию, превратится в АДФ и Фн , он может быть вновь быстро синтезирован из АДФ и Фн за счет энергии, полученной в процессе дыхания от окисления новой порции органических веществ.
Количество АТФ в клетке в любой данный момент очень невелико. Поэтому в АТФ следует видеть только носителя энергии, а не ее депо. Для длительного хранения энергии служат такие вещества, как жиры или гликоген. Клетки весьма чувствительны к уровню АТФ.
Как только скорость его использования возрастает, одновременно возрастает и скорость процесса дыхания, поддерживающего этот уровень. Роль АТФ в качестве связующего звена между клеточным дыханием и процессами, идущими с потреблением энергии, видна из рис.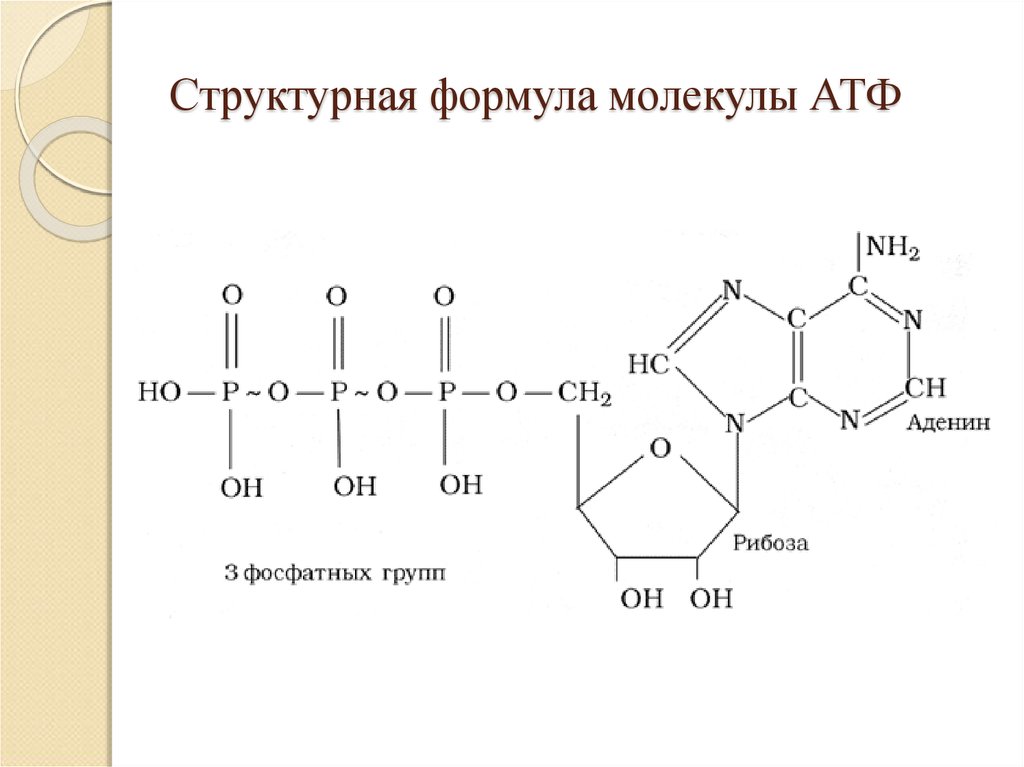 9.3.
9.3.
Схема эта выглядит простой, но она иллюстрирует очень важную закономерность. Можно, таким образом, сказать, что в целом функция дыхания заключается в том, чтобы вырабатывать АТФ.
9.2. Дополните схему на рис. 9.3 в левой ее части, чтобы показать, как в конечном счете в виде глюкозы запасается солнечная энергия.
Суммируем вкратце сказанное выше.
1. Для синтеза АТФ из АДФ и неорганического фосфата требуется 30,6 кДж энергии на 1 моль АТФ.
2. АТФ присутствует во всех живых клетках и является, следовательно, универсальным носителем энергии. Другие носители энергии не используются. Это упрощает дело — необходимый клеточный аппарат может быть более простым и работать более эффективно и экономно.
3. АТФ легко доставляет энергию в любую часть клетки к любому нуждающемуся в энергии процессу.
4. АТФ быстро высвобождает энергию. Для этого требуется всего лишь одна реакция — гидролиз.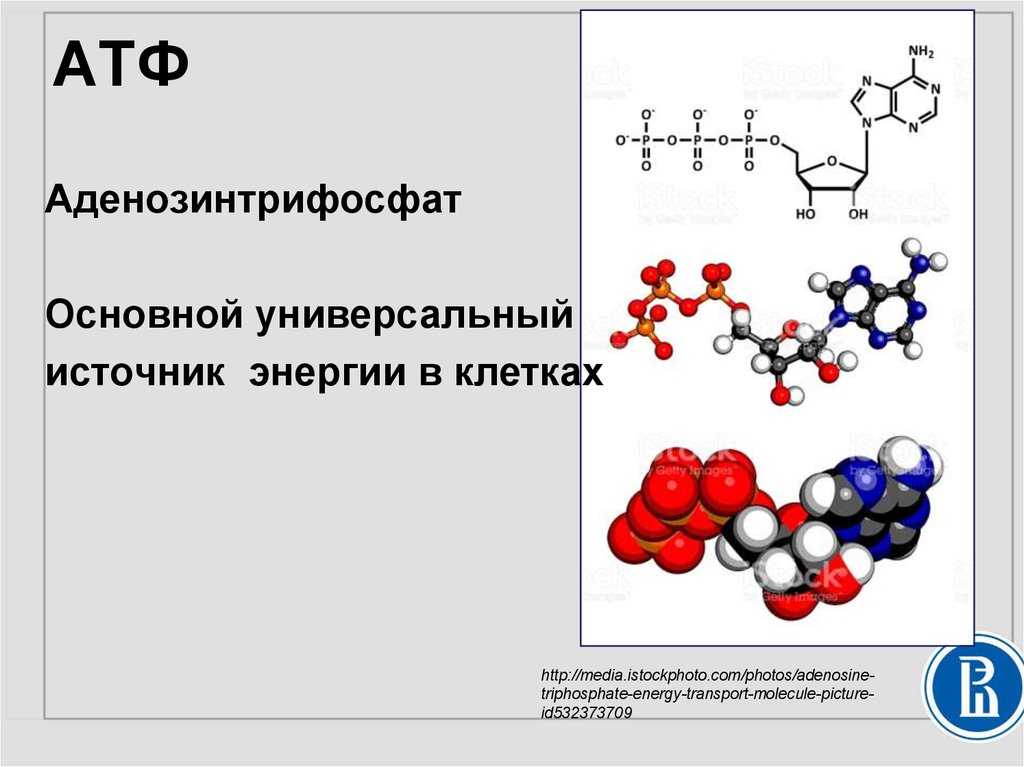
5. Скорость воспроизводства АТФ из АДФ и неорганического фосфата (скорость процесса дыхания) легко регулируется в соответствии с потребностями.
6. АТФ синтезируется во время дыхания за счет химической энергии, высвобождаемой при окислении таких органических веществ, как глюкоза, и во время фотосинтеза — за счет солнечной энергии. Образование АТФ из АДФ и неорганического фосфата называют реакцией фос- форилирования.
Если энергию для фосфорилирования поставляет окисление, то говорят об окислительном фосфорилиро- вании (этот процесс протекает при дыхании), если же для фосфорилирования используется световая энергия, то процесс называют фотофосфорилированием (это имеет место при фотосинтезе).
Литература. Биология : в 3 т. Т. 1 / Д. Тейлор, Н. Грин, У. Стаут ; под ред. Р. Сопера
AOF | 12.01.2021 12:44:45
НазадВперёд
Найдите три ошибки в приведенном тексте.
 Укажите номера предложений, в которых они сделаны, исправьте их. ( 1) Молекула АТФ Найдите три ошибки в приведенном тексте. Укажите номера предложений, в которых они сделаны, исправьте их. ( 1) Молекула АТФ — это мононуклеотид. (2) В состав молекулы АТФ входят аденин, дезоксирибоза и три остатка фосфорной кислоты. (3) Особенностью строения молекулы является наличие трех макроэргических связей. (4) Запас энергии макроэргической связи существенно превышает запас энергии простой связи. (5) При гидролизе молекулы АТФ до АДФ выделяется энергии существенно больше, чем прирасщеплении обычных соединений. (6) Синтез АТФ осуществляется в митохондрияхи комплексе Гольджи.
Укажите номера предложений, в которых они сделаны, исправьте их. ( 1) Молекула АТФ Найдите три ошибки в приведенном тексте. Укажите номера предложений, в которых они сделаны, исправьте их. ( 1) Молекула АТФ — это мононуклеотид. (2) В состав молекулы АТФ входят аденин, дезоксирибоза и три остатка фосфорной кислоты. (3) Особенностью строения молекулы является наличие трех макроэргических связей. (4) Запас энергии макроэргической связи существенно превышает запас энергии простой связи. (5) При гидролизе молекулы АТФ до АДФ выделяется энергии существенно больше, чем прирасщеплении обычных соединений. (6) Синтез АТФ осуществляется в митохондрияхи комплексе Гольджи.
Учебник Курсы Книги Тесты Вопросы
Личный кабинет
Задание ЕГЭ по биологии
Линия заданий — 24
Наслаждайтесь
интересным учебником
и решайте
десятки тестов
на Studarium,
мы всегда рады вам! =)
3875. Найдите три ошибки в приведенном тексте. Укажите номера предложений, в которых они сделаны, исправьте их.
Найдите три ошибки в приведенном тексте. Укажите номера предложений, в которых они сделаны, исправьте их.
(1) Молекула АТФ — это мононуклеотид. (2) В состав молекулы АТФ входят аденин, дезоксирибоза и три остатка фосфорной кислоты. (3) Особенностью строения молекулы является наличие трех макроэргических связей. (4) Запас энергии макроэргической связи существенно превышает запас энергии простой связи. (5) При гидролизе молекулы АТФ до АДФ выделяется энергии существенно больше, чем при расщеплении обычных соединений. (6) Синтез АТФ осуществляется в митохондриях и комплексе Гольджи.
Ошибки допущены в предложениях 2, 3, 6:
2) Молекула АТФ состоит из аденина (азотистое основание), рибозы (сахар) и трех остатков фосфорной кислоты
3) Особенностью строения АТФ является наличие двух макроэргических связей (две связи располагаются между тремя остатками фосфорной кислоты)
6) Синтез АТФ происходит в митохондриях (окислительное фосфорилирование) и хлоропластах (световая фаза фотосинтеза)
P. S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 3875.
P.S. Мы нашли статью, которая относится к данной теме, изучите ее — Энергетический обмен 😉
P.S.S. Для вас готово следующее случайное задание. Мы сами не знаем, но вас ждет что-то интересное!
Физиология, Аденозинтрифосфат — StatPearls
Введение
Тело представляет собой сложный организм, и поэтому ему требуется энергия для поддержания нормального функционирования. Аденозинтрифосфат (АТФ) является источником энергии для использования и хранения на клеточном уровне. Структура АТФ представляет собой нуклеозидтрифосфат, состоящий из азотистого основания (аденина), сахара рибозы и трех последовательно связанных фосфатных групп. АТФ обычно называют «энергетической валютой» клетки, поскольку он обеспечивает легко высвобождаемую энергию в связи между второй и третьей фосфатными группами.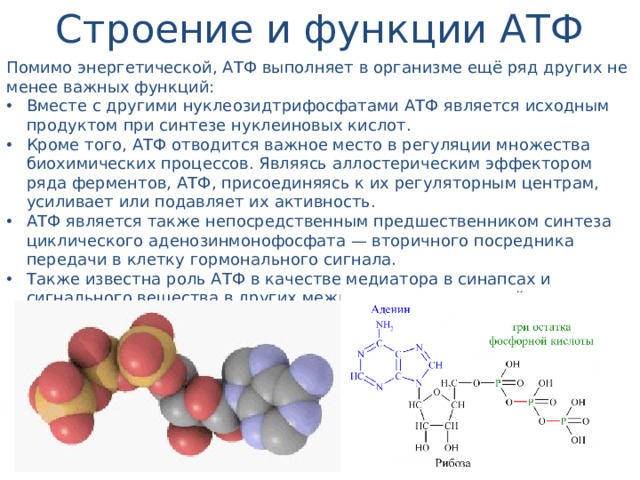 Помимо обеспечения энергией, расщепление АТФ посредством гидролиза выполняет широкий спектр клеточных функций, включая передачу сигналов и синтез ДНК/РНК. Синтез АТФ использует энергию, полученную от нескольких катаболических механизмов, включая клеточное дыхание, бета-окисление и кетоз.
Помимо обеспечения энергией, расщепление АТФ посредством гидролиза выполняет широкий спектр клеточных функций, включая передачу сигналов и синтез ДНК/РНК. Синтез АТФ использует энергию, полученную от нескольких катаболических механизмов, включая клеточное дыхание, бета-окисление и кетоз.
Большая часть синтеза АТФ происходит при клеточном дыхании в митохондриальном матриксе: образуется примерно тридцать две молекулы АТФ на молекулу окисляемой глюкозы. АТФ потребляется для получения энергии в процессах, включая перенос ионов, сокращение мышц, распространение нервных импульсов, фосфорилирование субстрата и химический синтез. Эти процессы, как и другие, создают высокий спрос на АТФ. В результате клетки в организме человека зависят от гидролиза от 100 до 150 моль АТФ в день для обеспечения правильного функционирования. В следующих разделах будет проведена дальнейшая оценка роли АТФ как ключевой молекулы в ежедневном функционировании клетки.
Клеточный
АТФ является превосходной молекулой для хранения энергии, которую можно использовать в качестве «валюты» благодаря фосфатным группам, которые соединяются через фосфодиэфирные связи. Эти связи имеют высокую энергию из-за связанных с ними электроотрицательных зарядов, создающих силу отталкивания между фосфатными группами. Значительное количество энергии остается запасенным в фосфатно-фосфатных связях. В ходе метаболических процессов АТФ гидролизуется до АДФ или далее до АМФ и свободных неорганических фосфатных групп. Процесс гидролиза АТФ до АДФ энергетически выгоден, давая свободную энергию Гиббса -7,3 кал/моль.[1] АТФ должен постоянно пополняться, чтобы питать постоянно работающую клетку. Обычная внутриклеточная концентрация АТФ составляет от 1 до 10 мкМ.[2] Существует множество механизмов обратной связи, обеспечивающих поддержание постоянного уровня АТФ в клетке. Усиление или ингибирование АТФ-синтазы является обычным регуляторным механизмом. Например, АТФ ингибирует фосфофруктокиназу-1 (PFK1) и пируваткиназу, два ключевых фермента гликолиза, эффективно действуя как петля отрицательной обратной связи для ингибирования распада глюкозы при наличии достаточного количества клеточного АТФ.
Эти связи имеют высокую энергию из-за связанных с ними электроотрицательных зарядов, создающих силу отталкивания между фосфатными группами. Значительное количество энергии остается запасенным в фосфатно-фосфатных связях. В ходе метаболических процессов АТФ гидролизуется до АДФ или далее до АМФ и свободных неорганических фосфатных групп. Процесс гидролиза АТФ до АДФ энергетически выгоден, давая свободную энергию Гиббса -7,3 кал/моль.[1] АТФ должен постоянно пополняться, чтобы питать постоянно работающую клетку. Обычная внутриклеточная концентрация АТФ составляет от 1 до 10 мкМ.[2] Существует множество механизмов обратной связи, обеспечивающих поддержание постоянного уровня АТФ в клетке. Усиление или ингибирование АТФ-синтазы является обычным регуляторным механизмом. Например, АТФ ингибирует фосфофруктокиназу-1 (PFK1) и пируваткиназу, два ключевых фермента гликолиза, эффективно действуя как петля отрицательной обратной связи для ингибирования распада глюкозы при наличии достаточного количества клеточного АТФ.
И наоборот, АДФ и АМФ могут активировать PFK1 и пируваткиназу, способствуя синтезу АТФ в периоды высокой потребности в энергии. Другие системы регулируют АТФ, например, в регуляторных механизмах, участвующих в регуляции синтеза АТФ в сердце. Новые эксперименты показали, что десятисекундные всплески, называемые митохондриальными вспышками, могут нарушить выработку АТФ в сердце. Во время этих митохондриальных вспышек митохондрии выделяют активные формы кислорода и эффективно приостанавливают синтез АТФ. Ингибирование продукции АТФ происходит во время митохондриальных вспышек. Во время низкой потребности в энергии, когда клетки сердечной мышцы получали достаточно строительных блоков, необходимых для производства АТФ, митохондриальные вспышки наблюдались чаще. С другой стороны, когда потребность в энергии высока во время быстрого сердечного сокращения, митохондриальные вспышки происходили реже. Эти результаты свидетельствуют о том, что в периоды, когда необходимы значительные количества АТФ, митохондриальные вспышки происходят реже, чтобы обеспечить продолжение производства АТФ. И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и ингибировали выработку АТФ.[3]
И наоборот, в периоды низкой выработки энергии митохондриальные вспышки происходили более регулярно и ингибировали выработку АТФ.[3]
Функция
Гидролиз АТФ обеспечивает энергию, необходимую для многих важных процессов в организмах и клетках. К ним относятся внутриклеточная передача сигналов, синтез ДНК и РНК, пуринергическая передача сигналов, синаптическая передача сигналов, активный транспорт и сокращение мышц. Эти темы не являются исчерпывающим списком, но включают в себя некоторые жизненно важные роли, которые выполняет ATP.
АТФ во внутриклеточной передаче сигналов
Передача сигнала в значительной степени зависит от АТФ. АТФ может служить субстратом для киназ, самого многочисленного АТФ-связывающего белка. Когда киназа фосфорилирует белок, может активироваться сигнальный каскад, что приводит к модуляции различных внутриклеточных сигнальных путей.[4] Активность киназы жизненно важна для клетки и, следовательно, должна жестко регулироваться.
Синтез ДНК/РНК
Для синтеза ДНК и РНК требуется АТФ. АТФ является одним из четырех нуклеотид-трифосфатных мономеров, необходимых при синтезе РНК. Синтез ДНК использует аналогичный механизм, за исключением того, что при синтезе ДНК АТФ сначала трансформируется путем удаления атома кислорода из сахара с образованием дезоксирибонуклеотида, дАТФ.
Пуринергическая сигнализация
Пуринергическая передача сигналов представляет собой форму внеклеточной паракринной передачи сигналов, которая опосредована пуриновыми нуклеотидами, включая АТФ. Этот процесс обычно влечет за собой активацию пуринергических рецепторов на клетках в непосредственной близости, тем самым передавая сигналы для регулирования внутриклеточных процессов. АТФ высвобождается из везикулярных запасов и регулируется IP3 и другими распространенными экзоцитотическими регуляторными механизмами. АТФ хранится и высвобождается вместе с нейротрансмиттерами, что еще раз подтверждает представление о том, что АТФ является необходимым медиатором пуринергической нейротрансмиссии как в симпатических, так и в парасимпатических нервах. АТФ может индуцировать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействие нервной глии, боль и контроль тонуса сосудов.[9]][10][11][12]
АТФ может индуцировать несколько пуринергических реакций, включая контроль вегетативных функций, взаимодействие нервной глии, боль и контроль тонуса сосудов.[9]][10][11][12]
Нейротрансмиссия
Мозг является самым большим потребителем АТФ в организме, потребляя примерно двадцать пять процентов всей доступной энергии.[13] Большое количество энергии тратится на поддержание концентрации ионов для правильной передачи сигналов нейронами и синаптической передачи.[14] Синаптическая передача является энергоемким процессом. На пресинаптических окончаниях АТФ требуется для установления ионного градиента, который перемещает нейротрансмиттеры в везикулы, и для подготовки везикул к высвобождению посредством экзоцитоза. [14] Нейрональная передача сигналов зависит от потенциала действия, достигающего пресинаптических окончаний, сигнализирующего о высвобождении загруженных везикул. Этот процесс зависит от того, что АТФ восстанавливает концентрацию ионов в аксоне после каждого потенциала действия, позволяя возникать другому сигналу. Активный транспорт отвечает за сброс концентраций ионов натрия и калия до исходных значений после возникновения потенциала действия через Na/K-АТФазу. Во время этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки и два иона калия транспортируются обратно в клетку, оба из которых движутся против градиента их концентрации.
Активный транспорт отвечает за сброс концентраций ионов натрия и калия до исходных значений после возникновения потенциала действия через Na/K-АТФазу. Во время этого процесса одна молекула АТФ гидролизуется, три иона натрия транспортируются из клетки и два иона калия транспортируются обратно в клетку, оба из которых движутся против градиента их концентрации.
Потенциалы действия, проходящие по аксону, инициируют везикулярное высвобождение при достижении пресинаптического окончания. После установления ионного градиента потенциалы действия затем распространяются вниз по аксону посредством деполяризации аксона, посылая сигнал к терминалу. Приблизительно один миллиард ионов натрия необходим для распространения одного потенциала действия. Нейронам потребуется гидролизовать около миллиарда молекул АТФ, чтобы восстановить концентрацию ионов натрия/калия после каждой клеточной деполяризации.[13]Возбуждающие синапсы в значительной степени преобладают в сером веществе мозга. Везикулы, содержащие глутамат, высвобождаются в синаптическую щель, чтобы активировать постсинаптические возбуждающие глутаминергические рецепторы.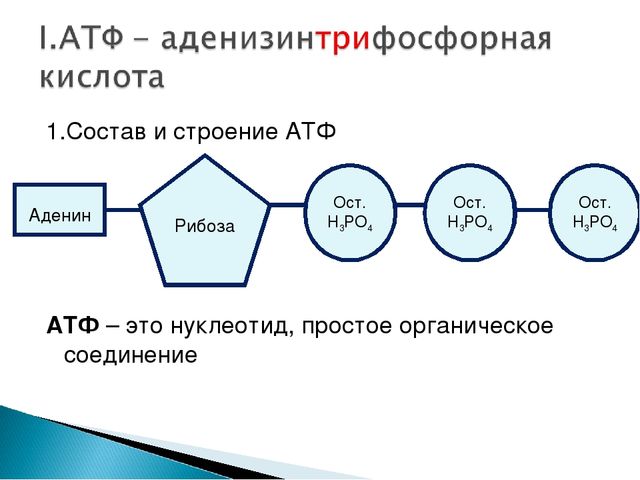 Для загрузки этих молекул требуется большое количество АТФ из-за почти четырех тысяч молекул глутамата, хранящихся в одном пузырьке. Необходимы значительные запасы энергии, чтобы инициировать высвобождение везикул, управлять глутаматергическими постсинаптическими процессами и перерабатывать везикулы, а также оставшийся глутамат. Следовательно, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам.
Для загрузки этих молекул требуется большое количество АТФ из-за почти четырех тысяч молекул глутамата, хранящихся в одном пузырьке. Необходимы значительные запасы энергии, чтобы инициировать высвобождение везикул, управлять глутаматергическими постсинаптическими процессами и перерабатывать везикулы, а также оставшийся глутамат. Следовательно, из-за большого количества энергии, необходимой для упаковки глутамата, митохондрии близки к глутаматергическим пузырькам.
АТФ в сокращении мышц
Сокращение мышц является необходимой функцией повседневной жизни и не может происходить без АТФ. Есть три основные роли, которые АТФ выполняет в действии мышечного сокращения. Во-первых, за счет генерации силы, воздействующей на соседние актиновые филаменты, за счет циклирования миозиновых поперечных мостиков. Во-вторых, это перекачка ионов кальция из миоплазмы через саркоплазматический ретикулум против градиента их концентрации с использованием активного транспорта. Третьей функцией, которую выполняет АТФ, является активный транспорт ионов натрия и калия через сарколемму, так что ионы кальция могут высвобождаться при получении входного сигнала.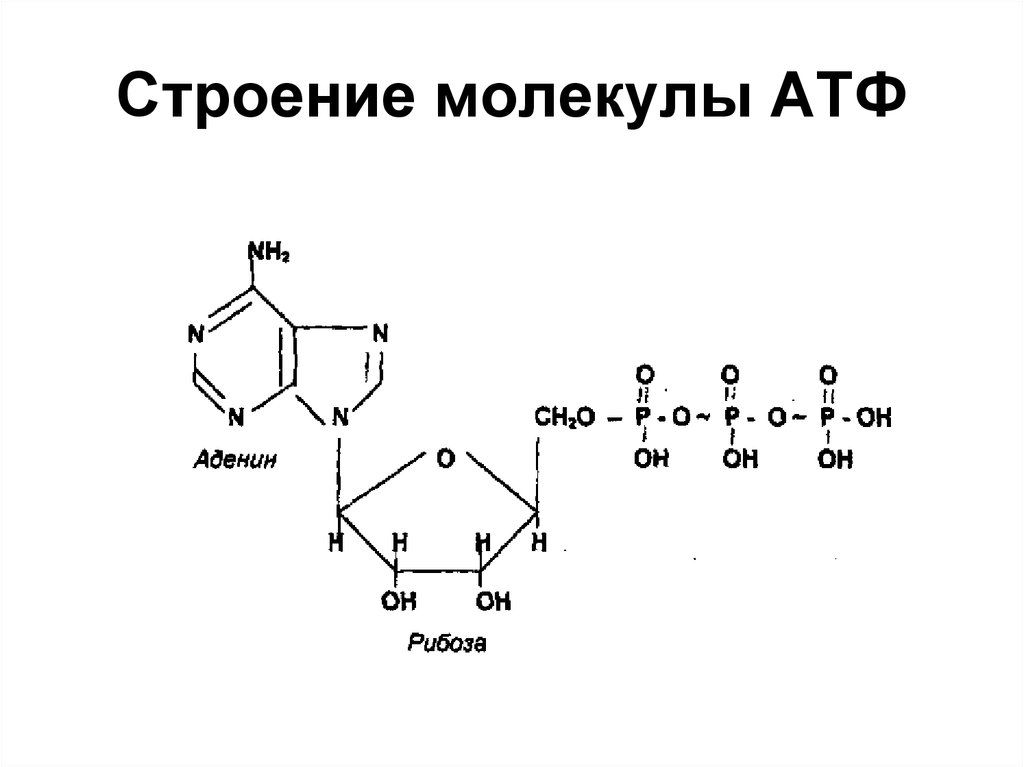 Гидролиз АТФ управляет каждым из этих процессов.[16]
Гидролиз АТФ управляет каждым из этих процессов.[16]
Механизм
Многие процессы способны производить АТФ в организме, в зависимости от текущих метаболических условий. Производство АТФ может происходить в присутствии кислорода в результате клеточного дыхания, бета-окисления, кетоза, катаболизма липидов и белков, а также в анаэробных условиях.
Клеточное дыхание
Клеточное дыхание — это процесс катаболизма глюкозы в ацетил-КоА с образованием высокоэнергетических переносчиков электронов, которые будут окисляться во время окислительного фосфорилирования с образованием АТФ. Во время гликолиза, первой стадии клеточного дыхания, одна молекула глюкозы расщепляется на две молекулы пирувата. Во время этого процесса два АТФ продуцируются путем фосфорилирования субстрата ферментами PFK1 и пируваткиназой. Также происходит образование двух восстановленных молекул переносчика электронов NADH. Затем молекулы пирувата окисляются пируватдегидрогеназным комплексом с образованием молекулы ацетил-КоА.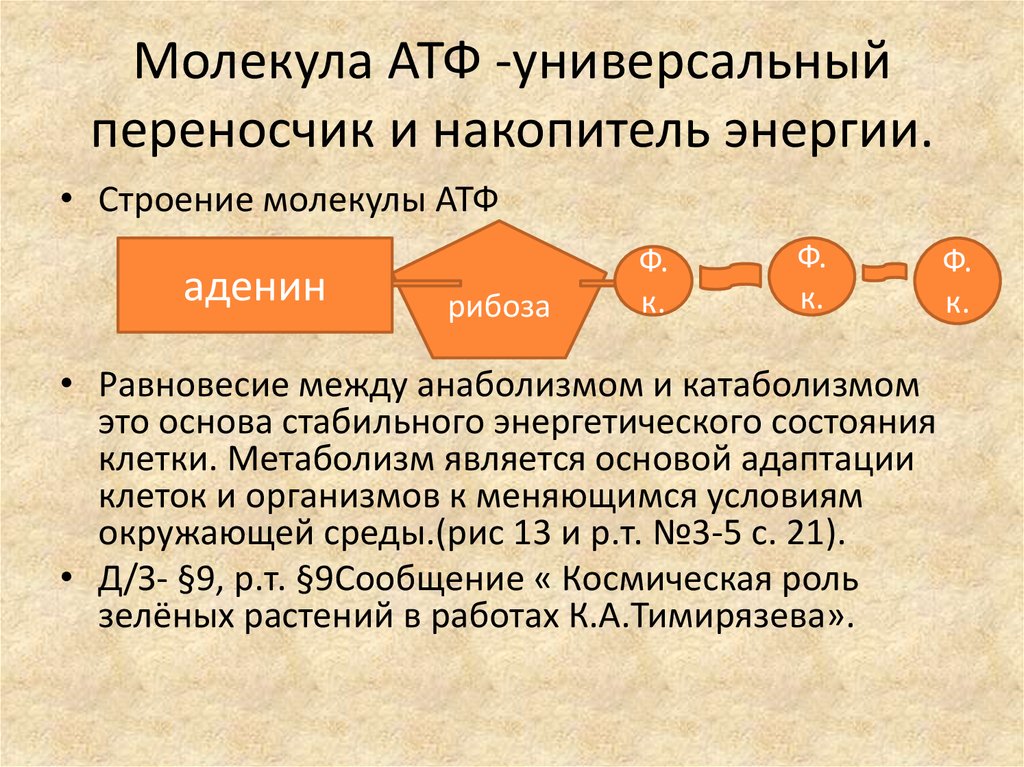 Затем молекула ацетил-КоА полностью окисляется с образованием диоксида углерода и восстановленных переносчиков электронов в цикле лимонной кислоты. При завершении цикла лимонной кислоты общий выход составляет две молекулы диоксида углерода, один эквивалент АТФ, три молекулы НАДН и одна молекула ФАДч3. Эти высокоэнергетические переносчики электронов затем переносят электроны в цепь переноса электронов, в которой ионы водорода (протоны) переносятся против своего градиента во внутреннее пространство мембраны из митохондриального матрикса. Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы.] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель пожертвовал протоны. Одна молекула NADH производит две с половиной молекулы АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Затем молекула ацетил-КоА полностью окисляется с образованием диоксида углерода и восстановленных переносчиков электронов в цикле лимонной кислоты. При завершении цикла лимонной кислоты общий выход составляет две молекулы диоксида углерода, один эквивалент АТФ, три молекулы НАДН и одна молекула ФАДч3. Эти высокоэнергетические переносчики электронов затем переносят электроны в цепь переноса электронов, в которой ионы водорода (протоны) переносятся против своего градиента во внутреннее пространство мембраны из митохондриального матрикса. Затем молекулы АТФ синтезируются в виде протонов, движущихся вниз по электрохимическому градиенту мощности АТФ-синтазы.] Количество произведенного АТФ варьируется в зависимости от того, какой электронный носитель пожертвовал протоны. Одна молекула NADH производит две с половиной молекулы АТФ, тогда как одна молекула FADh3 производит полторы молекулы АТФ.[17]
Бета-окисление
Бета-окисление — еще один механизм синтеза АТФ в организмах. Во время бета-окисления цепи жирных кислот постоянно укорачиваются, образуя молекулы ацетил-КоА. На протяжении каждого цикла бета-окисления жирная кислота восстанавливается на две длины углерода, образуя одну молекулу ацетил-КоА, которая может быть окислена в цикле лимонной кислоты, и по одной молекуле НАДН и ФАДч3, которые передают свою высокую энергию электрон в транспортную цепь.[18]
Во время бета-окисления цепи жирных кислот постоянно укорачиваются, образуя молекулы ацетил-КоА. На протяжении каждого цикла бета-окисления жирная кислота восстанавливается на две длины углерода, образуя одну молекулу ацетил-КоА, которая может быть окислена в цикле лимонной кислоты, и по одной молекуле НАДН и ФАДч3, которые передают свою высокую энергию электрон в транспортную цепь.[18]
Кетоз
Кетоз – это реакция образования АТФ в результате катаболизма кетоновых тел. Во время кетоза кетоновые тела подвергаются катаболизму для производства энергии, образуя двадцать две молекулы АТФ и две молекулы ГТФ на молекулу ацетоацетата, которая окисляется в митохондриях.
Анаэробное дыхание
Когда кислорода мало или он недоступен во время клеточного дыхания, клетки могут подвергаться анаэробному дыханию. В анаэробных условиях происходит накопление молекул НАДН из-за неспособности окислять НАДН до НАД+, что ограничивает действие ГАФД и потребление глюкозы.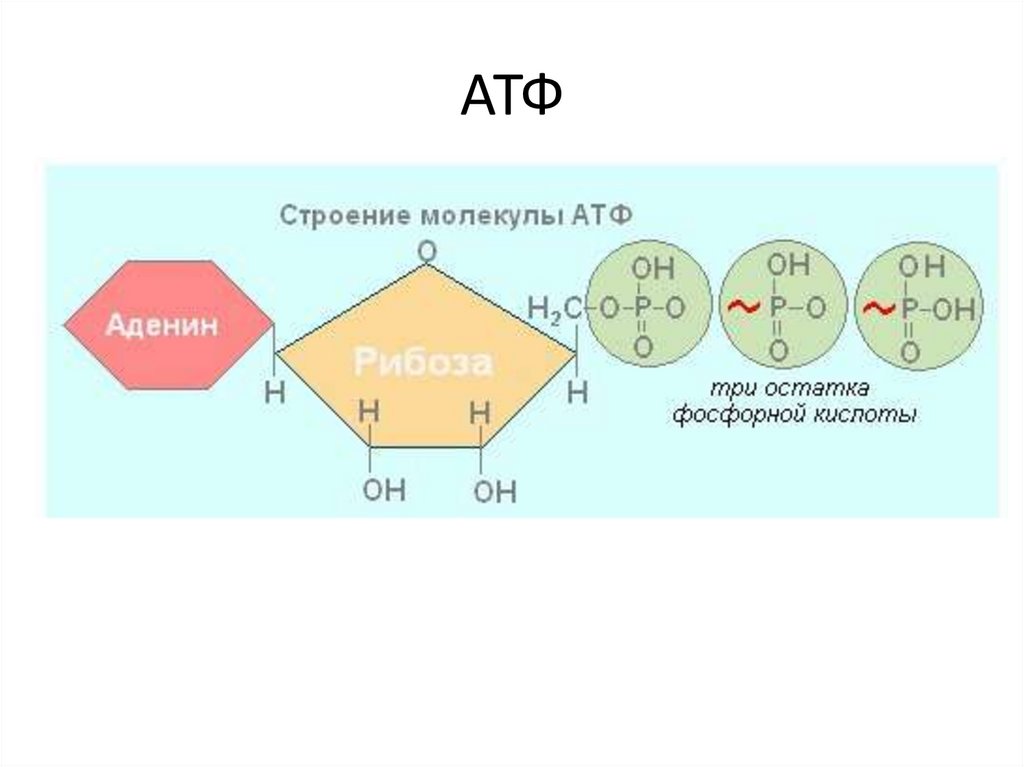 Для поддержания гомеостатического уровня НАДН пируват восстанавливается до лактата, что приводит к окислению одной молекулы НАДН в процессе, известном как молочнокислое брожение. При молочнокислом брожении две молекулы НАДН, образующиеся в результате гликолиза, окисляются для поддержания резервуара НАД+. Эта реакция дает только две молекулы АТФ на молекулу глюкозы.
Для поддержания гомеостатического уровня НАДН пируват восстанавливается до лактата, что приводит к окислению одной молекулы НАДН в процессе, известном как молочнокислое брожение. При молочнокислом брожении две молекулы НАДН, образующиеся в результате гликолиза, окисляются для поддержания резервуара НАД+. Эта реакция дает только две молекулы АТФ на молекулу глюкозы.
Связанное тестирование
Многие методы позволяют рассчитать внутриклеточный уровень АТФ. Общепринятый протокол включает использование люциферазы светлячка, фермента, который вызывает окисление люциферина.[19] Эта реакция поддается количественному измерению из-за выхода энергии этой реакции, высвобождающей фотон света, известного как биолюминесценция, которая поддается количественному измерению.
Клиническое значение
Роль АТФ в контроле боли
ATP демонстрирует уменьшение острой периоперационной боли в клинических исследованиях.[20] В этих исследованиях пациенты получали АТФ внутривенно.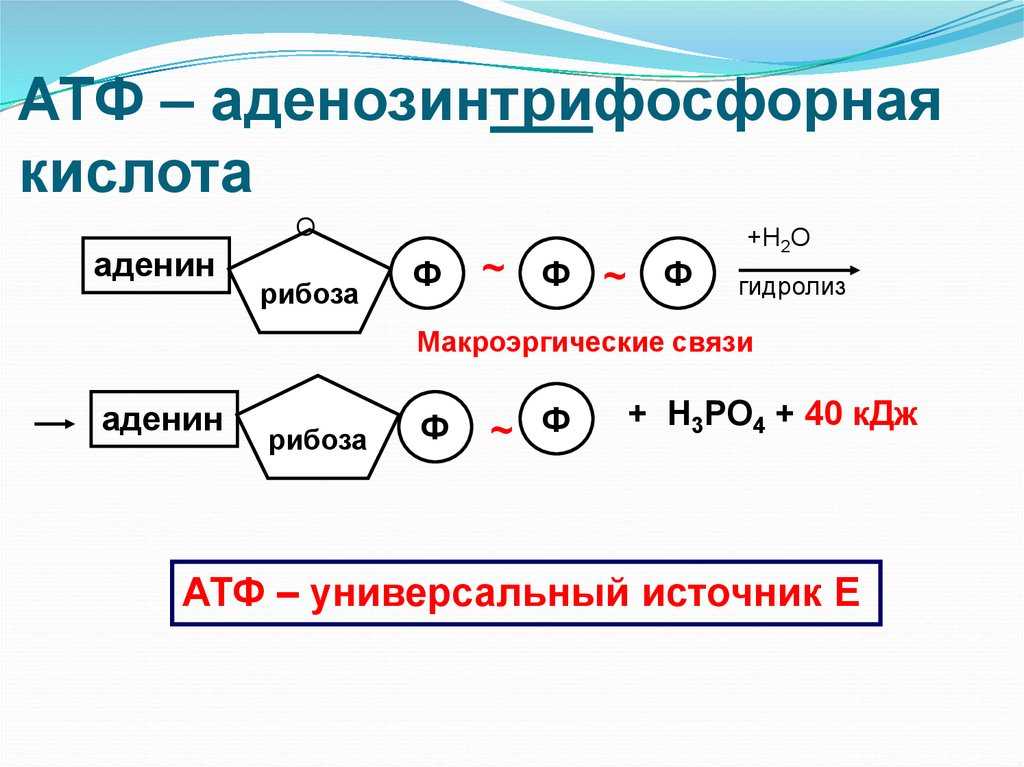 Внутривенная инфузия аденозина действует на аденозиновый рецептор A1, инициируя сигнальный каскад, который в конечном итоге способствует обезболивающему эффекту, наблюдаемому при воспалении. Исследования показали, что соединения аденозина уменьшают аллодинию и гипералгезию при введении в умеренных дозах.[20] Активация аденозинового рецептора A1 оказывает эффективное обезболивающее действие благодаря медленному началу и длительному действию, которое в некоторых случаях может продолжаться в течение нескольких недель.
Внутривенная инфузия аденозина действует на аденозиновый рецептор A1, инициируя сигнальный каскад, который в конечном итоге способствует обезболивающему эффекту, наблюдаемому при воспалении. Исследования показали, что соединения аденозина уменьшают аллодинию и гипералгезию при введении в умеренных дозах.[20] Активация аденозинового рецептора A1 оказывает эффективное обезболивающее действие благодаря медленному началу и длительному действию, которое в некоторых случаях может продолжаться в течение нескольких недель.
Анестезия
Добавление АТФ дало положительные результаты во время анестезии. Имеющиеся данные показывают, что низкие дозы аденозина уменьшают невропатическую боль, ишемическую боль и гипералгезию до уровня, сравнимого с морфином.[21] Аденозин также снижал послеоперационное использование опиоидов, что свидетельствует о потенциальной длительной активации аденозиновых рецепторов А1.
Кардиология и хирургия
Было показано, что АТФ является безопасным и практичным легочным сосудорасширяющим средством у пациентов с легочной гипертензией. [21] Точно так же аденозин и АТФ можно использовать во время операции, чтобы вызвать гипотензию у пациентов.[21]
[21] Точно так же аденозин и АТФ можно использовать во время операции, чтобы вызвать гипотензию у пациентов.[21]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Литература
- 1.
Meurer F, Do HT, Sadowski G, Held C. Стандартная энергия Гиббса метаболических реакций: II. Глюкозо-6-фосфатазная реакция и гидролиз АТФ. Биофиз хим. 2017 Апр; 223:30-38. [PubMed: 28282626]
- 2.
Beis I, Newsholme EA. Содержание адениновых нуклеотидов, фосфагенов и некоторых гликолитических интермедиатов в покоящихся мышцах позвоночных и беспозвоночных. Биохим Дж. 1975 октября; 152(1):23-32. [Бесплатная статья PMC: PMC1172435] [PubMed: 1212224]
- 3.
Wang X, Zhang X, Wu D, Huang Z, Hou T, Jian C, Yu P, Lu F, Zhang R, Sun T, Li J, Qi W, Wang Y, Gao F, Cheng H. Митохондриальные вспышки регулируют гомеостаз АТФ в сердце.
 Элиф. 2017 Jul 10;6 [PMC бесплатная статья: PMC5503511] [PubMed: 28692422]
Элиф. 2017 Jul 10;6 [PMC бесплатная статья: PMC5503511] [PubMed: 28692422]- 4.
Mishra NS, Tuteja R, Tuteja N. Передача сигналов через сети киназ MAP в растениях. Арх Биохим Биофиз. 2006 01 августа; 452 (1): 55-68. [В паблике: 16806044]
- 5.
Лин Х, Айрапетов М.К., Сун Г. Характеристика взаимодействий между активным центром протеинтирозинкиназы и активатором двухвалентного металла. БМС Биохим. 2005 23 ноября; 6:25. [PMC бесплатная статья: PMC1316873] [PubMed: 16305747]
- 6.
Zimmermann H. Внеклеточный АТФ и другие нуклеотиды-повсеместные триггеры высвобождения межклеточного мессенджера. Пуринергический сигнал. 2016 март; 12(1):25-57. [Бесплатная статья PMC: PMC4749530] [PubMed: 26545760]
- 7.
Каменецкий М., Миддельхауфе С., Банк Э.М., Левин Л.Р., Бак Дж., Стигборн С. Молекулярные детали образования цАМФ в клетках млекопитающих: рассказ о двух системах. Дж Мол Биол. 2006 г., 29 сентября; 362(4):623-39.
 [Бесплатная статья PMC: PMC3662476] [PubMed: 16934836]
[Бесплатная статья PMC: PMC3662476] [PubMed: 16934836]- 8.
Джойс CM, Steitz TA. Структуры и функции полимеразы: вариации на тему? J Бактериол. 1995 ноябрь; 177 (22): 6321-9. [Бесплатная статья PMC: PMC177480] [PubMed: 7592405]
- 9.
Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A, Giorgi C, Marchi S, Missiroli S, Poletti F, Wieckowski MR, Pinton P. Синтез и хранение АТФ. Пуринергический сигнал. 2012 Сентябрь;8(3):343-57. [Бесплатная статья PMC: PMC3360099] [PubMed: 22528680]
- 10.
Карденас С., Миллер Р.А., Смит И., Буй Т., Молго Дж., Мюллер М., Вайс Х., Чунг К.Х., Ян Дж., Паркер И., Томпсон С.Б., Бирнбаум М.Дж., Халлоус К.Р., Фоскетт Дж.К. Существенная регуляция биоэнергетики клетки путем конститутивного переноса Ca2+ рецептора InsP3 в митохондрии. Клетка. 2010 23 июля; 142 (2): 270-83. [Бесплатная статья PMC: PMC2911450] [PubMed: 20655468]
- 11.
Пабло Хуидобро-Торо Дж.
 , Вероника Доносо М. Симпатическая котрансмиссия: скоординированное действие АТФ и норадреналина и их модуляция нейропептидом Y в сосудистых нейроэффекторных соединениях человека. Евр Дж Фармакол. 2004 01 октября; 500 (1-3): 27-35. [PubMed: 15464018]
, Вероника Доносо М. Симпатическая котрансмиссия: скоординированное действие АТФ и норадреналина и их модуляция нейропептидом Y в сосудистых нейроэффекторных соединениях человека. Евр Дж Фармакол. 2004 01 октября; 500 (1-3): 27-35. [PubMed: 15464018]- 12.
Coco S, Calegari F, Pravettoni E, Pozzi D, Taverna E, Rosa P, Matteoli M, Verderio C. Хранение и высвобождение АТФ из астроцитов в культуре. Дж. Биол. Хим. 2003 10 января; 278 (2): 1354-62. [В паблике: 12414798]
- 13.
Аттвелл Д., Лафлин С.Б. Энергетический баланс для передачи сигналов в сером веществе головного мозга. J Cereb Blood Flow Metab. 21 октября 2001 г. (10): 1133-45. [PubMed: 11598490]
- 14.
Harris JJ, Jolivet R, Attwell D. Использование и поставка синаптической энергии. Нейрон. 06 сентября 2012 г .; 75 (5): 762–777. [PubMed: 22958818]
- 15.
Вонг-Райли MT. Цитохромоксидаза: эндогенный метаболический маркер активности нейронов.
 Тренды Нейроси. 1989 марта; 12(3):94-101. [PubMed: 2469224]
Тренды Нейроси. 1989 марта; 12(3):94-101. [PubMed: 2469224]- 16.
Барклай CJ. Энергетика сокращения. сост. физиол. 2015 Апрель;5(2):961-95. [PubMed: 25880520]
- 17.
Богатый PR. Молекулярный механизм дыхательной цепи Кейлина. Биохим Сок Транс. 2003 г.; 31 декабря (часть 6): 1095–105. [PubMed: 14641005]
- 18.
Ronnett GV, Kim EK, Landree LE, Tu Y. Метаболизм жирных кислот как мишень для лечения ожирения. Физиол Поведение. 2005 19 мая;85(1):25-35. [PubMed: 15878185]
- 19.
Бровко Л.Ю., Романова Н.А., Угарова Н.Н. Биолюминесцентный анализ бактериального внутриклеточного АМФ, АДФ и АТФ с использованием коиммобилизованного трехферментного реагента (аденилаткиназа, пируваткиназа и люцифераза светлячка). Анальная биохимия. 1994 01 августа; 220 (2): 410-4. [PubMed: 7978286]
- 20.
Хаяшида М., Фукуда К., Фукунага А. Клиническое применение аденозина и АТФ для обезболивания.
 Джей Анест. 2005;19(3): 225-35. [PubMed: 16032451]
Джей Анест. 2005;19(3): 225-35. [PubMed: 16032451]- 21.
Agteresch HJ, Dagnelie PC, van den Berg JW, Wilson JH. Аденозинтрифосфат: установившееся и потенциальное клиническое применение. Наркотики. 1999 авг; 58 (2): 211-32. [PubMed: 10473017]
Аденозинтрифосфат | Определение, структура, функции и факты
общий обзор процессов производства АТФ
Смотреть все СМИ
- Ключевые люди:
- Джон Уокер Йенс С. Скоу Пол Д. Бойер
- Похожие темы:
- метаболизм нуклеотид кофермент гликолиз
См. все связанные материалы →
аденозинтрифосфат (АТФ) , молекула-носитель энергии, обнаруженная в клетках всех живых существ. АТФ улавливает химическую энергию, полученную при распаде молекул пищи, и высвобождает ее для подпитки других клеточных процессов.
Клеткам требуется химическая энергия для выполнения трех основных задач: для запуска метаболических реакций, которые не происходят автоматически; для транспорта необходимых веществ через мембраны; и для выполнения механической работы, такой как движение мышц.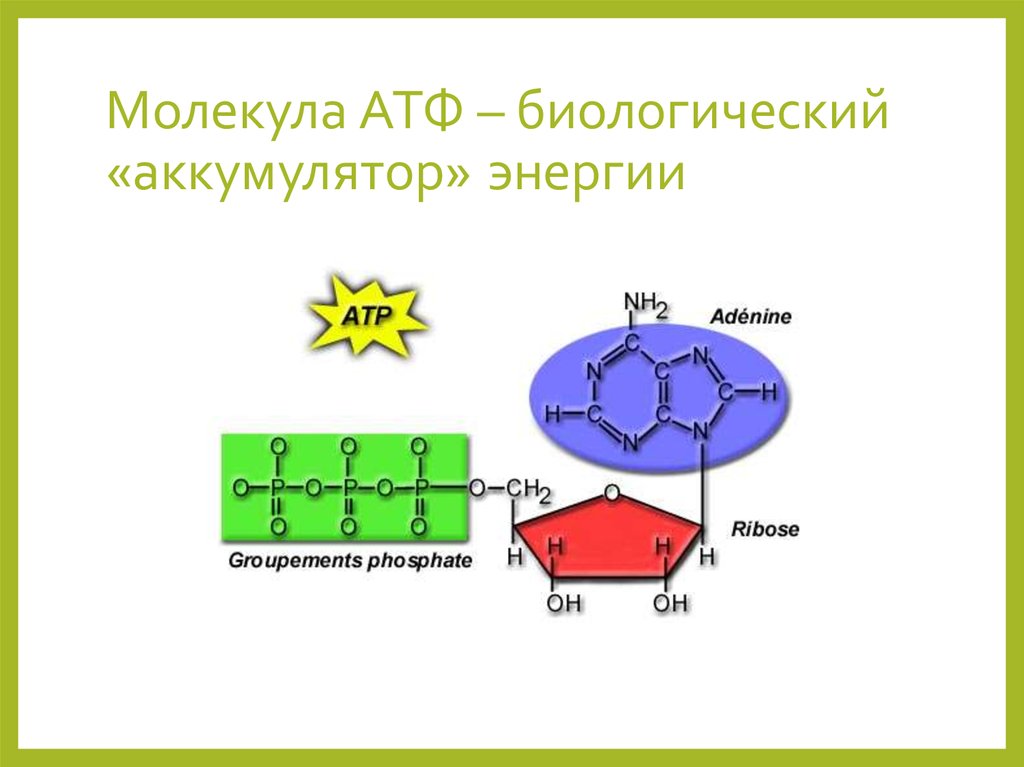 АТФ не является молекулой-аккумулятором химической энергии; это работа углеводов, таких как гликоген и жиры. Когда клетка нуждается в энергии, она преобразуется из запасных молекул в АТФ. Затем АТФ служит челноком, доставляющим энергию в те места внутри клетки, где происходят энергозатратные действия.
АТФ не является молекулой-аккумулятором химической энергии; это работа углеводов, таких как гликоген и жиры. Когда клетка нуждается в энергии, она преобразуется из запасных молекул в АТФ. Затем АТФ служит челноком, доставляющим энергию в те места внутри клетки, где происходят энергозатратные действия.
More From Britannica
life: ATP
АТФ представляет собой нуклеотид, состоящий из трех основных структур: азотистого основания, аденина; сахар, рибоза; и цепь из трех фосфатных групп, связанных с рибозой. Фосфатный хвост АТФ является фактическим источником энергии, который использует клетка. Доступная энергия содержится в связях между фосфатами и высвобождается при их разрыве, что происходит за счет присоединения молекулы воды (процесс, называемый гидролизом). Обычно для получения энергии из АТФ удаляется только внешний фосфат; когда это происходит, АТФ превращается в аденозиндифосфат (АДФ), форму нуклеотида, содержащую только два фосфата.