48. Катаболизм аминокислот.
80% аминокислот, которые поступают в организм из желудочно-кишечного тракта, используются для синтеза белков. Остальные 20% вступают в метаболические процессы. Все эти процессы можно разделить на 2 группы:
1. Общие пути катаболизма аминокислот (для всех аминокислот они одинаковы). В них принимает участие общая часть молекулы аминокислоты.
2. Специфические пути метаболизма для каждой отдельной аминокислоты (разные для разных аминокислот) — участвуют радикалы аминокислот. Это — особенности обмена отдельных аминокислот.
ОБЩИЕ ПУТИ КАТАБОЛИЗМА АМИНОКИСЛОТ
1. Декарбоксилирование
2. Дезаминирование
3. Трансаминирование (переаминирование)
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
У человека происходит в основном путем окислительного дезаминирования. Эти реакции протекают с помощью двух ферментов:
— оксидаза Д-аминокислот
— оксидаза L-аминокислот
Эти
ферменты обладают групповой
стереоспецифичностью. Оксидазы отнимают
протоны и электроны от аминокислот с
помощью такого же механизма, как и
оксидазы, обеспечивающие дезаминирование
биогенных аминов. Эти ферменты являются
флавопротеинами и содержат в качестве
простетической группы ФАД или ФМН:
Оксидазы отнимают
протоны и электроны от аминокислот с
помощью такого же механизма, как и
оксидазы, обеспечивающие дезаминирование
биогенных аминов. Эти ферменты являются
флавопротеинами и содержат в качестве
простетической группы ФАД или ФМН:
На первой стадии образуется иминокислота, а затем, после спонтанного гидролиза образуется альфа-кетокислота.
Кроме оксидаз имеется еще один фермент, катализирующий окислительное дезаминирование глутаминовой кислоты — глутамат-дегидрогеназа (глутаматДГ).
Этот
фермент является НАД-зависимым и обладает
высокой активностью (как и другие
НАД-зависимые дегидрогеназы). В этом
его отличие от оксидаз аминокислот,
которые медленно превращают аминокислоты
в физиологических условиях (поэтому в
клетке сохраняется большинство
аминокислот). Так как глутамат-ДГ является
никотинамидной, то отнимаемые протоны
и электроны не передаются сразу на
кислород, а транспортируются по полной
цепи МтО с образованием воды и параллельным
образованием трех молекул АТФ.
Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом — он ингибируется избытком АТФ, и активируется избытком АДФ.
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ
1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования — дезаминирование тоже может играть роль первого этапа на путях распада аминокислот.
2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма.
3.
Другой продукт реакции дезаминирования
— альфа-кетокислота.Все образующиеся
альфа-кетокислоты легко расщепляются
дальше до СО2 и Н2О
(например, аланин превращается в ПВК
(путем дезаминирования; аспартат — в
ЩУК; глутаминовая кислота — в
альфа-кетоглутаровую). Большинство
альфа-кетокислот тем или иным путем
превращаются в кислоты, которые являются
промежуточными метаболитами ЦТК:
Большинство
альфа-кетокислот тем или иным путем
превращаются в кислоты, которые являются
промежуточными метаболитами ЦТК:
— в альфа-кетоглутаровую; — в янтарную;- фумаровую; — щавелево-уксусную. Все эти метаболиты могут в организме трансформироваться в углеводы, перед этим превращаясь в ПВК. Поэтому большинство аминокислот относится к группе, которая называется ГЛЮКОГЕННЫМИ АМИНОКИСЛОТАМИ (их 17). Только 3 аминокислоты не могут превращаться в ПВК, но превращаются в Ац-КоА — КЕТОГЕННЫЕ АМИНОКИСЛОТЫ : лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
Метаболические пути, в которые вступают аминокслоты после дезаминирования, уже не являются собственно путями метаболизма аминокислот, а являются универсальными и для аминокислот, и для углеводов, и для жиров.
— трансдезаминирование — Биохимия
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
Реакция, катализируемая оксидазами D- и L-аминокислот
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
Реакция прямого окислительного дезаминирования
глутаминовой кислоты
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве конечной кетокислоты-акцептора («кетокислота 2») в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат («аминокислота 2»).
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться в печени для синтеза глюкозы в глюконеогенезе. В этом случае количество аминотрансфераз в гепатоците увеличивается под влиянием глюкокортикоидов.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования:
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.

При патологиях (сахарный диабет 1 типа, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
- является одной из транспортных форм аминного азота в гепатоциты,
- способна реагировать со свободным аммиаком, обезвреживая его (синтез глутамина).
Процесс трансдезаминирования идет в организме непрерывно, потому что:
- сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
10.2: Катаболизм аминокислот — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 66034
- Кевин Ахерн и Индира Раджагопал
- Университет штата Орегон
Расщепление глутамина глутаминазой является источником ионов аммония в клетке.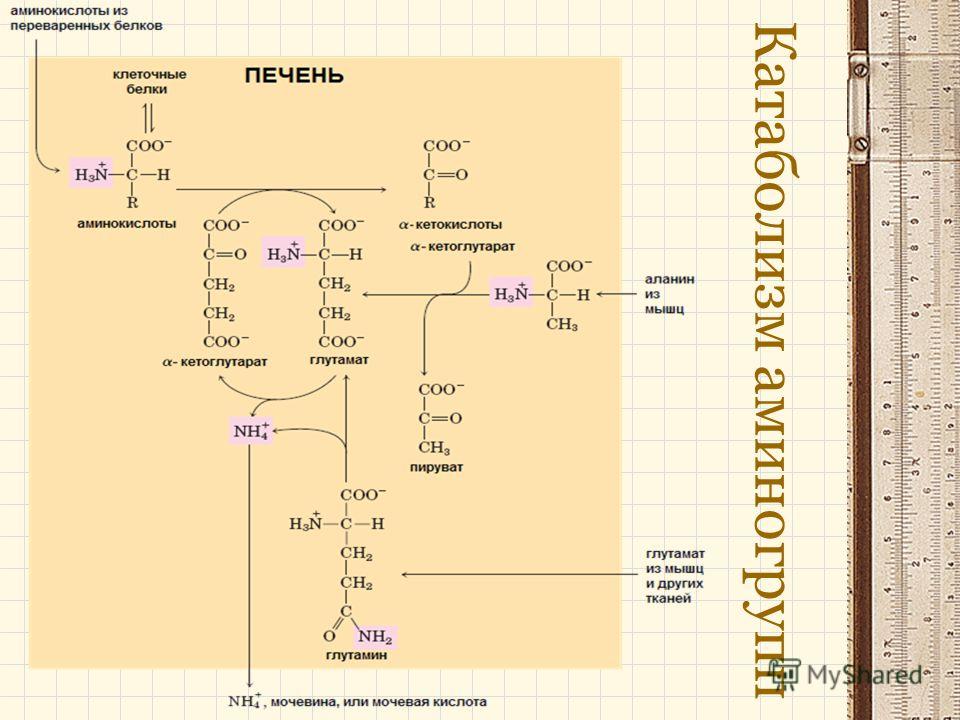 Другой продукт – глутамат. Глутамат, конечно, может быть превращен реакцией трансаминирования в альфа-кетоглутарат, который может быть окислен в цикле лимонной кислоты.
Другой продукт – глутамат. Глутамат, конечно, может быть превращен реакцией трансаминирования в альфа-кетоглутарат, который может быть окислен в цикле лимонной кислоты.
- Аспарагин может быть аналогичным образом расщеплен до аммония и аспартата с помощью аспарагиназы, а аспартат может быть преобразован трансаминированием в оксалоацетат для окисления в цикле лимонной кислоты.
- Аланин превращается в пируват в реакции трансаминирования, что делает его глюкогенным.
- Аргинин гидролизуется в цикле мочевины с образованием мочевины и орнитина.
- Пролин катаболизируется до глутамата в обратном направлении его синтеза.
- Серин отдает углерод с образованием фолиевой кислоты, а другим продуктом реакции является глицин, который сам окисляется до углекислого газа и аммиака. Глицин также может быть преобразован обратно в серин, который также может быть преобразован обратно в 3-фосфоглицерат или пируват.
- Треонин может расщепляться тремя путями, хотя для человека важны только два.
 Один путь ведет к ацетил-КоА и глицину. Другой приводит к пирувату.
Один путь ведет к ацетил-КоА и глицину. Другой приводит к пирувату. - Цистеин можно расщепить несколькими способами. Самый простой происходит в печени, где на нее может воздействовать десульфураза с образованием сероводорода и пирувата.
- Метионин может быть преобразован в цистеин для дальнейшего метаболизма. Его можно превратить в сукцинил-КоА для окисления в цикле лимонной кислоты. Он также может быть преобразован в S-аденозилметионин (SAM), донор углерода.
- Изолейцин и валин также могут быть преобразованы в сукцинил-КоА после преобразования сначала в пропионил-КоА. Поскольку для превращения пропионил-КоА в сукцинил-КоА требуется витамин \(\text{B}_{12}\), для катаболизма этих аминокислот также требуется витамин.
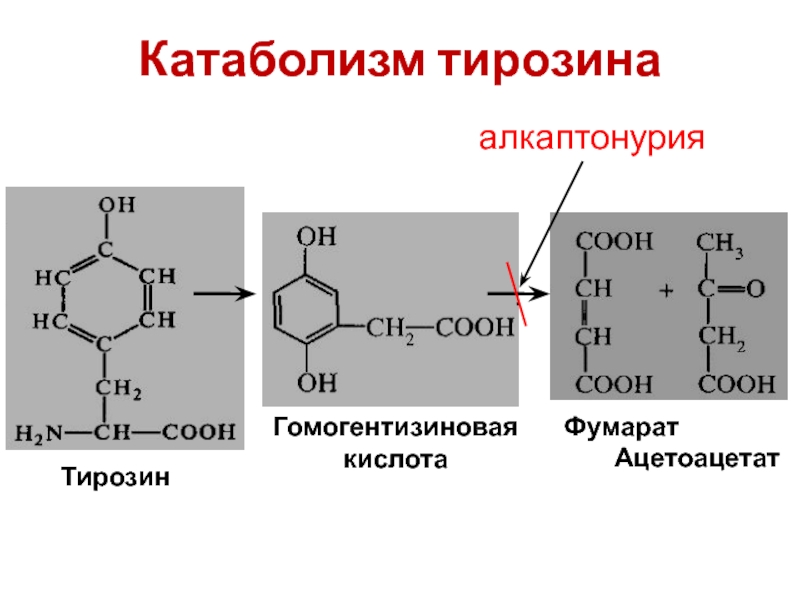
- Фенилаланин превращается в ходе катаболизма в тирозин, который в конечном итоге расщепляется до фумарата и ацетоацетата. Таким образом, обе эти аминокислоты являются глюкогенными и кетогенными. Тирозин также может быть преобразован в дофамин, норадреналин и адреналин.

- Лейцин и лизин могут катаболизироваться до ацетоацетата и ацетил-КоА. Лизин также является важным предшественником карнитина.
- Гистидин может катаболизироваться бактериями в кишечнике до гистамина, который при избытке вызывает строительство или расширение различных кровеносных сосудов.
- Катаболизм триптофана сложен, но может происходить через аланин, ацетоацетат и ацетил-КоА
Таким образом, в пируват метаболизируются следующие вещества: аланин, цистеин, глицин, серин и треонин
- Оксалоацетат получают из аспартата и аспарагина
- Сукцинил-КоА производится из изолейцина, валина и метионина
- Альфа-кетоглутарат производится из аргинина, глутамата, глутамина, гистидина и пролина.
- Фенилаланин и тирозин расщепляются до фумарата и ацетоацетата
- Лейцин и лизин дают ацетоацетат и ацетил-КоА.
- Триптофан приводит к аланину, ацетоацетату и ацетил-КоА.

Наконец, аминокислоты, помимо включения в белки, служат предшественниками важных соединений, в том числе серотонина (из триптофана), гема порфирина (из глицина), оксида азота (из аргинина) и нуклеотидов (из аспартата, глицина и глютамин).
Рисунок 7.8.1: Преобразование L-триптофана в серотонин, мелатонин и ниацинЭта страница под названием 10.2: Катаболизм аминокислот распространяется по лицензии CC BY-NC-SA, автором, ремиксом и/или куратором этой страницы являются Кевин Ахерн и Индира Раджагопал.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Кевин Ахерн и Индира Раджагопал
- Лицензия
- CC BY-NC-SA
- Показать оглавление
- нет
- Теги
- Катаболизм аминокислот
- источник[1]-био-3059
Катаболизм аминокислот с разветвленной цепью способствует дифференцировке адипоцитов и липогенезу
Rosen, E. D. и Шпигельман, Б.М. О чем мы говорим, когда говорим о жире. Cell 156 , 20–44 (2014).
D. и Шпигельман, Б.М. О чем мы говорим, когда говорим о жире. Cell 156 , 20–44 (2014).
Артикул КАС Google Scholar
Степпан С.М. и другие. Гормон резистин связывает ожирение с диабетом. Природа 409 , 307–312 (2001).
Артикул КАС Google Scholar
Стекло, К.К. и Олефски, Дж. М. Воспаление и передача сигналов липидов в этиологии резистентности к инсулину. Сотовый метаб. 15 , 635–645 (2012).
Артикул КАС Google Scholar
Турер, А.Т. и Шерер, П.Е. Адипонектин: механистическое понимание и клиническое значение. Диабетология 55 , 2319–2326 (2012).
Артикул КАС Google Scholar
Герман М. А. и др. Новая изоформа ChREBP в жировой ткани регулирует системный метаболизм глюкозы. Природа 484 , 333–338 (2012).
А. и др. Новая изоформа ChREBP в жировой ткани регулирует системный метаболизм глюкозы. Природа 484 , 333–338 (2012).
Артикул КАС Google Scholar
Кан, Б. Б. и Флиер, Дж. С. Ожирение и резистентность к инсулину. Дж. Клин. Вкладывать деньги. 106 , 473–481 (2000).
Артикул КАС Google Scholar
Бус, М.Г., Биггерс, Дж.Ф., Фридеричи, К.Х. и Бузе, Дж. Ф. Окисление аминокислот с разветвленной цепью изолированными сердцами и диафрагмами крысы. Влияние жирных кислот, глюкозы и пируватного дыхания. Дж. Биол. хим. 247 , 8085–8096 (1972).
КАС пабмед Google Scholar
Розенталь Дж., Анхель А. и Фаркас Дж. Метаболическая судьба лейцина: важный предшественник стерола в жировой ткани и мышцах. утра. Дж. Физиол. 226 , 411–418 (1974).
утра. Дж. Физиол. 226 , 411–418 (1974).
Артикул КАС Google Scholar
Newgard, CB et al. Метаболический признак, связанный с аминокислотами с разветвленной цепью, который отличает людей с ожирением от худых и способствует резистентности к инсулину. Сотовый метаб. 9 , 311–326 (2009).
Артикул КАС Google Scholar
Фин, О. и др. Метаболические профили плазмы, отражающие гомеостаз глюкозы у афроамериканских женщин с ожирением, не страдающих диабетом и диабетом 2 типа. PLoS ONE 5 , e15234 (2010 г.).
Артикул Google Scholar
Ван, Т.Дж. и другие. Метаболитные профили и риск развития диабета. Нац. Мед. 17 , 448–453 (2011).
Артикул Google Scholar
Кедишвили Н. Ю., Попов К.М., Яскевич Ю.А. и Харрис, Р.А. Координированная экспрессия катаболических ферментов валина во время адипогенеза: анализ активности, мРНК, уровней белка и метаболических последствий. Арх. Биохим. Биофиз. 315 , 317–322 (1994).
Ю., Попов К.М., Яскевич Ю.А. и Харрис, Р.А. Координированная экспрессия катаболических ферментов валина во время адипогенеза: анализ активности, мРНК, уровней белка и метаболических последствий. Арх. Биохим. Биофиз. 315 , 317–322 (1994).
Артикул КАС Google Scholar
Си, Ю., Юн, Дж. и Ли, К. Анализ профиля потока и модульности зависящих от времени метаболических изменений образования адипоцитов de novo. утра. Дж. Физиол. Эндокринол. Метаб. 292 , E1637–E1646 (2007 г.).
Артикул КАС Google Scholar
Чуанг, Д.Т., Ху, К.В., и Патель, М.С. Индукция комплекса 2-оксокислоты дегидрогеназы с разветвленной цепью в адипоцитах 3T3-L1 во время дифференцировки. Биохим. J. 214 , 177–181 (1983).
Артикул КАС Google Scholar
Лакей, Д. Э. и другие. Регуляция экспрессии фермента катаболизма аминокислот с разветвленной цепью в жировой ткани и перекрестного потока аминокислот в жировой ткани при ожирении человека. утра. Дж. Физиол. Эндокринол. Метаб. 304 , E1175–E1187 (2013 г.).
Э. и другие. Регуляция экспрессии фермента катаболизма аминокислот с разветвленной цепью в жировой ткани и перекрестного потока аминокислот в жировой ткани при ожирении человека. утра. Дж. Физиол. Эндокринол. Метаб. 304 , E1175–E1187 (2013 г.).
Артикул КАС Google Scholar
Ше, П. и др. Нарушение BCATm у мышей приводит к увеличению расхода энергии, связанному с активацией бесполезного цикла оборота белка. Сотовый метаб. 6 , 181–194 (2007).
Артикул КАС Google Scholar
Herman, M.A., She, P., Peroni, O.D., Lynch, CJ & Kahn, B.B. Метаболизм аминокислот с разветвленной цепью (BCAA) в жировой ткани модулирует уровни циркулирующих BCAA. Дж. Биол. хим. 285 , 11348–11356 (2010).
Артикул КАС Google Scholar
Циммерман Х. А., Олсон К.С., Чен Г. и Линч С.Дж. Трансплантация жировой ткани при врожденных нарушениях метаболизма аминокислот с разветвленной цепью у мышей. Мол. Жене. Метаб. 109 , 345–353 (2013).
А., Олсон К.С., Чен Г. и Линч С.Дж. Трансплантация жировой ткани при врожденных нарушениях метаболизма аминокислот с разветвленной цепью у мышей. Мол. Жене. Метаб. 109 , 345–353 (2013).
Артикул КАС Google Scholar
Сирс, Д.Д. и другие. Механизмы инсулинорезистентности человека и тиазолидиндион-опосредованной сенсибилизации к инсулину. Проц. Натл. акад. науч. США 106 , 18745–18750 (2009 г.).
Артикул КАС Google Scholar
Сяо Г. и др. Мультитканевая селективная модуляция PPARy чувствительности к инсулину и метаболических путей у крыс с ожирением. утра. Дж. Физиол. Эндокринол. Метаб. 300 , E164–E174 (2011 г.).
Артикул Google Scholar
Вандер Хайден, М.Г., Кэнтли, Л.К. и Томпсон, С. Б. Понимание эффекта Варбурга: метаболические потребности пролиферации клеток. Наука 324 , 1029–1033 (2009).
Б. Понимание эффекта Варбурга: метаболические потребности пролиферации клеток. Наука 324 , 1029–1033 (2009).
Артикул КАС Google Scholar
Ковальски Т.Дж. и Уотфорд, М. Производство глутамина и использование глутамата подкожной жировой тканью крысы in vivo. 901:45 утра. Дж. Физиол. 266 , E151–E154 (1994).
КАС пабмед Google Scholar
Чкония Т. и др. Содержание двух подтипов преадипоцитов человека с различными способностями к репликации, адипогенезу и апоптозу варьируется в зависимости от жировых депо. утра. Дж. Физиол. Эндокринол. Метаб. 288 , E267–E277 (2005 г.).
Артикул КАС Google Scholar
Ли, М.-Дж.Дж., Ву, Ю. и Фрид, С.К. Неоднородность жировой ткани: влияние различий депо в жировой ткани на осложнения ожирения. Мол. Аспекты Мед. 34 , 1–11 (2013).
Мол. Аспекты Мед. 34 , 1–11 (2013).
Артикул КАС Google Scholar
Филипс, С.А., Чиаральди, Т.П., О, Д.К., Саву, М.К. & Henry, R.R. Секреция адипонектина и реакция на пиоглитазон зависят от депо в культивируемой жировой ткани человека. 901:45 утра. Дж. Физиол. Эндокринол. Метаб. 295 , E842–E850 (2008 г.).
Артикул КАС Google Scholar
Дивакаруни А.С., Роджерс Г.В. и Мерфи, А.Н. Измерение функции митохондрий в пермеабилизированных клетках с использованием анализатора XF морского конька или кислородного электрода типа Кларка. Курс. протокол Токсикол. 60 , 25.2.1–25.2.16 (2014).
Артикул Google Scholar
Дивакаруни А.С. и другие. Тиазолидиндионы являются острыми специфическими ингибиторами митохондриального переносчика пирувата.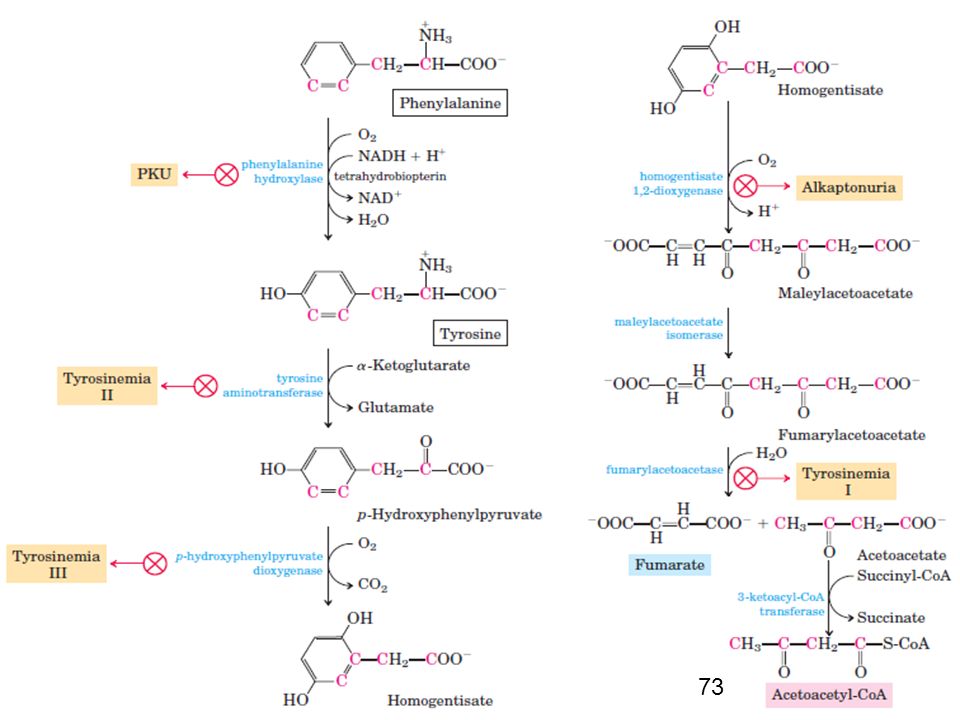 Проц. Натл. акад. науч. США 110 , 5422–5427 (2013).
Проц. Натл. акад. науч. США 110 , 5422–5427 (2013).
Артикул КАС Google Scholar
Никлин, П. и др. Двунаправленный транспорт аминокислот регулирует mTOR и аутофагию. Cell 136 , 521–534 (2009).
Артикул КАС Google Scholar
Cynober, L.A. Уровни аминокислот в плазме с примечанием о мембранном транспорте: характеристики, регуляция и метаболическое значение. Питание 18 , 761–766 (2002).
Артикул КАС Google Scholar
Zhang, Y. et al. Координированная регуляция синтеза и деградации белка с помощью mTORC1. Природа 513 , 440–443 (2014).
Артикул КАС Google Scholar
Робертс, Л. Д., Вирту, С., Видал-Пуиг, А., Николлс, А.В. и Гриффин, Дж. Л. Метаболическое фенотипирование модели дифференцировки адипоцитов. Физиол. Геномика 39 , 109–119 (2009).
Д., Вирту, С., Видал-Пуиг, А., Николлс, А.В. и Гриффин, Дж. Л. Метаболическое фенотипирование модели дифференцировки адипоцитов. Физиол. Геномика 39 , 109–119 (2009).
Артикул КАС Google Scholar
Kapadia, C.R. Витамин B12 в норме и при болезни: часть I — наследственные нарушения функции, всасывания и транспорта. Гастроэнтеролог 3 , 329–344 (1995).
КАС пабмед Google Scholar
Комиссо, К. и др. Макропиноцитоз белка является путем доставки аминокислот в Ras-трансформированные клетки. Природа 497 , 633–637 (2013).
Артикул КАС Google Scholar
Lynch, C.J. et al. Возможная роль метаболизма лейцина в сигнальном пути лейцина с участием mTOR. 901:45 утра. Дж. Физиол. Эндокринол. Метаб. 285 , E854–E863 (2003 г.).
Метаб. 285 , E854–E863 (2003 г.).
Артикул КАС Google Scholar
Su, X. et al. последовательное упорядоченное α-окисление жирных кислот и Δ9-десатурация являются основными детерминантами накопления и использования липидов в дифференцирующихся адипоцитах. Биохимия 43 , 5033–5044 (2004).
Артикул КАС Google Scholar
Хаарманн, А. и др. Поражение почек у пациента с метилмалоновой ацидурией типа кобаламина А (cblA): 42-летнее наблюдение. Мол. Жене. Метаб. 110 , 472–476 (2013).
Артикул КАС Google Scholar
Birn, H. Почки в гомеостазе витамина B12 и фолиевой кислоты: характеристика рецепторов канальцевого поглощения витаминов и белков-носителей. утра. Дж. Физиол. Почечная физиол. 291 , F22–F36 (2006 г.).
291 , F22–F36 (2006 г.).
Артикул КАС Google Scholar
Ячмень Ф.В., Сато Г.Х. и Abeles, R.H. Влияние дефицита витамина B12 на культуру тканей. Дж. Биол. хим. 247 , 4270–4276 (1972).
КАС пабмед Google Scholar
Kishimoto, Y., Williams, M., Moser, H.W., Hignite, C. & Biemann, K. Разветвленные и нечетные жирные кислоты и альдегиды в нервной системе пациента с нарушением метаболизма витамина B12 . J. Рез. липидов. 14 , 69–77 (1973).
КАС пабмед Google Scholar
Ньюгард, С. Б. Взаимодействие между липидами и аминокислотами с разветвленной цепью в развитии резистентности к инсулину. Сотовый метаб. 15 , 606–614 (2012).
Артикул КАС Google Scholar
Адамс, С. Х. Новые взгляды на метаболизм незаменимых аминокислот при ожирении и инсулинорезистентном состоянии. Доп. Нутр. 2 , 445–456 (2011).
Х. Новые взгляды на метаболизм незаменимых аминокислот при ожирении и инсулинорезистентном состоянии. Доп. Нутр. 2 , 445–456 (2011).
Артикул КАС Google Scholar
Мардиноглу А. и др. Интеграция клинических данных с геномной метаболической моделью адипоцитов человека. Мол. Сист. биол. 9 , 649 (2013).
Артикул КАС Google Scholar
Реинстатлер Л., Ци Ю.П., Уильямсон Р.С., Гарн Дж.В. и Окли Г.П. Jr. Ассоциация биохимического дефицита B12 с терапией метформином и добавками витамина B12: Национальное исследование здоровья и питания, 1999–2006. Diabetes Care 35 , 327–333 (2012).
Артикул КАС Google Scholar
Кан Д. и др. Более высокая распространенность вызванного метформином дефицита витамина B12 в комбинации с сульфонилмочевиной по сравнению с комбинацией инсулина у пациентов с диабетом 2 типа: перекрестное исследование. PLoS ONE 9 , e109878 (2014).
PLoS ONE 9 , e109878 (2014).
Артикул Google Scholar
Дегнан, П.Х., Барри, Н.А., Мок, К.С., Тага, М.Е. и Гудман, А.Л. Микробы кишечника человека используют несколько переносчиков, чтобы различать аналоги витамина В12 и конкурировать в кишечнике. Микроб-хозяин клетки 15 , 47–57 (2014).
Артикул КАС Google Scholar
Young, J.D. INCA: вычислительная платформа для изотопно-нестационарного анализа метаболических потоков. Биоинформатика 30 , 1333–1335 (2014).
Артикул КАС Google Scholar
Phillips, S.A. и др. Селективная регуляция клеточного и секретируемого мультимерного адипонектина противодиабетической терапией у людей. утра. Дж. Физиол. Эндокринол. Метаб. 297 , E767–E773 (2009 г.