что это и зачем назначают
Что такое Дипроспан? Зачем назначают гормональный препарат в период реабилитации после ринопластики? Безопасен ли он, стоит ли бояться побочных эффектов?
Дипроспан после ринопластики
Пластические хирурги нередко назначают после ринопластики Дипроспан — гормональный препарат, который вызывает у пациентов немало вопросов. Главный вопрос, насколько он безопасен? Может ли введение гормона привести к набору веса? Есть ли риск формирования неровностей кожи над зоной инъекции? Можно ли делать повторную пластику, если результат первой операции не устраивает, а в послеоперационном периоде врач назначил Дипроспан?
Что такое Дипроспан?
Прежде всего, необходимо разобраться, что такое Дипроспан? Это гормональный препарат, действующим веществом которого является бетаметазон — синтетический глюкокортикостероид, аналог естественных гормонов (кортизол, кортизон), вырабатывающихся в клетках коры надпочечников.Кортикостероиды, равно как и их синтетические производные, оказывают мощное противовоспалительное и противоотечное действие. По сути, в фармакологии нет других веществ, которые бы обладали сопоставимой противоотечной активностью. Именно по этой причине Дипроспан назначают пациентам после ринопластики.
По сути, в фармакологии нет других веществ, которые бы обладали сопоставимой противоотечной активностью. Именно по этой причине Дипроспан назначают пациентам после ринопластики.
Вторая важная особенность кортикостероидов в том, что они обладают катаболической активностью. Бетаметазон уменьшает образование грануляционной и рубцовой ткани — процесс, который может негативно повлиять на результат эстетической коррекции и привести к формированию грубых рубцов.
Уколы Дипроспана в ткани кончика носа позволяют избежать нежелательных рубцовых изменений. Если же шрамы после операции уже появились, инъекции помогут уменьшить их ыыраженность и полностью устранить этот косметический дефект.
Итак, целью применения препарата Дипроспан после ринопластики является:
- Уменьшение отеков, преимущественно, в области кончика носа.
- Профилактика рубцов.
- Устранение дефектов в виде послеоперационных рубцов.
Если коротко, нет. Однако вокруг гормональных препаратов существует столько мифов и недопонимания, что необходимо ответить на заданный вопрос максимально подробно.
Однако вокруг гормональных препаратов существует столько мифов и недопонимания, что необходимо ответить на заданный вопрос максимально подробно.
Поделиться в соц. сетях
Специфика препарата Дипроспан
Многих пугает само словосочетание «гормональный препарат». Об опасениях, которые вызывают гормоны, мы еще поговорим, пока же остановимся на главном. Гормональные препараты — очень разнородная группа лекарственных средств. Врачи используют препараты на основе половых гормонов (оральные контрацептивы, стероиды), гормонов щитовидной и поджелудочной железы (инсулин), гипофиза (гормон роста). И между этими лекарствами нельзя ставить знак равенства.В большинстве случаев целью применения гормонов является коррекция существующего в организме пациента гормонального дисбаланса. К примеру, при сахарном диабете 1 типа вводят инсулин, потому что поджелудочная железа синтезирует его в недостаточном количестве. При нарушениях менструального цикла или при лечении бесплодия применяют женские половые гормоны.
При нарушениях менструального цикла или при лечении бесплодия применяют женские половые гормоны.
У препарата Дипроспан абсолютно иная специфика. Его назначают ради местного эффекта и вводят непосредственно в те ткани носа, на которые необходимо воздействовать. В кровоток бетаметазон проникает крайне плохо, а потому общего влияния на организм практически не оказывает. Да, системное действие возможно, но только при введении высоких доз, которые после ринопластики никогда не используются.
Побочные эффекты: мифы и реальность
Мы выяснили, что после пластики носа системного действия бетаметазон не оказывает. Что это означает на практике? На практике это значит, что многих побочных эффектов, которых боятся пациенты и пациентки пластических хирургов, нет и быть не может.
Что это означает на практике? На практике это значит, что многих побочных эффектов, которых боятся пациенты и пациентки пластических хирургов, нет и быть не может.К примеру, некоторых пугает перспектива «поправиться на гормонах». Чтобы добиться подобного эффекта, нужно использовать препараты с системным действием в высоких дозах и на протяжении длительного периода. После одного или двух уколов Дипроспана в ткани носа набор веса невозможен даже в теории.
Снижение иммунитета — еще одна мнимая угроза. Да, кортикостероиды используются в официальной медицине в качестве иммуносупрессоров. С их помощью врачи снижают выраженность нежелательных иммунных реакций. Аллергологи включают бетаметазон в схемы лечения бронхиальной астмы. Важно понимать, что для угнетения иммунных реакций необходимо делать уколы Дипроспана внутримышечно и вводить его в дозах, которые обеспечивают системное действие. Такие дозировки не используются после пластики носа.
Третья группа опасений связана с возможным образованием на месте инъекции (как правило, уколы Дипроспана делают в кончик носа или в кожу над ним) ямочек или «вмятин». Здесь нужно признать, что подобный эффект возможен. Бетаметазон обладает выраженным катаболическим действием, а это значит, что он может провоцировать атрофию мягких тканей носа. Над зоной инъекции действительно может сформироваться эстетический дефект в виде неровностей кожи.
Здесь нужно признать, что подобный эффект возможен. Бетаметазон обладает выраженным катаболическим действием, а это значит, что он может провоцировать атрофию мягких тканей носа. Над зоной инъекции действительно может сформироваться эстетический дефект в виде неровностей кожи.
Уколы Дипроспана после ринопластики: что важно запомнить?
Анаболические и катаболические: olegchagin — LiveJournal
Еще с античных времен известно, что с возрастом гормональный уровень снижается.
Жители древних Греции, Египта и Индии пытались восстановить снижающуюся сексуальность и увеличить энергетический потенциал, принимая вытяжки из мужских половых желез животных.
Сегодня нам уже известно, что снижение уровня гормонов объясняется развитием болезней, сопровождающих процесс старения, таких как кардиоваскулярные болезни, остеопороз и рак.
Некоторые гормональные отклонения связаны с другими возрастными изменениями, как например, потеря мышечной массы, ожирение и умственные расстройства. Большинство из этих нежелательных изменений теперь происходят не только из–за снижения абсолютного уровня гормонов, но также из–за смещения баланса между различными гормонами.
Большинство из этих нежелательных изменений теперь происходят не только из–за снижения абсолютного уровня гормонов, но также из–за смещения баланса между различными гормонами.
Все гормоны нашего организма можно разделить на две группы: анаболические и катаболические.
Анаболические гормоны способствуют росту и образованию тканей – к примеру, они отвечают за мощную мускулатуру и крепкие кости. Возможно, вы что–либо слышали о стероидах–анаболиках – синтетические химические вещества, которые используются бодибилдерами для развития мощной мускулатуры (и которые запрещены к использованию при подготовке к Олимпийским играм). Но половые гормоны, гормоны роста и ДЭА (дегидроэпиандростерон) относятся к естественным анаболическим гормонам – стероидам, уровень которых практически всегда начинает падать после репродуктивного возраста.
Катаболические гормоны, напротив, вызывают разрушение тканей. Главным катаболическим гормоном считается кортизол, гормон стресса, который вырабатывается надпочечниками. Инсулин (вырабатываемый поджелудочной железой) и эстроген (у мужчин), в некоторой мере ведут себя как катаболические гормоны. В отличие от анаболических гормонов, уровень кортизола и инсулина (у обоих полов) и уровень эстрогена (у мужчин) обычно не снижается с возрастом; в редких случаях уровень может немного снизиться, или остаться на том же уровне или в некоторых случаях, как это бывает с эстрогеном у мужчин, наоборот, повышается. Это приводит к нарушению гормонального баланса, который играет важную роль в процессе старения.
Инсулин (вырабатываемый поджелудочной железой) и эстроген (у мужчин), в некоторой мере ведут себя как катаболические гормоны. В отличие от анаболических гормонов, уровень кортизола и инсулина (у обоих полов) и уровень эстрогена (у мужчин) обычно не снижается с возрастом; в редких случаях уровень может немного снизиться, или остаться на том же уровне или в некоторых случаях, как это бывает с эстрогеном у мужчин, наоборот, повышается. Это приводит к нарушению гормонального баланса, который играет важную роль в процессе старения.
Инсулин вырабатывается в поджелудочной железе в ответ на повышенное содержание сахара в крови. Нужно знать, что инсулин не всегда действует как катаболический гормон. В небольших количествах он работает как гормон – анаболик и способствует росту тканей.
В больших количествах, когда употребляется слишком много сладкой пищи или пищи с высокой гликемической нагрузкой, он стимулирует рост только одного вида тканей – жировой ткани, или попросту жир. С возрастом восприимчивость клеток к инсулину падает, и его уровень возрастает. В этом и заключается главная причина набора лишнего веса в процессе старения. С возрастом баланс между гормонами сдвигается от анаболиков к катаболикам.
В этом и заключается главная причина набора лишнего веса в процессе старения. С возрастом баланс между гормонами сдвигается от анаболиков к катаболикам.
Анаболические гормоны – тестостерон, эстроген у женщин, прогестерон, гормон роста, мелатонин и ДЭА – способствуют росту тканей и поддержанию молодости, поэтому их относят к гормонам юности. И напротив, кортизол, инсулин и эстроген (у мужчин) относят к гормонам старения.
Гормоны старения
Какие шаги мы можем сейчас предпринять для поддержания более молодого баланса между двумя типами гормонов? Предлагаем вам начать с обсуждения способов уменьшения или даже поворота вспять постепенного превалирования катаболических гормонов.
Кортизол
Ответной реакцией организма на стресс становится быстрый выброс кортизола из надпочечников, что заставляет усиленно работать сердечнососудистую систему и легкие, подавляя иммунную, замедляя процессы пищеварения и снижая репродуктивную функцию.
Сильный всплеск кортизола учащает сердцебиение, позволяя быстрее бежать, расширяет зрачки, позволяя лучше видеть, и повышает уровень сахара в крови, улучшая умственные способности. Но постоянные выбросы избытка кортизола ускоряют процесс старения, способствуют развитию болезней, разрушают мышечную ткань (саркопения) и кости (остеопороз), вызывают задержку натрия в организме и высокое кровяное давление, увеличивают сахар в крови и разрушают иммунную систему.
Но постоянные выбросы избытка кортизола ускоряют процесс старения, способствуют развитию болезней, разрушают мышечную ткань (саркопения) и кости (остеопороз), вызывают задержку натрия в организме и высокое кровяное давление, увеличивают сахар в крови и разрушают иммунную систему.
У пациентов с болезнью Кушинга (связанной с переизбытком кортизола) или пациентов, долгое время принимавших синтетические формы кортизола, развивается значительная потеря мышечной массы и слабость костей. В романе «Дюна» Фрэнка Герберта говорится «Страх разрушает мозг».
И в самом деле, страх повышает уровень кортизола, который, как доказали исследования, ведет к нарушению мозговой активности. Например, доктор Д.С. Халса продемонстрировал с помощью своих пациентов с болезнью Альцгеймера, каким образом хронический стресс разрушает память.
Как вы видите на рисунке ниже, все стероидные гормоны (включая кортизол) синтезируются из холестерола. Первым делом холестерол превращается в прегненолон, который затем может перейти либо в прогестерон, либо в ДЭА, «мать гормонов» тестостерона и эстрогена. Когда стресс хронический или избыточный, производится больше кортизола за счет ДЭА, тестостерона и эстрогена. Нормальный процесс старения связан с небольшим сдвигом к большему производству кортизола и одновременным снижением образования других гормонов.
Когда стресс хронический или избыточный, производится больше кортизола за счет ДЭА, тестостерона и эстрогена. Нормальный процесс старения связан с небольшим сдвигом к большему производству кортизола и одновременным снижением образования других гормонов.
Самым простым способом определить, как хорошо ваши гормоны юности борются с гормонами старения, является определение соотношения уровня ДЭА (анаболического гормона юности) и кортизола (катаболического гормона старения). Вы можете выяснить это, пройдя стресс–тест надпочечников, что также позволит проверить здоровье самих надпочечников.
Вы можете получить набор для проведения анализа у терапевта или практикующего врача и вам не придется для этого сдавать кровь. Вы проводите анализ дома, собирая образцы слюны 4 раза в день – как проснетесь, за ланчем, ужином и перед отходом ко сну.
Нормальным считается результат с более высоким уровнем кортизола утром и постепенным его снижением в течение дня. Под влиянием хронического стресса это дневное варьирование зачастую незаметно и в результате мы получаем практически прямую линию вместо нисходящей.
В стресс–тестах надпочечников также подсчитывается отношение ДЭА к кортизолу. У молодых людей это отношение обычно высокое, а вот у людей пожилого возраста уже понижается.
Особые указания к выравниванию отношения включают дополнительные добавки, содержащие ДЭА, употребление трав таких, как например, натуральная лакрица, которую используют в китайском траволечении, или аювердическую траву ашваганду, а также соблюдение образа жизни, способствующего снижению уровня кортизола, и рациона с низкой гликемической нагрузкой, снижение стресса, регулярные упражнения и здоровое количество сна.
Инсулин
Если бы проводились гонки между инсулином и кортизолом на предмет, кто быстрее разрушит организм, мы бы сделали ставку на инсулин. Барри Сирс в Зоне Омоложения называет переизбыток инсулина «билетом к ускоренному старению».
Переизбыток инсулина увеличивает жировые отложения в теле, повышает уровень кортизола и вызывает устойчивость к инсулину, способствует ускорению развития атеросклероза и увеличивает риск развития болезней сердца, а также вмешивается в работу других гормонов юности.
Инсулин вырабатывается при излишестве калорий. Когда вы употребляете сахар или пищу с высокой гликемической нагрузкой, вы настолько стимулируете выработку избыточного инсулина, что ваш организм может отделить липкий сахар от крови. Как только повышается уровень инсулина, глюкоза в крови мгновенно превращается в жир, который затем откладывается в жировых клетках организма.
Кортизол и инсулин относятся к тем же «старым добрым парням» гормонального кантри–клуба. Избыток инсулина повышает уровень кортизола, а его избыток ведет к повышению уровня инсулина. Избыток инсулина также является независимым фактором риска развития коронарных болезней сердца.
Инсулин снижает эффективность гормонов молодости, что ускоряет процесс старения.
Именно по этой причине, богатая сахаром пища или пища с высокой гликемической нагрузкой, которая повышает уровень инсулина, заставляет нас стареть намного скорее, чем что–либо другое из нашего рациона. Очень легко попасть в сети образа жизни, способствующего переизбытку инсулина: отсутствие физической нагрузки, постоянный слабый стресс и употребление высокогликемичных углеводов.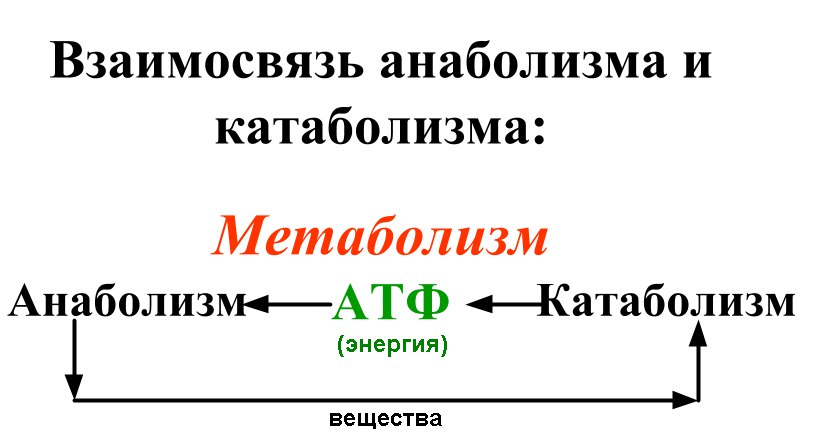
Знания о нематодах
С. еlegans – это разновидность круглых червей, которых ученые зачастую используют в своих экспериментах. Нематоды получили свою славу благодаря тому, что стали первыми многоклеточными, чью генетическую карту удалось полностью воспроизвести в 1999. В 2003 году c.elegans снова попали под лучи прожекторов, прожив 188 дней, что в переводе на человеческий возраст эквивалентно 500 годам.
В более ранних экспериментах продолжительность жизни достигла 150 дней за счет манипулирования геном круглых червей под кодом IGF–1, белок, который очень близок человеческому гормону роста. Но здесь обнаружилась одна проблема: в то время как черви получили долголетие, они демонстрировали сниженную активность в течение всей своей жизни.
При дальнейшем исследовании Синтия Кентон из Университета Калифорнии, Сан–Франциско, добавила манипуляцию уровнем инсулина и удалила некоторые гонадные ткани. В результате черви обрели еще большее долголетие без снижения активности. Так как у человека и c. elegans большинство генов одинаковы, это исследование может привести к методам продления жизни человека, манипулируя уровнем инсулина и некоторых других гормонов, не удаляя никаких тканей органов.
elegans большинство генов одинаковы, это исследование может привести к методам продления жизни человека, манипулируя уровнем инсулина и некоторых других гормонов, не удаляя никаких тканей органов.
Гормоны молодости
Снижение уровня катаболических гормонов способствует выравниванию их соотношения к анаболическим гормонам юности. Но исторически самым приемлемым способом выравнивания баланса была прямая замена гормонов. Обычно термин «гормонозаменительная терапия» (ГЗТ) относится к половым гормонам: эстрогену, прогестерону и тестостерону. Далее мы обсудим ничуть не менее важные по значимости гормоны молодости: ДЭА, гормон роста и мелатонин.
ДЭА
ДЭА, или дегидроэпиандростерон – наиболее распространённый стероидный гормон, который образуется в нашем организме. В прошлом считалось, что ДЭА – это всего лишь предшественник других гормонов, который не обладает никакими особыми физиологическими свойствами.
Но позже Уильям Регельсон, широко известный практикующий врач–исследователь, назвал ДЭА «суперзвездой среди супергормонов».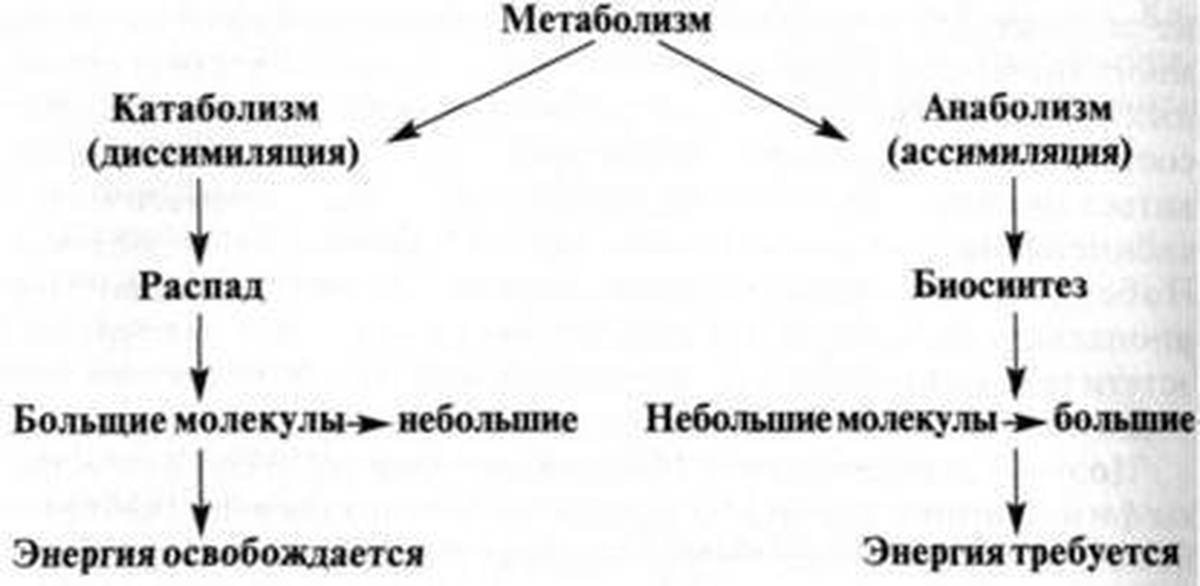 Уровень ДЭА достигает своего пика к 25 годам, затем постепенно снижается на 50% к 40 годам, и к 85 годам составляет примерно 5% от его уровня в молодости.
Уровень ДЭА достигает своего пика к 25 годам, затем постепенно снижается на 50% к 40 годам, и к 85 годам составляет примерно 5% от его уровня в молодости.
Значит ли это, что ДЭА мог бы способствовать продлению жизни? Согласно результатам экспериментов на животных добавки ДЭА могут замедлить процесс старения и увеличить продолжительность жизни.
Доказано, что мужчины с более высоким уровнем ДЭА менее подвержены развитию кардиоваскулярных заболеваний. ДЭА обладает противовоспалительными свойствами и способен снижать уровень IL–6 (интерлейкин–6) и TNF–α (фактор некроза опухолей альфа), которые являются сильными возбудителями опасных воспалений в организме. Согласно исследованию доктора Регельсона, посвященному онкологии, ДЭА препятствует бесконтрольному делению клеток, явному признаку раковых клеток.
Полезные свойства ДЭА:
Снижает риск развития сердечнососудистых заболеваний
Борется со стрессом
Улучшает функционирование иммунной системы
Снимает депрессию
Улучшает память
Смягчает симптому менопаузы
Предотвращает слабость костей
Укрепляет либидо
Повышает чувствительность к инсулину и выносливость к глюкозе
Увеличивает безжировую массу тела
ДЭА «приручает» кортизол. Когда вы испытываете стресс, в организме вырабатывается чрезмерное количество инсулина, что негативно отражается на работе вашей иммунной системы, что в свою очередь влечет предрасположенность к заболеваниям и ускоряет процесс старения.
Когда вы испытываете стресс, в организме вырабатывается чрезмерное количество инсулина, что негативно отражается на работе вашей иммунной системы, что в свою очередь влечет предрасположенность к заболеваниям и ускоряет процесс старения.
Некоторые исследования выявили связь между подавленной иммунной системой и нарушением баланса между ДЭА и кортизолом. Принимая добавки с ДЭА, вы улучшите состояние подавленной кортизолом и другими стероидами иммунной системы. Так как ДЭА – это предшественник тестостерона, он может оказывать положительное влияние на либидо, особенно у женщин. ДЭА также способствует трансформации пищи в энергию и сжигает лишний вес.
Прежде чем начать принимать добавки с ДЭА–С (ДЭА–сульфат), проверьте ваш уровень ДЭА, и затем проверяйте его каждые шесть–восемь недель, чтобы быть уверенными, что вы приближаетесь к желаемому результату. Рекомендуется придерживаться уровня в 300 для мужчин и 250 для женщин. Мужчинам следует начинать с 15–25 миллиграмм ДЭА в день, а женщинам с 5–10, затем следует увеличивать дозу для достижения необходимого уровня.
Внимание: так как ДЭА – это андрогенный гормон, в котором преобладают мужские свойства, он может легко превращаться в тестостерон. Добавки ДЭА также поднимают уровень САП (специфический антиген простаты), важный маркер рака простаты. Перед тем, как начать принимать ДЭА мужчины должны проверить уровень САП, а также во время приема каждые 6–12 месяцев. Если повышается уровень САП, то нужно немедленно прекратись принимать ДЭА и проконсультироваться с врачом.
Гормон Роста Человека
Ажиотаж вокруг роли гормона роста (ГР) в борьбе со старением разгорелся в 1990–е года, благодаря публикации Даниэля Рудмана, исследователя Медицинского Колледжа Висконсина.
Он опубликовал результаты исследования, при наличии контрольной плацебо–группы, в котором принимали участие 21 мужчина возрастом от 61 до 81 года. Среди всех положительных эффектов гормона роста он выявил следующее: увеличение мышечной массы, уменьшение жировой ткани, улучшение здоровья костей, улучшение показателей холестерола и более чуткое восприятие к инсулину.
Многочисленные подобные исследования пришли к таким же результатам. В онлайн поисковиках Национальной Медицинской Библиотеки на запрос «гормон роста» выходит 48 000 статей. Следует обратить внимание на то, что весьма маловероятно, что терапия гормоном роста поможет набрать мышечную массу и избавиться от жира без диеты и комплекса упражнений.
ГР оказывает положительно влияние на работу сердечнососудистой системы, липидный обмен и кровяное давление. У пациентов, которые проходили терапию ГР на протяжении 7 лет, снижение восприимчивости к инсулину, что происходит при старении, обратилось вспять.
Инъекции ГР раньше применялись для лечения детей, у которых был выявлен его дефицит. Но нехватку гормона роста у взрослых, что теперь называют дефицитом гормона роста у взрослых (ДГРВ), распознают как отдельный синдром, лечение которого ГР было одобрено Комиссией по контролю за лекарствами и питательными веществами.
Хотя очевидны положительные эффекты терапии ГР, следует отметить некоторые темные стороны. Это достаточно дорогое лечение, от 2 000 до 8 000 долларов в год, в зависимости от необходимой дозы и оно не всегда покрывается страховкой. Лечение требует ежедневных инъекций и их польза для здоровых людей довольно противоречива.
Это достаточно дорогое лечение, от 2 000 до 8 000 долларов в год, в зависимости от необходимой дозы и оно не всегда покрывается страховкой. Лечение требует ежедневных инъекций и их польза для здоровых людей довольно противоречива.
В 2002 году Национальный институт здоровья проспонсировал исследование, в котором наблюдались 121 человек после курса инъекций ГР с синтетической гормонозаменительной терапией или без нее в 1992 и 1998 годах.
Результаты доклада Рудмана о наборе мышечной массы и потере жировой ткани подтвердились, но так же были выявлены следующие побочные эффекты: у 24% мужчин развилась устойчивость к глюкозе или диабет, у 32% — синдром запястного канала, у 41% — ломота в суставах. У 39% процентов женщин развилась водянка. Авторы исследования пришли к выводу, что «из–за частого возникновения побочных эффектов (в особенности диабета и устойчивости к глюкозе), применение терапии ГР к взрослым должно быть ограничено рамками проведенных исследований».
В данный момент ведутся дебаты о вероятности повышения риска развития рака после прохождения терапии ГР. Но Шим и Коен из Униерситета Калифорнии в Лос–Анджелесе заявили: «Риск развития рака не увеличивается значительнее обычных показателей среди населения», вдобавок к чему другие исследования также не подтвердили увеличение показателей рака прямой кишки или простаты.
Но Шим и Коен из Униерситета Калифорнии в Лос–Анджелесе заявили: «Риск развития рака не увеличивается значительнее обычных показателей среди населения», вдобавок к чему другие исследования также не подтвердили увеличение показателей рака прямой кишки или простаты.
Так как терапия ГР в борьбе со старением применяется не так давно, нельзя забывать о возможных побочных эффектах. Очень важно понимать, что долгосрочные исследования по безопасности применения инъекций ГР здоровым взрослым еще только впереди. К счастью, в наших силах изменить привычный образ жизни так, чтобы достичь результатов инъекция ГР, не прибегая к самим инъекциям.
Сахар и высокогликемичные углеводы снижают выработку ГР в гипофизе, а белковая диета, наоборот, способствует его выработке. Придерживаясь рациона с низким содержанием сахара и низкой гликемической нагрузкой, вы повысите уровень ГР в организме.
Глубокий сон и анаэробные упражнения являются двумя главными факторами стимулирования выработки ГР у здоровых людей. Взрослые, которые на протяжение жизни продолжают заниматься спортом, сохраняют мышечную массу и более высокий уровень ГР.
Взрослые, которые на протяжение жизни продолжают заниматься спортом, сохраняют мышечную массу и более высокий уровень ГР.
Употребление определенных аминокислот, таких как аргинин, орнитин, глицин и глютамин, стимулирует гипофиз освобождать больше ГР. Широкодоступны добавки с разным количеством этих аминокислот, их еще называют стимуляторами секреции, так как они побуждают гипофиз выпускать ГР из резервов.
Добавки, содержащие ДЭА, является недорогим способом повысить уровень ГР.
Для большинства людей, которые хотели бы на себе ощутить эффективность противовозрастного действия гормона роста, рекомендуется придерживаться перечисленных выше рекомендаций. До тех пор, пока не будут известны результаты дальнейших исследований, советуем оставить инъекции ГР только взрослым с диагнозом ДГРВ, основанном на заключении опытного врача.
Прежде чем принимать любые из перечисленных мер проверьте уровень IGF–1 (инсулиноподобный фактор роста –1) в крови. IGF–1 дает более точные результаты, чем уровень ГР, так как IGF–1 дает среднее значение уровня ГР, который постоянно колеблется в кровотоке. Основываясь на вашем возрасте и половой принадлежности, ваш лечащий врач сможет определить оптимальный для вас уровень.
Основываясь на вашем возрасте и половой принадлежности, ваш лечащий врач сможет определить оптимальный для вас уровень.
Наши рудиментарные органы
Как только изобретут технологии, которые будут поддерживать питательные и другие вещества в крови на необходимом уровне нам не потребуются органы, которые отвечают за выработку химических веществ, гормонов и энзимов. В организме человека версии 2.0, гормоны и относящиеся к ним вещества будут доставляться с помощью нанороботов, а система биологической обратной связи будут контролировать выработку веществ и поддержание необходимого баланса между ними.
В конечном итоге, окажется возможным избежать присутствия большинства наших биологических органов. Это процесс перекройки нельзя будет завершить за один раз. Каждый орган и каждая идея требует собственного развития, проекта–полуфабриката и ступеней внедрения. Тем не менее, мы нацелены на фундаментальные и радикальные изменения абсолютно несовершенного, ненадежного и ограниченного по функционалу организма человека версии 1. 0.
0.
Мелатонин
Согласно некоторым данным, как минимум 50% всех американцев в возрасте от 65 лет страдают нарушением сна, хотя сон играет важную роль для здоровья организма. Продолжительные нарушения сна ведут к возникновению депрессии и подавлению иммунной системы.
Мелатонин – это светочувствительный гормон, который ритмично образуется в эпифизе человека, расположенном глубоко в мозгу. Суточный ритм человека контролируют внутренние биологические часы. В течение дня уровень мелатонина снижается и повышается к вечеру перед отходом ко сну.
Уровень мелатонина достигает своего пика к полуночи, держится некоторое время и затем начинает снижаться. Выработка мелатонина зависит от суточного цикла. Длительность выработки мелатонина зависит от длительности темноты, таким образом, получается, что наибольшее количество мелатонина вырабатывается в зимнее нежели летнее время.
Пик выработки мелатонина достигается к семи годам. Затем он резко снижается к подростковому возрасту. К 45 годам эпифиз начинает сокращаться и теряет вырабатывающие мелатонин клетки.
К 45 годам эпифиз начинает сокращаться и теряет вырабатывающие мелатонин клетки.
Гормон начинает вырабатываться хаотично. К 60 годам образуется только 50% от того количества мелатонина, которое производилось на момент вашего двадцатилетия, что объясняет, почему многие пожилые люди испытывают проблемы со сном. Недавние исследования двойной анонимности при участии контрольной группы – плацебо доказали, что добавки мелатонина помогают решить проблемы со сном людям старше 55 лет.
Мелатонин является сильным антиоксидантом и очень ценится при борьбе с некоторыми видами рака, например, раком груди.
При недостаточном уровне мелатонина возникает следующий порочный круг:
1. Организм теряет способность производить больше мелатонина и начинает быстрее стареть.
2. В процессе старения еще больше снижается выработка мелатонина
3. Снижение уровня мелатонина служит сигналом для других желез и систем органов, что пришло время заслуженного отдыха. У женщин перестают функционировать яичники, падает уровень эстрогена, наступает синдром менопаузы. У мужчин же, несмотря на то, что продолжает вырабатываться сперма, снижается тестостерон.
У мужчин же, несмотря на то, что продолжает вырабатываться сперма, снижается тестостерон.
4. У обоих полов ослабевает иммунная система, подвергая нас различным заболеваниям, начиная от инфекций до рака и аутоиммунных заболеваний (состояние, когда иммунная система восстает против собственных тканей организма).
5. Затем следуют нарушения в работе систем органов, что увеличивает скорость по наклонной.
Вы можете замедлить эту нисходящую спираль событий, ежедневно принимая небольшие дозы мелатонина. Так как у некоторых людей развивается устойчивость к мелатонину, следует начать его прием с 4–5 ночей в неделю (хотя некоторые принимают его каждый день, не испытывая никаких проблем).
Мелатонин недорогая и широкодоступная добавка, которая отпускается без рецепта врача, но он может оказать сильное влияние на наш организм. Советуем употреблять небольшие дозы, если вы решили сделать добавки мелатонина частью своей анти возрастной программы.
Для большинства здоровых людей, которых не беспокоят проблемы со сном, рекомендуется принимать по 0,1 миллиграмму мелатонина за полчаса до отхода ко сну. Вы можете увеличить дозу до 0,5–1,0 миллиграмма, что обычно не требуется людям без проблем со сном.
Вы можете увеличить дозу до 0,5–1,0 миллиграмма, что обычно не требуется людям без проблем со сном.
Если вы постоянно испытываете трудности при засыпании, вам рекомендуется принимать мелатонин подъязычно для быстрой его абсорбции. Начните с 3–5 миллиграмм и при необходимости увеличьте дозу до 10 миллиграмм. Было экспериментально доказано, что увеличение мелатонина свыше указанной нормы, не приводит ни к каким результатам. Если добавки мелатонина вам не помогают, вам следует проконсультироваться с вашим лечащим врачом.
Если в течение ночи вы часто просыпаетесь, постарайтесь засекать время выработки мелатонина. Обратите внимание, что при этом вы будете чувствовать усталость по утрам. Если вы тяжело засыпаете или часто просыпаетесь по ночам, попробуйте комбинировать продукты, которые имеют и быстродействующую и медленно высвобождающуюся формулу.
Чтобы не испытывать проблем при смене часовых поясов (джетлаг), следует принимать 3 миллиграмма мелатонина при отходе ко сну на новом месте первые три дня. Вам придется немного поэкспериментировать, чтобы найти лучшую для вас дозу мелатонина
Вам придется немного поэкспериментировать, чтобы найти лучшую для вас дозу мелатонина
Катаболическое и анаболическое действие паратгормона на скелет
1. Hanley DA, Watson PH, Hodsman AB, Dempster DW. Фармакологические механизмы терапии: паратиреоидный гормон. В: Билезикян Дж., Райш Л.Г., Мартин Т.Дж., редакторы. Принципы биологии костей. Амстердам: Эльзевир; 2008. стр. 1661–95. [Google Scholar]
2. Датта Н.С., Абу-Самра А.Б. Передача сигналов ПТГ и ПТГрП в остеобластах. Сотовый сигнал. 2009;21:1245–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Кустени С., Билезикян Ж.П. Клеточная биология паратгормона в остеобластах. Curr Osteoporos Rep. 2008; 6:72–6. [PubMed] [Google Scholar]
4. Potts JT. Паратгормон: прошлое и настоящее. J Эндокринол. 2005; 187:311–25. [PubMed] [Google Scholar]
5. Датта Н.С., Самра Т.А., Махалингам К.Д., Датта Т., Абу-Самра А.Б. Роль интернализации PTh2R в остеобластах и костной массе с использованием мышиной модели с дефицитом фосфорилирования. J Эндокринол. 2010; 207:355–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Эндокринол. 2010; 207:355–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Kramer I, Keller H, Leupin O, Kneissel M. Опосредует ли остеоцитарное подавление SOST анаболизм кости PTH? Тенденции Эндокринол Метаб. 2010;21:237–44. [PubMed] [Google Scholar]
7. Silverberg SJ, Shane E, de la Cruz L, et al. Поражение скелета при первичном гиперпаратиреозе. Джей Боун Шахтер Рез. 1989; 4: 283–91. [PubMed] [Google Scholar]
8. Dempster DW, Muller R, Zhou H, et al. Сохранение трехмерной губчатой структуры кости при легком первичном гиперпаратиреозе. Кость. 2007;41:19–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Parisien M, Mellish RW, Silverberg SJ, et al. Поддержание связности губчатой кости при первичном гиперпаратиреозе: анализ трабекулярных распорок. Джей Боун Шахтер Рез. 1992; 7: 913–9. [PubMed] [Google Scholar]
10. Parisien M, Silverberg SJ, Shane E, et al. Гистоморфометрия кости при первичном гиперпаратиреозе: сохранение губчатой структуры кости. J Clin Endocrinol Metab. 1990;70:930–8. [PubMed] [Академия Google]
J Clin Endocrinol Metab. 1990;70:930–8. [PubMed] [Академия Google]
11. Добниг Х., Тернер Р.Т. Влияние запрограммированного введения фрагмента паратиреоидного гормона человека (1–34) на гистоморфометрию костей и химический состав сыворотки у крыс. Эндокринология. 1997; 138:4607–12. [PubMed] [Google Scholar]
12. Neer RM, Arnaud CD, Zanchetta JR, et al. Влияние паратиреоидного гормона (1–34) на переломы и минеральную плотность костей у женщин в постменопаузе с остеопорозом. N Engl J Med. 2001; 344:1434–41. [PubMed] [Google Scholar]
13. Greenspan SL, Bone HG, Ettinger MP, et al. Лечение остеопороза исследовательской группой паратиреоидного гормона. Влияние рекомбинантного человеческого паратиреоидного гормона (1–84) на переломы позвонков и минеральную плотность костей у женщин в постменопаузе с остеопорозом: рандомизированное исследование. Энн Интерн Мед. 2007; 146: 326–39.. [PubMed] [Google Scholar]
14. Onyia JE, Helvering LM, Gelbert L, et al. Молекулярный профиль катаболических и анаболических схем лечения паратиреоидным гормоном (ПТГ) в костях крыс: анализ с помощью ДНК-микрочипа. Джей Селл Биохим. 2005; 95: 403–18. [PubMed] [Google Scholar]
Джей Селл Биохим. 2005; 95: 403–18. [PubMed] [Google Scholar]
15. Локлин Р.М., Хосла С., Тернер Р.Т., Риггс Б.Л. Медиаторы двухфазных реакций костей на прерывистое и постоянное введение паратиреоидного гормона. Джей Селл Биохим. 2003; 89: 180–90. [PubMed] [Академия Google]
16. Коуп О. Исследование гиперпаратиреоза в Массачусетской больнице общего профиля. N Engl J Med. 1966; 274: 1174–82. [PubMed] [Google Scholar]
17. Дофин Р.Т., Риггс Б.Л., Шольц Д.А. Боль в спине и размозжение позвонков: невыделенный способ проявления первичного гиперпаратиреоза. Энн Интерн Мед. 1975; 83: 365–7. [PubMed] [Google Scholar]
18. Rubin MR, Bilezikian JP, McMahon DJ, et al. Естественная история первичного гиперпаратиреоза с операцией на паращитовидных железах или без нее через 15 лет. J Clin Endocrinol Metab. 2008;93:3462–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Heath H, 3rd, Hodgson SF, Kennedy MA. Первичный гиперпаратиреоз. Заболеваемость, заболеваемость и потенциальные экономические последствия в сообществе. N Engl J Med. 1980; 302: 189–93. [PubMed] [Google Scholar]
N Engl J Med. 1980; 302: 189–93. [PubMed] [Google Scholar]
20. Сильверберг С.Дж., Шейн Э., Джейкобс Т.П., Сирис Э., Билезикян Дж.П. 10-летнее проспективное исследование первичного гиперпаратиреоза с операцией на паращитовидной железе или без нее. N Engl J Med. 1999; 341:1249–55. [PubMed] [Академия Google]
21. Parisien M, Cosman F, Mellish RW, et al. Структура костей у постменопаузальных гиперпаратиреоидных, остеопоротических и нормальных женщин. Джей Боун Шахтер Рез. 1995; 10:1393–9. [PubMed] [Google Scholar]
22. Утияма Т., Танидзава Т., Ито А., Эндо Н., Такахаши Х.Э. Микроструктуру трабекулы и коры подвздошной кости у больных с первичным гиперпаратиреозом определяют с помощью гистоморфометрии и узлово-распорного анализа. J Bone Miner Метаб. 1999; 17: 283–8. [PubMed] [Google Scholar]
23. Силверберг С.Дж., Локер Ф.Г., Билезикян Дж.П. Вертебральная остеопения: новое показание к операции при первичном гиперпаратиреозе. J Clin Endocrinol Metab. 1996;81:4007–12. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
24. Hansen S, Beck Jensen JE, Rasmussen L, Hauge EM, Brixen K. Влияние на геометрию, плотность и микроархитектуру кости в дистальном отделе лучевой кости, но не в большеберцовой кости, у женщин с первичным гиперпаратиреозом: Исследование случай-контроль с использованием HR-pQCT. Джей Боун Шахтер Рез. 2010; 25:1941–7. [PubMed] [Google Scholar]
25. Билезикян Дж. П., Брэнди М. Л., Рубин М., Сильверберг С. Дж. Первичный гиперпаратиреоз: новые представления о клинических, денситометрических и биохимических особенностях. J Интерн Мед. 2005; 257:6–17. [PubMed] [Академия Google]
26. Кулак С.А., Бандейра С., Восс Д. и соавт. Заметное улучшение костной массы после паратиреоидэктомии по поводу фиброзно-кистозного остита. J Clin Endocrinol Metab. 1998; 83: 732–5. [PubMed] [Google Scholar]
27. Yu N, Donnan PT, Flynn RW, et al. Повышенная смертность и заболеваемость у пациентов с легким первичным гиперпаратиреозом. Исследование эпидемиологии и аудита паращитовидных желез (PEARS) Clin Endocrinol (Oxf) 2010;73:30–4. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
28. Khosla S, Melton LJ, 3rd, Wermers RA, Crowson CS, O’Fallon W, Riggs B. Первичный гиперпаратиреоз и риск переломов: популяционное исследование. Джей Боун Шахтер Рез. 1999;14:1700–7. [PubMed] [Google Scholar]
29. Vignali E, Viccica G, Diacinti D, et al. Морфометрические переломы позвонков у женщин в постменопаузе с первичным гиперпаратиреозом. J Clin Endocrinol Metab. 2009;94:2306–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Wilson RJ, Rao S, Ellis B, Kleerekoper M, Parfitt AM. Легкий бессимптомный первичный гиперпаратиреоз не является фактором риска переломов позвонков. Энн Интерн Мед. 1988; 109: 959–62. [PubMed] [Академия Google]
31. Мелтон Л.Дж., 3-й, Аткинсон Э.Дж., О’Фаллон В.М., Хит Х., 3-й. Риск возрастных переломов у пациентов с первичным гиперпаратиреозом. Arch Intern Med. 1992; 152: 2269–73. [PubMed] [Google Scholar]
32. Larsson K, Ljunghall S, Krusemo UB, Naessén T, Lindh E, Persson I. Риск переломов бедра у пациентов с первичным гиперпаратиреозом: популяционное когортное исследование с последующим до 19 лет. J Интерн Мед. 1993; 234: 585–93. [PubMed] [Google Scholar]
J Интерн Мед. 1993; 234: 585–93. [PubMed] [Google Scholar]
33. Parfitt AM. Паратиреоидный гормон и периостальное расширение костей. Джей Боун Шахтер Рез. 2002; 17:1741–3. [PubMed] [Академия Google]
34. Билезикян Ж.П. Прочность костей при первичном гиперпаратиреозе. Остеопорос Инт. 2003; 14 (Приложение 5): S113–5. [PubMed] [Google Scholar]
35. Burr DB, Hirano T, Turner CH, Hotchkiss C, Brommage R, Hock JM. Периодически вводимый человеческий паратиреоидный гормон (1–34) увеличивает внутрикортикальный обмен кости и пористость без снижения прочности кости в плечевой кости яванских макаков после овариэктомии. Джей Боун Шахтер Рез. 2001; 16: 157–65. [PubMed] [Google Scholar]
36. Dempster DW, Cosman F, Kurland ES, et al. Влияние ежедневного лечения паратиреоидным гормоном на микроархитектонику и обмен костей у пациентов с остеопорозом: парное исследование биопсии. Джей Боун Шахтер Рез. 2001; 16: 1846–53. [PubMed] [Академия Google]
37. Recker RR, Bare SP, Smith SY, et al. Структура губчатой и кортикальной кости и оборот в гребне подвздошной кости у женщин в постменопаузе с остеопорозом, получавших лечение паратиреоидным гормоном 1–84. Кость. 2009;44:113–9. [PubMed] [Google Scholar]
Структура губчатой и кортикальной кости и оборот в гребне подвздошной кости у женщин в постменопаузе с остеопорозом, получавших лечение паратиреоидным гормоном 1–84. Кость. 2009;44:113–9. [PubMed] [Google Scholar]
38. Ma YL, Zeng Q, Donley DW, et al. Терипаратид увеличивает костеобразование при моделировании и ремоделировании остеонов и повышает иммунореактивность IGF-II у женщин в постменопаузе с остеопорозом. Джей Боун Шахтер Рез. 2006; 21: 855–64. [PubMed] [Академия Google]
39. Цзян И, Чжао Дж.Дж., Митлак Б.Х., Ван О, Генант Х.К., Эриксен Э.Ф. Рекомбинантный человеческий паратиреоидный гормон (1–34) [терипаратид] улучшает как кортикальную, так и губчатую структуру кости. Джей Боун Шахтер Рез. 2003; 18:1932–41. [PubMed] [Google Scholar]
40. Orwoll ES, Scheele WH, Paul S, et al. Влияние терапии терипаратидом [человеческим паратиреоидным гормоном (1–34)] на плотность костной ткани у мужчин с остеопорозом. Джей Боун Шахтер Рез. 2003; 18:9–17. [PubMed] [Google Scholar]
41. Fox J, Miller MA, Recker RR, Bare SP, Smith SY, Moreau I. Лечение женщин в постменопаузе с остеопорозом паратиреоидным гормоном 1–84 в течение 18 месяцев увеличивает образование губчатой кости и улучшает губчатое вещество. архитектура: исследование биоптатов гребня подвздошной кости с использованием гистоморфометрии и микрокомпьютерной томографии. J Musculoskelet Нейрональное взаимодействие. 2005; 5: 356–7. [PubMed] [Академия Google]
Fox J, Miller MA, Recker RR, Bare SP, Smith SY, Moreau I. Лечение женщин в постменопаузе с остеопорозом паратиреоидным гормоном 1–84 в течение 18 месяцев увеличивает образование губчатой кости и улучшает губчатое вещество. архитектура: исследование биоптатов гребня подвздошной кости с использованием гистоморфометрии и микрокомпьютерной томографии. J Musculoskelet Нейрональное взаимодействие. 2005; 5: 356–7. [PubMed] [Академия Google]
42. Dobnig H, Sipos A, Jiang Y, et al. Ранние изменения биохимических маркеров костеобразования коррелируют с улучшением структуры кости на фоне терапии терипаратидом. J Clin Endocrinol Metab. 2005;90:3970–7. [PubMed] [Google Scholar]
43. Lane NE, Sanchez S, Genant HK, Jenkins DK, Arnaud CD. Краткосрочное увеличение маркеров костного обмена предсказывает индуцированное паратиреоидным гормоном увеличение минеральной плотности костей позвоночника у женщин в постменопаузе с остеопорозом, вызванным глюкокортикоидами. Остеопорос Инт. 2000; 11: 434–42. [PubMed] [Академия Google]
[PubMed] [Академия Google]
44. Курланд Э.С., Косман Ф., МакМахон Д.Дж., Розен С.Дж., Линдсей Р., Билезикян Дж.П. Паратгормон как терапия идиопатического остеопороза у мужчин: влияние на минеральную плотность костей и костные маркеры. J Clin Endocrinol Metab. 2000; 85: 3069–76. [PubMed] [Google Scholar]
45. Рубин М.Р., Билезикян Дж.П. Паратиреоидный гормон как анаболическая скелетная терапия. Наркотики. 2005; 65: 2481–98. [PubMed] [Google Scholar]
46. Lindsay R, Cosman F, Zhou H, et al. Новый график мечения тетрациклином для продольной оценки краткосрочных эффектов анаболической терапии с биопсией одиночной кости гребня подвздошной кости: ранние действия терипаратида. Джей Боун Шахтер Рез. 2006; 21: 366–73. [PubMed] [Академия Google]
47. Компстон Дж. Э. Скелетные действия прерывистого паратиреоидного гормона: влияние на ремоделирование и структуру кости. Кость. 2007; 40:1447–52. [PubMed] [Google Scholar]
48. Линдси Р., Чжоу Х., Косман Ф., Нивес Дж. , Демпстер Д.В., Ходсман А.Б. Влияние одномесячного лечения ПТГ (1–34) на формирование кости на губчатых, эндокортикальных и периостальных поверхностях подвздошной кости человека. Джей Боун Шахтер Рез. 2007; 22: 495–502. [PubMed] [Google Scholar]
, Демпстер Д.В., Ходсман А.Б. Влияние одномесячного лечения ПТГ (1–34) на формирование кости на губчатых, эндокортикальных и периостальных поверхностях подвздошной кости человека. Джей Боун Шахтер Рез. 2007; 22: 495–502. [PubMed] [Google Scholar]
49. Zanchetta JR, Bogado CE, Ferretti JL, et al. Влияние терипаратида [рекомбинантного гормона паращитовидной железы человека (1–34)] на кортикальную кость у женщин в постменопаузе с остеопорозом. Джей Боун Шахтер Рез. 2003;18:539–43. [PubMed] [Google Scholar]
50. Seeman E, Delmas PD. Качество костей — материальная и структурная основа прочности и хрупкости костей. N Engl J Med. 2006; 354:2250–61. [PubMed] [Google Scholar]
51. Чемберс Т.Дж., Фуллер К., МакШихи П.М., Прингл Дж.А. Влияние гормонов, регулирующих кальций, на резорбцию кости изолированными клетками остеокластомы человека. Джей Патол. 1985; 145: 297–305. [PubMed] [Google Scholar]
52. McSheehy PM, Chambers TJ. Остеобластические клетки опосредуют чувствительность остеокластов к паратгормону. Эндокринология. 1986;118:824–8. [PubMed] [Google Scholar]
Эндокринология. 1986;118:824–8. [PubMed] [Google Scholar]
53. Kaji H, Sugimoto T, Kanatani M, Fukase M, Chihara K. Участие систем передачи двойного сигнала в стимуляции образования остеокластоподобных клеток с помощью паратиреоидного гормона и пептида, родственного паратиреоидному гормону. . Biochem Biophys Res Commun. 1993; 194: 157–62. [PubMed] [Google Scholar]
54. Lee SK, Lorenzo JA. Гормон паращитовидной железы стимулирует TRANCE и ингибирует экспрессию рибонуклеиновой кислоты мессенджера остеопротегерина в культурах костного мозга мышей: корреляция с образованием остеокластоподобных клеток. Эндокринология. 1999;140:3552–61. [PubMed] [Google Scholar]
55. Ma YL, Cain RL, Halladay DL, et al. Катаболические эффекты постоянного человеческого паратгормона (1-38) in vivo связаны с устойчивой стимуляцией RANKL и ингибированием остеопротегерина и связанного с геном формирования кости. Эндокринология. 2001; 142:4047–54. [PubMed] [Google Scholar]
56. Канзава М. , Сугимото Т., Канатани М., Чихара К. Участие фактора, ингибирующего остеопротегерин/остеокластогенез, в стимуляции образования остеокластов гормоном паращитовидной железы в костных клетках мыши. Евр Дж Эндокринол. 2000; 142:661–4. [PubMed] [Академия Google]
, Сугимото Т., Канатани М., Чихара К. Участие фактора, ингибирующего остеопротегерин/остеокластогенез, в стимуляции образования остеокластов гормоном паращитовидной железы в костных клетках мыши. Евр Дж Эндокринол. 2000; 142:661–4. [PubMed] [Академия Google]
57. Кернс А.Е., Хосла С., Костенуик П.Дж. Рецептор-активатор лиганда ядерного фактора kappaB и остеопротегерина, регулирующий ремоделирование костей в норме и при патологии. Endocr Rev. 2008; 29:155–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Huang JC, Sakata T, Pfleger LL, et al. ПТГ по-разному регулирует экспрессию RANKL и OPG. Джей Боун Шахтер Рез. 2004; 19: 235–44. [PubMed] [Google Scholar]
59. Fu Q, Jilka RL, Manolagas SC, O’Brien CA. Паратиреоидный гормон стимулирует активатор рецептора лиганда NFkappa B и ингибирует экспрессию остеопротегерина посредством активации протеинкиназы A белка, связывающего цАМФ-ответный элемент. Дж. Биол. Хим. 2002; 277:48868–75. [PubMed] [Академия Google]
60. Накчбанди И.А., Ланг Р., Киндер Б., Инсонна К.Л. Роль рецептор-активатора системы цитокинов ядерного фактора-каппаВ-лиганд/остеопротегерин при первичном гиперпаратиреозе. J Clin Endocrinol Metab. 2008;93:967–73. [PMC free article] [PubMed] [Google Scholar]
Накчбанди И.А., Ланг Р., Киндер Б., Инсонна К.Л. Роль рецептор-активатора системы цитокинов ядерного фактора-каппаВ-лиганд/остеопротегерин при первичном гиперпаратиреозе. J Clin Endocrinol Metab. 2008;93:967–73. [PMC free article] [PubMed] [Google Scholar]
61. Stilgren LS, Rettmer E, Eriksen EF, Hegedüs L, Beck-Nielsen H, Abrahamsen B. Скелетные изменения в остеопротегерине и активаторе рецептора мРНК лиганда ядерного фактора каппаб уровни при первичном гиперпаратиреозе: влияние паратиреоидэктомии и связь с костным метаболизмом. Кость. 2004; 35: 256–65. [PubMed] [Академия Google]
62. Li X, Qin L, Bergenstock M, Bevelock LM, Novack DV, Partridge NC. Гормон паращитовидной железы стимулирует остеобластную экспрессию MCP-1, рекрутируя и увеличивая слияние пре/остеокластов. Дж. Биол. Хим. 2007; 282:33098–106. [PubMed] [Google Scholar]
63. Langub MC, Monier-Faugere MC, Qi Q, Geng Z, Koszewski NJ, Malluche HH. Рецептор пептида типа 1, родственного паратиреоидному гормону/гормону паращитовидной железы, в костях человека. Джей Боун Шахтер Рез. 2001; 16: 448–56. [PubMed] [Академия Google]
Джей Боун Шахтер Рез. 2001; 16: 448–56. [PubMed] [Академия Google]
64. Dempster DW, Hughes-Begos CE, Plavetic-Chee K, et al. Нормальные остеокласты человека, образованные из моноцитов периферической крови, экспрессируют рецепторы ПТГ типа 1 и стимулируются ПТГ в отсутствие остеобластов. Джей Селл Биохим. 2005; 95: 139–48. [PubMed] [Google Scholar]
65. Shen V, Dempster DW, Birchman R, Xu R, Lindsay R. Потеря губчатой костной массы и связи у крыс с удаленными яичниками может быть восстановлена путем комбинированного лечения паратиреоидным гормоном и эстрадиолом. Джей Клин Инвест. 1993;91:2479–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Wronski TJ, Yen CF, Qi H, Dann LM. Паратиреоидный гормон более эффективен, чем эстроген или бисфосфонаты, для восстановления утраченной костной массы у крыс с овариэктомией. Эндокринология. 1993; 132: 823–31. [PubMed] [Google Scholar]
67. Иванец UT, Мур К., Ривера М.Ф., Майерс С.Е., Ванегас С.М., Вронски Т. Дж. Сравнительное исследование костно-восстановительной эффективности анаболических средств у старых крыс с овариэктомией. Остеопорос Инт. 2007; 18: 351–62. [PubMed] [Академия Google]
Дж. Сравнительное исследование костно-восстановительной эффективности анаболических средств у старых крыс с овариэктомией. Остеопорос Инт. 2007; 18: 351–62. [PubMed] [Академия Google]
68. Ян Д., Сингх Р., Дивиети П., Го Дж., Буксейн М.Л., Брингхерст Ф.Р. Вклад сигнальных путей рецептора паратиреоидного гормона (ПТГ)/родственного ПТГ пептидного рецептора в анаболический эффект ПТГ на кости. Кость. 2007;40:1453–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Ogata N, Shinoda Y, Wettschureck N, et al. Сигнал G альфа(q) в остеобластах ингибирует остеоанаболическое действие паратгормона. Дж. Биол. Хим. 2011; 286:13733–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Джилка Р.Л. Молекулярные и клеточные механизмы анаболического действия прерывистого ПТГ. Кость. 2007; 40:1434–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Кустени С., Билезикян Дж. Клеточные действия паратиреоидного гормона. В: Билезикян Дж., Райш Л.Г., Мартин Т. Дж., редакторы. Принципы биологии костей. Амстердам: Эльзевир; 2008. стр. 639–56. [Google Scholar]
Дж., редакторы. Принципы биологии костей. Амстердам: Эльзевир; 2008. стр. 639–56. [Google Scholar]
72. Ван Ю. Х., Лю Ю., Роу Д. В. Влияние транзиторного ПТГ на раннюю пролиферацию, апоптоз и последующую дифференцировку остеобластов в первичных культурах остеобластов. Am J Physiol Endocrinol Metab. 2007;292: E594–603. [PubMed] [Google Scholar]
73. Qin L, Li X, Ko JK, Partridge NC. Паратиреоидный гормон использует несколько механизмов для остановки прогрессирования клеточного цикла остеобластных клеток от фазы G1 до фазы S. Дж. Биол. Хим. 2005; 280:3104–11. [PubMed] [Google Scholar]
74. Onishi T, Hruska K. Экспрессия p27Kip1 в остеобластоподобных клетках во время дифференцировки с паратиреоидным гормоном. Эндокринология. 1997; 138:1995–2004. [PubMed] [Google Scholar]
75. Датта Н.С., Колайлат Р., Фите А., Петтуэй Г., Абу-Самра А.Б. Различные роли митоген-активируемой протеинкиназы фосфатазы-1 (MKP-1) и ERK-MAPK в передаче сигналов PTh2R во время пролиферации и дифференцировки остеобластов. Сотовый сигнал. 2010;22:457–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Сотовый сигнал. 2010;22:457–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Datta NS, Pettway GJ, Chen C, Koh AJ, McCauley LK. Циклин D1 как мишень для пролиферативных эффектов ПТГ и ПТГрП в ранних остеобластных клетках. Джей Боун Шахтер Рез. 2007; 22: 951–64. [PubMed] [Google Scholar]
77. Ogita M, Rached MT, Dworakowski E, Bilezikian JP, Kousteni S. Дифференцировка и пролиферация предшественников периостальных остеобластов по-разному регулируются эстрогенами и прерывистым введением паратиреоидного гормона. Эндокринология. 2008; 149: 5713–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Ishizuya T, Yokose S, Hori M, et al. Паратиреоидный гормон оказывает несоизмеримое влияние на дифференцировку остеобластов в зависимости от времени воздействия на остеобластные клетки крысы. Джей Клин Инвест. 1997; 99: 2961–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Chen HL, Demiralp B, Schneider A, et al. Паратиреоидный гормон и белок, родственный паратиреоидному гормону, оказывают как про-, так и антиапоптотическое действие в мезенхимальных клетках. Дж. Биол. Хим. 2002; 277:19374–81. [PubMed] [Академия Google]
Дж. Биол. Хим. 2002; 277:19374–81. [PubMed] [Академия Google]
80. Кришнан В., Мур Т.Л., Ма Ю.Л. и соавт. Анаболическое действие паратгормона на кости требует Cbfa1/Runx2-зависимой передачи сигналов. Мол Эндокринол. 2003; 17: 423–35. [PubMed] [Google Scholar]
81. Hisa I, Inoue Y, Hendy GN, et al. Чувствительный к паратиреоидному гормону фактор, родственный Smad3, Tmem119, способствует дифференцировке остеобластов и взаимодействует с путем костного морфогенетического белка-Runx2. Дж. Биол. Хим. 2011; 286:9787–96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Pettway GJ, Schneider A, Koh AJ, et al. Анаболические действия ПТГ (1–34): использование новой модели тканевой инженерии для исследования временных эффектов на кость. Кость. 2005;36:959–70. [PubMed] [Google Scholar]
83. Bellido T, Ali AA, Plotkin LI, et al. Протеасомная деградация Runx2 укорачивает индуцированную паратиреоидным гормоном передачу антиапоптотических сигналов в остеобластах. Предполагаемое объяснение того, почему прерывистое введение необходимо для анаболизма костей. Дж. Биол. Хим. 2003; 278:50259–72. [PubMed] [Google Scholar]
Дж. Биол. Хим. 2003; 278:50259–72. [PubMed] [Google Scholar]
84. Schnoke M, Midura SB, Midura RJ. Паратиреоидный гормон подавляет апоптоз остеобластов, усиливая репарацию ДНК. Кость. 2009; 45: 590–602. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Poole KE, van Bezooijen RL, Loveridge N, et al. Склеростин представляет собой отсроченный секретируемый продукт остеоцитов, подавляющий формирование кости. FASEB J. 2005; 19:1842–4. [PubMed] [Google Scholar]
86. Balemans W, Ebeling M, Patel N, et al. Увеличение плотности костной ткани при склеростеозе связано с дефицитом нового секретируемого белка (SOST) Hum Mol Genet. 2001; 10: 537–43. [PubMed] [Google Scholar]
87. Balemans W, Patel N, Ebeling M, et al. Выявление делеции 52 т.п.н. ниже гена SOST у пациентов с болезнью Ван Бухема. J Med Genet. 2002;39: 91–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Loots GG, Kneissel M, Keller H, et al. Геномная делеция дальнодействующего костного энхансера неправильно регулирует склеростин при болезни Ван Бухема. Геном Res. 2005; 15: 928–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Геном Res. 2005; 15: 928–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Li X, Ominsky MS, Niu QT, et al. Направленная делеция гена склеростина у мышей приводит к усилению костеобразования и прочности костей. Джей Боун Шахтер Рез. 2008; 23:860–9. [PubMed] [Академия Google]
90. Li X, Оминский М.С., Уормингтон К.С. и соавт. Лечение антителами к склеростину увеличивает костеобразование, костную массу и прочность костей в крысиной модели постменопаузального остеопороза. Джей Боун Шахтер Рез. 2009; 24: 578–88. [PubMed] [Google Scholar]
91. Padhi D, Jang G, Stouch B, Fang L, Posvar E. Однократное плацебо-контролируемое рандомизированное исследование AMG 785, моноклонального антитела к склеростину. Джей Боун Шахтер Рез. 2011; 26:19–26. [PubMed] [Google Scholar]
92. Fermor B, Skerry TM. Экспрессия рецептора ПТГ/ПТГрП на остеобластах и остеоцитах, но без резорбции поверхности кости у растущих крыс. Джей Боун Шахтер Рез. 1995;10:1935–43. [PubMed] [Google Scholar]
93. Bellido T, Ali AA, Gubrij I, et al. Хроническое повышение паратгормона у мышей снижает экспрессию склеростина остеоцитами: новый механизм гормонального контроля остеобластогенеза. Эндокринология. 2005; 146:4577–83. [PubMed] [Google Scholar]
Bellido T, Ali AA, Gubrij I, et al. Хроническое повышение паратгормона у мышей снижает экспрессию склеростина остеоцитами: новый механизм гормонального контроля остеобластогенеза. Эндокринология. 2005; 146:4577–83. [PubMed] [Google Scholar]
94. Rhee Y, Allen MR, Condon K, et al. Передача сигналов рецептора ПТГ в остеоцитах регулирует формирование периостальной кости и внутрикортикальное ремоделирование. Джей Боун Шахтер Рез. 2011;26:1035–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Drake MT, Srinivasan B, Mödder UI, et al. Влияние лечения паратиреоидным гормоном на уровни циркулирующего склеростина у женщин в постменопаузе. J Clin Endocrinol Metab. 2010;95:5056–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Keller H, Kneissel M. SOST является геном-мишенью для ПТГ в костях. Кость. 2005; 37: 148–58. [PubMed] [Google Scholar]
97. Mirza FS, Padhi ID, Raisz LG, Lorenzo JA. Уровни склеростина в сыворотке отрицательно коррелируют с уровнями паратиреоидного гормона и индексом свободного эстрогена у женщин в постменопаузе. J Clin Endocrinol Metab. 2010;95:1991–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Clin Endocrinol Metab. 2010;95:1991–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. van Lierop AH, Witteveen JE, Hamdy NA, Papapoulos SE. Пациенты с первичным гиперпаратиреозом имеют более низкие уровни циркулирующего склеростина, чем контрольная группа с эупаратиреозом. Евр Дж Эндокринол. 2010; 163:833–7. [PubMed] [Google Scholar]
99. Коста А., Кремерс С., Рубин М. и др. Уровни циркулирующего склеростина при нарушениях функции паращитовидной железы: первичный гиперпаратиреоз (PHPT) и гипопаратиреоз (HypoPT). Ежегодное собрание ASBMR 2010; 2010. с. С158. (аннотация) [Google Scholar]
100. Семенов М., Тамаи К., Хе Х. SOST является лигандом для LRP5/LRP6 и ингибитором передачи сигналов Wnt. Дж. Биол. Хим. 2005; 280:26770–5. [PubMed] [Google Scholar]
101. Li X, Zhang Y, Kang H, et al. Склеростин связывается с LRP5/6 и противодействует канонической передаче сигналов Wnt. Дж. Биол. Хим. 2005; 280:19883–7. [PubMed] [Google Scholar]
102. Yadav VK, Ryu JH, Suda N, et al. Lrp5 контролирует образование костей, ингибируя синтез серотонина в двенадцатиперстной кишке. Клетка. 2008; 135:825–37. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Lrp5 контролирует образование костей, ингибируя синтез серотонина в двенадцатиперстной кишке. Клетка. 2008; 135:825–37. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Wang Y, Nishida S, Boudignon BM, et al. Рецептор IGF-I необходим для анаболического действия паратгормона на кости. Джей Боун Шахтер Рез. 2007; 22:1329–37. [PubMed] [Google Scholar]
104. Lombardi G, Di Somma C, Vuolo L, Guerra E, Scarano E, Colao A. Роль IGF-I в воздействии ПТГ на кости. Дж Эндокринол Инвест. 2010;33 (7 Приложение):22–6. [PubMed] [Google Scholar]
105. Yakar S, Bouxsein ML, Canalis E, et al. Тройной комплекс ИФР влияет на формирование костной ткани в постнатальном периоде и реакцию скелета на прерывистое введение паратиреоидного гормона. J Эндокринол. 2006;189: 289–99. [PubMed] [Google Scholar]
106. Yamaguchi M, Ogata N, Shinoda Y, et al. Субстрат инсулинового рецептора-1 необходим для анаболической функции паратиреоидного гормона у мышей. Эндокринология. 2005; 146:2620–8. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
107. Pacifici R. Т-клетки: критические регуляторы костей в норме и при заболеваниях. Кость. 2010;47:461–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Gao Y, Wu X, Terauchi M, et al. Т-клетки потенцируют индуцированную ПТГ потерю кортикальной кости посредством передачи сигналов CD40L. Клеточный метаб. 2008; 8: 132–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Tawfeek H, Bedi B, Li JY, et al. Разрушение рецептора 1 ПТГ в Т-клетках защищает от индуцированной ПТГ потери костной массы. ПЛОС Один. 2010;5:e12290. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Может ли гормон роста противодействовать катаболическим эффектам стероидов? | Гормональные исследования в педиатрии
Skip Nav DestinationОбзор статей| 27 ноября 2009 г.
Nelly MaurasHormone Research (2009) 72 (Приложение 1): 48–54.
https://doi.org/10.1159/000229764
История статьиОпубликовано в Интернете:
27 ноября 2009 г.
- Взгляды
- Содержание артикула
- Рисунки и таблицы
- Видео
- Аудио
- Дополнительные данные
- Экспертная оценка
- Делиться
- Фейсбук
- Твиттер
- Электронная почта
- Инструменты
Получить разрешения
Иконка Цитировать Цитировать
- Поиск по сайту
Цитата
Нелли Маурас; Может ли гормон роста противодействовать катаболическим эффектам стероидов? Исследования гормонов 1 ноября 2009 г. ; 72 (Приложение 1): 48–54. https://doi.org/10.1159/000229764
; 72 (Приложение 1): 48–54. https://doi.org/10.1159/000229764
Скачать файл цитаты:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- RefWorks
- Бибтекс
Расширенный поиск
Справочная информация: Постоянное введение глюкокортикостероидов (ГК) может оказывать существенное катаболическое действие in vivo на целый ряд метаболических систем, включая метаболизм аминокислот, скелетные мышцы, кости и линейный рост. ГКС ингибируют синтез белка и усиливают расщепление белка на уровне скелетных мышц и всего тела, а также нарушают секрецию и действие гормона роста (ГР). И наоборот, ГР и инсулиноподобный фактор роста I (IGF-I) являются мощными белково-анаболическими и стимулирующими рост агентами in vitro и in vivo.

