Для чего нужны аминокислоты?
Последние десятилетия белкам и аминокислотам в питании уделяется много внимания. Считается, что здоровая диета обязательно должна содержать незаменимые аминокислоты и обеспечивать организм достаточным поступлением протеинов. Так ли они необходимы организму и нужно ли принимать аминокислоты в добавках? Это вопрос задают себе не только спортсмены, но каждый человек, ведущий здоровую, активную жизнь.
Основные функции аминокислот
Начать список доводов, для чего нужны аминокислоты, стоит с объединения понятий белок и протеин, которые по сути своей одно и то же — строительный материал для клетки. Аминокислоты — это белки, разделенные на фракции в процессе пищеварения. Таким образом, спортивные аминокислоты представляют собой готовые к усвоению питательные вещества. Они практически не нуждаются в переваривании и быстро поступают в клетку.
Аминокислоты разделяют на две группы: незаменимые, то есть протеиновые структуры, которые организм не сможет синтезировать сам. Их нужно получить с пищей. И заменимые или те, что создаются в клетках из других аминокислот. Есть также вещества, сходные по структуре с белковыми молекулами. Например, l-карнитин, ГАМК, таурин и другие, активно участвующие в метаболизме.
Их нужно получить с пищей. И заменимые или те, что создаются в клетках из других аминокислот. Есть также вещества, сходные по структуре с белковыми молекулами. Например, l-карнитин, ГАМК, таурин и другие, активно участвующие в метаболизме.
Аминокислоты нужны организму для:
- Синтеза белка и строительства клеток.
- Выделения энергии. Расщепление аминокислот проходит иначе, чем переваривание углеводов, что дает организму значительно больше энергии во время тренировки. Это свойство используют бодибилдеры и спортсмены, принимающие добавки перед нагрузкой.
- Производства гормонов и ферментов. Таким образом, наличие необходимых аминокислот опосредованно влияет на всю эндокринную систему и пищеварение.
- Подавления катаболизма. Достаточный запас аминокислот предупреждает разрушение мышечных клеток в процессе восстановления.
- Коррекции жирового обмена. ВСАА способно влиять на выработку гормона лептина, который регулирует количество жировых запасов в теле.
 L-карнитин стимулирует утилизацию жиров непосредственно в клетках.
L-карнитин стимулирует утилизацию жиров непосредственно в клетках.
Аминокислоты для женщин и мужчин: есть ли различия?
Сами по себе аминокислоты действуют на мужской и женский организм одинаково. На клеточном уровне выраженных различий нет. Однако при выборе спортивных добавок особенности метаболизма и гормонального фона учитывать необходимо.
Женщины меньше внимания уделяют наращиванию мышечной массы и значительно больше обеспокоены метаболизмом жиров. При этом их тело крайне неохотно расстается с жировыми запасами. В свою очередь, мужчины стремятся достичь максимальных объемов за самые короткие сроки. Исходя из задач, следует правильно подбирать спортивные аминокислоты и протеины, а также грамотно их принимать.
ВСАА. Эти три аминокислоты универсальны по своему действию и в первую очередь отвечают за предупреждение катаболизма. Поэтому и мужчинам, и женщинам ВСАА рекомендуют принимать во время и сразу после тренировки, когда открывается белковое окно. Эта аминокислоты для женщин не дадут значительного прироста мышечной массы, но будет планомерно оптимизировать синтез белка и расход жиров.
Эта аминокислоты для женщин не дадут значительного прироста мышечной массы, но будет планомерно оптимизировать синтез белка и расход жиров.
Протеин подобрать несколько сложней. Лучшим решением для мужчин, наращивающих мышечную массу, остается сывороточный протеин, такой как Лактомин80. Женщинам, которые ставят задачу снизить толщину жировой прослойки, рекомендуют два варианта:
- Комплексный протеин, который включает быстро устаивающиеся белки и медленные.
- Растительный протеин, полученный из сои и гороха. Такие добавки практически не отражаются на мышечной массе, но способствуют здоровому снижению веса.
BCAA (незаменимые аминокислоты)
Аминокислотные комплексы сегодня являются важнейшей составляющей здорового питания профессиональных спортсменов. Пептиды и свободные аминокислоты, содержащиеся в таких комплексах, начинают попадать в кровь ещё в желудке, поэтому достигают клеток организма достаточно быстро, спустя 10 минут после приёма.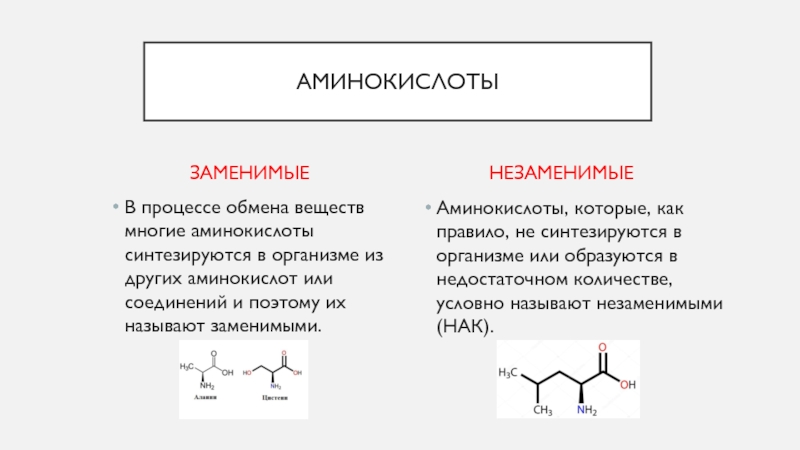 Использование комплексов аминокислот, содержащих в себе все жизненноважные аминокислоты, играет большое значение для эффективного и быстрого восстановления мышечных тканей, истощённых после интенсивных и тяжёлых нагрузок.
Использование комплексов аминокислот, содержащих в себе все жизненноважные аминокислоты, играет большое значение для эффективного и быстрого восстановления мышечных тканей, истощённых после интенсивных и тяжёлых нагрузок.
Для усвоения свободных аминокислот не требуется дополнительных энергозатрат организма. Попадая в кровь, они не препятствуют восстановлению энергии в мышечных тканях. Благодаря аминокислотам особенно эффективно ускоряется рост мышечной массы, увеличивается выносливость; в полной мере используется потенциал гормонального фона организма, который возникает после тренировок. Для того, чтобы сохранить и защитить мышечные ткани, спортсменам необходимо принимать специальныйкомплекс аминокислот BCAA. В нём содержатся только аминокислоты с разветвлёнными цепочками, а именно – валин, лейцин и изолейцин.
BCAA – это незаменимые аминокислоты с боковыми цепями, которые не образуются в нашем организме, следовательно, человек должен получать BCAA вместе с пищей или добавками.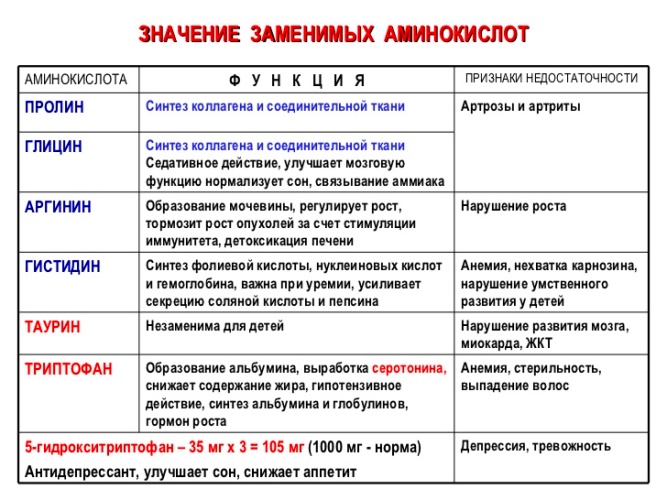 Уникальность BCAA аминокислот заключается в том, что реакция выделения энергии из них происходит непосредственно в мышечных волокнах, когда другие аминокислоты утилизируются в печени. Особенно сильно расходуются BCAA аминокислоты во время голодания, а также после тренировок, продолжительностью более 4 часов.
Уникальность BCAA аминокислот заключается в том, что реакция выделения энергии из них происходит непосредственно в мышечных волокнах, когда другие аминокислоты утилизируются в печени. Особенно сильно расходуются BCAA аминокислоты во время голодания, а также после тренировок, продолжительностью более 4 часов.
Что происходит?
При мощных нагрузках организм спортсмена использует в основном внутриклеточные запасы энергии. Когда в организме заканчиваются запасы АТФ (аденозинтрифосфата), он начинает активно расходовать белки, в особенности BCAA – валин, лейцин и изолейцин. Это нормальное состояние для нашего организма, и в этом нет ничего страшного, так как после занятий в спортзале в мышечных тканях начинают действовать процессы регенерации. Именно они и позволяют нарастить мышечную массу и снизить жировые отложения. Самое главное, чтобы в клетках организма всегда в доступной форме присутствовали BCAA аминокислоты.
Эффективность BCAA.
Научные исследования показали, что BCAA аминокислоты являются самыми важными и необходимыми для восстановления мышечных тканей и нормализации белковых процессов в организме. BCAA почти мгновенно усваиваются в пищеварительном тракте, и за несколько минут около 70% данных аминокислот поступает в клетки мышечной ткани.
BCAA почти мгновенно усваиваются в пищеварительном тракте, и за несколько минут около 70% данных аминокислот поступает в клетки мышечной ткани.
Таким образом, мышцы после изнуряющих тренировок получают необходимый материал для восстановления почти мгновенно. При этом в мышечные ткани поступают только те аминокислоты, которые были в большей мере затрачены организмом во время анаэробных нагрузок. Надо заметить, что любые другие способы пополнения организма BCAA аминокислотами, например обычная пища, затягивают начало процесса регенерации на много часов.
Было доказано, что спортсменам также следует принимать комплекс BCAA в период голодания или диеты с целью снижения катаболизма.
Как принимать?
Потребности организма спортсмена в BCAA зависят от интенсивности и продолжительности занятий в спортзале, от тренировочного опыта, особенностей организма и многих других факторов. Предпочтительно принимать BCAA в течение 15-30 минут после тренировки и непосредственно перед сном. А для достижения максимально эффекта от приёма BCAA, следует подобрать индивидуальную дозу с помощью экспериментов под строгим контролем специалиста или врача.
А для достижения максимально эффекта от приёма BCAA, следует подобрать индивидуальную дозу с помощью экспериментов под строгим контролем специалиста или врача.
ТАКЖЕ ВАМ БУДЕТ ИНТЕРЕСНО:
- КОЭНЗИМ Q10
- ТЕСТОСТЕРОНОВЫЕ БУСТЕРЫ
- ПРОТЕИН ОТ А ДО Я
Общие сведения об аминокислотах
Обзор
Аминокислоты представляют собой химические единицы или «строительные блоки», из которых состоят белки. Они также являются конечными продуктами переваривания белков или гидролиза. Аминокислоты содержат около 16 процентов азота. Химически это то, что отличает их от двух других основных питательных веществ, сахаров и жирных кислот, которые не содержат азота.
Чтобы понять, насколько важны аминокислоты, вы должны понять, насколько важны для жизни белки. Именно белок обеспечивает структуру всех живых существ. Каждый живой организм, от самого крупного животного до мельчайшего микроба, состоит из белка. И в своих различных формах белок участвует в жизненно важных химических процессах, поддерживающих жизнь.
Люди часто не осознают свою потребность в аминокислотах, потому что не осознают, насколько занят человеческий организм.
• Каждую секунду костный мозг производит 2,5 миллиона эритроцитов.
• Каждые четыре дня происходит замена большей части слизистой оболочки желудочно-кишечного тракта и тромбоцитов.
• Большинство лейкоцитов заменяется за десять дней.
• Человек имеет эквивалент новой кожи через двадцать четыре дня и костного коллагена через тридцать лет.
Все эти непрерывные ремонтные работы требуют аминокислот.
У вас дефицит аминокислот или проблемы с усвоением аминокислот?
Свяжитесь с клиникой ISM, чтобы получить консультацию по вопросам здоровья и разработать индивидуальную программу оздоровления.
Белки являются необходимой частью каждой живой клетки в организме. Белок, наряду с водой, составляет наибольшую часть массы нашего тела.
- В организме человека белковые вещества входят в состав мышц, связок, сухожилий, органов, желез, ногтей, волос и многих жизненно важных жидкостей организма и необходимы для роста костей.

- Ферменты и гормоны, которые катализируют и регулируют все процессы в организме, представляют собой белки.
- Белки помогают регулировать водный баланс организма и поддерживать правильный внутренний рН. Они способствуют обмену питательными веществами между межклеточными жидкостями и тканями, кровью и лимфой. Дефицит белка может нарушить баланс жидкости в организме, вызывая отеки.
- Белки составляют структурную основу хромосом, по которым генетическая информация передается от родителей к потомству. Генетический «код», содержащийся в ДНК каждой клетки, на самом деле является информацией о том, как производить белки этой клетки.
После переваривания белка в желудке аминокислоты поступают в кровь. Попадая в кровь, аминокислоты переносятся как красными кровяными тельцами, так и жидкой частью крови, называемой плазмой. Таким образом, аминокислоты распределяются по всем тканям организма, где различные клетки организма берут то, что им нужно для восстановления и реформирования белковых структур, в которых они нуждаются.
Кровь всегда содержит аминокислоты. Голодание не устраняет их, а диета с высоким содержанием белка не увеличивает их существенно. Организм имеет постоянную потребность в белковых аминокислотах, и в нем сохраняется достаточно равномерный баланс.
(a) Аминокислоты в качестве белкового субстрата
Белки представляют собой цепочки аминокислот, соединенных между собой так называемыми пептидными связями. Каждый отдельный тип белка состоит из определенной группы аминокислот в определенном химическом расположении. Именно определенные аминокислоты и способ их последовательного соединения придают белкам, из которых состоят различные ткани, их уникальные функции и свойства. Каждый белок в организме предназначен для определенной потребности; белки не взаимозаменяемы.
Белки, из которых состоит человеческий организм, не получают непосредственно из пищи. Скорее, диетический белок расщепляется на составляющие его аминокислоты, которые организм затем использует для создания определенных белков, в которых он нуждается.
(b) Аминокислоты в обмене веществ в организме
Существуют и другие аминокислоты, важные для метаболических функций.
- Некоторые из них, такие как цитрулин, глутатион, орнитин и таурин, могут быть похожи на аминокислоты, образующие белок, или являться их побочными продуктами.
- Некоторые действуют как нейротрансмиттеры или предшественники нейротрансмиттеров, химических веществ, передающих информацию от одной нервной клетки к другой. Таким образом, определенные аминокислоты необходимы мозгу для получения и отправки сообщений.
- Аминокислоты также позволяют витаминам и минералам правильно выполнять свою работу. Даже если витамины и минералы усваиваются и усваиваются организмом, они не могут быть эффективными, если не присутствуют необходимые аминокислоты. Например, низкий уровень аминокислоты тирозина может привести к дефициту железа.
Как классифицировать аминокислоты?
Существует примерно двадцать восемь широко известных аминокислот, которые комбинируются различными способами для создания тысяч различных типов белков, присутствующих во всех живых существах. В организме человека печень производит около 80 процентов необходимых аминокислот. Остальные 20 процентов должны быть получены из рациона. Они называются незаменимыми аминокислотами. Незаменимые аминокислоты, которые должны поступать в организм с пищей:
В организме человека печень производит около 80 процентов необходимых аминокислот. Остальные 20 процентов должны быть получены из рациона. Они называются незаменимыми аминокислотами. Незаменимые аминокислоты, которые должны поступать в организм с пищей:
- гистидин
- изолейцин
- лейцин
- лизин
- метионин
- фенилаланин
- треонин
- триптофан
- валин
Заменимые аминокислоты, которые могут синтезироваться в организме из других аминокислот, получаемых из пищевых источников, включают:
- аланин
- глютамин
- аспарагин
- глицин
- цитруллин
- орнитин
- цистеин
- пролин
- цистин
- серин
- гамма-аминомасляная кислота
- таурин
- глутаминовая кислота
- тирозин
Тот факт, что они называются «необязательными», не означает, что они не нужны, а только то, что их не обязательно получать с пищей, потому что организм может производить их по мере необходимости.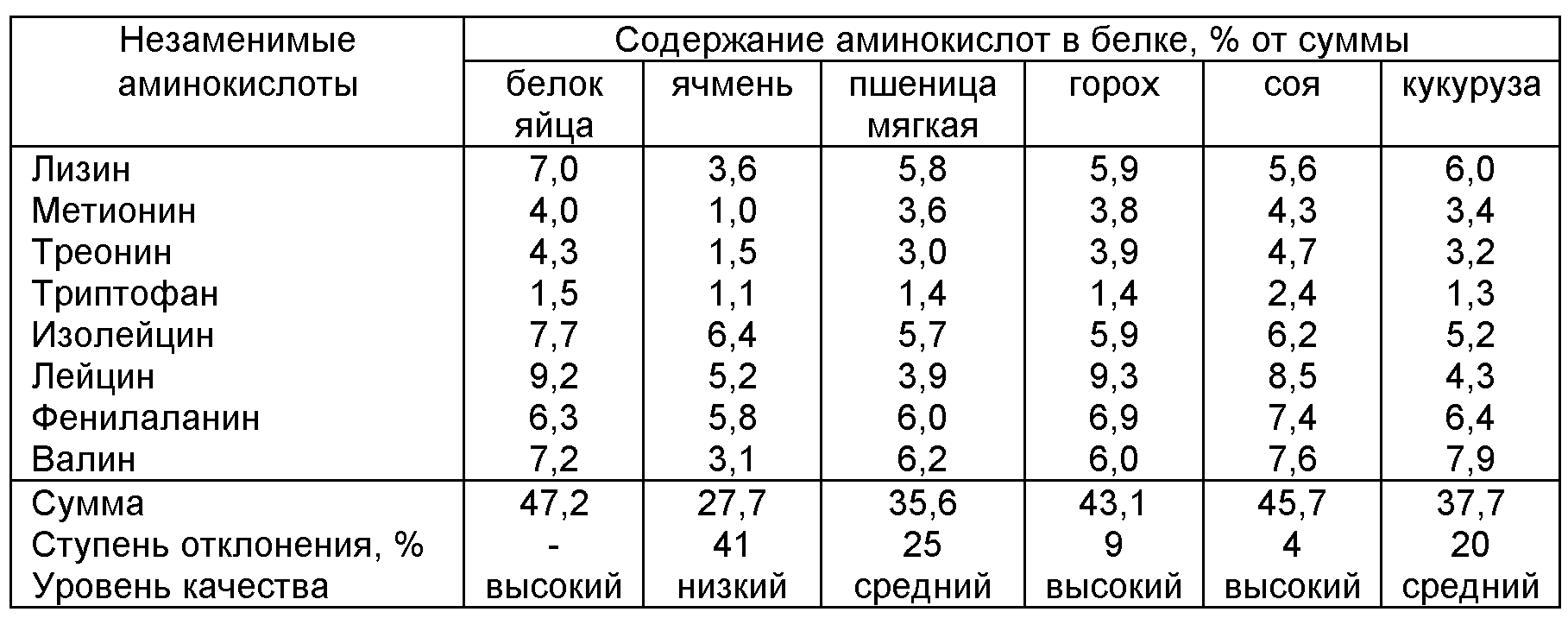 И незаменимые аминокислоты могут стать «незаменимыми» при определенных условиях. Например, заменимые аминокислоты цистеин и тирозин производятся из незаменимых аминокислот метионина и фенилаланина. Если метионин и фенилаланин не доступны в достаточном количестве, цистеин и тирозин становятся незаменимыми в рационе.
И незаменимые аминокислоты могут стать «незаменимыми» при определенных условиях. Например, заменимые аминокислоты цистеин и тирозин производятся из незаменимых аминокислот метионина и фенилаланина. Если метионин и фенилаланин не доступны в достаточном количестве, цистеин и тирозин становятся незаменимыми в рационе.
Процесс сборки аминокислот/белков
Процессы сборки аминокислот с образованием белков и расщепления белков на отдельные аминокислоты для использования организмом являются непрерывными. Когда нам нужно больше ферментных белков, организм вырабатывает больше ферментных белков; когда нам нужно больше клеток, организм производит больше белков для клеток. Эти различные типы белков производятся по мере необходимости. Если в организме истощатся запасы любой из незаменимых аминокислот, он не сможет производить белки, для которых требуются эти аминокислоты. Недостаточное поступление даже одной незаменимой аминокислоты может препятствовать синтезу необходимых белков и снижать их уровень в организме. Кроме того, все незаменимые аминокислоты должны присутствовать в рационе одновременно, чтобы другие аминокислоты могли быть использованы.
Кроме того, все незаменимые аминокислоты должны присутствовать в рационе одновременно, чтобы другие аминокислоты могли быть использованы.
Как могла произойти такая ситуация? Легче, чем вы думаете. Многие факторы могут способствовать дефициту незаменимых аминокислот, даже если вы соблюдаете хорошо сбалансированную диету, содержащую достаточное количество белка. Нарушение всасывания, инфекция, травма, стресс, употребление наркотиков, возраст и дисбаланс других питательных веществ могут влиять на доступность незаменимых аминокислот в организме. Недостаточное потребление витаминов и минералов, особенно витамина С, может препятствовать всасыванию аминокислот в нижней части тонкого кишечника. Витамин B6 также необходим для транспорта аминокислот в организме.
Если ваша диета не сбалансирована должным образом, т. е. если она рано или поздно не обеспечивает достаточное количество незаменимых аминокислот, это проявится как какое-то физическое расстройство. Это не означает, однако, что диета, содержащая огромное количество белка, является ответом. На самом деле это нездорово. Избыток белка создает чрезмерную нагрузку на почки и печень, которым приходится перерабатывать отходы белкового обмена. Почти половина аминокислот в пищевом белке преобразуется печенью в глюкозу и используется для обеспечения клеток необходимой энергией. В результате этого процесса образуется побочный продукт – аммиак. Аммиак токсичен для организма, поэтому организм защищает себя, заставляя печень превращать аммиак в гораздо менее токсичное соединение, мочевину, которая затем переносится кровотоком, фильтруется почками и выводится из организма.
На самом деле это нездорово. Избыток белка создает чрезмерную нагрузку на почки и печень, которым приходится перерабатывать отходы белкового обмена. Почти половина аминокислот в пищевом белке преобразуется печенью в глюкозу и используется для обеспечения клеток необходимой энергией. В результате этого процесса образуется побочный продукт – аммиак. Аммиак токсичен для организма, поэтому организм защищает себя, заставляя печень превращать аммиак в гораздо менее токсичное соединение, мочевину, которая затем переносится кровотоком, фильтруется почками и выводится из организма.
Транспортеры аминокислот | Энциклопедия MDPI
Обычная функция переносчиков аминокислот в клетках млекопитающих заключается в поддержании гомеостаза аминокислот. Каждая клетка нуждается в аминокислотах из внеклеточных источников, особенно в незаменимых аминокислотах, которые клетки млекопитающих не способны синтезировать. Эта потребность не может быть удовлетворена без участия специфических переносчиков в плазматической мембране из-за гидрофильной природы этих аминокислот, что препятствует их простой диффузии через гидрофобный липидный бислой.
1. Введение
Обычная функция переносчиков аминокислот в клетках млекопитающих заключается в поддержании гомеостаза аминокислот. Каждая клетка нуждается в аминокислотах из внеклеточных источников, особенно в незаменимых аминокислотах, которые клетки млекопитающих не способны синтезировать. Эта потребность не может быть удовлетворена без участия специфических переносчиков в плазматической мембране из-за гидрофильной природы этих аминокислот, что препятствует их простой диффузии через гидрофобный липидный бислой. Транспортный процесс, опосредованный этими переносчиками аминокислот, является либо однопортовым (т. обратное направление). Некоторые из них являются простыми облегчающими транспортерами без участия какого-либо совместно транспортируемого иона, тогда как другие являются связанными транспортерами с участием одного или нескольких ионов (Na + , H + , K + или Cl — ). В зависимости от стехиометрии аминокислотных субстратов и котранспортируемых ионов процесс транспорта может быть электронейтральным или электрогенным. Следовательно, направление переноса аминокислот, опосредованного данным переносчиком аминокислот, диктуется множеством факторов: градиентами концентрации аминокислотных субстратов и котранспортируемых ионов, а также мембранным потенциалом. Эти переносчики аминокислот не экспрессируются исключительно в плазматической мембране [1] [2] [3] [4] ; они также обнаружены во внутриклеточных мембранах, особенно в лизосомальных [5] [6] и митохондриальных мембранах [7] . Это имеет смысл, поскольку потребности клеток в аминокислотах удовлетворяются не только за счет поглощения из внеклеточных источников, но и за счет переноса из лизосом после протеолиза в сочетании с аутофагией, пиноцитозом и макропиноцитозом. В митохондриях многие из биохимических путей, протекающих в матриксе, включают аминокислоты (например, цикл мочевины, малат-аспартатный челнок), что требует опосредованного транспортером переноса аминокислот в обоих направлениях через внутреннюю митохондриальную мембрану.
Следовательно, направление переноса аминокислот, опосредованного данным переносчиком аминокислот, диктуется множеством факторов: градиентами концентрации аминокислотных субстратов и котранспортируемых ионов, а также мембранным потенциалом. Эти переносчики аминокислот не экспрессируются исключительно в плазматической мембране [1] [2] [3] [4] ; они также обнаружены во внутриклеточных мембранах, особенно в лизосомальных [5] [6] и митохондриальных мембранах [7] . Это имеет смысл, поскольку потребности клеток в аминокислотах удовлетворяются не только за счет поглощения из внеклеточных источников, но и за счет переноса из лизосом после протеолиза в сочетании с аутофагией, пиноцитозом и макропиноцитозом. В митохондриях многие из биохимических путей, протекающих в матриксе, включают аминокислоты (например, цикл мочевины, малат-аспартатный челнок), что требует опосредованного транспортером переноса аминокислот в обоих направлениях через внутреннюю митохондриальную мембрану.
В клетках млекопитающих имеется множество переносчиков аминокислот, и они различаются по субстратной селективности, механизму транспорта, движущим силам и характеру тканевой экспрессии. С точки зрения номенклатуры генома человека, эти транспортеры принадлежат к десяти различным семействам генов SLC (переносчики растворенных веществ) (1, 6, 7, 16, 17, 25, 36, 38, 43 и 66) вместе с четырьмя нетранспортными белками ( SLC3A1/rBAT, SLC3A2/4F2hc/CD98, ACE2 и коллекрин), которые служат шаперонами для некоторых из этих транспортеров [1] [2] . В зависимости от экспрессии, специфичной для клеточного типа, они участвуют не только в клеточном поглощении аминокислот, но и в трансклеточном переносе аминокислот через барьерные структуры, такие как гематоэнцефалический барьер, гематоэнцефалический барьер, барьер матери и плода и во всасывании диетических аминокислот (кишечник) и реабсорбции отфильтрованных аминокислот (почки). Мутации с потерей функции во многих из этих транспортеров вызывают специфические генетические заболевания (например, болезнь Хартнупа, цистинурию) [8] [9] [10] [11] .
2. Нетрадиционные функции переносчиков аминокислот
Аминокислоты представляют собой важный класс питательных веществ в клеточном метаболизме, выступая в качестве строительных блоков для синтеза белка и функционируя во многих метаболических путях, таких как цикл мочевины, биосинтез гема, одноуглеродный метаболизм, глутаминолиз и нейротрансмиссия, и это лишь некоторые из них. Следовательно, клеточная потребность в аминокислотах функционально связана с уровнями экспрессии специфических переносчиков аминокислот в плазматической мембране для координации двух событий, а именно наличия и использования аминокислот. Это связывание включает специфические сигнальные пути с непосредственным участием задействованных белков-транспортеров в функциональных перекрестных помехах. Это привело к появлению термина «трансцептор», чтобы подчеркнуть нетрадиционную роль белка, функционирующего как в качестве переносчика, так и в качестве рецептора 9.0180 [12] . В клетках млекопитающих этот новый аспект транспортера аминокислот был впервые обнаружен для классической «системы А» [13] , связанной с Na + транспортной системы для короткоцепочечных аминокислот и глутамина, принадлежащих к семейству SLC38. [14] . Система А состоит из трех специфических транспортеров, SLC38A1 [15] [16] , SLC38A2 [17] и SLC38A4 [18] ; среди этих трех новая функция «трансцептора» была приписана только SLC38A2 9.0180 [12] [13] [19] [20] . Эта особенность ответственна за увеличение плотности белка-транспортера в плазматической мембране при дефиците аминокислот в клетках и, наоборот, за уменьшение плотности транспортера в плазматической мембране при насыщении клеток аминокислотами. Совсем недавно было показано, что другой член семейства SLC38, а именно SLC38A9, экспрессируемый в лизосомальной мембране, связывает аминокислоты в лизосомах и активность mTORC1 9.0180 [21] [22] . Подобная особенность была также обнаружена для некоторых членов семейства переносчиков аминокислот SLC36 [23] [24] . Во всех этих случаях переносчики аминокислот не только опосредуют транспорт аминокислот, но также функционируют как датчики аминокислот, связывая, таким образом, статус аминокислот в клетках с плотностью переносчиков аминокислот в плазматической мембране, чтобы модулировать поступление аминокислот в клетки и их транспортировку.
[14] . Система А состоит из трех специфических транспортеров, SLC38A1 [15] [16] , SLC38A2 [17] и SLC38A4 [18] ; среди этих трех новая функция «трансцептора» была приписана только SLC38A2 9.0180 [12] [13] [19] [20] . Эта особенность ответственна за увеличение плотности белка-транспортера в плазматической мембране при дефиците аминокислот в клетках и, наоборот, за уменьшение плотности транспортера в плазматической мембране при насыщении клеток аминокислотами. Совсем недавно было показано, что другой член семейства SLC38, а именно SLC38A9, экспрессируемый в лизосомальной мембране, связывает аминокислоты в лизосомах и активность mTORC1 9.0180 [21] [22] . Подобная особенность была также обнаружена для некоторых членов семейства переносчиков аминокислот SLC36 [23] [24] . Во всех этих случаях переносчики аминокислот не только опосредуют транспорт аминокислот, но также функционируют как датчики аминокислот, связывая, таким образом, статус аминокислот в клетках с плотностью переносчиков аминокислот в плазматической мембране, чтобы модулировать поступление аминокислот в клетки и их транспортировку. зависимые метаболические пути. Это обеспечивает контроль поступления аминокислот в клетки таким образом, который соответствует статусу аминокислот (дефицит или избыток) в клетках, а также модуляцию метаболических путей, в которых используются аминокислоты, таким образом, чтобы скорость этих путей соответствовала степень доставки аминокислот в клетки.
зависимые метаболические пути. Это обеспечивает контроль поступления аминокислот в клетки таким образом, который соответствует статусу аминокислот (дефицит или избыток) в клетках, а также модуляцию метаболических путей, в которых используются аминокислоты, таким образом, чтобы скорость этих путей соответствовала степень доставки аминокислот в клетки.
Другой заметной нетрадиционной функцией переносчиков аминокислот является их участие в качестве рецепторов клеточной поверхности в ретровирусах. Интересно, что эта функция не зависит от роли этих переносчиков в переносе аминокислот. Это контрастирует с их «трансцепторной» функцией, где транспорт аминокислот связан с клеточной передачей сигналов. Ретровирусы захватывают переносчики специфических аминокислот, чтобы проникнуть в их клетки-мишени 90–180 [25] 90–181 . В этом процессе вирусы связываются с внешней поверхностью специфических переносчиков, а затем связанный комплекс подвергается эндоцитозу, в результате чего вирусы доставляются в клетки. Поскольку переносчики аминокислот экспрессируются в зависимости от типа клеток, это также обеспечивает молекулярную основу для избирательности клеток-мишеней для этих вирусов. Кроме того, вариабельность аминокислотных последовательностей данного переносчика аминокислот среди разных видов диктует специфичность взаимодействия вирусов для видоспецифического тропизма данного вируса.
Поскольку переносчики аминокислот экспрессируются в зависимости от типа клеток, это также обеспечивает молекулярную основу для избирательности клеток-мишеней для этих вирусов. Кроме того, вариабельность аминокислотных последовательностей данного переносчика аминокислот среди разных видов диктует специфичность взаимодействия вирусов для видоспецифического тропизма данного вируса.
На сегодняшний день было показано, что три переносчика аминокислот и один транспортер-шаперон служат рецепторами клеточной поверхности для специфических ретровирусов (, таблица 1, ). Транспортеры представляют собой мышиный переносчик катионных аминокислот 1 (Slc7a1) для экотропного вируса мышиного лейкоза (E-MLV) и вируса лейкоза крупного рогатого скота (BLV) [26] [27] , переносчик аланин-серин-цистеина человека 1 (ASCT1). или SLC1A4) для инфекционного эндогенного ретровируса кошек RD-114, эндогенного ретровируса бабуина (BaEV) и эндогенного ретровируса человека HERV-W [28] и транспортер аланин-серин-цистеин 2 (ASCT2 или SLC1A5) для эндогенного ретровируса бабуина (BaEV) и эндогенного ретровируса человека HERV-W [29] [30] . Хотя транспортная функция не имеет ничего общего со связыванием вируса с белком-транспортером, вполне вероятно, что это взаимодействие влияет на транспортную функцию. Поскольку проникновение вируса через транспортер связано с эндоцитозом, возможно, что связывание вируса с транспортером приводит к снижению плотности белка-транспортера в плазматической мембране, что негативно влияет на транспортную функцию. Это также относится к ACE2, шаперону для переносчиков кишечных аминокислот SLC6A19.и SLC6A20 [31] ; этот белок-шаперон служит первичным рецептором вируса COVID-19 SARS-CoV-2 [32] [33] . Делеция Ace2 у мышей приводила к резкому снижению плотности двух переносчиков в апикальной мембране эпителиальных клеток тонкой кишки 90–180 [34] 90–181 . Следовательно, вероятно, что связывание SARS-CoV-2 с ACE2 в кишечнике снижает проникновение SLC6A19 и SLC6A20 в апикальную мембрану, что, следовательно, снижает всасывание аминокислот в тонком кишечнике.
Хотя транспортная функция не имеет ничего общего со связыванием вируса с белком-транспортером, вполне вероятно, что это взаимодействие влияет на транспортную функцию. Поскольку проникновение вируса через транспортер связано с эндоцитозом, возможно, что связывание вируса с транспортером приводит к снижению плотности белка-транспортера в плазматической мембране, что негативно влияет на транспортную функцию. Это также относится к ACE2, шаперону для переносчиков кишечных аминокислот SLC6A19.и SLC6A20 [31] ; этот белок-шаперон служит первичным рецептором вируса COVID-19 SARS-CoV-2 [32] [33] . Делеция Ace2 у мышей приводила к резкому снижению плотности двух переносчиков в апикальной мембране эпителиальных клеток тонкой кишки 90–180 [34] 90–181 . Следовательно, вероятно, что связывание SARS-CoV-2 с ACE2 в кишечнике снижает проникновение SLC6A19 и SLC6A20 в апикальную мембрану, что, следовательно, снижает всасывание аминокислот в тонком кишечнике.
Таблица 1. Переносчики аминокислот, подрабатывающие в качестве рецепторов клеточной поверхности для проникновения в клетку определенных вирусов.
Переносчики аминокислот, подрабатывающие в качестве рецепторов клеточной поверхности для проникновения в клетку определенных вирусов.
| Транспортер | Вид | Вирус |
|---|---|---|
| Категория 1 (Slc7a1) | Мышь | Вирус экотропного мышиного лейкоза; Вирус лейкемии крупного рогатого скота |
| ASCT 1 (SLC1A4) | Человек | Эндогенный ретровирус кошек RD-114; Эндогенный ретровирус бабуина |
| ASCT 2 (SLC1A5) | Человек | Эндогенный ретровирус павиана; Эндогенный ретровирус человека HERV-W |
| ACE 2 (шаперон для переносчиков кишечных аминокислот SLC6A19 и SLC6A20) | Человек | Вирус COVID-19 SARS-CoV-2 |
Есть несколько других членов семейства SLC, которые используются в качестве рецепторов клеточной поверхности для ретровирусов [25] , но они не являются переносчиками аминокислот. Сюда входят облегчающий переносчик глюкозы GLUT1 (SLC2A1), обменник Na + / H + NHE1 (SLC9A1), два переносчика фосфатов (SLC20A1 и SLC20A2), два переносчика витаминов (SLC19A1 и SLC19A2) и переносчик гема SLC49A1.
Сюда входят облегчающий переносчик глюкозы GLUT1 (SLC2A1), обменник Na + / H + NHE1 (SLC9A1), два переносчика фосфатов (SLC20A1 и SLC20A2), два переносчика витаминов (SLC19A1 и SLC19A2) и переносчик гема SLC49A1.
Совсем недавно были обнаружены две новые нетрадиционные функции переносчиков аминокислот. Это включает усиление макропиноцитоза и регуляцию ожирения, вызванного диетой (потенциирование или защита в зависимости от вовлеченного переносчика).
3. Макропиноцитоз и SLC38A5/SLC38A3
Макропиноцитоз представляет собой механизм неспецифического поглощения жидкой фазы клетками, который отличается от других подобных процессов, таких как пиноцитоз и рецептор-опосредованный эндоцитоз [35] [36] . Этот путь играет важную роль в поддержании аминокислотного питания в клетках за счет поступления внеклеточных белков с последующим протеолизом в лизосомах с доставкой полученных аминокислот в цитоплазму. В некотором роде это похоже на аутофагию, при которой клеточные белки используются для поддержания питания аминокислотами в определенных условиях, опять-таки с участием лизосомального протеолиза для образования свободных аминокислот. Интересно, что по каким-то неизвестным причинам в аминокислотном питании основное внимание уделяется макропиноцитозу, но этот эндоцитозный процесс не может быть ограничен поглощением внеклеточных белков из-за его участия в неспецифическом поглощении всех компонентов, присутствующих во внеклеточной жидкости. Имеются убедительные данные, указывающие на участие макропиноцитоза в поглощении как нативных, так и окисленных липопротеинов низкой плотности (ЛПНП) [37] [38] . Следовательно, макропиноцитоз, вероятно, также обеспечивает питание клеток липидами, такими как холестерин, триглицериды и фосфолипиды. Понятно, что макропиноцитоз и аутофагия имеют решающее значение для раковых клеток в условиях лишения питательных веществ 90–180 [39] 90–181 90–180 [40] 90–181 90–180 [41] 90–181 .
В некотором роде это похоже на аутофагию, при которой клеточные белки используются для поддержания питания аминокислотами в определенных условиях, опять-таки с участием лизосомального протеолиза для образования свободных аминокислот. Интересно, что по каким-то неизвестным причинам в аминокислотном питании основное внимание уделяется макропиноцитозу, но этот эндоцитозный процесс не может быть ограничен поглощением внеклеточных белков из-за его участия в неспецифическом поглощении всех компонентов, присутствующих во внеклеточной жидкости. Имеются убедительные данные, указывающие на участие макропиноцитоза в поглощении как нативных, так и окисленных липопротеинов низкой плотности (ЛПНП) [37] [38] . Следовательно, макропиноцитоз, вероятно, также обеспечивает питание клеток липидами, такими как холестерин, триглицериды и фосфолипиды. Понятно, что макропиноцитоз и аутофагия имеют решающее значение для раковых клеток в условиях лишения питательных веществ 90–180 [39] 90–181 90–180 [40] 90–181 90–180 [41] 90–181 . Важность этих альтернативных способов доставки аминокислот в раковые клетки подчеркивается повышенным спросом на аминокислоты и другие питательные вещества для поддержки быстрой пролиферации в этих клетках. Это в дополнение к заметной активизации селективных переносчиков аминокислот, пептидов и других питательных веществ в раковых клетках для удовлетворения потребностей в питательных веществах традиционным путем, а именно опосредованной транспортером доставкой [42] [43] [44] [45] [46] .
Важность этих альтернативных способов доставки аминокислот в раковые клетки подчеркивается повышенным спросом на аминокислоты и другие питательные вещества для поддержки быстрой пролиферации в этих клетках. Это в дополнение к заметной активизации селективных переносчиков аминокислот, пептидов и других питательных веществ в раковых клетках для удовлетворения потребностей в питательных веществах традиционным путем, а именно опосредованной транспортером доставкой [42] [43] [44] [45] [46] .
Макропиноцитоз активируется различными онкогенами, такими как рецептор EGF и активирующие мутации в KRAS [47] [48] . Несмотря на то, что макропиноцитоз не зависит от клатрина и кавеолина, этот процесс все еще требует ремоделирования цитоскелетного белка актина [49] . Одним из основных факторов, положительно влияющих на это ремоделирование, необходимое для инициации инвагинации плазматической мембраны для макропиноцитоза, является подщелачивание рН на цитоплазматической стороне плазматической мембраны. Активация макропиноцитоза рецептором EGF включает индукцию Na + /H + обменник подтипа NHE1 (SLC9A1), который обеспечивает отток H + из клеток в обмен на приток Na + [50] . Альтернативные сигнальные механизмы могут также участвовать в индукции макропиноцитоза с помощью EGF [51] . В случае мутаций KRAS рекрутирование вакуолярной АТФазы на плазматическую мембрану обеспечивает отток H + из клеток [52] . В обоих случаях конечным результатом является подщелачивание цитоплазматического домена плазматической мембраны, что затем способствует ремоделированию актина для инициации макропиноцитоза.
Активация макропиноцитоза рецептором EGF включает индукцию Na + /H + обменник подтипа NHE1 (SLC9A1), который обеспечивает отток H + из клеток в обмен на приток Na + [50] . Альтернативные сигнальные механизмы могут также участвовать в индукции макропиноцитоза с помощью EGF [51] . В случае мутаций KRAS рекрутирование вакуолярной АТФазы на плазматическую мембрану обеспечивает отток H + из клеток [52] . В обоих случаях конечным результатом является подщелачивание цитоплазматического домена плазматической мембраны, что затем способствует ремоделированию актина для инициации макропиноцитоза.
Если отток H + из клеток через обменник Na + / H + или v-АТФазу способствует макропиноцитозу, могут ли переносчики аминокислот, которые опосредуют H + , из клеток как часть их транспорта механизм имеет аналогичный эффект? Этот вопрос привел к исследованию переносчика аминокислот SLC38A5 в отношении его потенциальной связи с макропиноцитозом [53] . SLC38A5, также называемый Системой N2 (SN2) или переносчиком нейтральной аминокислоты, связанным с натрием 5 (SNAT5), представляет собой Na + -связанный транспортер для аминокислот глутамина, гистидина, аспарагина, глицина, серина и метионина, и процесс его транспорта связан с одновременным высвобождением H + из клеток ( Рисунок 1 ). Стехиометрия Na + :H + составляет 1:1, что делает процесс переноса электронейтральным, поскольку все его аминокислотные субстраты являются цвиттер-ионными без суммарного заряда. Таким образом, SLC38A5 представляет собой аминокислотно-зависимый Na + /H + 9.0181 обменник [54] [55] . Клеточное поглощение аминокислот через этот переносчик в присутствии внеклеточного Na + действительно приводит к внутриклеточному подщелачиванию в результате оттока H + [55] . Этот транспортер сильно активируется при раке молочной железы, особенно при тройном негативном раке молочной железы [56] .
SLC38A5, также называемый Системой N2 (SN2) или переносчиком нейтральной аминокислоты, связанным с натрием 5 (SNAT5), представляет собой Na + -связанный транспортер для аминокислот глутамина, гистидина, аспарагина, глицина, серина и метионина, и процесс его транспорта связан с одновременным высвобождением H + из клеток ( Рисунок 1 ). Стехиометрия Na + :H + составляет 1:1, что делает процесс переноса электронейтральным, поскольку все его аминокислотные субстраты являются цвиттер-ионными без суммарного заряда. Таким образом, SLC38A5 представляет собой аминокислотно-зависимый Na + /H + 9.0181 обменник [54] [55] . Клеточное поглощение аминокислот через этот переносчик в присутствии внеклеточного Na + действительно приводит к внутриклеточному подщелачиванию в результате оттока H + [55] . Этот транспортер сильно активируется при раке молочной железы, особенно при тройном негативном раке молочной железы [56] . Поскольку субстратная селективность SLC38A5 включает глицин, серин и метионин, аминокислоты, необходимые для одноуглеродного метаболизма, а также глютамин, аминокислоту, обязательную для метаболического пути, специфичного для раковых клеток, известного как глутаминолиз, повышенная экспрессия и активность этого транспортер в раковых клетках подпитывает онкогенный метаболизм и поддерживает рост опухоли [56] . Поскольку трижды негативные клетки рака молочной железы экспрессируют высокие уровни SLC38A5, связь этого переносчика с макропиноцитозом была исследована в этих клетках 90–180 [53] 90–181 . Эти исследования убедительно установили, что поглощение аминокислот клетками с помощью этого переносчика связано с активацией макропиноцитоза, о чем свидетельствует поглощение клетками TMR (тетраметилродамин)-декстрана, флуоресцентного маркера, который обнаруживает макропиноцитоз. Интересно, что макропиноцитоз, стимулируемый SLC38A5, ингибируется производными амилорида, такими как этиизопропиламилорид 9.
Поскольку субстратная селективность SLC38A5 включает глицин, серин и метионин, аминокислоты, необходимые для одноуглеродного метаболизма, а также глютамин, аминокислоту, обязательную для метаболического пути, специфичного для раковых клеток, известного как глутаминолиз, повышенная экспрессия и активность этого транспортер в раковых клетках подпитывает онкогенный метаболизм и поддерживает рост опухоли [56] . Поскольку трижды негативные клетки рака молочной железы экспрессируют высокие уровни SLC38A5, связь этого переносчика с макропиноцитозом была исследована в этих клетках 90–180 [53] 90–181 . Эти исследования убедительно установили, что поглощение аминокислот клетками с помощью этого переносчика связано с активацией макропиноцитоза, о чем свидетельствует поглощение клетками TMR (тетраметилродамин)-декстрана, флуоресцентного маркера, который обнаруживает макропиноцитоз. Интересно, что макропиноцитоз, стимулируемый SLC38A5, ингибируется производными амилорида, такими как этиизопропиламилорид 9. 0180 [53] . Это подняло вопрос о том, ингибируется ли EIPA и другими производными амилорида, которые известны своей активностью в качестве ингибиторов классические теплообменники Na + /H + . Последующие эксперименты показали, что это действительно так; SLC38A5 напрямую ингибируется амилоридами [53] .
0180 [53] . Это подняло вопрос о том, ингибируется ли EIPA и другими производными амилорида, которые известны своей активностью в качестве ингибиторов классические теплообменники Na + /H + . Последующие эксперименты показали, что это действительно так; SLC38A5 напрямую ингибируется амилоридами [53] .
Рис. 1. Пути транспорта для NHE1 и SNAT5 и их значение для макропиноцитоза. Схема показывает сходство между двумя переносчиками в оттоке H + , один из которых представляет собой обменник Na + /H + (NHE1), а другой представляет собой аминокислотно-зависимый Na + /H. + обменник. В обоих случаях процесс транспорта приводит к подщелачиванию цитоплазматического субдомена под плазматической мембраной, что инициирует ремоделирование актиновых филаментов и, следовательно, способствует макропиноцитозу. SNAT5, связанный с натрием переносчик нейтральных аминокислот 5, другое название SLC38A5.
До недавнего времени четыре переносчика аминокислот привлекали наибольшее внимание из-за их роли в питании аминокислотами раковых клеток; это SLC7A5, SLC1A5, SLC7A11 и SLC6A14 [42] [43] [44] [45] . Ни один из них не связан с макропиноцитозом. Это делает SLC38A5 уникальным. Этот транспортер также активируется при определенных видах рака, и его функции, способствующие развитию опухолей, не ограничиваются поставкой селективных аминокислот в раковые клетки. Его функция также связана с регуляцией внутриклеточного pH из-за участия H + как один из котранспортируемых ионов. Приток аминокислотных субстратов через SLC38A5 связан с удалением H + из клеток, что обеспечивает новый механизм поддержания клеточного pH. Этот процесс имеет решающее значение для раковых клеток, поскольку они генерируют большое количество молочной кислоты посредством аэробного гликолиза и, следовательно, нуждаются в эффективных путях удаления H + из клеток [57] . SLC38A5 предоставляет один такой механизм. Новые данные о том, что этот переносчик аминокислот также способствует макропиноцитозу, подчеркивают важность этого переносчика для роста опухоли, поскольку макропиноцитоз является эффективным путем доставки аминокислот и других питательных веществ к раковым клеткам. Анализ данных, доступных в Атласе генома рака (TGCA), показывает, что SLC38A5 активируется не только при тройном негативном раке молочной железы, но и при раке поджелудочной железы. Фактически уровни экспрессии SLC38A5 обратно коррелируют с выживаемостью пациентов с раком поджелудочной железы. Важно отметить, что макропиноцитозу уделяется самое пристальное внимание при раке поджелудочной железы из-за широкого распространения активирующих мутаций в KRAS и их роли в потенцировании макропиноцитоза как нового механизма обеспечения оптимального питания раковых клеток. Следовательно, SLC38A5, не только как поставщик аминокислот, но и как активатор макропиноцитоза, занимает уникальное место среди переносчиков аминокислот, которые, как известно, активируются при раке.
SLC38A5 предоставляет один такой механизм. Новые данные о том, что этот переносчик аминокислот также способствует макропиноцитозу, подчеркивают важность этого переносчика для роста опухоли, поскольку макропиноцитоз является эффективным путем доставки аминокислот и других питательных веществ к раковым клеткам. Анализ данных, доступных в Атласе генома рака (TGCA), показывает, что SLC38A5 активируется не только при тройном негативном раке молочной железы, но и при раке поджелудочной железы. Фактически уровни экспрессии SLC38A5 обратно коррелируют с выживаемостью пациентов с раком поджелудочной железы. Важно отметить, что макропиноцитозу уделяется самое пристальное внимание при раке поджелудочной железы из-за широкого распространения активирующих мутаций в KRAS и их роли в потенцировании макропиноцитоза как нового механизма обеспечения оптимального питания раковых клеток. Следовательно, SLC38A5, не только как поставщик аминокислот, но и как активатор макропиноцитоза, занимает уникальное место среди переносчиков аминокислот, которые, как известно, активируются при раке.
SLC38A3, также известный как SN1 или SNAT3, представляет другой подтип системы транспорта аминокислот N [14] . Механизм транспортной функции идентичен для SLC38A5 и SLC38A3 в том смысле, что последний также является зависимым от аминокислот обменником Na + /H + . Можно предположить, что SLC38A3 также способен активировать макропиноцитоз аминокислотно-связанным образом. SLC38A3 играет в почках обязательную роль в кислотно-щелочном балансе. При метаболическом ацидозе почкам приходится устранять избыток H + , а для этого требуется источник аммиака, который соединяется с H + , в результате чего NH 4 + выводится через апикальную мембрану с мочой. Глютамин представляет собой этот источник аммиака, а SLC38A3 является основным поставщиком этого глютамина. Соответственно, SLC38A3 индуцируется в базолатеральной мембране эпителиальных клеток в почках во время метаболического ацидоза, чтобы обеспечить этот глутамин посредством связанного с Na + поглощения из кровотока [58] . Интересно, что эта повышенная экспрессия специфична для SLC38A3; на экспрессию SLC38A5 в почках не влияет метаболический ацидоз 90–180 [58] 90–181 . Мутация потери функции в Slc38a3, вызывающая дефицит Slc38a3 в мышиной модели, подтверждает критическую роль этого транспортера в метаболическом ацидозе 90–180 [59] 90–181 . можно предположить, что макропиноцитоз может быть активирован в клетках почечных канальцев во время метаболического ацидоза и что в результате может увеличиться клеточное поглощение белков плазмы и липопротеинов. Что это означает с точки зрения физиологии и патологии канальцевых клеток, необходимо исследовать. В настоящее время эта линия мышления является лишь спекулятивной и нуждается в экспериментальной проверке и подтверждении.
Интересно, что эта повышенная экспрессия специфична для SLC38A3; на экспрессию SLC38A5 в почках не влияет метаболический ацидоз 90–180 [58] 90–181 . Мутация потери функции в Slc38a3, вызывающая дефицит Slc38a3 в мышиной модели, подтверждает критическую роль этого транспортера в метаболическом ацидозе 90–180 [59] 90–181 . можно предположить, что макропиноцитоз может быть активирован в клетках почечных канальцев во время метаболического ацидоза и что в результате может увеличиться клеточное поглощение белков плазмы и липопротеинов. Что это означает с точки зрения физиологии и патологии канальцевых клеток, необходимо исследовать. В настоящее время эта линия мышления является лишь спекулятивной и нуждается в экспериментальной проверке и подтверждении.
SLC38A3 и SLC38A5 также экспрессируются в головном мозге, прежде всего в астроцитах, где они, как полагают, играют роль в глутамин-глутаматном цикле, в котором транспортеры опосредуют высвобождение глутамина из астроцитов [60] [61] .

