Глюкоза 40%, 100 мл. РАСТВОРЫ. ВЕТПРЕПАРАТЫ. Ветеринарная аптека «ЗооФарм»
СОСТАВ И ФОРМА ВЫПУСКА
Раствор глюкозы 40 % — гипертонический. Представляет собой прозрачную, бесцветную или слегка желтоватую жидкость сладкую на вкус, рН 3,0-4,0. Расфасовывают по 100 мл, 200 мл и 400 мл в стеклянные флаконы.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Глюкоза — один из наиболее легко усвояемых сахаров. Она хорошо всасывается в кровь, а избыток ее поступает в печень и мышцы, где превращается в гликоген. В организме она распадается с образованием энергии, которая обеспечивает тепло, работу мышц и других тканей. Глюкоза также стимулирует синтез гормонов и ферментов в организме животных, повышает защитные силы организма. При внутривенном введении гипертонического раствора глюкозы повышается осмотическое давление крови, усиливается ток жидкости из тканей в кровь, повышаются процессы обмена, улучшается дезинтоксикационная функция печени, усиливается сократительная деятельность сердечной мышцы, расширяются сосуды, увеличивается диурез.
ПОКАЗАНИЯ
Токсикоинфекции, инфекционные заболевания, различные интоксикации (отравления наркотиками, синильной кислотой и ее солями, окисью углерода, анилином, мышьяковистым водородом и другими веществами), заболевания печени (гепатит, цирроз, дистрофия и атрофия печени), декомпенсация сердечной деятельности, отек легких, геморрагический диатез и многие другие патологические состояния. У жвачных животных назначают при желудочно-кишечных заболеваниях с явлениями интоксикации, гипотонии, атонии преджелудков, а также при ацетонемии, послеродовой гемоглобинурии, кетонурии и токсемии. Растворы глюкозы назначают слабым и истощенным животным как энергетическое и диетическое средство.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
В зависимости от тяжести заболевания препарат вводят животным внутрь или внутривенно 1 – 2 раза в день в следующих дозах (в мл на одно животное): крупный рогатый скот — 75-370, лошади — 75-300, овцы и козы — 10-75, свиньи — 20-75, собаки и кошки — 5-50.
ПОБОЧНЫЕ ДЕЙСТВИЯ
При правильном использовании и дозировке побочные явления, как правило, не наблюдаются.
ПРОТИВОПОКАЗАНИЯ
Гипергликемия.
ОСОБЫЕ УКАЗАНИЯ
Животноводческую продукцию после применения раствора глюкозы можно использовать без каких-либо ограничений.
УСЛОВИЯ ХРАНЕНИЯ
В сухом, защищенном от света месте при температуре от 0 до 25 °С. Срок годности — 2 года.
Лабораторные показатели обмена глюкозы. Общая информация
Глюкоза – моносахарид альдогексоза – присутствует в большинстве органов и тканей. Окисление глюкозы – один из главных источников энергии организма. Помимо этого, глюкоза является материалом для синтеза гликогена (основной формы запаса энергии в организме животных и человека), моносахаридов пентоз, входящих в состав ДНК, РНК и многих ферментов, ее остаток присутствует в гликопротеинах, гликолипидах, липополисахаридах.
Помимо этого, глюкоза является материалом для синтеза гликогена (основной формы запаса энергии в организме животных и человека), моносахаридов пентоз, входящих в состав ДНК, РНК и многих ферментов, ее остаток присутствует в гликопротеинах, гликолипидах, липополисахаридах.
В физиологических условиях концентрация глюкозы в крови повышается после приема пищи, уменьшается при голодании, физических нагрузках, стрессе. Концентрация глюкозы в крови является производной активности процессов гликогенеза (синтез гликогена), гликогенолиза (распад гликогена), глюконеогенеза (синтез углеводов из неуглеводных компонентов – белков, липидов) и катаболизма в ферментативных реакциях гликолиза и цикла трикарбоновых кислот. Существенное изменение нормальной концентрации глюкозы в крови приводит к серьезным нарушениям метаболизма и может быть фатальным. Выраженная гипогликемия способствует возникновению энергетического голода в нейронах головного мозга и в результате развитию гипогликемической комы и острой гипоксии.
Уровень глюкозы в крови находится под контролем ЦНС и эндокринной системы. Инсулин является основным гипогликемическим фактором, другие гормоны вызывают гипергликемию (контринсулярное действие).
| Гормон | Место синтеза | Стимул для увеличения концентрации | Влияние на уровень глюкозы крови | Влияние на метаболизм глюкозы |
|---|---|---|---|---|
| Инсулин | Поджелудочная железа (β -клетки) | Повышенный уровень глюкозы в крови | Понижает |
Способствует проникновению глюкозы из крови в клетки (кроме клеток печени и ЦНС). Стимулирует гликолиз, гликогенез в печени. Инги бирует глюконеогенез. Стимулирует гликолиз, гликогенез в печени. Инги бирует глюконеогенез.
|
| Глюкагон | Поджелудочная железа (α -клетки) | Пониженный уровень глюкозы в крови | Повышает | Стимулирует гликогенолиз в печени, глюконеогенез. |
| Адреналин | Мозговое вещество надпочечников | Эмоциональный и физический стресс | Повышает | Стимулирует гликогенолиз в печени, снижает расход глюкозы. |
| Кортизол | Кора надпочечников | Пониженный уровень глюкозы в крови, стресс | Повышает | Стимулирует глюконеогенез |
Абсолютная или относительная недостаточность инсулина является причиной развития СД – заболевания, распространенность которого в мире удваивается каждые 10–15 лет. Классификации ВОЗ выделяет несколько типов СД, наиболее распространенными являются:
Классификации ВОЗ выделяет несколько типов СД, наиболее распространенными являются:
- СД 1-го типа (ранее – инсулинозависимый диабет) – абсолютная недостаточность инсулина, обусловленная патологией -клеток поджелудочной железы, проявляется преимущественно в молодом возрасте, требует заместительной гормональной терапии;
- СД 2-го типа, (ранее – инсулинонезависимый диабет) – относительная недостаточность инсулина, вызванная инсулинорезистентностью – нарушением биологического действия инсулина, сопровождающимся снижением инсулинзависимого потребления глюкозы тканями (преимущественно скелетными мышцами), приводящим к хронической компенсаторной гиперинсулинемии. Этот тип диабета проявляется, как правило, после 40 лет.
Остальные типы выделяются достаточно редко, за исключением СД беременных, который имеет преходящий характер.
Для лабораторной диагностики нарушений углеводного обмена, помимо оценки уровня глюкозы в крови натощак и в моче, используют пероральный глюкозо-толерантный тест (ПГТТ) – определение концентрации глюкозы натощак и через 2 ч после приема per os 75 гр сухой глюкозы, растворенной в 250 мл воды.
О возможных противопоказаниях необходимо проконсультироваться со специалистом
Биохимия, гликоген — StatPearls — Книжная полка NCBI
Салах А. Даглас; Шамим С. Мохиуддин.
Информация об авторе и организацияхПоследнее обновление: 8 мая 2022 г.
Введение
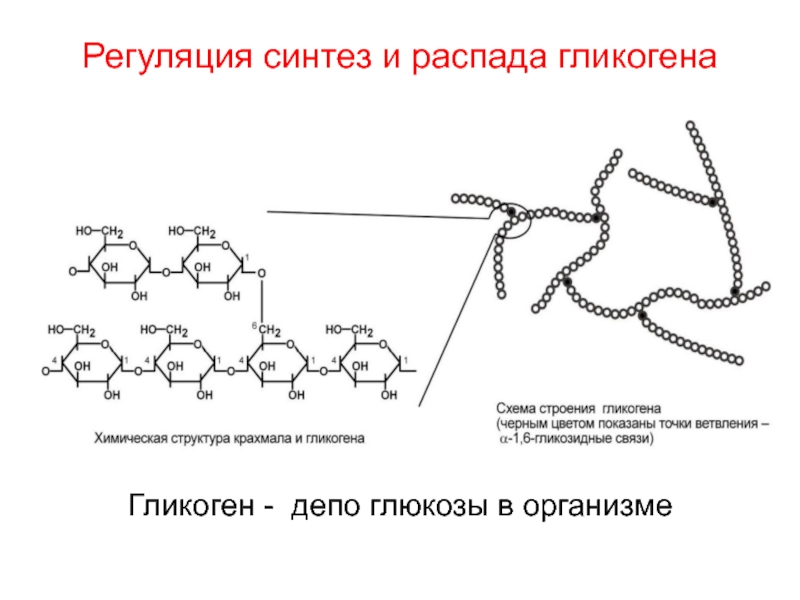
Гликоген представляет собой разветвленный полимер глюкозы, который животные используют в качестве источника энергии. Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких концентрациях в других тканях, таких как почки, сердце и мозг.[1][2] Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения.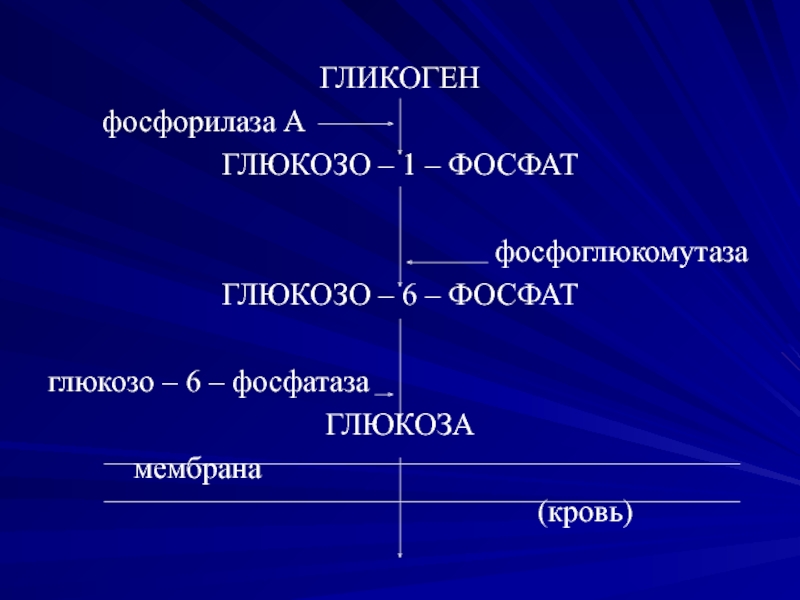 Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма.[3][4]
Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма.[3][4]
Основы
Ключевые фундаментальные положения:
Гликоген влияет на гомеостаз глюкозы.
Гликоген имеет высокую концентрацию в печени, хотя больше всего гликогена по массе содержится в скелетных мышцах. Гликогена в растительных тканях нет.
Скелетные мышцы не могут высвобождать гликоген в кровоток из-за недостатка глюкозо-6-фосфатазы (G6Pase)
Гликоген состоит из двух основных связей: альфа-1,4 и альфа-1 ,6 гликозидные связи — эти связи дают начало линейным цепям и точкам ветвления соответственно.

Разветвление гликогена имеет важное значение, поскольку оно обеспечивает повышенную растворимость в воде и наличие нескольких участков для его расщепления; это позволяет легко и быстро утилизировать гликоген, когда он расщепляется.
Синтез и расщепление гликогена коррелируют с состояниями высокой и низкой энергии соответственно.
Инсулин и глюкагон представляют собой пептидные гормоны, которые регулируют метаболизм гликогена, сигнализируя о состояниях высокой и низкой энергии соответственно.
Сотовый уровень
Постановление
Гликоген либо синтезируется, либо расщепляется в зависимости от потребностей организма. Это важная молекула для поддержания гомеостаза глюкозы. Двумя основными пептидными гормонами, участвующими в его регуляции, являются инсулин и глюкагон, которые способствуют анаболизму и катаболизму. Понимание широких эффектов этих двух гормонов важно в контексте метаболизма гликогена.
В частности, последующие эффекты инсулина и глюкагона изменяют активность нескольких ферментов, противоположно участвующих в метаболизме гликогена посредством дефосфорилирования и фосфорилирования соответственно. Инсулин связан с активацией протеинфосфатазы 1 (PP1) и протеинкиназы B (PKB). Глюкагон связан с цАМФ-опосредованным путем, который активирует протеинкиназу А (ПКА). В синтезе гликогена гликогенсинтаза является основным ферментом, регулируемым ферментами PP1, PKB и PKA.
Гликогенсинтаза имеет две основные формы: гликогенсинтаза и гликогенсинтаза b. Это активная и неактивная формы соответственно. [6] Существенное структурное различие между ними состоит в том, что гликогенсинтаза b более фосфорилирована, чем гликогенсинтаза а. В инсулин-опосредованном пути PP1 дефосфорилирует гликогенсинтазу b, превращая ее в гликогенсинтазу а. PKB может поддерживать эту форму гликогенфосфорилазы путем инактивации фермента, известного как гликогенсинтаза-киназа 3 (GSK3)[7], который в противном случае фосфорилировал бы гликогенсинтазу а. В глюкагон-опосредованном пути PKA фосфорилирует PP1, предотвращая активацию PP1 гликогенсинтазы b в гликогенсинтазу a.
[6] Существенное структурное различие между ними состоит в том, что гликогенсинтаза b более фосфорилирована, чем гликогенсинтаза а. В инсулин-опосредованном пути PP1 дефосфорилирует гликогенсинтазу b, превращая ее в гликогенсинтазу а. PKB может поддерживать эту форму гликогенфосфорилазы путем инактивации фермента, известного как гликогенсинтаза-киназа 3 (GSK3)[7], который в противном случае фосфорилировал бы гликогенсинтазу а. В глюкагон-опосредованном пути PKA фосфорилирует PP1, предотвращая активацию PP1 гликогенсинтазы b в гликогенсинтазу a.
Двумя основными формами гликогенфосфорилазы являются гликогенфосфорилазы a и b, которые представляют собой активную и неактивную формы соответственно.[6] PKA активирует киназу гликогенфосфорилазы, которая впоследствии фосфорилирует и активирует гликогенфосфорилазу. Напротив, PP1 дефосфорилирует гликогенфосфорилазу, превращая ее в b-форму. Важно отметить, что печеночная изоформа гликогенфосфорилазы нуждается в глюкозе для связывания с аллостерическим сайтом, чтобы позволить PP1 дефосфорилировать ее. Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
Регуляция метаболизма гликогена характерна для скелетных мышц. Киназа гликогенфосфорилазы мышц повышает свою активность в присутствии кальция в цитоплазме, высвобождаемого из саркоплазматического ретикулума при мышечном сокращении. Он содержит субъединицы кальмодулина, обладающие высоким сродством к кальцию. Кроме того, известно, что соединения с низким энергетическим состоянием, такие как AMP, IMP и Pi, являются положительными аллостерическими регуляторами гликогенфосфорилазы скелетных мышц.
Молекулярный уровень
Гликогенез
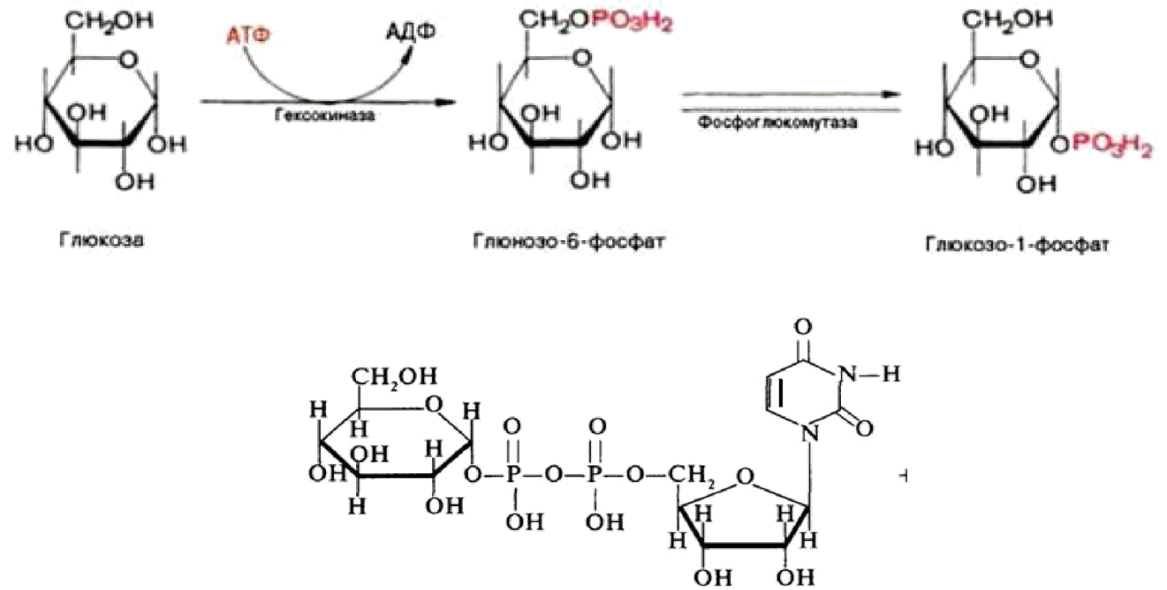
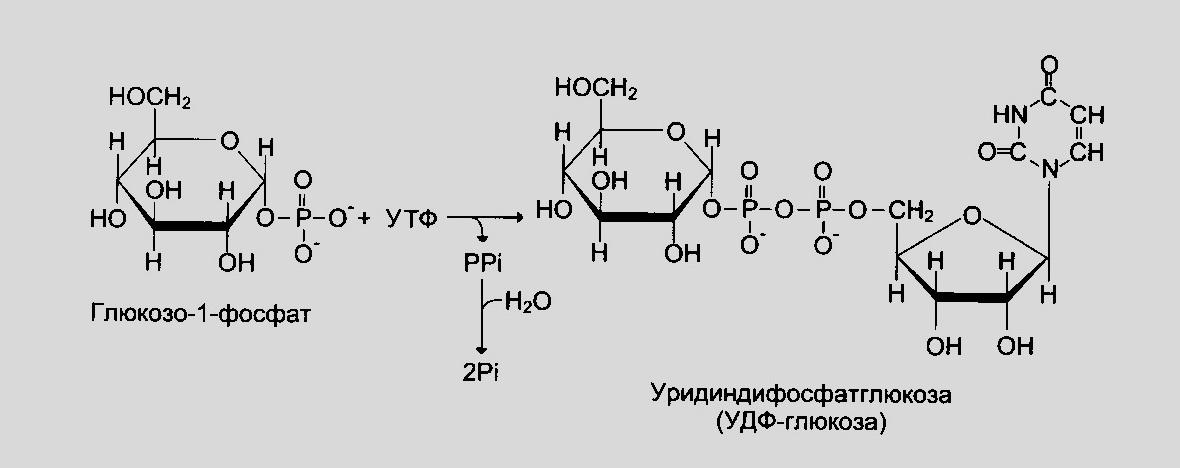
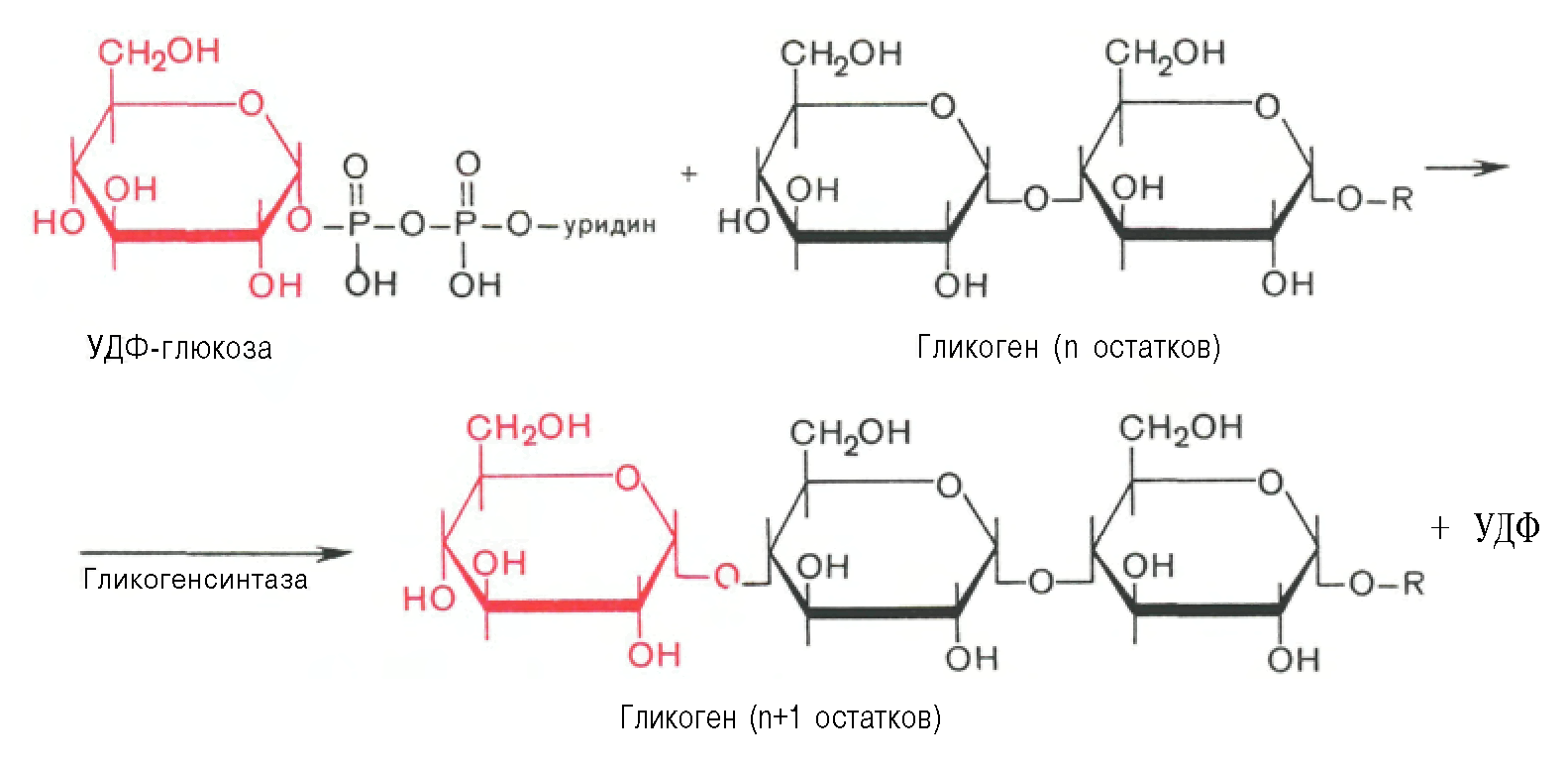
Гликогенез или синтез гликогена представляет собой многоэтапный процесс, который начинается с превращения глюкозы в глюкозо-6-фосфат с помощью гексокиназы или печеночной изоформы гексокиназы, известной как глюкокиназа. Этот процесс является важным этапом, поскольку добавление фосфатной группы улавливает глюкозу внутри клетки. G6P впоследствии превращается в глюкозо-1-фосфат (G1P) с помощью фосфоглюкомутазы.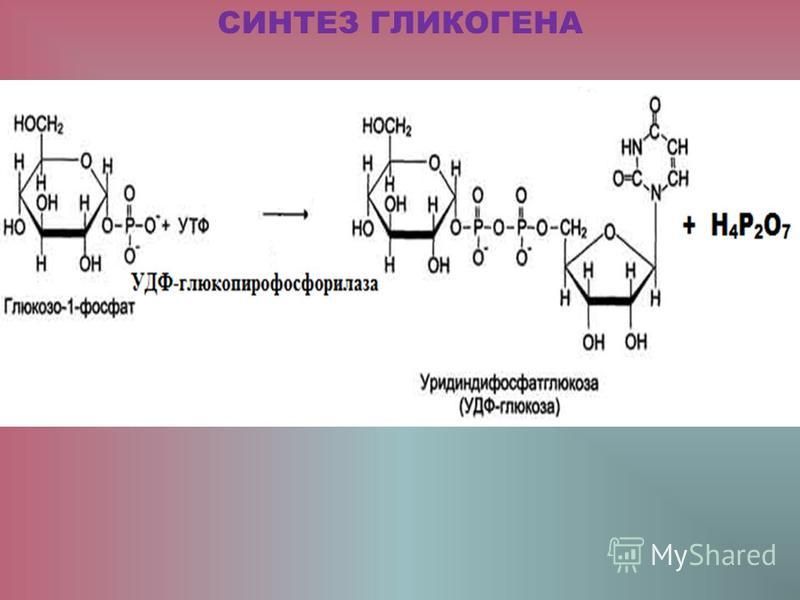 G1P превращается в УДФ-глюкозу с помощью глюкозо-1-фосфатуридилтрансферазы, для которой в качестве дополнительного субстрата требуется УТФ. На этом этапе фосфатная группа глюкозо-1-фосфата осуществляет нуклеофильную атаку на альфа-фосфат UTP, что приводит к высвобождению пирофосфата (PPi), высокореактивной молекулы, которая быстро подвергается гидролизу. Высвобождение PPi помогает ускорить реакцию.[9] Гликогенсинтаза создает альфа-1,4 гликозидную связь между УДФ-глюкозой и растущей цепью гликогена.
G1P превращается в УДФ-глюкозу с помощью глюкозо-1-фосфатуридилтрансферазы, для которой в качестве дополнительного субстрата требуется УТФ. На этом этапе фосфатная группа глюкозо-1-фосфата осуществляет нуклеофильную атаку на альфа-фосфат UTP, что приводит к высвобождению пирофосфата (PPi), высокореактивной молекулы, которая быстро подвергается гидролизу. Высвобождение PPi помогает ускорить реакцию.[9] Гликогенсинтаза создает альфа-1,4 гликозидную связь между УДФ-глюкозой и растущей цепью гликогена.
Однако, прежде чем гликогенсинтаза заработает, ей требуется гликогеновый праймер. Гликогенин синтезирует этот начальный праймер для гликогенсинтазы. Вкратце, гликогенин действует путем присоединения молекулы УДФ-глюкозы в положении 1C к гидроксильной группе остатка тирозина, что вызывает выход УДФ, а длина праймера впоследствии увеличивается до 10–20 остатков глюкозы.[4] Ветвление впоследствии происходит с помощью фермента ветвления гликогена, который имеет две каталитические активности, которые включают трансферазу и альфа-1,6 гликозидазу, которая образует разветвленную связь.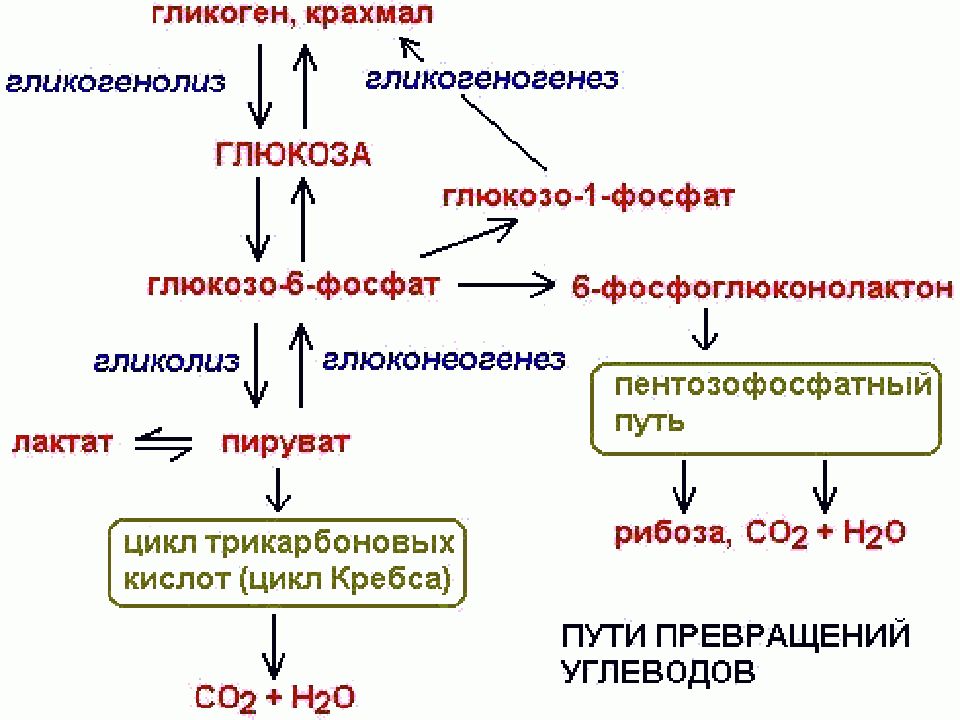 Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
Гликогенолиз
Гликогенолиз или расщепление гликогена в первую очередь требует гликогенфосфорилазы и фермента деветвления. Гликогенфосфорилаза включает поступление фосфата (Pi) и PLP (пиридоксальфосфата), кофактора, полученного из витамина B6.[10] В конечном итоге он удаляет один остаток глюкозы из гликогена в форме глюкозо-1-фосфата. Однако гликогенфосфорилаза не может расщепить альфа-1,4-связи по мере приближения к точке соединения; таким образом, фермент, разветвляющий гликоген, захватывает четыре остатка глюкозы, прежде чем достигнет точки соединения. Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.
Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.
Клиническое значение
Существует множество болезней накопления гликогена (БГБ), вызванных генетическими мутациями ферментов, непосредственно участвующих в анаболизме и катаболизме гликогена. Как правило, они наследуются по аутосомно-рецессивному типу и часто проявляются в раннем детстве. Основные GSD и нарушенные ферменты следующие [3][11]:
Тип 0: гликогенсинтаза мышц (GYS1) или гликогенсинтаза печени (GYS2)
Тип Ia (болезнь фон Гирке): гликоген -6-фосфатаза, особенно G6PC (удаляет фосфатную группу из G6P)
Тип 1b (болезнь фон Гирке): гликоген-6-фосфатаза, особенно G6PT (транспортирует G6P в эндоплазматический ретикулум)
Тип II (болезнь Помпе): кислая альфа-глюкозидаза (ГАА; в лизосомах)
Тип III (болезнь Кори): фермент, разветвляющий гликоген
Тип IV (болезнь Андерсена): фермент, разветвляющий гликоген.
Тип V (болезнь Мак-Ардла): мышечная и сердечная гликогенфосфорилаза
Тип VI (болезнь Герса): гликогенфосфорилаза печени
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Роуч П.Дж., Депаоли-Роуч А.А., Херли Т.Д., Тальябраччи В.С. Гликоген и его метаболизм: некоторые новые разработки и старые темы. Biochem J. 2012 Feb 01;441(3):763-87. [Бесплатная статья PMC: PMC4945249] [PubMed: 22248338]
- 2.
Jensen J, Rustad PI, Kolnes AJ, Lai YC. Роль распада гликогена скелетных мышц в регуляции чувствительности к инсулину при физических нагрузках. Фронт Физиол. 2011;2:112. [Бесплатная статья PMC: PMC3248697] [PubMed: 22232606]
- 3.
Эллингвуд С.С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141. [Бесплатная статья PMC: PMC6050127] [PubMed: 29875163]
- 4.
Адева-Андани М.М., Гонсалес-Лукан М., Донапетри-Гарсия С., Фернандес-Фернандес С., Аменейрос-Родригес Э. Метаболизм гликогена у людей. Клиника ББА. 2016 июнь; 5:85-100.
 [Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]
[Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]- 5.
Петерсен М.С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587. [Бесплатная статья PMC: PMC5777172] [PubMed: 28731034]
- 6.
Сюй К., Морган К.Т., Тодд Герис А., Элстон Т.С., Гомес С.М. Модель всего организма для регуляции гликогена показывает критическую роль круговорота субстрата в поддержании гомеостаза глюкозы в крови. PLoS Comput Biol. 2011 Декабрь;7(12):e1002272. [Бесплатная статья PMC: PMC3233304] [PubMed: 22163177]
- 7.
Кросс Д.А., Алесси Д.Р., Коэн П., Анджелкович М., Хеммингс Б.А. Ингибирование киназы-3 гликогенсинтазы инсулином, опосредованное протеинкиназой B. Природа. 1995 21–28 декабря; 378 (6559)): 785-9. [PubMed: 8524413]
- 8.
Baker DJ, Timmons JA, Greenhaff PL. Ингибирование гликогенфосфорилазы при лечении диабета 2 типа: систематическая оценка метаболических и функциональных эффектов в скелетных мышцах крыс.
 Диабет. 2005 г., август; 54 (8): 2453-9. [PubMed: 16046314]
Диабет. 2005 г., август; 54 (8): 2453-9. [PubMed: 16046314]- 9.
Heikinheimo P, Lehtonen J, Baykov A, Lahti R, Cooperman BS, Goldman A. Структурная основа пирофосфатазного катализа. Состав. 1996 15 декабря; 4 (12): 1491-508. [PubMed: 8994974]
- 10.
Schneider G, Käck H, Lindqvist Y. Многообразие ферментов, зависимых от витамина B6. Состав. 2000 г., 15 января; 8 (1): R1-6. [PubMed: 10673430]
- 11.
Hicks J, Wartchow E, Mierau G. Болезни накопления гликогена: краткий обзор и обновленная информация о клинических особенностях, генетических аномалиях, патологических особенностях и лечении. Ультраструктура Патол. 2011 окт; 35 (5): 183-96. [PubMed: 21910565]
Биохимия, гликоген — StatPearls — NCBI Bookshelf
Салах А. Даглас; Шамим С. Мохиуддин.
Информация об авторе и организацияхПоследнее обновление: 8 мая 2022 г.
Введение
Гликоген представляет собой разветвленный полимер глюкозы, который животные используют в качестве источника энергии. Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких концентрациях в других тканях, таких как почки, сердце и мозг.[1][2] Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения. Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма.
Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких концентрациях в других тканях, таких как почки, сердце и мозг.[1][2] Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения. Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться.[3] Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут иметь серьезные неблагоприятные последствия для организма. [3][4]
[3][4]
Основы
Ключевые фундаментальные положения:
Гликоген влияет на гомеостаз глюкозы.
Гликоген имеет высокую концентрацию в печени, хотя больше всего гликогена по массе содержится в скелетных мышцах. Гликогена в растительных тканях нет.
Скелетные мышцы не могут высвобождать гликоген в кровоток из-за недостатка глюкозо-6-фосфатазы (G6Pase)
Гликоген состоит из двух основных связей: альфа-1,4 и альфа-1 ,6 гликозидные связи — эти связи дают начало линейным цепям и точкам ветвления соответственно.
Разветвление гликогена имеет важное значение, поскольку оно обеспечивает повышенную растворимость в воде и наличие нескольких участков для его расщепления; это позволяет легко и быстро утилизировать гликоген, когда он расщепляется.
Синтез и расщепление гликогена коррелируют с состояниями высокой и низкой энергии соответственно.
Инсулин и глюкагон представляют собой пептидные гормоны, которые регулируют метаболизм гликогена, сигнализируя о состояниях высокой и низкой энергии соответственно.

Сотовый уровень
Постановление
Гликоген либо синтезируется, либо расщепляется в зависимости от потребностей организма. Это важная молекула для поддержания гомеостаза глюкозы. Двумя основными пептидными гормонами, участвующими в его регуляции, являются инсулин и глюкагон, которые способствуют анаболизму и катаболизму. Понимание широких эффектов этих двух гормонов важно в контексте метаболизма гликогена. Инсулин сигнализирует о высокоэнергетическом состоянии; таким образом, его последующие эффекты включают синтез липидов и гликогена. Глюкагон сигнализирует о низком энергетическом состоянии; следовательно, его последующие эффекты обратны действию инсулина. Таким образом, повышенное высвобождение глюкагона приведет к последующему эффекту повышенного липолиза и гликогенолиза для удовлетворения потребностей организма.
В частности, последующие эффекты инсулина и глюкагона изменяют активность нескольких ферментов, противоположно участвующих в метаболизме гликогена посредством дефосфорилирования и фосфорилирования соответственно.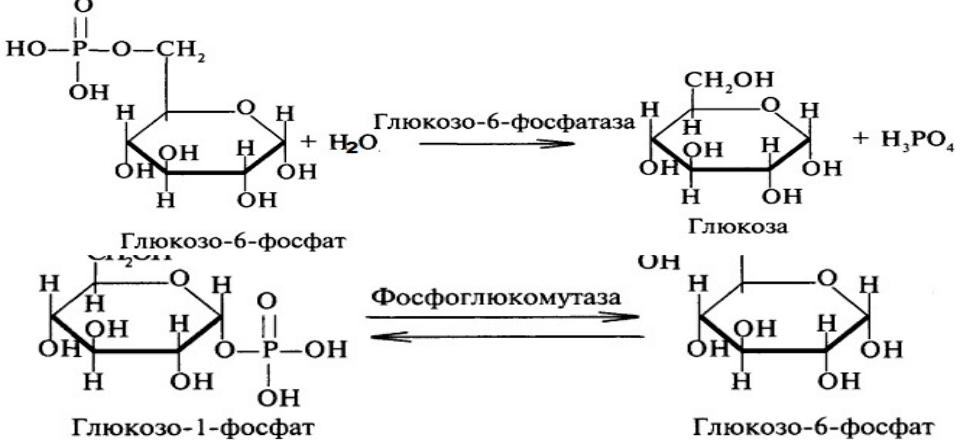 Инсулин связан с активацией протеинфосфатазы 1 (PP1) и протеинкиназы B (PKB). Глюкагон связан с цАМФ-опосредованным путем, который активирует протеинкиназу А (ПКА). В синтезе гликогена гликогенсинтаза является основным ферментом, регулируемым ферментами PP1, PKB и PKA.
Инсулин связан с активацией протеинфосфатазы 1 (PP1) и протеинкиназы B (PKB). Глюкагон связан с цАМФ-опосредованным путем, который активирует протеинкиназу А (ПКА). В синтезе гликогена гликогенсинтаза является основным ферментом, регулируемым ферментами PP1, PKB и PKA.
Гликогенсинтаза имеет две основные формы: гликогенсинтаза и гликогенсинтаза b. Это активная и неактивная формы соответственно.[6] Существенное структурное различие между ними состоит в том, что гликогенсинтаза b более фосфорилирована, чем гликогенсинтаза а. В инсулин-опосредованном пути PP1 дефосфорилирует гликогенсинтазу b, превращая ее в гликогенсинтазу а. PKB может поддерживать эту форму гликогенфосфорилазы путем инактивации фермента, известного как гликогенсинтаза-киназа 3 (GSK3)[7], который в противном случае фосфорилировал бы гликогенсинтазу а. В глюкагон-опосредованном пути PKA фосфорилирует PP1, предотвращая активацию PP1 гликогенсинтазы b в гликогенсинтазу a.
Двумя основными формами гликогенфосфорилазы являются гликогенфосфорилазы a и b, которые представляют собой активную и неактивную формы соответственно. [6] PKA активирует киназу гликогенфосфорилазы, которая впоследствии фосфорилирует и активирует гликогенфосфорилазу. Напротив, PP1 дефосфорилирует гликогенфосфорилазу, превращая ее в b-форму. Важно отметить, что печеночная изоформа гликогенфосфорилазы нуждается в глюкозе для связывания с аллостерическим сайтом, чтобы позволить PP1 дефосфорилировать ее. Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
[6] PKA активирует киназу гликогенфосфорилазы, которая впоследствии фосфорилирует и активирует гликогенфосфорилазу. Напротив, PP1 дефосфорилирует гликогенфосфорилазу, превращая ее в b-форму. Важно отметить, что печеночная изоформа гликогенфосфорилазы нуждается в глюкозе для связывания с аллостерическим сайтом, чтобы позволить PP1 дефосфорилировать ее. Таким образом, гликогенфосфорилазу печени обычно считают «сенсором глюкозы».
Регуляция метаболизма гликогена характерна для скелетных мышц. Киназа гликогенфосфорилазы мышц повышает свою активность в присутствии кальция в цитоплазме, высвобождаемого из саркоплазматического ретикулума при мышечном сокращении. Он содержит субъединицы кальмодулина, обладающие высоким сродством к кальцию. Кроме того, известно, что соединения с низким энергетическим состоянием, такие как AMP, IMP и Pi, являются положительными аллостерическими регуляторами гликогенфосфорилазы скелетных мышц.
Молекулярный уровень
Гликогенез
Гликогенез или синтез гликогена представляет собой многоэтапный процесс, который начинается с превращения глюкозы в глюкозо-6-фосфат с помощью гексокиназы или печеночной изоформы гексокиназы, известной как глюкокиназа. Этот процесс является важным этапом, поскольку добавление фосфатной группы улавливает глюкозу внутри клетки. G6P впоследствии превращается в глюкозо-1-фосфат (G1P) с помощью фосфоглюкомутазы. G1P превращается в УДФ-глюкозу с помощью глюкозо-1-фосфатуридилтрансферазы, для которой в качестве дополнительного субстрата требуется УТФ. На этом этапе фосфатная группа глюкозо-1-фосфата осуществляет нуклеофильную атаку на альфа-фосфат UTP, что приводит к высвобождению пирофосфата (PPi), высокореактивной молекулы, которая быстро подвергается гидролизу. Высвобождение PPi помогает ускорить реакцию.[9] Гликогенсинтаза создает альфа-1,4 гликозидную связь между УДФ-глюкозой и растущей цепью гликогена.
Этот процесс является важным этапом, поскольку добавление фосфатной группы улавливает глюкозу внутри клетки. G6P впоследствии превращается в глюкозо-1-фосфат (G1P) с помощью фосфоглюкомутазы. G1P превращается в УДФ-глюкозу с помощью глюкозо-1-фосфатуридилтрансферазы, для которой в качестве дополнительного субстрата требуется УТФ. На этом этапе фосфатная группа глюкозо-1-фосфата осуществляет нуклеофильную атаку на альфа-фосфат UTP, что приводит к высвобождению пирофосфата (PPi), высокореактивной молекулы, которая быстро подвергается гидролизу. Высвобождение PPi помогает ускорить реакцию.[9] Гликогенсинтаза создает альфа-1,4 гликозидную связь между УДФ-глюкозой и растущей цепью гликогена.
Однако, прежде чем гликогенсинтаза заработает, ей требуется гликогеновый праймер. Гликогенин синтезирует этот начальный праймер для гликогенсинтазы. Вкратце, гликогенин действует путем присоединения молекулы УДФ-глюкозы в положении 1C к гидроксильной группе остатка тирозина, что вызывает выход УДФ, а длина праймера впоследствии увеличивается до 10–20 остатков глюкозы. [4] Ветвление впоследствии происходит с помощью фермента ветвления гликогена, который имеет две каталитические активности, которые включают трансферазу и альфа-1,6 гликозидазу, которая образует разветвленную связь. Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
[4] Ветвление впоследствии происходит с помощью фермента ветвления гликогена, который имеет две каталитические активности, которые включают трансферазу и альфа-1,6 гликозидазу, которая образует разветвленную связь. Как только цепь гликогена составляет примерно 11 остатков глюкозы, фермент, разветвляющий гликоген, начинает добавлять ответвления. В среднем сегмент из восьми остатков глюкозы переносится и размещается как ветвь соседней нити. Это разветвление является важным компонентом, поскольку оно увеличивает растворимость и увеличивает количество участков, в которых глюкоза может быть извлечена из полимера гликогена.[3]
Гликогенолиз
Гликогенолиз или расщепление гликогена в первую очередь требует гликогенфосфорилазы и фермента деветвления. Гликогенфосфорилаза включает поступление фосфата (Pi) и PLP (пиридоксальфосфата), кофактора, полученного из витамина B6.[10] В конечном итоге он удаляет один остаток глюкозы из гликогена в форме глюкозо-1-фосфата. Однако гликогенфосфорилаза не может расщепить альфа-1,4-связи по мере приближения к точке соединения; таким образом, фермент, разветвляющий гликоген, захватывает четыре остатка глюкозы, прежде чем достигнет точки соединения. Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.
Подобно ферменту ветвления, он обладает двумя каталитическими свойствами. В данном случае это трансфераза и альфа-1,6-глюкозидаза, осуществляющие перенос трех дистальных молекул глюкозы на проксимальную более длинную цепь и гидролиз альфа-1,6-гликозидной связи соответственно. Гидролиз альфа-1,6-гликозидной связи дает единицу глюкозы вместо глюкозо-1-фосфата (G1P). Отношение G1P к глюкозе, образующейся в результате гликогенолиза, составляет 10 : 1. После экстракции G1P из гликогена он может превращаться в глюкозо-6-фосфат (G6P) с помощью фосфоглюкомутазы для использования в других процессах, таких как гликолиз или пентозофосфатный путь (PPP). альтернативно называемый путем гексозомонофосфата (путь HMP) [4]. Кроме того, он может превращаться в глюкозу. Для этого он должен расщепляться с помощью глюкозо-6-фосфатазы, которая находится на мембране эндоплазматического ретикулума. Важно подчеркнуть, что скелетные мышцы не экспрессируют глюкозо-6-фосфатазу (G6Pase).[2][3] Таким образом, скелетные мышцы не могут расщеплять свой гликоген для использования другими тканями.
Клиническое значение
Существует множество болезней накопления гликогена (БГБ), вызванных генетическими мутациями ферментов, непосредственно участвующих в анаболизме и катаболизме гликогена. Как правило, они наследуются по аутосомно-рецессивному типу и часто проявляются в раннем детстве. Основные GSD и нарушенные ферменты следующие [3][11]:
Тип 0: гликогенсинтаза мышц (GYS1) или гликогенсинтаза печени (GYS2)
Тип Ia (болезнь фон Гирке): гликоген -6-фосфатаза, особенно G6PC (удаляет фосфатную группу из G6P)
Тип 1b (болезнь фон Гирке): гликоген-6-фосфатаза, особенно G6PT (транспортирует G6P в эндоплазматический ретикулум)
Тип II (болезнь Помпе): кислая альфа-глюкозидаза (ГАА; в лизосомах)
Тип III (болезнь Кори): фермент, разветвляющий гликоген
Тип IV (болезнь Андерсена): фермент, разветвляющий гликоген.
Тип V (болезнь Мак-Ардла): мышечная и сердечная гликогенфосфорилаза
Тип VI (болезнь Герса): гликогенфосфорилаза печени
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Роуч П.Дж., Депаоли-Роуч А.А., Херли Т.Д., Тальябраччи В.С. Гликоген и его метаболизм: некоторые новые разработки и старые темы. Biochem J. 2012 Feb 01;441(3):763-87. [Бесплатная статья PMC: PMC4945249] [PubMed: 22248338]
- 2.
Jensen J, Rustad PI, Kolnes AJ, Lai YC. Роль распада гликогена скелетных мышц в регуляции чувствительности к инсулину при физических нагрузках. Фронт Физиол. 2011;2:112. [Бесплатная статья PMC: PMC3248697] [PubMed: 22232606]
- 3.
Эллингвуд С.С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141. [Бесплатная статья PMC: PMC6050127] [PubMed: 29875163]
- 4.
Адева-Андани М.М., Гонсалес-Лукан М., Донапетри-Гарсия С., Фернандес-Фернандес С., Аменейрос-Родригес Э. Метаболизм гликогена у людей. Клиника ББА. 2016 июнь; 5:85-100.
 [Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]
[Бесплатная статья PMC: PMC4802397] [PubMed: 27051594]- 5.
Петерсен М.С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587. [Бесплатная статья PMC: PMC5777172] [PubMed: 28731034]
- 6.
Сюй К., Морган К.Т., Тодд Герис А., Элстон Т.С., Гомес С.М. Модель всего организма для регуляции гликогена показывает критическую роль круговорота субстрата в поддержании гомеостаза глюкозы в крови. PLoS Comput Biol. 2011 Декабрь;7(12):e1002272. [Бесплатная статья PMC: PMC3233304] [PubMed: 22163177]
- 7.
Кросс Д.А., Алесси Д.Р., Коэн П., Анджелкович М., Хеммингс Б.А. Ингибирование киназы-3 гликогенсинтазы инсулином, опосредованное протеинкиназой B. Природа. 1995 21–28 декабря; 378 (6559)): 785-9. [PubMed: 8524413]
- 8.
Baker DJ, Timmons JA, Greenhaff PL. Ингибирование гликогенфосфорилазы при лечении диабета 2 типа: систематическая оценка метаболических и функциональных эффектов в скелетных мышцах крыс.


