Французские ученые разработали препарат, способствующий лечению повышенной усталости
15 декабря 2017, 10:45,
обновлено 29 ноября 2017, 13:26
Партнерский материал
Динамичный темп жизни в больших городах делает человека уязвимым для многих заболеваний. Среди распространенных симптомов — слабость, повышенная усталость, раздражительность, плохое настроение, утрата способности к длительному умственному и физическому напряжению. Многие это связывают с наступлением осени или зимы, когда уменьшается количество солнечных дней, однако подобные ощущения бывают после перенесенной болезни или отпуска.
Что такое повышенная усталость и как ее лечить?
Повышенная усталость развивается не только у офисных сотрудников, но и у других специалистов, которые испытывают постоянное напряжение на работе. В этот момент происходит истощение энергетических ресурсов организма, как следствие, появляется усталость и снижается работоспособность. Прийти в форму и «развеяться» помогают занятия спортом, но не у всех бывает на это время и желание.
Читайте также
Только встал и уже устал: как отличить обычную лень от серьезной болезни
В конце 1970-х годов французская компания «БИОКОДЕКС» занялась решением этой проблемы и начала исследования нового препарата Стимол®, в основу которого вошли два естественных метаболита человеческого организма — цитруллин и малат (яблочная кислота). Их действие направлено на подавление симптомов повышенной усталости на клеточном уровне.
«Цитруллин и малат — это естественные метаболиты организма, которые известны давно. Они участвуют в клеточных химических реакциях, в том числе в цикле Кребса по образованию аденозинтрифосфорной кислоты (АТФ) — нашего главного энергетического субстрата. Яблочная кислота и аминокислота цитруллин увеличивают синтез АТФ», — поясняет профессор кафедры нервных болезней Первого Московского государственного медицинского университета им. И.М. Сеченова Владимир Захаров.
Большая часть цитруллина содержится в корке арбуза, а малат присутствует в незрелых яблоках, винограде, рябине, барбарисе, малине. Но, чтобы получить необходимое количество кислоты, нужно съесть очень много фруктов и ягод, а корки от арбузов вообще мало кто использует в пищу. «Гораздо проще и эффективнее, когда эти вещества поступают в организм в виде стандартизованного лекарственного препарата», — считает профессор Захаров.
Но, чтобы получить необходимое количество кислоты, нужно съесть очень много фруктов и ягод, а корки от арбузов вообще мало кто использует в пищу. «Гораздо проще и эффективнее, когда эти вещества поступают в организм в виде стандартизованного лекарственного препарата», — считает профессор Захаров.
По словам эксперта, Стимол® оказывает эффект при повышенной усталости и переутомлении. «Повышенная усталость — это симптом, который может быть при самых разнообразных заболеваниях, начиная с банального гриппа и заканчивая психоэмоциональными расстройствами. И то и другое в конечном счете приводит к уменьшению синтеза АТФ в организме. Цитруллина малат действует на конечный механизм формирования симптома, поэтому может использоваться при любой астении», — отметил Захаров.
Кстати, профессор ни в коем случае не рекомендует принимать энергетические напитки при повышенной усталости, приводя аналогию с «подстегиванием загнанной лошади». Энергетики стимулируют работу головного мозга, в клетках при этом ускоряется метаболизм, что ведет к еще большему сокращению энергетического запаса.
Детям с пяти лет и взрослым
Читайте также
Продажа антидепрессантов проходит с осенним обострением
Как показали исследования, в основе практически всех клинических проявлений повышенной усталости находятся метаболические расстройства — повышение уровня аммиака и молочной кислоты блокирует образование и использование АТФ. Цитруллин является промежуточным продуктом образования мочевины и способствует ускорению выведения аммиака из организма. Малат, в свою очередь, помогает избавиться от аммиака и молочной кислоты.
Безрецептурный препарат Стимол® достаточно широко используется в клинической практике, отмечают специалисты. Его можно применять у детей с пяти лет и у взрослых при повышенной усталости, переутомлении, в процессе выздоровления после инфекционных заболеваний.
Кроме приема препарата, специалисты также рекомендуют для уменьшения проявлений повышенной усталости правильно организовывать работу и отдых, совершать прогулки на свежем воздухе, регулярно и полноценно питаться, соблюдать режим сна и не забывать выполнять физические упражнения.
_____________________________
STM201711-СX-03
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Статья опубликована при поддержке ООО «БИОКОДЕКС». Мнение автора может не совпадать с точкой зрения ООО «БИОКОДЕКС».
Maxler L-Citrulline Malate 200g за 950 рублей — «NutritionBar»
L-Citrulline Malate 200g
· · Повышает выносливость и эффективность тренировок
· Снижает утомляемость
· Предупреждает катаболизм
· Улучшает регенерацию
Цитруллин ― заменимая аминокислота,
которая содержится в некоторых белковых продуктах. Основное преимущество
цитруллина состоит в том, что он увеличивает производительность тренировки
путём увеличения расхода энергии в клетках, что даёт рост мощности и
интенсивности выполнения физических упражнений. Кроме того, Л-Цитруллин
ускоряет восстановление после тренировок, снижая болевые ощущения в мышцах.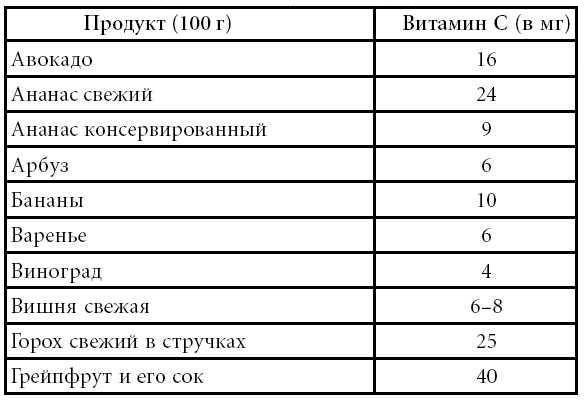 Добавление в цитруллин яблочной кислоты – малата– стимулирует прилив крови и
кислорода к мышцам, что дополнительно повышает выносливость спортсмена и его
эффективность. В зависимости от Вашей цели, L-Citrulline Malate
Добавление в цитруллин яблочной кислоты – малата– стимулирует прилив крови и
кислорода к мышцам, что дополнительно повышает выносливость спортсмена и его
эффективность. В зависимости от Вашей цели, L-Citrulline Malate
Рекомендации по применению: принимать одну порцию (5г) в день.
|
Состав Размер Порции: 1 Мерная Ложка (5 г) Порций в Упаковке: 40 |
||
|
Состав |
На 100 г |
На Порцию |
|
Энергетическая Ценность |
377 кДж (87 ккал) |
18,9 кДж (4,4 ккал) |
|
Жиры |
< 0,1 г |
< 0,1 г |
|
— Насыщенные Жирные Кислоты |
< 0,1 г |
< 0,1 г |
|
Углеводы |
< 0,1 г |
< 0,1 г |
|
— Сахар |
< 0,1 г |
< 0,1 г |
|
Белки |
< 0,1 г |
< 0,1 г |
|
Соль |
< 0,1 г |
< 0,1 г |
|
L-Цитруллин DL-Малат 2:1 |
100 г |
5 г |
Ингредиент: L-Цитруллин DL-Малат (100%).
Ваше имя:
Ваш отзыв:Примечание: HTML разметка не поддерживается! Используйте обычный текст.
Оценка: Плохо Хорошо
L-цитруллин | Энциклопедия MDPI
L-цитруллин (ЦИТ) представляет собой органическое соединение и незаменимую аминокислоту [1] , и организм может синтезировать его эндогенно. CIT представляет собой небелковую аминокислоту, которая является еще одной основной метаболической характеристикой; это не одна из 20 первичных аминокислот, кодируемых ДНК и, следовательно, не участвующих в синтезе белка [2] . Диета является плохим источником ЦИТ, а эндогенный синтез является его основным источником в организме [3] . Фактически, арбуз является основным источником этой аминокислоты в рационе; Название CIT происходит от Citrullus lanatus (Thunb.), научного названия арбуза. Концентрация CIT в арбузе зависит от сорта и обычно колеблется в пределах 0,7–3,6 г/кг сырого веса [4] . CIT присутствует как в мякоти, так и в кожуре [5] ; при развитии арбуза происходит прогрессирующее накопление ЦИТ в этих тканях [6] , в частности, в условиях стресса. Кроме того, побочные продукты производства арбузов, такие как кожура свежесрезанных арбузов, могут использоваться для экстракции CIT [7] , повышая устойчивость отрасли производства свежесрезанных арбузов и продвигая модель экономики замкнутого цикла. Мировые площади сбора и производства арбузов в 2019 году составили 3 млн га и 100 млн тонн соответственно. [8] . Этот фрукт больше всего ценится потребителями из-за его способности освежать их.
Диета является плохим источником ЦИТ, а эндогенный синтез является его основным источником в организме [3] . Фактически, арбуз является основным источником этой аминокислоты в рационе; Название CIT происходит от Citrullus lanatus (Thunb.), научного названия арбуза. Концентрация CIT в арбузе зависит от сорта и обычно колеблется в пределах 0,7–3,6 г/кг сырого веса [4] . CIT присутствует как в мякоти, так и в кожуре [5] ; при развитии арбуза происходит прогрессирующее накопление ЦИТ в этих тканях [6] , в частности, в условиях стресса. Кроме того, побочные продукты производства арбузов, такие как кожура свежесрезанных арбузов, могут использоваться для экстракции CIT [7] , повышая устойчивость отрасли производства свежесрезанных арбузов и продвигая модель экономики замкнутого цикла. Мировые площади сбора и производства арбузов в 2019 году составили 3 млн га и 100 млн тонн соответственно. [8] . Этот фрукт больше всего ценится потребителями из-за его способности освежать их. Организация Объединенных Наций объявила 2021 год Международным годом фруктов и овощей. Цель состоит в том, чтобы повысить осведомленность о питательной и медицинской пользе потребления большего количества фруктов и овощей в рамках разнообразного, сбалансированного и здорового питания и образа жизни, а также привлечь внимание политики к сокращению потерь и отходов этих скоропортящихся продуктов. . Хорошо известно, что цвет фруктов и овощей часто связан с содержащимися в них питательными веществами и фитохимическими веществами.
Организация Объединенных Наций объявила 2021 год Международным годом фруктов и овощей. Цель состоит в том, чтобы повысить осведомленность о питательной и медицинской пользе потребления большего количества фруктов и овощей в рамках разнообразного, сбалансированного и здорового питания и образа жизни, а также привлечь внимание политики к сокращению потерь и отходов этих скоропортящихся продуктов. . Хорошо известно, что цвет фруктов и овощей часто связан с содержащимися в них питательными веществами и фитохимическими веществами.
2. Биохимия L-цитруллина
2.1. Эндогенный синтез L-цитруллина
Образование CIT de novo происходит в энтероцитах [3] , как описано в . Следовательно, концентрация CIT в настоящее время считается маркером функции кишечника [9] . Субстратами для синтеза CIT в кишечнике являются аминокислоты, полученные из пищи, такие как глютамин, пролин и L-аргинин (Arg) [10] . В энтероцитах часть пищевого и портального глютамина катаболизируется до CIT различными ферментами (глутаминазой, пирролин-5-карбоксилатсинтазой, орнитинаминотрансферазой (ОАТ), орнитинтранскарбамилазой (OTC) (также называемой орнитинкарбамоилтрансферазой) и карбамоилфосфатсинтетазой). -я [11] [12] .
-я [11] [12] .
Рисунок 1. Образование цитруллина de novo в эпителиальных всасывающих клетках тонкой кишки (энтероцитах). Пунктирные линии указывают на поток аминокислот при пероральном приеме через энтероциты (верхушечный транспорт), а пунктирные линии указывают на поток аминокислот из портальной крови через энтероциты (базолатеральный транспорт).
Глутаминаза превращает глутамин в глутамат, и поэтому глутамат, поступающий с пищей и портальной кровью, катаболизируется в энтероцитах до ЦИТ по общему пути биосинтеза глутамина. Однако ключевыми регулирующими ферментами являются пирролин-5-карбоксилатсинтаза и ОАТ, которые являются уникальными для энтероцитов тонкого кишечника [10] . CIT составляет 27,6% метаболизированного глютамина [3] . Глютамин обычно считается основным предшественником кишечного CIT [10] . Однако Марини и соавт. [13] продемонстрировали, что диетический Arg был основным предшественником для синтеза CIT и что вклад пролина был низким (3,4%), а глутамина был незначительным (0,4%).
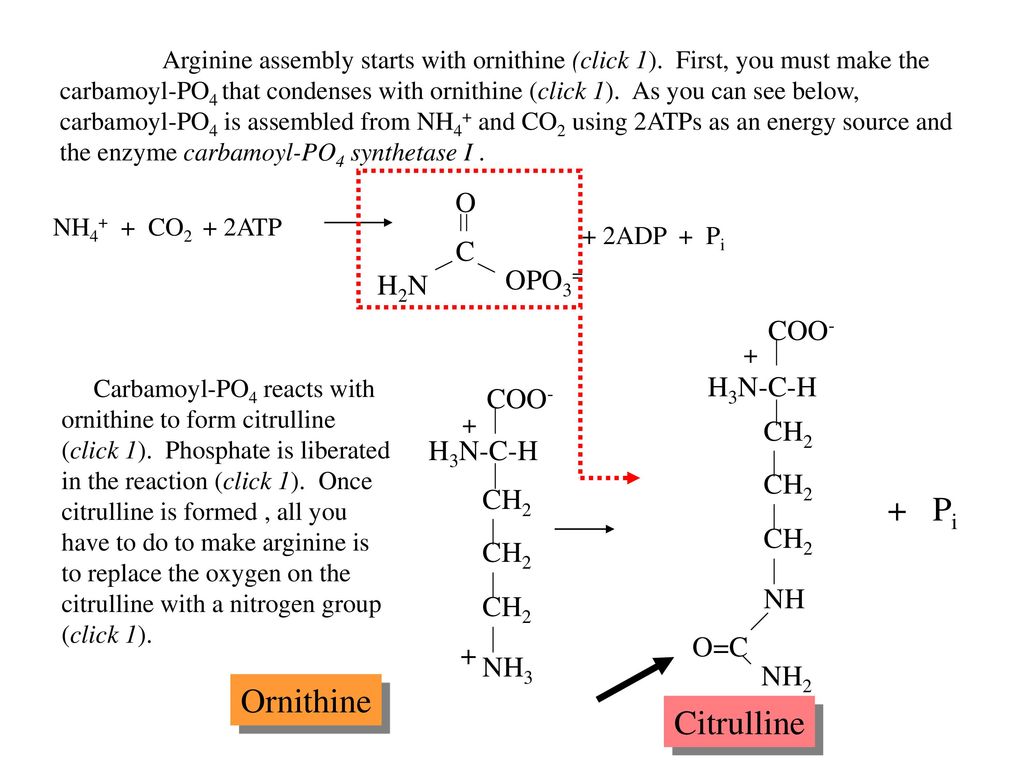
2.2. Метаболизм L-цитруллина
Метаболизм ЦИТ, в зависимости от тканевого распределения участвующих в нем ферментов, протекает по трем метаболическим путям (): биосинтез Арг, цикл Арг-ЦИТ-оксид азота и цикл мочевины [16] . Существует три ключевых фермента, два из которых участвуют в синтезе CIT, синтаза оксида азота (NOS) и OTC, и один участвует в катаболизме CIT у млекопитающих, аргининосукцинатсинтаза (ASS), которая превращает CIT в аргининосукцинат, который используется в обоих метаболических путях [17] .
Рисунок 2. Метаболизм цитруллина. NO: оксид азота; NOS: синтаза оксида азота; ADMA: асимметричный диметиларгинин; ASS: аргининосукцинатсинтаза; ASL: аргининосукцинатлиаза.
2.2.1. Аргинин
Биосинтез аргинина
У млекопитающих Arg классифицируется как полузаменимая или условно незаменимая аминокислота в зависимости от состояния здоровья человека и стадии развития [18] . Arg является производным от эндогенного синтеза Arg de novo, расщепления белка в организме или поступления с пищей (). Arg, синтезируемый из CIT, представляет собой 60% синтеза Arg организмом de novo, хотя только 5–15% Arg 9 циркулирует.0003 [19] . Энтероциты высвобождают CIT в портальную циркуляцию и транспортируют его в почки, где около 83% CIT катаболизируется до Arg в клетках проксимальных канальцев [20] . ASS превращает CIT в аргиносукцинат в присутствии аспартата и АТФ, а аргиносукцинат превращается в фумарат и Arg с помощью аргиносукцинатлиазы (ASL). Arg синтезируется в кишечно-почечной оси, в котором участвуют эпителиальные клетки тонкой кишки, а также клетки проксимальных канальцев почек
Arg является производным от эндогенного синтеза Arg de novo, расщепления белка в организме или поступления с пищей (). Arg, синтезируемый из CIT, представляет собой 60% синтеза Arg организмом de novo, хотя только 5–15% Arg 9 циркулирует.0003 [19] . Энтероциты высвобождают CIT в портальную циркуляцию и транспортируют его в почки, где около 83% CIT катаболизируется до Arg в клетках проксимальных канальцев [20] . ASS превращает CIT в аргиносукцинат в присутствии аспартата и АТФ, а аргиносукцинат превращается в фумарат и Arg с помощью аргиносукцинатлиазы (ASL). Arg синтезируется в кишечно-почечной оси, в котором участвуют эпителиальные клетки тонкой кишки, а также клетки проксимальных канальцев почек  Arg подвергается интенсивному катаболизму в печени, но CIT не метаболизируется в печени, кажется, что прием добавок CIT позволяет вводить Arg, избегая его поглощения печенью [3] .
Arg подвергается интенсивному катаболизму в печени, но CIT не метаболизируется в печени, кажется, что прием добавок CIT позволяет вводить Arg, избегая его поглощения печенью [3] .
Катаболизм аргинина
Метаболизм Arg сильно разделен. Аргиназа представляет собой двухъядерный марганцевый металлофермент, который катализирует гидролиз Arg до L-орнитина и мочевины (4). Две разные генетические изоформы аргиназы различаются по распределению в тканях, субклеточной локализации и иммунологической реактивности. Аргиназа I представляет собой цитозольный фермент, преобладающая экспрессия которого происходит в печени в рамках цикла мочевины, в котором его функция заключается в удалении азота, образующегося в результате метаболизма аминокислот. Однако в гораздо меньшей степени аргиназа I была обнаружена во внепеченочных тканях, таких как эндотелиальные клетки, а также клетки гладкой мускулатуры сосудов [22] . С другой стороны, аргиназа II представляет собой митохондриальный фермент, широко распространенный во внепеченочных клетках и тканях (таких как почки, тонкий кишечник, головной мозг, эритроциты и иммунные клетки) [23] . Аргиназа II слизистой оболочки кишечника обладает высокой активностью, фактически на внутренностную область приходится 40% экстрагируемого с пищей Arg, что объясняет низкие концентрации Arg в плазме. Следовательно, конститутивные уровни активности аргиназы в эндотелиальных клетках ограничивают биодоступность Arg в качестве субстрата для синтеза эндотелиального оксида азота (NO) посредством NOS и зависимой от оксида азота вазодилататорной функции
Аргиназа II слизистой оболочки кишечника обладает высокой активностью, фактически на внутренностную область приходится 40% экстрагируемого с пищей Arg, что объясняет низкие концентрации Arg в плазме. Следовательно, конститутивные уровни активности аргиназы в эндотелиальных клетках ограничивают биодоступность Arg в качестве субстрата для синтеза эндотелиального оксида азота (NO) посредством NOS и зависимой от оксида азота вазодилататорной функции
2.2.2. Биосинтез оксида азота
Оксид азота (NO) может синтезироваться эндогенно двумя способами: восстановлением неорганического нитрата или под действием фермента NOS из Arg с образованием CIT в качестве побочного продукта () [25] . Чтобы эта реакция имела место, должен присутствовать кислород, а также восстановленный никотинамидадениндинуклеотидфосфат (НАДФН) в качестве косубстратов, и требуется сотрудничество кофакторов флавинадениндинуклеотида (ФАД), флавинмононуклеотида (ФМН), тетрагидробиоптерина и гема.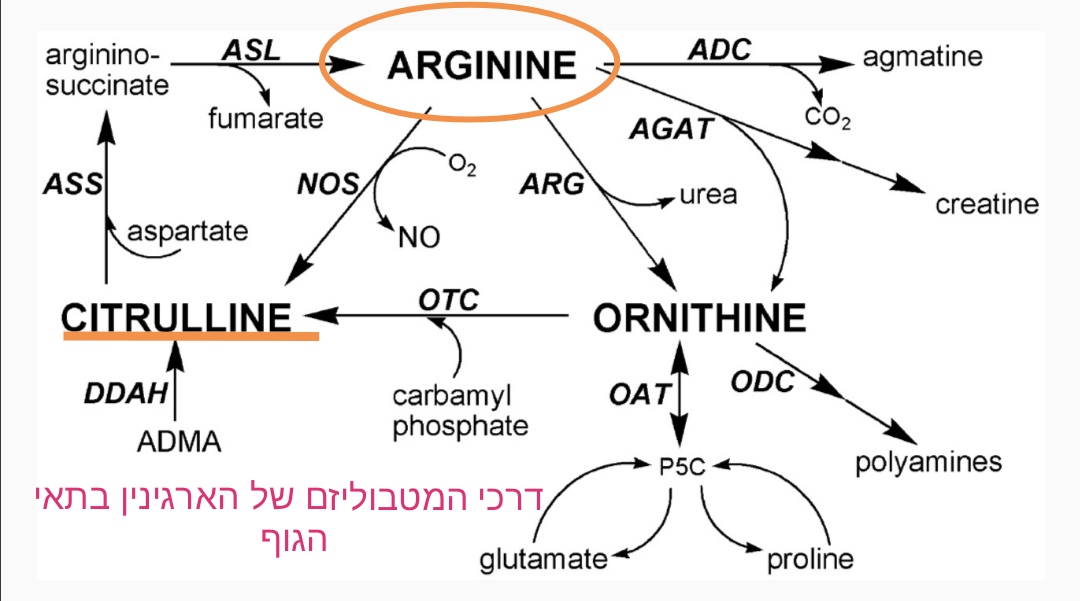 Действие ASS может перерабатывать CIT, полученный в качестве побочного продукта, в Arg, тем самым увеличивая Arg, доступный для производства NO [26] . Существуют три изоформы NOS, расположенные в разных клетках организма: нейрональная NOS (NOS1), которая присутствует в нейрональных клетках, индуцируемая NOS (NOS2) в макрофагах и эндотелиальная NOS (NOS3) в эндотелиальных клетках [1] . NOS2 является индуцируемым, Са 2+ независимым и экспрессируется макрофагами и другими тканями во время воспаления или при стимуляции бактериальными эндотоксинами или воспалительными цитокинами. NOS1 и NOS3 являются конститутивными ферментами, регулируемыми концентрацией внутриклеточного кальция и содержанием Ca 2+ /кальмодулиновый комплекс. Таким образом, NOS1 участвует в синаптической пластичности в центральной нервной системе (ЦНС), центральной регуляции артериального давления, расслаблении гладкой мускулатуры и вазодилатации через периферические нитрергические нервы, которые участвуют в расслаблении пещеристых тел и эрекции полового члена [27].
Действие ASS может перерабатывать CIT, полученный в качестве побочного продукта, в Arg, тем самым увеличивая Arg, доступный для производства NO [26] . Существуют три изоформы NOS, расположенные в разных клетках организма: нейрональная NOS (NOS1), которая присутствует в нейрональных клетках, индуцируемая NOS (NOS2) в макрофагах и эндотелиальная NOS (NOS3) в эндотелиальных клетках [1] . NOS2 является индуцируемым, Са 2+ независимым и экспрессируется макрофагами и другими тканями во время воспаления или при стимуляции бактериальными эндотоксинами или воспалительными цитокинами. NOS1 и NOS3 являются конститутивными ферментами, регулируемыми концентрацией внутриклеточного кальция и содержанием Ca 2+ /кальмодулиновый комплекс. Таким образом, NOS1 участвует в синаптической пластичности в центральной нервной системе (ЦНС), центральной регуляции артериального давления, расслаблении гладкой мускулатуры и вазодилатации через периферические нитрергические нервы, которые участвуют в расслаблении пещеристых тел и эрекции полового члена [27]. . NO, образующийся из NOS1, действует как нейротрансмиттер, а NO, образуемый NOS3, действует как сосудорасширяющее средство. NOS3 поддерживает расширение кровеносных сосудов, контроль артериального давления, а также ряд других вазопротекторных и антиатеросклеротических эффектов. Многочисленные сердечно-сосудистые факторы риска вызывают окислительный стресс, разобщение NOS3 и дисфункцию эндотелия в сосудистой сети. NO регулирует тонус сосудов и кровоток, активируя растворимую гуанилатциклазу (рГЦ) в гладких мышцах сосудов. NO расслабляет гладкие мышцы сосудов, связываясь с гемовой частью цитозольной гуанилатциклазы, активируя гуанилатциклазу и повышая внутриклеточные уровни циклического гуанозин-3′,5′-монофосфата, вызывая вазодилатацию [28] .
. NO, образующийся из NOS1, действует как нейротрансмиттер, а NO, образуемый NOS3, действует как сосудорасширяющее средство. NOS3 поддерживает расширение кровеносных сосудов, контроль артериального давления, а также ряд других вазопротекторных и антиатеросклеротических эффектов. Многочисленные сердечно-сосудистые факторы риска вызывают окислительный стресс, разобщение NOS3 и дисфункцию эндотелия в сосудистой сети. NO регулирует тонус сосудов и кровоток, активируя растворимую гуанилатциклазу (рГЦ) в гладких мышцах сосудов. NO расслабляет гладкие мышцы сосудов, связываясь с гемовой частью цитозольной гуанилатциклазы, активируя гуанилатциклазу и повышая внутриклеточные уровни циклического гуанозин-3′,5′-монофосфата, вызывая вазодилатацию [28] .
Также ингибирует агрегацию тромбоцитов и предотвращает адгезию лейкоцитов по всему эндотелиальному клеточному слою сосудов, ингибирует пролиферацию гладкомышечных клеток сосудов за счет ингибирования цитохромоксидазы, регулирует потребление митохондриального кислорода [29] [30 ] . Аномальная продукция и транспорт NO в сосудах вызывают эндотелиальную дисфункцию с некоторыми сердечно-сосудистыми патологиями, такими как гипертония, атеросклероз и нарушения, связанные с ангиогенезом [18] . Синтез NO зависит от доступности Arg, на которую могут влиять: внутриклеточный синтез Arg из CIT (который, в свою очередь, зависит от доступности CIT), транспорт внеклеточного Arg (катионная аминокислота) и активность аргиназы (которая конкурирует с NOS за Arg) . Кроме того, асимметричный диметиларгинин (АДМА) является эндогенным ингибитором всех трех изоформ NOS и считается фактором риска всех причин смертности от сердечно-сосудистых заболеваний [31] .
Аномальная продукция и транспорт NO в сосудах вызывают эндотелиальную дисфункцию с некоторыми сердечно-сосудистыми патологиями, такими как гипертония, атеросклероз и нарушения, связанные с ангиогенезом [18] . Синтез NO зависит от доступности Arg, на которую могут влиять: внутриклеточный синтез Arg из CIT (который, в свою очередь, зависит от доступности CIT), транспорт внеклеточного Arg (катионная аминокислота) и активность аргиназы (которая конкурирует с NOS за Arg) . Кроме того, асимметричный диметиларгинин (АДМА) является эндогенным ингибитором всех трех изоформ NOS и считается фактором риска всех причин смертности от сердечно-сосудистых заболеваний [31] .
2.2.3. Цикл мочевины
Цикл мочевины (), происходящий в печени, детоксифицирует аммиак из азота из энтеральных источников (пищевой белок) и мышц, таким образом метаболизируя его в мочевину [3] . Метаболизм CIT в печени состоит из сильно разделенного метаболизма, который не связан с другими метаболическими путями, включающими CIT [17] . Более того, гепатоциты, участвующие в цикле мочевины, не могут поглощать CIT из портального кровообращения (1). Два фермента, которые контролируют первые реакции цикла мочевины, карбамоилфосфатсинтетаза (CPS) и OTC, присутствуют не только в печени, но и в тонком кишечнике. OTC объединяет карбамоилфосфат и L-орнитин для производства CIT [32] . Дефицит безрецептурных препаратов может вызвать гипоцитруллинемию, гипераммониемию и повышение концентрации глютамина, аланина и лизина в плазме и даже привести к коме или смерти [11] . Однако этот пул ЦИТ особенно лабилен: цитоплазматическая АСС превращает весь синтезированный ЦИТ в аргининосукцинат, и ЦИТ не высвобождается в общий кровоток [1] [3] . Затем аргининосукцинат превращается в Arg и фумарат с помощью ASL. Цикл завершается, когда фермент аргиназа превращает Arg в L-орнитин, высвобождая таким образом мочевину. Орнитин в основном рециркулируется, в то время как мочевина синтезируется, в конечном счете, в результате синтеза de novo в тонком кишечнике, хотя источники пищи могут обеспечивать незначительные количества.
Более того, гепатоциты, участвующие в цикле мочевины, не могут поглощать CIT из портального кровообращения (1). Два фермента, которые контролируют первые реакции цикла мочевины, карбамоилфосфатсинтетаза (CPS) и OTC, присутствуют не только в печени, но и в тонком кишечнике. OTC объединяет карбамоилфосфат и L-орнитин для производства CIT [32] . Дефицит безрецептурных препаратов может вызвать гипоцитруллинемию, гипераммониемию и повышение концентрации глютамина, аланина и лизина в плазме и даже привести к коме или смерти [11] . Однако этот пул ЦИТ особенно лабилен: цитоплазматическая АСС превращает весь синтезированный ЦИТ в аргининосукцинат, и ЦИТ не высвобождается в общий кровоток [1] [3] . Затем аргининосукцинат превращается в Arg и фумарат с помощью ASL. Цикл завершается, когда фермент аргиназа превращает Arg в L-орнитин, высвобождая таким образом мочевину. Орнитин в основном рециркулируется, в то время как мочевина синтезируется, в конечном счете, в результате синтеза de novo в тонком кишечнике, хотя источники пищи могут обеспечивать незначительные количества. Наконец, мочевина поступает в почки для выведения, таким образом завершая цикл мочевины в результате взаимодействия печени и почек.
Наконец, мочевина поступает в почки для выведения, таким образом завершая цикл мочевины в результате взаимодействия печени и почек.
3. L-цитруллин в мышцах
Добавка CIT у пожилых истощенных крыс увеличивает содержание мышечного белка за счет стимуляции синтеза белка, но не синтеза белка в печени. Это объясняет, почему синтез белка в организме не меняется. С другой стороны, ни на белковую массу, ни на синтез белка добавление CIT в внутренностной области не влияет, таким образом подтверждая, что эта область обходится [17] . Кроме того, аминокислоты с разветвленной цепью (BCAA; лейцин (LEU), валин, изолейцин), особенно LEU, способны стимулировать синтез белка и снижать катаболизм белка [33] . Ле Пленье и др. [34] , показали, что у взрослых голодающих крыс как LEU, так и CIT (несмотря на разную химическую структуру и метаболизм) могут стимулировать синтез мышечного белка (MPS), но что LEU стимулирует MPS в постпрандиальном состоянии, а CIT в постпрандиальном состоянии. постабсорбционное состояние. Кроме того, Форе и соавт. [35] продемонстрировали путем моделирования белково-энергетической недостаточности у старых крыс в постабсорбционном состоянии, что диета, обогащенная CIT, увеличение мышечной массы и мышечной функции были связаны с улучшением как двигательной активности, так и максимальной тетанической изометрической силы.
постабсорбционное состояние. Кроме того, Форе и соавт. [35] продемонстрировали путем моделирования белково-энергетической недостаточности у старых крыс в постабсорбционном состоянии, что диета, обогащенная CIT, увеличение мышечной массы и мышечной функции были связаны с улучшением как двигательной активности, так и максимальной тетанической изометрической силы.
У человека Jourdan et al. [36] были первыми, кто продемонстрировал синтез мышечного белка, стимулированный CIT. В этом исследовании увеличение синтеза мышечного белка на 25% наблюдалось у здоровых добровольцев после трех дней относительно низкобелковой диеты с CIT по сравнению с изоазотной смесью заменимых аминокислот. Этот повышенный синтез мышечного белка, по-видимому, специфически влияет на CIT в мышцах и не является следствием повышенного потребления азота, поскольку CIT не влияет на синтез белка в организме [37] . Это может быть связано со специфическим эффектом CIT на синтез и экспрессию миофибриллярных белков в мышцах, которые представляют собой белковую фракцию, участвующую в сократительной способности мышц [38] .
4. Фармакокинетика и фармакодинамика L-цитруллина
Характеристики фармакокинетических параметров CIT напоминают характеристики родственных аминокислот, Arg и орнитина, но не Cmax (пиковая концентрация), которая у CIT в несколько раз выше, чем у Arg или орнитина [39] . Следовательно, в отличие от Arg, кишечник или печень не метаболизируют CIT; он не является субстратом для ферментов аргиназы, потому что CIT обходит внутренностную экстракцию [17] , а также ингибирует его активность [40] . Это может объяснить, почему уровни Arg в плазме быстро и значительно повышаются при совместном введении, что дает основание предположить, что Arg может проходить через желудочно-кишечный тракт и печень, не подвергаясь влиянию эффектов первого прохождения через кишечник и печень, что, вероятно, связано с CIT ингибирует активность аргиназы [29] . Пероральное введение CIT можно использовать для повышения системной доступности CIT и Arg; он биодоступен, и его потери с мочой очень малы [41] .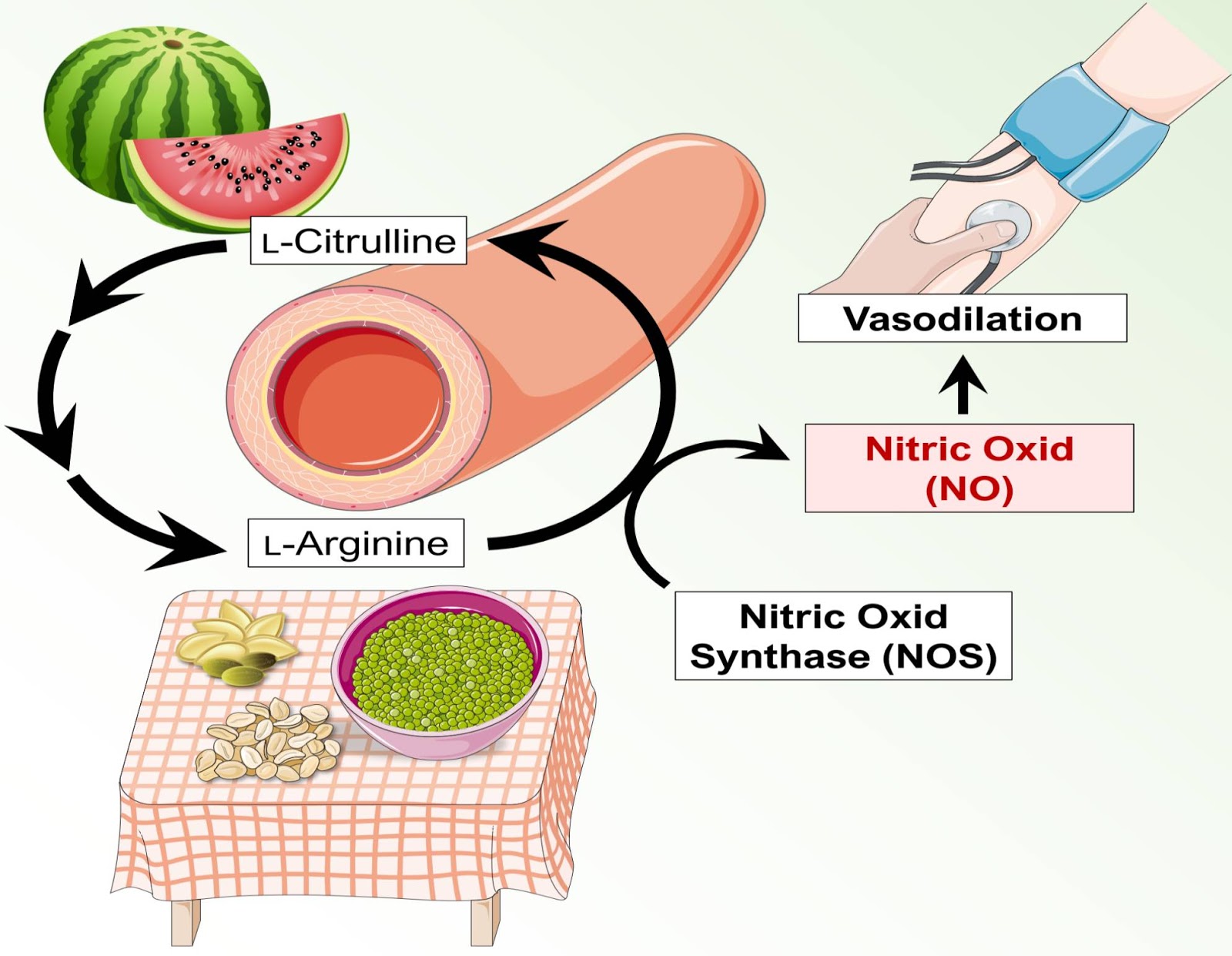 В объединенной выборке женщин и мужчин среднего возраста Schwedhelm et al. [42] обнаружили, что пероральный прием CIT в дозе 1,5 г два раза в день в течение одной недели увеличивает концентрацию CIT и Arg в плазме дозозависимым образом и повышает уровень Arg в плазме с большей эффективностью, чем прием Arg в здоровые субъекты. Мойнар и др. [43] обнаружили подобное поведение у здоровых пожилых людей, когда однократное введение вызывало заметное увеличение доступности Arg при введении CIT (10 г) по сравнению с самим введением Arg (9,94 г). Ранее в исследовании, проведенном на здоровых мужчинах с использованием случайных пероральных доз (2, 5, 10 или 15 г CIT), Moinard et al. [39] , обнаружили, что концентрация CIT в плазме быстро и сильно увеличивалась (в 10 раз при нагрузке 2 г до 100 раз при нагрузке 15 г) и возвращалась к исходным значениям в течение 5–8 часов после нагрузки. Эти авторы продемонстрировали, что CIT хорошо переносится (отсутствие побочных эффектов) и не вызывает желудочно-кишечных расстройств при приеме высоких доз (т.
В объединенной выборке женщин и мужчин среднего возраста Schwedhelm et al. [42] обнаружили, что пероральный прием CIT в дозе 1,5 г два раза в день в течение одной недели увеличивает концентрацию CIT и Arg в плазме дозозависимым образом и повышает уровень Arg в плазме с большей эффективностью, чем прием Arg в здоровые субъекты. Мойнар и др. [43] обнаружили подобное поведение у здоровых пожилых людей, когда однократное введение вызывало заметное увеличение доступности Arg при введении CIT (10 г) по сравнению с самим введением Arg (9,94 г). Ранее в исследовании, проведенном на здоровых мужчинах с использованием случайных пероральных доз (2, 5, 10 или 15 г CIT), Moinard et al. [39] , обнаружили, что концентрация CIT в плазме быстро и сильно увеличивалась (в 10 раз при нагрузке 2 г до 100 раз при нагрузке 15 г) и возвращалась к исходным значениям в течение 5–8 часов после нагрузки. Эти авторы продемонстрировали, что CIT хорошо переносится (отсутствие побочных эффектов) и не вызывает желудочно-кишечных расстройств при приеме высоких доз (т. е. 15 г), что позволяет предположить, что кишечная абсорбция CIT не является ограничивающим этапом. Однако продукция Arg была ниже, чем ожидалось, при введении 15 г CIT. Это можно объяснить снижением почечной конверсии ЦИТ в Арг и/или возможным насыщением его транспортеров определенной дозой ЦИТ. Несколько авторов предположили, что поглощение CIT использует другую транспортную систему, чем Arg, который в основном транспортируется через Na+-независимые транспортеры катионных аминокислот (CAT-1, 2 и 3) [44] . CIT транспортируется через энтероциты в портальную вену, вероятно, с использованием Na+-зависимой нейтральной аминокислоты, в том числе транспортеров ASC или B 0,+ -аминокислот, расположенных в этих клетках [12] [44] [45] [46] .
е. 15 г), что позволяет предположить, что кишечная абсорбция CIT не является ограничивающим этапом. Однако продукция Arg была ниже, чем ожидалось, при введении 15 г CIT. Это можно объяснить снижением почечной конверсии ЦИТ в Арг и/или возможным насыщением его транспортеров определенной дозой ЦИТ. Несколько авторов предположили, что поглощение CIT использует другую транспортную систему, чем Arg, который в основном транспортируется через Na+-независимые транспортеры катионных аминокислот (CAT-1, 2 и 3) [44] . CIT транспортируется через энтероциты в портальную вену, вероятно, с использованием Na+-зависимой нейтральной аминокислоты, в том числе транспортеров ASC или B 0,+ -аминокислот, расположенных в этих клетках [12] [44] [45] [46] .
Согласно фармакодинамическим параметрам CIT, эта аминокислота хорошо переносится и при кратковременном применении не наблюдалось никаких побочных эффектов, таких как желудочно-кишечные расстройства, даже при применении высоких доз (например, 15 г). Это положительная черта ЦИТ, так как в предыдущих исследованиях введение родственных аминокислот (>9г/день Arg в течение 1 недели или >10 г/день орнитина в разовой дозе) вызывали тошноту, рвоту или диарею [47] . Объяснение этому может заключаться в быстром насыщении всасывания орнитина и аргинина в кишечнике, при высоких нагрузках вызывающем осмотическую диарею [39] . В отличие от аргинина и орнитина, кишечная абсорбция CIT не является ограничивающим фактором биодоступности CIT, поскольку CIT хорошо переносится и признан безопасным для приема внутрь [17] [48] . Самые высокие зарегистрированные дозы CIT составляют 0,18 г/кг/день (примерно 12,6 г/день для человека весом 70 кг) в течение 7 дней [49] и разовая доза 15 г [39] .
Это положительная черта ЦИТ, так как в предыдущих исследованиях введение родственных аминокислот (>9г/день Arg в течение 1 недели или >10 г/день орнитина в разовой дозе) вызывали тошноту, рвоту или диарею [47] . Объяснение этому может заключаться в быстром насыщении всасывания орнитина и аргинина в кишечнике, при высоких нагрузках вызывающем осмотическую диарею [39] . В отличие от аргинина и орнитина, кишечная абсорбция CIT не является ограничивающим фактором биодоступности CIT, поскольку CIT хорошо переносится и признан безопасным для приема внутрь [17] [48] . Самые высокие зарегистрированные дозы CIT составляют 0,18 г/кг/день (примерно 12,6 г/день для человека весом 70 кг) в течение 7 дней [49] и разовая доза 15 г [39] .
Продукты, содержащие цитруллин
Продукты, содержащие цитруллин
Время до Повышение спортивных результатов и сердечно-сосудистой системы естественным путем.
Вы можете сделать это, поняв роль цитруллина в организме.
Цитруллин – это аминокислота, участвующая в цикле мочевины, которая помогает организму выводить избыток азота. Некоторые исследования показали, что добавки цитруллина могут помочь улучшить спортивные результаты, особенно упражнения на выносливость.
Одно исследование показало, что добавки с цитруллином улучшают насыщение мышц кислородом и снижают усталость у спортсменов во время высокоинтенсивных упражнений. Другое исследование показало, что добавки с цитруллином улучшают физическую работоспособность у людей с сердечной недостаточностью.
Цитруллин — это аминокислота, которая содержится в некоторых продуктах питания. Некоторые примеры продуктов, содержащих цитруллин, включают:
Продукты с высоким содержанием цитруллина
Арбуз: Арбуз является хорошим источником цитруллина.
Дыня: Дыня — еще один вид дыни с высоким содержанием цитруллина.

Огурцы: Огурцы являются хорошим источником цитруллина, а также других питательных веществ, таких как витамин К и кремний.
Папайя: Папайя — тропический фрукт с высоким содержанием цитруллина.
Тыквы: Некоторые виды тыкв, такие как люффа и бутылочная тыква, содержат большое количество цитруллина.
Тыква: Некоторые виды тыквы, такие как кабачки и кабачки, являются хорошими источниками цитруллина.
Тыквы: Тыква — еще один вид тыквы с высоким содержанием цитруллина.
Баклажаны: Баклажаны — еще один овощ, который является хорошим источником цитруллина.
Шпинат: Шпинат — листовой зеленый овощ с высоким содержанием цитруллина, а также других питательных веществ, таких как железо и кальций.
Бамия: Бамия — это овощ с высоким содержанием цитруллина, а также других питательных веществ, таких как клетчатка и витамин С.

Это лишь несколько примеров продуктов, содержащих цитруллин. Есть много других продуктов, которые также содержат цитруллин, например, чеснок, лук и некоторые виды орехов и семян.
Комбинация цитруллина и нитратов для максимального спортивного преимущества
Было показано, что нитраты и цитруллин увеличивают выработку оксида азота в организме. Оксид азота — это молекула, которая вырабатывается организмом и играет ряд важных функций в организме, в том числе регулирует кровоток и кровяное давление.
Нитраты — это соединения, содержащиеся в некоторых пищевых продуктах, особенно в овощах. Когда нитраты потребляются, они превращаются в оксид азота в организме. Также было показано, что нитраты увеличивают выработку оксида азота в организме.
Увеличение выработки оксида азота может иметь ряд потенциальных преимуществ для спортивных результатов, в том числе:
Улучшение кровотока: Оксид азота помогает расслабить и расширить кровеносные сосуды, что может улучшить приток крови к мышцам и другим тканям.
 Это может помочь улучшить доставку кислорода к мышцам и более эффективно удалять отходы, такие как молочная кислота.
Это может помочь улучшить доставку кислорода к мышцам и более эффективно удалять отходы, такие как молочная кислота.Улучшение мышечной функции: Было показано, что оксид азота улучшает мышечную функцию за счет повышения активности митохондрий, «электростанций» клеток, вырабатывающих энергию.
Уменьшение усталости: Оксид азота может помочь уменьшить усталость, ингибируя выработку определенных ферментов, которые могут привести к мышечной усталости.
Увеличение силы и мощности: Некоторые исследования показывают, что увеличение выработки оксида азота может улучшить силу и мощность у спортсменов.
Высокоэффективная формула Nature
Здесь, в Royal Fruits, мы упростили комбинирование нитратов и цитруллина.
Мы сделали это для вас.
Наш натуральный предтренировочный порошок High Frequency представляет собой комбинацию нитратов в форме сушеной свеклы, цитруллина и витамина С в форме сливы какаду.

