Триптофан, структурная формула, свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
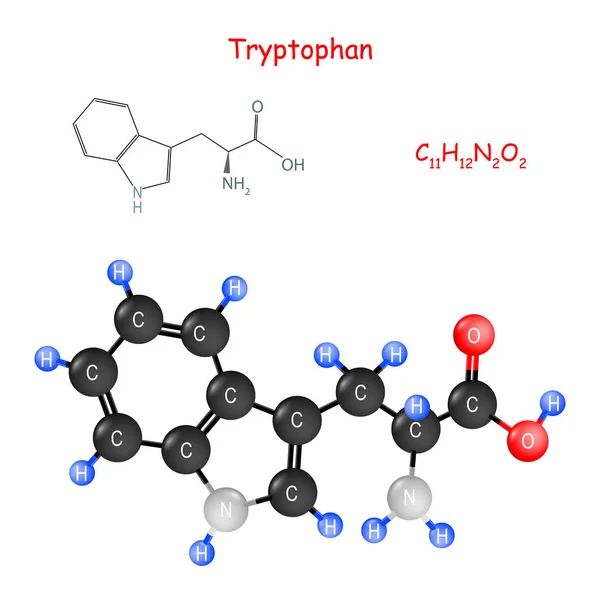
Триптофан. Большая российская энциклопедия
Химические соединения
- Области знаний:
- Органические соединения, Органическая химия
- Другие наименования:
- β-(β-индолил)-α-аминопропионовая кислота, 2-амино-3-(3-индолил)пропановая кислота, Trp, W, Три
- Брутто-формула:
- C₁₁H₁₂N₂O₂
- Молярная масса:
- 204,22 г/моль
- Агрегатное состояние:
- Твёрдое
Триптофа́н [β-(β-индолил)-α-аминопропионовая кислота, 2-амино-3-(3-индолил)пропановая кислота, общепринятые сокращения: Trp, W, Три], неполярная ароматическая α-аминокислота, имеющая в боковой цепи ядро индола. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-триптофана и D-триптофана. В природе преобладает L-форма триптофана. Молярная масса 204,22 г/моль. Температура плавления 283–285 °C (D,L-триптофан), 281–282 °C (D-триптофан), 293–295 °C с разложением (L-триптофан). Триптофан впервые был выделен из казеина (1901, Ф. Хопкинс и С. Коул).
Триптофан впервые был выделен из казеина (1901, Ф. Хопкинс и С. Коул).
L-триптофан – протеиногенная аминокислота, кодируется триплетом UGG. Входит в состав белков (частота встречаемости 1,27), биологически активных пептидов. Промежуточные продукты катаболизма L-триптофана служат предшественниками других важных биологически активных соединений. L-триптофан активно вовлечён в работу нервной системы, иммунитета, пищеварительной системы. L-триптофан – незаменимая для человека аминокислота и должен в достаточном количестве поступать с пищей, рекомендованная ВОЗ норма потребления L-триптофана для человека составляет 4 мг на 1 кг веса.
Физико-химические свойства
Триптофан – бесцветное кристаллическое вещество, растворимое в воде [1,14 г/100 мл (25 °C), 2,79 г/100 мл (75 °C), 4,99 г/100 г (100 °C)], малорастворимое в этаноле, нерастворимое в диэтиловом эфире.
Как и другие аминокислоты, в кристаллах и полярных растворителях триптофан существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,89. Константы диссоциации кислоты (рКа) составляют 2,38 для карбоксильной группы (α-COOH), 9,39 для аминогруппы (α-NH3+).
Его изоэлектрическая точка равна 5,89. Константы диссоциации кислоты (рКа) составляют 2,38 для карбоксильной группы (α-COOH), 9,39 для аминогруппы (α-NH3+).
Триптофан взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное дезаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи. В качественных реакциях триптофан даёт окрашенные продукты: с n-Диметиламинобензальдегидом в концентрированной хлористо-водородной кислоте (реакция Эрлиха) – синий, в кислой среде с глиоксиловой кислотой (альдегидами) (реакция Адамкевича) – красно-фиолетовый.
За счёт ароматического индольного ядра триптофан может принимать участие в гидрофобных и стэкинг-взаимодействиях.
Способность триптофана поглощать ультрафиолетовый свет приводит к характеристической адсорбции белков при длине волны 280 нм, что широко используется в исследовательских целях.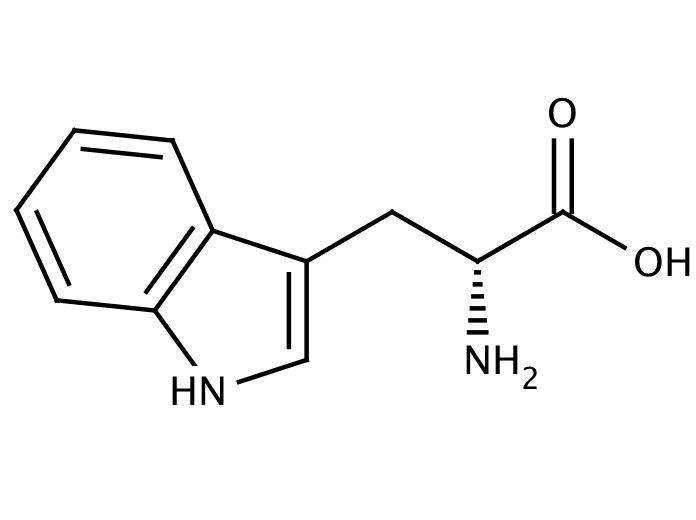
Способы получения
Химический синтез триптофана проводят аминометилированием индола по методу Манниха. Полученный 3-(диметиламинометил)-индол конденсируют с эфиром нитроуксусной кислоты, что даёт метиловый эфир 3-индолилнитропропионовой кислоты. Далее восстанавливают нитрогруппу до аминной и после щелочного гидролиза получают триптофан или его натриевую соль.
Химико-ферментативный способ получения L-триптофана состоит в прямой конденсации индола, пировиноградной кислоты и аммиака. Реакция катализируется пиридоксаль-зависимой триптофаназой (КФ 4.1.99.1).
Промышленное производство организовано преимущественно по двухступенчатой схеме – химический синтез антраниловой кислоты с последующим энзиматическим превращением ее в триптофан.
Участие в обмене веществ
Бактерии и растения способны синтезировать L-триптофан из хоризмата. Конечными продуктами деградации L-триптофана являются ацилированное производное кофермента А и пируват.
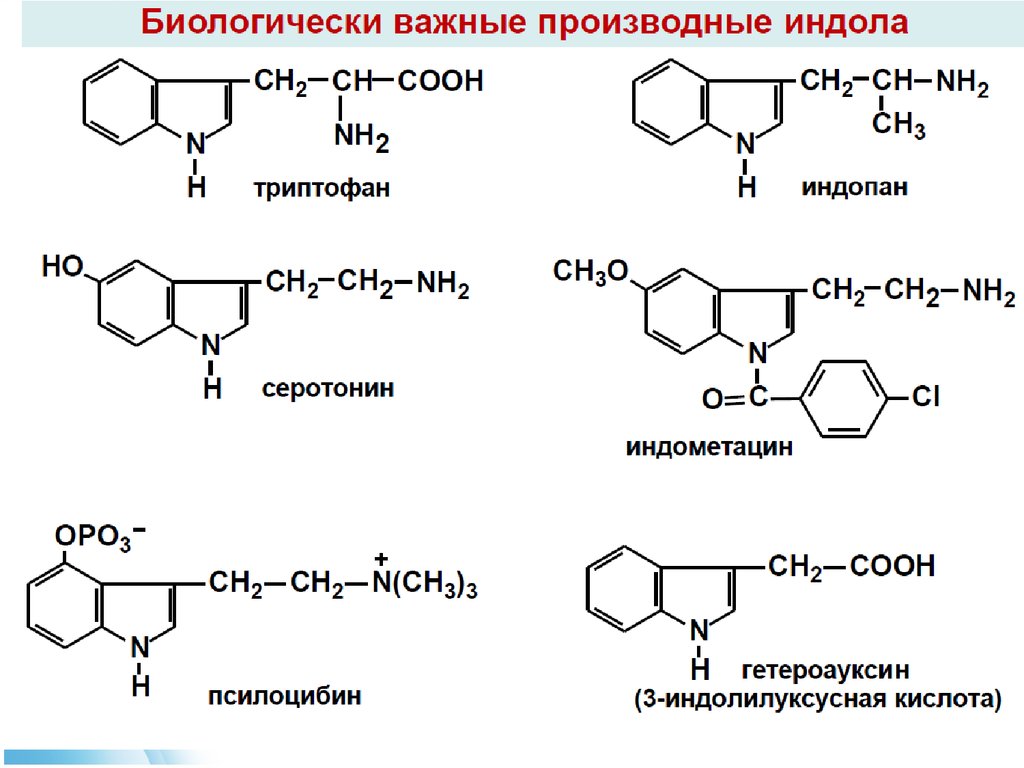
Некоторые промежуточные продукты катаболизма L-триптофана служат предшественниками других важных биологически активных соединений, например нейромедиатора серотонина, гормона мелатонина, витамина никотиновая кислота у человека, гетероауксинов, индиго и ряда алкалоидов у растений.
L-триптофан содержится во многих природных белках (до 5 % в кональбумине, химотрипсиногене).
L-триптофан активно вовлечён в работу нервной системы, иммунитета, пищеварительной системы. Нарушения обмена L-триптофана и его метаболитов ассоциированы с неврологическими и психическими расстройствами, могут служить показателями онкологических заболеваний, хронической иммунной активации.
D-триптофан был обнаружен в биологически активных пептидах (грамицидины, тироцидин С и др.), нейропептидах и токсинах моллюсков.
Применение
L-триптофан применяется в медицине в составе средств парентерального питания, средств лечения почечной недостаточности, кардиоплегических средств.
Содержание в продуктах питания
№ п/п |
| Наименование продукта | мг L-триптофана /100 г продукта |
1 | Рыба и рыбные продукты | Икра кетовая/осетровая | 379/317 |
Тунец | 292 | ||
Горбуша | 215 | ||
2 | Мясо | Свинина | 274 |
Говядина | 273 | ||
Телятина | 260 | ||
Баранина | 237 | ||
3 | Птица и яйца | Индейка | 354 |
Куры | 315 | ||
Яйца куриные | 204 | ||
4 | Молоко и молокопродукты | Сыры твёрдые | 660–1000 |
Творог нежирный | 180 | ||
Молоко | 50 | ||
5 | Зерновые и бобовые | Соя | 450 |
Горох | 260 | ||
Чечевица | 220 | ||
Пшеница | 150 | ||
Гречиха | 137 | ||
6 | Семена масличных культур | Соевые | 654 |
Подсолнечные | 337 | ||
Горчичные | 335 | ||
7 | Овощи | Картофель | 28 |
Баклажаны | 12 | ||
Капуста белокочанная | 10 | ||
8 | Фрукты и ягоды | Земляника (садовая) | 9 |
Груши | 5 | ||
Яблоки | 3 |
Дата публикации: 2 июня 2022 г.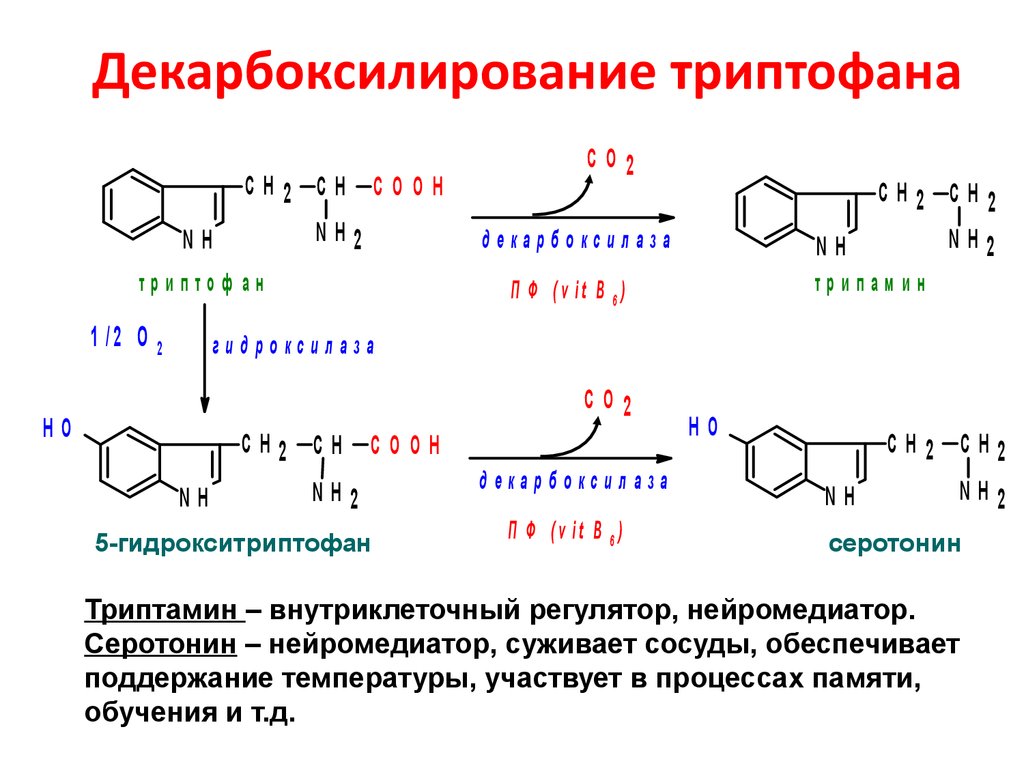 в 16:29 (GMT+3)
в 16:29 (GMT+3)
Триптофан — Энциклопедия Нового Света
Триптофан представляет собой α-аминокислоту, которая содержится в большинстве белков и имеет индольную функциональную группу в качестве отличительной структурной характеристики. Это предшественник нейротрансмиттера серотонина и витамина ниацина (также известного как никотиновая кислота или витамин B 3 ).
У человека L-изомер триптофана, который является единственной формой, участвующей в синтезе белка, является одной из 20 стандартных аминокислот, распространенных в животных белках и необходимых для нормального функционирования человека. Триптофан также классифицируется как «незаменимая аминокислота», поскольку он не может быть синтезирован человеческим организмом из других соединений посредством химических реакций и поэтому должен поступать с пищей. Триптофан, тирозин и фенилаланин являются самыми большими из стандартных аминокислот.
В целом, незаменимые аминокислоты требуют, чтобы люди проявляли личную ответственность и самодисциплину в своем рационе и взаимодействовали с множеством других растений и животных для удовлетворения своих пищевых потребностей.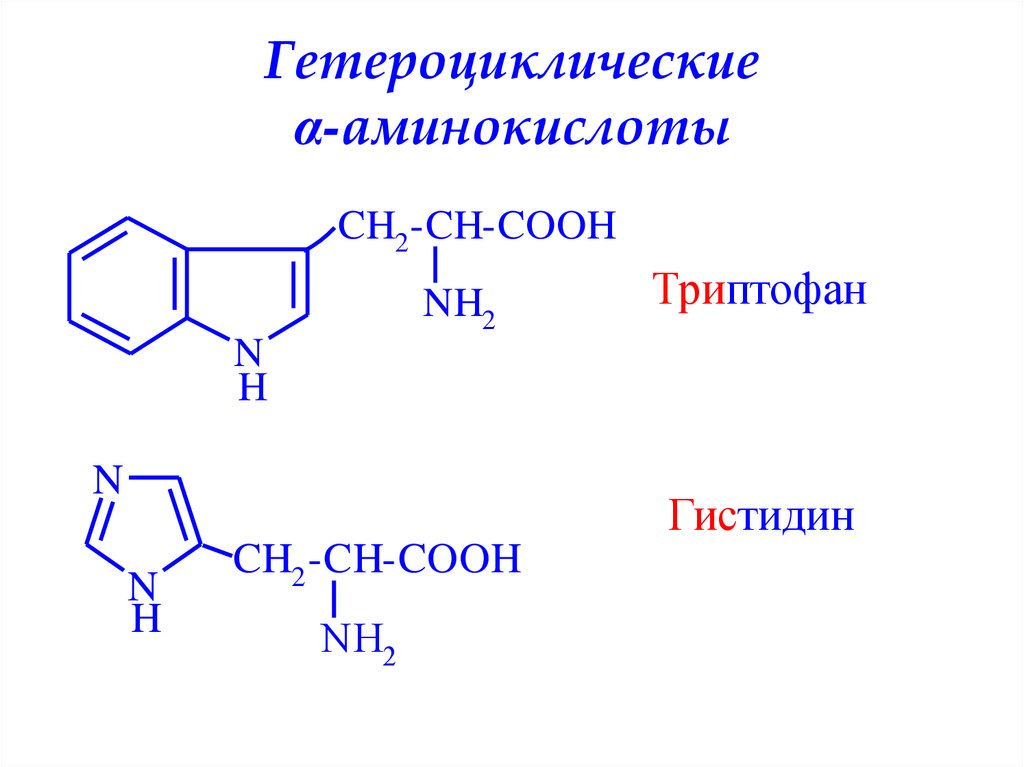
Пищевые добавки L-триптогана были изъяты из продажи в Соединенных Штатах в какой-то момент из-за того, что некоторые из них были связаны с синдромом эозинофилии-миалгии (EMS) при инвалидности. Это заболевание в значительной степени было связано с загрязнением, отнесенным к одному производителю, который, чтобы сэкономить производственные затраты, допустил некоторые вольности в производственном процессе.
Содержание
- 1 Структура
- 1.1 Флуоресценция
- 2 Диетические источники
- 3 Функция
- 3.1 Использование в качестве пищевой добавки
- 3.2 Медицинское применение
- 4 Мясо индейки и сонливость
- 5 Каталожные номера
- 6 Внешние ссылки
- 7 кредитов
Трехбуквенный код триптофана — Trp, его однобуквенный код — W, его кодон — UGG, а его систематическое название — 2-амино-3-(1H-индол-3-ил)-пропановая кислота (IUPAC-IUB 1983). Триптофан — одна из двух стандартных аминокислот, кодируемых одним кодоном, второй — метионин.
Структура
В биохимии термин «аминокислота» часто используется для обозначения альфа-аминокислот : тех аминокислот, в которых амино- и карбоксилатные группы присоединены к одному и тому же углероду, так называемому α-углероду ( альфа-углерод). Общая структура этих альфа-аминокислот:
Р
|
Н 2 N-C-COOH
|
ЧАС
, где R представляет собой боковую цепь , специфичную для каждой аминокислоты.
Большинство аминокислот встречаются в виде двух возможных оптических изомеров, называемых D и L. Аминокислоты L представляют подавляющее большинство аминокислот, содержащихся в белках. Их называют протеиногенными аминокислотами. Как следует из названия «протеиногенные» (буквально, строящие белок), эти аминокислоты кодируются стандартным генетическим кодом и участвуют в процессе синтеза белка. У триптофана только L-стереоизомер участвует в синтезе белков млекопитающих. Однако D-стереоизомер иногда обнаруживается в природных материалах, таких как пептид морского яда контрифан (Pallaghy et al.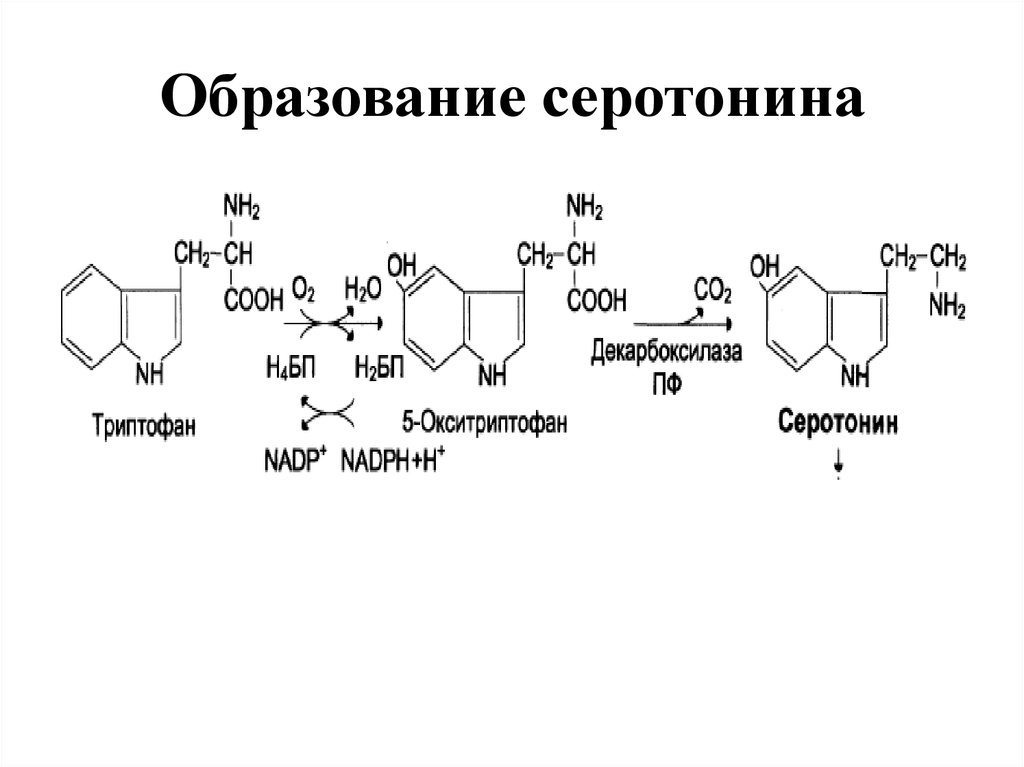 19).99).
19).99).
Химическая формула тирптофана C 11 H 12 N 2 O 2 .
Триптофан ведет себя аналогично фенилаланину и тирозину. Как и эти две аминокислоты, тирптофан содержит большую жесткую ароматическую группу в боковой цепи. Тиртофан, тирозин и фенилаланин, подобно изолейцину, лейцину и валину, являются гидрофобными и имеют тенденцию ориентироваться внутрь свернутой белковой молекулы.
Флуоресценция
Флуоресценция свернутого белка представляет собой смесь флуоресценции отдельных ароматических остатков. Большая часть собственных флуоресцентных эмиссий свернутых белков связана с возбуждением остатков триптофана, а некоторые эмиссии связаны с тирозином и фенилаланином.
Обычно триптофан имеет длину волны максимального поглощения 280 нм и длину волны максимального флуоресцентного излучения 350 нм. Однако эти параметры флуоресценции сильно зависят от среды, в которой находится остаток триптофана, например, от степени воздействия растворителя (Brooks 2007).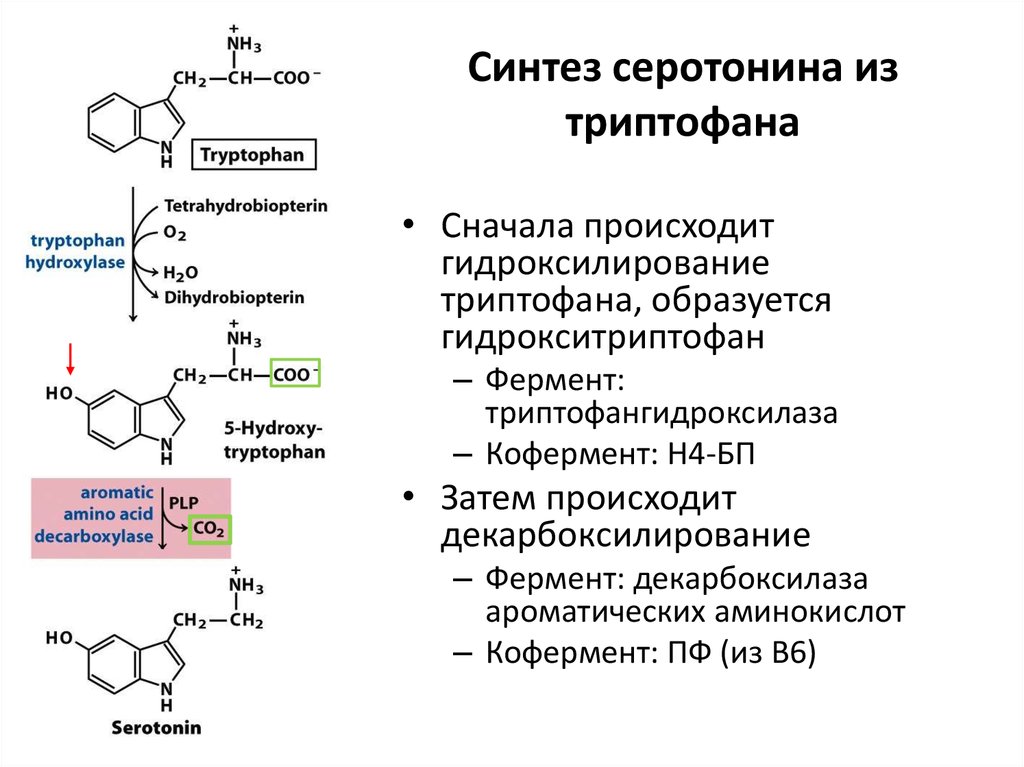 Следовательно, флуоресценция белка может использоваться для диагностики конформационного состояния белка (Vivian 2006).
Следовательно, флуоресценция белка может использоваться для диагностики конформационного состояния белка (Vivian 2006).
Кроме того, на флуоресценцию триптофана сильно влияет близость других остатков (т. е. соседние протонированные кислотные группы, такие как аспарагиновая кислота или глутаминовая кислота, могут вызывать тушение флуоресценции Trp). Кроме того, триптофан является относительно редкой аминокислотой, поэтому многие белки содержат только один или несколько остатков триптофана. Таким образом, флуоресценция триптофана является очень чувствительным измерением конформационного состояния отдельных остатков триптофана.
Пищевые источники
Как незаменимая аминокислота, триптофан не синтезируется в организме человека, поэтому его необходимо принимать внутрь, обычно в составе белков. К счастью, он содержится в большинстве белков, хотя и в небольших количествах.
Основные источники включают бобовые, молоко, йогурт, творог, красное мясо, яйца, рыбу, птицу, шоколад, овес, бананы, сушеные финики, кунжут, нут, семена подсолнечника, семена тыквы, спирулину и арахис.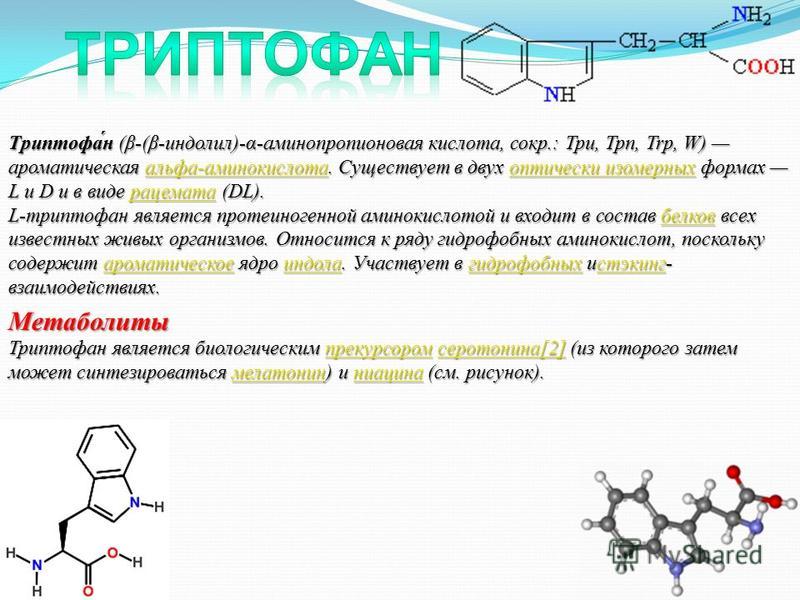
Кишечные бактерии человека расщепляют триптофан на два химических вещества: индол и скатол. Нарушения мальабсорбции фруктозы и непереносимости лактозы вызывают неправильное всасывание триптофана в кишечнике, снижение уровня триптофана в крови и депрессию (Ledochowski et. al 2001).
Функция
Основная функция аминокислот, включая триптофан, заключается в том, что они являются строительными блоками в биосинтезе белка.
Кроме того, триптофан действует как биохимический предшественник для производства нейротрансмиттера серотонина (через триптофангидроксилазу) и витамина ниацина (с кинуренином в качестве промежуточного звена). Серотинин, в свою очередь, может быть преобразован в мелатонин (нейрогормон) с помощью 5-гидроксииндол-О-метилтрансферазы.
Превращение триптофана в никотиновую кислоту недостаточно для удовлетворения потребности в этом витамине. Однако нехватка триптофана, например зависимость от продуктов с низким содержанием триптофана, таких как кукуруза, может способствовать развитию пеллагры, связанной с дефицитом ниацина.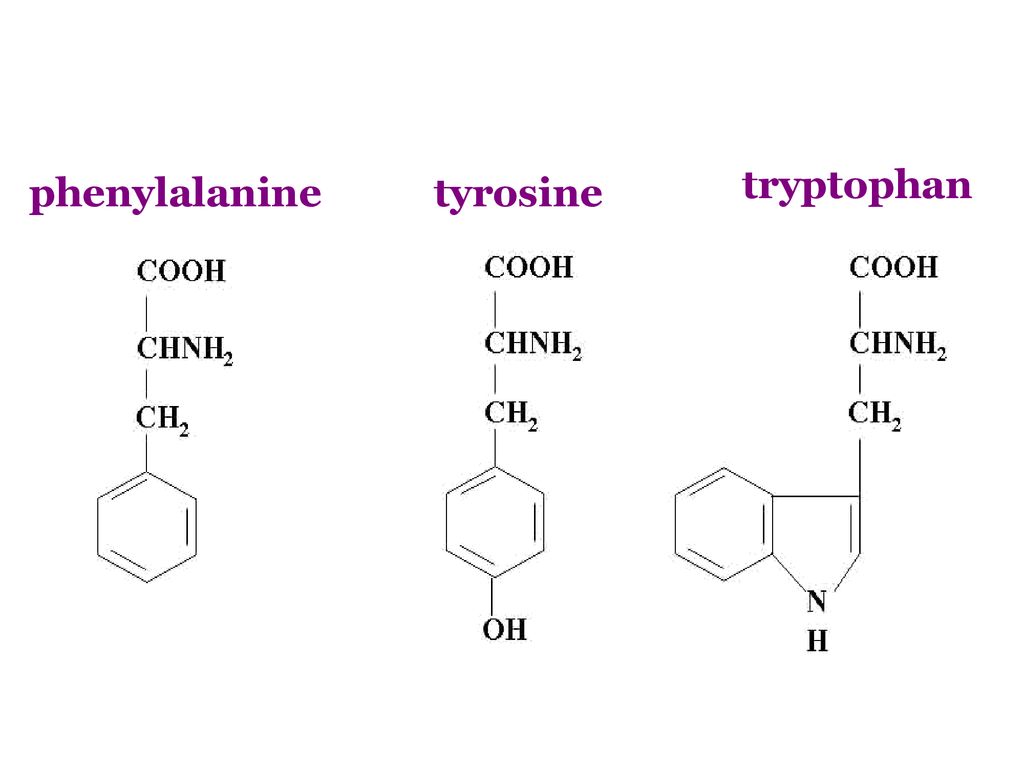
В организмах, синтезирующих триптофан (растения и микроорганизмы), высокие уровни этой аминокислоты активируют белок-репрессор, который, в свою очередь, связывается с опероном trp. Связывание этого репрессора с его опероном предотвращает транскрипцию нижестоящей ДНК, которая кодирует ферменты, участвующие в биосинтезе триптофана. Следовательно, высокие уровни триптофана предотвращают дополнительный синтез триптофана через петлю отрицательной обратной связи. И наоборот, если уровень триптофана в клетке падает, транскрипция генов оперона возобновляется. Это один из примеров того, как экспрессия генов быстро реагирует на изменения во внутренней и внешней среде клетки.
Метаболизм L-триптофана в серотонин и мелатонин (слева) и ниацин (справа). Преобразованные функциональные группы после каждой химической реакции выделены красным цветом.
Использование в качестве пищевой добавки
В течение некоторого времени триптофан продавался в магазинах здоровой пищи в качестве пищевой добавки. Он был в значительной степени изъят из продажи в 1991 году из-за проблем со здоровьем (обсуждается ниже), но с 2002 года L-триптофан снова продается в своей первоначальной форме.
Он был в значительной степени изъят из продажи в 1991 году из-за проблем со здоровьем (обсуждается ниже), но с 2002 года L-триптофан снова продается в своей первоначальной форме.
Многие люди считают триптофан безопасным и достаточно эффективным снотворным средством, вероятно, из-за его способности повышать уровень серотонина (успокаивающий нейротрансмиттер, если он присутствует в умеренных количествах) и/или мелатонина (гормон, вызывающий сонливость, секретируемый мозгом). шишковидной железы в ответ на темноту или низкий уровень освещенности) (Wurtman et al. 1968).
Клинические исследования, как правило, подтверждают эффективность триптофана в качестве естественного снотворного средства, а также при растущем числе других состояний, обычно связанных с низким уровнем серотонина или активностью в головном мозге. В частности, триптофан показал себя многообещающим как сам по себе антидепрессант, так и как «усилитель» антидепрессантов. Другие многообещающие показания включали облегчение хронической боли и уменьшение импульсивного, агрессивного, маниакального, аддиктивного, связанного с тревогой, навязчивого и компульсивного поведения и расстройств.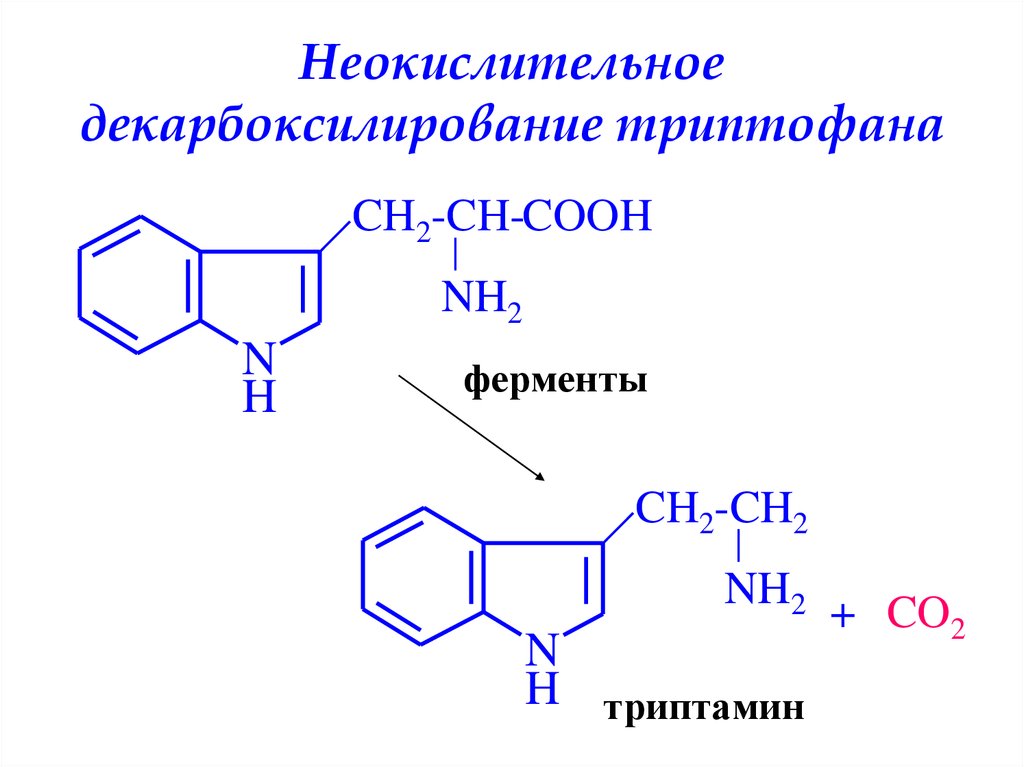
В 1989 г. крупная вспышка нового инвалидизирующего и в некоторых случаях смертельного аутоиммунного заболевания, называемого синдромом эозинофилии-миалгии (EMS), была связана с одним источником L-триптофана. Бактериальная культура, используемая для синтеза триптофана крупным японским производителем Showa Denko KK, в течение 1980-х годов несколько раз подвергалась генетической модификации для увеличения производства триптофана (Smith 2003). Наряду с более высокими концентрациями триптофана в модифицированных питательных средах процесс очистки также был оптимизирован для снижения затрат, а стадия очистки, на которой использовалась абсорбция углем для удаления некоторых примесей, была исключена (Mayeno and Gleich 19).94). Производитель утверждал, что эта модификация процесса позволила очистить другой бактериальный метаболит, что привело к присутствию загрязняющего вещества в конечном продукте, ответственного за токсические эффекты. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США не смогло публично с уверенностью установить, какой загрязнитель стал причиной вспышки.
Большая часть триптофана была запрещена к продаже в Соединенных Штатах в 1991 году, и другие страны последовали его примеру. Триптофан одного из шести производителей продолжал продаваться для производства детских смесей. Beisler (2000) отметил, что «политическое давление сыграло свою роль в решении FDA запретить L-триптофан, а также в его желании усилить свою регулирующую власть над пищевыми добавками».
Во время запрета FDA не знало или не указало, что EMS был вызван загрязненной партией (Raphals 2000). В феврале 2001 г. FDA ослабило ограничения на маркетинг (но не на импорт), но все же выразило следующую озабоченность:
- «На основании научных данных, доступных в настоящее время, мы не можем с уверенностью определить, что возникновение СЭМ у восприимчивых лиц, потребляющих добавки L-триптофана, происходит из-за содержания L-триптофана, примеси, содержащейся в L-триптофан или их комбинация в сочетании с другими, пока неизвестными, внешними факторами» (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, 2001 г.
 ).
).
Медицинское применение
Метаболит триптофана, 5-гидрокситриптофан (5-HTP), был предложен для лечения эпилепсии (Kostowski et al., 1978) и депрессии, хотя клинические испытания неубедительны и отсутствуют (Turner et al. 2006). 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется до серотонина (5-гидрокситриптамина или 5-HT) (Hardebo and Owman, 1980) и поэтому может быть полезен для лечения депрессии. Однако серотонин имеет относительно короткий период полураспада, поскольку он быстро метаболизируется моноаминоксидазой; поэтому, вероятно, он будет иметь ограниченную эффективность. Он продается в Европе для лечения депрессии и других показаний под такими торговыми марками, как Cincofarm и Tript-OH. В Соединенных Штатах 5-HTP не требует рецепта, поскольку он подпадает под действие Закона о пищевых добавках.
Триптофан по-прежнему используется в клинических и экспериментальных исследованиях с участием пациентов и субъектов. Некоторые из этих исследований показывают, что триптофан может эффективно лечить осенне-зимнюю депрессию сезонного аффективного расстройства (Jepson et al., 1999).
Некоторые из этих исследований показывают, что триптофан может эффективно лечить осенне-зимнюю депрессию сезонного аффективного расстройства (Jepson et al., 1999).
Мясо индейки и сонливость
Согласно распространенному мнению, употребление триптофана в мясе индейки вызывает сонливость. Индейка содержит триптофан, который имеет задокументированный эффект, вызывающий сонливость, поскольку он легко превращается в организме в серотонин и/или мелатонин, которые обладают седативным эффектом, как указано выше. Однако не было доказано, что употребление только индейки оказывает такой эффект. Кроме того, считается, что куриный и говяжий фарши имеют такие же уровни содержания, как и индейка (McCue 2001). Некоторые связывают сонливость с перееданием углеводов и употреблением алкоголя во время застолья.
Дополнительный гипотетический механизм заключается в следующем. Большое количество любой пищи, например, празднования Дня Благодарения, содержит большое количество углеводов и аминокислот с разветвленной цепью, высвобождающих инсулин.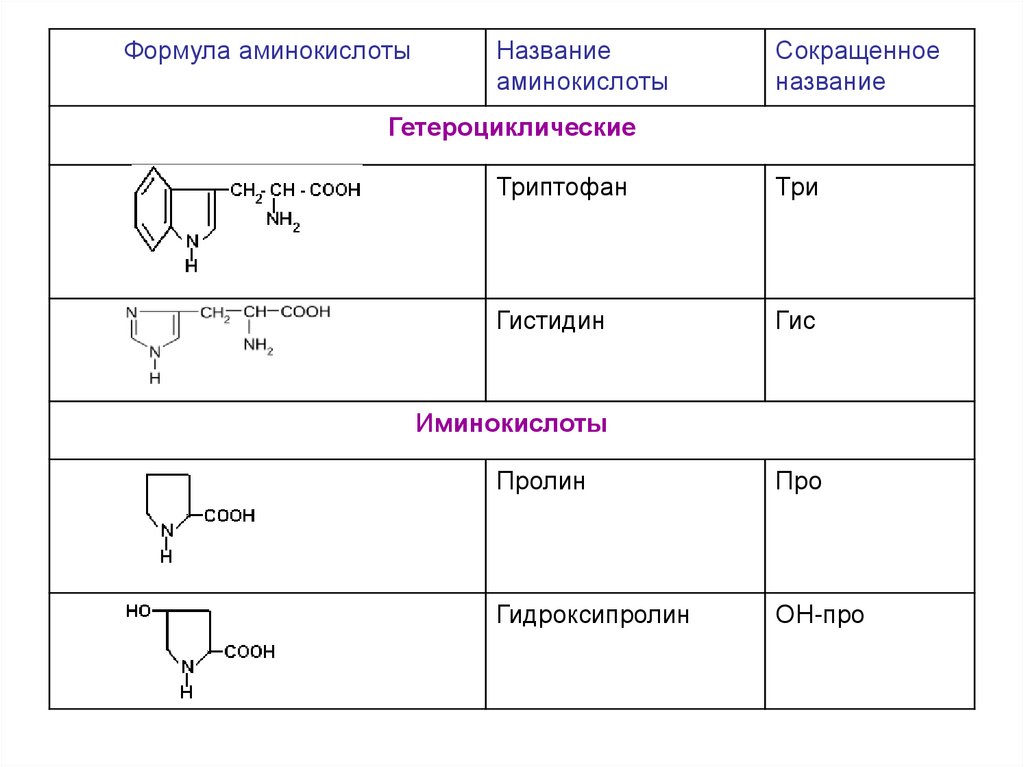 Инсулин стимулирует поглощение больших нейтральных аминокислот с разветвленной цепью (но не триптофана) мышечными клетками через мембраны миоцитов. В результате увеличивается отношение триптофана к большим нейтральным аминокислотам в крови. Это снижает конкуренцию с другими аминокислотами за транспортер больших нейтральных аминокислот за поглощение триптофана через гематоэнцефалический барьер в центральную нервную систему. Попав в центральную нервную систему, триптофан превращается в серотонин ядрами шва, а серотонин далее метаболизируется в мелатонин шишковидной железой. Употребление алкогольных напитков на праздничных застольях, вероятно, усугубит эффект.
Инсулин стимулирует поглощение больших нейтральных аминокислот с разветвленной цепью (но не триптофана) мышечными клетками через мембраны миоцитов. В результате увеличивается отношение триптофана к большим нейтральным аминокислотам в крови. Это снижает конкуренцию с другими аминокислотами за транспортер больших нейтральных аминокислот за поглощение триптофана через гематоэнцефалический барьер в центральную нервную систему. Попав в центральную нервную систему, триптофан превращается в серотонин ядрами шва, а серотонин далее метаболизируется в мелатонин шишковидной железой. Употребление алкогольных напитков на праздничных застольях, вероятно, усугубит эффект.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Бейслер, Дж. Х. 2000. Пищевые добавки и их недовольство: регулирование FDA и Закон о пищевых добавках, здравоохранении и образовании 1994 г. (секция L-триптофана). Юридический журнал Рутгерса . Проверено 28 июня 2007 г.
- Brooks, DW 2007.
 Внутренняя флуоресценция белков и пептидов. Учебный и исследовательский веб-сайт Brooks . Проверено 29 июня 2007 г.
Внутренняя флуоресценция белков и пептидов. Учебный и исследовательский веб-сайт Brooks . Проверено 29 июня 2007 г.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. 2001. Информационный документ FDA по L-триптофану и 5-гидрокси-L-триптофану. FDA . Проверено 28 июня 2007 г.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. 1990. Отзыв триптофана FDA. FDA . Проверено 28 июня 2007 г.
- Хардебо, Дж. Э. и К. Оуман. 1980. Барьерные механизмы для моноаминов нейротрансмиттеров и их предшественников на границе кровь-мозг. Энн НейролАнн Нейрол 8(1): 1-31. PMID 6105837. Проверено 19 февраля., 2013.
- Совместная комиссия Международного союза теоретической и прикладной химии и Международного союза биохимии и молекулярной биологии (IUPAC-IUB) по биохимической номенклатуре. 1983. Номенклатура и символы для аминокислот и пептидов: Рекомендации по органической и биохимической номенклатуре, символам и терминологии.
 ИЮПАК-ИУБ . Проверено 14 июня 2007 г.
ИЮПАК-ИУБ . Проверено 14 июня 2007 г.
- Джепсон Т.Л., М.Е. Эрнст и М.В. Келли. 1999. Современные взгляды на лечение сезонного аффективного расстройства. J Am Pharm Assoc 39(6): 822-829. PMID 10609448. Проверено 19 февраля 2013 г.
- Костовски В., А. Бидзинский, М. Гауптманн, Дж. Э. Малиновски, М. Джерлич и Дж. Дымецкий. 1978. Серотонин мозга и эпилептические припадки у мышей: фармакологическое и биохимическое исследование. Pol J Pharmacol Pharm 30(1): 41-47. PMID 148040. Проверено 19 февраля 2013 г.
- Ледочовский М., Виднер Б., Мурр С., Спернер-Унтервегер Б., Фукс Д. 2001. Мальабсорбция фруктозы связана со снижением триптофана в плазме. Scand J Гастроэнтерол. апреля; 36 (4): 367-71. PMID 11336160. Проверено 19 февраля 2013 г.
- Ленингер А.Л., Д.Л. Нельсон и М.М. Кокс. 2000. Принципы биохимии Ленингера , 3-е изд. Нью-Йорк: стоит издать. ISBN 1572591536 .
- Майено, А.
 Н. и Г. Дж. Глейх. 1994. Синдром эозинофилии-миалгии и производство триптофана: поучительная история. Trends Biotechnol 12(9): 346-352. PMID 7765187. Проверено 19 февраля., 2013.
Н. и Г. Дж. Глейх. 1994. Синдром эозинофилии-миалгии и производство триптофана: поучительная история. Trends Biotechnol 12(9): 346-352. PMID 7765187. Проверено 19 февраля., 2013.
- МакКью, К. 2001. День благодарения, индейка и триптофан. Американское химическое общество . Проверено 29 июня 2007 г.
- Паллаги, П.К., А.П. Мельникова, Э.К. Хименес, Б.М. Оливера и Р.С. Нортон. 1999. Структура раствора контрифана-R, встречающегося в природе октапептида с дисульфидным мостиком, содержащего D-триптофан: сравнение с белковыми петлями. Биохимия 38(35): 11553-11559. PMID 10471307. Проверено 19 февраля 2013 г.
- Raphals, P. 2000. Угрожают ли медицинские тайны биотехнологиям? Science 250: 4981. PMID 2237411. Проверено 19 февраля 2013 г.
- Смит, Дж. М. 2003. Семена обмана: разоблачение лжи промышленности и правительства о безопасности генетически модифицированных продуктов, которые вы едите.
 Фэрфилд, Айова: Да! Книги. ISBN 9780972966580 .
Фэрфилд, Айова: Да! Книги. ISBN 9780972966580 .
- Тернер, Э. Х., Дж. М. Лофтис и А. Д. Блэквелл. 2006. Серотонин по меню: добавка предшественника серотонина 5-гидрокситриптофана. Pharmacol Ther 109(3): 325-338. PMID 16023217. Проверено 19 февраля 2013 г.
- Вивиан, Дж. Т. и П. Р. Каллис. 2006. Механизмы сдвигов флуоресценции триптофана в белках. Biophys J 80(5): 2093-2109. PMID 11325713. Проверено 19 февраля 2013 г.
- Вуртман, Р. Дж., У. Дж. Шумейкер и Ф. Ларин. 1968. Механизм суточного ритма активности печеночной тирозинтрансаминазы: роль пищевого триптофана. Proc Natl Acad Sci USA 59(3): 800-807. PMID 4384464. Проверено 19 февраля 2013 г.
Внешние ссылки
Все ссылки получены 27 марта 2020 г.
- Катаболизм триптофана (ранние стадии).
- Катаболизм триптофана (поздние стадии).
- Статья Сноупса, разоблачающая связь между индейкой и сонливостью.
| Основные семейства биохимических веществ | ||
| Пептиды | Аминокислоты | Нуклеиновые кислоты | Углеводы | Нуклеотидные сахара | липиды | Терпены | каротиноиды | Тетрапирролы | Кофакторы ферментов | Стероиды | Флавоноиды | Алкалоиды | Поликетиды | Гликозиды | ||
| Аналоги нуклеиновых кислот: | 20 распространенных аминокислот | Аналоги нуклеиновых кислот: |
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia .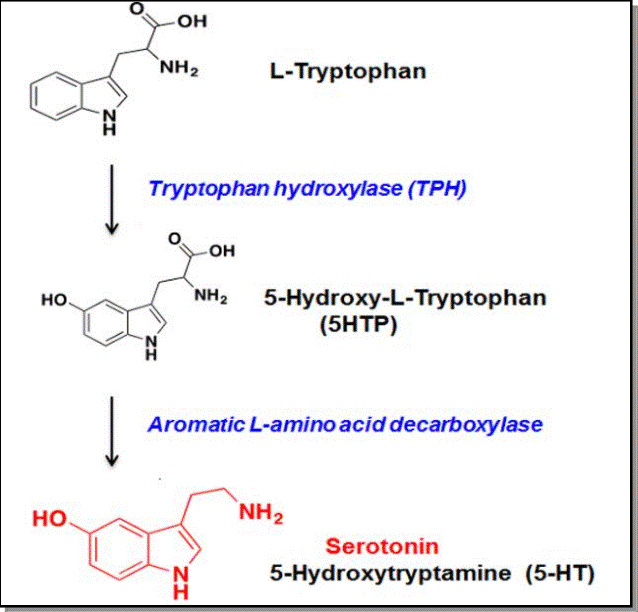 Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Триптофан история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Триптофана»
Примечание. На использование отдельных изображений могут распространяться некоторые ограничения, которые лицензируются отдельно.
ВЭЖХ Определение общего триптофана в детских смесях и пищевых смесях для взрослых/детей после ферментативного гидролиза: проверка в одной лаборатории, первое действие 2017.
 03 | Журнал AOAC INTERNATIONAL
03 | Журнал AOAC INTERNATIONALФильтр поиска панели навигации Журнал AOAC INTERNATIONALЭтот выпускНаука и математикаКнигиЖурналыOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации Журнал AOAC INTERNATIONALЭтот выпускНаука и математикаКнигиЖурналыOxford Academic Введите поисковый запрос
Расширенный поиск
Журнальная статья
Джонатан Драхер,
Джонатан Драэр
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Норман Уайт
Норман Уайт
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Журнал AOAC International , том 101, выпуск 4, 1 июля 2018 года, стр.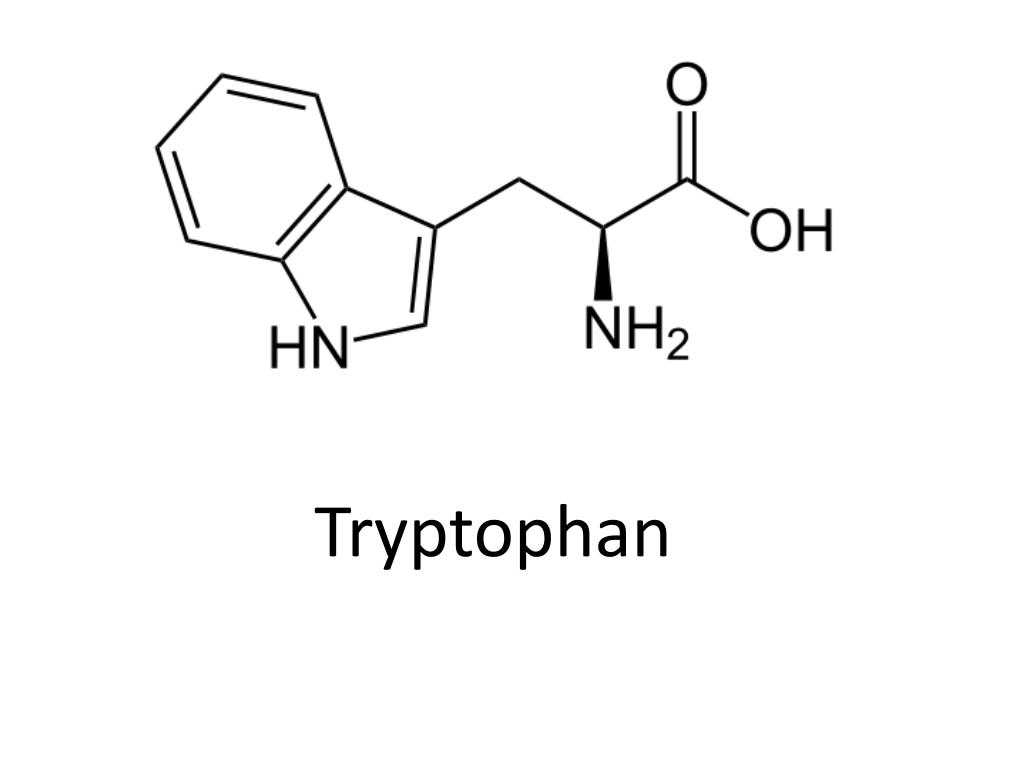 PDF
PDF
- Содержание статьи
- Рисунки и таблицы
- видео
- Аудио
- Дополнительные данные
Цитировать
Cite
Jonathan Draher, Norman White, ВЭЖХ Определение общего триптофана в смесях для младенцев и пищевых смесях для взрослых/детей после ферментативного гидролиза: проверка в одной лаборатории, первое действие 2017. 03, Journal of AOAC INTERNATIONAL , том 101, выпуск 4 , 1 июля 2018 г., страницы 1244–1248, https://doi.org/10.5740/jaoacint.2017.03
03, Journal of AOAC INTERNATIONAL , том 101, выпуск 4 , 1 июля 2018 г., страницы 1244–1248, https://doi.org/10.5740/jaoacint.2017.03
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Разрешения
- Электронная почта
- Твиттер
- Подробнее
Фильтр поиска панели навигации Журнал AOAC INTERNATIONALЭтот выпускНаука и математикаКнигиЖурналыOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации Журнал AOAC INTERNATIONALЭтот выпускНаука и математикаКнигиЖурналыOxford Academic Введите поисковый запрос
Расширенный поиск
Предварительный просмотр первой страницы статьи PDF
Закрыть
Этот контент доступен только в формате PDF.

