6 плюсов от приема донаторов азота
Задумывались ли вы когда-нибудь о том, чтобы включить в свое спортивное питание донаторы азота (NO бустеры)? Если зачастую, во время тренировки, вы чувствуете апатию и сильную усталость, то эта статья для вас! Сегодня вы узнаете о действии донаторов и о результатах, которых вы сможете достичь с их помощью!
Вы на полную выкладываетесь в зале, принимаете полезные коктейли до тренировки и после нее, ежемесячно увеличиваете веса, даете организму полноценный отдых для качественного восстановления и роста мышц. Отлично, но действительно ли вы используете все возможности для успешного продвижения на арене спорта? Даже если вы изучили бодибилдинг от и до, проконсультировались со знающими в этой области людьми, нашли кучу полезной информации и изучили технику — это еще не значит, что вы ничего не упустили и выжимаете все из своих тренингов для получения максимальных результатов. Рынок спортивного питания и различных примочек постоянно растет и развивается.
Оксид азота — действенный и незаменимый препарат для достижения спортивных высот.
Что же это и как работает? Давайте внимательно изучим и определимся — что нам может дать данный препарат.
1. Быстрое восстановление
Если вы тренируетесь в зале на 100% и выкладываетесь за двоих, а то и за троих — без оксида азота вам не обойтись. Именно с процессом восстановления он связан в первую очередь. Учтите, что после тяжелой тренировки, вам нужно несколько дней отдыха чтобы дать мышцам хорошенько вырасти и отдохнуть организму. Это позволит избежать перетренированности и не даст пропасть результатам.
Как вам поможет в этом оксид азота? Он поможет улучшить кровоснабжение и успокоит напряженные сосуды. Это даст мышцам возможность получить достаточно кислорода и полезных веществ. Не пренебрегайте отдыхом — это главный фактор, ведь своевременная доза нутриентов и налаженный кровоток является необходимым условием отличного результата.
Также, не забывайте о приеме пищи в нужное время и вспомогательных питательных коктейлях. Только в этом случае, оксид азота принесет вам максимальную пользу. Чем быстрее проходит восстановление, тем чаще вы посещаете зал, а именно это дает результаты.
2. Устранение дефицита энергии во время высокоинтенсивного тренировки
Это еще одно преимущества от употребления донаторов оксида азота. Если вы чувствуете сильный спад энергии под конец тренинга и не можете выполнить целиком свою программу, то оксид азота вам поможет. В период силовых упражнений, мышцы быстро расходуют кислородные запасы, а затем, происходит активное накапливание молочной кислоты. Это и есть причиной сильной усталости.
Появляются ощущения как будто по вашему телу разливается раскаленное олово и жжет мышцы. Из-за невероятно сильной усталости, вы вынуждены прекращать тренировку. Особенно это заметно во время много повторных упражнений. Оксид азота поспособствует поставке порции кислорода вашим мышцам и увеличит в несколько раз вашу работоспособность.
3. Повышенная выносливость
Однако не стоит думать, что донатор пригодится только бодибилдерам. Если ваши тренировки требуют огромной выносливости, то оксид вам также необходим. В период такого тренинга, ваши мышцы тоже нуждаются в достаточной порции кислорода. Улучшенный процесс кровотока даст вам возможность тренироваться долго и при этом не ощущать усталости.
Если вы испытываете свою выносливость и подготавливаетесь к соревнованиям на внушительной высоте, то обязательно примите во внимание донаторы. На большой высоте, насыщение организма кислородом весьма снижено, а это важный показатель для ваших будущих результатов. Оксид азота создаст для спортсмена комфортную среду.
4. Мощный приток энергии
Воздействие азота взаимосвязано с улучшением кровотока. Именно это позволяет поддерживать в организме наилучшую температуру. Во время тренинга происходит существенное повышение температуры и организм использует все силы для борьбы с перегреванием. Налаженный кровоток заметно помогает добиться этого эфекта, экономя энергию, затрачиваемую впустую. Таким образом, остается хороший запас сил для продолжения тренинга.
Налаженный кровоток заметно помогает добиться этого эфекта, экономя энергию, затрачиваемую впустую. Таким образом, остается хороший запас сил для продолжения тренинга.
5. Ускоренный расход глюкозы
Оксид азота станет вашим надежным спутником в процессе устранения подкожного жира. Один известный американский журнал, посвященный эндокринологии провел исследование влияния L-аргинина на расход глюкозы в период тренинга. В эксперименте приняли участие девять максимально выносливых мужчин. Они крутили велоэргометр в течение двух часов, а затем сразу же показали 100% результат в 15-ти минутном спринте. Весь процесс обуславливался беспрерывным мониторингом глюкозы.
Спортсмены, принявшие L-аргинин заметно увеличили скорость появления, исчезновения и метаболического клиренса. Из этого следует, что у этих людей глюкоза активнее расщеплялась во время увеличения нагрузок. Более того, оксид азота помогал повысить уровень концентрации жирных кислот наряду с глицерином — показатель расхода жира в качестве энергии.
Если хотите уменьшить жировую прослойку, расходуйте как можно быстрее глюкозу и переходите на жировые запасы. В этом вам поможет донатор оксид азота.
6. Мощный пампинг
Последний пункт плюсов оксида азота — хорошее наполнение мышц кровью. Кто же откажется от этих великолепных ощущений — забитые до отказа трицепсы и широчайшие? С помощью донатора, пампинг станет максимально выраженным и продолжительным. Данное явление — это результат наполнения мышц кровью, достигающийся естественно, в процессе тренинга. Применение оксида азота попросту увеличит кровоток и сделает пампинг более сильным.
Выводы
Из всего вышеизложенного можно сделать вывод — оксид азота является наиболее действенным препаратом для силовых показателей, а также выносливости. Многие препараты вмещают его в своем составе, что дает возможность получить разносторонние нутриенты. Советуем подумать о приеме Оксид азота (NO2), ведь с его помощью вы сможете выйти на уровень выше!
Альтернативные органическим нитратам доноры оксида азота.
 Сиднонимины в лечении пациентов с кардиоваскулярной патологией
Сиднонимины в лечении пациентов с кардиоваскулярной патологиейРезюме. В статье рассмотрены преимущества и ограничения терапии органическими нитратами, а также потенциальные возможности применения альтернативных им доноров оксида азота, в частности производного сиднонимина — молсидомина — у пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью.
Роль оксида азота в кардиоваскулярном гомеостазе
В настоящее время установлена решающая роль эндотелия в регуляции сосудистой функции, а также прямая корреляционная взаимосвязь между риском возникновения сердечно-сосудистых событий и дисфункцией эндотелия (ДЭ) в различных когортах пациентов (Березин А.Е., 2010). Являясь основным регулятором сосудистого гомеостаза, эндотелий контролирует тонус сосудов, поддерживая баланс между вазодилатацией и вазоконстрикцией, а также процессы пролиферации и миграции гладкомышечных клеток, тромбообразования, фибринолиза и многие другие (Задионченко В.С. и соавт.
Основной причиной ДЭ у пациентов с коронарным атеросклерозом является нарушение образования или активности эндотелийзависимого релаксирующего фактора — оксида азота (nitric oxide — NO) — вазодилатирующей субстанции, высвобождаемой эндотелиальными клетками сосудов. В физиологических условиях NO постоянно вовлечен в адаптацию сосудистой системы к повышенным метаболическим потребностям, физическим нагрузкам (Задионченко В.С. и соавт., 2002) и обеспечивает регуляцию тонуса сосудов и антикоагулянтных свойств крови, оказывает влияние на адгезию лейкоцитов, пролиферацию гладкомышечных клеток сосудов и апоптоз (Коваленко В.Н. (ред.), 2008).
Таблица. Роль NO в кардиоваскулярном гомеостазе (Задионченко В.С. и соавт., 2002)
| Функция NO | Эффекты NO |
|---|---|
| Расслабление гладкомышечных клеток | Вазодилатация, снижение общего периферического сопротивления сосудов |
| Ингибирование пролиферации и миграции гладкомышечных клеток | Торможение ремоделирования сосудов |
| Ингибирование адгезии и миграции моноцитов | Антиатерогенный, противовоспалительный |
| Торможение адгезии и агрегации тромбоцитов | Антиагрегационный |
| Антиоксидантное действие | Антиатерогенный |
Снижение биологической доступности NO для эндотелиоцитов негативно отражается на вазодилатирующей способности сосудов и вносит важный вклад в прогрессирование многих кардиоваскулярных заболеваний, в частности ИБС и сердечной недостаточности (СН) (Березин А.Е., 2010). В связи с этим неотъемлемой частью терапии пациентов с данной патологией является применение доноров NO (органических нитратов, сиднониминов).
В связи с этим неотъемлемой частью терапии пациентов с данной патологией является применение доноров NO (органических нитратов, сиднониминов).
Органические нитраты: преимущества и ограничения применения
Благодаря снижению потребности миокарда в кислороде и увеличению притока крови к ишемизированной области органические нитраты (глицерола тринитрат (нитроглицерин), изосорбида динитрат и его природный активный метаболит изосорбида-5-мононитрат) сохраняют свои позиции среди основных антиангинальных лекарственных средств. Основным эффекторным субстратом нитратов является NO, что обусловливает их способность частично восполнять его недостаток у пациентов с ИБС (Аронов Д.М., Лупанов В.П., 2005).
Являясь пролекарствами, нитраты становятся активными после ряда метаболических превращений. Внутри гладкомышечной клетки сосуда они взаимодействуют с сульфгидрильными (тиоловыми, -SH) группами эндогенных нитратных рецепторов, в результате чего происходит высвобождение NO. Последний активирует растворимую гуанилатциклазу, что приводит к повышению образования циклического гуанозинмонофосфата (цГМФ) в гладкомышечных клетках и тромбоцитах и далее — к снижению содержания внутриклеточной концентрации ионизированного кальция, расслаблению гладких мышц сосудов и вазодилатации, а также торможению активности тромбоцитов и макрофагов (Задионченко В. С. и соавт., 2002; Окороков А.Н., 2002; Аронов Д.М., Лупанов В.П., 2005).
С. и соавт., 2002; Окороков А.Н., 2002; Аронов Д.М., Лупанов В.П., 2005).
При применении в низких дозах нитропрепараты вызывают расширение преимущественно сосудов венозного русла, что приводит к депонированию крови в венах и снижению преднагрузки на сердце, давления в камерах сердца (в частности конечно-диастолического давления в полости левого желудочка), систолического напряжения его стенок. Вследствие этого потребность миокарда в кислороде снижается, а его перфузия улучшается, особенно в субэндокардиальных отделах. При применении в высоких дозах нитропрепараты влияют преимущественно на крупные артерии, включая коронарные сосуды сердца. Селективная дилатация именно крупных коронарных сосудов является важнейшим фактором оптимизации миокардиального кровотока в ишемизированных зонах (Fox K. et al., 2006; Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010).
Наряду с вазодилатацией нитраты обладают антитромбоцитарной и антитромботической активностью, проявляющейся в снижении агрегации тромбоцитов, их адгезии и дисперсии образующихся скоплений тромбоцитов (Мельник М. В., 2009).
В., 2009).
Высокая антиангинальная эффективность позволяет применять органические нитраты практически при всех формах ИБС, в том числе стабильной стенокардии напряжения. При этом значительно уменьшается количество приступов стенокардии, повышается толерантность к физической нагрузке. Однако следует отметить, что применение нитратов показано далеко не всем пациентам с ИБС. Так, у около 10% больных стабильной стенокардией применение нитратов неэффективно и еще у 10% — сопровождается развитием побочных эффектов, требующих их отмены (Коваленко В.Н. (ред.), 2008).
Проблема толерантности к нитратам и пути ее преодоления
Основным ограничением, связанным с непрерывным применением нитратов, является развитие толерантности к ним, проявляющейся в снижении или полном исчезновении терапевтического эффекта у значительной части пациентов. Например, эффективность лечения при постоянном применении изосорбида динитрата в дозе 10–20 мг 4 раза в сутки в течение 1 мес остается стабильной лишь у 10–15%, значительно снижается — у 60–70% и сопровождается полной потерей антиангинального эффекта у 10–15% пациентов со стабильной стенокардией (Коваленко В. Н. (ред.), 2008; Лутай М.І. та співавт., 2010). Обычно толерантность развивается при длительном, регулярном и частом применении нитратов, особенно в высоких дозах. В некоторых случаях возможно возникновение толерантности после применения лишь нескольких доз нитратов.
Н. (ред.), 2008; Лутай М.І. та співавт., 2010). Обычно толерантность развивается при длительном, регулярном и частом применении нитратов, особенно в высоких дозах. В некоторых случаях возможно возникновение толерантности после применения лишь нескольких доз нитратов.
В настоящее время установлено, что постоянно высокий уровень нитратов в крови приводит к насыщению их рецепторов в гладких мышцах сосудов, снижению количества доступных SH-групп, обеспечивающих ферментативное превращение молекул нитратов в NO, в связи с чем реактивность сосудов и вазодилатирующий эффект препаратов снижаются (Окороков А.Н., 2002). Свободнорадикальная гипотеза предполагает, что толерантность к нитратам обусловлена повышением продукции эндотелием сосудов супероксидного аниона, инактивирующего высвобождение NO из органических нитратов, что приводит к утрате способности реагировать на лечение (Herman A.G., Moncada S., 2005). В настоящее время существуют четкие доказательства негативного влияния нитратов на функционирование NO-синтазы (NOS) — фермента, отвечающего за эндотелиальный контроль сосудистого тонуса. В экспериментах in vitro установлено повышение экспрессии NOS при сниженной ее активности в течение продолжительной терапии нитроглицерином, ассоциированное с повышением образования супероксидного аниона (Бабушкина А.В., 2011).
В экспериментах in vitro установлено повышение экспрессии NOS при сниженной ее активности в течение продолжительной терапии нитроглицерином, ассоциированное с повышением образования супероксидного аниона (Бабушкина А.В., 2011).
Следует отметить, что толерантность к нитратам соответствует всем критериям ДЭ. В ряде рандомизированных клинических исследований показано, что продолжительный прием нитроглицерина ухудшает эндотелийзависимую вазодилатацию у пациентов с ИБС и здоровых лиц как в коронарной, так и периферической артериальной циркуляции (Бабушкина А.В., 2011).
В течение нескольких последних десятилетий очевидная клиническая значимость данного феномена поддерживает неугасающий интерес к подробному изучению механизмов, лежащих в его основе, и активному поиску наиболее эффективных путей решения проблемы.
Установлено, что применение нитратов в более высоких дозах эффективно лишь в течение нескольких дней, после чего толерантность возобновляется (Окороков А.Н. , 2002). Предотвратить снижение терапевтического эффекта нитратов удается путем прерывистого их применения — обеспечения ежедневных безнитратных периодов продолжительностью 8–12 ч/сут (как правило, в ночное время). Однако в этот период не исключено развитие у пациентов спазма коронарных артерий в результате синдрома отмены (рикошетная стенокардия) (Fox K. et al., 2006; Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010).
, 2002). Предотвратить снижение терапевтического эффекта нитратов удается путем прерывистого их применения — обеспечения ежедневных безнитратных периодов продолжительностью 8–12 ч/сут (как правило, в ночное время). Однако в этот период не исключено развитие у пациентов спазма коронарных артерий в результате синдрома отмены (рикошетная стенокардия) (Fox K. et al., 2006; Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010).
Альтернативные доноры оксида азота. Молсидомин
В качестве альтернативы или дополнения к терапии органическими нитратами рассматривают производные сиднонимина, наиболее изученным представителем которых является молсидомин. Разработанные в Японии, первоначально они были предложены в качестве антигипертензивных средств (Lablanche J.M. et al., 1997). В странах Европы их применяют для лечения больных со стабильной стенокардией с 70-х годов XX в. (Herman A.G., Moncada S., 2005).
Отметим, что производные сиднонимина обладают уникальной способностью к реализации вазодилатирующего потенциала за счет реверсии ДЭ фактически при любом исходном уровне продукции NO, а также при высокой активности супрессантов его синтеза (Березин А. Е., 2010).
Е., 2010).
Основной механизм антиангинального действия молсидомина заключается в уменьшении преднагрузки на серце и благоприятном влиянии на метаболизм миокарда, в результате чего его потребность в кислороде резко снижается. Молсидомин снижает венозное давление, конечное диастолическое давление в желудочках и давление в легочной артерии, расширяет крупные коронарные артерии, а также улучшает коллатеральное кровообращение при атеросклерозе коронарных сосудов (Компендиум 2010 — лекарственные препараты, 2010).
После приема внутрь молсидомин метаболизируется в печени, превращаясь в фармакологически активное производное SIN-1, из которого неэнзимным путем образуется нестойкое соединение SIN-1А, содержащее свободную фармакологически активную группу NO и разлагающееся в крови и тканях до фармакологически неактивного SIN-1С (Компендиум 2010 — лекарственные препараты, 2010). Самопроизвольное отщепление NO в процессе этих превращений, аналогично действию органических нитратов, последовательно приводит к расслаблению гладких мышц сосудов и вазодилатации (Kmieć M. , Ochmański W., 1998; Компендиум 2010 — лекарственные препараты, 2010).
, Ochmański W., 1998; Компендиум 2010 — лекарственные препараты, 2010).
В то же время молекулярный механизм вазодилатирующего действия сиднониминов имеет немаловажное отличие от соответствующего механизма действия нитратов: отсутствие предварительного взаимодействия с SH-группами для активации цГМФ (Бабушкина А.В., 2011). В связи с этой особенностью молсидомина клинически значимая толерантность к нему не развивается (Компендиум 2010 — лекарственные препараты, 2010).
У пациентов с ангиографически подтвержденной ИБС во время продолжительной (в течение 4 нед) терапии молсидомином в дозе 4 мг 3 раза в сутки per os при повышении работоспособности и лучшей переносимости пациентами физической нагрузки развития толерантности не выявлено (Jansen W. et al., 1987).
SIN-1 сохраняет вазодилатирующую активность даже у пациентов с доказанной толерантностью к органическим нитратам, что является отражением протекторного влияния препарата в отношении сосудистого эндотелия. Его внутривенное или интракоронарное введение оказывает быстрый вазодилатирующий эффект, не сопровождающийся синдромом обкрадывания (Березин А. Е., 2010).
Е., 2010).
Результаты повторной коронарной ангиографии в нескольких проекциях до и через 2 мин после внутрикоронарного введения SIN-1 в дозе 1 мг, а также до и после второй инъекции 60 мин позднее показали увеличение среднего диаметра 44 нормальных сегментов левой коронарной артерии на 12% (р<0,001) непосредственно после введения SIN-1, и на 8% — спустя 60 мин (Serruys P.W. et al., 1987).
В рандомизированном двойном слепом плацебо-контролируемом исследовании применение у пациентов с ИБС молсидомина per os в дозе 12 мг/сут в течение 48 ч увеличило на 60% поток-опосредованную дилатацию (flow-mediated dilation) сосудов после первого приема препарата (Herman A.G., Moncada S., 2005).
Результаты клинических испытаний подтверждают лучшую переносимость молсидомина по сравнению с нитроглицерином при одинаково выраженной эффективности обоих препаратов у пациентов с острым инфарктом миокарда и нестабильной стенокардией (Kmieć M., Ochmański W., 1998).
В двойном слепом перекрестном сравнении с плацебо молсидомин в дозе 2 мг 3 раза в сутки снижал частоту приступов стенокардии и применения нитроглицерина в таблетках у пациентов со стабильной стенокардией, а во время нагрузочного тестирования на тредмиле показал статистически значимое уменьшение депрессии сегмента ST на электрокардиограмме (ЭКГ) в течение около 6 ч. Исследователи пришли к выводу, что действие молсидомина в предотвращении симптомов стенокардии подобно таковому нитроглицерина, однако его эффект более продолжителен (Majid P.A., 1980).
Исследователи пришли к выводу, что действие молсидомина в предотвращении симптомов стенокардии подобно таковому нитроглицерина, однако его эффект более продолжителен (Majid P.A., 1980).
Терапия молсидомином снижала частоту эпизодов стенокардии, а также необходимость сублингвального применения изосорбида динитрата у пациентов со стабильной стенокардией по сравнению с плацебо (Messin R. et al., 2005; Ben-Dor I., Battler A., 2007).
Сопоставимый антиишемический эффект препаратов молсидомина и изосорбида динитрата с замедленным высвобождением показан при их кратковременном применении в дозе 8 и 40 мг 3 раза в сутки соответственно у пациентов с ИБС и стабильной стенокардией (Wagner F. et al., 1991). Эффективность и продолжительность антиангинального действия пролонгированных форм этих препаратов в дозе 8 и 20 мг соответственно оценены в серии симптом-ограниченных тестовых упражнений у пациентов со стенокардией напряжения до начала лечения и через 1, 4 и 8 ч после применения препаратов или плацебо. Через 1 ч после приема молсидомина отмечено значительно более позднее появление и меньшая выраженность признаков ишемии на ЭКГ. Кроме того, период, свободный от приступов стенокардии, увеличился. Через 4 ч оба препарата значительно задерживали появление стенокардии и депрессии сегмента ST (Ruano J. et al., 1988).
Через 1 ч после приема молсидомина отмечено значительно более позднее появление и меньшая выраженность признаков ишемии на ЭКГ. Кроме того, период, свободный от приступов стенокардии, увеличился. Через 4 ч оба препарата значительно задерживали появление стенокардии и депрессии сегмента ST (Ruano J. et al., 1988).
R. Messin и соаторы (1998) в многоцентровом рандомизированном двойном слепом перекрестном плацебо-контролируемом исследовании сравнивали эффективность применения изосорбида динитрата, обычной (в дозе 4 мг 3 раза в сутки) и пролонгированной (в дозе 8 мг 2 раза в сутки) формы молсидомина в течение 6 нед у 90 пациентов со стабильной стенокардией. Отмечено значительное повышение работоспособности по сравнению с исходным уровнем и плацебо до 8 и 12 ч после применения обычной и ретардной формы молсидомина соответственно, а также значительное уменьшение депрессии сегмента ST на ЭКГ. Эти эффекты оставались значительно выраженными после 6 нед лечения, а частота приступов стенокардии и необходимости в сублингвальном приеме нитратов значительно снизились. Однако в целом результаты показали, что ретардная форма уменьшает выраженность ишемии миокарда более эффективно, имеет более продолжительный эффект в отношении толерантности к физической нагрузке, поддерживаемый на высоком уровне после 6-недельного лечения.
Однако в целом результаты показали, что ретардная форма уменьшает выраженность ишемии миокарда более эффективно, имеет более продолжительный эффект в отношении толерантности к физической нагрузке, поддерживаемый на высоком уровне после 6-недельного лечения.
У пациентов с тяжелой ИБС проведено исследование гемодинамического эффекта разовой дозы молсидомина внутривенно во время приступа стенокардии, индуцированного ходьбой, и после введения молсидомина — во время ходьбы на скорость, провоцирующей развитие приступа. Приступов стенокардии, а также существенных изменений систолического артериального давления после введения молсидомина не последовало, конечно-диастолическое давление левого желудочка резко снизилось, показатели коронарного кровотока и потребления кислорода миокардом превысили контрольные уровни на 38 и 33% соответственно (при 58,3% во время приступа стенокардии) (Crexells C. et al., 1985).
В двойном слепом перекрестном клиническом испытании с фиксированными дозами сравнивали антиангинальную эффективность молсидомина и пропранолола у пациентов с умеренно выраженной стабильной стенокардией и объективными признаками коронарного атеросклероза. Частота приступов стенокардии во время лечения молсидомином статистически не отличалась от таковой при терапии пропранололом, оба препарата повышали толерантность к физической нагрузке, а нежелательные эффекты были незначительными. Несмотря на то что пропранолол показал бо`льшую эффективность в снижении потребности пациентов в нитроглицерине, молсидомин был рекомендован в качестве эффективного антиангинального средства и полезного дополнения к уже применяющимся с этой целью препаратам (Balakumaran K. et al., 1983). Аналогичная точка зрения высказана H. Schmutzler (1985), описавшем терапевтический эффект молсидомина и более низкую частоту побочных эффектов в сравнении с нитратами.
Частота приступов стенокардии во время лечения молсидомином статистически не отличалась от таковой при терапии пропранололом, оба препарата повышали толерантность к физической нагрузке, а нежелательные эффекты были незначительными. Несмотря на то что пропранолол показал бо`льшую эффективность в снижении потребности пациентов в нитроглицерине, молсидомин был рекомендован в качестве эффективного антиангинального средства и полезного дополнения к уже применяющимся с этой целью препаратам (Balakumaran K. et al., 1983). Аналогичная точка зрения высказана H. Schmutzler (1985), описавшем терапевтический эффект молсидомина и более низкую частоту побочных эффектов в сравнении с нитратами.
В проспективном многоцентровом рандомизированном испытании ACCORD (Angioplastic Coronaire Corvasal Diltiazem) (1997) изучено влияние внутривенного введения SIN-1 с последующим применением молсидомина/дилтиазема per os в течение 6 мес на просвет коронарных артерий и прогноз у 700 пациентов со стабильной стенокардией, перенесших избирательную перкутанную транслюминальную коронарную ангиопластику (Percutaneous Transluminal Cardiac Angioplasty — PTCA). Результаты показали, что при отсутствии влияния на прогноз, SIN-1 и молсидомин в большей степени увеличивали просвет коронарных артерий и снижали частоту рестенозов по сравнению с дилтиаземом (Lablanche J.M. et al., 1997).
Результаты показали, что при отсутствии влияния на прогноз, SIN-1 и молсидомин в большей степени увеличивали просвет коронарных артерий и снижали частоту рестенозов по сравнению с дилтиаземом (Lablanche J.M. et al., 1997).
Антитромбоцитарные свойства молсидомина и его активного метаболита SIN-1A изучены в результате применения per os у здоровых добровольцев и внутривенно — у пациентов с инфарктом миокарда (Wautier J.L. et al., 1989), а также в сравнении с аналогичными свойствами изосорбида-5-мононитрата и плацебо у здоровых добровольцев (Drummer C. et al., 1991). Агрегация тромбоцитов ex vivo измерена у них до и через 30 и 60 мин после приема 4 мг молсидомина/20 мг изосорбида-5-мононитрата/плацебо. В отличие от изосорбида-5- мононитрата, через 30 и 60 мин после применения молсидомина отмечено значительное (на 100 и 120% соответственно) повышение пороговых доз фактора активации тромбоцитов (рlatelet-activating factor — PAF), вызывавших их необратимую агрегацию, и значительное снижение кривых агрегации (р<0,01).
Применение молсидомина оказывает благоприятный эффект у пациентов с гипертонической болезнью (Kmieć M., Ochmański W., 1998). В двойном слепом контролируемом испытании J. Milei и соавторов (1980) отмечено дозозависимое антигипертензивное действие терапии молсидомином в течение 1 мес. Разовая доза препарата 4 мг существенно снижала систолическое, диастолическое и среднее артериальное давление у пациентов с артериальной гипертензией в течение около 8 ч. У пациентов с ИБС однократный прием молсидомина в дозе 4 мг снижал среднее артериальное давление в покое на 12%, при субмаксимальной физической нагрузке — на 8% (Jansen W. et al., 1987).
Предполагают также, что метаболит молсидомина SIN-1С обладает иммуномодулирующими свойствами, что может благоприятно влиять на течение иммунных процессов в очаге некроза при инфаркте миокарда (Мельник М.В., 2009).
Как и органические нитраты, сиднонимины эффективны у пациентов с хронической СН, обусловленной ишемической кардиомиопатией, дилатационной кардиомиопатией, а также при легочной гипертензии у пациентов с хронической обструктивной болезнью легких и застойной СН (Kmieć M. , Ochmański W., 1998; Компендиум 2010 — лекарственные препараты, 2010). У пациентов с застойной СН возможно применение молсидомина в качестве дополнения к терапии ингибиторами ангиотензинпревращающего фермента (АПФ), диуретиками, сердечными гликозидами, блокаторами β-адренорецепторов в случаях ее недостаточной эффективности (Мельник М.В., 2009).
, Ochmański W., 1998; Компендиум 2010 — лекарственные препараты, 2010). У пациентов с застойной СН возможно применение молсидомина в качестве дополнения к терапии ингибиторами ангиотензинпревращающего фермента (АПФ), диуретиками, сердечными гликозидами, блокаторами β-адренорецепторов в случаях ее недостаточной эффективности (Мельник М.В., 2009).
В исследовании А. Spring и соавторов (1998) отмечено значительное (с 33,8 до 44,8%; р<0,05) увеличение фракции выброса левого желудочка после 3 мес терапии молсидомином в дозе 2 мг 3 раза в сутки с сохранением предшествующего лечения (ингибиторы АПФ, диуретики и сердечные гликозиды) у 30 пациентов с хронической СН III и IV функционального класса по NYHA (New York Heart Association).
Таким образом, перечисленные свойства молсидомина позволяют применять его при ИБС — для профилактики приступов стенокардии (особенно у пациентов пожилого возраста и при индивидуальной непереносимости нитратов), а также в составе комбинированной терапии хронической СН. Уменьшение количества приступов стенокардии в течение суток вплоть до полного их устранения на фоне терапии молсидомином дает возможность пациентам сохранять не только повседневную, но и во многих случаях профессиональную активность, если она не связана с тяжелым физическим трудом, а положительная динамика физического и психологического статуса способствует существенному улучшению качества их жизни.
Уменьшение количества приступов стенокардии в течение суток вплоть до полного их устранения на фоне терапии молсидомином дает возможность пациентам сохранять не только повседневную, но и во многих случаях профессиональную активность, если она не связана с тяжелым физическим трудом, а положительная динамика физического и психологического статуса способствует существенному улучшению качества их жизни.
Литература
І.Б. Щербак
Резюме. У статті розглянуто переваги та обмеження терапії органічними нітратами, а також потенціальні можливості застосування альтернативних їм донорів оксиду азоту, а саме похідного сидноніміну — молсидоміну — у пацієнтів з ішемічною хворобою серця та хронічною серцевою недостатністю.
Ключові слова: ішемічна хвороба серця, хронічна серцева недостатність, стенокардія, антиангінальна терапія, органічні нітрати, дисфункція ендотелію,оксид азоту, толерантність до нітратів, молсидомін, Сиднофарм.
I.B. Shcherbak
Summary. The article discusses the advantages and limitations of organic nitrates therapy, as well as the potential use of alternative donors of nitric oxide, in particular sidnonimine derivate — molsidomin — in patients with coronary heart disease and chronic heart failure.
The article discusses the advantages and limitations of organic nitrates therapy, as well as the potential use of alternative donors of nitric oxide, in particular sidnonimine derivate — molsidomin — in patients with coronary heart disease and chronic heart failure.
Key words: coronary heart disease, chronic heart failure, angina, antianginal therapy, organic nitrates, endothelial dysfunction, nitric oxide, nitrate tolerance, molsidominе, Sydnopharm.
Азотодонорные лиганды — Катализаторы / Alfa Chemistry
NAVIGATION
- Продукты
- Катализатор из драгоценных металлов
- Хиральные катализаторы
- Лиганды
- Металлические катализаторы
- Неметаллические катализаторы
- Органокатализаторы
- Катализаторы межфазного переноса
- Фотокатализаторы
- Тип реакции
- Защитные катализаторы
- Нанокатализаторы
- Заказ
- Карьера
СВЯЗАТЬСЯ С НАМИ
- Главная
- Продукты
- Лиганды
- Лиганды-доноры азота
Лиганд-донор азота является одним из лигандов.
Рис. 1. Бизиминовый лиганд
Применение
С развитием координационной химии применение лигандов-доноров азота стало более распространенным. Лиганды-доноры азота обычно не используются сами по себе, но могут быть объединены с центральным атомом с образованием координационного комплекса, который можно использовать в различных приложениях.
- Оптический материал: Люминесцентный материал с координационным комплексом металлов, использующий лиганд-донор азота в качестве лиганда, представляет собой материал, который обладает как высокой квантовой эффективностью флуоресценции, так и хорошей стабильностью, и поэтому его будущее широко благоприятствует.
 Координационные комплексы лигандов-доноров азота с Cu(I) и редкоземельными металлами хорошо продемонстрированы с точки зрения люминесценции. Их можно использовать в качестве лигандов для синтеза металлоорганических координационных комплексов. Люминесцентный материал дает ссылку на улучшение или даже решение проблем плохой растворимости координационного комплекса и низкого квантового выхода. Кроме того, их также можно использовать для разработки электрохимических сенсоров за счет их взаимодействия с ДНК.
Координационные комплексы лигандов-доноров азота с Cu(I) и редкоземельными металлами хорошо продемонстрированы с точки зрения люминесценции. Их можно использовать в качестве лигандов для синтеза металлоорганических координационных комплексов. Люминесцентный материал дает ссылку на улучшение или даже решение проблем плохой растворимости координационного комплекса и низкого квантового выхода. Кроме того, их также можно использовать для разработки электрохимических сенсоров за счет их взаимодействия с ДНК. - Металлический катализатор: . Благодаря сильной координационной способности лигандов-доноров азота для ионов металлов он широко используется в синтезе и исследовании катализаторов на основе переходных металлов. А поскольку металлические катализаторы обладают хорошей каталитической активностью и селективностью, они широко используются во многих типах реакций органического синтеза. Например, координационный комплекс палладия бидентатного лиганда-донора азота катализирует реакцию карбонилирования; и координационный комплекс ногтя тридентатного лиганда-донора азота может катализировать реакцию переноса водорода и/или реакцию радикальной полимеризации с переносом атома.

- Антибактериальные средства: Большое значение имеет разработка и применение антибактериальных комплексов в синтетических волокнах и текстиле. Лиганды-доноры нейтрального азота и редкоземельные элементы могут образовывать антибактериальный координационный комплекс и оказывать определенное антибактериальное действие на такие бактерии, как Pseudomonas aeruginosa и Neisseria gonorrhoeae. Использование координационного комплекса в отделке синтетического волокна придает ткани сильный антибактериальный эффект широкого спектра действия.
- Разделительный агент для экстракции: Благодаря превосходству собственной структуры лиганды-доноры азота могут быть полностью сожжены после использования, что позволяет избежать преимуществ вторичных твердых загрязнителей в конце срока службы. Его можно использовать для разделения радиоактивных элементов лантаноидов и актиноидов.
Классификация
Лиганды-доноры азота можно разделить на монодентатные лиганды-доноры азота, бидентатные лиганды и мультидентатные лиганды-доноры азота в зависимости от количества N-координирующих атомов в лигандах-донорах азота. .
.
- Монодентатные лиганды-доноры азота: Монодентатные лиганды-доноры азота: Лиганды-доноры азота только с одним атомом координации N называются монодентатными азотсодержащими лигандами.
- Бидентатные лиганды-доноры азота: Лиганды-доноры азота с двумя координирующими атомами азота называются бидентатными азотсодержащими лигандами
- Мультидентатные лиганды-доноры азота: координирующие атомы называются мультидентатными лигандами-донорами азота.
Ссылки
- Кавамура. (2018). «Извлечение и извлечение иона мягкого металла пористым кремнеземом, покрытым гидрофильным полимерным гелем с шестивалентным лигандом-донором азота». Science and Technology (Филадельфия, Пенсильвания, США) 53(9), 1319-1326.
- Гуань, Лей. (2014) . «Синтез, кристаллические структуры и свойства двух твердых люминесцентных материалов комплексов, содержащих N-донорные лиганды».
 Жэньгун Цзинти Сюэбао 43(11), 3049-3054.
Жэньгун Цзинти Сюэбао 43(11), 3049-3054. - Chen, Bingfeng. (2012). «Самособирающиеся наноструктуры Ag6[PV3Mo9O40] с N-донорными лигандами и их каталитическая активность». RSC Advances 2(30),1449-1456.
※ Обратите внимание, что наши услуги предназначены только для исследовательских целей.
Влияние доноров азота на негемовые модели железа супероксидредуктазы: высокоспиновые комплексы FeIII-OOR
1. Niviere V, Fontecave M. J Biol Inorg Chem. 2004; 9: 119–123. [PubMed] [Академия Google]
2. Kurtz DM., Jr J Inorg Biochem. 2006; 100: 679–93. [PubMed] [Google Scholar]
3. Дей А., Дженни Ф.Е., Адамс М.В.В., Джонсон М.К., Ходжсон К.О., Хедман Б., Соломон Э.И. J Am Chem Soc. 2007; 129:12418–12431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Huang VW, Emerson JP, Kurtz DM., Jr Biochemistry. 2007;46:11342–11351. [PubMed] [Google Scholar]
5. Kovacs JA, Brines LM. Acc Chem Res. 2007; 40: 501–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Mathé C, Weill CO, Mattioli TA, Berthomieu C, Houee-Levin C, Tremey E, Nivière V. J Biol Chem. 2007; 282:22207–22216. [PubMed] [Академия Google]
7. Моура И., Паулета С.Р., Моура Дж.Дж.Г. J Biol Inorg Chem. 2008; 13:1185–1195. [PubMed] [Google Scholar]
8. Катона Г., Карпентье П., Нивьер В., Амара П., Адам В., Охана Дж., Цанов Н., Буржуа Д. Наука. 2007; 316: 449–453. [PubMed] [Google Scholar]
9. Clay MD, Yang TC, Jenney FE, Kung IY, Cosper CA, Krishnan R, Kurtz DM, Jr, Adams MWW, Hoffman BM, Johnson MK. Биохимия. 2006; 45: 427–438. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Перейра А.С., Таварес П., Фолгоса Ф., Алмейда Р.М., Моура И., Моура Дж.Дж. Eur J Inorg Chem. 2007:2569–2581. [Google Scholar]
11. Слигарь С.Г., Макрис Т.М., Денисов И.Г. Biochem Biophys Res Commun. 2005; 338: 346–354. [PubMed] [Google Scholar]
12. Shaik S, Kumar D, de Visser SP, Altun A, Thiel W.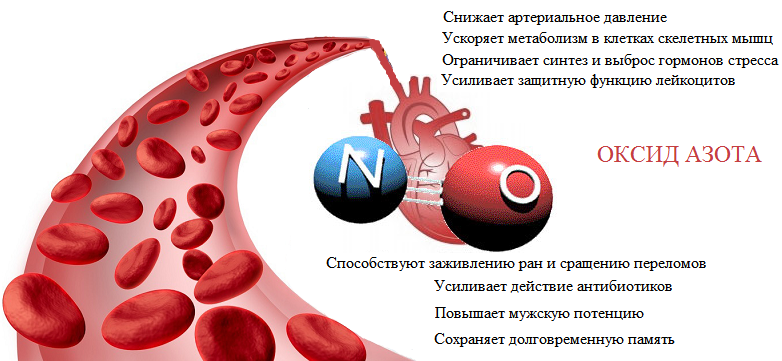 Chem Rev. 2005;105:2279–2328. [PubMed] [Google Scholar]
Chem Rev. 2005;105:2279–2328. [PubMed] [Google Scholar]
13. Лоу Г.Х., Харрис Д.Л. Chem Rev. 2000; 100:407–419. [PubMed] [Google Scholar]
14. Денисов И.Г., Макрис Т.М., Слигар С.Г., Schlichting I. Chem Rev. 2005;105:2253–2277. [PubMed] [Google Scholar]
15. Ленерт Н., Хо РИН, Кью Л. мл., Соломон Э.И. J Am Chem Soc. 2001; 123:12802–12816. [PubMed] [Академия Google]
16. Ленерт Н., Хо РИН, Кью Л., младший, Соломон Э.И. J Am Chem Soc. 2001; 123:8271–8290. [PubMed] [Google Scholar]
17. Silaghi-Dumitrescu R, Silaghi-Dumitrescu L, Coulter ED, Kurtz DM., Jr Inorg Chem. 2003; 42: 446–456. [PubMed] [Google Scholar]
18. Roelfes G, Vrajmasu V, Chen K, Ho RYN, Rohde JU, Zondervan C, la Crois RM, Schudde EP, Lutz M, Spek AL, Hage R, Feringa BL, Münck E , Que L., Jr Inorg Chem. 2003;42:2639–2653. [PubMed] [Google Scholar]
19. Clay MD, Jenney FE, Jr, Hagedoorn PL, George GN, Adams MWW, Johnson MK. J Am Chem Soc. 2002; 124: 788–805. [PubMed] [Академия Google]
20. Bukowski MR, Halfen HL, van den Berg TA, Halfen JA, Que L., Jr Angew Chem Int Ed. 2005; 44: 584–587. [PubMed] [Google Scholar]
Bukowski MR, Halfen HL, van den Berg TA, Halfen JA, Que L., Jr Angew Chem Int Ed. 2005; 44: 584–587. [PubMed] [Google Scholar]
21. Ogliaro F, de Visser SP, Shaik S. J Inorg Biochem. 2002; 91: 554–567. [PubMed] [Google Scholar]
22. Horner O, Mouesca JM, Oddou JL, Jeandey C, Niviere V, Mattioli TA, Mathe C, Fontecave M, Maldivi P, Bonville P, Halfen JA, Latour JM. Биохимия. 2004; 43:8815–8825. [PubMed] [Google Scholar]
23. Mathé C, Nivière V, Houee-Levin C, Mattioli TA. Биофиз хим. 2006;119: 38–48. [PubMed] [Google Scholar]
24. Mathé C, Mattioli TA, Horner O, Lombard M, Latour JM, Fontecave M, Nivière V. J Am Chem Soc. 2002; 124:4966–4967. [PubMed] [Google Scholar]
25. Namuswe F, Kasper GD, Sarjeant AAN, Hayashi T, Krest CM, Green MT, Moënne-Loccoz P, Goldberg DP. J Am Chem Soc. 2008; 130:14189–14200. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Brines LM, Kovacs JA. Eur J Inorg Chem. 2007: 29–38. [Google Scholar]
27. Ковач Дж.А. Chem Rev. 2004; 104:825–848. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ковач Дж.А. Chem Rev. 2004; 104:825–848. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Фидлер А.Т., Халфен Х.Л., Халфен Дж.А., Брунольд Т.С. J Am Chem Soc. 2005; 127:1675–1689. [PubMed] [Google Scholar]
29. Halfen JA, Moore HL, Fox DC. Неорг хим. 2002;41:3935–3943. [PubMed] [Google Scholar]
30. Berry JF, Bill E, Garcia-Serres R, Neese F, Weyhermüller T, Wieghardt K. Inorg Chem. 2006;45:2027–2037. [PubMed] [Google Scholar]
31. Che CM, Wong KY, Poon CK. Неорг хим. 1986; 25: 1809–1813. [Google Scholar]
32. Meyerstein D. Coord Chem Rev. 1999;186:141–147. [Google Scholar]
33. Китагава Т., Дей А., Луго-Мас П., Бенедикт Дж. Б., Каминский В., Соломон Э., Ковач Дж. А. J Am Chem Soc. 2006; 128:14448–14449. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Krishnamurthy D, Kasper GD, Namuswe F, Kerber WD, Sarjeant AAN, Moënne-Loccoz P, Goldberg DP. J Am Chem Soc. 2006; 128:14222–14223. [PubMed] [Google Scholar]
35. Walling C, Buckler SA. J Am Chem Soc. 1955; 77: 6032–6038. [Google Scholar]
Walling C, Buckler SA. J Am Chem Soc. 1955; 77: 6032–6038. [Google Scholar]
36. Suh Y, Seo MS, Kim KM, Kim YS, Jang HG, Tosha T, Kitagawa T, Kim J, Nam W. J Inorg Biochem. 2006; 100: 627–633. [PubMed] [Академия Google]
37. CrysAlis PRO. Оксфорд Дифракшн Лтд.; Вроцлав, Польша: [Google Scholar]
38. Шелдрик GM. ШЕЛХТЛ версии 6.10. Брукер AXS Inc.; Мэдисон, Висконсин, США: 2000. [Google Scholar]
39. Бхаттачарья П.К. Далтон Транс. 1980: 810–812. [Google Scholar]
40. Hay RW, Tarafder MTH. Далтон Транс. 1991: 823–827. [Google Scholar]
41. Ислам М.С., Уддин М.М. Многогранник. 1993; 12: 423–426. [Google Scholar]
42. Хунг Ю., Буш Д.Х. J Am Chem Soc. 1977;99:4977–4984. [Google Scholar]
43. Addison AW, Rao TN, Reedjik J, van Rijn J, Verschoor GC. Далтон Транс. 1984: 1349–1456. [Google Scholar]
44. Mak TCW, Che CM, Wong KY. хим. коммун. 1985: 986–988. [Google Scholar]
45. Che CM, Wong KY, Mak TCW. хим. коммун. 1985: 546–548. [Google Scholar]
1985: 546–548. [Google Scholar]
46. Rohde JU, In JH, Lim MH, Brennessel WW, Bukowski MR, Stubna A, Münck E, Nam W, Que L., Jr Science. 2003; 299:1037–1039. [PubMed] [Академия Google]
47. Кришнамурти Д., Сарджант А.Н., Гольдберг Д.П., Канески А., Тотти Ф., Захаров Л.Н., Рейнгольд А.Л. Chem Eur J. 2005; 11:7328–7341. [PubMed] [Google Scholar]
48. Мукерджи Р.Н., Абрахамсон А.Дж., Паттерсон Г.С., Stack TDP, Холм Р.Х. Неорг хим. 1988; 27: 2137–2144. [Google Scholar]
49. Zang Y, Que L., Jr Inorg Chem. 1995; 34:1030–1035. [Google Scholar]
50. Адам В., Руайан А., Нивьер В., Молина-Эредиа Ф.П., Буржуа Д. Структура. 2004; 12:1729–1740. [PubMed] [Академия Google]
51. Сантос-Сильва Т., Тринкао Дж., Карвалью А.Л., Бонифачо С., Ошере Ф., Ралейрас П., Моура И., Моура Дж.Дж.Г., Ромао М.Дж. J Biol Inorg Chem. 2006; 11: 548–558. [PubMed] [Google Scholar]
52. Yeh AP, Hu YL, Jenney FE, Jr, Adams MWW, Rees DC. Биохимия. 2000; 39: 2499–2508. [PubMed] [Google Scholar]
53. Golub G, Cohen H, Paoletti P, Bencini A, Meyerstein D. Dalton Trans. 1996: 2055–2060. [Google Scholar]
Golub G, Cohen H, Paoletti P, Bencini A, Meyerstein D. Dalton Trans. 1996: 2055–2060. [Google Scholar]
54. Golub G, Zilbermann I, Cohen H, Meyerstein D. Supramol Chem. 1996;6:275–279. [Google Scholar]
55. Clark T, Hennemann M, van Eldik R, Meyerstein D. Inorg Chem. 2002;41:2927–2935. [PubMed] [Google Scholar]
56. Jovanovic T, Ascenso C, Hazlett KRO, Sikkink R, Krebs C, Litwiller R, Benson LM, Moura I, Moura JJG, Radolf JD, Huynh BH, Naylor S, Rusnak F. Дж. Биол. Хим. 2000; 275:28439–28448. [PubMed] [Google Scholar]
57. Rodrigues JV, Saraiva LM, Abreu IA, Teixeira M, Cabelli DE. J Biol Inorg Chem. 2007; 12: 248–256. [PubMed] [Академия Google]
58. Tavares P, Ravi N, Moura JJG, LeGall J, Huang YH, Crouse BR, Johnson MK, Huynh BH, Moura I. J Biol Chem. 1994; 269:10504–10510. [PubMed] [Google Scholar]
59. Jensen MP, Costas M, Ho RYN, Kaizer J, Payeras AMI, Münck E, Que L, Jr, Rohde JU, Stubna A. J Am Chem Soc. 2005; 127:10512–10525. [PubMed] [Google Scholar]
60. Jensen MP, Payeras AMI, Fiedler AT, Costas M, Kaizer J, Stubna A, Münck E, Que L., Jr Inorg Chem. 2007; 46: 2398–2408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Jensen MP, Payeras AMI, Fiedler AT, Costas M, Kaizer J, Stubna A, Münck E, Que L., Jr Inorg Chem. 2007; 46: 2398–2408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Menage S, Wilkinson EC, Que L, Jr, Fontecave M. Angew Chem Int Ed. 1995; 34: 203–205. [Google Scholar]
62. Kennepohl P, Neese F, Schweitzer D, Jackson HL, Kovacs JA, Solomon EI. Неорг хим. 2005; 44: 1826–1836. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Kim J, Zang Y, Costas M, Harrison RG, Wilkinson EC, Que L., Jr J Biol Inorg Chem. 2001; 6: 275–284. [PubMed] [Google Scholar]
64. Bazzicalupi C, Bencini A, Cohen H, Giorgi C, Golub G, Meyerstein D, Navon N, Paoletti P, Valtancoli B. Dalton Trans. 1998: 1625–1631. [Google Scholar]
65. Бернхардт П.В. J Am Chem Soc. 1997; 119: 771–774. [Google Scholar]
66. Golub G, Cohen H, Paoletti P, Bencini A, Messori L, Bertini I, Meyerstein D. J Am Chem Soc. 1995; 117:8353–8361. [Google Scholar]
67. Jubran N, Ginzburg G, Cohen H, Koresh Y, Meyerstein D. Inorg Chem. 1985; 24: 251–258. [Google Scholar]
Inorg Chem. 1985; 24: 251–258. [Google Scholar]
68. Вагнер Ф., Бэрфилд Э.К. Неорг хим. 1976; 15: 408–417. [Google Scholar]
69. Weisser JT, Nilges MJ, Sever MJ, Wilker JJ. Неорг хим. 2006; 45:7736–7747. [PubMed] [Академия Google]
70. Aasa R, Vänngård T. J Magn Reson. 1975; 19: 308–315. [Google Scholar]
71. Бу-Абдаллах Ф., Честин Н.Д. J Biol Inorg Chem. 2008; 13:15–24. [PubMed] [Google Scholar]
72. Ленерт Н., Фудзисава К., Соломон Э.И. Неорг хим. 2003; 42: 469–481. [PubMed] [Google Scholar]
73. Эксперименты, направленные на то, чтобы лучше охарактеризовать состояние координации железа (III) транс с алкилпероксолигандом у пурпурных видов, не дали результатов. В частности, добавление бензолсульфината натрия, вероятного продукта окисления фенилтиолатного лиганда, к 3a не превращал этот вид в пурпурный комплекс (514 нм). Точно так же добавление трифлата натрия к пурпурным видам не превращало последние виды в 3a .

