Энергетические системы организма и целенаправленная тренировка
Главная / Статьи / Энергетические системы организма и целенаправленная тренировка
Мониторинг частоты сердечных сокращений (ЧСС), совместно или без контроля уровня молочной кислоты (лактата), — на сегодняшний день неотъемлемый элемент тренировки, позволяющий спортсмену и наставнику подобрать оптимальную интенсивность, что позволяет при меньших нагрузках добиваться более высоких результатов. Эффективная тренировка, ведущая к высоким достижениям, возможна только при хорошем знании и правильном применении принципов энергообеспечения физической деятельности.
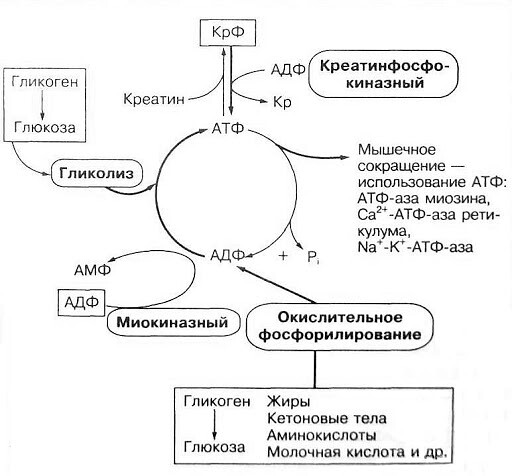
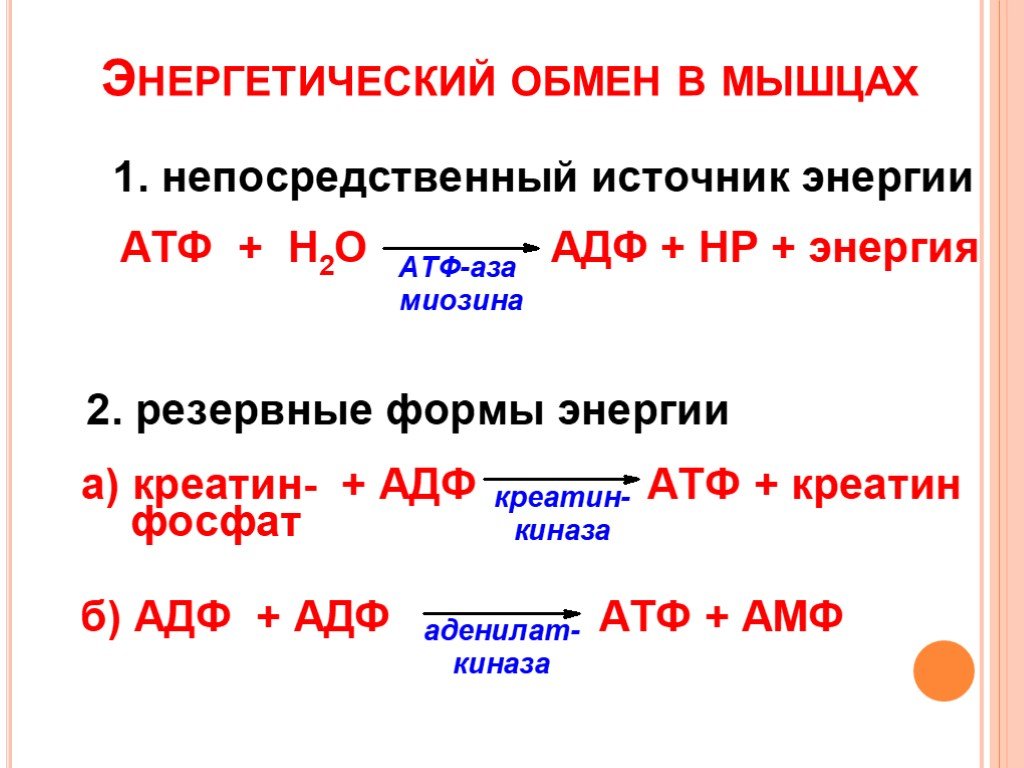
Энергетические системыАденозинтрифосфат (АТФ) в организме человека является универсальным источником энергии, которая высвобождается при распаде АТФ до аденозинфосфата (АДФ) и используется мышцами для выполнения механической работы. Запасы АТФ в мышцах незначительны, расходуются за 2 секунды. Системы ресинтеза АТФ (фосфатная, лактатная и кислородная) поддерживают относительное постоянство этого вещества.
Фосфатная система ресинтеза АТФ (анаэробная, алактатная) включает использование запасов АТФ в мышцах (2сек) и быстрое восстановление АТФ из креатинфосфата (КрФ), которого хватит ещё на 6-8 секунд. Система важна для всех взрывных, кратковременных и стремительных действий. Уже через 30 секунд после нагрузки АТФ и КрФ восстанавливаются на 70%, а через 3-5 минут полностью. Важно — направленная тренировка соответствующими упражнениями с достаточными периодами отдыха не только повышает запасы АТФ и КрФ, но и ускоряет процесс распада и восстановления АТФ за счёт увеличения ферментативной базы, поэтому и представителям стайерских дисциплин полезно регулярно включать в основную тренировку краткие (не более 10 с), мощные, быстрые упражнения.
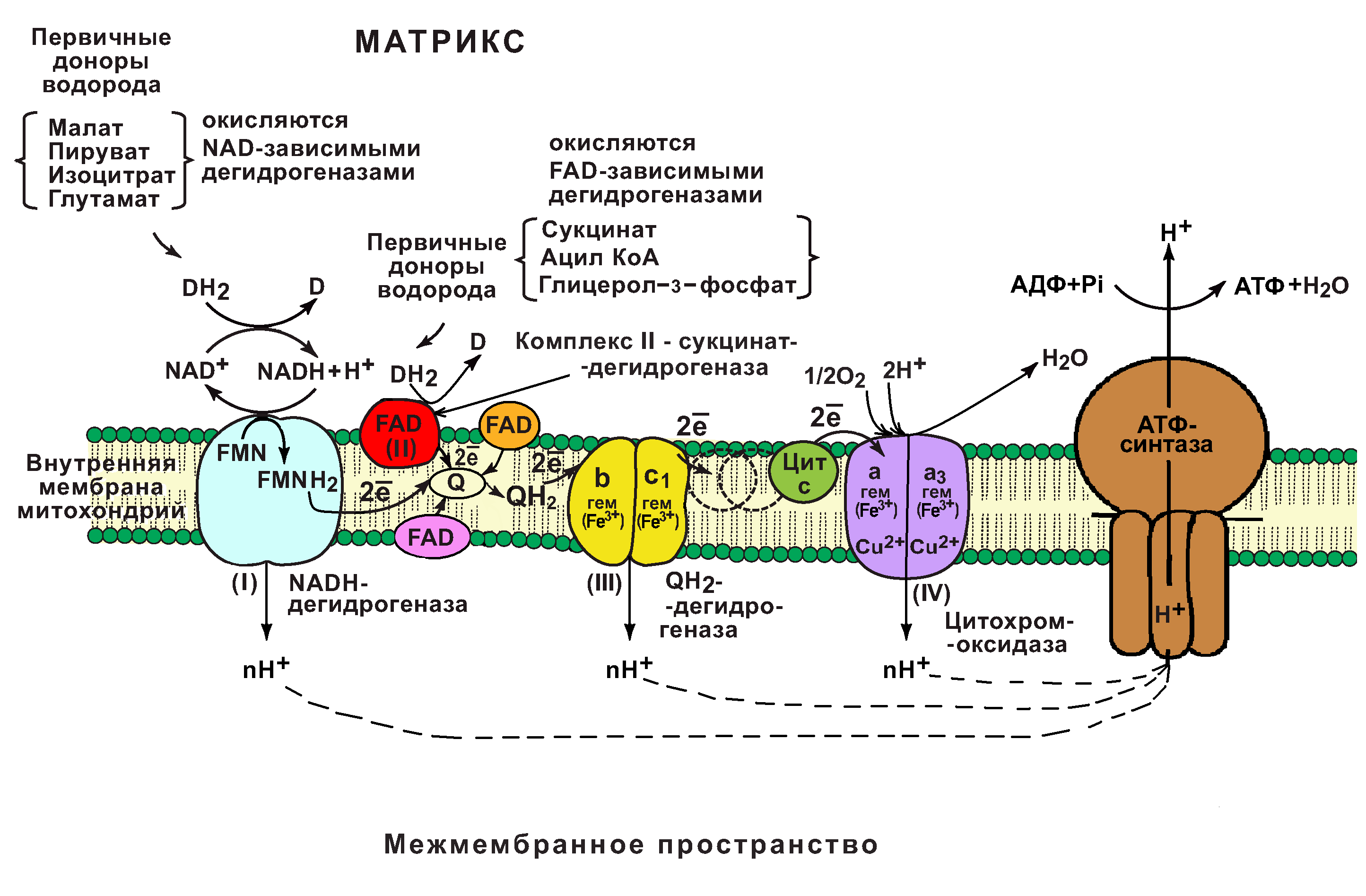
Кислородная система ресинтеза АТФ (аэробная) является наиболее важной в тренировках на выносливость, поскольку она может поддерживать физическую работу в течение длительного времени, снабжая энергией посредством химического взаимодействия пищевых веществ (главным образом, жиров и углеводов) с кислородом.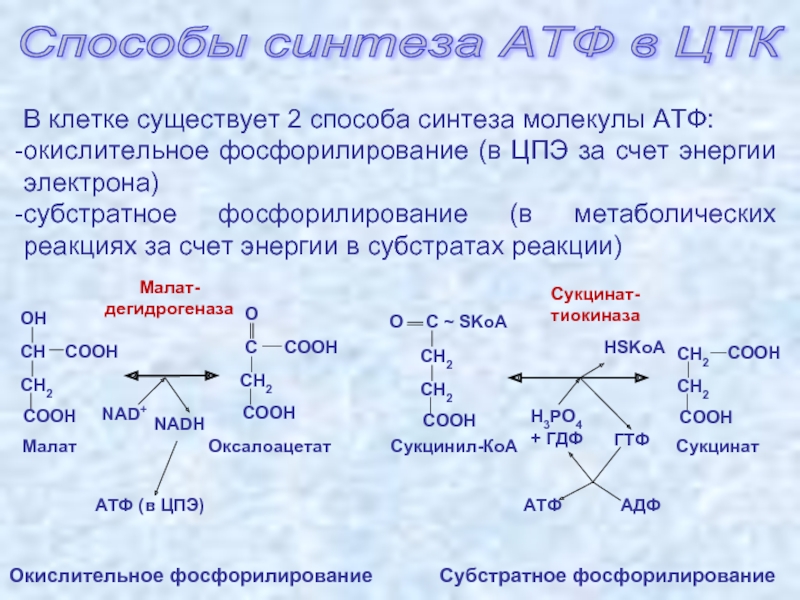 Производительность кислородной системы зависит от количества кислорода, которое способен усвоить организм человека (МПК – максимальное потребление кислорода). Углеводы — более эффективное топливо по сравнению с жирами, т.к. при одинаковом потреблении энергии на их окисление требуется на 12% меньше кислорода, но запасов углеводов (гликоген печени и мышц) хватит на 60-90 минут активности, запасы жира практически неисчерпаемы, при окислении не образуется лактат. Чем выше интенсивность нагрузки, тем больше вклад углеводов в энергообразование. Но при одинаковой интенсивности аэробной нагрузки тренированный спортсмен будет использовать больше жиров и меньше углеводов, чем не тренированный, т.е. будет расходовать энергию более экономно. Важно – обязательное включение длительных медленных тренировок в видах на выносливость.
Производительность кислородной системы зависит от количества кислорода, которое способен усвоить организм человека (МПК – максимальное потребление кислорода). Углеводы — более эффективное топливо по сравнению с жирами, т.к. при одинаковом потреблении энергии на их окисление требуется на 12% меньше кислорода, но запасов углеводов (гликоген печени и мышц) хватит на 60-90 минут активности, запасы жира практически неисчерпаемы, при окислении не образуется лактат. Чем выше интенсивность нагрузки, тем больше вклад углеводов в энергообразование. Но при одинаковой интенсивности аэробной нагрузки тренированный спортсмен будет использовать больше жиров и меньше углеводов, чем не тренированный, т.е. будет расходовать энергию более экономно. Важно – обязательное включение длительных медленных тренировок в видах на выносливость.
Распад углеводов происходит в два этапа, на первом, протекающем без участия кислорода, образуется молочная кислота (лактат), которая используется в ресинтезе АТФ на втором этапе с участием кислорода. Пока потребляемого кислорода достаточно, молочная кислота не будет накапливаться в организме. Важно – элиминация лактата, основанная на его использовании на втором этапе углеводного энергообеспечения лежит в основе обязательных низкоинтенсивных заминок, активного отдыха и восстановительных тренировок.
Пока потребляемого кислорода достаточно, молочная кислота не будет накапливаться в организме. Важно – элиминация лактата, основанная на его использовании на втором этапе углеводного энергообеспечения лежит в основе обязательных низкоинтенсивных заминок, активного отдыха и восстановительных тренировок.
Итак, при росте интенсивности нагрузки и недостатке кислорода молочная кислота, образовавшаяся в первой анаэробной фазе, не нейтрализуется полностью во второй, аэробной, в результате накапливается в работающих мышцах, что приводит к ацидозу, или закислению мышц, основной причине мышечной усталости. При превышении определённого уровня интенсивности (который варьируется от человека к человеку) происходит активация механизма, посредством которого организм переходит на полностью анаэробное энергообеспечение, где в качестве источника используются исключительно углеводы. Ускорение, подъём, финишный рывок – за них ответственна лактатная система. При нарастающем ацидозе спортсмен не способен поддерживать тот же уровень нагрузки, что приводит достаточно быстро к резкому снижению интенсивности или отказу выполнять нагрузку.
Важно – в самом начале любого упражнения, независимо от его интенсивности энергообеспечение происходит только анаэробным путём. Каждый раз организму требуется несколько минут, чтобы аэробная система включилась в работу. Соответственно, разминка обязательна.
Ацидоз повреждает аэробную ферментативную систему мышечной клетки, что снижает аэробные способности. Если клетки повреждены ацидозом, то может потребоваться несколько дней, прежде чем ферментативная система начнёт снова нормально функционировать и аэробные возможности восстановятся, а аэробные тренировки будут эффективными. Повреждение мышечных стенок в результате ацидоза является причиной утечки веществ из мышечных клеток в кровь, замедляется образование КрФ, нарушается работа сократительного аппарата, страдает координация, тренировки на технику или скорость неэффективны, возрастает риск травм.
Типы мышечных волоконУсловно мышечные волокна разделяются на два типа: красные (тип1, медленно сокращающиеся) и белые (тип2, быстро сокращающиеся). Между мужчинами и женщинами не существует разницы в соотношении быстрых и медленных мышечных волокон, реакция на тренировку одинаковая. Красные мышечные волокна густо усеяны капиллярами, снабжаются энергией преимущественно аэробно, важны в видах на выносливость. Белые мышечные волокна (выделяют так же подтип2а – анаэробно-аэробные и подтип2в – анаэробные) обладают высокой анаэробной способностью, поэтому максимально используются в скоростно-силовых видах. Соотношение белых и красных волокон у отдельного человека генетически детерминировано, т.е. практически мы изначально рождаемся либо стайерами, либо спринтерами. Под воздействием тренировок некоторое количество белых волокон могут превратиться в красные, к сожалению, обратное действие невозможно. Выраженный стайер никогда не станет спринтером, а у спринтера есть шанс стать хорошим стайером. С возрастом спринтерские способности спортсмена снижаются быстрее, чем способности к выполнению длительной работы. Важно – в видах на выносливость обязательно находить время для скоростно-силовых тренировок, чтобы поддерживать соответствующие качества на достойном уровне.
Между мужчинами и женщинами не существует разницы в соотношении быстрых и медленных мышечных волокон, реакция на тренировку одинаковая. Красные мышечные волокна густо усеяны капиллярами, снабжаются энергией преимущественно аэробно, важны в видах на выносливость. Белые мышечные волокна (выделяют так же подтип2а – анаэробно-аэробные и подтип2в – анаэробные) обладают высокой анаэробной способностью, поэтому максимально используются в скоростно-силовых видах. Соотношение белых и красных волокон у отдельного человека генетически детерминировано, т.е. практически мы изначально рождаемся либо стайерами, либо спринтерами. Под воздействием тренировок некоторое количество белых волокон могут превратиться в красные, к сожалению, обратное действие невозможно. Выраженный стайер никогда не станет спринтером, а у спринтера есть шанс стать хорошим стайером. С возрастом спринтерские способности спортсмена снижаются быстрее, чем способности к выполнению длительной работы. Важно – в видах на выносливость обязательно находить время для скоростно-силовых тренировок, чтобы поддерживать соответствующие качества на достойном уровне.
Тренировка должна быть направлена именно на ту энергетическую систему, которая участвует в энергообеспечении конкретной спортивной деятельности. Результаты марафонца зависят от его способности выполнять длительную работу, поэтому его тренировки должны быть нацелены на совершенствование кислородной системы и расширение аэробных способностей. Для спринтера важны максимальные возможности его фосфатной системы, поэтому его тренировки должны быть направлены на увеличение числа высокоэнергетических фосфатов. В некоторых видах, например в беге на средние дистанции (400, 800, 1500м), лыжном спринте требуется тренировка все систем энергообеспечения, требуются высокие анаэробно-аэробные способности, спортсмены должны учиться бороться с сильным ацидозом.
Таблица 1. Зависимость подключения энергосистем от продолжительности нагрузки.
| Продолжительность | Скорость. Фосфатная система Фосфатная система | Аэробные способности. Кислородная система | Анаэробные способности: фосфатная и лактатная системы |
| 130 – 180 мин | 0 | 95 | 5 |
| 28 – 50 мин | 5 | 80 | 15 |
| 14 – 26 мин | 10 | 70 | 20 |
| 9 – 16 мин | 20 | 40 | 40 |
| 4 – 6 мин | 20 | 35 | 55 |
| 2 – 3 мин | 30 | 5 | 65 |
| 1 – 1,5 мин | 80 | 5 | 15 |
| 22 – 35 с | 98 | 0 | 2 |
| 10 – 16 с | 98 | 0 | 2 |
Зависимость между продолжительностью нагрузки и относительным вкладом различных энергетических систем применима к любому виду спорта. Подключение той или иной энергетической системы зависит от продолжительности нагрузки. Например, для бега на 1 500м (продолжительность 4 – 6 мин) 20% тренировок должно быть направлено на совершенствование фосфатной системы (спринтерские тренировки), 25% — на повышение аэробной выносливости и 55% — на повышение анаэробных возможностей.
Итак, тренировка должна выполняться при определённой (для каждого вида спорта) интенсивности, которая измеряется в разных величинах — % от максимальной ЧСС (ЧССмах) или % от анаэробного порога (АнП). АнП обозначается нагрузка, выше которой организм переключается с аэробного на частично анаэробное. Международные обозначения зон интенсивности следующие: аэробная (А), развивающая (Е от endurance – выносливость, чуть выше анаэробного порога) и анаэробная (Аn). Каждая из трех зон разделяется на 2 подзоны. Существует так же восстановительная зона (R – recreation).
Таблица 2. Зоны интенсивности.
| Зона инс-ти | Характеристика | % от АнП | % от ЧССмах |
| R | Восстановительная, очень низкая интенсивность | 70 — 80 | 60 – 70 |
| A1 | Аэробная 1, низкая интенсивность | 80 — 90 | 70 — 80 |
| A2 | Аэробная 2, средняя интенсивность | 90 — 95 | 80 – 85 |
| E1 | Развивающая 1, транзитная зона | 95 — 100 | 85 – 90 |
| E2 | Развивающая 2, высокоинтенсивная выносливость | 100 — 110 | 90 – 95 |
| An1 | Анаэробная, основана на гликолизе | максимальное энергообеспечение – 2-3 мин | |
| An2 | Анаэробная 2, основана на фосфатах | Максимальное энергобеспечение – до 10с |
Главная цель – истощение высокоэнергетических фосфатов без накопления молочной кислоты. Лучший способ – спринты на максимальной (продолжительность отрезка 6-8сек) или субмаксимальной (20-30с) скоростях, выполняемые повторно (8-10раз) с большими паузами пассивного отдыха (3-5 мин в зависимости от подготовленности). Выполнение лёгкой нагрузки во время отдыха частично блокирует ресинтез АТФ и КрФ, приводит к их недостаточным запасам для следующего ускорения, активации анаэробной системы и накоплению лактата. Руководствуясь показателями ЧСС, управлять спринтерской тренировкой и вносить коррективы невозможно, для этого лучше использовать показатели лактата.
Лучший способ – спринты на максимальной (продолжительность отрезка 6-8сек) или субмаксимальной (20-30с) скоростях, выполняемые повторно (8-10раз) с большими паузами пассивного отдыха (3-5 мин в зависимости от подготовленности). Выполнение лёгкой нагрузки во время отдыха частично блокирует ресинтез АТФ и КрФ, приводит к их недостаточным запасам для следующего ускорения, активации анаэробной системы и накоплению лактата. Руководствуясь показателями ЧСС, управлять спринтерской тренировкой и вносить коррективы невозможно, для этого лучше использовать показатели лактата.
Основная цель — совершенствование способности спортсмена выполнять упражнение при высоких концентрациях лактата. Интенсивные тренировки в анаэробной зоне, лучший – интервальный метод, оптимальная продолжительность отрезков максимального усилия от 30с до 3-х минут, активный отдых от 30с до нескольких минут, концентрация лактата не должна снижаться слишком сильно. Важно — после напряжённых анаэробных нагрузок обязательны очень лёгкие восстановительные тренировки.
Лучший метод – тренировки на выносливость, то есть нагрузки с субмаксимальной мощностью в течение длительного времени без накопления лактата.
Интенсивная аэробная тренировка выполняется в виде интервальной работы (с короткими или длинными рабочими отрезками). В первом случае кислородная система полностью активируется, ЧСС 90% ЧССмах, т.е. на уровне или чуть выше анаэробного порога, отрезки 2-8 мин., количество интервалов 5 -8, отдых 4-6 мин., небольшое повышение лактата до 5-6 ммоль/л допустимо. Во втором случае, ЧСС 85-90% ЧССмах, отрезки 8-20 мин., количество 4-5, отдых 5 мин, лактат 3-4 ммоль/л. Данные тренировка не должна проводиться чаще 1-2 раз в неделю. Эффективны при хорошем самочувствии. При сопутствующей усталости или недостаточном восстановлении резко возрастает опасность перетренировки.
Промежуточная аэробная тренировка выполняется со средней интенсивностью (80-85% ЧССмах), лактат не накапливается, продолжительность зависит от соревнований, к которым готовиться спортсмен. Соревновательная дистанция обычно преодолевается 1 раз за неделю.
Соревновательная дистанция обычно преодолевается 1 раз за неделю.
Экстенсивная аэробная тренировка представляет длительную непрерывную работу при ЧСС 70-80% ЧССмах продолжительностью от 90 мин, тренируют жировой обмен, часто совмещают с промежуточной аэробной тренировкой.
Восстановительная тренировкаНеотъемлемая часть общего тренировочного процесса. Работа при интенсивности менее 70% от ЧССмах не улучшает аэробные способности, но в большинстве случаев более выгодна для восстановления, чем пассивный отдых (см.выше).
*По книге — ЧСС, ЛАКТАТ И ТРЕНИРОВКИ НА ВЫНОСЛИВОСТЬ. П.ЯНСЕН. ТУЛОМА 2007г.
В книге изложены теория, практика и анализ тренировки спортсменов на выносливость на основе мониторинга частоты сердечных сокращений (ЧСС) и уровня молочной кислоты (лактата) в крови, приведены тесты нахождения анаэробного порога и оценки функционального состояния, обсуждаются проблемы перетренированности и спортивного сердца.
Гейнеры Аминокислоты комплексные BCAA Предтрен.  комплексы комплексы Витамины Сжигатели жира Энергетики Для связок и суставов Спец препараты Другие |
АТФ представляет собой источник внутриклеточной энергии, контролирующий почти все функции мышц и определяющий уровень силы и выносливости. Факт в том, что интенсивный тренинг бодибилдера исчерпывает запасы АТФ в мышцах. И это состояние опустошенности может длиться несколько дней, препятствуя росту мышц. В частности, перетренированность является результатом длительного нахождения организма в состоянии истощения запасов АТФ. Для того, чтобы восстановить уровень АТФ в мышцах, вы должны научиться эффективно использовать различные стимуляторы повышения уровня АТФ. Уровень АТФ во время тренировки Для мышечных сокращений используется энергия АТФ, содержащегося в мышечных клетках. Однако, при интенсивных сокращениях запас этого «горючего» быстро исчерпывается. Именно по этой причине вы не можете вечно продолжать вырабатывать такое же усилие. Чем тяжелее вы тренируетесь, тем больше АТФ вам требуется. В действительности, уровень АТФ является одним из самых лимитирующих факторов в тренинге. Он сокращает количество стимулирующих рост повторений в каждом сете. Для того, чтобы возместить отсутствие интенсивности в конце сета, вы выполняете большее число сетов, что в результате дает значительный объем неэффективной работы с низкой интенсивностью. 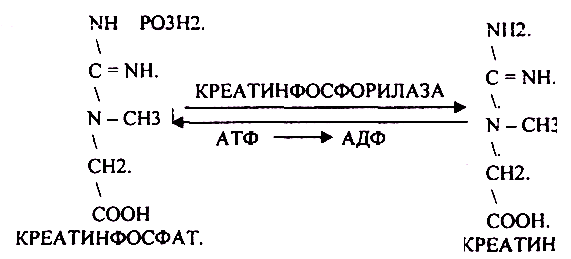 После 30 секунд выработки таких усилий уровень АТФ находится на отметке 50%. Поэтому вы все еще далеки до полного исчерпания запасов АТФ. Но даже небольшого снижения его уровня достаточно для того, чтобы не позволить мышцам сокращаться с такой мощностью, как вам бы хотелось. Конечно, запасы АТФ все больше и больше снижаются, когда вы выполняете более одного сета. Исследования показали, что 4-х минут отдыха было недостаточно для полного восстановления уровня АТФ в волокнах типа 2 после 30 секунд мышечных сокращений (2). Следовательно, когда вы начинаете второй сет, резерв АТФ в мышцах не оптимален. По мере того, как вы выполняете все больше и больше подходов, уровень АТФ становится все меньше. После 30 секунд выработки таких усилий уровень АТФ находится на отметке 50%. Поэтому вы все еще далеки до полного исчерпания запасов АТФ. Но даже небольшого снижения его уровня достаточно для того, чтобы не позволить мышцам сокращаться с такой мощностью, как вам бы хотелось. Конечно, запасы АТФ все больше и больше снижаются, когда вы выполняете более одного сета. Исследования показали, что 4-х минут отдыха было недостаточно для полного восстановления уровня АТФ в волокнах типа 2 после 30 секунд мышечных сокращений (2). Следовательно, когда вы начинаете второй сет, резерв АТФ в мышцах не оптимален. По мере того, как вы выполняете все больше и больше подходов, уровень АТФ становится все меньше.Что происходит с АТФ после тренировки После завершения тренировки резервы АТФ могут быть значительно сокращены. Когда вы отдыхаете, вы, возможно, ожидаете, что ваши мышцы получают возможность восстановиться. Ведь потребность в АТФ в это время снижается, а выработка увеличивается. Однако, помните, что в начале периода восстановления уровень АТФ низкий, поэтому его возвращение к нормальному займет некоторое время. АТФ и диета Процесс тренинга и мышечного развития довольно труден даже тогда, когда вы нормально питаетесь. Но ведь культуристам время от времени приходится соблюдать низкоуглеводную диету. Вы можете себе представить, как сокращение приема пищи влияет на энергетический уровень в клетке. Во время длительной ограничительной диеты энергетическое равновесие в мышцах нарушается, что еще более усложняет поддержание нормального уровня АТФ. Это приводит к снижению силы при тренинге и длительному восстановлению после тренировки. Помимо основной функции обеспечения энергией мышечных сокращений и контроля содержания электролитов в мышцах, АТФ выполняет множество других функций в мышцах. Например, он контролирует скорость синтеза протеина. Подобно тому, как строительство здания требует наличия исходных материалов и определенного расхода энергии, так и строительство мышечных тканей. Материалом служат аминокислоты, а источником энергии — АТФ. Анаболизм является одним из самых энергопотребляющих процессов, которые происходят внутри мышц. Как повысить уровень АТФ Как культурист, вы обладаете огромным арсеналом мощных средств для повышения уровня АТФ. В данной статье я расскажу об использовании креатина, прогормонов и рибозы. Не буду останавливаться на углеводах, поскольку о них, как об источнике энергии, и так уже слишком много было написано. Глютамин и аминокислоты с разветвленными цепями тоже оказывают небольшое влияние на выработку АТФ, но в этот раз я не буду останавливаться на них подробно. Самым быстродействующим стимулятором является D-рибоза. Молекула АТФ рождается при взаимодействии одной молекулы аденина, трех фосфатных групп и одной молекулы рибозы. Таким образом, рибоза является необходимым сырьем для синтеза АТФ. Рибоза также контролирует активность фермента 5-фосфорибозил-1-пирофосфат, необходимого для ресинтеза АТФ. Я считаю креатин умеренным стимулятором АТФ, а стимуляторами АТФ самого длительного действия являются прогормоны. Я сомневаюсь в том, что креатин способен оказывать стимулирующий эффект на выработку АТФ у тех, кто ведет малоподвижный образ жизни. Однако, как уже рассказывалось выше, интенсивная физическая нагрузка снижает уровень АТФ на длительное время. В этом случае креатин может обеспечить необходимый исходный материал для ресинтеза АТФ, благодаря его трансформации в фосфокреатин внутри мышц. Проведенный европейскими учеными эксперимент показал, что при дополнительном употреблении спортсменами высокого уровня тренированности креатина на протяжении пяти дней в количестве 21 г в день, вместе с употреблением 252 г углеводов, уровень АТФ в мышцах увеличился аж на 9%, а при употреблении предшественника АТФ фосфокреатина — на 11% (3). Рибоза, креатин и прогормоны являются эффективными стимуляторами выработки АТФ. Комбинированный их прием повысит ваш силовой уровень во время тренинга с отягощениями, улучшая при этом мышечное восстановление и рост после тренировки. Ссылки:
| 20. Акция выходного дня! Подробнее… 07.03.2023 Дорогие дамы! Специально для вас… Дорогие дамы! Специально для вас… Подробнее… 21.02.2023 Акция ко Дню защитника! Подробнее… 15.02.2023 Optimeal — новый бренд в нашей сети Подробнее… 11.02.2023 Акция ко дню влюбленных! Подробнее… |
Активирующий фактор транскрипции 4 (ATF4) способствует атрофии скелетных мышц за счет образования гетеродимера с регулятором транскрипции C/EBPβ
1. Эберт С.М., Аль-Зугби А., Бодин С.К. и Адамс С.М. (2019)Атрофия скелетных мышц: открытие механизмов и потенциальных методов лечения. физиология 34, 232–239 10.1152/физиол.00003.2019 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2.
Эберт С.М., Дайл М.С., Кункель С.Д., Буллард С.А., Бонгерс К.С., Фокс Д.К., Дирдорф Дж.М., Фостер Э.Д. и Адамс С.М. (2012) Вызванная стрессом экспрессия Gadd45a в скелетных мышцах перепрограммирует миоядра и вызывает мышечную атрофию. Дж. Биол. хим. 287, 27290–27301
10.1074/jbc.M112.374777
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Биол. хим. 287, 27290–27301
10.1074/jbc.M112.374777
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Фокс Д.К., Эберт С.М., Бонгерс К.С., Дайл М.С., Буллард С.А., Дирдорф Дж.М., Кункель С.Д. и Адамс С.М. (2014) p53 и ATF4 опосредуют различные и дополнительные пути к атрофии скелетных мышц во время иммобилизации конечностей. Являюсь. Дж. Физиол. Эндокринол. Метаб. 307, Е245–Е261 10.1152/ajpendo.00010.2014 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Эберт С.М., Дайл М.С., Буллард С.А., Диердорф Дж.М., Мерри Д.Дж., Фокс Д.К., Бонгерс К.С., Лира В.А., Мейерхольц Д.К., Талли Дж.Дж. и Адамс С.М. (2015) Идентификация и ингибирование малых молекул активирующего фактора транскрипции 4 (ATF4) -зависимый путь к возрастной слабости и атрофии скелетных мышц. Дж. Биол. хим. 290, 25497–25511 10.1074/jbc.M115.681445 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5.
Эберт С.М., Монтейс А.М., Фокс Д.К., Бонгерс К.С., Шилдс Б. Е., Мальмберг С.Е., Дэвидсон Б.Л., Сунеджа М. и Адамс С.М. (2010) Фактор транскрипции ATF4 способствует атрофии скелетных мышечных волокон во время голодания. Мол. Эндокринол. 24, 790–799
10.1210/м.2009-0345
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Е., Мальмберг С.Е., Дэвидсон Б.Л., Сунеджа М. и Адамс С.М. (2010) Фактор транскрипции ATF4 способствует атрофии скелетных мышечных волокон во время голодания. Мол. Эндокринол. 24, 790–799
10.1210/м.2009-0345
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Велле С., Брукс А.И., Делеханти Дж.М., Нидлер Н. и Торнтон К.А. (2003) Профиль экспрессии генов старения в мышцах человека. Физиол. Геномика 14, 149–159 10.1152/физиолгеномика.00049.2003 [PubMed] [CrossRef] [Google Scholar]
7. Уэлле С., Брукс А.И., Делеханти Дж.М., Нидлер Н., Бхатт К., Шах Б. и Торнтон С.А. (2004) Профили экспрессии генов скелетных мышц у женщин в возрасте 20–29 и 65–71 лет. Эксп. Геронтол. 39, 369–377 10.1016/j.exger.2003.11.011 [PubMed] [CrossRef] [Google Scholar]
8.
Эдвардс М.Г., Андерсон Р.М., Юань М., Кендзиорски С.М., Вайндрух Р. и Пролла Т.А. (2007) Профилирование экспрессии генов при старении выявляет активацию программы транскрипции, опосредованной p53. Геномика BMC
8, 80
10. 1186/1471-2164-8-80
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1186/1471-2164-8-80
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Гонсалес де Агилар Дж. Л., Нидерхаузер-Видеркер К., Халтер Б., Де Тапиа М., Ди Скала Ф., Демужен П., Дюпюи Л., Примиг М., Майнингер В. и Леффлер Дж. П. (2008) Профилирование генов скелетные мышцы в модели бокового амиотрофического склероза на мышах. Физиол. Геномика 32, 207–218 10.1152/физиолгеномика.00017.2007 [PubMed] [CrossRef] [Google Scholar]
10. Бандусела В. К., Очала Дж., Чен Ю. В., Йоранссон Х., Норман Х., Раделл П., Эрикссон Л. И., Хоффман Э. П. и Ларссон Л. (2009 г.)) Экспрессия генов и функция мышечных волокон в модели отделения интенсивной терапии свиней. Физиол. Геномика 39, 141–159 10.1152/физиолгеномика.00026.2009 [PubMed] [CrossRef] [Google Scholar]
11. Ллано-Диз М., Густафсон А.М., Олссон С., Горанссон Х. и Ларссон Л. (2011)Мышечная атрофия и характер экспрессии временных генов в новой модели отделения интенсивной терапии крыс. Геномика BMC 12, 602 10.1186/1471-2164-12-602 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Ибебунджо К., Чик Дж. М., Кендалл Т., Иш Дж. К., Ли К., Чжан Ю., Викерс К., Ву З., Кларк Б. А., Ши Дж., Круз Дж., Фурнье Б., Брачат С., Гуцвиллер С., Ма К. и др. (2013)Геномное и протеомное профилирование выявило снижение митохондриальной функции и нарушение нервно-мышечного соединения, вызывающее саркопению у крыс. Мол. Клетка. биол. 33, 194–212
10.1128/МКБ.01036-12
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ибебунджо К., Чик Дж. М., Кендалл Т., Иш Дж. К., Ли К., Чжан Ю., Викерс К., Ву З., Кларк Б. А., Ши Дж., Круз Дж., Фурнье Б., Брачат С., Гуцвиллер С., Ма К. и др. (2013)Геномное и протеомное профилирование выявило снижение митохондриальной функции и нарушение нервно-мышечного соединения, вызывающее саркопению у крыс. Мол. Клетка. биол. 33, 194–212
10.1128/МКБ.01036-12
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Бонгерс К.С., Фокс Д.К., Эберт С.М., Кункель С.Д., Дайл М.С., Буллард С.А., Дирдорф Дж.М. и Адамс С.М. (2013) Денервация скелетных мышц вызывает атрофию скелетных мышц по пути, который включает как Gadd45a, так и HDAC4. Являюсь. Дж. Физиол. Эндокринол. Метаб. 305, Е907–Е915 10.1152/ажпендо.00380.2013 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14.
Буллард С.А., Сео С., Шиллинг Б., Дайл М.С., Дирдорф Дж.М., Эберт С.М., ДеЛау А.Д., Гибсон Б.В. и Адамс С.М. (2016) Белок Gadd45a способствует атрофии скелетных мышц, образуя комплекс с протеинкиназой MEKK4. Дж. Биол. хим. 291, 17496–17509
10.1074/jbc.M116.740308
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Биол. хим. 291, 17496–17509
10.1074/jbc.M116.740308
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Ландшульц В. Х., Джонсон П. Ф. и Макнайт С. Л. (1988) Лейциновая молния: гипотетическая структура, общая для нового класса ДНК-связывающих белков. Наука 240, 1759–1764 гг. 10.1126/наука.3289117 [PubMed] [CrossRef] [Google Scholar]
16. Landschulz W.H., Johnson P.F., and McKnight S.L. (1989) ДНК-связывающий домен ядерного белка C/EBP печени крысы является двудольным. Наука 243, 1681–1688 гг. 10.1126/наука.2494700 [PubMed] [CrossRef] [Google Scholar]
17. Винсон К.Р., Сиглер П.Б. и Макнайт С.Л. (1989) Модель захвата-ножниц для распознавания ДНК семейством белков лейциновой молнии. Наука 246, 911–916 10.1126/наука.2683088 [PubMed] [CrossRef] [Google Scholar]
18. Лэмб П. и Макнайт С.Л. (1991) Разнообразие и специфичность в регуляции транскрипции: преимущества гетеротипической димеризации. Тенденции биохим. науч. 16, 417–422 10.1016/0968-0004(91)
-Т [PubMed] [CrossRef] [Академия Google] 19. Подаст Л. М., Крезель А. М. и Ким Ю. (2001) Кристаллическая структура гетеродимера основной лейциновой молнии CCAAT-бокса/энхансер-связывающего белка β, активирующего транскрипционный фактор-4, в отсутствие ДНК. Дж. Биол. хим. 276, 505–513
10.1074/jbc.M005594200
[PubMed] [CrossRef] [Google Scholar]
Подаст Л. М., Крезель А. М. и Ким Ю. (2001) Кристаллическая структура гетеродимера основной лейциновой молнии CCAAT-бокса/энхансер-связывающего белка β, активирующего транскрипционный фактор-4, в отсутствие ДНК. Дж. Биол. хим. 276, 505–513
10.1074/jbc.M005594200
[PubMed] [CrossRef] [Google Scholar]
20. Ньюман Дж. Р. и Китинг А. Э. (2003) Комплексная идентификация взаимодействия bZIP человека с массивами спиральных катушек. Наука 300, 2097–2101 гг. 10.1126/наука.1084648 [PubMed] [CrossRef] [Академия Google]
21. Рейнке А.В., Бэк Дж., Ашенберг О. и Китинг А.Е. (2013) Сети белок-белковых взаимодействий bZIP диверсифицировались за миллиард лет эволюции. Наука 340, 730–734 10.1126/наука.1233465 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22.
Fawcett T.W., Martindale J.L., Guyton K.Z., Hai T., and Holbrook N.J. (1999) Комплексы, содержащие активирующий транскрипционный фактор (ATF)/цАМФ-чувствительный элемент-связывающий белок (CREB), взаимодействуют с CCAAT/энхансер-связывающим белком (C /EBP)-ATF композитный сайт для регуляции экспрессии Gadd153 во время реакции на стресс. Биохим. Дж. 339, 135–141
10.1042/bj33 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Биохим. Дж. 339, 135–141
10.1042/bj33 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Siu F., Bain P.J., LeBlanc-Chaffin R., Chen H. и Kilberg M.S. (2002) ATF4 является медиатором пути реакции на питательные вещества, который активирует ген аспарагинсинтетазы человека. Дж. Биол. хим. 277, 24120–24127 10.1074/jbc.M201959200 [PubMed] [CrossRef] [Google Scholar]
24. Лопес А.Б., Ван С., Хуанг С.С., Яман И., Ли Ю., Чакраварти К., Джонсон П.Ф., Чианг С.М., Снайдер М.Д., Век Р.С. и Хацоглу М. (2007) Транскрипционный механизм обратной связи контролирует уровень транспортер аргинина/лизина cat-1 при аминокислотном голодании. Биохим. Дж. 402, 163–173. 10.1042/БДЖ20060941 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Gombart A.F., Grewal J., and Koeffler H.P. (2007) ATF4 по-разному регулирует транскрипционную активацию миелоид-специфических генов с помощью C/EBPϵ и C/EBPα. Дж. Лейкок. биол. 81, 1535–1547 гг. 10.1189/jlb.0806516 [PubMed] [CrossRef] [Google Scholar]
26. Томинага Х., Маэда С., Хаяши М., Такеда С., Акира С., Комия С., Накамура Т., Акияма Х. и Имамура Т. (2008) CCAAT/энхансер-связывающий белок β способствует дифференцировке остеобластов путем усиление активности Runx2 с помощью ATF4. Мол. биол. Клетка
19, 5373–5386
10.1091/mbc.e08-03-0329
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Томинага Х., Маэда С., Хаяши М., Такеда С., Акира С., Комия С., Накамура Т., Акияма Х. и Имамура Т. (2008) CCAAT/энхансер-связывающий белок β способствует дифференцировке остеобластов путем усиление активности Runx2 с помощью ATF4. Мол. биол. Клетка
19, 5373–5386
10.1091/mbc.e08-03-0329
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Коэн Д. М., Вон К. Дж., Нгуен Н., Лазар М. А., Чен К. С. и Стегер Д. Дж. (2015) ATF4 лицензирует активность C / EBPβ в мезенхимальных стволовых клетках человека, подготовленных для адипогенеза. Элиф 4, e06821 10.7554/eLife.06821 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Хаггинс С.Дж., Майекар М.К., Мартин Н., Сейлор К.Л., Гонит М., Джайлвала П., Касоджи М., Хейнс Д.К., Киньонес О.А. и Джонсон П.Ф. (2015) C/EBPγ является важным регулятором клеточных сетей реакции на стресс через гетеродимеризация с ATF4. Мол. Клетка. биол. 36, 693–713 10.1128/МКБ.00911-15 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Kilberg M.S., Shan J., and Su N. (2009) ATF4-зависимая транскрипция опосредует передачу сигналов об ограничении аминокислот. Тенденции Эндокринол. Метаб. 20, 436–443
10.1016/j.tem.2009.05.008
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Kilberg M.S., Shan J., and Su N. (2009) ATF4-зависимая транскрипция опосредует передачу сигналов об ограничении аминокислот. Тенденции Эндокринол. Метаб. 20, 436–443
10.1016/j.tem.2009.05.008
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Бэрд Т. Д. и Век Р. К. (2012) Фосфорилирование эукариотического фактора инициации 2 и трансляционный контроль в метаболизме. Доп. Нутр. 3, 307–321 10.3945/ан.112.002113 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Пакош-Зебрука К., Корыга И., Мнич К., Люич М., Самали А. и Горман А. М. (2016) Интегральная реакция на стресс. EMBO, отчет 17, 1374–1395 гг. 10.15252/эмбр.201642195 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32.
Lassot I., Ségéral E., Berlioz-Torrent C., Durand H., Groussin L., Hai T., Benarous R. и Margottin-Goguet F. (2001) Деградация ATF4 зависит от зависимого от фосфорилирования взаимодействия с SCF(βTrCP) убиквитинлигаза. Мол. Клетка. биол. 21, 2192–2202
10. 1128/МКБ.21.6.2192-2202.2001
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1128/МКБ.21.6.2192-2202.2001
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Lassot I., Estrabaud E., Emiliani S., Benkirane M., Benarous R. и Margottin-Goguet F. (2005) p300 модулирует стабильность и транскрипционную активность ATF4 независимо от его ацетилтрансферазного домена. Дж. Биол. хим. 280, 41537–41545 10.1074/jbc.M505294200 [PubMed] [CrossRef] [Google Scholar]
34. Pons J., Evrard-Todeschi N., Bertho G., Gharbi-Benarous J., Benarous R. и Girault J.P. (2007) Зависимая от фосфорилирования структура пептидов ATF4, полученных из человеческого белка ATF4, члена семейства факторы транскрипции. пептиды 28, 2253–2267 гг. 10.1016/к.пептиды.2007.090,016 [PubMed] [CrossRef] [Google Scholar]
35.
Ampofo E., Sokolowsky T., Götz C. и Montenarh M. (2013)Функциональное взаимодействие протеинкиназы CK2 и активирующего фактора транскрипции 4 (ATF4), ключевого игрока в клеточной реакции на стресс. Биохим. Биофиз. Акта
1833, 439–451
10.1016/j.bbamcr. 2012.10.025
[PubMed] [CrossRef] [Google Scholar]
2012.10.025
[PubMed] [CrossRef] [Google Scholar]
36. Багери-Ярманд Р., Синха К.М., Гурураж А.Е., Ахмед З., Ризви Ю.К., Хуанг С.К., Ладбери Дж.Е., Боглер О., Уильямс М.Д., Кот Г.Дж. и Гагель Р.Ф. (2015) Новая двойная киназная функция прототипа RET -онкоген отрицательно регулирует активацию апоптоза, опосредованного фактором транскрипции 4. Дж. Биол. хим. 290, 11749–11761 10.1074/jbc.M114.619833 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Родригес-Мартинес Дж. А., Рейнке А. В., Бхимсария Д., Китинг А. Э. и Ансари А. З. (2017) Комбинаторные димеры bZIP демонстрируют сложные ландшафты специфичности связывания ДНК. Элиф 6, e19272 10.7554/eLife.19272 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38.
Сартори Р., Милан Г., Патрон М., Маммукари С., Блаау Б., Абрахам Р. и Сандри М. (2009) Факторы транскрипции Smad2 и 3 контролируют мышечную массу во взрослом возрасте. Являюсь. Дж. Физиол. Клеточная физиол. 296, C1248–C1257
10.1152/ajpcell.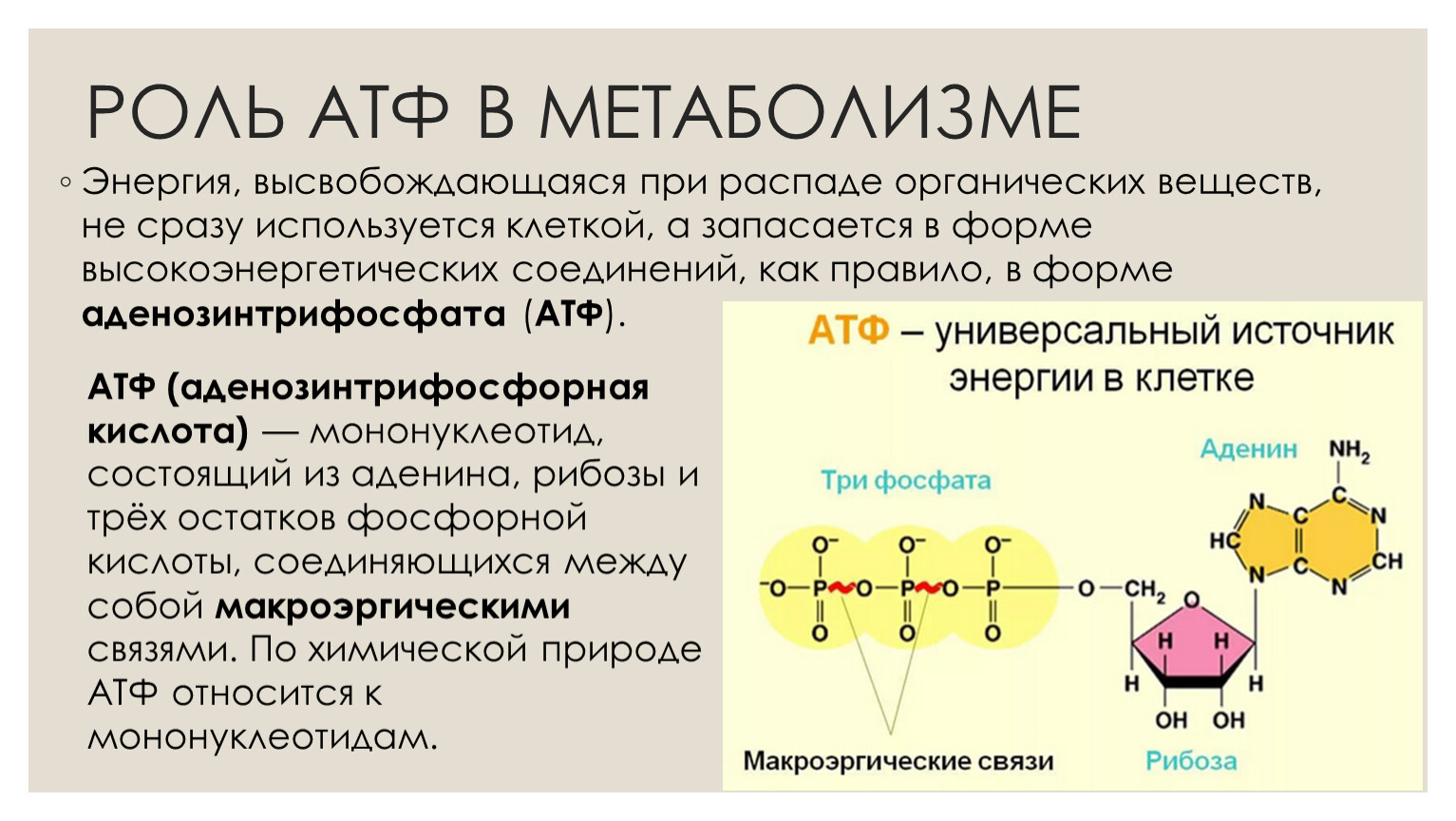 00104.2009
[PubMed] [CrossRef] [Google Scholar]
00104.2009
[PubMed] [CrossRef] [Google Scholar]
39. Вальехо М., Рон Д., Миллер С.П. и Хабенер Дж.Ф. (1993) C/ATF, член семейства ДНК-связывающих белков, активирующих транскрипционный фактор, димеризуется с CAAT/энхансер-связывающими белками и направляет их связывание на реакцию цАМФ. элементы. проц. Натл. акад. науч. США 90, 4679–4683 10.1073/пнас.90.10.4679 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Винсон С. Р., Хай Т. и Бойд С. М. (1993) Специфичность димеризации мотива bZIP, содержащего лейциновую молнию, в отношении связывания ДНК: предсказание и рациональный дизайн. Гены Дев. 7, 1047–1058 гг. 10.1101/гад.7.6.1047 [PubMed] [CrossRef] [Google Scholar]
41. Дешмукх А.С., Мургия М., Нагарадж Н., Трибак Дж.Т., Кокс Дж. и Манн М. (2015)Глубокая протеомика скелетных мышц мыши позволяет проводить количественный анализ изоформ белков, метаболических путей и факторов транскрипции. Мол. Клетка. протеомика 14, 841–853 10.1074/мкп.М114.044222 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Ramji D.P. и Foka P. (2002) CCAAT/белки, связывающие усилители: структура, функция и регулирование. Биохим. Дж. 365, 561–575.
10.1042/bj20020508
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ramji D.P. и Foka P. (2002) CCAAT/белки, связывающие усилители: структура, функция и регулирование. Биохим. Дж. 365, 561–575.
10.1042/bj20020508
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Tsukada J., Yoshida Y., Kominato Y., and Auron P.E. (2011) Семейство факторов транскрипции с основной лейциновой молнией (bZIP) CCAAT/enhancer (C/EBP) представляет собой многогранную высокорегулируемую систему для регуляции генов. Цитокин 54, 6–19 10.1016/j.cyto.2010.12.019 [PubMed] [CrossRef] [Академия Google]
44. Кребс А. Р., Деммерс Дж., Кармодия К., Чанг Н. С., Чанг А. С. и Тора Л. (2010) Коактиваторы ATAC и Mediator образуют стабильный комплекс и регулируют набор некодирующих генов РНК. EMBO Отчет 11, 541–547 10.1038/эмбор.2010.75 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Shi J. и Vakoc C.R. (2014) Механизмы терапевтической активности ингибирования бромодомена BET. Мол. Клетка 54, 728–736 10.1016/ж.молцель.2014.05.016 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Иноуэ Ю., Кавати С., Окубо Т., Нагасака М., Ито С., Фукуура К., Ито Ю., Охока Н., Моришита Д. и Хаяши Х. (2017) Ингибитор CDK р21 является новым ген-мишень ATF4 и способствует выживанию клеток при стрессе ER. ФЭБС лат. 591, 3682–3691
10.1002/1873-3468.12869
[PubMed] [CrossRef] [Google Scholar]
Иноуэ Ю., Кавати С., Окубо Т., Нагасака М., Ито С., Фукуура К., Ито Ю., Охока Н., Моришита Д. и Хаяши Х. (2017) Ингибитор CDK р21 является новым ген-мишень ATF4 и способствует выживанию клеток при стрессе ER. ФЭБС лат. 591, 3682–3691
10.1002/1873-3468.12869
[PubMed] [CrossRef] [Google Scholar]
47. Jiang HY, Jiang L. и Wek RC (2007)Киназный путь эукариотического фактора инициации-2 способствует дифференцированной экспрессии GADD45a в ответ на стресс окружающей среды. Дж. Биол. хим. 282, 3755–3765 10.1074/jbc.M606461200 [PubMed] [CrossRef] [Академия Google]
48. Санчес Р., Пантоха-Уседа Д., Прието Дж., Диркс Т., Маркайда М.Дж., Монтойя Г., Кампос-Оливас Р. и Бланко Ф.Дж. (2010) Структура раствора при остановке роста человека и повреждении ДНК 45α (Gadd45α) и его взаимодействие с ядерным антигеном пролиферирующих клеток (PCNA) и киназой Aurora A. Дж. Биол. хим. 285, 22196–22201 10.1074/jbc.M109.069344 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Zhang G., Jin B., and Li Y.P. (2011) C/EBPβ опосредует индуцированную опухолью активацию убиквитинлигазы атрогин1/MAFbx и атрофию мышц. EMBO J. 30, 4323–4335
10.1038/emboj.2011.292
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Zhang G., Jin B., and Li Y.P. (2011) C/EBPβ опосредует индуцированную опухолью активацию убиквитинлигазы атрогин1/MAFbx и атрофию мышц. EMBO J. 30, 4323–4335
10.1038/emboj.2011.292
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Судья С.М., Ву С.Л., Бехарри А.В., Робертс Б.М., Феррейра Л.Ф., Кандарян С.К. и судья А.Р. (2014) Полногеномная идентификация FoxO-зависимых генных сетей в скелетных мышцах во время раковой кахексии C26. BMC Рак 14 997 10.1186/1471-2407-14-997 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Hulmi JJ, Silvennoinen M., Lehti M., Kivelä R. и Kainulainen H. (2012)Измененная передача сигналов REDD1, миостатина и Akt/mTOR/FoxO/MAPK при диабетической мышечной атрофии, вызванной стрептозотоцином. Являюсь. Дж. Физиол. Эндокринол. Метаб. 302, Е307–Е315 10.1152/айпендо.00398.2011 [PubMed] [CrossRef] [Google Scholar]
52.
Хирш Н. и Бирнбаум Р.Ю. (2015) Двойная функция последовательностей ДНК: последовательности, кодирующие белок, действуют как усилители транскрипции. Перспектива. биол. Мед. 58, 182–195
10.1353/пм.2015.0026
[PubMed] [CrossRef] [Google Scholar]
Перспектива. биол. Мед. 58, 182–195
10.1353/пм.2015.0026
[PubMed] [CrossRef] [Google Scholar]
53. Sun D.S., Chang A.C., Jenkins N.A., Gilbert D.J., Copeland N.G. и Chang N.C. (1996) Идентификация, молекулярная характеристика и хромосомная локализация кДНК, кодирующей новый белок, содержащий мотив лейциновой молнии. Геномика 36, 54–62 10.1006/ген.1996.0425 [PubMed] [CrossRef] [Google Scholar]
54. Бастиани М., Лю Л., Хилл М. М., Джедрыховски М. П., Никсон С. Дж., Ло Х. П., Абанква Д., Люттерфорст Р., Фернандес-Рохо М., Брин М. Р., Гиги С. П., Винтен Дж., Вальсер П. Дж., Норт К. Н., Хэнкок Дж. Ф. и соавт. (2009) MURC/Cavin-4 и члены семейства cavin образуют тканеспецифические кавеолярные комплексы. Дж. Клеточная биология. 185, 1259–1273 гг. 10.1083/jcb.200903053 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55.
Сегатто М., Фиттипальди Р., Пин Ф., Сартори Р., Дае Ко К., Заре Х., Фениция К., Занчеттин Г., Пьеробон Э. С., Хатакеяма С., Сперти К. , Мерильяно С., Сандри М. ., Филиппакопулос П., Костелли П. и др. (2017)Эпигенетическое нацеливание на белок бромодомена BRD4 противодействует раковой кахексии и продлевает выживаемость. Нац. коммун. 8, 1707 г.
10.1038/с41467-017-01645-7
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Мерильяно С., Сандри М. ., Филиппакопулос П., Костелли П. и др. (2017)Эпигенетическое нацеливание на белок бромодомена BRD4 противодействует раковой кахексии и продлевает выживаемость. Нац. коммун. 8, 1707 г.
10.1038/с41467-017-01645-7
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Humbert M.C., Weihbrecht K., Searby CC, Li Y., Pope RM, Sheffield VC и Seo S. (2012) ARL13B, PDE6D и CEP164 образуют функциональную сеть для нацеливания на реснички INPP5E. проц. Натл. акад. науч. США 109, 19691–19696 10.1073/пнас.1210916109 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Басисти Н., Мейер Дж. Г., Вей Л., Гибсон Б. В. и Шиллинг Б. (2018) Одновременная количественная оценка ацетилома и сукцинилома с помощью аффинного обогащения «One-Pot». протеомика 18, е1800123 10.1002/пмик.201800123 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58.
Ван Г., Мейер Дж. Г., Кай В., Софтич С., Ли М. Э., Вердин Э., Ньюгард С., Шиллинг Б. и Кан С. Р. (2019) Регуляция UCP1 и митохондриального метаболизма в бурой жировой ткани путем обратимого сукцинилирования. Мол. Клетка
74, 844–857.e7
10.1016/j.molcel.2019.03.021
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
и Кан С. Р. (2019) Регуляция UCP1 и митохондриального метаболизма в бурой жировой ткани путем обратимого сукцинилирования. Мол. Клетка
74, 844–857.e7
10.1016/j.molcel.2019.03.021
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Шиллинг Б., Кристенсен Д., Дэвис Р., Саху А. К., Ху Л. И., Уокер-Педдакотла А., Соренсен Д. Дж., Земайтайтис Б., Гибсон Б. В. и Вулф А. Дж. (2015) Динамика ацетилирования белка в ответ на избыток углерода в Кишечная палочка . Мол. микробиол. 98, 847–863 10.1111/мм.13161 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Кун М.Л., Жемайтайтис Б., Ху Л.И., Саху А., Соренсен Д., Минасов Г., Лима Б.П., Шолле М., Мрксич М., Андерсон В.Ф., Гибсон Б.В., Шиллинг Б. и Вулф А.Дж. (2014) Структурная , кинетическая и протеомная характеристика ацетилфосфатзависимого ацетилирования бактериальных белков. ПЛОС Один 9, е94816 10.1371/journal.pone.0094816 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Gillet L.C., Navarro P., Tate S., Rost H., Selevsek N., Reiter L., Bonner R., and Aebersold R. (2012) Целевое извлечение данных из спектров МС/МС, полученных путем независимого сбора данных: новая концепция последовательного и точного анализа протеома. Мол. Клетка. протеомика
11, О111.016717
10.1074/мкп.О111.016717
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Gillet L.C., Navarro P., Tate S., Rost H., Selevsek N., Reiter L., Bonner R., and Aebersold R. (2012) Целевое извлечение данных из спектров МС/МС, полученных путем независимого сбора данных: новая концепция последовательного и точного анализа протеома. Мол. Клетка. протеомика
11, О111.016717
10.1074/мкп.О111.016717
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Коллинз Б.С., Хантер С.Л., Лю Ю., Шиллинг Б., Розенбергер Г., Бадер С.Л., Чан Д.В., Гибсон Б.В., Гинграс А.С., Хелд Дж.М., Хираяма-Куроги М., Хоу Г., Крисп С., Ларсен Б. , Лин Л. и др. (2017)Многолабораторная оценка воспроизводимости, качественных и количественных характеристик SWATH-масс-спектрометрии. Нац. коммун. 8, 291 10.1038/с41467-017-00249-5 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63.
Шилов И.В., Сеймур С.Л., Патель А.А., Лобода А., Танг В.Х., Китинг С.П., Хантер С.Л., Нувайсир Л.М. и Шеффер Д.А. (2007) Алгоритм Paragon, поисковая система следующего поколения, которая использует значения температуры последовательности и вероятности признаков для идентификации пептиды из тандемных масс-спектров. Мол. Клетка. протеомика
6, 1638–1655 гг.
10.1074/мкп.Т600050-МКП200
[PubMed] [CrossRef] [Академия Google]
Мол. Клетка. протеомика
6, 1638–1655 гг.
10.1074/мкп.Т600050-МКП200
[PubMed] [CrossRef] [Академия Google]
64. Линк А. Дж., Энг Дж., Шильц Д. М., Кармак Э., Мизе Г. Дж., Моррис Д. Р., Гарвик Б. М. и Йейтс Дж. Р. 3-й. (1999) Прямой анализ белковых комплексов с помощью масс-спектрометрии. Нац. Биотехнолог. 17, 676–682 10.1038/10890 [PubMed] [CrossRef] [Google Scholar]
65. Дубовиц В. и Сьюри С.А. (редакторы) (2007) Мышечная биопсия: практический подход, 3-е изд., с. 83, Saunders/Elsevier, Philadelphia [Google Scholar]
ATF-1 является чувствительным к гипоксии активатором транскрипции скелетных мышц Митохондриально-разобщающий белок 3
1. Видал-Пуиг А.Дж., Груич Д., Чжан С.Ю., Хаген Т., Босс О., Идо Ю., Щепаник А., Уэйд Дж., Мутха В., Кортрайт Р., Муойо Д. М., и Lowell, B.B. (2000) J. Biol. хим. 275 16258-16266 [PubMed] [Google Scholar]
2. Brand, MD, and Esteves, T.C. (2005) Клеточный метаб. 2 85-93 [PubMed] [Google Scholar]
3. Sack, M. N. (2006) Cardiovasc
Рез. 72
210-219 [PubMed] [Google Scholar]
Sack, M. N. (2006) Cardiovasc
Рез. 72
210-219 [PubMed] [Google Scholar]
4. Гарсия-Мартинес, К., Сибилль, Б., Соланес, Г., Даримонт, К., Мейс, К., Вильярройя Ф. и Гомес-Фуа А.М. (2001) Фасеб. Дж. 15 2033-2035 [PubMed] [Google Scholar]
5. Талбот, Д. А., и Бранд, М. Д. (2005) Биохим. Биофиз. Акта 1709 150-156 [PubMed] [Google Scholar]
6. Маклеод, С.Дж., Азиз, А., Хойт, Р.Ф., младший, Маккой, Дж.П., младший, и Сак, М. Н. (2005) J. Biol. хим. 280 33470-33476 [PubMed] [Google Scholar]
7. Андерсон Э. Дж., Ямадзаки Х. и Нойфер П. Д. (2007) J. Biol. хим. 282 31257-31266 [PubMed] [Google Scholar]
8. Костфорд, С. Р., Чаудхри, С. Н., Салкхорде, М., и Харпер, М. Э. (2006) Ам. Дж. Физиол. Эндокринол. Метаб. 290 E1304-E1312 [PubMed] [Google Scholar]
9. Чой, К.С., Филлмор, Дж.Дж., Ким, Дж.К., Лю, З.С., Ким, С.,
Коллиер, Э. Ф., Кулкарни, А., Дистефано, А., Хван, Ю. Дж., Кан, М., Чен, Ю.,
Ю С., Мур И. К., Резник Р. М., Хигашимори Т. и Шульман Г. И.
(2007) Дж. Клин. расследование
117
1995-2003 [бесплатная статья PMC] [PubMed] [Google Scholar]
и Шульман Г. И.
(2007) Дж. Клин. расследование
117
1995-2003 [бесплатная статья PMC] [PubMed] [Google Scholar]
Хайот, М., и Префо, К. (2005) Грудная клетка 60 834-841 [бесплатная статья PMC] [PubMed] [Google Scholar]
11. Magalhaes, J., Ascensao, A., Soares, J.M., Ferreira, R., Neuparth, M.J., Marques, F., and Duarte, J.A. (2005) J. Appl. Физиол. 99 1247-1253 [PubMed] [Google Scholar]
12. Clanton, T.L. (2007) J. Appl. Физиол. 102 2379-2388 [PubMed] [Google Scholar]
13. Чжоу М., Линь Б. З., Кафлин С., Валлега Г. и Пилч П. Ф. (2000) Ам. Дж. Физиол. Эндокринол. Метаб. 279 E622-E629 [PubMed] [Google Scholar]
14. Рандо Т. А. и Блау Х. М. (1994) Ж. Клеточная биол. 125 1275-1287 [бесплатная статья PMC] [PubMed] [Google Scholar]
15. Kim, D., Jitrapakdee, S., and Thompson, M. (2007) Дж. Биохим. Мол. биол. 40 921-927 [PubMed] [Google Scholar]
16. Wang, G.L., and Semenza, G.L. (1995) J. биол. хим. 270 1230-1237 [PubMed] [Google Scholar]
17. Фландин П., Донати Ю., Бараццоне-Аргироффо К. и Муззин П.
(2005) FEBS Lett.
579
3411-3415 [PubMed] [Google Scholar]
Фландин П., Донати Ю., Бараццоне-Аргироффо К. и Муззин П.
(2005) FEBS Lett.
579
3411-3415 [PubMed] [Google Scholar]
18. Соланес Г., Педраса Н., Кальво В., Видал-Пуиг А., Лоуэлл Б. Б., и Вильярройя, Ф. (2005) Biochem. Дж. 386 505-513 [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Соланес Г., Педраса Н., Иглесиас Р., Хиральт М. и Вильярройя Ф. (2003) мол. Эндокринол. 17 1944-1958 [PubMed] [Google Scholar]
20. Эхтай К.С., Руссель Д., Сен-Пьер Дж., Екабсонс М.Б., Каденас, С., Стюарт, Дж. А., Харпер, Дж. А., Робак, С. Дж., Моррисон, А., Пикеринг, С., Клэпхэм, Дж. К., и Бранд, доктор медицины (2002) Природа 415 96-99 [PubMed] [Google Scholar]
21. Echtay, K.S., Esteves, T.C., Pakay, J.L., Jekabsons, M.B., Ламберт А. Дж., Портеро-Отин М., Памплона Р., Видаль-Пуиг А. Дж., Ван С., Робак, С.Дж., и Бранд, доктор медицины (2003) EMBO Дж. 22 4103-4110 [бесплатная статья PMC] [PubMed] [Google Scholar]
22. Mayr, B., and Montminy, M. (2001) Nat.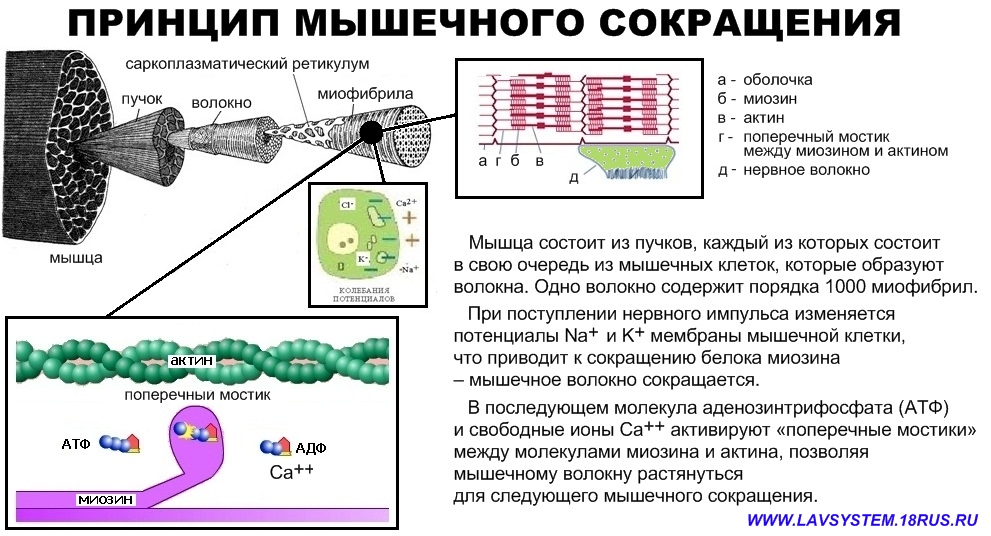 преп.
Мол. Клетка. биол. 2
599-609 [PubMed] [Google Scholar]
преп.
Мол. Клетка. биол. 2
599-609 [PubMed] [Google Scholar]
23. Бонни А., Гинти Д. Д., Дудек Х. и Гринберг М. Э. (1995) Мол. Клеточные нейробиологи. 6 168-183 [PubMed] [Google Scholar]
24. Бриндл П., Накадзима Т. и Монтмини М. (1995) проц. Натл. акад. науч. США. 92 10521-10525 [бесплатная статья PMC] [PubMed] [Google Scholar]
25. Beitner-Johnson, D., Rust, R. T., Hsieh, T. C., and Millhorn, D. E. (2001) Сотовый сигнал. 13 23-27 [PubMed] [Google Scholar]
26. Розенберг Д., Груссен Л., Джуллиан Э., Перлемуан К., Бертанья, X. и Bertherat, J. (2002) Ann. Н. Я. акад. науч. 968 65-74 [PubMed] [Google Scholar]
27. Fujimura, Y., Siddique, H., Lee, L., Rao, V.N., and Reddy, E.S. (2001) Онкоген 20 6653-6659 [PubMed] [Google Scholar]
28. Понгубала, Дж. М., и Атчисон, М. Л. (1995) Дж. Биол. хим. 270 10304-10313 [PubMed] [Google Scholar]
29. Блекманн, С. К., Бленди, Дж. А., Рудольф, Д., Монаган, А. П.,
Schmid, W., and Schutz, G. (2002) Mol. Клетка.
биол. 22
1919-1925 [бесплатная статья PMC] [PubMed] [Google Scholar]
(2002) Mol. Клетка.
биол. 22
1919-1925 [бесплатная статья PMC] [PubMed] [Google Scholar]
30. Джин Д., Теллез С., Хуанг С., Дэвис Д. В., Брунс С. Дж., МакКонки, Д.Дж., Хинрихс, С.Х., и Бар-Эли, М. (2000) Онкоген 19 2721-2730 [PubMed] [Google Scholar]
31. Квиетикова И., Венгер Р. Х., Марти Х. Х. и Гассманн М. (1995) Nucleic Acids Res. 23 4542-4550 [бесплатная статья PMC] [PubMed] [Google Scholar]
32. Ebert, B.L., and Bunn, H.F. (1998) Mol. Клетка. биол. 18 4089-4096 [бесплатная статья PMC] [PubMed] [Google Scholar]
33. Semenza, G.L. (2007) Biochem. Дж. 405 1-9 [PubMed] [Google Scholar]
34. Taylor, C. T. (2008) Biochem. Дж. 409 19-26 [PubMed] [Google Scholar]
35. Сен С.К., Ханна С. и Рой С. (2006) Кардиовасц Рез. 71 280-288 [PubMed] [Google Scholar]
36. Китагава, К. (2007) Febs. Дж. 274 3210-3217 [PubMed] [Google Scholar]
37. Симокава Т., Като М., Эзаки О. и Хашимото С.
(1998) Биохим. Биофиз. Рез. коммун.



 Какое? Как это ни удивительно, для полного восполнения запасов АТФ потребуется от 24 до 72 часов.
Какое? Как это ни удивительно, для полного восполнения запасов АТФ потребуется от 24 до 72 часов. Для того, чтобы справиться с возросшей потребностью в глютамине, организм начинает вырабатывать больше глютамина из других аминокислот, таких как аминокислоты с разветвленными цепями. Возникает состояние «перетягивания каната». По мере увеличения использования глютамина, увеличиваются и усилия организма по производству нового глютамина. Производство глютамина очень затратно с энергетической точки зрения — имеется в виду АТФ. Происходит оно в основном в мышцах, но уровень АТФ в мышцах после тренировки понижен, что препятствует выработке глютамина. Через некоторый промежуток времени выработка его уже не покрывает увеличившуюся потребность, что приводит к достоверному сокращению уровня глютамина после тренировки. С другой стороны, чтобы сделать это сокращение минимальным, организм старается увеличить скорость синтеза глютамина, используя еще больше АТФ. Следовательно, потребление АТФ мышцами остается высоким в течение длительного периода времени после тренировки, и это является причиной слишком длительного восстановления мышц.
Для того, чтобы справиться с возросшей потребностью в глютамине, организм начинает вырабатывать больше глютамина из других аминокислот, таких как аминокислоты с разветвленными цепями. Возникает состояние «перетягивания каната». По мере увеличения использования глютамина, увеличиваются и усилия организма по производству нового глютамина. Производство глютамина очень затратно с энергетической точки зрения — имеется в виду АТФ. Происходит оно в основном в мышцах, но уровень АТФ в мышцах после тренировки понижен, что препятствует выработке глютамина. Через некоторый промежуток времени выработка его уже не покрывает увеличившуюся потребность, что приводит к достоверному сокращению уровня глютамина после тренировки. С другой стороны, чтобы сделать это сокращение минимальным, организм старается увеличить скорость синтеза глютамина, используя еще больше АТФ. Следовательно, потребление АТФ мышцами остается высоким в течение длительного периода времени после тренировки, и это является причиной слишком длительного восстановления мышц.

 Хотя вы можете предположить, что послетренировочное сокращение уровня АТФ может спасти мышцы от катаболизма, к сожалению, это не так. Когда уровень АТФ в мышцах достигает нижнего порога, запускаются другие катаболические механизмы, не зависящие от АТФ. Содержащийся в клетках кальций начинает выводиться из клеток, вызывая основные нарушения. Более выигрышным вариантом будет усиление и анаболического, и катаболического процессов, чем сильный катаболический процесс и слабый анаболический. Следовательно, чем больше АТФ — тем лучше.
Хотя вы можете предположить, что послетренировочное сокращение уровня АТФ может спасти мышцы от катаболизма, к сожалению, это не так. Когда уровень АТФ в мышцах достигает нижнего порога, запускаются другие катаболические механизмы, не зависящие от АТФ. Содержащийся в клетках кальций начинает выводиться из клеток, вызывая основные нарушения. Более выигрышным вариантом будет усиление и анаболического, и катаболического процессов, чем сильный катаболический процесс и слабый анаболический. Следовательно, чем больше АТФ — тем лучше. Важно, чтобы вы поняли, что все эти стимуляторы характеризуются разновременностью срабатывания, поэтому являются лишь вспомогательными.
Важно, чтобы вы поняли, что все эти стимуляторы характеризуются разновременностью срабатывания, поэтому являются лишь вспомогательными. Уридинтрифосфат имеет наиболее важное значение для медленносокращающихся волокон. Исследования показывают, что он оказывает сильное анаболическое влияние на мышцы. Он также помогает им избавиться от нашествий натрия, помогая калию проникнуть внутрь мышечных клеток, что, в свою очередь, щадит запасы АТФ.
Уридинтрифосфат имеет наиболее важное значение для медленносокращающихся волокон. Исследования показывают, что он оказывает сильное анаболическое влияние на мышцы. Он также помогает им избавиться от нашествий натрия, помогая калию проникнуть внутрь мышечных клеток, что, в свою очередь, щадит запасы АТФ.
 Поскольку их влияние по-разному распределяется по времени, и у них разный способ действия, они приносят оптимальные результаты, работая в синергии.
Поскольку их влияние по-разному распределяется по времени, и у них разный способ действия, они приносят оптимальные результаты, работая в синергии. 05.2023
05.2023