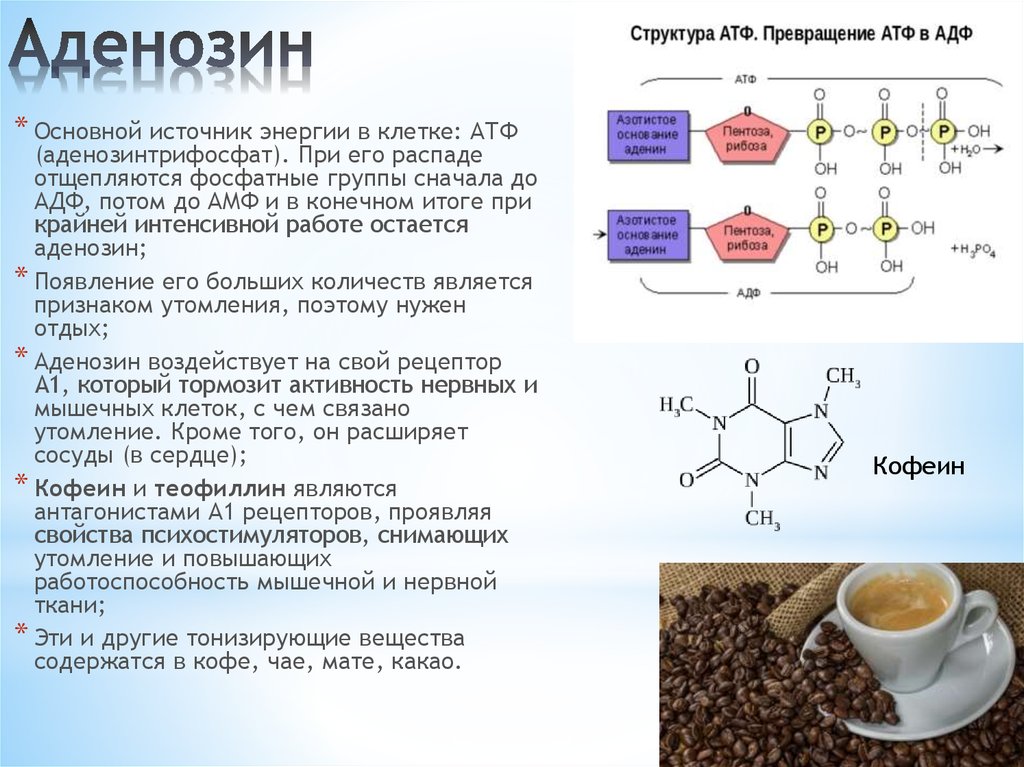
Строение атф. Роль атф для жизнедеятельности клетки.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
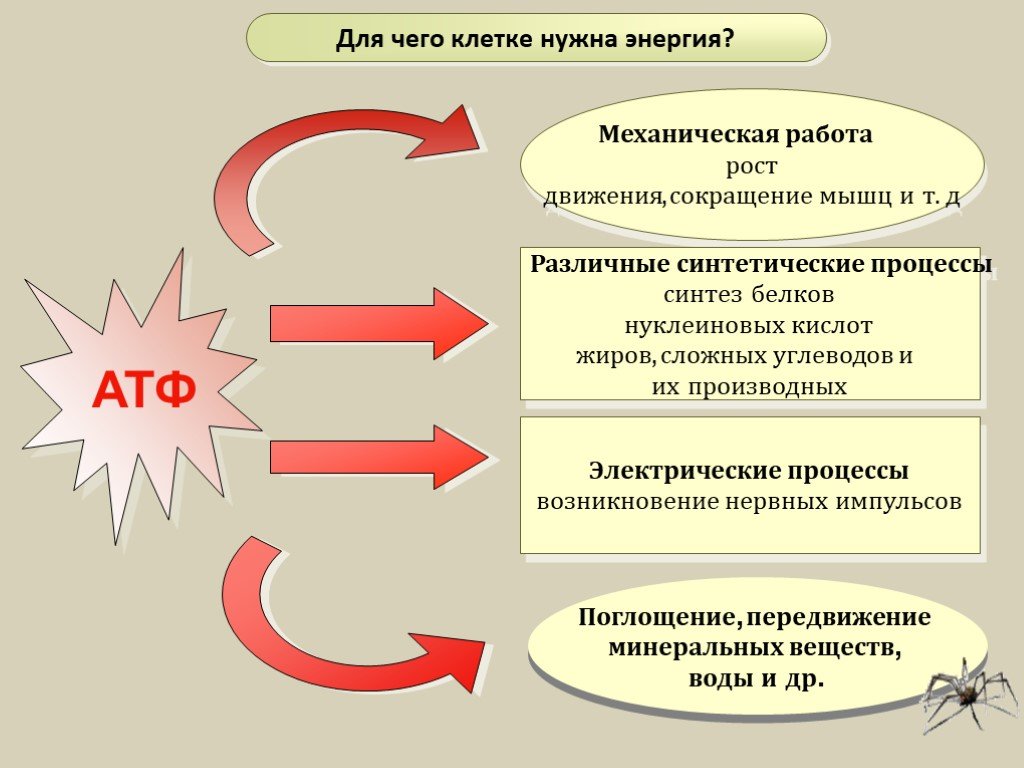
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул черезбиологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.

Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
Также известна роль АТФ в качестве медиатора в синапсах.
Образование половых клеток. Этапы овогенеза.
Гаметогенез или предзародышевое развитие — процесс созревания половых клеток, или гамет. Поскольку в ходе гаметогенеза специализация яйцеклеток
и спермиев происходит в разных направлениях, обычно выделяют оогенез и сперматогенез соответственно.
Гаметогенез закономерно присутствует в жизненном цикле ряда простейших, водорослей, грибов, споровых и голосеменных растений, а также многоклеточных животных. В некоторых группах гаметы вторично редуцированы (сумчатые и базидиевые грибы, цветковые растения). Наиболее подробно процессы гаметогенеза изучены у многоклеточных животных.
[Править]Гаметогенез и мейоз
Гаметогенез не следует путать с мейозом. Сущность этих процессов совершенно различна: формирование специализированных половых клеток и специфический вариант деления клеток с уменьшением числа хромосом.
В группах, для которых характерен жизненный цикл с зиготической (например, грибы) или спорической редукцией (например, сосудистые растения) числа хромосом, мейоз предшествует гаметогенезу и, как правило, отделён от него значительным временным промежутком, поскольку формирование гамет происходит на
В группах, для которых характерен жизненный цикл с гаметической редукцией (например, многоклеточные животные) мейоз сопряжён с гаметогенезом, однако и здесь нельзя говорить о полной идентичности этих процессов. Так, зрелый сперматозоид, готовый к оплодотворению, формируется лишь по завершении мейоза, в то время как ооцит созревает до его завершения, более того, слияние гаметпроисходит ещё до завершения мейоза в ооците
Оогенез совершается в три этапа, называемых периодами.
[Править]Период размножения
Попав в яичник, гоноциты становятся оогониями. Оогонии осуществляют период размножения. В этот период оогонии делятсямитотическим путем. Этот процесс происходит только в период эмбрионального развития самки.
404 Cтраница не найдена
Мы используем файлы cookies для улучшения работы сайта МГТУ и большего удобства его использования.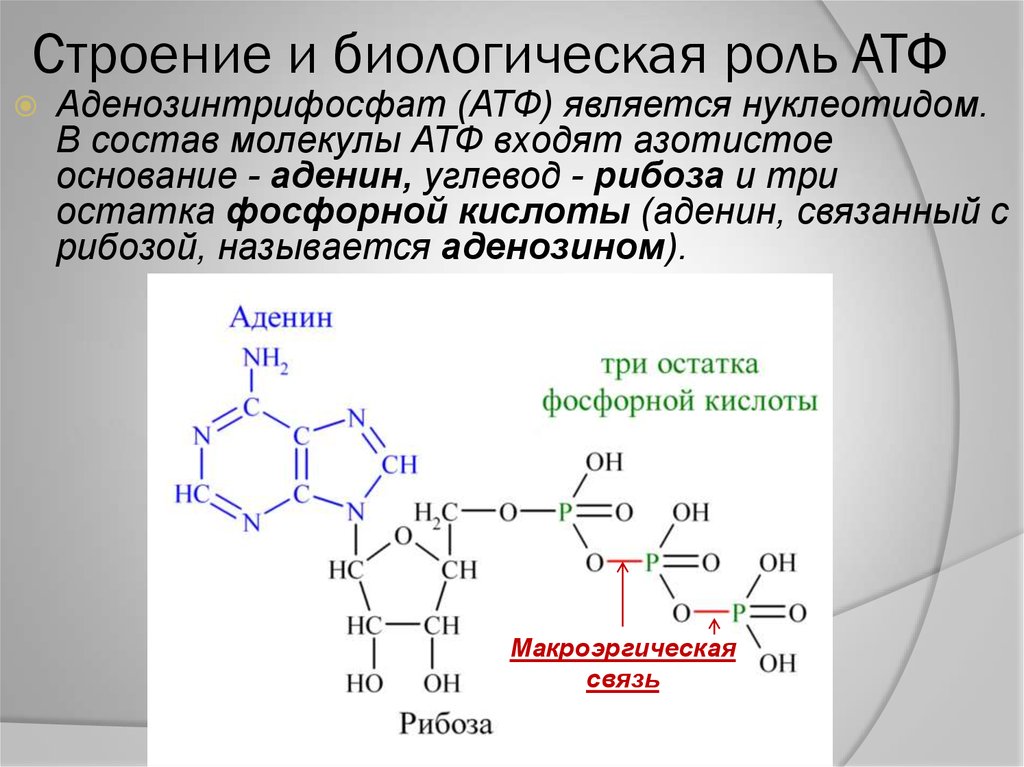 Более подробную информацию об использовании файлов cookies можно найти здесь.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Более подробную информацию об использовании файлов cookies можно найти здесь.
Продолжая пользоваться сайтом, вы подтверждаете, что были проинформированы об использовании файлов cookies сайтом ФГБОУ ВО «МГТУ» и согласны с нашими правилами обработки персональных данных.
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Двойная жизнь АТФ в организме человека
Одним из первых и наиболее устойчивых фактов, которые большинство студентов узнают на уроках биологии, является то, что все живые клетки используют в качестве топлива небольшую молекулу, называемую аденозинтрифосфатом (АТФ). Эта универсальная энергетическая валюта управляет биологическими реакциями, которые позволяют клеткам функционировать и процветать жизни, что делает АТФ важным игроком в биологическом мире.
Эта универсальная энергетическая валюта управляет биологическими реакциями, которые позволяют клеткам функционировать и процветать жизни, что делает АТФ важным игроком в биологическом мире.
Менее известно, однако, что то, что, возможно, является наиболее производимой и потребляемой молекулой в человеческом организме, также играет совершенно отдельную, но не менее важную роль вне клеток. Долгая серия открытий безоговорочно продемонстрировала, что АТФ является важной сигнальной молекулой, которая позволяет клеткам и тканям по всему телу общаться друг с другом. Универсальное топливо, по сути, служит еще и общим языком.
Когда почти 50 лет назад впервые была предложена двойная функция АТФ, эта идея была встречена со значительным скептицизмом. Но лавина открытий за последние 15 лет подробно описала, как АТФ действует на клетки извне и как она участвует в развитии и повседневной работе органов и тканей. Поскольку АТФ настолько вездесущ, его сигнальные действия оказывают уникально широкое влияние на физиологическое функционирование и предлагают необычайно разнообразные возможности для улучшения здоровья человека. Лаборатории по всему миру сейчас стремятся превратить эти идеи в методы лечения.
Лаборатории по всему миру сейчас стремятся превратить эти идеи в методы лечения.
АТФ без маски, дважды
Когда в 1929 году была открыта АТФ, исследователи всего мира искали неуловимый источник клеточной энергии. Практически одновременные открытия Карла Ломанна, работавшего с лауреатом Нобелевской премии 1922 года Отто Мейерхофом из Института медицинских исследований кайзера Вильгельма в Гейдельберге, и Сайруса Х. Фиске, работавшего со своим аспирантом Йеллапрагадой Суббароу из Гарвардской медицинской школы, показали, что внутриклеточная активность, способность мышечных клеток сокращаться зависит от молекулы, состоящей из пурина — аденозина, комбинации основания аденина с сахаром — и трех фосфатов. К 1935 Каташи Макино из больницы Дайлен в Маньчжурии предложил структуру молекулы, которая была подтверждена 10 лет спустя Бэзилом Литгоу и Александром Р. Тоддом из химической лаборатории Кембриджского университета.
В этот период никто не представлял роли молекулы вне клетки. Так было и в 1962 году, когда один из нас (Бернсток) был молодым нейрофизиологом в Мельбурнском университете в Австралии и изучал нервы, контролирующие гладкую мышечную ткань. В ходе исследования передачи сигналов вегетативной нервной системой (которая контролирует такие основные мышечно-зависимые функции, как сокращения кишечника и мочевого пузыря) он обнаружил доказательства передачи нервных сигналов, в которых не участвовали классические химические нейротрансмиттеры ацетилхолин или норадреналин. Заинтригованы данными, опубликованными в 1959 Памелы Холтон из Кембриджской физиологической лаборатории, предполагая, что сенсорные нервы выделяют молекулы АТФ, Бернсток решил определить, может ли АТФ отвечать за передачу сигналов между двигательными нервами и мышцами. С помощью серии экспериментов, в которых он применил химические вещества для блокирования передачи сигналов классическими нейротрансмиттерами к гладкой мышечной ткани, он смог продемонстрировать, что любая непрерывная передача сигналов от нервов к мышцам должна передаваться АТФ.
Так было и в 1962 году, когда один из нас (Бернсток) был молодым нейрофизиологом в Мельбурнском университете в Австралии и изучал нервы, контролирующие гладкую мышечную ткань. В ходе исследования передачи сигналов вегетативной нервной системой (которая контролирует такие основные мышечно-зависимые функции, как сокращения кишечника и мочевого пузыря) он обнаружил доказательства передачи нервных сигналов, в которых не участвовали классические химические нейротрансмиттеры ацетилхолин или норадреналин. Заинтригованы данными, опубликованными в 1959 Памелы Холтон из Кембриджской физиологической лаборатории, предполагая, что сенсорные нервы выделяют молекулы АТФ, Бернсток решил определить, может ли АТФ отвечать за передачу сигналов между двигательными нервами и мышцами. С помощью серии экспериментов, в которых он применил химические вещества для блокирования передачи сигналов классическими нейротрансмиттерами к гладкой мышечной ткани, он смог продемонстрировать, что любая непрерывная передача сигналов от нервов к мышцам должна передаваться АТФ. Преследуя это лидерство более десяти лет, Бернсток чувствовал себя достаточно уверенно к 19 годам.72, чтобы предположить существование «пуринергических нервов», которые выделяют АТФ в качестве нейротрансмиттера.
Преследуя это лидерство более десяти лет, Бернсток чувствовал себя достаточно уверенно к 19 годам.72, чтобы предположить существование «пуринергических нервов», которые выделяют АТФ в качестве нейротрансмиттера.
Нервные клетки генерируют электрические импульсы, которые проходят по длине одного нейрона, но заряд не пересекает крошечную щель между клетками, известную как синаптическую щель, или щель между нервными клетками и мышцами. Сообщение передается от клетки к клетке с помощью химических трансмиттеров, таких как ацетилхолин, глутамат, дофамин и другие, которые высвобождаются из возбуждающего нейрона в расщелину. Эти химические вещества преодолевают разрыв и связываются с рецепторными белками принимающей клетки, вызывая в этой клетке ряд внутренних изменений, которые изменяют ее активность; нейроны-реципиенты могут запускать собственные импульсы, а мышечные клетки могут сокращаться или расслабляться. Таким образом, сообщение может передаваться от нейрона к нейрону с помощью чередующихся серий импульсов и химических разрядов.
Долгое время считалось, что отдельные нейроны выделяют только один тип нейромедиаторов, а клетки, высвобождающие ацетилхолин, стали называть холинергическими; те, которые выделяют дофамин, были дофаминергическими и так далее. Концепция Бернстока о пуринергических нейронах была основана не только на его собственных наблюдениях к тому моменту, но и на ранних работах ряда выдающихся студентов и сотрудников, включая Макса Беннета, Грэма Кэмпбелла, Дэвида Сэтчелла, Молли Холман и Майка Рэнда из университетов Нью-Йорка. Мельбурн и Лондон.
Несмотря на огромное количество данных, свидетельствующих о высвобождении АТФ из нейронов в ткани мышц, кишечника и мочевого пузыря, многие нейрофизиологи, тем не менее, скептически относились к существованию нервов, высвобождающих АТФ в качестве мессенджера, в основном потому, что они считали маловероятным, что такое вездесущее вещество может выполнять такая конкретная роль. Более того, чтобы сигнальная молекула могла функционировать, она должна найти подходящий рецептор на своей клетке-мишени. Первый рецептор нейротрансмиттера был выделен лишь в 1970; поэтому началась охота за рецепторами АТФ.
Первый рецептор нейротрансмиттера был выделен лишь в 1970; поэтому началась охота за рецепторами АТФ.
Однако задолго до того, как они были обнаружены, многие исследователи продолжали использовать фармакологические методы для изучения того, как АТФ, высвобождаемый нейронами, доставляет сообщения в мышцы и другие клетки тела. Основываясь на этой работе, Бернсток в 1978 г. предположил, что существуют отдельные семейства рецепторов для АТФ (которые он обозначил как рецепторы Р2) и для конечного продукта его распада, аденозина (которые он назвал рецепторами Р1). Дальнейшие исследования показали, что активация АТФ рецепторов Р2 может вызывать различные клеточные эффекты. Это привело Бернстока и его сотрудника Чарльза Кеннеди к предположению о существовании подтипов рецепторов P2, которые они назвали P2X и P2Y.
Тем не менее, идея о том, что нервы выделяют АТФ в качестве нейротрансмиттера, оставалась спорной и многие годы отвергали ее. Однако в 1990-х годах стали доступны молекулярные инструменты, которые позволили многим исследовательским группам изолировать рецепторы АТФ и дополнительно изучить их многочисленные захватывающие эффекты на клетки нервной системы и за ее пределами.
Взаимодействие и динамика
В начале 1990-х годов был инициирован проект «Геном человека» и началась эра плодотворных открытий генов, кодирующих важные белки в организме человека. Среди этих генов было несколько генов рецепторов АТФ, что позволило ученым локализовать сами рецепторы во многих различных типах клеток. Исследования передачи сигналов АТФ вступили в новую захватывающую эру. Попытки охарактеризовать молекулярную структуру пуриновых рецепторов доказали существование большого семейства рецепторов и выявили ряд каналов и ферментов на поверхности клеток, которые участвуют в передаче сигналов АТФ.
Как и предполагалось, были идентифицированы два широких класса рецепторов, но работа также выявила гораздо больше подтипов рецепторов, чем ожидалось, в этих классах. Это разнообразие подразумевало, что на определенные подтипы рецепторов можно воздействовать с помощью высокоселективных препаратов для модуляции передачи сигналов АТФ только в определенных тканях или типах клеток — перспектива, которая сегодня приносит плоды.
После первоначального выделения АТФ-рецепторов различные исследователи показали, что два основных класса действуют существенно по-разному. Рецепторы P2X принадлежат к «суперсемейству» управляемых передатчиком ионных каналов. Один из нас (Хах) вместе с другими исследователями показал, что при связывании с АТФ рецепторы Р2Х буквально открываются, образуя канал, позволяющий ионам натрия и кальция устремляться в клетки. Рецепторы P2Y, напротив, не открываются таким же образом, но связывание АТФ с их внеклеточной поверхностью запускает каскад молекулярных взаимодействий внутри клеток, что приводит к высвобождению внутриклеточных запасов кальция. В обоих случаях кальций может запускать дальнейшие молекулярные события, которые изменяют поведение клеток.
Хотя АТФ остается в синаптической щели ненадолго, клеточные эффекты активации рецепторов в одних случаях могут проявляться быстро — в течение миллисекунд, а в других — медленно — иногда в течение нескольких лет. Например, проникновение ионов кальция через P2X-каналы может привести к тому, что клетка высвобождает другие медиаторы, как показал Khakh на ткани головного мозга, или кальций, высвобождаемый при активации P2Y, может изменить активность генов, участвующих в пролиферации клеток, что вызывает изменения в ткани на протяжении всей жизни. последствия. Несмотря на то, что присутствие молекул АТФ во внеклеточном пространстве кратковременно, их биологические эффекты могут быть весьма всеобъемлющими.
последствия. Несмотря на то, что присутствие молекул АТФ во внеклеточном пространстве кратковременно, их биологические эффекты могут быть весьма всеобъемлющими.
Механизмы передачи сигналов АТФ становятся еще более увлекательными, если принять во внимание их взаимодействие с другими сигнальными системами вне клеток. Большое семейство ферментов, известных как эктоАТФазы, расположено на поверхности большинства клеток, где они быстро удаляют фосфаты из АТФ один за другим, последовательно превращая молекулу АТФ в аденозиндифосфат (АДФ), аденозинмонофосфат (АМФ) и, наконец, только аденозин. Каждый из продуктов распада АТФ может по-своему влиять на клетку, например, когда аденозин связывается с рецепторами P1.
Фусао Като из Медицинской школы Университета Дзикей в Токио показал, например, что АТФ и аденозин совместно действуют в сети ствола головного мозга, ответственной за основные функции организма, такие как дыхание, сердечный ритм и желудочно-кишечная деятельность. Однако существуют и другие ситуации, когда АТФ и аденозин противостоят друг другу, например, во время передачи от нейрона к нейрону, когда аденозин может ингибировать высвобождение АТФ нейроном в синаптическую щель. Взаимосвязанные эффекты АТФ, ее составных частей и внеклеточных эктоАТФаз, таким образом, можно рассматривать как формирование саморегулирующейся сигнальной петли во многих случаях.
Взаимосвязанные эффекты АТФ, ее составных частей и внеклеточных эктоАТФаз, таким образом, можно рассматривать как формирование саморегулирующейся сигнальной петли во многих случаях.
На действие молекулы на клетки влияют не только продукты распада АТФ. В нервной системе АТФ также действует совместно с другими нейротрансмиттерами в качестве комедиатора. Открытие этого явления в 1976 году Бернстоком помогло пересмотреть давнее представление о том, что любой конкретный нейрон может синтезировать, хранить и выделять только один вид нейротрансмиттера. На сегодняшний день имеется значительный объем данных, свидетельствующих о том, что АТФ обычно высвобождается вместе с классическими нейротрансмиттерами, такими как норадреналин или ацетилхолин. Хотя котрансмиссия была впервые предложена и доказана для АТФ, феномен нейронов, которые совместно высвобождают молекулы медиатора, теперь также продемонстрирован для множества других медиаторов, включая ГАМК с глицином, дофамином с серотонином и ацетилхолином с глутаматом. Таким образом, котрансмиссия является еще одним примером того, как исследования передачи сигналов АТФ выявили более общие физиологические принципы, а также сформировали и направили исследования в других областях.
Таким образом, котрансмиссия является еще одним примером того, как исследования передачи сигналов АТФ выявили более общие физиологические принципы, а также сформировали и направили исследования в других областях.
СПС в области здравоохранения и болезней
В свете установленной роли АТФ в передаче сигналов между клетками нервной системы неудивительно, что АТФ играет важную роль в функционировании пяти органов чувств. Например, в глазах рецепторы АТФ на нервных клетках сетчатки влияют на реакцию клеток на информацию, полученную от палочек и колбочек, детекторов света в глазах. Нервы сетчатки, в свою очередь, направляют АТФ и ацетилхолин в качестве копередатчиков для передачи информации в центры сенсорной обработки в головном мозге. В дополнение к этой повседневной функции АТФ несколько исследовательских групп показали, что передача сигналов АТФ в ключевой момент развития глаза эмбриона может иметь последствия, сохраняющиеся на протяжении всей жизни. Действительно, Николас Дейл из Уорикского университета в Англии и его коллеги показали, что высвобождение АТФ в критический момент у раннего эмбриона является сигналом для развития глаз.
Высвобождение АТФ во время развития также важно для правильного формирования улитки, органа, отвечающего за слух, а передача сигналов АТФ по-прежнему имеет решающее значение для работы внутреннего уха у взрослых. Около 50 000 волосковых клеток — нейронов внутреннего уха, передающих звук, — выстилают улитку человека, и около половины из них имеют рецепторы АТФ, которые, как было показано, при некоторых обстоятельствах облегчают возбуждение нейронов. Кроме того, вкусовые рецепторы, окончания чувствительных нервов на языке, обладают рецепторами P2X, которые опосредуют вкус. В особенно хорошо спланированном исследовании Сью К. Киннамон и ее коллеги из Университета штата Колорадо продемонстрировали, что АТФ играет жизненно важную роль в качестве передатчика от клеток вкусовых рецепторов к вкусовым нервам, и что у мышей отсутствуют оба P2X 9.Подтипы рецепторов 0048 2 и P2X 3 не способны ощущать вкус.
Интересно, что рецепторы P2X 2 и P2X 3 , присутствующие на вкусовых сосочках, являются одними и теми же рецепторами, участвующими в определенных типах передачи болевых сигналов. На протяжении десятилетий ученым было известно, что АТФ, введенный в кожу, вызывает боль. Стивен Б. МакМахон и его коллеги из Школы биомедицинских наук Гая, Кинга и Св. Томаса в Лондоне недавно показали, что боль вызывается активацией P2X 9.0048 3 АТФ-рецепторы на окончаниях чувствительных нервов в коже, которые опосредуют реакцию на прикосновение и боль. Другая форма боли, связанная с повреждением нервов, называется невропатической болью и вовлекает АТФ другим путем. Элегантные исследования Кадзухиде Иноуэ из Университета Кюсю в Японии и Майкла Солтера из Университета Торонто показывают, что ключевой шаг в развитии этого типа боли включает активацию рецепторов АТФ на иммунных клетках спинного мозга, называемых микроглией. Микроглия, в свою очередь, высвобождает молекулы, которые раздражают нервные волокна, что приводит к хронической боли [см. «Новые виновники хронической боли», Р. Дуглас Филдс; Scientific American , ноябрь 2009 г.].
На протяжении десятилетий ученым было известно, что АТФ, введенный в кожу, вызывает боль. Стивен Б. МакМахон и его коллеги из Школы биомедицинских наук Гая, Кинга и Св. Томаса в Лондоне недавно показали, что боль вызывается активацией P2X 9.0048 3 АТФ-рецепторы на окончаниях чувствительных нервов в коже, которые опосредуют реакцию на прикосновение и боль. Другая форма боли, связанная с повреждением нервов, называется невропатической болью и вовлекает АТФ другим путем. Элегантные исследования Кадзухиде Иноуэ из Университета Кюсю в Японии и Майкла Солтера из Университета Торонто показывают, что ключевой шаг в развитии этого типа боли включает активацию рецепторов АТФ на иммунных клетках спинного мозга, называемых микроглией. Микроглия, в свою очередь, высвобождает молекулы, которые раздражают нервные волокна, что приводит к хронической боли [см. «Новые виновники хронической боли», Р. Дуглас Филдс; Scientific American , ноябрь 2009 г.].
Из-за такого понимания сигнальной роли АТФ несколько фармацевтических компаний в настоящее время изучают рецепторы P2X в качестве новых мишеней для лекарств от невропатической боли или боли, вызванной воспалением. И боль — это лишь один из аспектов здоровья человека, который вскоре может выиграть от терапии, направленной на АТФ или ее рецепторы.
И боль — это лишь один из аспектов здоровья человека, который вскоре может выиграть от терапии, направленной на АТФ или ее рецепторы.
Люди с заболеваниями сердца и сосудов входят в число тех, кому будут полезны будущие препараты, воздействующие на АТФ-рецепторы. Причина становится ясной, если взглянуть на события, следующие за травмой. Клетки, которые находятся в состоянии стресса или физически повреждены, могут высвобождать или проливать АТФ во внеклеточное пространство. В таких ситуациях передача сигналов АТФ часто приводит к защитным и заживляющим реакциям, в том числе с помощью тромбоцитов, клеток, ответственных за образование сгустка, чтобы остановить кровотечение из новой раны. Тромбоциты отображают P2Y 12 подтипа рецептора, и его активация внеклеточным АТФ заставляет их претерпевать изменения, которые приводят к образованию сгустка. Конечно, этот же процесс способствует образованию тромбов в сосудах, что может привести к инфарктам и инсультам. Существующий «блокбастер» клопидогрел работает, блокируя рецептор P2Y12 на тромбоцитах и тем самым предотвращая образование тромбов АТФ. Несколько препаратов, которые действуют схожим образом, также проходят расширенные клинические испытания при коронарных заболеваниях.
Несколько препаратов, которые действуют схожим образом, также проходят расширенные клинические испытания при коронарных заболеваниях.
Столь же перспективной терапевтической областью является пищеварительная система. Джеймс Дж. Галлиган из Мичиганского государственного университета и другие продемонстрировали, что АТФ, направляемый из нервной системы кишечника в стенку кишечника, действует на рецепторы P2X и P2Y, контролируя ритмические сокращения, которые продвигают пищу по тракту. Между тем АТФ, который связывается с рецепторами P2Y на клетках, выстилающих внутреннюю поверхность стенки кишечника, запускает секрецию пищеварительных ферментов. Поэтому фармацевтические компании горячо ищут агенты, которые воздействуют на эти рецепторы, чтобы модулировать эти функции, в качестве потенциальных средств для лечения синдрома раздраженного кишечника и его более тяжелой формы, болезни Крона.
Участие АТФ в здоровом функционировании других органов и тканей делает его возможной лекарственной мишенью при длинном списке заболеваний, включая заболевания почек, костей, мочевого пузыря, кожи и даже неврологические и психические заболевания. Более того, АТФ может быть одним из естественных средств борьбы с раком. Элиезер Рапапорт, работая в Медицинской школе Бостонского университета, впервые описал эффект АТФ, убивающего опухоль, в 1983 году. рост опухолей, в том числе предстательной железы, молочной железы, колоректального рака, рака яичников и пищевода, а также клеток меланомы. Передача сигналов АТФ частично способствует самоубийству опухолевых клеток, а частично способствует дифференцировке клеток, что замедляет пролиферацию опухолевых клеток.
Более того, АТФ может быть одним из естественных средств борьбы с раком. Элиезер Рапапорт, работая в Медицинской школе Бостонского университета, впервые описал эффект АТФ, убивающего опухоль, в 1983 году. рост опухолей, в том числе предстательной железы, молочной железы, колоректального рака, рака яичников и пищевода, а также клеток меланомы. Передача сигналов АТФ частично способствует самоубийству опухолевых клеток, а частично способствует дифференцировке клеток, что замедляет пролиферацию опухолевых клеток.
Предстоит проделать большую работу, чтобы воплотить новые знания о передаче сигналов АТФ, собранные до сих пор, в новые лекарства, готовые к использованию в клинике. Но многие лаборатории и фармацевтические компании активно ищут лекарства, которые могут избирательно активировать или подавлять определенные подтипы рецепторов АТФ, ингибировать или усиливать высвобождение АТФ или ингибировать расщепление АТФ после того, как он был высвобожден из клеток.
Лучший мессенджер
Повсеместное распространение АТФ в качестве сигнальной молекулы создает по крайней мере одну серьезную проблему: разработка лекарств, нацеленных только на один орган или ткань, не вызывающих побочных эффектов в других системах организма.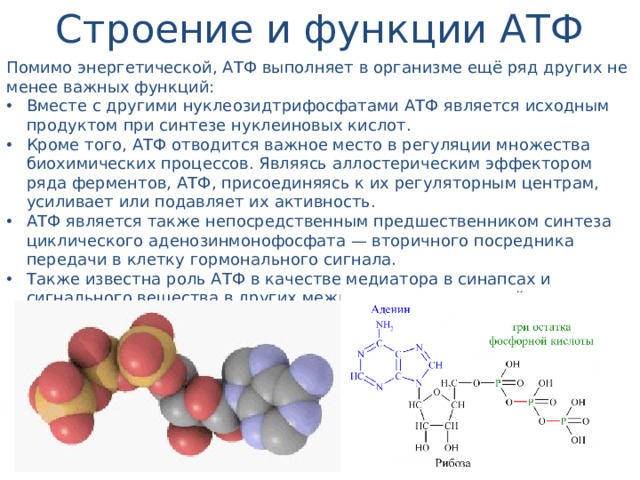 Однако эта проблема не уникальна для АТФ, и большое разнообразие конфигураций субъединиц, обнаруживаемых в разных типах клеток, сделает более возможным нацеливание на конкретные ткани. Кхах экспериментировал с созданием «дизайнерских» АТФ-рецепторов, которые можно было внедрить в культивируемые клетки или даже в живых лабораторных мышей и использовать для проверки эффектов тонкого изменения функции белка рецептора P2X. Это всего лишь один из подходов, который позволяет исследователям контролировать передачу сигналов АТФ и изучать результаты на живых организмах.
Однако эта проблема не уникальна для АТФ, и большое разнообразие конфигураций субъединиц, обнаруживаемых в разных типах клеток, сделает более возможным нацеливание на конкретные ткани. Кхах экспериментировал с созданием «дизайнерских» АТФ-рецепторов, которые можно было внедрить в культивируемые клетки или даже в живых лабораторных мышей и использовать для проверки эффектов тонкого изменения функции белка рецептора P2X. Это всего лишь один из подходов, который позволяет исследователям контролировать передачу сигналов АТФ и изучать результаты на живых организмах.
Одним из наиболее важных достижений за последние 20 лет стало недавнее определение кристаллической структуры P2X-канала рыбки данио Эриком Гуо и его коллегами из Орегонского университета здоровья и науки. Это знаменательное достижение показывает детали того, как работает рецептор АТФ, на атомном уровне и прокладывает путь к пониманию передачи сигналов АТФ от уровня молекул до уровня целых физиологических систем. Это также значительно ускорит процесс открытия лекарств.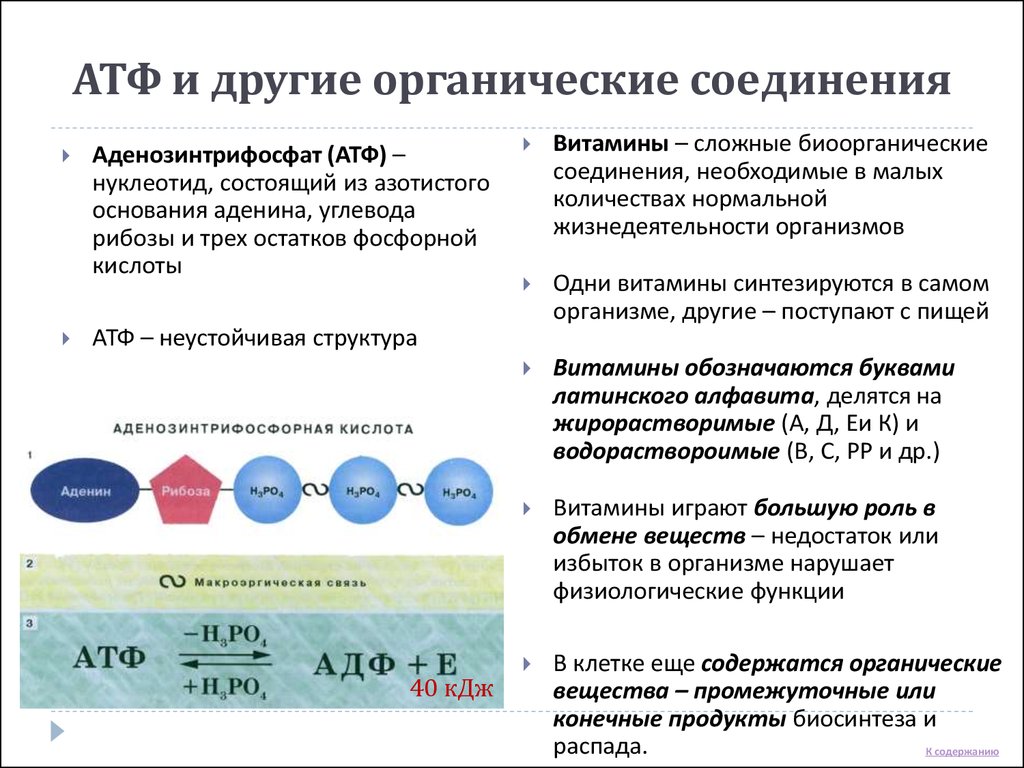
Недавние данные о наличии рецепторов АТФ в растениях и примитивных организмах, таких как зеленые водоросли, амебы и паразитические шистосомы, позволяют предположить, что нацеливание на передачу сигналов АТФ также может быть полезным в сельском хозяйстве и при лечении инфекционных заболеваний. Присутствие передачи сигналов АТФ у таких разнообразных форм жизни предполагает также, что функция АТФ как сигнальной молекулы проявилась в начале эволюции жизни — возможно, более или менее одновременно с ее принятием в качестве источника энергии. Многие сообщения о мощных эффектах, вызываемых АТФ и ее производными у большинства беспозвоночных и низших позвоночных животных, также предполагают, что влияние АТФ действительно может быть широко распространенным.
Нам приятно видеть, как роль АТФ как сигнальной молекулы превратилась из идеи, которая 50 лет назад считалась сомнительной, в обширную и динамичную область исследований, представляющую интерес для всего биологического сообщества и большую потенциальный импорт в медицину.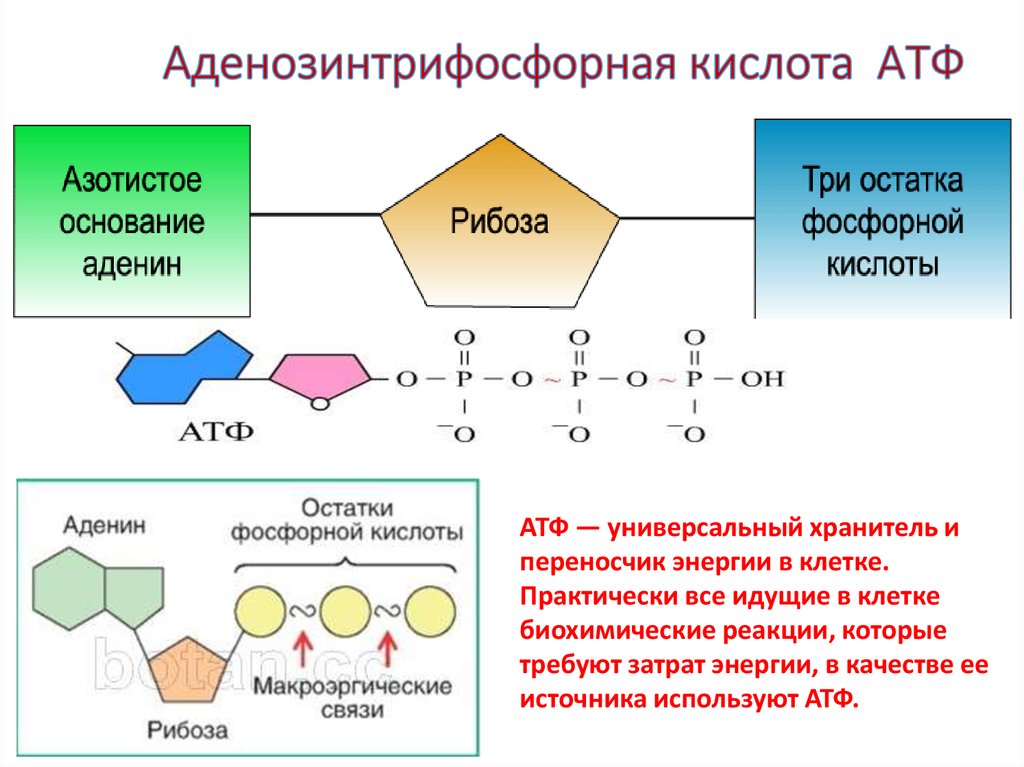 Мы с нетерпением ждем возможности увидеть, как дальнейшие прорывы в понимании удивительной двойной жизни АТФ будут использованы для улучшения качества жизни человека.
Мы с нетерпением ждем возможности увидеть, как дальнейшие прорывы в понимании удивительной двойной жизни АТФ будут использованы для улучшения качества жизни человека.
Примечание. Первоначально эта статья была напечатана под названием «Двойная жизнь АТФ».
Энергия клетки, функции клетки | Изучайте науку в Scitable
Конкретный энергетический путь, который использует клетка, во многом зависит от того, является ли эта клетка эукариотной или прокариотической. Эукариотические клетки используют три основных процесса для преобразования энергии, содержащейся в химических связях пищевых молекул, в более удобные для использования формы — часто богатые энергией молекулы-носители. Аденозин 5′-трифосфат, или АТФ, является наиболее распространенной молекулой переносчика энергии в клетках. Эта молекула состоит из
азотистое основание (аденин), сахар рибозы и три фосфатные группы. Слово аденозин
относится к аденину плюс сахару рибозе. Связь между вторым и
третий фосфат представляет собой высокоэнергетическую связь (рис.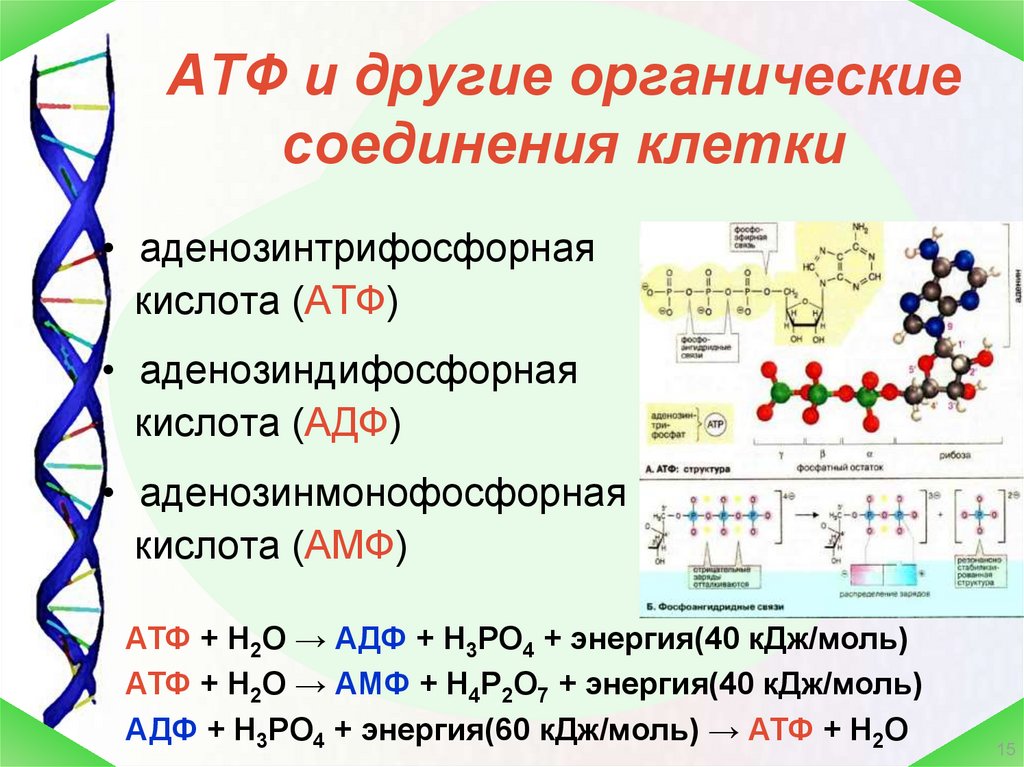 5).
5).
Первым процессом эукариотического энергетического пути является гликолиз , что буквально означает «расщепление сахара». Во время гликолиза отдельные молекулы глюкозы расщепляются и в конечном итоге превращаются в две молекулы вещества, называемого пируватом ; поскольку каждая глюкоза содержит шесть атомов углерода, каждый образующийся пируват содержит всего три атома углерода. Гликолиз на самом деле представляет собой серию из десяти химических реакций, которые требуют ввода двух молекул АТФ. Этот вход используется для создания четырех новых молекул АТФ, что означает, что гликолиз приводит к чистому приросту двух АТФ. Также образуются две молекулы НАДН; эти молекулы служат переносчиками электронов для других биохимических реакций в клетке.
Гликолиз — это древний основной путь образования АТФ, который присутствует почти во всех клетках, как у эукариот, так и у прокариот. Этот процесс, также известный как ферментация , происходит в цитоплазме и не требует кислорода. Однако судьба пирувата, образующегося во время гликолиза, зависит от того, присутствует ли кислород. В отсутствие кислорода пируват не может полностью окислиться до углекислого газа, поэтому образуются различные промежуточные продукты. Например, когда уровень кислорода низкий, клетки скелетных мышц полагаются на гликолиз для удовлетворения своих интенсивных энергетических потребностей. Эта зависимость от гликолиза приводит к накоплению промежуточного продукта, известного как молочная кислота, из-за которого мышцы человека могут чувствовать себя «в огне». Точно так же дрожжи, одноклеточные эукариоты, производят спирт (вместо углекислого газа) в условиях дефицита кислорода.
Однако судьба пирувата, образующегося во время гликолиза, зависит от того, присутствует ли кислород. В отсутствие кислорода пируват не может полностью окислиться до углекислого газа, поэтому образуются различные промежуточные продукты. Например, когда уровень кислорода низкий, клетки скелетных мышц полагаются на гликолиз для удовлетворения своих интенсивных энергетических потребностей. Эта зависимость от гликолиза приводит к накоплению промежуточного продукта, известного как молочная кислота, из-за которого мышцы человека могут чувствовать себя «в огне». Точно так же дрожжи, одноклеточные эукариоты, производят спирт (вместо углекислого газа) в условиях дефицита кислорода.
Напротив, при наличии кислорода пируваты, образующиеся в результате гликолиза, становятся исходными веществами для следующей части энергетического пути эукариот. На этом этапе каждая молекула пирувата в цитоплазме попадает в митохондрию, где превращается в ацетил-КоА , двухуглеродный энергоноситель, а его третий углерод соединяется с кислородом и высвобождается в виде углекислого газа. В то же время также образуется переносчик NADH. Затем ацетил-КоА поступает в путь, называемый 9-й.0095 цикл лимонной кислоты , который является вторым основным энергетическим процессом, используемым клетками. Восьмистадийный цикл лимонной кислоты генерирует еще три молекулы НАДН и две другие молекулы-носители: ФАДН 2 и ГТФ (рис. 6, в середине).
В то же время также образуется переносчик NADH. Затем ацетил-КоА поступает в путь, называемый 9-й.0095 цикл лимонной кислоты , который является вторым основным энергетическим процессом, используемым клетками. Восьмистадийный цикл лимонной кислоты генерирует еще три молекулы НАДН и две другие молекулы-носители: ФАДН 2 и ГТФ (рис. 6, в середине).
Третий основной процесс эукариотического энергетического пути включает электрон-транспортную цепь , катализируемую несколькими белковыми комплексами, расположенными во внутренней мембране митохондрий. Этот процесс, называемый окислительным фосфорилированием, переносит электроны от NADH и FADH 2 через мембранные белковые комплексы и, в конечном счете, к кислороду, где они соединяются с образованием воды. Когда электроны проходят через белковые комплексы в цепи, через митохондриальную мембрану формируется градиент ионов водорода или протонов. Клетки используют энергию этого протонного градиента для создания трех дополнительных молекул АТФ на каждый электрон, перемещающийся по цепи.


 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав