Энергетический обмен клетки в норме и патологии. Возможности его оценки
Энергетический обмен, согласно современным представлениям, является совокупностью реакций окисления, протекающих во всех живых клетках [1–3, 13]. Его основная функция — обеспечение организма энергией в доступной для использования форме — аденозинтрифосфата (АТФ).
Энергия АТФ необходима для функционирования всех систем организма (сердечно-сосудистой, нервной, мышечной, терморегуляции и др.). Процессы гликолиза, глюконеогенеза, первичная клеточная защита, выработка антител, транспорт веществ через клеточные мембраны, поддержание гемоглобина в функционально активном состоянии невозможны без использования АТФ [1–3].
Следует отметить, что 95 % адениннуклеотидов, составляющих АТФ, содержатся в эритроцитах, не имеющих митохондрий. Синтез АТФ осуществляется в них путем гликолиза. В норме основной энергетический обмен происходит на мембранах митохондрий в ходе клеточного дыхания и окислительного фосфорилирования. Для функционирования внутримитохондриальной части процесса необходим кислород, поэтому в анаэробных условиях в клетках накапливается пируват. Избыток пирувата превращается в лактат, который диффундирует из клеток в кровяное русло [3, 17]. Концентрация лактата во внеклеточной жидкости составляет около 1 ммоль/л, отражая динамический процесс образования и потребления от 1200 до 1500 ммоль лактата в течение суток [14]. Лактат как продукт анаэробного гликолиза образуется в скелетных мышцах, кишечнике, мозге, коже и в эритроцитах. Интенсивные физические упражнения сопровождаются возрастанием продукции лактата в мышцах, достигая 10-кратного увеличения в сравнении с исходным состоянием покоя. Ресинтез глюкозы из лактата происходит в печени путем глюконеогенеза [18].
Для функционирования внутримитохондриальной части процесса необходим кислород, поэтому в анаэробных условиях в клетках накапливается пируват. Избыток пирувата превращается в лактат, который диффундирует из клеток в кровяное русло [3, 17]. Концентрация лактата во внеклеточной жидкости составляет около 1 ммоль/л, отражая динамический процесс образования и потребления от 1200 до 1500 ммоль лактата в течение суток [14]. Лактат как продукт анаэробного гликолиза образуется в скелетных мышцах, кишечнике, мозге, коже и в эритроцитах. Интенсивные физические упражнения сопровождаются возрастанием продукции лактата в мышцах, достигая 10-кратного увеличения в сравнении с исходным состоянием покоя. Ресинтез глюкозы из лактата происходит в печени путем глюконеогенеза [18].
Энергия, образующаяся в результате окислительного фосфорилирования и гликолиза, неравноценна. Так, при гликолизе одной молекулы глюкозы образуется 16–20 ккал, а в процессе окислительного фосфорилирования — 304–380 ккал [3]. Гликолиз всегда сопровождается продукцией иона водорода, что приводит к ацидозу, вначале внутриклеточному, затем тканевому и, наконец, системному [15]. Однако при нормальном течении энергетического обмена функция клеток не нарушается и показатели кислотно-основного состояния крови остаются константными величинами.
Однако при нормальном течении энергетического обмена функция клеток не нарушается и показатели кислотно-основного состояния крови остаются константными величинами.
Биохимическая и клиническая интерпретация уровня лактата в крови, на первый взгляд, выглядит достаточно просто: осуществляется только одна реакция — преобразование пирувата в лактат и наоборот [14]. Тем не менее открытие продукции лактата из глюкозы путем гликолиза, а также превращения лактата в глюкозу путем глюконеогенеза является одним из величайших достижений биохимии в ХХ веке [18]. Содержание лактата в плазме крови здоровых людей достаточно стабильно, возрастные и половые различия незначительны. Результаты определения этого метаболита в депротеинизированной крови дают более низкие показатели, чем в плазме крови [14]. У здоровых людей повышение уровня лактата обычно обусловлено физической нагрузкой, особенно после продолжительных мышечных тренировок. Наряду с указанным повышение уровня лактата наблюдается при ряде генетических заболеваний, вследствие несбалансированного питания (например, при недостатке тиамина) и у женщин в последнем триместре беременности [14, 18].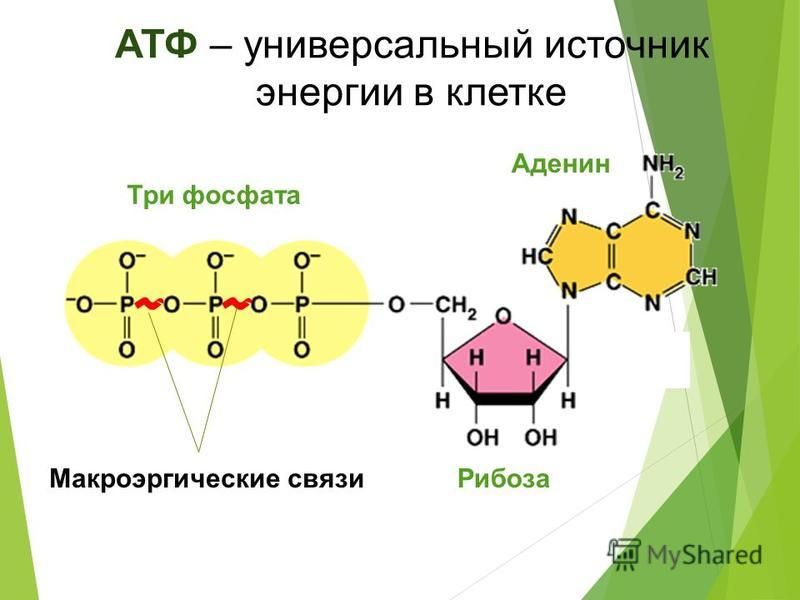
Основной причиной, ведущей к наиболее выраженным нарушениям процессов энергообеспечения, является гипоксия [2, 4, 5, 13], представляющая собой несоответствие энергопотребности клетки энергопродукции в системе митохондриального окислительного фосфорилирования [1, 2, 6, 7]. К ее развитию могут приводить различные причины, самыми распространенными из которых являются расстройства внешнего дыхания, нарушения кровообращения и микроциркуляции, изменения кислородтранспортной функции крови и др. [5, 8, 13].
При гипоксии снижается поступление кислорода в клетку и, как следствие, в митохондрии. В результате развивается нарушение митохондриального окисления, что приводит к разобщению сопряженного с ним фосфорилирования и, следовательно, вызывает прогрессирующий дефицит АТФ [13, 15]. В условиях энергодефицита клетка поддерживает собственные энергетические потребности за счет активации процессов анаэробного гликолиза, который частично компенсирует недостаток АТФ, однако быстро вызывает накопление лактата и развитие ацидоза. При этом активизируется протеолиз, усиливается внутриклеточный ацидоз, что, в свою очередь, вызывает повреждение цитомембран, сопровождающееся инициацией перекисного окисления липидов и накоплением в жидких средах его продуктов: малонового диальдегида, диеновых и триеновых конъюгат, гидроперекисей липидов, диенкетонов [6]. Результатом этого является деструкция клеточных мембран и разрушение клеток [9, 10].
При этом активизируется протеолиз, усиливается внутриклеточный ацидоз, что, в свою очередь, вызывает повреждение цитомембран, сопровождающееся инициацией перекисного окисления липидов и накоплением в жидких средах его продуктов: малонового диальдегида, диеновых и триеновых конъюгат, гидроперекисей липидов, диенкетонов [6]. Результатом этого является деструкция клеточных мембран и разрушение клеток [9, 10].
Особенно чувствительны к гипоксии кардиомиоциты и нейроглия, так как митохондрии в этих клетках составляют до 30 % объема цитоплазмы [7].
Стандартные методы оценки внутриклеточных процессов (биопсия скелетных мышц, молекулярно-генетический анализ и др.) технически сложны, инвазивны и дорогостоящи, что ограничивает их использование, в частности, у детей. Преимущественным методом, который отражает состояние энергетического обмена клеток и тканей и коррелирует с морфологическими изменениями в биоптатах мышечной ткани, является цитохимический анализ ферментного статуса клеток периферической крови (лактатдегидрогеназы, участвующей в окислении L-лактата в пировиноградную кислоту, сукцинатдегидрогеназы и других ферментов, являющихся катализаторами цикла трикарбоновых кислот) [11].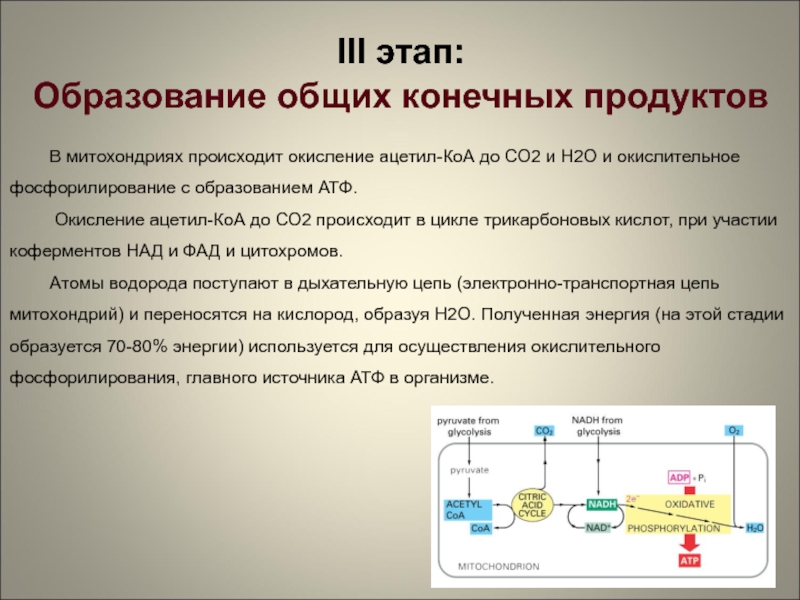
Впервые возможность исследования уровня лактата в крови млекопитающих продемонстрировал Gaglio в 1886 году. Исследование занимало несколько дней и требовало около 200 мл крови животного. В 1940 г. Barker и Summerson существенно упростили методику, в дальнейшем эта работа была продолжена [11].
В настоящее время для исследования уровня лактата наиболее часто используют измерение скорости формирования НАДФ (переносчика электронов и протонов от органических субстратов к кислороду для образования АТФ) при окислении лактатоксидазой. Преимуществами данного метода являются несложность методики исследования, использование стабильных реагентов, высокая точность результатов, что делает возможным его проведение в условиях любой лаборатории [16].
В 1964 году Broder и Weil выявили корреляционную взаимосвязь уровня лактата крови с тяжестью шока. В ряде работ, выполненных за рубежом [9, 15–17], доказана роль уровня лактата крови у больных, находящихся в критическом состоянии, как показателя степени гипоксии тканей, в оценке эффективности терапии, как прогностического признака неблагоприятного исхода. Повышение уровня лактата наблюдается при шоке любой этиологии, анемии, астматическом статусе, сепсисе и других инфекциях, почечной недостаточности, врожденных метаболических нарушениях, отравлении монооксидом углерода и др. [15].
Повышение уровня лактата наблюдается при шоке любой этиологии, анемии, астматическом статусе, сепсисе и других инфекциях, почечной недостаточности, врожденных метаболических нарушениях, отравлении монооксидом углерода и др. [15].
Повышение уровня лактата наблюдается при сердечной недостаточности (острой и хронической), коррелируя со степенью ее тяжести, при остром септическом эндокардите, полиомиелите, воспалительных заболеваниях сосудов, синдроме гипервентиляции и др. [18].
Представляют интерес данные о значении уровня лактата в качестве прогностического признака неблагоприятного исхода патологических процессов. Доказано [14–16], что повышение уровня лактата происходит раньше, чем изменения других показателей развивающегося шока (гипотония, олигурия, снижение рН и др.). Выявлена прямая корреляция между уровнем лактата крови у больных в критическом состоянии и показателем летальности. Javier Aduen et al. установлено, что повышение лактата до 2,7 ммоль/л не изменяло показателей летальности, при уровне 4,0 ммоль/л таковая достигала 50 %, а при 8 ммоль/л и более составляла 90 % [17]. Вместе с тем констатировано отсутствие подобной корреляции у новорожденных, перенесших асфиксию, уровень лактата в крови у которых превышал физиологические величины в 8–9 раз [14].
Вместе с тем констатировано отсутствие подобной корреляции у новорожденных, перенесших асфиксию, уровень лактата в крови у которых превышал физиологические величины в 8–9 раз [14].
В отечественной литературе представлены результаты единичных исследований уровня лактата при патологических состояниях у детей. Так, С.Г. Иванусь и К.Д. Дука при обследовании детей с хроническими заболеваниями бронхолегочной системы выявили повышение активности лактатдегидрогеназы как показателя снижения интенсивности энергетического обмена и компенсаторной активации анаэробного гликолиза [11, 12].
А.В. Костенко с соавт. [19], изучая особенности прооксидантно-оксидантного баланса и энергетического метаболизма у 147 здоровых детей младшего школьного возраста, доказали зависимость уровня неспецифической резистентности организма как от показателей митохондриального окисления, так и от прооксидантно-оксидантной системы. У каждого пятого обследованного выявлено изменение клеточного метаболизма (показателя энергетического обмена) при нормальном состоянии антиоксидантной системы. Указанное подтверждает взаимную связь, но неравнозначность понятий «энергетический обмен» и «перекисное окисление липидов».
Указанное подтверждает взаимную связь, но неравнозначность понятий «энергетический обмен» и «перекисное окисление липидов».
Таким образом, состояние энергетического обмена является важным показателем функционирования всех систем организма. Исследование уровня лактата в плазме крови и лактатдегидрогеназы в эритроцитах может использоваться в ранней (доклинической) диагностике заболеваний, для определения степени тяжести патологического процесса, в оценке эффективности профилактических и лечебно-реабилитационных мероприятий.
Список літератури1. Ленинджер А. Основы биохимиии. — М.: Мир, 1985. — Т. 1. — 367 с.
2. Биохимия человека / Марри Р., Греннер Д., Мейес П., Родуэлл В. — М., 1993. — Т. 1-2. — 779 с.
3. Брязгунов И.П. Длительные субфебрилитеты у детей (клиника, этиология, патогенез и лечение). — 2-е изд. — МИА, 2008. — 240 с.
4. Bjelakovic G., Jevtovik T., Stojanovik I. et al. Biochemтical study of hematological diseases in childhood // Jugoslav.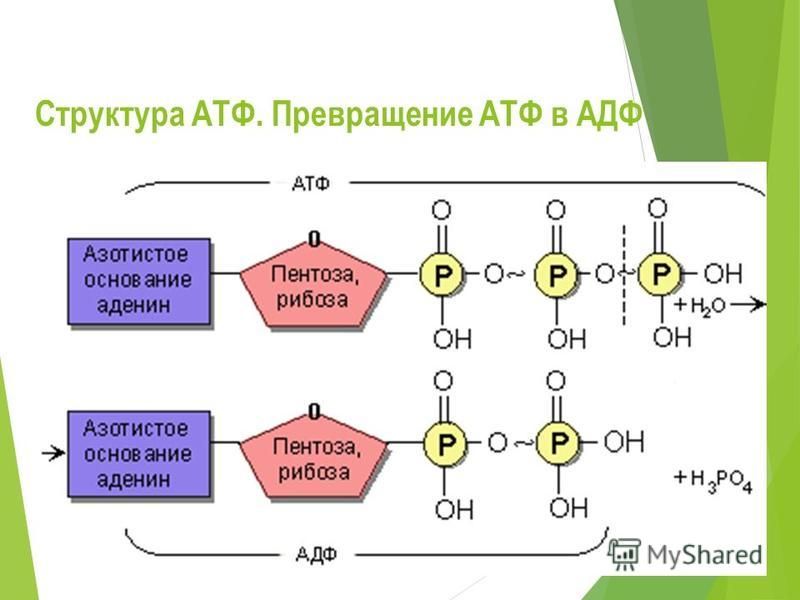 Med. Biohem. — 2003. — 22. — Р. 141-149.
Med. Biohem. — 2003. — 22. — Р. 141-149.
5. Илларионов М.Ю. Биохимические процессы, лежащие в основе свободнорадикального окисления, механизмы антирадикальной защиты, оценка их эффективности у онкологических больных. http://www.medlinks.ru
6. Поздняков А.А. Ранняя диагностика гипоксического поражения ЦНС у новорожденных. http://www.vsma.ac.ru/publ/vest/011/09.doc
7. Horowitz J., Frenneaux M. Metabolic manipulation in ischaemic heart disease, a novel approach to treatment // Eur. Heart J. — 2004. — 25(8). — 634-641.
8. Подколзин А.А., Мегреладзе А.Г., Донцов В.И., Арутюнов С.Д., Мрикаева О.М., Жукова Е.А. Система антиоксидантной защиты организма и старение. http://medi.ru
9. Ruuge E.K., Ledenev A.N., Lakomkin V.L., Konstantinov A.A., Ksenzenko M.Yu. Free radical metabolites in myocardium during ishemia and reperfusion // American Journal of Physiology. — 1991. — 261. — P. 81-86.
10. Nohl H. A novel superoxide radical generator in heart mitochondria // FEBS Letters. — 1993. — 214. — P. 268-273.
— 1993. — 214. — P. 268-273.
11. Іванусь С.Г., Дука К.Д. Діагностика мітохондріальної дисфункції у дітей з хронічними бронхолегеневими захворюваннями // Таврический медико-биологический вестник. — 2008. — Т. 11. — С. 85.
12. Іванусь С.Г., Дука К.Д. Стан енергетичного обміну у дітей з хронічними захворюваннями бронхолегеневої системи // Таврический медико-биологический вестник — 2008. — Т. 11. — С. 84-85.
13. Кравцова Л.А., Школьникова М.А., Калинин Л.А. Антигипоксанты в практике детского кардиолога-аритмолога: Метод. Рекомендации. — М., 2008. — 24 с.
14. Челноков С.Б., Пудина Н.А. Уровень лактата крови у новорожденных, рожденных в асфиксии // Мат-лы 1-го Российского конгресса по детской анестезиологии и реаниматологии. — М., 2001. — С. 321-322.
15. James A. Kruse. Understanding Blood Lactate Analysis // The Journal for Respiratory Care Practitioners. — 1995. — 63-69.
16. John Toffaletti. Elevations in blood lactate: Overview of use in critical care // Scand. J. Clin. Lab. Invest. — 1996. — 56, Suppl. 224. — 107-110.
J. Clin. Lab. Invest. — 1996. — 56, Suppl. 224. — 107-110.
17. Javier Aduen et al. The Use and Clinical Importance of a Substrate-Specific Electrode for Rapid Determination of Blood Lactate Concentrations // JAMA. — 1994 December 7. — Vol. 272, № 21.
18. Торшин В.А. Уровень лактата в крови как показатель STAT-анализа // Лаборатория. — 2001. — № 4. — С. 17-19.
19. Костенко А.В., Несвітайлова К.В., Квашніна Л.В., Матвійчук В.В. Особливості оксидантно-прооксидантного балансу та енергетичного метаболізму у здорових дітей молодшого шкільного віку // Современная педиатрия. — 2007. — № 4. — С. 148-152.
Где и как образуется АТФ?. Рассказы о биоэнергетике
Где и как образуется АТФ?
Первой системой, для которой выяснили механизм образования АТФ, оказался гликолиз — вспомогательный тип энергообеспечения, включающийся в условиях нехватки кислорода. При гликолизе молекула глюкозы расщепляется пополам и полученные обломки окисляются до молочной кислоты.
Такое окисление сопряжено с присоединением фосфорной кислоты к каждому из фрагментов молекулы глюкозы, то есть с их фосфорилированием. Последующий перенос фосфатных остатков с фрагментов глюкзы на АДФ дает АТФ.
Механизм образования АТФ при внутриклеточном дыхании и фотосинтезе долгое время оставался совершенно неясным. Было известно только, что ферменты, катализирующие эти процессы, встроены в биологические мембраны — тончайшие пленки (толщиной около одной миллионной доли сантиметра), состоящие из белков и фосфорилированных жироподобных веществ — фосфолипидов.
Мембраны — важнейший структурный компонент любой живой клетки. Внешняя мембрана клетки отделяет протоплазму от окружающей клетку среды. Клеточное ядро окружено двумя мембранами, которые образуют ядерную оболочку — преграду между внутренним содержимым ядра (нуклеоплазмой) и остальной частью клетки (цитоплазмой). Кроме ядра, в клетках животных и растений находят еще несколько структур, окруженных мембранами. Это эндоплазматическая сеть — система мельчайших трубочек и плоских цистерн, стенки которых образованы мембранами. Это, наконец, митохондрии — шарообразные или вытянутые пузырьки размером мельче ядра, но крупнее компонентов эндоплазматической сети. Диаметр митохондрии обычно около микрона, хотя иногда митохондрии образуют ветвящиеся и сетчатые структуры протяженностью в десятки микрон.
Это, наконец, митохондрии — шарообразные или вытянутые пузырьки размером мельче ядра, но крупнее компонентов эндоплазматической сети. Диаметр митохондрии обычно около микрона, хотя иногда митохондрии образуют ветвящиеся и сетчатые структуры протяженностью в десятки микрон.
В клетках зеленых растений, помимо ядра, эндоплазматической сети и митохондрий, находят еще и хлоропласты — мембранные пузырьки более крупные, чем митохондрии.
Каждая из этих структур выполняет свою, специфическую биологическую функцию. Так, ядро — вместилище ДНК. Здесь происходят процессы, лежащие в основе генетической функции клетки, и начинается сложная цепь процессов, приводящая в конечном итоге к синтезу белка. Этот синтез завершается в мельчайших гранулах — рибосомах, большая часть которых связана с эндоплазматической сетью. В митохондриях происходят окислительные реакции, совокупность которых называется внутриклеточным дыханием. Хлоропласты отвечают за фотосинтез.
Клетки бактерий устроены проще.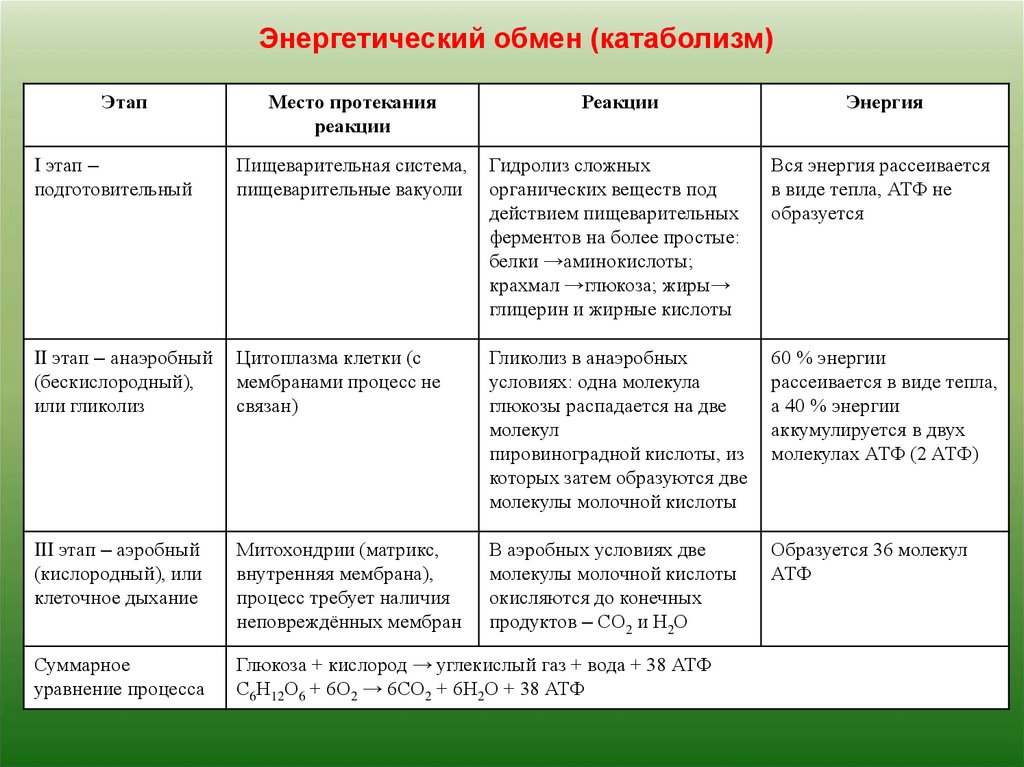 Обычно они имеют только две мембраны — внешнюю и внутреннюю. Бактерия — это как бы мешок в мешке, а точнее, очень мелкий пузырек с двойной стенкой. Здесь нет ни ядра, ни митохондрий, ни хлоропластов.
Обычно они имеют только две мембраны — внешнюю и внутреннюю. Бактерия — это как бы мешок в мешке, а точнее, очень мелкий пузырек с двойной стенкой. Здесь нет ни ядра, ни митохондрий, ни хлоропластов.
Долгое время считалось, что образование АТФ при дыхании и фотосинтезе протекает аналогично уже известному превращению энергии при гликолизе (фосфорилирование расщепляемого вещества, его окисление и перенос остатка фосфорной кислоты на АДФ). Однако все попытки экспериментально доказать эту схему оканчивались неудачей.
Биосинтез АТФ
- Скачать PDF Копировать
 Sc. Рецензировано Afsaneh Khetrapal, BSc
Sc. Рецензировано Afsaneh Khetrapal, BScАденозинтрифосфат (АТФ) представляет собой высокоэнергетическую молекулу, присутствующую в живых клетках. Это нуклеозидтрифосфат, который обеспечивает клетки энергией для метаболизма и используется в нескольких клеточных процессах, включая синтез ключевых биомолекул.
АТФ обычно присутствует в клетках в концентрации 1–10 мМ – она постоянно рециркулируется в организмах, чтобы обеспечить постоянную поставку энергии для клеточных процессов.
АТФ может быть синтезирован в результате окислительно-восстановительных реакций, в которых в качестве источника энергии используются простые и сложные липиды или углеводы. Сложные источники энергии необходимо расщепить на более простые молекулы, прежде чем использовать их в синтезе АТФ. Сложные углеводы обычно гидролизуются до глюкозы и фруктозы, тогда как триглицериды метаболизируются с образованием глицерина и жирных кислот.
Биосинтез АТФ путем окислительного фосфорилирования и фотофосфорилирования является основным путем производства энергии у животных, растений и микробов. Эукариотическая продукция АТФ обычно происходит в митохондриях клетки.
Эукариотическая продукция АТФ обычно происходит в митохондриях клетки.
Важными путями, посредством которых эукариоты генерируют энергию, являются гликолиз, цикл лимонной кислоты (или цикл Кребса) и цепь переноса электронов (или путь окислительного фосфорилирования).
Вместе эти 3 этапа называются клеточным дыханием. У человека клеточное дыхание превращает аденозиндифосфат (АДФ) в АТФ и, таким образом, высвобождает энергию из молекул, богатых энергией.
Гликолиз
Гликолиз включает метаболизм глюкозы и глицерина с образованием пирувата. Эти реакции происходят в цитоплазме у большинства организмов и высвобождают чистое количество 2 АТФ. Здесь глюкоза превращается в пируват путем фосфорилирования с помощью двух ключевых ферментов — фосфоглицераткиназы и пируваткиназы.
Общая реакция может быть представлена следующим образом:
Глюкоза + 2 НАД + + 2 АДФ + 2 Р i à 2 Пируват + 2 НАДН + 2 Н + + 2 АТФ + 2 H 2 O
Таким образом, каждая молекула глюкозы подвергается гликолизу с образованием 2 пируватов.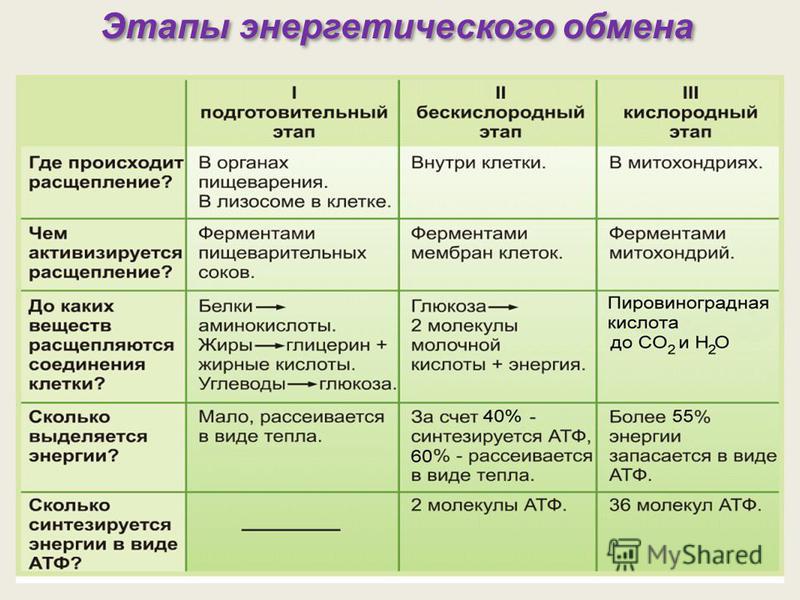 В результате гликолиза также образуются две молекулы восстановленного никотинамидадениндинуклеотида (NADH) и 2 молекулы воды (H 2 O). Молекулы НАДН окисляются в цепи переноса электронов с образованием АТФ, а образующийся пируват используется в качестве субстрата для цикла Кребса.
В результате гликолиза также образуются две молекулы восстановленного никотинамидадениндинуклеотида (NADH) и 2 молекулы воды (H 2 O). Молекулы НАДН окисляются в цепи переноса электронов с образованием АТФ, а образующийся пируват используется в качестве субстрата для цикла Кребса.
Цикл Кребса
Цикл Кребса также известен как цикл трикарбоновых кислот (TCA) и происходит в митохондриях. Он включает ряд реакций, в ходе которых пируват распадается до CO 2 , АТФ, вода и электроны.
Пируват, образующийся в результате гликолиза в цитоплазме, превращается в ацетил-Коэнзим А (ацетил-КоА) в митохондриях. Ацетил-КоА превращается в цитрат, который затем подвергается серии окислительно-восстановительных реакций, гидратации, дегидратации и декарбоксилирования с образованием изоцитрата, альфа-кетоглутерата, сукцин-КоА, фумерата и малата.
Эти реакции катализируются несколькими ключевыми ферментами пути, такими как цитратсинтаза, аконитаза, изоцитратдегидрогеназа и малатдегидрогеназа. В целом цикл Кребса дает 2 молекулы АТФ, 6 молекул НАДН и 2 восстановленных флавинадениндинуклеотида 9.0051 (FADH 2 ) молекулы.
В целом цикл Кребса дает 2 молекулы АТФ, 6 молекул НАДН и 2 восстановленных флавинадениндинуклеотида 9.0051 (FADH 2 ) молекулы.
Ацетил-КоА, полученный в результате метаболизма углеводов, жиров и белков в клетках, используется в цикле Кребса для выработки энергии. Следовательно, это важный метаболический путь, объединяющий углеводный, жировой и белковый обмены в живых организмах.
НАДН и ФАДН 2 Молекулы, образующиеся в качестве побочных продуктов цикла лимонной кислоты, поступают в цепь переноса электронов, где они окисляются с образованием АТФ с помощью фермента АТФ-синтазы. Этот фермент присутствует в митохондриях и катализирует выработку АТФ путем объединения АДФ и неорганического фосфата.
АТФ-синтазу часто называют сложной молекулярной машиной с центральным ротором, который движется со скоростью 150 об/с во время синтеза АТФ.
Всего каждая молекула глюкозы при клеточном дыхании производит 38 молекул АТФ – 2 АТФ в результате гликолиза, 2 АТФ в цикле Кребса и 34 АТФ в электрон-транспортной цепи.
Ссылки
- http://www.ncbi.nlm.nih.gov/pubmed/11997128
- http://www.ncbi.nlm.nih.gov/pubmed/12745923
- https://www.ncbi.nlm.nih.gov/pubmed/11997128
Последнее обновление: 26 февраля 2019 г.
- Скачать PDF Копировать
Пожалуйста, используйте один из следующих форматов, чтобы цитировать эту статью в своем эссе, статье или отчете:
APA
Cheriyedath, Susha. (2019, 26 февраля). Биосинтез АТФ. Новости-Мед. Получено 8 июня 2023 г. с сайта https://www.news-medical.net/life-sciences/ATP-Bio Synthese.aspx.
MLA
Чериедат, Суша. «Биосинтез АТФ». Новости-Медицина . 8 июня 2023 г.
Чикаго
Чериедат, Суша. «Биосинтез АТФ». Новости-Мед.
 https://www.news-medical.net/life-sciences/АТФ-Биосинтез.aspx. (по состоянию на 8 июня 2023 г.).
https://www.news-medical.net/life-sciences/АТФ-Биосинтез.aspx. (по состоянию на 8 июня 2023 г.).Гарвард
Чериедат, Суша. 2019. Биосинтез АТФ . News-Medical, просмотрено 8 июня 2023 г., https://www.news-medical.net/life-sciences/ATP-Bio Synthese.aspx.
4.10 Клеточное дыхание — биология человека
Перейти к содержимомуАвтор: CK-12/Адаптировано Кристин Миллер
Рис. 4.10.1 Готово!Этот манящий костер можно использовать как для обогрева, так и для освещения. Тепло и свет — это две формы , которые высвобождаются при сжигании такого топлива, как древесина. Живые существа также получают энергию путем «сжигания». Они «сгорают» в процессе, который называется .
— это процесс, при котором живые клетки расщепляют молекулы и высвобождают их. Этот процесс похож на горение, хотя он не дает света или сильного тепла, как у костра. Это связано с тем, что клеточное дыхание высвобождает энергию в глюкозе медленно и многими маленькими шагами. Он использует высвобождаемую энергию для образования молекул
Это связано с тем, что клеточное дыхание высвобождает энергию в глюкозе медленно и многими маленькими шагами. Он использует высвобождаемую энергию для образования молекул
C 6 H 12 O 6 6O 2 → 6CO 2 6H 2 O Химическая энергия (в A ТП)
Проще говоря, уравнение показывает, что глюкоза (C 6 H 12 O 6 ) и кислород (O 2 ) реагируют с образованием диоксида углерода (CO 2 ) и воды (H ).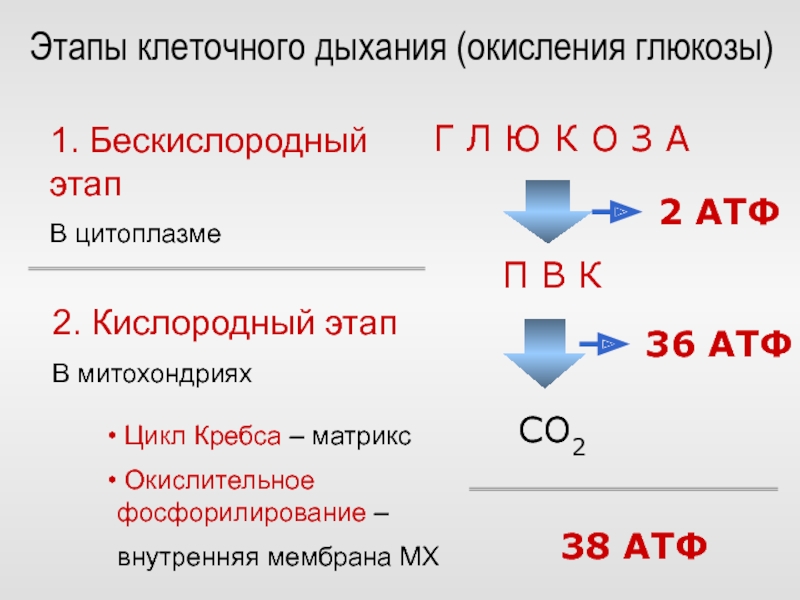
Клеточное дыхание встречается у всех живых существ, как у , так и у . Все они сгорают до формы. Реакции можно разделить на три стадии: гликолиз, цикл Кребса (также называемый циклом лимонной кислоты) и транспорт электронов. На рис. 4.10.2 представлен обзор этих трех этапов, которые также подробно описаны ниже.
Рис. 4.10.2 Клеточное дыхание протекает в стадии, показанные здесь. Процесс начинается с молекулы глюкозы, которая имеет шесть атомов углерода. Что происходит с каждым из этих атомов углерода?
Первая стадия клеточного дыхания , которая происходит в .
Расщепление глюкозы
Слово гликолиз буквально означает «расщепление глюкозы», что и происходит на этом этапе. расщепить молекулу глюкозы на две молекулы пирувата (также известного как пировиноградная кислота). Это происходит в несколько этапов, как показано на следующей диаграмме.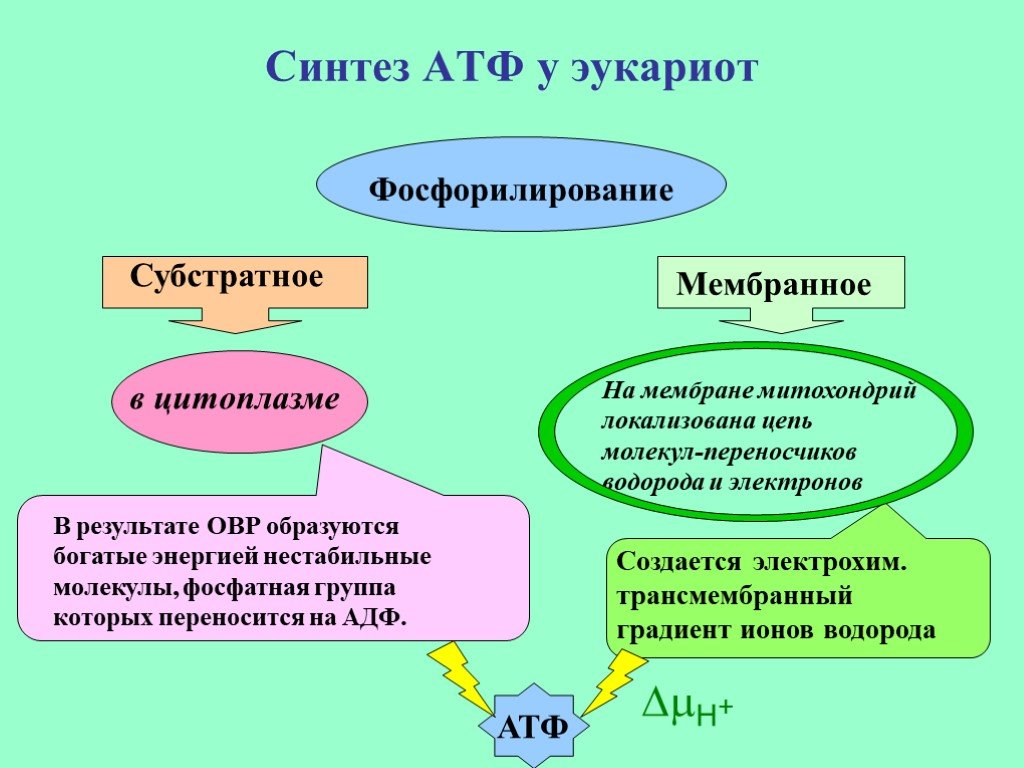
Результаты гликолиза
Энергия необходима в начале для расщепления молекулы глюкозы на две молекулы пирувата, которые переходят на II стадию клеточного дыхания. Энергия, необходимая для расщепления глюкозы, обеспечивается двумя молекулами АТФ; это называется фазой инвестиций в энергию. В ходе гликолиза высвобождается энергия, которая используется для образования четырех молекул АТФ; это фаза сбора энергии. В результате получается чистый прирост двух молекул АТФ во время гликолиза. На этом этапе высокоэнергетические электроны также передаются молекулам НАД с образованием двух молекул НАДН, другой молекулы, несущей энергию. НАДН используется на стадии III клеточного дыхания для производства большего количества АТФ.
Реакция перехода
Прежде чем пируват сможет перейти на следующую стадию клеточного дыхания, его необходимо немного модифицировать. Реакция перехода представляет собой очень короткую реакцию, в ходе которой две молекулы пирувата превращаются в две молекулы ацетил-КоА, двуокиси углерода, а две высокоэнергетические пары электронов превращают НАД в НАДН. Высвобождается углекислый газ, ацетил-КоА перемещается в митохондрии, чтобы войти в цикл Кребса (этап II), а НАДН переносит высокоэнергетические электроны в электрон-транспортную систему (этап III).
Рисунок 4.10.14: Во время реакции перехода пируват превращается в ацетил-КоА и диоксид углерода.Структура митохондрии
Рис. 4.10.5 Структура меченой митохондрии.Прежде чем читать о последних двух стадиях клеточного дыхания, вам нужно больше узнать о том, где эти две стадии происходят. Схема митохондрии показана на рис. 4.10.5.
Структура митохондрии определяется внутренней и внешней мембраной. Эта структура играет важную роль в аэробном дыхании.
Эта структура играет важную роль в аэробном дыхании.
Как видно из рисунка, митохондрия имеет внутреннюю и внешнюю мембраны. Пространство между внутренней и внешней мембраной называется . Пространство, окруженное внутренней мембраной, называется . В матриксе протекает вторая стадия клеточного дыхания (цикл Кребса). Третий этап (транспорт электронов) происходит на внутренней мембране.
Напомним, что образуются две молекулы пирувата (пировиноградной кислоты), которые затем превращаются в ацетил-КоА в ходе короткой переходной реакции. Эти молекулы входят в матрикс митохондрии, где они начинают (также известный как цикл лимонной кислоты). Причина, по которой эта стадия считается циклом, заключается в том, что молекула, называемая оксалоацетатом, присутствует как в начале, так и в конце этой реакции и используется для расщепления двух молекул ацетил-КоА. Реакции, которые происходят затем, показаны на рис. 4.10.6.
Рисунок 4.10. 6 Реагенты и продукты цикла Кребса.
6 Реагенты и продукты цикла Кребса. Этапы цикла Кребса
Сам процесс начинается, когда ацетил-КоА соединяется с четырехуглеродной молекулой, называемой ОАА (оксалоацетат) (см. рис. 4.10.6). Это производит лимонную кислоту, которая имеет шесть атомов углерода. Вот почему цикл Кребса также называют циклом лимонной кислоты.
После образования лимонная кислота проходит ряд реакций, в результате которых выделяется энергия. Энергия захватывается молекулами НАДН, АТФ и ФАДН 2 , другого кофермента, несущего энергию. Углекислый газ также выделяется как побочный продукт этих реакций.
На заключительном этапе цикла Кребса регенерируется ОАА, молекула, с которой начался цикл Кребса. Эта молекула необходима для следующего оборота цикла. Два оборота необходимы, потому что гликолиз производит две молекулы пировиноградной кислоты, когда она расщепляет глюкозу.
Результаты гликолиза, переходной реакции и цикла Кребса
После гликолиза, переходной реакции и цикла Кребса молекула глюкозы полностью расщепляется. Все шесть его атомов углерода соединились с кислородом с образованием углекислого газа. Энергия его химических связей хранится в общей сложности в 16 молекулах-носителях энергии. Эти молекулы:
Все шесть его атомов углерода соединились с кислородом с образованием углекислого газа. Энергия его химических связей хранится в общей сложности в 16 молекулах-носителях энергии. Эти молекулы:
- 4 АТФ (2 из гликолиза, 2 из цикла Кребса)
- 12 НАДН (2 из гликолиза, 2 из переходной реакции и 8 из цикла Кребса)
- 2 FADH 2 (оба из цикла Кребса)
События клеточного дыхания до этого момента – высвобождение энергии, которая хранилась в связях молекулы глюкозы. Эта энергия будет передана третьему и последнему этапу клеточного дыхания: системе переноса электронов, которая представляет собой . Использование экзотермической реакции для питания эндотермической реакции известно как .
Рисунок 4.10.7. Реагенты и продукты электронтранспортной цепи. ETC, на заключительном этапе клеточного дыхания вырабатывается 32 АТФ. Цепь переноса электронов является конечной стадией клеточного дыхания. На этом этапе энергия, транспортируемая NADH и FADH 2 , передается АТФ. Кроме того, кислород действует как конечный акцептор протонов для водорода, высвобождаемого из всех NADH и FADH 2 , образуя воду. На рис. 4.10.8 показаны реагенты и продукты ЭТЦ.
Кроме того, кислород действует как конечный акцептор протонов для водорода, высвобождаемого из всех NADH и FADH 2 , образуя воду. На рис. 4.10.8 показаны реагенты и продукты ЭТЦ.
Транспортировка электронов
— это третья стадия клеточного дыхания, показанная на рис. 4.10.8. На этом этапе из НАДН и ФАДН 2 высвобождаются высокоэнергетические электроны, которые движутся по электрон-транспортным цепям на внутренней мембране митохондрии. Цепь переноса электронов представляет собой ряд молекул, которые переносят электроны от молекулы к молекуле в результате химических реакций. Часть энергии электронов используется для перекачки ионов водорода (H) через внутреннюю мембрану из матрикса в межмембранное пространство. Этот ионный перенос создает , который управляет синтезом .
Рис. 4.10.8 Электронотранспортные цепи на внутренней мембране митохондрии осуществляют последнюю стадию клеточного дыхания.
Изготовление АТФ
Как показано на рис. 4.10.8, прокачка ионов водорода через внутреннюю мембрану создает большую концентрацию ионов в межмембранном пространстве, чем в матрице. Этот градиент заставляет ионы течь обратно через мембрану в матрицу, где их концентрация ниже. АТФ-синтаза действует как канальный белок, помогая ионам водорода проходить через мембрану. Он также действует как фермент, образуя АТФ из АДФ и неорганического фосфата в процессе, называемом окислительным фосфорилированием. Пройдя электрон-транспортную цепь, «отработанные» электроны соединяются с кислородом, образуя воду.
4.10.8, прокачка ионов водорода через внутреннюю мембрану создает большую концентрацию ионов в межмембранном пространстве, чем в матрице. Этот градиент заставляет ионы течь обратно через мембрану в матрицу, где их концентрация ниже. АТФ-синтаза действует как канальный белок, помогая ионам водорода проходить через мембрану. Он также действует как фермент, образуя АТФ из АДФ и неорганического фосфата в процессе, называемом окислительным фосфорилированием. Пройдя электрон-транспортную цепь, «отработанные» электроны соединяются с кислородом, образуя воду.
Вы видели, как три стадии используют энергию глюкозы для создания . Сколько АТФ образуется на всех трех стадиях вместе взятых? Гликолиз производит две молекулы АТФ, а цикл Кребса производит еще две. Транспорт электронов начинается с нескольких молекул НАДН и ФАДН 2 из цикла Кребса и передает их энергию еще 34 молекулам АТФ. Таким образом, всего лишь из одной молекулы глюкозы в процессе клеточного дыхания может быть получено до 38 молекул АТФ.
- — это процесс, при котором живые клетки расщепляют молекулы, высвобождая энергию и образуя молекулы . Вообще говоря, этот трехэтапный процесс включает реакцию глюкозы и кислорода с образованием углекислого газа и воды.
- В цитоплазме протекает первая стадия клеточного дыхания, называемая . На этом этапе ферменты расщепляют молекулу глюкозы на две молекулы пирувата, что высвобождает энергию, которая передается АТФ. После гликолиза короткая реакция, называемая переходной реакцией, превращает пируват в две молекулы ацетил-КоА.
- Органелла, называемая митохондрией, является местом двух других стадий клеточного дыхания. Митохондрия имеет внутреннюю и внешнюю мембраны, разделенные межмембранным пространством, а внутренняя мембрана заключает в себе пространство, называемое матриксом.
- Вторая стадия клеточного дыхания, называемая , происходит в матриксе митохондрии. На этом этапе два оборота в цикле приводят к тому, что все атомы углерода из двух молекул пирувата образуют диоксид углерода, а энергия от их химических связей накапливается в общей сложности в 16 молекулах-носителях энергии (включая две из гликолиза и две из переходная реакция).

- Третий и заключительный этап клеточного дыхания, называемый , происходит на внутренней мембране митохондрии. Электроны переносятся от молекулы к молекуле по электрон-транспортной цепи. Часть энергии электронов используется для прокачки ионов водорода через мембрану, создавая электрохимический градиент, который стимулирует синтез гораздо большего количества молекул АТФ.
- На всех трех стадиях клеточного дыхания из одной молекулы глюкозы образуется 38 молекул АТФ.
- Какова цель клеточного дыхания? Дайте краткое описание процесса.
- Укажите, что происходит при гликолизе.
- Опишите строение митохондрии.
- Какая молекула присутствует как в начале, так и в конце цикла Кребса?
- Что происходит на стадии переноса электронов клеточного дыхания?
- Сколько молекул АТФ может образоваться из одной молекулы глюкозы во время всех трех стадий клеточного дыхания вместе взятых?
- Подвергаются ли растения клеточному дыханию? Почему или почему нет?
- Объясните, почему описанный в этом разделе процесс клеточного дыхания считается аэробным.

- Назовите три молекулы-носители энергии, участвующие в клеточном дыхании.
- На каком этапе аэробного клеточного дыхания образуется больше всего АТФ?
ATP & Respiration: Crash Course Biology #7, CrashCourse, 2012.
Клеточное дыхание и могучие митохондрии, Сестры амебы, 2014 г. o на Unsplash используется по лицензии Unsplash (https://unsplash.com). /лицензия).
Рисунок 4.10.2
Углеводы_Метаболизм от OpenStax College на Викискладе используется под лицензией CC BY 3.0 (https://creativecommons.org/licenses/by/3.0).
Рисунок 4.10.3
Гликолиз Кристин Миллер используется по лицензии CC BY 4. 0 (https://creativecommons.org/licenses/by/4.0/).
0 (https://creativecommons.org/licenses/by/4.0/).
Рисунок 4.10.4
Transition Reaction by Christine Miller используется по лицензии CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/).
Рисунок 4.10.5
Митохондрия от Марианы Руис Вильярреал [LadyofHats] на Викискладе общедоступна (https://en.wikipedia.org/wiki/Public_domain).
Рисунок 4.10.6
Цикл Кребса Кристин Миллер используется по лицензии CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/).
Рисунок 4.10.7
Электронная транспортная цепь (ETC) Кристин Миллер используется по лицензии CC BY 4.0 (https://creativecommons.org/licenses/by/4.0/).
Рисунок 4.10.8
The_Electron_Transport_Chain от OpenStax College на Викискладе используется под лицензией CC BY 3.0 (https://creativecommons.org/licenses/by/3.0).
Каталожные номера
Аварийный курс. (2012, 12 марта). АТФ и дыхание: ускоренный курс биологии № 7. YouTube. https://www.youtube.com/watch?time_continue=2&v=00jbG_cfGuQ&feature=emb_logo
(2012, 12 марта). АТФ и дыхание: ускоренный курс биологии № 7. YouTube. https://www.youtube.com/watch?time_continue=2&v=00jbG_cfGuQ&feature=emb_logo
Беттс, Дж. Г., Янг, К. А., Уайз, Дж. А., Джонсон, Э., По, Б., Круз, Д. Х., Корол, О., Джонсон, Дж. Э., Уомбл, М., ДеСэ, П. (2013, 25 апреля ). Рисунок 24.8 Электронно-транспортная цепь [цифровое изображение]. В Анатомия и физиология, Connexions (Раздел). ОпенСтакс. https://openstax.org/books/anatomy-and-physiology/pages/24-2-углеводный-метаболизм
Беттс, Дж. Г., Янг, К. А., Уайз, Дж. А., Джонсон, Э., По, Б., Круз, Д. Х., Корол, О., Джонсон, Дж. Э., Уомбл, М., ДеСэ, П. (2013, 25 апреля ). Рисунок 24.9 Метаболизм углеводов [цифровое изображение]. В Анатомия и физиология, Connexions (Раздел 24.2). ОпенСтакс. https://openstax.org/books/anatomy-and-physiology/pages/24-2-углеводный метаболизм
Сестры Амебы. (2014, 22 октября). Клеточное дыхание и могучие митохондрии. YouTube. https://www.

