Аминокислоты в плазме крови, скрининговое исследование 13 показателей (Amino Acids Analysis, Plasma, 13 parameters)
Метод определения ВЭЖХ-МС/МС (высокоэффективная жидкостная хроматография и тандемная масс-спектрометрия).
Исследуемый материал Плазма крови (ЭДТА)
Доступен выезд на дом
Синонимы: Aнализ крови на аминокислоты (13 аналитов).
Аminoacids, screening of 13 indicators, plasma.
Состав аминокислот скринингового профиля:
Протеиногенные:
Незаменимые глюкогенные
Аргинин (Arg)
Валин (Val)
Метионин (Met)
Незаменимые кетогенные
Лейцин (Leu)
Незаменимые глюко-/кетогенные
Фенилаланин (Phe)
Заменимые глюкогенные
Аланин (Ala)
Аспарагиновая кислота (Asp)
Глицин (Gly)
Глутаминовая кислота (Glu)
Пролин (Pro)
Заменимые глюко-/кетогенные
Тирозин (Tyr)
Непротеиногенные:
Метаболиты цикла образования мочевины
Орнитин (Orn)
Цитруллин (Cit)
Для детей до 1 года референсные пределы в данном тесте не установлены. Возможный альтернативный вариант для детей №НБО1 Анализ спектра аминокислот и ацилкарнитинов, тандемная масс-спектрометрия, метод сухой капли крови.
Возможный альтернативный вариант для детей №НБО1 Анализ спектра аминокислот и ацилкарнитинов, тандемная масс-спектрометрия, метод сухой капли крови.
Краткое описание исследования «Аминокислоты в плазме крови, скрининговое исследование 13 показателей»
Аминокислоты – органические соединения, содержащие одновременно аминогруппу и карбоксильную группу. Это основные структурные единицы, из которых строятся белки. Аминокислоты участвуют в процессах жизнедеятельности организма, включая синтез нейромедиаторов и гормонов (тиреоидных, катехоламинов, серотонина, оксида азота, мелатонина), формирование клеток, рост и регенерацию тканей, поддержание мышечной массы, иммунные функции и пр. Источником аминокислот для синтеза белков организма преимущественно являются пищевые белки, которые после расщепления в кишечнике до аминокислот всасываются в кровь. Многие из них могут синтезироваться организмом, но часть (незаменимые аминокислоты) поступает только с пищей. Аминокислоты являются важными промежуточными метаболитами во многих метаболических путях – цикле мочевины для конвертации аммония в мочевину, цикле аланина для переноса азота и источников энергии из мышц в печень, образовании аммония в почках из глутамина и глутаминовой кислоты, образовании глутатиона для поддержания восстановительного потенциала внутри клеток и пр.
В соответствии с разными принципами формируются группы аминокислот:
- По возможным источникам поступления (возможности эндогенного синтеза) – заменимые и незаменимые.
- В зависимости от того, присутствуют ли они в составе белков – протеиногенные и непротеиногенные.
- В зависимости от метаболических циклов, в которые включены аминокислоты – глюкогенные, кетогенные, смешанные глюко- и кетогенные одновременно. При распаде глюкогенных аминокислот образуются соединения-предшественники синтеза глюкозы – пируват, оксалоацетат, фосфоенолпируват; кетогенные аминокислоты окисляются до ацетил-ЅКоА, из которого синтезируются кетоновые тела, жирные кислоты и холестерин; смешанные аминокислоты, соответственно, используются в синтезе как углеводов, так и липидов.
Нарушения метаболизма аминокислот, приводящие к их дефициту или аккумуляции в биологических жидкостях, проявляются симптомами разной степени тяжести, которые зависят от специфики и степени нарушений – угрожающие жизни критические состояния, задержка роста и развития, неврологическая симптоматика, нарушения пищеварения, дерматологические проявления и пр. Своевременное выявление и лечение таких нарушений, включая использование специфической диеты, позволяет поддержать баланс аминокислот.
Своевременное выявление и лечение таких нарушений, включая использование специфической диеты, позволяет поддержать баланс аминокислот.
Приобретенные расстройства метаболизма аминокислот возможны при эндокринных нарушениях, патологии печени, неврологических расстройствах, недостаточном питании, нарушениях обмена веществ, онкологических заболеваниях, почечной недостаточности, ожогах.
С какой целью выполняют исследование «Аминокислоты в плазме крови, скрининговое исследование 13 показателей»
Скрининговая оценка уровня аминокислот плазмы может быть использована в обследованиях для оценки состояния здоровья при приобретенных расстройствах и контроле проводимой терапии.
Что может повлиять на результат исследования «Аминокислоты в плазме крови, скрининговое исследование 13 показателей»
Несоблюдение правил подготовки к исследованию может повлиять на результат.
Открытия японских биохимиков, ломающие традиционные представления о превращении треонина и гистидина в организме человека и значение этих открытий в лечении уремии
В традиционной биохимии существовало два устоявшихся стереотипа. Первый: все аминокислоты, как заменимые, так и незаменимые, в организме подвергаются обратимому переаминированию с α-кетокислотами, кроме лизина и треонина. При уремии возникает необходимость замещения в малобелковой диете незаменимых аминокислот их α-кетоаналогами в расчете на дальнейшее переаминирование последних, но при этом кетоаналоги лизина и треонина не используют, т.к. считают, что эти две аминокислоты не переаминируются. Японские биохимики еще в конце прошлого века доказали, что в отличие от лизина треонин подвергается переаминированию так же, как и другие аминокислоты. Второй: гистидин не синтезируется в животном организме, в т.ч. в человеческом. Но если для подавляющего большинства млекопитающих гистидин является незаменимой аминокислотой, то для здорового взрослого человека гистидин – заменимая аминокислота. И только в этом веке японские биохимики обнаружили фермент, катализирующий последнюю реакцию на пути биосинтеза гистидина, причем это открытие объясняет незаменимость/заменимость гистидина для того или иного вида животных, включая человека, а также резкое изменение статуса гистидина у больных уремией, что дает веские основания для введения гистидина в организм людей, страдающих почечной недостаточностью.
Первый: все аминокислоты, как заменимые, так и незаменимые, в организме подвергаются обратимому переаминированию с α-кетокислотами, кроме лизина и треонина. При уремии возникает необходимость замещения в малобелковой диете незаменимых аминокислот их α-кетоаналогами в расчете на дальнейшее переаминирование последних, но при этом кетоаналоги лизина и треонина не используют, т.к. считают, что эти две аминокислоты не переаминируются. Японские биохимики еще в конце прошлого века доказали, что в отличие от лизина треонин подвергается переаминированию так же, как и другие аминокислоты. Второй: гистидин не синтезируется в животном организме, в т.ч. в человеческом. Но если для подавляющего большинства млекопитающих гистидин является незаменимой аминокислотой, то для здорового взрослого человека гистидин – заменимая аминокислота. И только в этом веке японские биохимики обнаружили фермент, катализирующий последнюю реакцию на пути биосинтеза гистидина, причем это открытие объясняет незаменимость/заменимость гистидина для того или иного вида животных, включая человека, а также резкое изменение статуса гистидина у больных уремией, что дает веские основания для введения гистидина в организм людей, страдающих почечной недостаточностью. В данной статье показаны эти открытия японских биохимиков и делаются выводы о практическом их применении при уремии.
В данной статье показаны эти открытия японских биохимиков и делаются выводы о практическом их применении при уремии.
Введение
Хорошо известно, что белки необходимы для питания человека и животных. Биологическая ценность белка определяется его аминокислотным составом. Одни аминокислоты (незаменимые) не синтезируются в организме при их отсутствии в пище, тогда как другие (заменимые) в аналогичном случае могут синтезироваться в организме. Восемь аминокислот (лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валин и изолейцин) необходимы всем исследованным видам животных и являются незаменимыми [1]. Что касается гистидина, то до сих пор идут споры о возможности его синтеза в животном организме, а следовательно, о том, относить его к незаменимым или заменимым аминокислотам.
Необходимо добавить, что под невозможностью синтеза в организме понимается свойственная всем незаменимым аминокислотам необратимость распада их углеродного скелета. Но почти все аминокислоты, как заменимые, так и незаменимые, способны подвергаться обратимому переаминированию с α-кетокислотами. Значительный интерес представляет следующий факт. Отмечено [2], что после того, как крысам и кроликам добавляли в пищу глицин, меченный N15, треонин не содержал этого изотопного маркера (в отличие от других аминокислот, кроме лизина). Отсюда можно сделать вывод: треонин, подобно лизину, не принимает участия в переносе аминогруппы, который наблюдается у других аминокислот, как заменимых, так и незаменимых. Но другие авторы [3] после кормления крыс лейцином, меченным N15, нашли очень небольшое количество метки в треонине. Тот факт, что некоторое количество азота лейцина было обнаружено в молекуле треонина, указывает на наличие в организме животных незначительного синтеза треонина путем переаминирования.
Значительный интерес представляет следующий факт. Отмечено [2], что после того, как крысам и кроликам добавляли в пищу глицин, меченный N15, треонин не содержал этого изотопного маркера (в отличие от других аминокислот, кроме лизина). Отсюда можно сделать вывод: треонин, подобно лизину, не принимает участия в переносе аминогруппы, который наблюдается у других аминокислот, как заменимых, так и незаменимых. Но другие авторы [3] после кормления крыс лейцином, меченным N15, нашли очень небольшое количество метки в треонине. Тот факт, что некоторое количество азота лейцина было обнаружено в молекуле треонина, указывает на наличие в организме животных незначительного синтеза треонина путем переаминирования.
Целью настоящего обзора стало обсуждение открытий японских биохимиков, сделанных в разные годы, но долгое время остававшихся незамеченными в мировой биохимической науке, которые проливают свет на белые пятна в понимании возможности переаминирования треонина и биосинтеза гистидина, а также значения этих процессов для терапии хронической болезни почек (ХБП). Поскольку переаминирование треонина изучено лучше, чем биосинтез гистидина у человека и животных, обзор следует начать с него.
Поскольку переаминирование треонина изучено лучше, чем биосинтез гистидина у человека и животных, обзор следует начать с него.
Треонин
Углеродный скелет треонина необратимо распадается в печени млекопитающих под влиянием двух ферментов: треониндегидратазы и треониндегидрогеназы. Крысы ярко демонстрируют невозможность синтеза у млекопитающих углеродного скелета треонина – иными словами, что треонин – незаменимая аминокислота. В то же время именно у крыс в организме был обнаружен N15, введенный в организм с лейцином [3]. Это могло быть только результатом переаминирования, поскольку последнее является единственным способом биосинтеза незаменимых аминокислот у животных.
Т. Т. Березов в своей монографии [4] в 1969 г. пишет: считается доказанным, что в тканях млекопитающих механизм переаминирования является главным путем дезаминирования L-аминокислот, и перечисляет их. Cреди аминокислот Т. Т. Березов называет треонин, но не называет лизин, следовательно, он имеет в виду непосредственно аминокислоты, а не продукты их превращения, потому что продукт превращения лизина (α-аминоадипиновая кислота) активно подвергается переаминированию. Несмотря на то что традиционно считается, что партнером той или иной аминокислоты при переаминировании является α-кетоглутаровая кислота (соответственно, партнером той или иной α-кетокислоты – глутаминовая кислота), Т.Т . Березов отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Была показана и обратимость этих реакций, а также различная способность отдельных тканей катализировать описанные превращения. Дальнейшие исследования японских биохимиков подтвердили возможность переаминирования треонина у крыс. Так, Т. Noguchi et al. [5] рассматривают фермент серин-пируватаминотрансферазу, выделенный из митохондрий печени крыс и катализирующий переаминирование различных аминокислот как с пировиноградной, так и с фенилпировинградной кислотой.
Несмотря на то что традиционно считается, что партнером той или иной аминокислоты при переаминировании является α-кетоглутаровая кислота (соответственно, партнером той или иной α-кетокислоты – глутаминовая кислота), Т.Т . Березов отмечает, что переаминирование может происходить в тканях между разнообразными монокарбоновыми донорами и акцепторами аминогрупп без участия дикарбоновых аминокислот. К реакциям этого типа относятся процессы переаминирования между рядом аминокислот и пировиноградной кислотой с образованием аланина и соответствующих α-кетокислот, протекающие в митохондриях печени. Была показана и обратимость этих реакций, а также различная способность отдельных тканей катализировать описанные превращения. Дальнейшие исследования японских биохимиков подтвердили возможность переаминирования треонина у крыс. Так, Т. Noguchi et al. [5] рассматривают фермент серин-пируватаминотрансферазу, выделенный из митохондрий печени крыс и катализирующий переаминирование различных аминокислот как с пировиноградной, так и с фенилпировинградной кислотой. Причем если фенилаланин весьма активно переаминируется серин-пируватаминотрансферазой с пировиноградной кислотой, то лейцин (в большой степени), треонин (в меньшей степени) и глицин (в очень малой степени) переаминируются ею только с фенилпировиноградной кислотой (рис. 1): В свете этого…
Причем если фенилаланин весьма активно переаминируется серин-пируватаминотрансферазой с пировиноградной кислотой, то лейцин (в большой степени), треонин (в меньшей степени) и глицин (в очень малой степени) переаминируются ею только с фенилпировиноградной кислотой (рис. 1): В свете этого…
Разница между незаменимыми и заменимыми аминокислотами
Ключевое различие между незаменимыми и заменимыми аминокислотами заключается в том, что незаменимые аминокислоты не могут быть синтезированы организмом, тогда как заменимые аминокислоты могут быть синтезированы организмом .
Аминокислоты являются строительными блоками или предшественниками белков. Как следует из названия, аминокислота содержит аминогруппу (-NH 2 ) и кислую карбоксильную группу (-COOH). С этими двумя группами дополнительный водород и функциональная боковая цепь (группа R) связаны с центральным атомом углерода. Природа этой группы R определяет уникальные характеристики и химический состав аминокислоты; таким образом, в результате различных белков. Белки представляют собой наиболее разнообразную группу макромолекул как в химическом, так и в функциональном отношении. Существует 21 аминокислота, соединенная пептидными связями для создания различных белков. Все они необходимы каждому организму.
Белки представляют собой наиболее разнообразную группу макромолекул как в химическом, так и в функциональном отношении. Существует 21 аминокислота, соединенная пептидными связями для создания различных белков. Все они необходимы каждому организму.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое незаменимые аминокислоты
3. Что такое заменимые аминокислоты
4. Наглядное сравнение – незаменимые и заменимые аминокислоты в табличном формате
5. Резюме
Что такое незаменимые аминокислоты?
Большинство растений и микроорганизмов способны самостоятельно синтезировать все 20 аминокислот из глюкозы или CO 2 или NH 3- . В процессе эволюции млекопитающие, включая человека, утратили способность синтезировать углеродный скелет для некоторых аминокислот. Поэтому очень важно получать именно эти аминокислоты с пищей. Те аминокислоты, которые не могут быть синтезированы в организме для удовлетворения потребностей организма, известны как «незаменимые аминокислоты».
Человеческому организму необходимы 9 незаменимых аминокислот: фенилаланин, валин, треонин, триптофан, изолейцин, метионин, гистидин, лизин и лейцин. Поскольку мясо животных является полным источником незаменимых аминокислот, невегетарианцам не нужно слишком беспокоиться о сбалансированной диете, но тем, кто не ест продукты животного происхождения, следует подумать о незаменимых аминокислотах, потому что без них организм не может синтезировать определенные основные белки. аминокислоты.
Что такое незаменимые аминокислоты?
Заменимые аминокислоты — это аминокислоты, которые наш организм может производить сам. Несмотря на то, что мы можем получать эти аминокислоты с пищей, человеческий организм все равно может синтезировать именно эти аминокислоты.
Рисунок 01: Аминокислоты
Заменимые аминокислоты включают 12 аминокислот. Это аланин, аргинин, цистеин, тирозин, глутамин, глутамат, глицин, гистидин, серин, аспарагин, аспартат и пролин. Хотя заменимые аминокислоты легко доступны в организме человека, мы также можем получать их из таких продуктов, как орехи, злаки, мясо, фрукты и овощи.
Это аланин, аргинин, цистеин, тирозин, глутамин, глутамат, глицин, гистидин, серин, аспарагин, аспартат и пролин. Хотя заменимые аминокислоты легко доступны в организме человека, мы также можем получать их из таких продуктов, как орехи, злаки, мясо, фрукты и овощи.
В чем разница между незаменимыми и заменимыми аминокислотами?
Основное различие между незаменимыми и заменимыми аминокислотами заключается в том, что человеческий организм не может синтезировать незаменимые аминокислоты, тогда как человеческий организм может синтезировать заменимые аминокислоты. Следовательно, необходимо получать незаменимые аминокислоты с пищей. Однако нет необходимости получать заменимые аминокислоты, так как организм может синтезировать их самостоятельно. Кроме того, незаменимые аминокислоты обычно содержатся в продуктах животного происхождения, тогда как заменимые аминокислоты имеются как в продуктах животного, так и растительного происхождения. Таким образом, мы можем рассматривать это также как разницу между незаменимыми и заменимыми аминокислотами.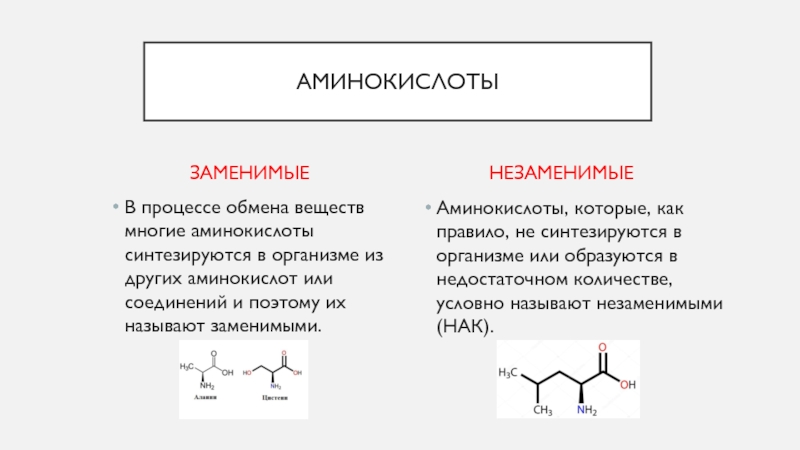
Резюме – Заменимые и незаменимые аминокислоты
Аминокислоты являются строительными блоками белков. Они бывают двух типов: незаменимые и заменимые аминокислоты. Организм человека не может синтезировать незаменимые аминокислоты, в то время как человеческий организм может синтезировать заменимые аминокислоты. Таким образом, в этом ключевое различие между незаменимыми и заменимыми аминокислотами.
Ссылка:
1. «Незаменимые аминокислоты: определение, преимущества и пищевые источники». Healthline , Healthline Media, доступно здесь.
Изображение предоставлено:
1. «Аминокислоты» Dancojocari — собственная работа, также созданная с помощью Adobe Illustrator.iИсходный код этого SVG действителен (CC BY-SA 3.0) через Commons Wikimedia
Amino acid — Knowledge @ AMBOSS
Последнее обновление: 11 октября 2022 г.
Резюме
Аминокислоты представляют собой органические соединения, состоящие из атома углерода, присоединенного к карбоксильной группе, атома водорода, аминогруппы и вариабельной группы R (боковая цепь). . У человека (и других эукариот) существует 21 протеиногенная аминокислота, 20 из которых закодированы генетическим кодом для синтеза белка, а также селеноцистеин, который интегрируется посредством специального механизма трансляции. Их можно разделить на незаменимые аминокислоты (не синтезируются в организме) и заменимые аминокислоты (могут синтезироваться в организме). Производные аминокислот включают глицин, глутамат, гистидин, аргинин, триптофан и фенилаланин. Катаболизм аминокислот может происходить различными метаболическими путями, каждый из которых преследует определенную цель, включая производство метаболического топлива (например, пирувата, ацетил-КоА), повторное использование в синтезе новых белков и создание производных аминокислот. Дефицит этих метаболических путей может привести к различным состояниям, которые более подробно описаны в разделах «Нарушения метаболизма аминокислот», «Гиперфенилаланинемия» и «Гипераммониемия».
. У человека (и других эукариот) существует 21 протеиногенная аминокислота, 20 из которых закодированы генетическим кодом для синтеза белка, а также селеноцистеин, который интегрируется посредством специального механизма трансляции. Их можно разделить на незаменимые аминокислоты (не синтезируются в организме) и заменимые аминокислоты (могут синтезироваться в организме). Производные аминокислот включают глицин, глутамат, гистидин, аргинин, триптофан и фенилаланин. Катаболизм аминокислот может происходить различными метаболическими путями, каждый из которых преследует определенную цель, включая производство метаболического топлива (например, пирувата, ацетил-КоА), повторное использование в синтезе новых белков и создание производных аминокислот. Дефицит этих метаболических путей может привести к различным состояниям, которые более подробно описаны в разделах «Нарушения метаболизма аминокислот», «Гиперфенилаланинемия» и «Гипераммониемия».
Аминокислоты
Структура
- Аминокислота (АК) состоит из атома углерода, присоединенного к a/an:
- Карбоксильная группа (-COOH)
- Атом водорода
- Аминогруппа (-NH 2 )
- Вариабельная группа R (боковая цепь): определяет уникальные свойства
- Только аминокислоты L-формы включаются в белки во время трансляции.

- В организме человека содержится 21 стандартная протеиногенная аминокислота
- 20 кодируются генетическим кодом для синтеза белка
- Селеноцистеин включается с помощью механизма, известного как трансляционная перекодировка
Свойства
Заменимые или незаменимые
| Заменимые и незаменимые аминокислоты | |||
|---|---|---|---|
| Группа | Аминокислота | Синтез | Катаболический продукт |
Незаменимые аминокислоты | Лейцин (Leu) Лизин (Lys) |
|
|
Фенилаланин (Phe) Изолейцин (Ile) Треонин (Thr) Триптофан (Trp) 9011 2 |
| ||
Метионин (метионин) Валин (Val) Аргинин* (Arg) Гистидин* (His) |
| ||
| Заменимые аминокислоты | Аланин (Ala) Аспарагин (Asn) Аспартат (Asp) Глутамат (G lu) Глутамин (Gln) Глицин (Gly) Пролин ( Pro) Серин (Ser) Цистеин** (Cys) |
| |
| Условные аминокислоты | |||
*Аргинин и гистидин могут стать незаменимыми (поэтому потребуются добавки) в периоды повышенного спроса (например, во время болезни, в периоды роста, такие как беременность или детство). **Цистеин и тирозин синтезируются из незаменимых аминокислот. | |||
Для основных АК подумайте PVT (частный) ТИМ ХОЛЛ: Фенилаланин, Валин, Треонин, Триптофан, Изолейцин, Метионин, Гистидин, Аргинин, Лейцин, Лизин
Чтобы вспомнить глюкогенные АК, подумайте : Арджеш встретил свою валентинку и подарил ей сладости.
Для своих ролей в кино Брэд Питт может много есть (глюкогенно) или соблюдать диету (кетогенно): фенилаланин, изолейцин, треонин, триптофан
Для кетогенных AA визуализируйте 2 L-образных ключа: лейцин и лизин.
Гидрофобные или гидрофильные
| Гидрофобные и гидрофильные аминокислоты | ||
|---|---|---|
| Характеристики | Гидрофобные аминокислоты | Гидрофильные аминокислоты |
| Расположение во время фолдинга белка |
|
|
| Группы R |
|
| 90 113
| Примеры |
|
|
Кислотно-основные свойства
- Обзор
- Общий заряд и, следовательно, полярность АК могут меняться в зависимости от окружающего рН и наличия H + , доступных для протонирования.
 При зарядке АК становятся полярными/гидрофильными.
При зарядке АК становятся полярными/гидрофильными. - Константа кислотной диссоциации (pKa)
- Показывает силу слабой кислоты или основания
- Определяется как pH, при котором ионизированная и неионизированная формы существуют в равных концентрациях
- Все АК имеют как минимум две ионизируемые группы, каждая со своей константой кислотной диссоциации (pKa).
- pKa α-карбоксильной группы = 2
- pKa α-аминогруппы = 9–10
- Кислотно-основные АК имеют другое pKa для ионизируемой группы боковой цепи, которое варьируется.
- Общий заряд и, следовательно, полярность АК могут меняться в зависимости от окружающего рН и наличия H + , доступных для протонирования.
- Кислые аминокислоты: боковые группы отрицательно заряжены при pH тела (обе имеют pKa ∼ 4). ;
- Аспид
- Глюк
- Основные аминокислоты
- Слабоосновная: боковая группа не имеет заряда при pH тела (~ 7,4).
- Его: pKa 6
- Боковые группы положительно заряжены при pH тела. Их можно найти в гистонах, связывающих отрицательно заряженную ДНК.

- Lys: pKa 10,5
- Arg: pKa 12,5
- Слабоосновная: боковая группа не имеет заряда при pH тела (~ 7,4).
Его (гистидин) лежит (лизин) и (аргинин) основание (основные аминокислоты).
Производные аминокислот
- Глицин
- (+ сукцинил-КоА + пиридоксин) → порфирин → гем
- (+ аспартат + глутамин) → пурины
- Глутамат
- (+ пиридоксин) → ГАМК
- (+ глицин + цистеин) → Глутатион
- Гистидин: (+ пиридоксин) → гистамин + CO 2 (декарбоксилирование)
- Аргинин
- (+ НАДФН + ТГБ) → Оксид азота
- Мочевина
- Креатинин синтезируется из аргинина + глицина.
- Триптофан
- (+ пиридоксин + рибофлавин) → ниацин (= витамин B 3 ) → НАД + /НАДФ +
- (+ ТГВ + пиридоксин) → серотонин → мелатонин 9008 0
- Фенилаланин
- (+ THB) → тирозин (+ THB) → L-Dopa (+ пиридоксин) → дофамин (+ витамин C) → норадреналин (+ S-аденозилметионин) → эпинефрин
- Тирозин → тироксин (T 4 ) → T 3
- L-Dopa → Меланин
- (+ THB) → тирозин (+ THB) → L-Dopa (+ пиридоксин) → дофамин (+ витамин C) → норадреналин (+ S-аденозилметионин) → эпинефрин
Катаболизм аминокислот
Обзор
- Метаболические пути: во время катаболизма белка аминокислоты могут подвергаться различным метаболическим путям для разных целей, в том числе:
- Катаболизм АК, приводящий к образованию
- Метаболических топлив (например, образующих пируват, ацетил-КоА)
- Мочевина для выведения избыточного азота
- Повторное использование в синтезе новых белков (см.
 «Перевод и синтез белков». )
«Перевод и синтез белков». ) - Создание производных аминокислот (см. выше)
- См. «Расщепление белков».
- Катаболизм АК, приводящий к образованию
- Участки метаболизма
- Незаменимые аминокислоты: прежде всего печень.
- Заменимые АК: по всему телу
- Процессы метаболизма АК
- Биохимические реакции АК
- Расщепление аминогруппы (путем трансаминирования или дезаминирования)
- Расщепление карбоксильной группы (путем декарбоксилирования)
- Пиридоксальфосфат (PLP) является важным кофактором, производным витамина B 6 , используемым в переаминировании, декарбоксилировании и дезаминировании серина.
- Катаболизм углеродного скелета аминокислот: может быть повторно использован как часть углеводного или липидного метаболизма или цикла лимонной кислоты.
- Цикл мочевины: избыток азота превращается в мочевину через цикл мочевины и выводится с мочой.
- Биохимические реакции АК
Биохимические реакции обмена аминокислот
Трансаминирование
- Описание: перенос аминогруппы от АК к α-кетокислоте для расщепления или к α-кетокислоте с образованием заменимой АК.

- Ферменты
- Трансаминазы, в частности
- аланин аминотрансфераза (ALT)
- аспартат -аминотрансфераза (AST)
- 0080
- Трансаминазы, в частности
- Локализация: трансаминазы обнаружены в большинстве клеток организма, но их концентрация выше в печени и сердце.
- Наиболее распространенные примеры
- АЛТ: аланин + α-кетоглутарат ⇄ пируват + глутамат
- АСТ: аспартат + α-кетоглутарат ⇄ оксалоацетат + глутамат
- Все аминокислоты (кроме треонина и лизина) в какой-то момент катаболизма подвергаются переаминированию.
Глутамат участвует в большинстве реакций трансаминирования и является очень важной частью метаболизма АК.
Дезаминирование
- Описание: реакция, при которой аминогруппа из АК высвобождается в виде аммония
- Примеры
- Глутаматдегидрогеназа: глутамат + НАД(Ф) + + Н 2 O ⇄ α-кетоглутарат + NH 4 + + НАД(Ф)Н + Н + 9007 7 Сериндегидратаза: серин + PLP ⇄ NH 4 + + пируват
- Глутаминаза: глутамин + H 2 O → глутамат + аммоний (необратимо)
- Аспарагиназа: аспарагин + H 2 O → аспартат + аммоний (необратимый)
Глутаматдегидрогеназа может использовать либо НАД+, либо НАДФ+ в качестве кофактора.
Декарбоксилирование
- Описание: высвобождение α-карбоксильной группы АК посредством расщепления СО 2
- Пример: синтез биогенных аминов с помощью декарбоксилазы ароматических L-аминокислот (также известной как DOPA-декарбоксилаза), в которой также используется PLP.
Катаболизм углеродного скелета аминокислот
| Обзор метаболизма углеродного скелета аминокислот | ||
|---|---|---|
| Категория | Аминокислоты | Пути метаболизма | 9011 3
| Глюкогенные аминокислоты | Аланин Аспарагин Аспартат Цистеин Глутамат Глутамин Глицин Гистидин Метионин Пролин Серин Валин |
|
| Смешанные глюкогенные/кетогенные аминокислоты | Изолейцин Фенилаланин Треонин Триптофан Тирозин |
|
| Кетогенные аминокислоты | Лейцин Лизин |
|
Глюкогенные аминокислоты
- Метаболизируются до пирувата и до метаболитов цикла лимонной кислоты, затем либо:
- Окисляются до CO 90 009 2 в ЦАС по производству энергии ИЛИ
- Используется в качестве субстрата для глюконеогенеза.
- Побочные продукты
- Пируват
- Продукт глицина, аланина, серина и цистеина
- Также треонин → глицин и серин → пируват
- Сукцинил-КоА
- Метионин и валин: метаболизируются в сукцинил-КоА через пропионил-КоА и метилмалонил-КоА
- Метиониновый цикл: метионин → S-аденозилметионин (SAM) → S-аденозилгомоцистеин → гомоцистеин → метионин
- S-аденозилметионин (SAM): играет важную роль в качестве кофактора для реакций метилирования (он жертвует свою метильную группу для анаболических путей).

- S-аденозилметионинсинтаза: фермент, катализирующий превращение метионина и АТФ в S-аденозилметионин; дефицит этого фермента вызывает гиперметионинемию
- Гомоцистеин: деметилирование SAM приводит к гомоцистеину, который может метаболизироваться до цистатионина, а затем до цистеина.
- S-аденозилметионин (SAM): играет важную роль в качестве кофактора для реакций метилирования (он жертвует свою метильную группу для анаболических путей).
- α-кетоглутарат
- Глутамин, аргинин, гистидин, пролин → глутамат → α-кетоглутарат
- Фумарат
- Оксалоацетат
- Трансаминирование аспартата → оксалоацетат
- Дезаминирование аспарагина → аспартат → оксалоацетат
- Пируват
Кетогенные аминокислоты
Лизин и лейцин метаболизируются до ацетил-КоА, затем либо:
- Ацетильная группа представляет собой оксид преобразован в CO 2 в цикле лимонной кислоты для производства энергии ИЛИ
- Используется для синтеза кетоновых тел ИЛИ
- Используется для синтеза жирных кислот или холестерина
Смешанные глюконеогенные/кетогенные аминокислоты
- Тирозин и фенилаланин: метаболизируются до фумарата и ацетил-КоА
- Тирозин: трансаминирование через тирозинтрансаминазу, которая затем метаболизируется в несколько этапов до фумарата и ацетил-КоА
- Фенилаланин: сначала метаболизируется в тирозин с помощью фенилаланингидроксилазы (требуется O 2 и восстанавливающий агент тетрагидробиоптерин), затем метаболизируется, как описано выше
- Триптофан: метаболизируется до аланина и ацетил-КоА с образованием никотинамида
- изолейцин
- Трансаминирование в пропионил-КоА и ацетил-КоА
- Пропионил-КоА далее метаболизируется до метилмалонил-КоА до сукцинил-КоА.

- Треонин [1]
- Глюкогенные пути
- → кетобутират → пропионил-КоА (через дегидратазу)
- → Аминоацетон → пируват (через дегидрогеназу)
- Кетогенные пути
- → Глицин + ацетальдегид → ацетил-КоА (через альдолазу)
- + КоА → глицин + ацетил-КоА (через дегидрогеназу в сочетании с лиазой)
- Глюкогенные пути
Лизин и лейцин являются единственными чистыми кетогенными АК.
Цикл мочевины
- Описание
- Цикл реакций, в результате которых образуется мочевина; ((НХ 2 ) 2 CO) из аммиака (NH 3 ), бикарбоната (HCO 3 − ) и аминогруппы аспартата
- Требуется 3 АТФ для получения энергии
- Измеряется как азот мочевины крови (АМК) для клинического применения
- Функция: выведение почками азота в виде мочевины.

- Локализация: преимущественно происходит в цитозоле и митохондриях клеток печени, а также в клетках почек.
- Происхождение аммиака
- Аммиак образуется как продукт различных метаболических процессов в организме.
- Из-за своей токсичности аммиак должен быть связан с глютамином или аланином для транспортировки.
- Глютаминовый цикл (наиболее распространенный): транспорт аммиака в виде аминогруппы, присоединенной к глутамину, в печень
- Глутаминсинтетаза присоединяет свободный аммиак к глутамату с образованием глутамина.
- Затем аммиак отщепляется от глутамата посредством окислительного дезаминирования в гепатоцитах.
- Аланиновый цикл
- Транспорт аммиака в виде аминогруппы на аланине из скелетных мышц в печень
- Создается АЛТ из пирувата в мышцах и снова превращается в пируват в печени с помощью АЛТ.
- Глютаминовый цикл (наиболее распространенный): транспорт аммиака в виде аминогруппы, присоединенной к глутамину, в печень
| Реакции цикла мочевины | ||||
|---|---|---|---|---|
| Реакция | 9 0119 СубстратФермент (+ место реакции) | Продукт(ы) | Особенности | |
1. Вступление в цикл мочевины: образование карбамоилфосфата из HCO 3 − и NH 3 Вступление в цикл мочевины: образование карбамоилфосфата из HCO 3 − и NH 3 |
|
|
| |
2. Создание цитруллина из карбамоилфосфата и орнитина |
|
|
|
|
3. Создание аргининосукцината из цитруллина и аспартата Создание аргининосукцината из цитруллина и аспартата |
|
|
|
|
| 80 |
|
| ||
| 5. Гидролиз аргинина до мочевины и орнитин |
|
|
|
|
Этапы цикла мочевины (орнитин, карбамоилфосфат, цитруллин, аспартат, аргининосукцинат, фумарат, аргинин и мочевина): «Возмутительно циничная критика вызывает отвращение у всех моих друзей в университете»
Ограничение скорости шаг цикл мочевины включает CPS1.
Расположение фермента CPS1: «M1tochondria».
NH 2 группы для производства мочевины получают из карбамоилфосфата и аспартата, а углеродную группу получают из бикарбоната.
Митохондриальную карбамоилфосфатсинтетазу 1 цикла мочевины не следует путать с цитозольной карбамоилфосфатсинтетазой 2, которая является важным ферментом биосинтеза пиримидина.
Не путайте мочевину с мочевой кислотой в результате метаболизма пуринов.
Синтез заменимых аминокислот
| Обзор синтеза заменимых аминокислот | ||
|---|---|---|
Аминокислоты | 9011 9 Развитие изОтветственный фермент(ы) | |
| Глутамат |
|
|
| Глутамин |
|
|
| Аспартат |
|
|
| Аспарагин |
|
|
| Аргинин и пролин |
|
|
| Цистеин |
|
|
| Серин |
|
|
| Глицин |
|
|
| Аланин |
|
|
- Синтез заменимых АК происходит в основном в печени.

- Углеродный скелет берется либо из цикла лимонной кислоты, либо из катаболизма углеводов.
Состояния, связанные с метаболизмом аминокислот
- Подробную информацию о следующих состояниях см. в разделе «Нарушения метаболизма аминокислот»
- Болезнь Хартнупа
- Болезнь мочи кленового сиропа
- Гистидинемия
- Органические ацидемии
- Цистиноз
Гипераммониемия
- Нормальная физиология внутричерепного аммиака
- Глутамат и аммиак находятся в химическом равновесии с глутамином, опосредованном ферментом глутаминсинтетазой.
- Глутамат служит субстратом для глутаматдекарбоксилазы с образованием ГАМК.
- Этот механизм контролирует концентрацию ГАМК и, таким образом, ГАМКергический тонус.
- Патофизиология
- Повышенный уровень аммиака в сыворотке нарушает баланс между глутамином, глутаматом, α-кетоглутаратом и ГАМК за счет действия глутаматдегидрогеназы и глутаминсинтетазы, что приводит к повышению уровня глутамина и снижению уровня глутамата → низкий синтез ГАМК и ГАМКергический тонус → типичные признаки гипераммониемической энцефалопатии:
- Избыток глютамина → осмотическое повреждение астроцитов → набухание и дисфункция клеток → отек мозга
- Дисбаланс нейротрансмиттеров → ингибирование возбуждающей нейротрансмиссии и активация тормозной нейротрансмиссии
- Низкий уровень α-кетоглутарата → ингибирование цикла ТСА
- Повышенный уровень аммиака в сыворотке нарушает баланс между глутамином, глутаматом, α-кетоглутаратом и ГАМК за счет действия глутаматдегидрогеназы и глутаминсинтетазы, что приводит к повышению уровня глутамина и снижению уровня глутамата → низкий синтез ГАМК и ГАМКергический тонус → типичные признаки гипераммониемической энцефалопатии:
- Этиология
- Приобретенная: наиболее часто встречается у взрослых
- Печеночная недостаточность: естественные азотистые отходы в крови накапливаются до токсических уровней вследствие нарушения функции цикла мочевины в поврежденных гепатоцитах и/или шунтирования крови из воротной вены в коллатеральные кровотоки→ печеночная энцефалопатия.

- Печеночная недостаточность: естественные азотистые отходы в крови накапливаются до токсических уровней вследствие нарушения функции цикла мочевины в поврежденных гепатоцитах и/или шунтирования крови из воротной вены в коллатеральные кровотоки→ печеночная энцефалопатия.
- Приобретенная: наиболее часто встречается у взрослых

 ниже «Синтез заменимых аминокислот»). 112
ниже «Синтез заменимых аминокислот»). 112 «Пути метаболизма углеродного скелета АА» ниже .
«Пути метаболизма углеродного скелета АА» ниже .