Пищевые аминокислоты — Компания НЕО Кемикал
Аминокислоты — основной элемент построениях всех белков. Они делятся на заменимые, незаменимые и условно незаменимые.
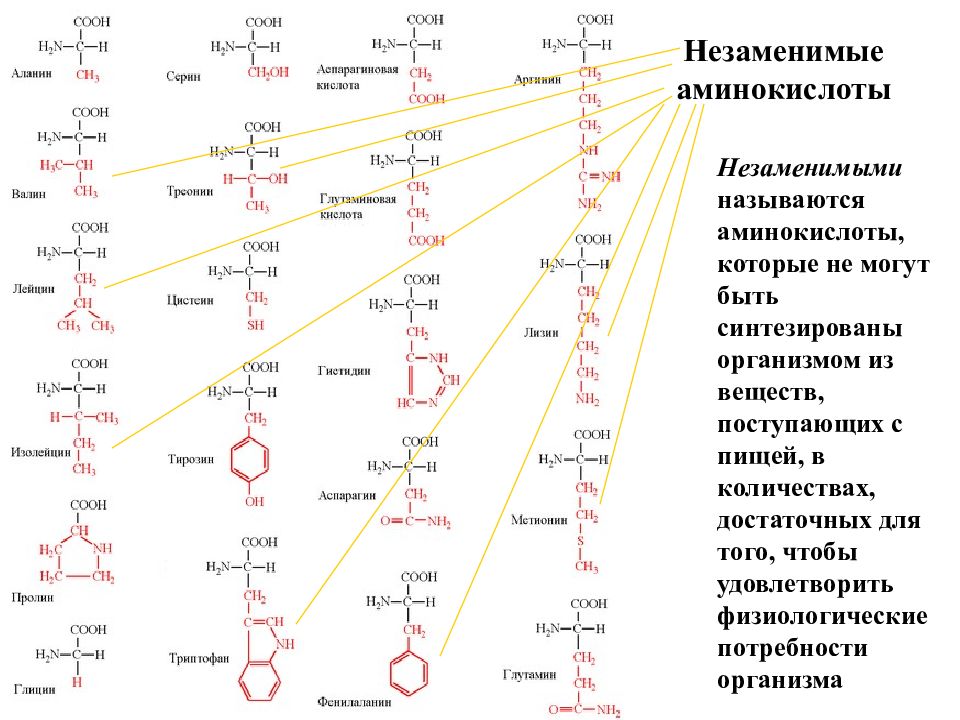
Незаменимые аминокислоты – те аминокислоты, которые не могут быть синтезированы в организме человека и должны поступать в организм с пищей.
Условно незаменимыми кислотами называются аминокислоты, которые синтезируются организмом человека при определенных условиях. Часто организм испытывает недостаток этих аминокислот.
К заменимым относятся аминокислоты, которые наш организм способен синтезировать самостоятельно.
ВСАА — это комплекс из трех незаменимых аминокислот: L-лейцин, L-изолейцин и L-валин, основной материал для построения новых мышц. Составляют 35% всех аминокислот в мышцах и принимают важное участие в процессах анаболизма и восстановления, обладают антикатаболическим действием. BCAA не могут синтезироваться в организме, поэтому получать человек их может только с пищей и специальными добавками.
L — Валин — Один из главных компонентов в росте и синтезе тканей тела. Вместе с лейцином и изолейцином служит источником энергии в мышечных клетках, а также препятствует снижению уровня серотонина. Также необходим для поддержания нормального обмена азота в организме, входит в состав практически всех известных белков, является незаменимой аминокислотой не синтезируется в организме человека и поэтому должен поступать с пищей. Входит в состав ВСАА.
L — Лейцин — Лейцин входит в состав природных белков, применяется для лечения болезней печени, анемий и других заболеваний. В среднем суточная потребность организма в лейцине для здорового человека составляет 4-6 грамм. Входит в состав ВСАА и многих БАД
L — Изолейцин — это аминокислота входящая в состав всех природных белков. Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене..
Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене..
L — Глутамин – одна из 20 стандартных аминокислот, входящих в состав белка. Самая распространенная аминокислота организма, мышцы состоят из неё на 60%. Широко используется в спортивном питании и при производстве БАД.
Креатин – Креатин чаще всего используется для повышения эффективности физических нагрузок и увеличения мышечной массы у спортсменов. Существуют научные исследования, поддерживающие использование креатина для улучшения спортивной активности молодых и здоровых людей во время кратковременной интенсивной активности и нагрузки
Аминокислоты для здоровья | Гомельский областной ЦГЭ и ОЗ
В природе существует более 500 различных аминокислот, из них всего 20 входят в состав белка. Аминокислотами называют гетерофункциональные соединения, содержащие одновременно амино- и карбоксильную группы в составе одной молекулы.
Аминокислоты участвуют во всех жизненных процессах. Это те самые кирпичики из которых состоит белок. В человеческом теле практически все органы состоят из белков – это и мышцы, и различные соединительные ткани, внутренние органы, железы, ногти, волосы, кожа, кости и жидкости. Некоторые белки содержат все незаменимые аминокислоты в количестве, достаточном для организма человека и животных. Такие белки называются биологически полноценными.
Организм синтезирует аминокислоты самостоятельно. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты являются незаменимыми. Всего насчитывается 8 незаменимых аминокислот: лейцин, валин, изолейцин, лизин, фенилаланин, треонин, метионин и триптофан. Такие аминокислоты должны поступать в организм извне. В случае отсутствия или недостатка в рационе питания незаменимых аминокислот в организме нарушается белковый синтез.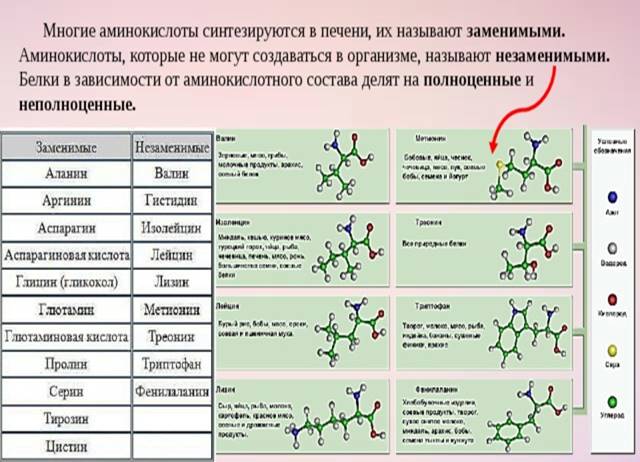
Условно-незаменимые аминокислоты синтезируются в организме в небольшом количестве. Этого недостаточно для здорового функционирования организма, поэтому они должны дополнительно поступать либо с пищей, либо с пищевыми добавками. К этой группе относятся аргинин и гистидин.
Аргинин – аминокислота, которая вырабатывается организмом здорового взрослого человека самостоятельно, но у младенцев и пожилых людей синтез этого вещества существенно снижен. Аргинин выступает стимулятором роста у детей и подростков, а также может быть показан при беременности при малом весе плода. Основная функция аргинина состоит в его способности повышать уровень оксида азота, т.е. он обеспечивает гибкость сосудов, поддерживает их тонус, улучшает циркуляцию крови, что приводит к лучшему снабжению тканей и органов (орехи, особенно арахис и кедровые орехи, тыквенные и кунжутные семечки, немного меньше его в рыбе, птице, в мясных и молочных продуктах).
Гистидин способствует восстановлению поврежденных тканей, образованию лейкоцитов и эритроцитов, строительству миелиновых оболочек клеток. Эта аминокислота необходима в период с рождения до двадцати одного года, а также в периоды восстановления после перенесенных тяжелых заболеваний и травм. Дефицит гистидина может спровоцировать проблемы со слухом, а избыток – развитие неврозов и даже психозов (орехи, семечки, бананы, сухофрукты, бобовые, молочные продукты (особенно сыр), рыба (особенно лосось и тунец), мясе домашней птицы, говядине (филе), свинине (вырезка).
Эта аминокислота необходима в период с рождения до двадцати одного года, а также в периоды восстановления после перенесенных тяжелых заболеваний и травм. Дефицит гистидина может спровоцировать проблемы со слухом, а избыток – развитие неврозов и даже психозов (орехи, семечки, бананы, сухофрукты, бобовые, молочные продукты (особенно сыр), рыба (особенно лосось и тунец), мясе домашней птицы, говядине (филе), свинине (вырезка).
В отдельную группу выделяют условно-заменимые аминокислоты – цистеин и тирозин, их синтез осуществляется при наличии незаменимых аминокислот. При недостатке предшественников эти аминокислоты могут стать незаменимыми.
Цистеин в организме производится из незаменимой аминокислоты метионин и при его недостатке также может стать незаменимой аминокислотой. Цистеин необходим организму для производства таурина, который регулирует работу нервной системы, и глутатиона, отвечающего за иммунную систему организма. Цистеин входит в состав коллагена, кератина, инсулина, при необходимости может трансформироваться в глюкозу, наполняя организм энергией, регулирует давление, снижает холестерин в крови, выводит из организма токсические вещества.
Тирозин вырабатывается в здоровом организме из незаменимой аминокислоты фенилаланин. Он регулирует синтез гормонов щитовидной железы, надпочечников, гипофиза. Улучшает мыслительные процессы, памяти, помогает противостоять стрессовым ситуациям, а также поддерживает хорошее настроение. Отвечает за выработку пигмента меланина, благодаря которому мы имеет тот или иной цвет волос, кожи. Для спортсменов важно также, что тирозин участвуя в синтезе белка, способствует росту мышечных тканей, ускоряет восстановление после тяжелой физической нагрузки.
Незаменимые аминокислоты
| Аминокислота | Значение | Содержание |
| Лейцин | выработка инсулина, строительный материал для белка мышц | соевый белок, молочный белок – казеин и сывороточный белок. |
| Изолейцин | в меньшей степени активирует рост мышечной ткани, в большей снабжает их глюкозой, участвует в синтезе гемоглобина, для усвоение изолейцина и лейцина необходим биотин (витамин B7) | миндаль, кешью, куриное мясо, нут, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, сои. |
| Метионин | необходим для выработки и таурина, для синтеза креатина, коллагена, участвует в синтезе серотонина, а также способствует выработке адреналина. помогает печени в переработке жиров, выведению тяжелых металлов, метионин снижает уровень гистамина в крови | бразильские орехи, говядина, свинина, курица, кролик, морская рыба, бобовые, яйцах, творог, молоко, кефир, сыр твердых сортов |
| Фенилаланин | тирозин вырабатывается только из фенилаланина, образует дофамин и другие катехоламины, снижает депрессивные симптомы, продукты метаболизма фенилаланина обладают токсическим эффектом и при значительном избытке этой аминокислоты возможно негативное влияние на нервную систему | белки сои, сыр твердых сортов, орехи и семена растений, мясо (говядина, птица) и рыба (тунец), яйца, молочные продукты, фасоль и зерновые культуры |
| Триптофан | триптофан (точнее примерно 1 % от общего количества, поступающего с пищей) перерабатывается в серотонин, часть которого преобразуется в мелатонин (гормон сна). При недостатке сокращается синтез белков и ниацина (витамин B3), как следствие может развиться пеллагра. Серотонин способен повышать болевой порог и снимать состояния тревожности, беспокойства, а мелатонин понижает интенсивность многих физиологических процессов и способствует наступлению глубокого и спокойного сна. При недостатке сокращается синтез белков и ниацина (витамин B3), как следствие может развиться пеллагра. Серотонин способен повышать болевой порог и снимать состояния тревожности, беспокойства, а мелатонин понижает интенсивность многих физиологических процессов и способствует наступлению глубокого и спокойного сна. | икра (красная и черная), голландский сыр, арахис и другие орехи, соевые бобы и другие бобовые (фасоль, горох), мясо курицы, кролика и индейки, кальмары, ставрида, сельдь, лосось и треска, а также куриные яйца, творог (и другие молочные продукты) и шоколад. |
| Треонин | необходим для синтеза серина и глицина, треонин входит в состав зубной эмали, избыток приводит к накоплению мочевой кислоты | мясо, птица, яйца, сыр, жирная морская рыба, морепродукты, грибах, чечевица, фасоль, пшеница, рожь, гречка, орехи. |
| Лизин | синтез почти всех видов белков, он выполняет важнейшие функции в организме – в частности, обеспечивает работу иммунной системы, составляя существенную часть коллагена, поддерживает необходимый баланс азота, участвует в усвоении кальция в пищеварительном тракте, без лизина невозможен синтез многих гормонов, ферментов | бобовые, куриц, сом говядина, молоко и молочные продукты, яйца, семечки и орехи |
| Валин | участвует в синтезе белка, защищает миелиновые оболочки нервных волокон, улучшает нервные процессы, участвует в азотистом обмене, защищает миелиновые оболочки нервных волокон, препятствует снижению уровня серотонина, участвует в азотистом обмене. | яйца, сыр, икра красная, соя (зерно), чечевица, арахис, горбуша, фисташки, молоко сухое. |
Толкачёва Екатерина Александровна,
отдел общественного здоровья государственного учреждения
«Гомельский областной центр гигиены, эпидемиологии и общественного здоровья»
Аминокислоты в питании человека Текст научной статьи по специальности «Фундаментальная медицина»
lectures
АМИНОКИСЛОТЫ В ПИТАНИИ ЧЕЛОВЕКА
Лысиков Ю.А.
ГУ Институт питания РАМН, Москва
Лысиков Юрий Александрович 109240 Москва, Устьинский проезд, д. 2/14 E-mail: [email protected]
РЕЗЮМЕ
В статье представлены данные о метаболизме аминокислот в организме человека. Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
SUMMARY
The article presents data on amino acids metabolism in human organism. The review described structure and function of amino acids, essentiality criteria, amino acids energy source role, amino acids specific functions, amino acids requirements.
CO CO
СТРУКТУРА И СВОЙСТВА АМИНОКИСЛОТ
Известно около 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, в-аланин, таурин и др. . Многие из протеиноген-ных аминокислот в организме человека выполняют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат источником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
. Многие из протеиноген-ных аминокислот в организме человека выполняют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат источником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
Первая аминокислота, аспарагин, была открыта еще в 1806 году. Последней из обнаруженных известных аминокислот оказался треонин, который
соон
Н — С — 1ЧН2
Рис. 1. Общая структурная формула аминокислоты
удалось выделить лишь в 1938 году. Каждая аминокислота имеет тривиальное (традиционное) название, иногда связанное с источником происхождения. Например, аспарагин впервые был обнаружен в аспарагусе, глютаминовая кислота — в клейковине (глютене) пшеницы. Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
Все 20 аминокислот, которые входят в состав белка, характеризуются общей структурной особенностью — наличием карбоксильной группы (-СООН) и аминогруппы (-№И2), связанной с одним и тем же атомом углерода и различаются структурой боковых цепей групп) (рис. 1). Почти все аминокислоты содержат по одной карбоксильной и аминогруппе. Однако имеются аминокислоты, которые могут содержать две карбоксильные (дикарбоновые аминокислоты) или две аминогруппы (диаминоами-нокислоты). Большинство аминокислот являются а-аминокислотами, в отличие от в-аминокислот, таких как в-аланин и таурин.
Стереоизомеры аминокислот. Из-за асимметрии молекулы все а-аминокислоты, за исключением
глицина, могут существовать в форме двух Б- или Ь-стереоизомеров — оптических изомеров, которые представляют собой зеркальные изображения друг друга. В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
заключается в том, что для аминокислот характерна медленная самопроизвольная неферментативная рацемизация, в результате которой в составе белка появляются Б-аминокислоты. По этой причине структура белка со временем начинает меняться, могут изменяться и его свойства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
Таблица 1
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ [2; 3]
Химическая структура Полярность боковой цепи Изоэлектри-ческая точка р! Молекулярная масса , г/моль Степень гидрофильности Полярность боковой цепи
1. Алифатические Высокогидрофильные
Алифатические Высокогидрофильные
Алании -1,9 6,0 89 Глютамин +9,4
Валин* -2,0 6,0 117 Аспарагин +9,7
Глицин -2,4 6,0 75 Глютаминовая кислота +10,2
Изолейцин* -2,2 5,9 131 Гистидин +10,3
Лейцин* -2,3 6,0 131 Аспарагиновая кислота +11,0
2. Серосодержащие Лизин* +15,0
Метионин* -1,5 5,7 149 Аргинин +20,0
Цистеин -1,2 5,0 121 Умеренно гидрофильные
3. Ароматические Треонин* +4,9
Тирозин +6,1 5,7 181 Серин +5,1
Триптофан* +5,9 5,9 204 Триптофан* +5,9
Фенилаланин* +0,8 5,5 165 Пролин +6,0
4. Оксиаминокислоты Тирозин +6,1
Оксиаминокислоты Тирозин +6,1
Серин +5,1 5,7 105 Высокогидрофобные
Треонин* +4,9 5,6 119 Цистеин -1,2
5. Дикарбоновые (кислые) Метионин* -1,5
Аспарагиновая кислота +11,0 2,8 133 Аланин -1,9
Глютаминовая кислота +10,2 3,2 147 Валин* -2,0
6. Амиды дикарбоновых кислот Изолейцин* -2,2
Аспарагин +9,7 5,4 132 Лейцин* -2,3
Глютамин +9,4 5,7 146 Глицин -2,4
7. Диаминоаминокислоты (основные) Фенилаланин* +0,8
Аргинин +20,0 10,9 174
Гистидин +10,3 7,6 155
Лизин* +15,0 9,7 146
8. Иминокислота
Иминокислота
Пролин +6,0 6,3 115
о
СО
Примечание: * — незаменимые аминокислоты.
сэ
о
Биосинтез Ь-аминокислот в клетках организма происходит с помощью стереоспецифических ферментов, которые имеют асимметричные активные центры. При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
По химической структуре можно выделить 8 классов аминокислот (табл. 1):
1. Алифатические аминокислоты (аланин, ва-лин, глицин, изолейцин и лейцин) отличаются тем, что их боковые цепи содержат лишь атомы углерода и водорода.
У валина, изолейцина и лейцина боковая цепь разветвляется, их еще называют аминокислотами с разветвленной цепью.
2. Серосодержащие аминокислоты (метионин и цистеин) содержат атомы серы. При этом место серы может занимать атом селена.
3. Ароматические аминокислоты (тирозин, триптофан и фенилаланин) содержат ароматические циклические группы.
4. Оксиаминокислоты (серин и треонин) содержат -ОН-группы.
5. Дикарбоновые аминокислоты (аспарагино-вая и глютаминовая кислоты) содержат две карбоксильные группы
6. Амиды дикарбоновых аминокислот (аспа-рагин и глютамин) содержат атом азота в составе второй карбоксильной группы.
7. Диамино-, или двуосновные, аминокислоты (аргинин, гистидин и лизин) содержат две аминогруппы.
8. «Аминокислота» пролин занимает особое положение, поскольку, аминокислотой не является. По своей структуре это иминокислота и включает циклическое имидазольное кольцо. Благодаря циклической группе пролин вызывает изгибы в полипептидной цепочке белка, что очень важно, например, для структуры белка соединительной ткани коллагена, где пролина очень много.
Благодаря наличию карбоксильной и аминогруппы в водных растворах все аминокислоты ионизированы и ведут себя одновременно как кислоты и как основания. В водной среде организма свободные аминокислоты играют роль буферных веществ, стабилизируя рН среды. При этом растворимость в воде и степень гидрофильности разных аминокислот существенно различается. По степени
гидрофильности — способности связывать молекулы воды аминокислоты можно разделить на [2]:
1. Высокогидрофильные: аспарагин, аспара-гиновая кислота, аргинин, гистидин, глютамин, глютаминовая кислота и лизин, которые почти всегда располагаются на внешней поверхности молекул белка.
2. Умеренно гидрофильные: пролин, серин, тирозин, треонин и триптофан. Они занимают промежуточное положение, отличаясь определенной гидрофильностью.
3. Гидрофобные: аланин, валин, глицин, изо-лейцин, лейцин, метионин, цистеин и фенилала-нин, которые располагаются в основном внутри молекул белка.
Гидрофильность аминокислот во многом зависит от их полярности, которая связана с величиной заряда их боковых групп. Пять алифатических аминокислот (аланин, валин, глицин, изолейцин и лейцин) содержат слабо полярные боковые группы. Слабую полярность имеют серосодержащие аминокислоты (метионин и цистеин), а также одна из ароматических аминокислот — фенилаланин. Благодаря гидрофобности эти аминокислоты плохо растворяются в воде. Остальные аминокислоты содержат заряженные положительно полярные боковые группы и поэтому они более гидрофильны и хорошо растворяются в воде. Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Онкотическое давление. Гидрофобные аминокислоты, как правило, располагаются внутри молекулы белка, тогда как гидрофильные — на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. Гидрофильность белков крови обеспечивают онкотическое давление, которое удерживает жидкость в кровеносных сосудах. При уменьшении содержания белка в организме человека в первую очередь уменьшается количество плазменных белков, что приводит к снижению он-котического давления крови, выходу жидкости из кровеносной системы в межклеточное пространство, что может приводить к возникновению безбелковых (голодных) отеков. Гидрофильность пищевых белков обеспечивает их способность набухать, образовывать студни, эмульсии и пены. Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Нестандартные аминокислоты в составе белка. Кроме 20 стандартных аминокислот, которые присутствуют почти во всех белках, существуют так называемые нестандартные аминокислоты, которые
встречаются лишь в некоторых из них. Причем, каждая из этих аминокислот представляет собой производное одной из обычных. К нестандартным аминокислотам относят: производное пролина — 4-гидроксипролин и 5-гидроксипролин. Обе аминокислоты входят в состав коллагена. В мышечном белке миозине присутствует производное лизина — Nметиллизин. Другое производное лизина — аминокислота десмозин (комплекс из четырех молекул лизина — тетрапептид) содержится только в фибриллярном белке соединительной ткани — эластине. В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.
Особо следует остановиться на серосодержащей аминокислоте цистеине. Она может находиться в составе белка в двух формах: либо в форме цисте-ина, либо в форме дипептида — цистина, который представляет собой комплекс из двух молекул ци-стеина, ковалентно связанных друг с другом при помощи дисульфидного мостика. Благодаря этому свойству цистеин выполняет важную функцию по стабилизации структуры белковой молекулы. Цистеин играет ключевую роль в формировании инсулина и иммуноглобулинов (антител). В этих белках благодаря дисульфидным цистеиновым мостикам соединяются разные полипептидные цепи в одну молекулу белка. Такие поперечные связи обычно отсутствуют во внутриклеточных белках, но широко представлены в секреторных белках. Разрушение дисульфидных связей в кератине, формирующем структуру волос, лежит в основе процесса химической завивки. Для этого используют тиоловые соединения, под действием которых происходит разрыв поперечных дисульфидных связей в кератине. После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
Функциональная классификация аминокислот. С физиологических позиций аминокислоты можно разделить на:
• Протеиногенные, которые входят в состав белка (20 аминокислот), и непротеиногенные, не входящие в состав белка, но выполняющие в организме человека другие важные функции.
• Заменимые (8 аминокислот) и незаменимые (12 аминокислот). О них мы будем говорить ниже.
• Глюкогенные, которые превращаются в глюкозу и далее в гликоген или расщепляются по пути метаболизма глюкозы с образованием АТФ. Глюкогенными, в той или иной степени, являются подавляющее большинство — 19 аминокислот, за исключением лейцина.
• Кетогенные, которые могут превращаться в кетоновые тела (короткоцепочечные жирные кислоты). Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
АМИНОКИСЛОТЫ КАК ИСТОЧНИКИ ЭНЕРГИИ
Известно, что при полном окислении 1 г белка (или смеси аминокислот) в калориметрической бомбе в среднем образуется 5,65 ккал. Углерод аминокислот окисляется до СО2, водород — до Н2О, а азот — до NО2. Однако в организме человека энергию в форме АТФ можно получить только при окислении углеводородной составляющей аминокислот. Поэтому из 5,65 ккал организму будут доступны только 4,3 ккал, а оставшаяся часть (1,3 ккал) является энергией окисления азота. В настоящее время установлено, что действительная энергетическая ценность белка колеблется от 1,82 до 4,27 ккал/г, однако за эталон принимают цифру 4,0 ккал/г [4]. Существенные различия в энергетической ценности белка связаны, с одной стороны, с различной молекулярной массой аминокислот, а с другой — с разными путями и механизмами их окислительного метаболизма (рис. 2).
2).
Считают, что белки (аминокислоты) могут обеспечить 11-14% энергии суточного рациона. Например, при суточной калорийности в 2500 ккал на белок может приходиться 275-350 ккал, что должно соответствовать 69-88 г белка. Однако все пищевые аминокислоты не могут полностью окисляться с образованием энергии. Значительная часть энергии теряется в процессе кругооборота и метаболизма аминокислот. Поэтому эффективность использования энергии пищи организмом человека, как полагают, составляет около 20-25% [4].
Аминокислоты мышечных белков, а также сывороточные и другие белки являются важным источником образования глюкозы и метаболической энергии в форме АТФ. При длительном голодании это приводит к массивному распаду мышечного белка и снижения содержания белка и его фракций в сыворотке крови. Диеты с низким (недостаточным) количеством углеводов также ведут к деградации мышечных и сывороточных белков.
В биосинтезе глюкозы участвуют в основном заменимые аминокислоты — 10-25% и только 1% незаменимых аминокислот. В организме человека углеродные скелеты некоторых аминокислот могут непосредственно превращаться в пируват или в промежуточные продукты цитратного цикла (окса-лоацетат, сукцинил-КоА, кетоглутарат и фума-рат) с освобождением энергии в дыхательной цепи митохондрий (табл. 2). При этом оксалоацетат может превращаться в фосфоенолпируват и по пути глюконеогенеза — в глюкозу. Источником глюкозы может стать и пируват [5]. Таким образом, разные глюкогенные аминокислоты могут включаться в пути обмена глюкозы (гликолиз и глюконеогенез) на разных его этапах. Судьба разных аминокислот
го
О 2
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолп и руват
оксалоацетат
го
го
0 ^
2
го
1
I
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолпируват
оксалоацетат
Пируват
аминокислоты
Ацетил-КоА
I
ЦИТРАТНЫЙ ЦИКЛ сукцинил КоА, кетоглутарат, фумарат, оксалоацетат
ДЫХАТЕЛЬНАЯ ЦЕПЬ
ЭНЕРГИЯ
Рис. 2. Пути метаболизма глюкогенных аминокислот
2. Пути метаболизма глюкогенных аминокислот
о
неодинакова: одни из них могут превращаться в глюкозу и далее в гликоген, тогда как другие, минуя глюкозу, могут непосредственно окисляться до СО2 и Н2О с образованием АТФ.
Установлено, что из 100 г аминокислот может образовываться только 57 г глюкозы. При голодании в первые 3-4 дня из аминокислот в среднем в сутки образуется около 41 г глюкозы, а спустя несколько недель голодания образование глюкозы снижается до 16 г в сутки. При сахарном диабете 2-го типа превращение глюкогенных аминокислот в глюкозу происходит с гораздо большей скоростью, чем у здоровых людей [5]. Как следствие этого у больных диабетом с мочой выводится большое количество мочевины, которая образуется при дезаминировании глюкогенных аминокислот. В критических состояниях скорость глюконеогенеза с использованием аминокислот также существенно возрастает.
Среди аминокислот наиболее эффективно превращаются в глюкозу серин, аланин и пролин, тогда как глютамин, который широко используется в энтеральном и парентеральном питании, стоит на четвертом месте (табл. 3).
Важную роль в процессах глюконеогенеза играет так называемый цикл аланина, который характерен для мышечной ткани (рис. 3). При дефиците глюкозы в организме или при голодании усиливается катаболизм мышечных белков с освобождением свободных аминокислот, около 50% которых составляет аланин [2]. Аланин поступает в печень, где из него образуется пируват, который включается в глюконеогенез. Когда в мышечной ткани возобновляется биосинтез белка, возникает потребность в аланине, который начинает синтезироваться из пирувата. В свою очередь источником пирувата является глюкоза, из которой он образуется в результате гликолиза. Таким образом, аланин завершает свой кругооборот:
НЕЗАМЕНИМОСТЬ АМИНОКИСЛОТ
Говоря о значении различных аминокислот для организма человека, необходимо рассмотреть понятие незаменимости. Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
S Lr
обеспечивающих пластические и регенера- sj
тивные процессы, связанные с образованием ц
новых клеток и тканей» [6]. <
Согласно классическим исследованиям Rose, для взрослого здорового человека жизненно необходимыми являются 8 аминокислот, которые стали считать незаменимыми (табл. 4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
Остальные 12 аминокислот считают заменимыми. К ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, гистидин, глицин, глютамин, глютами-новую кислоту, пролин, серин, тирозин и цистеин. Эти аминокислоты, как полагают,
катаболизм белка t! глюконеогенез
БЕЛОК аланин пируват ГЛЮКОЗА
анаболизм белка МЫШЕЧНАЯ ТКАНЬ гликолиз ПЕЧЕНЬ
Рис. 3. Цикл аланина Таблица 2
СУДЬБА ГЛЮКОГЕННЫХ АМИНОКИСЛОТ [5]
Аминокислоты Превращаются в: Результат
Аланин, глицин, серин, треонин, цистеин Пируват Глюкоза/АТФ
Аспарагин, аспарагиновая кислота Оксалоацетат Глюкоза/АТФ
Валин, изолейцин, метионин, триптофан Сукцинил-КоА АТФ
Аргинин, гистидин, глутамин, глутаминовая кислота, пролин Кетоглутарат АТФ
Аспарагиновая кислота, тирозин, фенилаланин Фумарат АТФ
Таблица 3
СКОРОСТЬ ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ ИЗ РАЗЛИЧНЫХ ПРЕДШЕСТВЕННИКОВ [5]
Предшественник Образование глюкозы мк моль/мин г ткани Предшественник Образование глюкозы, мкмоль/мин г ткани
Фруктоза 2,68 Глутамин 0,45
Диоксиацетон 2,07 Треонин* 0,40
Лактат 1,06 Глутамат 0,31
Пируват 1,02 Аргинин 0,27
Серин 0,98 Аспартат 0,23
Аланин 0,66 Изолейцин* 0,22
Пролин 0,55 Орнитин 0,19
Глицерин 0,48 Валин* 0,12
Примечание: * — незаменимые аминокислоты.
m
о
способны синтезироваться в организме человека в достаточном количестве. Наряду с этим выделяют группу аминокислот, которые необходимы человеку в определенные периоды развития и в некоторых физиологических и клинических ситуациях. Эти аминокислоты относят к условно незаменимым (табл. 5).
Другим критерием значимости и биологической ценности аминокислот считают степень их участия в обеспечении азотистого равновесия. Имеются данные о целесообразности выделения третьей группы аминокислот, обладающих свойствами ускорять рост. К их числу относят 7 аминокислот: аргинин, глютаминовую кислоту, пролин, серин, тирозин, триптофан и цистеин.
Заслуживает внимание классификация аминокислот, предложенная Josue de Castro, который разделил их на две группы. В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
А.Э. Шарпенак относил к незаменимым 12 аминокислот: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, тирозин, треонин, триптофан, фенилаланин и цистеин. По данным Eagle, для культивирования клеток животных и человека необходимы те же 12 аминокислот, но с заменой треонина на глютамин [6].
Таблица 4
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ [6]
Автор Rose Условно незаменимые Ускоряют рост Jose de Castro А.Э. Шарпенак Eagle, 1958
Число 8 6 7 10 12 12
Валин Аспартат Аргинин Рост Аргинин Аргинин
Изолейцин Гистидин Глютамат Аргинин Валин Валин
Лейцин Глютамин Пролин Гистидин Гистидин Гистидин
ЛИЗИН* Таурин Серин Лизин Изолейцин Изолейцин
Метионин Тирозин Тирозин Пролин Лейцин Лейцин
Ами- ТРЕОНИН* Цистеин Триптофан Цистеин Лизин Лизин
лоты Триптофан Цистеин Регенерация Метионин Метионин
Фенилаланин Аспартат Тирозин Тирозин
Абсолютно Глютамат Треонин Глютамин
заменимые Тирозин Триптофан Триптофан
ГЛЮТАМАТ Триптофан Фенилаланин Фенилаланин
СЕРИН Фенилаланин Цистеин Цистеин
Примечание: * — абсолютно незаменимые аминокислоты.
Таблица 5
ФУНКЦИИ УСЛОВНО НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
Аминокислота Функции в организме
Аспартат Необходим для процессов регенерации
Гистидин Необходим для маленьких детей, у которых эндогенный синтез недостаточен
Глютамин Необходим для процессов регенерации, является важным энергетическим субстратом в критических состояниях
Таурин Необходим для новорожденных, у которых эндогенный синтез недостаточен, а также для больных в критических состояниях. Дефицит возникает при недостатке метионина и цистеина
Тирозин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. При нарушении функции почек снижено образование тирозина из фенилаланина
При нарушении функции почек снижено образование тирозина из фенилаланина
Цистеин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. Дефицит возникает при недостаточном содержании метионина в питании. Крайне необходим при нарушениях функции печени и для больных в критических состояниях
В основе разноголосицы в определении важности и незаменимости тех или иных аминокислот лежат особенности их биосинтеза и метаболизма в организме человека. За исключением двух аминокислот — лизина и треонина, которые являются у человека абсолютно незаменимыми, остальные «незаменимые» аминокислоты в определенных количествах могут синтезироваться за счет реакций трансаминирования, но объем их синтеза является недостаточным.
Ряд незаменимых аминокислот являются предшественниками для синтеза заменимых. Например, из незаменимой аминокислоты фенилаланина синтезируется заменимая аминокислота тирозин, а из незаменимого метионина — заменимый цистеин. Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
С метаболических позиций абсолютно заменимыми являются глютаминовая кислота и серин, которые в необходимых количествах синтезируются из кетокислот. Биосинтез остальных «заменимых» аминокислот в организме человека ограничен. По этой и другим причинам полностью обеспечить потребность организма только за счет биосинтеза большинства заменимых аминокислот невозможно. Важно подчеркнуть, что потребность организма в белке, а, стало быть, в аминокислотах — есть величина переменная, которая изменяется на протяжении жизни и может резко возрастать при очень многих физиологических и патологических состояниях.
Подводя итог спорам о важности и незаменимости тех или иных аминокислот, следует подчеркнуть:
• Во-первых, ценность тех или иных аминокислот определяется возможностью их биосинтеза в организме. При этом часть незаменимых аминокислот может синтезироваться в организме, но объем их биосинтеза недостаточен. Разумеется, те аминокислоты, которые ни при каких условиях не образуются в организме и являются абсолютно незаменимыми, должны непрерывно поступать с пищей. Возможности запасания и резервирования лимитирующих аминокислот в составе мышечных белков, альбумина или других белков ограничены.
• Во-вторых, некоторая часть незаменимых аминокислот, помимо пищи, может образовываться при микробиологическом синтезе кишечной микрофлорой и поступать во внутреннюю среду организма.
• В-третьих, физиологическая потребность в незаменимых аминокислотах есть величина переменная и может изменяться в зависимости от активности процессов анаболизма и катаболизма белка, которые, в свою очередь, зависят от уровня физической активности, особенностей обмена веществ, состояния здоровья.
• В-четвертых, обеспечение организма белком и незаменимыми аминокислотами зависит не только от качества, но и режима питания, а также от содержания других компонентов пищевого рациона, например, углеводов. Заменимые аминокислоты занимают
достаточно большой удельный вес в составе белков пищи — до 2/3 суммы аминокислот. В организме человека они выполняют весьма важные функции, причем многие из них играют не меньшую роль, чем незаменимые аминокислоты. Следует подчеркнуть, что хотя заменимые аминокислоты могут образовываться в организме, однако за счет эндогенного биосинтеза обеспечивается лишь минимальная потребность организма. Более того, установлено, что при небольшом потреблении белка в том случае, когда потребность в незаменимых аминокислотах удовлетворяется полностью, лимитирующими становятся заменимые аминокислоты I II [6]. Для обеспечения стабильного азотистого равновесия в организме необходимо примерно в 2 раза больше качественного белка, чем для того, чтобы закрыть потребность в незаменимых аминокислотах. Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
В организме человека аминокислоты, помимо строительства белковых молекул, выполняют еще целый ряд важных функций:
• Участвуют в образовании других аминокислот.
• Входят в состав разных природных соединений — коферментов, желчных кислот, антибиотиков.
• Участвуют в образовании гормонов, медиаторов и нейротрансмиттеров.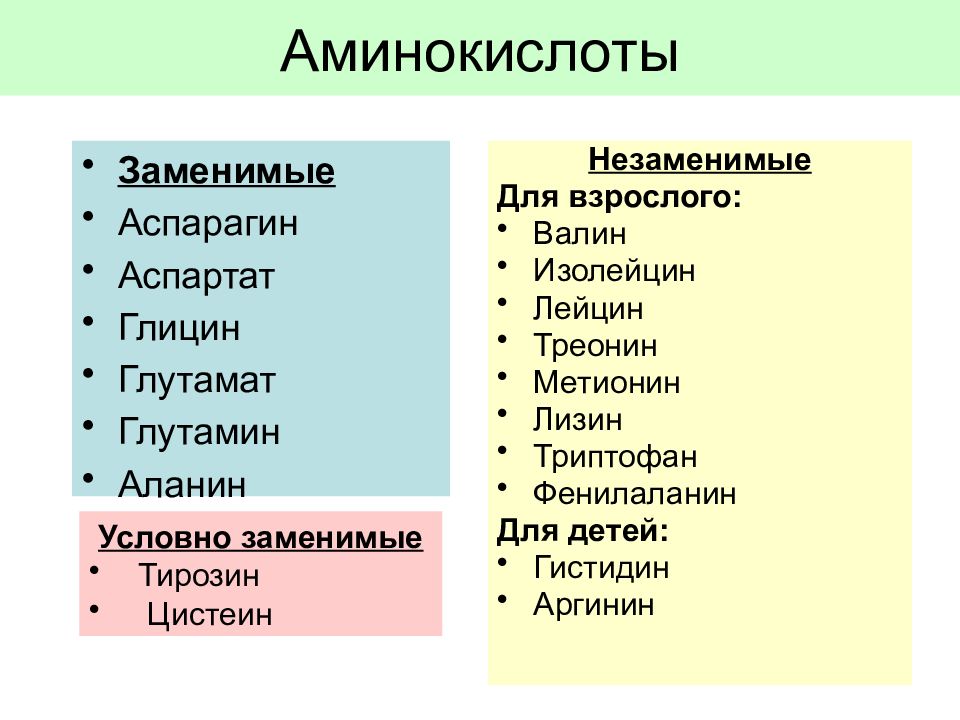
• Являются источниками метаболитов, принимающих участие в обмене веществ.
К числу медиаторов относятся некоторые аминокислоты (глютаминовая и аспарагиновая кислоты, глицин и дофа), а также биогенные амины.
1-Л
о
<3
о
Биогенные амины образуются при отщеплении от аминокислот карбоксильной группы (реакция декарбоксилирования). К их числу относятся: у-аминомасляная кислота, дофамин, норадреналин, адреналин, серотонин, гистамин. Из триптофана через промежуточный продукт 5-гидрокситриптофан образуется нейромедиатор серотонин. Из глютамино-вой кислоты образуется у-аминомасляная кислота.
Гистамин — важнейший медиатор и нейромедиатор, образуется в основном в тучных клетках и нейтрофильных лейкоцитах и участвует в развитии аллергических и воспалительных реакций. При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
Таблица 6
Адреналин — гормон коры надпочечников, где он образуется из аминокислоты тирозина. Адреналин является ключевым гормоном стресса — «аварийным гормоном» и действует на обмен веществ и сердечно-сосудистую систему: повышает сердечную функцию; сужает сосуды, повышая артериальное давление; расширяет бронхи, увеличивая снабжение кислородом; ускоряет расщепление гликогена до глюкозы, обеспечивая энергией мышечную ткань.
Катехоламины — группа биогенных аминов, которые содержат в качестве общего фрагмента производное фенилаланина — катехол. Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
ПРОДУКТЫ МЕТАБОЛИЗМА И СПЕЦИФИЧЕСКИЕ ФУНКЦИИ ОТДЕЛЬНЫХ АМИНОКИСЛОТ [8]
Аминокислота Метаболиты аминокислот Физиологическая функция
Аргинин Образования N0 Креатин Полиамины Молекулярный биорегулятор Предшественник креатинфосфата Экспрессия генов
Аспарагиновая кислота Основа нуклеотида пиримидина Входит в состав нуклеотидов и нуклеиновых кислот
Гистидин Гистамин Нейромедиатор, медиатор воспаления, стимуляция секреции соляной кислоты
Глицин Основа нуклеотида пурина Порфирин Креатин Гиппуровая кислота Гликохолевая желчная кислота Входит в состав нуклеотидов и нуклеиновых кислот Входит в состав гемоглобина и цитохрома Предшественник креатинфосфата Связывание токсических соединений — детоксикация Эмульгирование липидов
Глютаминовая кислота Глютамин у-аминомасляная кислота Транспорт азота в организме, важный источник энергии, предшественник глутатиона Нейромедиатор
Лизин Гидроксилизин Карнитин Составная часть коллагена Транспорт жирных кислот в клетке
Метионин Холин Составная часть фосфолипидов
Серин Этаноламин Холин-ацетилхолин Составная часть фосфолипидов Нейромедиатор
Тирозин Норадреналин-адреналин Тироксин Меланин Нейромедиатор, гормон Гормон щитовидной железы Пигмент кожи и волос
Триптофан Серотонин Никотиновая кислота Нейромедиатор Витамин, составная часть пуриновых нуклеотидов, NAD и NADH
Цистеин Таурин Таурохолевая желчная кислота Антиокислительная активность Предшественник глутатиона
В процессе обмена веществ отдельные аминокислоты превращаются в метаболиты, которые выполняют важные функции в организме человека. -имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
-имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
Лейцин (а-аминоизокапроновая кислота) впервые получен из сыра в 1819 году. Его много в составе белка (в среднем 10%). При недостатке лейцина в
Таблица 7
питании у детей происходит задержка роста и снижение массы тела, отмечают изменения в почках и щитовидной железе.
Лизин (а,е-диаминокапроновая кислота) выделен в 1889 году из казеина. Недостаточное содержание лизина в широко распространенных зерновых продуктах и сравнительно высокая потребность в нем организма (3-5 г в сутки) делают его одной из наиболее важных незаменимых аминокислот. Его недостаток в питании приводит к уменьшению числа эритроцитов и снижению гемоглобина, возникают дистрофические изменения в мышцах, в печени и в легких, нарушается кальцификация костей. Наиболее богат лизином мышечный белок — миозин, а также гемоглобин.
Метионин (а-амино-у-метилтиомасля-ная кислота) впервые был выделен в 1922 году из казеина. Метионин относится к серосодержащим аминокислотам и играет исключительно важную роль в обмене веществ и в процессах метилирования и трансметилирования. Метионин является основным донатором метильных групп. В процессе деметилирования метионина образуется гомоцистеин. Метильные группы метионина используются для синтеза хо-лина, который участвует в обмене липидов. Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
Метильные группы метионина используются для синтеза хо-лина, который участвует в обмене липидов. Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
I
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Валин Легко переаминируется и теряется, восстанавливает мышцы после физической нагрузки Гипертензия, атаксия
Гистидин Синтез фолиевой кислоты, нуклеиновых кислот, гемоглобина и карнозина, важна при уремии, усиливает секрецию соляной кислоты и пепсина Анемия, нехватка карнози-на, нарушение умственного развития у детей
Изолейцин Много в составе иммуноглобулинов, ключевая роль в утилизации пищи Потеря массы тела, высокий диурез
Лейцин Активирует эндокринную систему, важная роль для иммунной системы Задержка роста и физического развития
Лизин Содержится во всех белках, обеспечивает рост костной ткани, стимулирует митозы, поддерживает половую функцию у женщин, снижает уровень триглицеридов, противовирусное действие Головная боль, тошнота, снижение слуха, медленный рост костной ткани
Метионин Защита печени, детоксикация организма, защита от токсикоза беременных, антиоксидантное действие, синтез гемоглобина, функция щитовидной железы, рост Ожирение, цирроз печени, анемия, кровотечения, атрофия мышц
Треонин Усвоение пищевого белка, липотропное действие, обмен коллагена и эластина, повышает иммунитет Потеря веса, высокий диурез
Фенилала-нин 50% идет на синтез белка, синтез адреналина и тирозина, умственная активность, память, улучшает работу печени и поджелудочной железы Нарушение функции щитовидной железы и надпочечников, гипотония
г^.
о
СО
о
биологическое действие витамина В и фолиевой кислоты. В свою очередь эти витамины стимулируют деметилирование метионина и образование холина. Метионин играет важную роль в функции надпочечников, он необходим для синтеза адреналина. Имеются данные о профилактическом действии метионина при лучевых поражениях и бактериальной интоксикации.
Треонин (а-амино-в-оксимасляная кислота) получен в 1935 году из фибрина. Дефицит треонина вызывает задержку роста и снижение массы тела.
Триптофан (а-амино-в-индолилпропионовая кислота) выделен в 1901 году. Важнейшая из незаменимых аминокислот необходим для роста и поддержания азотистого равновесия, участвует в биосинтезе белков сыворотки крови и гемоглобина. Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Фенилаланин (а-амино-в-фенилпропионовая кислота) выделен в 1879 году. Фенилаланин регулирует функцию щитовидной железы и надпочечников. Из него образуется гормон тироксин, а также аминокислота тирозин, из которого, в свою очередь, образуется адреналин. Тирозин может образовываться из фенилаланина, однако обратного образования фенилаланина из тирозина не происходит.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Аргинин (амино-$-гуанидин валериановая кислота) открыт в 1886 году. Играет очень важную роль в обмене веществ. Белки ядер сперматозоидов содержат до 80% аргинина. Аргинин является предшественником оксида азота (N0), который является важным молекулярным биорегулятором. Введение аргинина приводит к расширению сосудов и существенному снижению артериального давления при гипертонической болезни. Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Известно, что аргинин стимулирует активность Т-лимфоцитов, предотвращает возрастное угнетение фагоцитоза макрофагами. Неспецифическая стимуляция иммунной функции аргинином сопровождается снижение частоты рака толстой кишки и молочной железы у экспериментальных животных. Назначение аргинина больным сахарным диабетом 2-го типа существенно повышает чувствительность к инсулину рецепторов клеток организма. У пациентов
У пациентов
с сахарным диабетом он ингибирует гликозилиро-вание гемоглобина, снижая развитие осложнений. У лиц с повышенной физической нагрузкой аргинин усиливает действие инсулина и увеличивает рост кровеносных капилляров в скелетных мышцах. Аргинин стимулирует выработку соматотропного гормона (гормона роста), способствует уменьшению жировых отложений, росту мышечной массы, увеличивает активность и физическую выносливость, улучшает настроение. Он повышает половую функцию, увеличивают выработку сперматозоидов.
Аргинин не рекомендуют беременным и кормящим женщинам, больным шизофренией. Он может стимулировать свободнорадикальные процессы, поэтому его следует принимать в сопровождении антиоксидантов.
Глицин (аминоуксусная кислота) — наиболее простая из аминокислот, в большом количестве содержится в клетках головного и спинного мозга.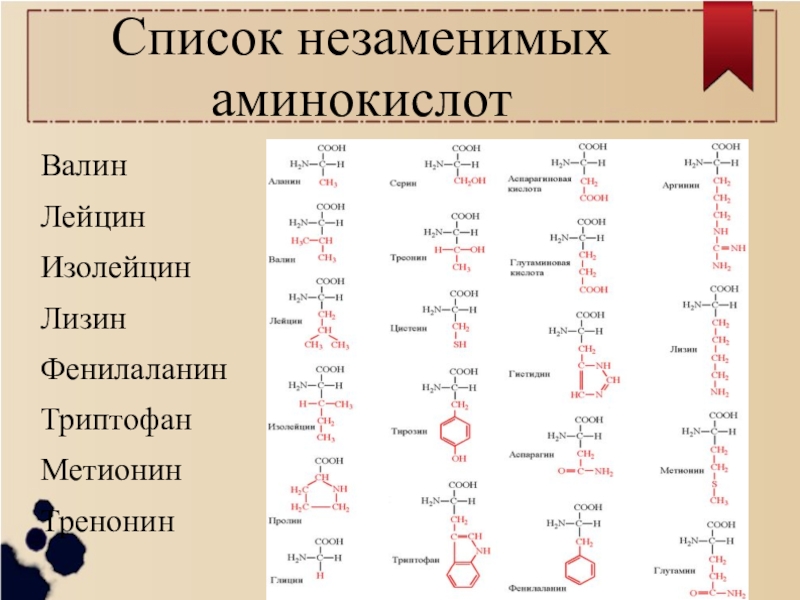 Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Глютамин (8-амид-а-аминоглутаровая кислота) — самая распространенная свободная аминокислота в организме человека (в мышечной ткани содержание свободного глютамина составляет 67%). Очень активно обменивается в организме и является наиболее важной для переноса азота в печень и другие органы. Однако содержание глютамина в составе белка сравнительно небольшое — 5-7% (на лейцин приходится 10%). Глютамин является важным энергетическим субстратом для клеток печени, эпителиальных клеток тонкой кишки и иммунных клеток. Введение глютамина тяжелым больным ослабляет потерю мышечной массы улучшает функцию всасывания. Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Глютамин играет ключевую роль в регуляции синтеза глутатиона — трипептида, состоящего из глютаминовой кислоты, цистеина и глицина. Глутатион является важнейшим эндогенным анти-оксидантом и защищает клетки от окислительного повреждения. Потребность в глютамине возрастает при окислительном стрессе.
Глютаминовая кислота (аминоглютаровая кислота) выделена в 1866 году из эндосперма пшеницы. Глютаминовая кислота играет активную роль в обмене белка и в удалении из организма продуктов распада. Глютаминовая кислота является единственной аминокислотой, поддерживающей дыхание клеток головного мозга. Аминокислоту применяют при лечении некоторых нервных и психических заболеваний. Глютаминовая кислота
участвует в поддержании кислотно-щелочного го-меостаза в крови и тканях.
Пролин (пирролидин-а-карбоновая кислота) — способствует заживлению ран, укрепляет сухожилия, связки и суставы, увеличивает физическую работоспособность, укрепляет сердечную мышцу.
Тирозин (а-амино-в-параоксифенилпропионовая кислота) — способствует функционированию щитовидной железы (синтез тироксина), гипофиза, надпочечников, снижает раздражительность, усталость, стресс, укрепляет сон.
Цистеин (ди-а-амино-в-тиопропионовая кислота) — способствует заживлению ожогов и ран, регенерации кожи, активирует иммунную систему, обладает антиоксидантной активностью.
ПОТРЕБНОСТЬ В АМИНОКИСЛОТАХ
Физиологическая потребность в аминокислотах окончательно не установлена. Проведенные исследования позволили выявить ориентиры потребности в незаменимых аминокислотах, отражающие минимальную потребность, «безусловно достаточное количество» и минимальные показатели суточной потребности [6]. Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Поскольку заменимые аминокислоты могут образовываться в организме, определение их физиологической потребности также непросто. В 2004 году в РФ предложены (на основе расчета) значения адекватного и верхнего уровня потребности для заменимых и незаменимых аминокислот, табл. 9.
Как видно из таблицы, в 2004 году по сравнению с 1971-м суточная потребность примерно для половины аминокислот была пересмотрена как в сторону повышения (аспарагиновая кислота, серин и аланин), так и в сторону снижения (фенилаланин, валин, метионин, триптофан и глютами-новая кислота).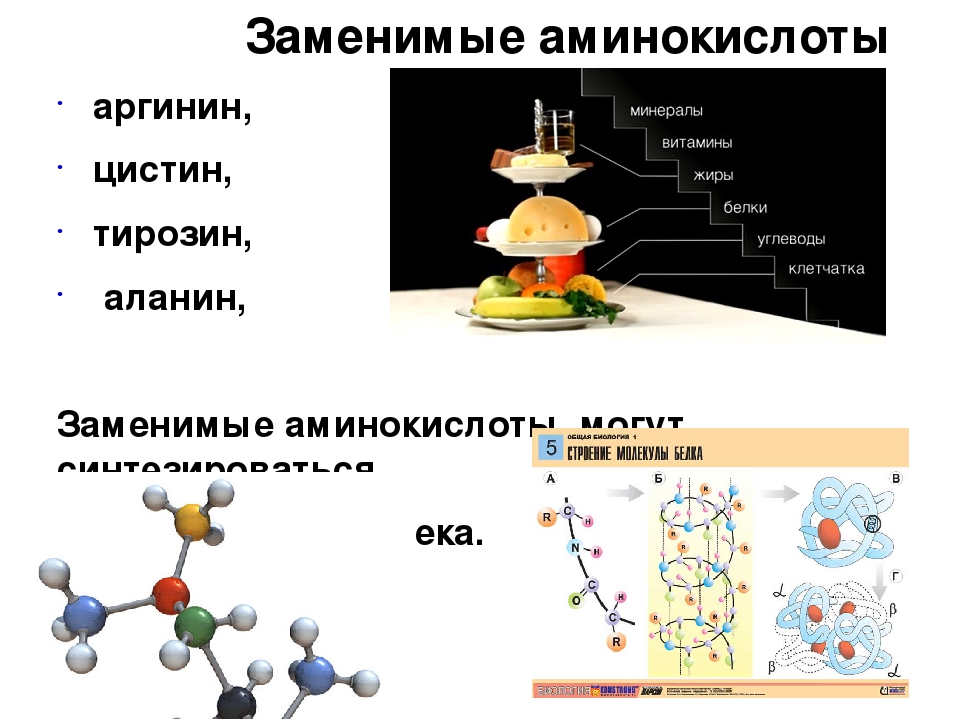 При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
Аминокислотный скор. Качество белка можно оценивать, сравнивая его аминокислотный состав с составом стандартного (идеального) белка. Такой расчет называют аминокислотным скором (оценкой). Аминокислотный скор определяют по формуле:
I
Таблица 8
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ ЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Аргинин Образование мочевины, регулирует рост, тормозит рост опухолей за счет стимуляции иммунитета, детоксикация печени Нарушение роста, риск развития сахарного диабета, эректильная дисфункция
Глицин Синтез коллагена и соединительной ткани, седативное действие, нормализует мозговую функцию и сон, связывание аммиака. Увеличивает синтез лецитина Артрозы и артриты Повышенная возбудимость
Глютамин Переносчик аминных групп, важный энергетический субстрат для печени, тонкой кишки и иммунной системы, играет ключевую роль в регуляции синтеза глутатиона Быстрая потеря мышечной массы у больных, окислительный стресс
Пролин Синтез коллагена и соединительной ткани
Таурин Незаменим у детей, необходим в критических состояниях Нарушение развития мозга, миокарда, ЖКТ
Тирозин Синтез тироксина, пигмента кожи меланина, норадренали-на и адреналина Нарушение пигментации кожи
Триптофан Образование альбумина, выработка серотонина, снижает содержание жира, гипотензивное действие, синтез альбумина и глобулинов, гормона роста, антидепрессант, улучшает сон, снижает аппетит Анемия, стерильность, выпадение волос, депрессия, тревожность
Цистеин Процессы регенерации и заживления ожогов и ран Длительное заживление ран
о о
CD CD
(содержание аминокислоты данного белка (г/100 г) / содержание аминокислоты стандартного белка (г/100 г)) х 100.
Если в исследуемом белке содержание какой-либо аминокислоты будет менее 100%, то эта аминокислота окажется лимитирующей. Для взрослого человека в качестве идеального белка применяют шкалу ФАО/ВОЗ, в которой указано содержание каждой из незаменимых аминокислот в расчете на 100 г белка. Однако для человека и животных существует другие белки, которые в определенные периоды жизни являются единственным источником аминокислот для растущего организма. Среди белков животного происхождения к ним относятся белки молока и яйца. Среди растительных белков
Таблица 9
такими белками являются, например, белки сои, орехов, зародыша пшеницы и др. Сравним состав незаменимых аминокислот женского молока, который можно считать эталонным, с составом аминокислот известных животных (табл. 10) и растительных (табл. 11) белков [9].
Как видно из таблицы, состав незаменимых аминокислот женского молока является достаточно уникальным и не похожим как по составу, так и по соотношению аминокислот среди аналогичных по значимости белков коровьего молока и куриного яйца. В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
РЕЙТИНГ ПОТРЕБНОСТИ ВЗРОСЛОГО ЧЕЛОВЕКА В АМИНОКИСЛОТАХ (г/сутки)
Аминокислоты А.Э. Шарпенак [6] Rous, Mesy, Block [6] ФАО/ВОЗ г/100 г белка [4] О.П. Молчанова, 1971 [6] Адекватный уровень (РФ, 2004) Верхний уровень (РФ, 2004)
Незаменимые
Лейцин 10,0*** 9,1 6,6 4-6 4,6 7,3
Фенилаланин 4,5 4,4 6,3* 2-4 4,4* 6,9*
Лизин 8,0 5,2 5,8 3-5 4,1 6,4
Валин 6,0 3,8 3,5 4,0 2,5 3,9
Треонин — 3,5 3,4 2-3 2,4 3,7
Изолейцин — 3,3 2,8 3-4 2,0 3,1
Метионин 2,5 3,8** 2,5** 2-4 1,8** 2,8**
Триптофан 1,6 1,1 1,1 1,0 0,8 1,2
Суммарно, г/сутки 32,6 34,2 32,0 26 22,6 35,3
% аминокислот 32% 34% 28% 28%
Заменимые
Глютамин + глютаминовая кислота 16,0 13,6 21,8
Аспарагин + аспарагиновая кислота 6,0 12,2 19,9
Серин 3,0 8,3 13,3
Аланин 3,0 6,6 10,6
Аргинин 6,0 6,1 9,8
Пролин 5,0 4,5 7,2
Глицин 3,0 3,5 5,6
Гистидин 2,0 2,1 3,4
Тирозин 3-4
Цистеин 2-3
Суммарно, г/сутки 68 50 56,9 91,6
% аминокислот 68% 66% 72% 72%
Сумма всех аминокислот 100 76 79,5 126,9
заменимые : незаменимые 2,12 1,92 2,5 2,6
Примечание:* — фенилаланин + тирозин; ** — метионин + цистеин; *** — лейцин + изолейцин.
Таблица 10
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И ЖИВОТНЫХ БЕЛКОВ
Аминокислоты Женское молоко Коровье молоко Куриное яйцо Рыба Мясо ФАО/ВОЗ
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 9,7 95 9,2 90 9,1 89 8,7 85 6,6 65
Валин 9,9 6,9 70 7,3 74 6,1 62 5,9 60 3,5 35
Лизин 8,5 7,5 88 7,9 93 9,5 112 8,6 101 5,8 68
Изолейцин 7,6 6,2 82 8,0 105 6,0 79 4,5 59 2,8 37
Фенилаланин 5,9 5,7 97 7,3 124 4,8 81 4,5 76 6,3* —
Треонин 5,0 4,6 92 5,9 118 5,1 102 5,3 106 3,4 68
Метионин 2,3 3,7 161 4,1 178 2,6 113 3,2 139 2,5** —
Триптофан 1,9 1,6 84 1,5 79 0,8 42 1,2 63 1,1 58
Аргинин*** 5,0 4,3 86 6,5 130 8,1 162 6,5 130 — —
Гистидин*** 2,7 2,5 93 2,1 78 2,6 96 3,0 111 — —
Суммарно 51,3 45,9 89 51,2 100 44,0 86 41,9 82 32,0 62
Заменимые 48,7 54,1 48,8 56,0 58,1 68,0
Заменимые : незаменимые 0,94 1,18 0,95 1,27 1,39 2,13
Примечание: * — фенилаланин + тирозин; ** — метионин + цистеин; *** — заменимые аминокислоты.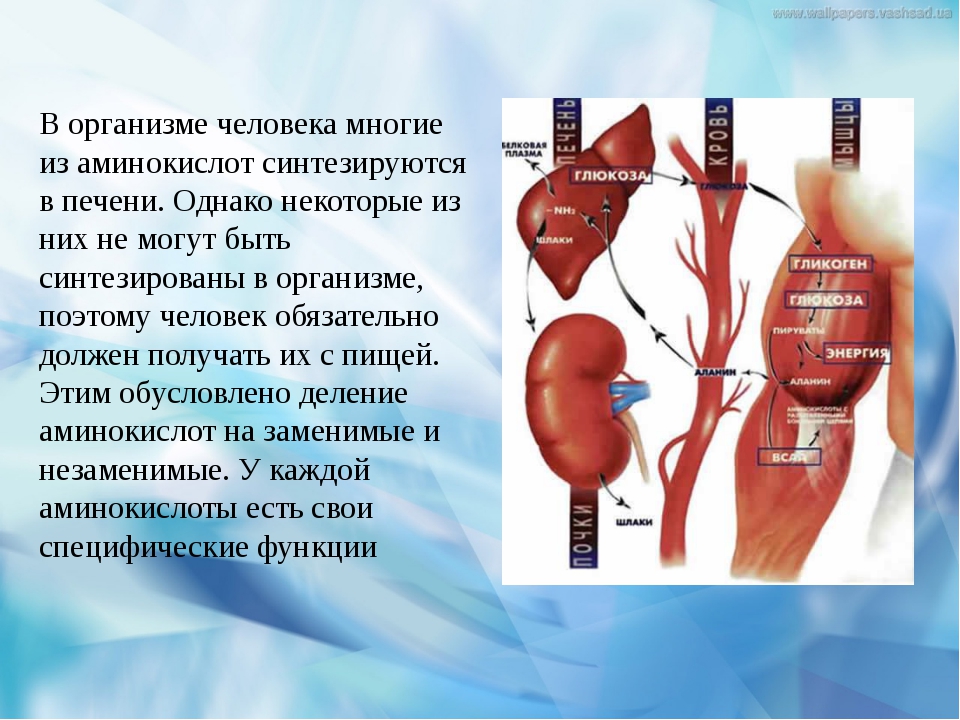
Таблица 11
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И РАСТИТЕЛЬНЫХ БЕЛКОВ
Аминокислоты Женское молоко Соевые бобы Овсяные хлопья Пшеничная мука Картофель
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 7,7 75 7,7 75 6,2 61 10* 56
Валин 9,9 5,3 54 5,3 54 4,3 43 4,0 40
Лизин 8,5 6,9 81 3,0 35 2,5 29 2,6 31
Изолейцин 7,6 5,8 76 5,3 70 3,1 41
Фенилаланин 5,9 5,0 85 4,6 78 4,8 81 6,4 108
Треонин 5,0 4,4 88 3,5 70 2,8 56 3,1 62
Метионин 2,3 1,3 57 1,2 52 1,2 52 1,5 65
Триптофан 1,9 1,3 68 1,3 68 1,3 68 0,6 32
Аргинин** 5,0 7,3 146 7,4 148 4,5 90 1,4 28
Гистидин** 2,7 2,5 93 2,0 74 2,0 74 0,6 22
Суммарно 51,3 37,7 73 31,9 62 26,2 51 28,2 55
Заменимые 48,7 62,3 68,1 73,8 71,8
Заменимые : незаменимые 0,94 1,65 2,13 2,82 2,55
Примечание: * — лейцин + изолейцин; ** — заменимые аминокислоты.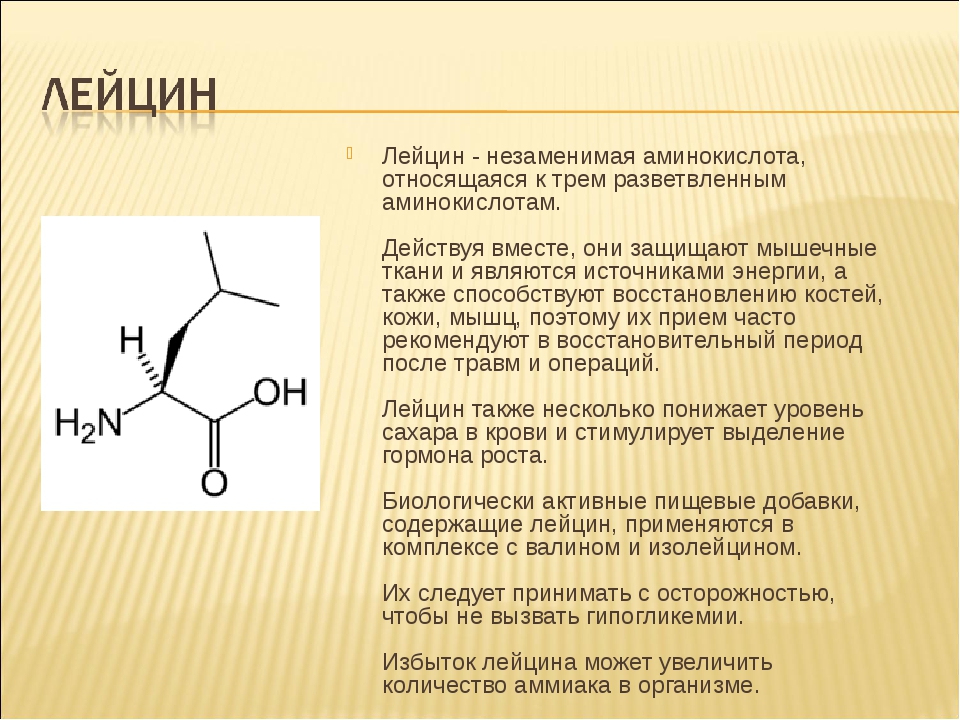 а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
(29-35%), валину (40-54%) и метионину (52-65%). Среди наиболее распространенных растительных белков, безусловно, лучшим является белок сои, который содержит существенно больше незаменимых аминокислот, чем другие растительные белки. Однако белок сои дефицитен по валину (54%), метионину (57%) и изолейцину (76%). Обращает на себя внимание доминирование в растительном белке заменимых аминокислот, которых больше чем незаменимых в 1,6-2,5 раза.
Сравнивая состав незаменимых аминокислот «идеального» белка ФАО/ВОЗ с белками женского или коровьего молока, а также яйца, можно увидеть, что последние отличаются принципиально иным составом и соотношением заменимых и незаменимых аминокислот близким к 1,0. Тогда как в «идеальном» белке ФАО/ВОЗ, а также в современных отечественных нормах это соотношение больше 2,0 (2,12-2,5), что характерно для белков растительного происхождения.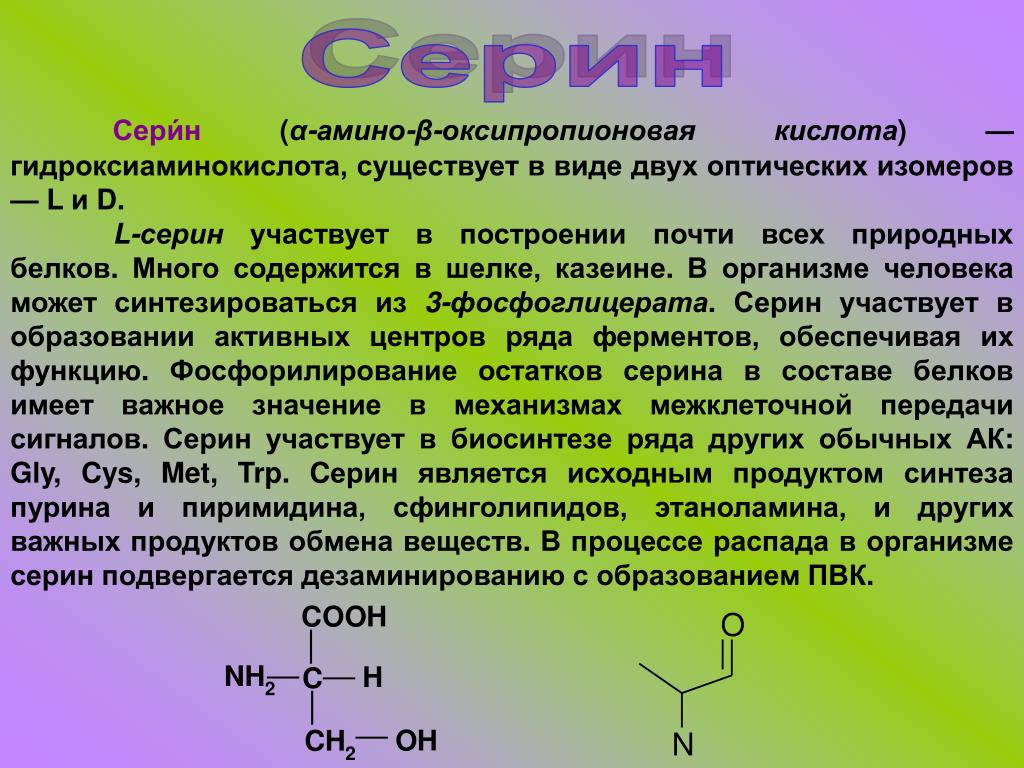 Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
и мяса по содержанию аминокислот существенно отличаются от идеала, а растительные белки имеют еще более низкую биологическую ценность.
Биологическая ценность белка — доля задержки азота в организме от всего белка, попавшего в кровь. Мерой биологической ценности является такое количество белка, которое необходимо для поддержания азотистого равновесия в организме человека или животных. Если в белке есть все необходимые организму незаменимые и заменимые аминокислоты в нужном количестве и в необходимых пропорциях, и они полностью всасываются в желудочно-кишечном тракте, то его биологическая ценность будет равна 100. Когда в составе белка соотношение аминокислот неоптимальное, имеется дефицит отдельных незаменимых аминокислот или если белок плохо усваивается, то его биологическая ценность будет заведомо ниже (табл. 12).
12).
Кругооборот белка в организме человека — явление физиологическое и связано с необходимостью обновления белка. Дело в том, что большинство белков и, прежде всего ферменты, живут недолго и могут разрушаться через несколько часов после биосинтеза. Значительно более долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета клетки. Полупериод жизни белков в организме человека в среднем составляет 2-8 дней. Постоянное обновление белка играет важную роль в обмене веществ и является весьма эффективным механизмом регуляции активности ферментов, обновления пула иммуноглобулинов, удаления дефектных и ненужных в данное время белков. Быстрое разрушение требуется для удаления из организма биологически активных пептидов и пептидных гормонов. Постоянное разрушение и ресинтез новых белков позволяет клеткам «быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов» [2]. Ориентировочно в организме взрослого человека ежедневно в результате протеолиза деградирует до аминокислот 300-400 г белка. В то же время примерно столько же аминокислот включается во вновь
В то же время примерно столько же аминокислот включается во вновь
Таблица 12
ОЛ
сэ
КАЧЕСТВО НЕКОТОРЫХ ПИЩЕВЫХ БЕЛКОВ ОТНОСИТЕЛЬНО БЕЛКОВ ЖЕНСКОГО МОЛОКА
Пищевой белок Химическая ценность, % Биологическая ценность, % Дефицитные аминокислоты
Женское молоко 100 95 Нет
Яйцо куриное 100 87 Валин (74%), триптофан (79%)
Говядина 98 93 Изолейцин (59%), валин (60%), триптофан (63%), фенилала-нин (76%)
Коровье молоко 95 80-82 Валин (70%)
Рыба 61-86 Триптофан (42%), валин (62%), изолейцин (79%)
Соя 61-73 Валин (64%), метионин (57%), лейцин (75%), изолейцин (76%)
Белый хлеб 47 30 Лизин (29%), изолейцин (41%), валин (43%), метионин (52%), треонин (56%), лейцин (61%), триптофан (68%)
образованные белки. Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
В результате протеолиза образуются аминокислоты, которые могут быть использованы клеткой для биосинтеза новых белков или поступают в кровь, формируя пул свободных аминокислот, объем которого составляет около 100 г. Деградация белка в клетках осуществляется с помощью двух специализированных систем: лизосом и протеосом. Важную роль в осуществлении деградации белков организма играет система пищеварения, в которой переваривается, а затем реутилизируется значительная часть плазматических и других эндогенных белков, а также белки, которые попадают в просвет кишки при слущивании завершивших свою работу эпителиальных клеток. В ходе деградации белка может накапливаться аминный азот, который, в отличие от углеводородной части аминокислот, непригоден для получения энергии. Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
В организме человека существует весьма эффективный механизм регуляции уровня белка. Чем выше дефицит белка в организме, тем лучше
Таблица 13
усваивается пищевой белок, и тем меньше будут потери аминокислот с калом и мочой. С другой стороны, чем больше белка содержится в пище, тем хуже он будет усваиваться. При отсутствии дефицита белка в организме его усвоение в желудочно-кишечном тракте также снижается. Механизм регуляции уровня белка в организме человека также связан с увеличением кругооборота белка и аминокислот при его дефиците и снижением кругооборота и усилением катаболизма белка при его избыточном поступлении с пищей. Таким образом, организм способен в определенной степени сглаживать дефицит белка, в то же время препятствуя перегрузке организма пищевым белком. Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Свободные аминокислоты, находящиеся в крови, захватываются печенью, почками, поджелудочной железой, тонкой кишкой,
РЕЙТИНГ СОДЕРЖАНИЯ АМИНОКИСЛОТ В КРОВИ И В МОЧЕ ЧЕЛОВЕКА [10]
Аминокислота Содержание в крови, мг/100 мл Экскреция с мочой в сутки, мг
Незаменимые диапазон в среднем
Валин 2,88 4-6 5,0
Лизин 2,72 7-48 27,5
Лейцин 1,86 9-26 17,5
Треонин 1,67 15-53 34,0
Изолейцин 1,34 14-28 21
Триптофан 1,27
Метионин 0,52 5-10 7,5
Заменимые
Аланин 3,40 21-71 46
Пролин 2,36 Менее 10 10
Аргинин 1,62
Глицин 1,50 21-71 46
Цистеин 1,47 10-21 15,5
Гистидин 1,38 113-320 217
Серин 1,12 27-73 50
Тирозин 1,04 15-49 32
Глютамат 0,70 8-40 24
Аспартат 0,03 Менее 10 10
т
сэ
более 85% свободных аминокислот покидает систему кровообращения в течение 5-15 минут, поэтому концентрация аминокислот в крови достаточно низкая — 35-70 мг/100 мл [2] (табл. 13).
13).
ЗАКЛЮЧЕНИЕ
Таким образом, потребность человека в белке во многом зависит от качественного состава аминокислот, и прежде всего незаменимых. Поэтому белков животного происхождения, которые наиболее близки по составу аминокислот к белкам организма человека, требуется меньше, чем белков растительных, аминокислотный состав которых существенно отличается от оптимального для человека. Например, при употреблении белков с высокой биологической ценностью (мяса, молока, яиц) для удовлетворения потребности взрослого человека достаточно 0,75 г/ кг массы тела (52,5 г белка/сутки). При употреблении смешанного рациона (белки животного и растительного происхождения) потребность в белке будет составлять 0,85-1,0 г кг массы тела (59,5-70,0 г белка/сутки). Более того, при потреблении животных белков с калом теряется 2,5-3,0% азота, тогда как употреблении в пищу растительных продуктов, богатых клетчаткой (овощи, зерновые) — до 40% пищевого азота [6].
Низкие нормы потребности в белке, которые в свое время предлагали Ро и Читтенден, а затем и Вильямс, были основаны на классических представлениях об азотистом балансе (равновесии). Согласно этим представлениям для поддержания азотистого (белкового) равновесия в организме большинства взрослых людей, которые здоровы и находятся в покое, может быть достаточно 30 г белка/сутки. Читтенден, который изучал белковый обмен у молодых людей (студентов, солдат, спортсменов), показал, что азотистое равновесие вполне может обеспечить 55-60 г белка/сутки [7].
В принципе для поддержания азотистого равновесия у взрослого и здорового человека на минимальном уровне достаточно 36,9 г молочного белка/ сутки. С учетом высокого качества белка куриного яйца минимальная потребность в белке для поддержания азотистого равновесия может составлять 0,34-0,43 г белка/кг массы тела в сутки, или 28 г яичного белка в сутки [11]. Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Таким образом, потребность в белке должна складываться из некоего минимального количества — «безопасного уровня белка», который обеспечивает «надежный уровень потребления», и «дополнительного количества белка», который учитывает особенности обмена веществ, состояние здоровья и качественный состав пищевого рациона. Безопасный уровень белка обеспечивает надежное поддержание азотистого равновесия в организме определенного числа людей, а введение дополнительного количества белка необходимо для заполнения так называемых «лабильныхрезервов белка».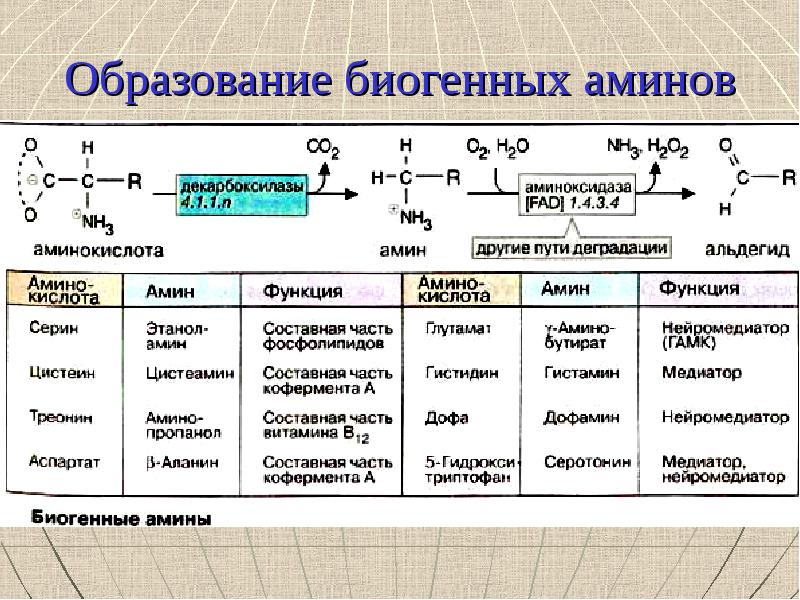
В 1973 году ФАО/ВОЗ путем расчета определило, что величина средней потребности в белке населения развитых стран должно составлять 48,5-56,6 г/ сутки (при относительной биологической ценности 70-80%). Для развивающихся стран, в питании которых присутствует большая доля низкокачественного растительного белка (относительная биологическая ценность — 60-70%), средняя потребность в белке была определена равной 56,6-65,5 г в сутки [11].
Чем ниже биологическая ценность белка, тем больше его требуется. Однако в этом случае некоторые аминокислоты будут поступать в организм человека в избыточном количестве, превышающем текущие потребности, связанные с биосинтезом белка и специфическим метаболизмом отдельных аминокислот. Белки и аминокислоты не способны запасаться в организме, поэтому лишние аминокислоты будут либо выводиться из организма, либо подвергаться метаболической деградации. Содержащийся в аминокислотах азот будет превращаться в мочевину и креатинин и выделяться с почками, углеродный скелет — использоваться для биосинтеза глюкозы или жирных кислот, а другая его часть — окисляться до углекислого газа и воды с образованием АТФ.
Потребность в белке во многом зависит от калорийности и состава других компонентов пищевого рациона — углеводов и липидов (табл. 14). Низкокалорийные диеты или диеты с недостаточным количеством углеводов увеличивают потребность в белке, поскольку часть белка начинает расходоваться для образования глюкозы и кетоновых тел. При отсутствии в пищевом рационе углеводов и жиров для достижения азотистого равновесия пищевого белка требуется в 5 раз больше [6]. С увеличением калорийности пищевого рациона потребность в белке снижается.
Таким образом, рассматривая потребность организма в белке и аминокислотах, можно сделать следующие выводы:
• Белок пищи необходим не только для биосинтеза белков организма, но и для решения энергетических проблем, особенно в критических ситуациях.
• Отдельные аминокислоты пищевого белка выполняют в организме самостоятельную функцию, что необходимо учитывать при назначении
Таблица 14
ВЛИЯНИЕ КАЛОРИЙНОСТИ РАЦИОНА НА ПОТРЕБНОСТЬ В БЕЛКЕ ДЛЯ ПОДДЕРЖАНИЯ АЗОТИСТОГО РАВНОВЕСИЯ [12]
Калорийность рациона Потребность в белке для нулевого баланса Безопасный уровень потребления белка
ккал/кг кал/70 кг г/кг г/70 кг г/кг г/70 кг
40 2800 0,78 54,6 1,02 71,4
45 3150 0,56 39,2 0,74 51,8
48 3360 0,51 35,7 0,62 43,4
57 4000 0,42 29,4 0,50 35
Рекомендуемая норма потребления 0,80 56
I
аминокислот, используя отдельные аминокислоты для коррекции питания.
• Идеальными белками по составу и пропорциям незаменимых аминокислот являются белки молока и куриного яйца и в меньшей степени — белки мяса. Растительные белки содержат аминокислоты в иных пропорциях и дефицитны по большинству незаменимых аминокислот.
• Избыточное потребление белковой пищи «не идет нам впрок», поскольку лишние аминокислоты пищи будут разрушаться, а белковый азот удаляться из организма. Потребление белка
должно быть равномерным на протяжении суток, что позволяет оптимизировать его всасывание и утилизацию, а также свести к минимуму потери аминокислот.
• Умеренное потребление белка не является столь катастрофичным для организма человека, поскольку при этом снижаются потери аминокислот.
• Для достижения разных целей необходимы белковые модули с разным количеством и соотношением как заменимых, так и незаменимых аминокислот.
ЛИТЕРАТУРА
1. ЛенинджерА.Л. Основы биохимии. — М.: Мир, 1985. — Т. 1. — 365 с.
2. КольманЯ., РемК.-Г. Наглядная биохимия. — М.: Мир, 2000. — 469 с.
3. Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М., 2002. — 320 с.
4. Мартинчик А.Н., Маев И.В., Петухов А.Б. Питание человека (основы нутрициологии). — М.: ГОУ ВУНМЦ МЗ РФ, 2002. — 572 с.
5. Ньюсхолм Э., Старт К. Регуляция метаболизма. — М.: Мир, 1977. — 408 с.
6. Гигиена питания / Под ред. К.С. Петровского. — М.: Медицина, 1971.— Т. 1. — 511 с.
7. Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
8. Основы клинического питания. — Петрозаводск: ИнтелТек, 2003. — 412 с.
9. Химический состав пищевых продуктов. Книга 2. — М.: ВО Агропромиздат, 1987. — 360 с.
10. Большая медицинская энциклопедия. — М.: Медицина, 1974. — Т. 1. — С. 364-371.
11. Energy and Protein Requirements // WHO Tech. Rep. Ser. — 1973. — No 522. — P. 40-72.
12. Общая нутрициология. — М.: МЕДпресс-информ, 2005. — 392 с.
LЛ
CD
Заменимые и незаменимые аминокислоты — Лечебно-диагностический центр Нейрон (Таганрог)
- Подробности
- Автор: ЛДЦ Нейрон
- Опубликовано: 10 Ноябрь 2015
Для нормальной работы и жизнедеятельности наш организм должен регулярно пополнять запасы витаминов, минералов и питательных веществ, которые отвечают за работу внутренних органов и протекание различных внутренних процессов.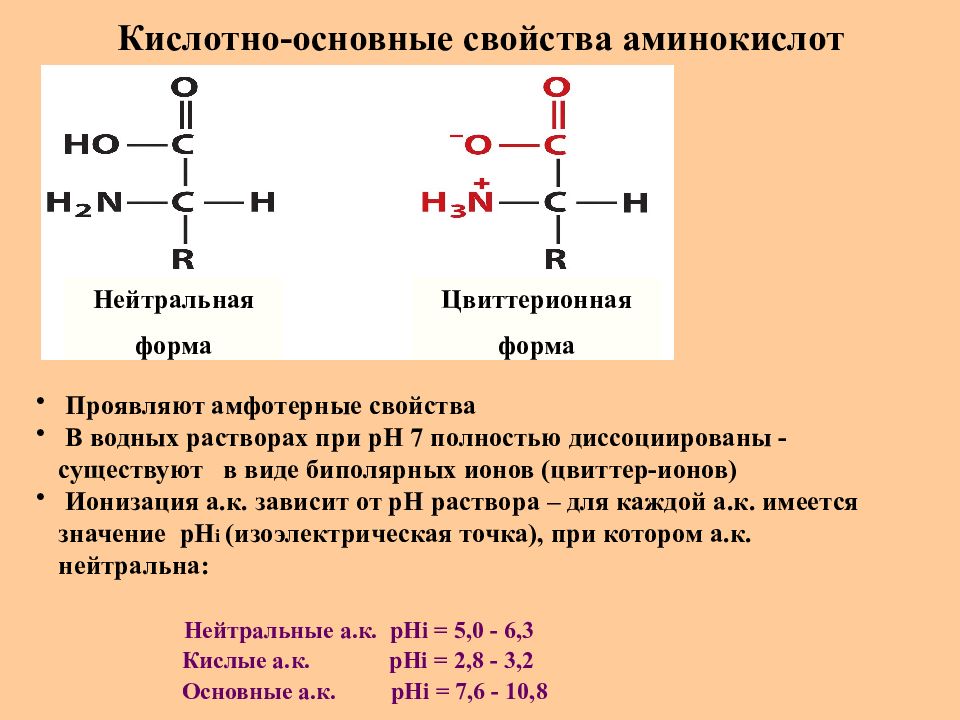 В число важнейших веществ, в которых нуждается каждый из нас, входят аминокислоты. Они представляют собой органические соединения, способствующие образованию белковых молекул, являющихся основой мышечных тканей и отвечающих за обменные процессы в организме.
В число важнейших веществ, в которых нуждается каждый из нас, входят аминокислоты. Они представляют собой органические соединения, способствующие образованию белковых молекул, являющихся основой мышечных тканей и отвечающих за обменные процессы в организме.
По значимости и количеству в организме человека аминокислоты занимают второе место после воды, поэтому не стоит их недооценивать. Чтобы избежать нежелательных последствий, необходимо регулярно пополнять запасы аминокислот в организме и способствовать их выработке, в зависимости от вида.
Виды аминокислот
Все известные на сегодняшний день аминокислоты можно разделить на два основных вида: заменимые и незаменимые. Как вы уже, наверняка, догадались, незаменимые аминокислоты – это те вещества, которые не могут синтезироваться организмом самостоятельно и не заменяются никакими другими веществами. Именно поэтому стоит позаботиться о том, чтобы они регулярно попадали в организм с продуктами питания. Что же касается заменимых аминокислот, то они могут быть получены в результате синтеза других питательных веществ во время протекания внутренних процессов.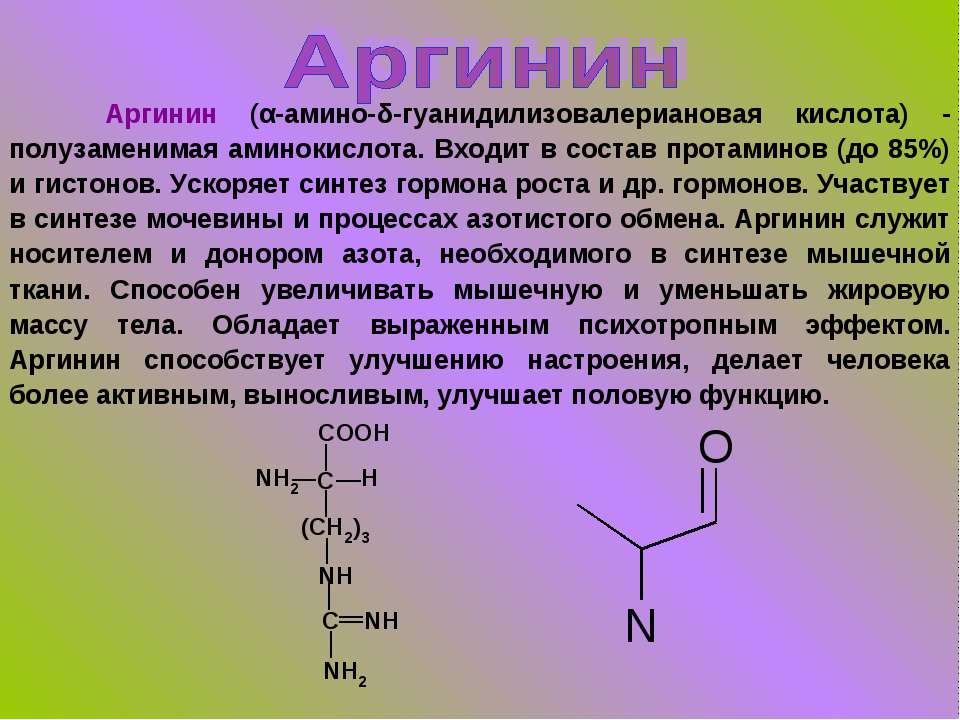 Поэтому их употребление в чистом виде не обязательно. Однако, и те, и другие аминокислоты имеют одинаково важное значение для организма, поэтому нельзя отдавать предпочтение какому-либо одному из видов.
Поэтому их употребление в чистом виде не обязательно. Однако, и те, и другие аминокислоты имеют одинаково важное значение для организма, поэтому нельзя отдавать предпочтение какому-либо одному из видов.
Как уже было сказано ранее, заменимые аминокислоты синтезируются организмом в процессе метаболизма, извлекаясь в достаточном количестве из других органических веществ. При возникновении необходимости, то есть при истощении запасов аминокислот, организм автоматически переключается в режим создания нужной аминокислоты. К заменимым аминокислотам относятся аргинин, аланин, глютамин, глицин, тирозин, пролин, аспарагин, серин и цистеин. Рассмотрим подробнее некоторые из них и их влияние на наш организм.
Аланин
Данная аминокислота вырабатывается организмом в результате попадания в него мяса, молочных продуктов, рыбы, птицы, яиц и некоторых продуктов растительного происхождения, таких как авокадо.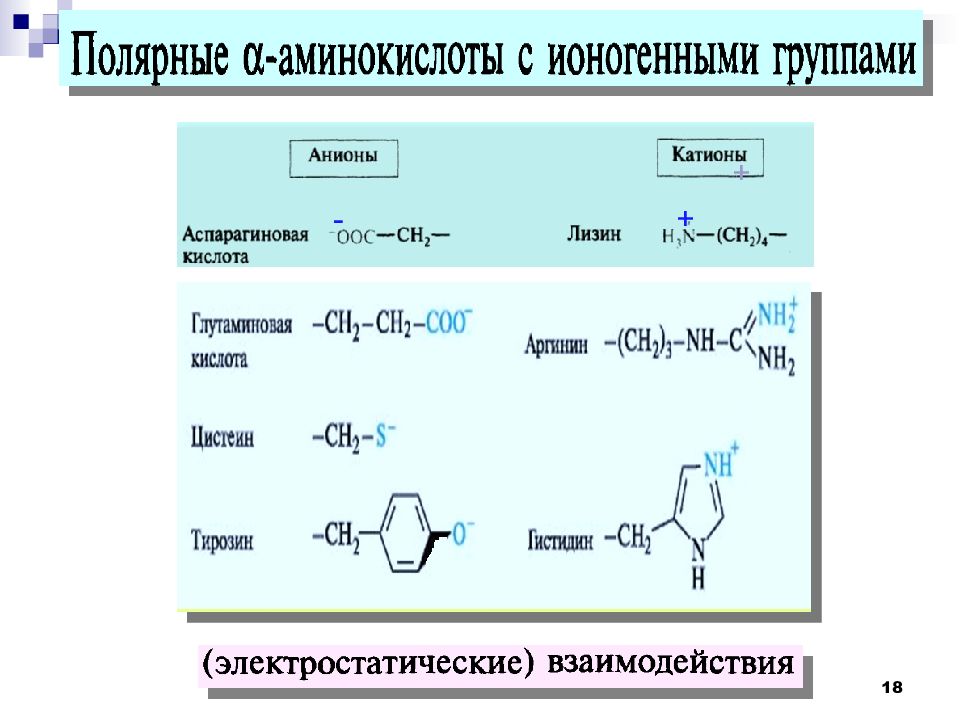 Аланин представляет собой великолепный источник энергии, который обеспечивает организм силой на длительный период. Он способствует ускорению процесса переработки и усвоения глюкозы и выведению токсинов из печени. Помимо этого аланин предотвращает распад мышечных тканей, который протекает особо интенсивно во время физической нагрузки. В некоторых случаях аланин выступает в роли профилактического средства при увеличении предстательной железы.
Аланин представляет собой великолепный источник энергии, который обеспечивает организм силой на длительный период. Он способствует ускорению процесса переработки и усвоения глюкозы и выведению токсинов из печени. Помимо этого аланин предотвращает распад мышечных тканей, который протекает особо интенсивно во время физической нагрузки. В некоторых случаях аланин выступает в роли профилактического средства при увеличении предстательной железы.
Аргинин
Такая аминокислота, как аргинин, имеет весьма большое значение для человека и считается одной из важнейших в организме. Она принимает участие в поддержании здоровья суставов, мышц, кожи и печени. Она обладает восстановительными свойствами, поэтому часто способствует регенерации тканей при артрите и других заболеваниях суставов. Аргинин принимает непосредственное участие в процессе укрепления иммунной системы, участвует в синтезе креатина, а также снижает количество жировых отложений, что будет весьма кстати для тех, кто занимается спортом с целью похудения.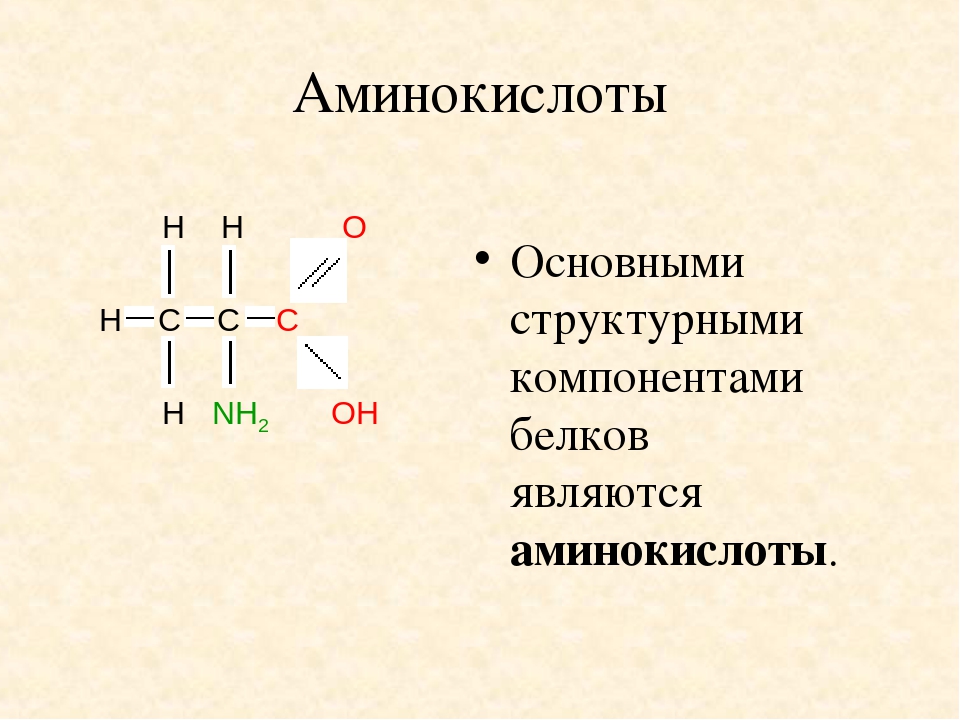 Несмотря на то, что аргинин вырабатывается организмом, людям с ожогами на коже и тем, кто хочет стремительно набрать мышечную массу рекомендуется дополнительно принимать данную аминокислоту в виде пищевой добавки. Природными источниками аргинина являются молочные продукты, мясо, шоколад, некоторые орехи, овёс и пшеница.
Несмотря на то, что аргинин вырабатывается организмом, людям с ожогами на коже и тем, кто хочет стремительно набрать мышечную массу рекомендуется дополнительно принимать данную аминокислоту в виде пищевой добавки. Природными источниками аргинина являются молочные продукты, мясо, шоколад, некоторые орехи, овёс и пшеница.
Глютамин
Получить это заменимую аминокислоту можно из многих продуктов, а в особенности из зелени. Однако, стоит учитывать, что глютамин быстро разрушается при термической обработке, поэтому его источники лучше употреблять в сыром виде. Данная аминокислота принимает участие в создании мышц и поддержании их состояния. Она выступает в качестве источника питания для головного мозга, а также представляет собой источник энергии для нервной системы, нормализуя её состояние и снимая напряжение. Кроме этого, глютамин способен выводить из печени токсические вещества, предотвращать нежелательный распад мышечных тканей, укреплять иммунную систему и помогать при артрите и хронической усталости. Одним словом, эта заменимая аминокислота обязательно должна присутствовать в рационе тех, кто беспокоится о своём здоровье.
Одним словом, эта заменимая аминокислота обязательно должна присутствовать в рационе тех, кто беспокоится о своём здоровье.
Незаменимые, или как их ещё называют, эссенциальные аминокислоты не могут синтезироваться нашим организмом, поэтому практически единственным их источником являются продукты питания, которые мы употребляем ежедневно. В случае нехватки этих аминокислот, организм потребляет их из мышечных тканей, что негативно отражается на состоянии мышц. В число незаменимых аминокислот входят лейцин, изолейцин, лизин, метионин, гистидин, валин, треонин и триптофан.
Лейцин
Эта аминокислота относится к классу ВСАА, так как имеет разветвлённую цепочку и играет весьма важную роль в процессе восстановления мышц, благодаря чему невероятно популярна среди людей, регулярно занимающихся спортом. Лейцин гораздо быстрее других незаменимых аминокислот превращается в глюкозу, благодаря чему способствует остановке в мышечных тканях катаболических процессов, происходящих во время изнурительных тренировок. Помимо этого, лейцин контролирует уровень сахара в крови, увеличивает выработку гормона роста, а также способствует сжиганию жиров, что непременно порадует тех, кто приобщился к спорту с целью похудения. Источниками лейцина являются мясо, орехи, бобовые культуры, рис, цельная пшеница и соевая мука.
Помимо этого, лейцин контролирует уровень сахара в крови, увеличивает выработку гормона роста, а также способствует сжиганию жиров, что непременно порадует тех, кто приобщился к спорту с целью похудения. Источниками лейцина являются мясо, орехи, бобовые культуры, рис, цельная пшеница и соевая мука.
Изолейцин
Изолейцин, как и предыдущая аминокислота, является одной из главных аминокислот ВСАА, которые часто используются в профессиональном бодибилдинге. Регулярное употребление изолейцина способствует увеличению выносливости и продуктивности тренировок, ускоряет восстановление и рост мышечной массы, стимулирует пополнение запасов энергии естественным путём, исключая разрушение мышц. Благодаря изолейцину можно в кротчайшие сроки улучшить свои спортивные результаты и добиться желаемых форм. Получить эту незаменимую аминокислоту можно из мяса, рыбы, орехов, яиц, гороха, сои и семян.
Лизин
Данная аминокислота часто добавляется в спортивное питание, так как основная её функция – это укрепление иммунитета, который ослабевает при недостатке питательных веществ и чрезмерных нагрузках на организм. Лизин обладает противовирусным свойством, он регулирует процессы обновления костной ткани, предупреждает развитие простудных заболеваний, а также стимулирует выработку коллагена и мышечного протеина, которые способствуют быстрому восстановлению организма и мышц в частности. Для того, чтобы пополнить запасы лизина, необходимо употреблять красное мясо, рыбу, молоко, яйца, сыр, картофель и дрожжи.
Метионин
В число незаменимых аминокислот, которые необходим нашему организму, входит метионин, обладающий уникальными свойствами. Он принимает участие в переработке и утилизации жиров, поэтому часто помогает во время похудения и пользуется спросом у тех, кто желает избавиться от лишнего веса. Эта аминокислота участвует в процессе образования таурина и цистеина, которые, в свою очередь, выводят из организма токсические вещества, очищая и обновляя его. При помощи метионина осуществляется синтез креатина, повышающего работоспособность и выносливость. Без него невозможен синтез коллагена, отвечающего за эластичность и упругость кожи, а также за здоровье ногтей. Метионин должен стать неотъемлемой частью рациона для людей, страдающих артритом и аллергией. Получить его можно из мяса, рыбы, бобовых культур, лука, чеснока и сои.
лдц «Нейрон»
Добавить комментарий
Аминокислоты, которые не могут быть синтезированы организмом и должны быть получены из рациона, известны как?
существенный.
Как ваше тело получает аминокислоты?
Когда вы едите продукты с белками, ваше тело разрушает белки в аминокислоты, а затем объединяет эти аминокислоты, чтобы сделать белки, в которых они нуждаются … Мясные продукты имеют тенденцию иметь больше аминокислот, поэтому они, естественно, более полезны для вашего организма. Возможны некоторые заменители, за исключением того, что у них не всегда есть необходимые вам аминокислоты.
Как можно получить энергию из аминокислот?
Когда вы едите продукты с белками, ваше тело разрушает белки в аминокислоты, а затем объединяет эти аминокислоты, чтобы сделать белки, в которых они нуждаются. Мясные продукты, как правило, имеют больше аминокислот, поэтому они, естественно, более полезны для вашего организма. Возможны некоторые заменители, за исключением того, что у них не всегда есть необходимые вам аминокислоты.
Зачем вам нужны аминокислоты в диетах?
аминокислоты составляют белки и белки составляют ДНК, которая имеет всю информацию, необходимую вашему организму.
Каковы аминокислоты, которые не могут быть получены организмом?
В алфавитном порядке они: Аргинин. Изолейцин. Гистидин. Лейцин. Метионин. Лизин. Фенилаланин. Триптофан. Треонин. Валин Используйте PVT TIM HALL в качестве пневмонии для запоминания.
Что делает ваше тело с аминокислотами?
Молекулы белка состоят из аминокислот, которые содержат азот и иногда серу. Ваше тело использует аминокислоты для производства новых белков и для замены поврежденных белков.
Как Аминокислоты помогают с телом?
Он строит протеины организма, повышает иммунитет, который помогает создавать антитела, помогает регулировать инсулин и гормоны щитовидной железы, способствует поддержанию баланса жидкости, а также электролитного баланса, который способствует щелочности и кислотности организма.
Сколько аминокислот использует ваше тело?
22 человека используются как «Условные», так и «Существенные», 11 из которых определяются как «Существенные»: Isoleucine. Аланин. Лейцин. Аргинин. Lysine.Aspartate. Метионин. Цистеин. Фенилаланин. Глутамат. Треонин. Глютамин. Триптофан. Глицин. Валин. Proline. Гистидин. Серин. Тирозин.
Аспарагин. Селеноцистеин. Пирролизин.
Аминокислоты, которые не могут быть получены организмом?
Аминокислоты, которые не могут быть получены организмом, называются незаменимыми аминокислотами. Их нужно принимать в рационе человека. В организме человека основными аминокислотами являются фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, аргинин, лейцин и лизин.
Сколько различных аминокислот известно?
Есть 100 с аминокислот, однако 20 из них необходимы для организма. Из них 20, 10 производится в организме, а 10 из них должны быть снабжены диетой для хорошего здоровья. Продукты, содержащие все эти 20 аминокислот, называются полными белковыми продуктами, а продукты, которые не называются неполными белковыми продуктами.
Аминокислоты, которые ваше тело не может сделать?
Существует девять незаменимых аминокислот: гистидин (существенный для детей), изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Эти аминокислоты должны быть снабжены пищевыми продуктами; тело не может их сделать.
Что делает организм с избытком аминокислот?
печень превратит лишние аминокислоты в мочевину, которая затем выводится из крови печенью, а затем выделяется через мочеиспускание.
Сколько аминокислот не может быть получено вашими телами?
Есть 9 аминокислот, которые организм не может производить. Они называются незаменимыми аминокислотами.
Как организмы получают незаменимые аминокислоты?
Поедая определенные типы белков. Белки необходимы в диете животных, так как животные не могут синтезировать все необходимые им аминокислоты и должны получать незаменимые аминокислоты из пищи. Apex Ответ: есть определенные типы белков.
Какую аминокислоту можно использовать организмом для синтеза ниацина?
Ниацин может быть получен из пищевых продуктов в виде самих витаминов или синтезирован в организме из незаменимого триптофана аминокислоты.
Как dna определяет как виды аминокислот, так и их порядок в белках, которые необходимо синтезировать?
Прежде чем клетка сможет создавать аминокислоты, она должна перевести ДНК в РНК. Затем клетка может использовать РНК для создания аминокислот. Звонок читает РНК в трехбуквенных разделах, называемых кодонами. Каждая аминокислота имеет соответствующий антикодон. Клетка соответствует этим кодам вверх и может затем добавить правильную аминокислоту в растущий белок.
Каковы названия двадцать аминокислот в организме?
Аланин Аргинин Аспарагин Аспарагиновая кислота Цистеин Глутаминовая кислота Глютамин Глицин Гистидин Изолейцин Лейцин Лизин Метионин Фенилаланин Пролин Серин Треонин Триптофан Тирозин Валин.
Аминокислоты, которые организм не может производить сам по себе?
Существенными аминокислотами являются те аминокислоты, которые наше тело не может производить само по себе. Их называют так, потому что они должны быть важны в рационе.
Сколько аминокислот не может быть сделано в вашем теле?
Девять незаменимых аминокислот, которые не могут быть получены в организме человека, должны быть получены из пищи: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Что нужно удалить, чтобы одна аминокислота соединилась с другой аминокислотой?
В реакциях конденсации удаляется молекула воды: H из одного мономера и ОН из другого мономера. Оба объединяются, чтобы образовать воду. По этой причине реакции конденсации также называются реакциями дегидратации. Обратите внимание, что реакции конденсации / дегидратации происходят при связывании любых мономеров с образованием любых полимеров;
не только в белках.
Сколько аминокислот содержится в вашем теле?
В вашем организме есть двадцать общих белковых аминокислот, из которых половина может быть образована в клетках. Остальное нужно потреблять в нашем рационе, так как наше тело не может их сделать, но они все еще жизненно важны. Есть две другие аминокислоты, очень часто используемые в белках (только один у людей), то есть 21 аминокислота белка в организме человека.
Некоторые биологические пути используют другие типы аминокислот, не встречающихся в белках. У людей есть по крайней мере шесть дополнительных, но было бы трудно определить точное число.
Могут ли аминокислоты синтезировать белки?
Аминокислоты — это не то, что синтезирует белки. Аминокислоты являются реагентами в процессе синтеза белка. Аминокислоты связаны вместе пептидными связями на рибосоме. Этот процесс известен как перевод. мРНК и тРНК образуют сплошные нити, кодирующие эти аминокислоты. мРНК и тРНК как связываются с рибосомой, и как только мРНК полностью считывается рибосомой, аминокислотная цепь отделяется от рибосомы и идет выполнять желаемую функцию в клетке.
Почему, по-вашему, процесс, посредством которого аминокислоты из белков называют синтезом белка?
Аминокислоты являются строительными блоками белков. Когда образуются белки, с помощью рибосом и строительных блоков, имеет смысл, что этот процесс называется синтезом белка. Это образование белка.
Когда организм использует аминокислоты для энергии?
Глюкоза является предпочтительным источником топлива для тела в состоянии покоя и во время тренировки. Жир является предпочтительным источником энергии при некоторой легкой активности. Аминокислоты обычно не используются для энергии, за исключением тех случаев, когда истощаются другие источники. Аминокислоты могут вводить метаболизм на разных стадиях, в зависимости от химического состава.
Как правило, вы должны стараться иметь «белку, экономящую диету», которая просто означает, что достаточное количество углеводов потребляется, чтобы избавить белок от использования энергии. Белки наиболее важны для водного баланса, образования ферментов и т. Д.
Какие аминокислоты должны присутствовать в рационе, потому что организм не способен их продуцировать?
Из 22 стандартных аминокислот 8 называются незаменимыми аминокислотами, потому что организм человека не может синтезировать их из других соединений на уровне, необходимом для нормального роста, поэтому они должны быть получены из пищи. Это: Isoleucine. Лейцин. Лизин. Метионин. Фенилаланин. Треонин. Триптофан. Валин.
Кроме того, цистеин, таурин, тирозин, гистидин и аргинин представляют собой полуэссенциальные аминокислоты у детей, поскольку метаболические пути, которые синтезируют эти аминокислоты, не полностью развиты.
Почему важно, чтобы незаменимые аминокислоты, потерянные из организма, были заменены в рационе?
аминокислоты очень важны. ДНК, например, производится из аминокислот. без аминокислот ваши клетки не смогут разделить.
Какие 9 аминокислот, которые не могут быть получены организмом?
В алфавитном порядке они: Аргинин. Изолейцин. Гистидин. Лейцин. Метионин. Лизин. Фенилаланин. Триптофан. Треонин. Валин Используйте PVT TIM HALL в качестве пневмонии для запоминания.
Почему организму нужны аминокислоты?
Я думаю, что организму нужны аминокислоты, потому что организм использует эти аминокислоты и превращает их в пригодных к употреблению протинов.
Откуда организм получает свой запас аминокислот?
Ваше тело может производить некоторые из его собственных аминокислот из пищи, которую вы едите, называемой «несущественными» аминокислотами. Другие, называемые «существенными» аминокислотами, должны поступать из растительных и животных источников.
Аминокислоты, сделанные в вашем теле?
MethionineIsoleucine Фенилананин Лисин Валин Leucine Treonine Tryptophan Это незаменимые аминокислоты, найдите список из 20 аминокислот, остальные из них — те, которые мы можем синтезировать, между ними — глутамат. Холин.
Если вы вегетарианец, какие аминокислоты вам следует включать в свой рацион?
Фенилаланин. Валин. Треонин. Триптофан. Изолейцин. Метионин. Лейцин. Лизин. Гистидин Для детей добавить: Цистеин. Тирозин. Аргинин.
Будут ли вегетарианцы получать все двадцать незаменимых аминокислот в своих рационах, объединяя пищевые группы?
Да. Это можно сделать с помощью таких комбинаций, как рис и бобы, например (как и многие другие комбинации зерен и бобовых). Для вегетарианцев, которые пьют молоко (лактовегетарианцы), они получают все 20 незаменимых аминокислот из молочных продуктов.
Могут ли все жирные кислоты синтезироваться в организме?
За исключением нескольких миллиардов молекул, используемых для «изоляции» нервных клеток, они просто делают вас жирными.
Что такое аминокислоты в организме человека?
Аминокислоты являются органическими молекулами, которые обладают как карбоксильными группами, так и аминогруппами. Они представляют собой мономеры полипептидов, которые составляют белки, которые служат многим целям. Например, в качестве ферментов, которые катализируют реакции в каждой клетке организма человека. Он также имеет свои цели в отношении связи между клетками (гормоны), в структуре (например, цитоскелет, волосы, ногти и т. Д.) И другие.
Могут ли аминокислоты исходить из чьего-то рациона?
Да, мы перерабатываем аминокислоты. Тем не менее, человеческое тело может самостоятельно построить половину своих аминокислот. Остальное называют незаменимыми аминокислотами и должно быть съедено.
Что определяет тип аминокислоты, которая синтезируется в клетке?
Биохимический процесс определяет тип аминокислоты, синтезируемой в клетке. Кроме того, РНК играет большую роль в этом.
Аминокислоты, которые не производятся организмом и должны быть получены из источников пищи, называются?
незаменимые аминокислоты. «существенное» означает, что необходимо извлечь их из продуктов, которые мы едим, но на самом деле аминокислоты, которые вырабатывает организм, столь же важны для правильного функционирования и здоровья наших тел.
КАК многие аминокислоты должны быть получены из продуктов, которые вы едите?
Десять. В организме человека, используемого для синтеза белков, содержится 21 аминокислота. 20 являются стандартными, но существует одна нестандартная аминокислота, селеноцистеин, также используемая у эукариот (люди являются частью этой группы). Люди могут синтезировать 10 из них в организме, чтобы другие 10 были получены из внешних источников.
Как организм использует аминокислоты?
В организме используются аминокислоты как строительные блоки белков и как промежуточные звенья в метаболизме. Ваше тело может сделать только 10 из 20 аминокислот. Чтобы получить остальные 10, вы должны есть пищу.
Откуда ваше тело получает аминокислоты?
Продукты, содержащие белок, являются источником аминокислот. Белок разбивается на его аминокислотные компоненты в организме после абсорбции из кишечника и обработки в печени.
Почему основная жирная кислота не может быть синтезирована вашим телом?
Ну, все они, поэтому их называют «необходимыми» жирными кислотами, и их нужно добывать из продуктов, которые вы едите. В основном, это полиненасыщенные жиры, такие как Омега-3, 6 и 9 дюймов.
Должны ли все аминокислоты быть приобретены из рациона?
Аминокислоты, которые должны быть приобретены из продуктов питания и вашей диеты, называются незаменимыми аминокислотами. Эти кислоты включают гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Каковы 20 известных аминокислот?
На самом деле существует 22 известных аминокислоты — 9 из которых являются Essential. То есть, они не могут быть изготовлены организмом. Другие 13 могут быть изготовлены до тех пор, пока все 9 основных аминокислот будут потребляться из нашей пищи … 1. Аланин 2. Аргинин 3.Asparagine 4. Аспарагиновая кислота 5. Цистеин 6. Цистин 7. Глутамин 8.
Глутаминовая кислота 9. Глицин 10. Гистидин — основной 11. Гидроксипролин 12. Изолейцин — основной 13. Лейцин — существенный 14. Лизин — существенный 15. Метионин — существенный 16. Фенилаланин — основной 17. Пролин 18. Серин 19. Треонин — существенный 20 Триптофан — Существенный 21. Тирозин 22. Валин — Существенный.
Что такое аминокислоты, которые не могут быть вызваны метаболизмом?
Аминокислоты, которые не могут быть получены путем метаболизма, называются эфирными аминокислотами. Эти аминокислоты должны быть получены с помощью диеты.
Сколько полипептидов можно синтезировать, используя двадцать общих аминокислот?
Теоретически существует бесконечное количество. Мало того, что последовательность и длина аминокислоты меняют полученный полипептид, а также то, как аминокислотная цепь складывается в свою вторичную, третичную, а иногда и четвертичную структуру. Складывание белков может быть чрезвычайно сложным.
Что должно произойти для аминокислот в белковой полоске, чтобы провести в белок клетки вашего организма?
В белковых слитках нет аминокислот. Аминокислоты состоят из нитей белков. Что происходит, когда пища переваривается, белки поглощаются специальными клетками. Эти клетки конструируют белки в аминокислоту. Затем они переносятся в другие клетки и растворяются в них для получения энергии.
Названы аминокислоты, которые нужно принимать в рационе?
Существенные аминокислоты … Лейцин. Изолейцин. Валин. Лизин. Метионин. Фенилаланин. Треонин. Триптофан. Гистидин.
Как люди получают аминокислоты в своих телах?
Люди получают аминокислоты, необходимые их организмам, через пищу, которую они едят, особенно продукты, богатые белками.
Каково минимальное количество различных аминокислот, необходимых для синтеза большинства белков?
Расчеты показывают, что для кодирования 20 аминокислот требуется минимум три основания. Эксперименты показывают, что аминокислота кодируется группами из трех оснований.
Что делают аминокислоты для вашего тела?
Аминокислоты составляют белки. Функции белков состоят в следующем: — Помогите восстановить клетки тела — Помогите сделать ферменты — Обеспечьте энергию, когда углеводы и жиры закончились — Помогите построить тело — Транспортные среды (такие как гемоглобин, транспортирующий кислород) — Молекулы хранения (железо хранится в печени как белок)
Могут ли все жирные кислоты синтезироваться в организме?
Нет, не все жирные кислоты могут быть синтезированы организмом. Тело не способно синтезировать полиненасыщенные или транс-жирные кислоты.
Урок 12. аминокислоты. белки — Химия — 10 класс
Химия, 10 класс
Урок № 12. Аминокислоты. Белки
Перечень вопросов, рассматриваемых в теме: урок посвящён аминокислотам, их строению, номенклатуре, знакомству с пептидной группой и пептидной связью, химическими свойствами аминокислот, пептидам и полипептидам, знакомству с глицином как представителем аминокислот, биологической роли аминокислот, белкам, их структуре, химическим свойствам.
Глоссарий
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
Получение аминокислот
В промышленности α-аминокислоты получают гидролизом белков.
Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
Cl-CH2-COOH + 2NH3 → NH2-CH2-COOH + NH4Cl
Физические и химические свойства аминокислот
Аминокислоты – кристаллические вещества без цвета и запаха, сладковатые на вкус. Хорошо растворяются в воде.
Аминокислоты – амфотерные соединения, так как аминогруппа проявляет основные свойства, а карбоксильная группа – кислотные.
Карбоксильная группа в составе аминокислот позволяет им реагировать со спиртами. В результате реакции образуются сложные эфиры.
Ион водорода от карбоксильной группы может переходить к аминогруппе, в результате образуется биполярный ион.
Пептиды
Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
Структура белков
Последовательность остатков аминокислот в молекуле белка образует первичную структуру белка.
Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль. Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
Химические свойства белков
В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Превращения белков в организме
Белки являются обязательными компонентами в пищевом рационе человека. В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты. Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Успехи в изучении и синтезе белков
В 1954 г. британский биолог Фредерик Сенгер впервые расшифровал строение белка инсулина. Каждая молекула инсулина состоит из двух полипептидов, в одном из которых 21 остаток аминокислоты, а в другом – 30 аминокислотных остатков.
В 1967 г. был создан прибор – секвенатор, позволяющий определять последовательность остатков аминокислот в макромолекуле белка.
Первый белок, синтезированный в лаборатории в 1953 г. был окситоцин.
В настоящее время развивается наука, которая занимается синтезом искусственных белков, – генная инженерия.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Условие задачи: вычислите массовую долю азота в молекуле аспаргина
. Ответ запишите с точностью до десятых долей.
Шаг первый: вычислить относительную молекулярную массу молекулы аспаргина:
М = 4·12 + 8·1 + 2·14 + 3·16 = 132 а.е.м.
Шаг второй: определить количество атомов азота в молекуле аспаргина и определить их относительную атомную массу:
2·14 = 28 а.е.м.
Шаг третий: определить массовую долю азота как отношение относительной атомной массы азота к относительной молекулярной массе аспаргина:
(28 : 132)·100 = 21,2 %.
Ответ: 21,2.
2. Решение задачи на определение количества различных олигопептидов, которые можно получить из определённого набора аминокислот.
Условие задачи: Сколько ди- и трипептидов можно составить из двух молекул аланина и одной молекулы цистеина?
Шаг первый: определить количество возможных дипептидов.
Из двух молекул аланина и одной молекулы цистеина можно составить три дипептида: Ala-Ala, Ala-Cys и Cys-Ala (два последних дипептида – разные соединения, так как в молекуле Ala-Cys карбоксильная группа аланина соединяется с аминогруппой цистеина, а в молекуле Cys-Ala карбоксильная группа цистеина соединяется с аминогруппой аланина).
Шаг второй: определить количество возможных трипептидов.
Ala-Ala-Cys, Ala-Cys-Ala, Cys-Ala-Ala – возможно составить 3 трипептида.
Ответ: 3 дипептида и 3 трипептида.
Белки — ФГБУ «НМИЦ ТПМ» Минздрава России
Белки представляют основу структурных элементов клеток и тканей. Функции их разнообразны, они принимают участие в обмене веществ, сократимости, росте, размножении, мышлении.
Еще одна функция белков — транспортировка необходимых соединений или химических элементов. Гемоглобин, например, переносит кислород, он же транспортирует углекислый газ.
При попадании в организм чужих белков или клеток вырабатываются особые белки — антитела, которые связывают и обеззараживают чужеродные вещества.
И наконец, белки могут служить источником энергии. Но это самое невыгодное «топливо». В сутки в организме человека расщепляется около 400 г белка. Две трети образовавшихся при этом аминокислот идут на восстановление белка, и одна треть расходуется на образование энергии.
В раннем детстве потребность в белке максимальная. С возрастом она уменьшается, так как ткани наращиваются медленнее. К моменту зрелости главной становится не строительная функция, а энергетическая.
Организм не может принять белка больше, чем ему необходимо, и если потребление белка с возрастом не уменьшается, то образуются конечные продукты белкового обмена: мочевая кислота, мочевина, аммиак, креатинин, креатин и др. При избытке этих соединений выведение их затруднено, и они задерживаются в организме, постепенно накапливаясь и нарушая обменные процессы.
Все огромное множество белков — это комбинации 20 аминокислот, из них 10 аминокислот не синтезируются организмом и могут быть получены только из продуктов питания. Эти незаменимые аминокислоты должны поступать в составе потребляемых нами белков.
Белки пищи могут быть животного и растительного происхождения. Ценность пищевого рациона определяется наличием в белке незаменимых аминокислот.
К полезным животным белкам относятся постная говядина, курятина и индюшатина без кожи, яйца, молочные и кисломолочные продукты.
Рыба является не только источником белка, но и обеспечивает нас полезными омега-3-жирными кислотами.
Белки растительного происхождения (фасоль, соя, горох, чечевица) сочетают в себе высококачественный белок и растворимое волокно, которое очищает организм от холестерина.
Орехи и семена богаты не только белками, но и мононенасыщенными жирами.
Грецкие орехи содержат еще и омега-3-жирные кислоты. Это делает их особенно полезными, однако они содержат много калорий, поэтому потреблять их в большом количестве не следует.
аминокислот, которые не могут быть синтезированы организмом и должны поступать с пищей | Здоровое питание
Автор: Ян Анниган Обновлено 17 декабря 2018 г.
Аминокислоты — это небольшие биологические молекулы, которые при соединении вместе и свертывании образуют белок. Когда вы едите белок, ваша пищеварительная система разъединяет аминокислоты и поглощает их одну за другой. Затем они проходят через ваш кровоток к вашим клеткам, готовые при необходимости соединяться вместе в новые белки. Пищевые белки содержат 20 различных аминокислот, которые можно смешивать и сочетать, создавая в организме самые разные белки.У вас есть способность синтезировать определенные аминокислоты, если в вашем рационе их не хватает; другие же должны быть обеспечены пищей.
Незаменимые и несущественные
Незаменимые аминокислоты — это те аминокислоты, которые вы не можете производить. Поскольку вам не хватает ферментов, необходимых для их создания из других биологических молекул, вы должны ежедневно получать их из своего рациона. Они включают гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аргинин условно незаменим; хотя вы можете синтезировать его, во времена быстрого роста вы, возможно, не сможете сделать достаточно, чтобы удовлетворить свои потребности.С другой стороны, незаменимые аминокислоты не являются абсолютно необходимыми в пищевых продуктах, которые вы потребляете. Однако для поддержания оптимального здоровья в вашем рационе должно быть достаточное количество общего белка.
Дефицит
Ваше тело не накапливает излишки диетических аминокислот, как углеводы или жиры, а недостаток даже одной незаменимой аминокислоты может привести к проблемам со здоровьем. Поскольку вам нужен белок для многих физиологических функций, если ваш рацион не обеспечивает достаточное количество этих питательных веществ, вы начнете разлагать мышечную ткань, чтобы ваши клетки могли получить доступ к недостающей аминокислоте.Кроме того, синтез заменимых аминокислот может зависеть от наличия достаточного количества общего пищевого белка, поскольку аминокислоты, которые он содержит, могут служить биологическими предшественниками. Например, вы можете синтезировать тирозин из избытка фенилаланина или цистеина из избытка метионина, но только если у вас достаточно свободного исходного материала.
Источники
Все пищевые белки животного происхождения содержат полный набор незаменимых аминокислот. Эти белки — из мяса, морепродуктов, яиц, птицы и молока — считаются полноценными по питательной ценности.В большинстве растительных белков отсутствует хотя бы одна незаменимая аминокислота, что делает их неполными. Тем не менее, комбинирование растительных источников белков дополнительным образом обеспечивает ваш рацион всеми незаменимыми аминокислотами. Например, аминокислоты, которых не хватает в цельнозерновых, доступны в бобовых и наоборот, поэтому тушеное мясо из ячменя и чечевицы обеспечивает ваш рацион всеми незаменимыми аминокислотами.
Рекомендации
Включение белков животного происхождения в ваш рацион для удовлетворения ваших потребностей в незаменимых аминокислотах может дать дополнительные преимущества.Например, красное мясо содержит железо, молоко — кальций, а лосось — полезные для сердца жиры. С другой стороны, эти продукты также могут содержать нездоровые насыщенные жиры или холестерин. Растительные источники белка, хотя их правильное включение в свой рацион может потребовать планирования, чтобы убедиться, что вы принимаете все незаменимые аминокислоты, могут обеспечить витамины, минералы, клетчатку и фитохимические вещества, которые могут быть недоступны в белках животного происхождения.
Биохимия, незаменимые аминокислоты — StatPearls
Введение
Незаменимые аминокислоты, также известные как незаменимые аминокислоты, представляют собой аминокислоты, которые люди и другие позвоночные не могут синтезировать из промежуточных продуктов метаболизма.Эти аминокислоты должны поступать из экзогенной диеты, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот. [1] [2] В питании аминокислоты подразделяются на незаменимые и несущественные. Эти классификации явились результатом ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или азотного баланса, даже когда имеется достаточное количество альтернативных аминокислот [3]. Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин.Мнемоническое слово PVT TIM HaLL («частный Тим Холл») — это широко используемое устройство для запоминания этих аминокислот, поскольку оно включает первую букву всех незаменимых аминокислот. Что касается питания, девять незаменимых аминокислот можно получить из одного полноценного белка. Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои. [4] [5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно представляют собой растительные продукты.Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в пищевом белке в наименьшем количестве по сравнению с эталонным пищевым белком, таким как яичные белки. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не отвечает минимальным требованиям для человека. [6]
Основы
Аминокислоты являются основными строительными блоками белков, и они служат азотистыми скелетами для таких соединений, как нейротрансмиттеры и гормоны. В химии аминокислота — это органическое соединение, которое содержит функциональные группы как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислота.Белки — это длинные цепи или полимеры определенного типа аминокислоты, известной как альфа-аминокислота. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновых кислот разделены только одним атомом углерода, который обычно является хиральным углеродом. В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки. [7] [8]
Белки представляют собой цепочки аминокислот, которые собираются через амидные связи, известные как пептидные связи. Разница в группе боковой цепи или R-группе определяет уникальные свойства каждой аминокислоты.Затем уникальность различных белков определяется тем, какие аминокислоты они содержат, как эти аминокислоты расположены в цепи, и другими сложными взаимодействиями, которые цепь осуществляет с собой и с окружающей средой. Эти полимеры аминокислот способны производить разнообразие, наблюдаемое в жизни.
Существует около 20 000 уникальных генов, кодирующих белок, ответственных за более чем 100 000 уникальных белков в организме человека. Хотя в природе встречаются сотни аминокислот, для производства всех белков, содержащихся в организме человека и в большинстве других форм жизни, необходимо всего около 20 аминокислот.Все эти 20 аминокислот представляют собой L-изомер, альфа-аминокислоты. Все они, кроме глицина, содержат хиральный альфа-углерод. И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует упомянуть, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время синтеза рибосомных белков.Пирролойзин жизненно важен; однако люди не используют пирролизин для синтеза белка. После трансляции эти 22 аминокислоты также могут быть модифицированы посредством посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерацию белков. [8]
От 20 до 22 аминокислот, которые составляют белки, включают:
Из этих 20 аминокислот девять незаменимы:
Фенилаланин
Валин
Триптофан
Треонин
Метионин
Гистидин
Лейцин
Лизин
Изолейцин
Незаменимые, также известные как незаменимые аминокислоты, можно исключить из рациона.Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточных количествах в течение определенных физиологических периодов роста, включая беременность, рост в подростковом возрасте или восстановление после травмы [9].
Механизм
Хотя для синтеза белка человека требуется двадцать аминокислот, люди могут синтезировать только половину этих необходимых строительных блоков.У людей и других млекопитающих есть только генетический материал, необходимый для синтеза ферментов, обнаруженных в путях биосинтеза заменимых аминокислот. Вероятно, есть эволюционное преимущество в удалении длинных путей, необходимых для синтеза незаменимых аминокислот с нуля. Потеряв генетический материал, необходимый для синтеза этих аминокислот, и полагаясь на окружающую среду, чтобы обеспечить эти строительные блоки, эти организмы могут снизить расход энергии, особенно при репликации своего генетического материала.Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении материалов, необходимых для синтеза белка. [10] [11] [12]
Клиническая значимость
Классификация незаменимых и заменимых аминокислот была впервые представлена в исследованиях питания, проведенных в начале 1900-х годов. Одно исследование (Rose 1957) показало, что человеческое тело способно поддерживать азотный баланс при диете, состоящей только из восьми аминокислот. [13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот.В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования кормления очищенными аминокислотами. Исследователи обнаружили, что, когда они исключили из рациона отдельные незаменимые аминокислоты, субъекты не смогли бы расти или поддерживать азотный баланс. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, хотя здоровый взрослый может синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для осуществления этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимым продуктом. незаменимая аминокислота в этих условиях.Эта концепция также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут привести организм в такое метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В общем, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Поиск оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером различных физиологических состояний, требующих различного потребления питательных веществ.Следовательно, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья. [1]
При состояниях недостаточного потребления незаменимых аминокислот, таких как рвота или низкий аппетит, могут появиться клинические симптомы. Эти симптомы могут включать депрессию, беспокойство, бессонницу, утомляемость, слабость, задержку роста у молодых и т. Д. Эти симптомы в основном вызваны недостаточным синтезом белка в организме из-за нехватки незаменимых аминокислот.Необходимое количество аминокислот необходимо для выработки нейромедиаторов, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей, которым не уделяется должного ухода [2].
Квашиоркор и маразм являются примерами более тяжелых клинических расстройств, вызванных недоеданием и недостаточным потреблением незаменимых аминокислот. Квашиоркор — это форма недоедания, характеризующаяся периферическими отеками, сухим шелушением кожи с гиперкератозом и гиперпигментацией, асцитом, нарушением функции печени, иммунодефицитом, анемией и относительно неизменным составом мышечных белков.Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания, характеризующаяся истощением, вызванным недостатком белка и недостаточным потреблением калорий в целом. [14]
Непрерывное обучение / обзорные вопросы
Рисунок
Родовая структура аминокислот. Внесен и создан Майклом Лопесом, B.S.
Ссылки
- 1.
- Hou Y, Yin Y, Wu G. Необходимость в питании «незаменимых в питательном отношении аминокислот» для животных и людей.Exp Biol Med (Maywood). 2015 август; 240 (8): 997-1007. [Бесплатная статья PMC: PMC44] [PubMed: 26041391]
- 2.
- Hou Y, Wu G. Adv Nutr. 01 ноября 2018 г .; 9 (6): 849-851. [Бесплатная статья PMC: PMC6247364] [PubMed: 30239556]
- 3.
- Reeds PJ. Незаменимые и незаменимые аминокислоты для человека. J Nutr. 2000 Июл; 130 (7): 1835С-40С. [PubMed: 10867060]
- 4.
- Le DT, Chu HD, Le NQ. Улучшение питательного качества растительных белков с помощью генной инженерии.Curr Genomics. 2016 июн; 17 (3): 220-9. [Бесплатная статья PMC: PMC4869009] [PubMed: 27252589]
- 5.
- Hoffman JR, Falvo MJ. Белок — какой лучше? J Sports Sci Med. 2004 сентябрь; 3 (3): 118-30. [Бесплатная статья PMC: PMC3
4] [PubMed: 24482589] - 6.
- Джуд С., Капур А.С., Сингх Р. Аминокислотный состав и химическая оценка качества белка зерновых культур при поражении насекомыми. Растительная еда Hum Nutr. 1995 сентябрь; 48 (2): 159-67. [PubMed: 8837875]
- 7.
- ЛаПелуса А., Кошик Р. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 5 декабря 2020 г. Физиология, белки. [PubMed: 32310450]
- 8.
- Ву Г. Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 Май; 37 (1): 1-17. [PubMed: 195]
- 9.
- de Koning TJ. Нарушения синтеза аминокислот. Handb Clin Neurol. 2013; 113: 1775-83. [PubMed: 23622400]
- 10.
- Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM.Пути биосинтеза аминокислот и ассимиляции азота: большая делеция генома в ходе эволюции эукариот. BMC Genomics. 2011 22 декабря; 12 Дополнение 4: S2. [Бесплатная статья PMC: PMC3287585] [PubMed: 22369087]
- 11.
- D’Souza G, Waschina S, Pande S, Bohl K, Kaleta C, Kost C. биосинтетические гены у бактерий. Эволюция. 2014 сентябрь; 68 (9): 2559-70. [PubMed: 24
8] - 12.
- Сигенобу С., Ватанабе Х., Хаттори М., Сакаки Й., Исикава Х.Последовательность генома внутриклеточного бактериального симбионта тлей Buchnera sp. APS. Природа. 2000, 7 сентября; 407 (6800): 81-6. [PubMed: 109]
- 13.
- ROSE WC. Потребности в аминокислотах взрослого человека. Nutr Abstr Rev.1957 июл; 27 (3): 631-47. [PubMed: 13465065]
- 14.
- Бенджамин О., Лаппин С.Л. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 19 июля 2020 г., Квашиоркор. [PubMed: 29
3]
Аминокислоты, которые не синтезируются в нашем организме, класс 11 биология CBSE
Подсказка: Аминокислоты являются строительными блоками белков.Они необходимы для многих метаболических реакций в организме. Аминокислоты, которые не синтезируются в нашем организме, пополняются пищей, которую мы едим.Полный ответ: Незаменимые аминокислоты — это аминокислоты, которые наш организм не может производить самостоятельно. Они не могут синтезировать эти ферменты, поскольку им не хватает ферментов, необходимых для их создания из других биологических молекул. Следовательно, эти незаменимые аминокислоты должны поступать с пищей каждый день.
Незаменимые аминокислоты включают гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.Лучшие диетические источники для получения этих незаменимых аминокислот включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты. Казеин — это белок, содержащийся в молоке. В нем есть все незаменимые аминокислоты, поэтому в коровьем молоке самая высокая концентрация казеина, который полезен для роста и развития младенцев. Белки можно классифицировать в зависимости от их пищевой ценности:
a) Богатые белки: их также называют полноценными / первоклассными белками. Они содержат все незаменимые аминокислоты в необходимых и точных пропорциях.Включив эти белки в рацион, дети будут расти здоровыми.
б) Неполные белки: им не хватает одной из незаменимых аминокислот. Они не могут способствовать удовлетворительному развитию тела у детей. Они могут поддерживать вес тела у взрослых. Например, в белках зернобобовых не хватает метионина, а в зерновых — лизина.
c) Плохие белки: им не хватает многих незаменимых аминокислот. Диета, основанная на этих белках, не сможет поддерживать даже исходную массу тела.В зеине кукурузы отсутствуют триптофан и лизин
Следовательно, правильный ответ — вариант D.Примечание: Условные аминокислоты — это те, которые обычно не являются незаменимыми. Они требуются только во время болезни и стресса. Условные аминокислоты включают аргинин, цистеин, глутамин, тирозин, глицин, орнитин, пролин и серин.
Вы в одном шаге от ответа!
Подпишитесь бесплатно!
Регистрируясь, вы также получаете БЕСПЛАТНЫЙ доступ к тысячам решенных вопросов, викторин
и загружаемым PDF-файлам!2.25 типов аминокислот
Наш организм использует 20 аминокислот для синтеза белков. Эти аминокислоты можно разделить на незаменимые, несущественные или условно незаменимые. В таблице ниже показано, как классифицируются 20 аминокислот.
Таблица 2.251 Незаменимые, условно незаменимые и заменимые аминокислоты 1
Essential Условно необходимые Несущественные Гистидин Аргинин Аланин Изолейцин Цистеин Аспарагин Лейцин Глютамин Аспарагиновая кислота или аспартат Лизин Глицин Глутаминовая кислота или глутамат метионин Proline Серин Фенилаланин Тирозин Треонин Триптофан Валин Организм не может синтезировать девять аминокислот.Таким образом, очень важно, чтобы они использовались в рационе. В результате эти аминокислоты известны как незаменимые или незаменимые аминокислоты. В качестве примера того, как аминокислоты были определены как незаменимые, д-р Уильям К. Роуз из Университета Иллинойса обнаружил, что треонин был необходим, давая студентам-выпускникам университета различные диеты, как описано в следующей ссылке.
Незаменимые или незаменимые аминокислоты могут вырабатываться в нашем организме, поэтому нам не нужно их потреблять.Условно незаменимые аминокислоты становятся незаменимыми для людей в определенных ситуациях. Примером состояния, при котором аминокислота становится незаменимой, является болезнь фенилкетонурия (PKU). Люди с PKU имеют мутацию фермента фенилаланингидроксилазы, который обычно добавляет спиртовую группу (OH) к аминокислоте фенилаланину с образованием тирозина, как показано ниже.
Рис. 2.251 Фенилкетонурия (PKU) возникает в результате мутации фермента фенилаланингидроксилазы 2,3
Поскольку люди с фенилкетонурией не могут синтезировать тирозин, он становится для них незаменимым.Таким образом, тирозин является условно незаменимой аминокислотой. Люди с фенилкетонурией должны придерживаться диеты с очень низким содержанием белка и избегать альтернативного подсластителя аспартама, поскольку он может расщепляться на фенилаланин. Если люди с фенилкетонурией потребляют слишком много фенилаланина, фенилаланин и его метаболиты могут накапливаться и вызывать повреждение мозга и серьезную умственную отсталость. Препарат Куван был одобрен для применения у пациентов с фенилкетонурией в 2007 году с низким уровнем активности фенилаланингидроксилазы. Вы можете узнать больше об этом препарате, перейдя по ссылке ниже.
Источники и ссылки
1. Аноним. Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот (макроэлементов) с пищей. Белок и аминокислоты. Институт медицины, пищевых продуктов и питания. 2005 г. http://books.nap.edu/openbook.php?record_id=10490&page=589
2. https://en.wikipedia.org/wiki/Phenylalanine#/media/File:L-Phenylalanin_-_L-Phenylalanine.svg
3. https://en.wikipedia.org/wiki/Tyrosine#/media/File:L-Tyrosin_-_L-Tyrosine.svg
Ссылки
Открытие треонина Уильямом К. Роузом — http://www.jbc.org/content/277/37/e25.full
Куван — http://www.kuvan.com/
незаменимых и незаменимых аминокислот для человека | Журнал питания
РЕФЕРАТ
Здесь мы сравнили традиционное определение питательных веществ незаменимых и незаменимых аминокислот для человека с категоризацией, основанной на метаболизме и функции аминокислот.Эти три точки зрения приводят к несколько разным толкованиям. С точки зрения питания совершенно очевидно, что некоторые аминокислоты являются абсолютной диетической необходимостью для поддержания нормального роста. Тем не менее, в литературе можно найти реакцию роста на дефицит незаменимых аминокислот. С точки зрения метаболизма, есть только три незаменимые аминокислоты (лизин, треонин и триптофан) и две незаменимые аминокислоты (глутамат и серин). Кроме того, рассмотрение метаболизма аминокислот in vivo приводит к определению третьего класса аминокислот, называемых условно незаменимыми, синтез которых может осуществляться млекопитающими, но может быть ограничен множеством факторов.Эти факторы включают наличие в рационе соответствующих прекурсоров, а также зрелость и здоровье человека. С функциональной точки зрения все аминокислоты незаменимы, и был выдвинут аргумент в пользу идеи о критической важности заменимых и условно незаменимых аминокислот для физиологической функции.
Вот уже как минимум 60 лет принято разделять аминокислоты на две категории: незаменимые (или незаменимые) и несущественные (или несущественные).Эта категоризация обеспечивает удобный и в целом полезный способ просмотра аминокислотного питания. Однако, несмотря на долговечность этой конвенции, по мере того, как стало доступно больше информации, различия между незаменимыми и незаменимыми аминокислотами, по крайней мере на метаболическом уровне, стали все более размытыми. Действительно, У. К. Роуз, который отвечал за первоначальное определение этих двух терминов, не был особенно очарован тем, как они применялись другими, и написал следующее (Womack and Rose, 1947):
«Мы подчеркнули несколько раз… классификация аминокислот, таких как аргинин или глутаминовая кислота, как незаменимых или незаменимых, является чисто вопросом определения.”
Я хочу рассмотреть этот« вопрос определения », исследуя термины с точки зрения питания, метаболизма и функциональности.
Пищевая ценность незаменимых и незаменимых аминокислот
Важно помнить, что термины «незаменимый» и «необязательный» изначально были определены не только с точки зрения диеты, но и в отношении роли аминокислот в поддержке отложения и роста белка. На самом деле, насколько я могу судить, исходное определение незаменимой аминокислоты в пищевой ценности (Borman et al.1946): «Тот, который не может быть синтезирован организмом животных из материалов , обычно доступных клеткам со скоростью , соизмеримой с требованиями для нормального роста . «
» Ключевые фразы в этом определении и фразы, выделенные авторами курсивом: «обычно доступны», «со скоростью» и «нормальный рост». Каждый из них является важным определителем.
Фраза «обычно доступные» важна, потому что ряд незаменимых в питательном отношении аминокислот, например.g., аминокислоты с разветвленной цепью, фенилаланин и метионин, могут быть синтезированы путем трансаминирования их аналогичных α-кетокислот. Однако эти кетокислоты обычно не входят в рацион и, следовательно, «обычно не доступны для клеток». Фраза «со скоростью» важна, потому что существуют обстоятельства, при которых скорость синтеза аминокислоты может быть ограничена, например, доступностью соответствующих количеств метаболического азота. Действительно, скорость синтеза приобретает особое значение, когда мы рассматриваем группу аминокислот, например аргинин, цистеин, пролин и, возможно, глицин, которые часто называют условно незаменимыми.Например, Вомак и Роуз (1947) подчеркнули важное замечание о том, что степень, в которой аргинин может считаться незаменимым, во многом зависит от количества его естественных предшественников, пролина и глутамата, в рационе. Наконец, фраза «нормальный рост» важна в двух отношениях. Во-первых, он служит для того, чтобы подчеркнуть, что определения изначально были построены в контексте роста. Например, можно показать (таблица 1), что прием пищи, полностью лишенной глутамата, который в некотором смысле может рассматриваться как доработка незаменимых аминокислот, приводит к небольшой, но статистически значимой более медленной скорости роста.Во-вторых, ограничение определения существенности для роста не включает в себя важность некоторых аминокислот для путей удаления, отличных от отложения белка, что я буду обсуждать позже.
ТАБЛИЦА 1Влияние рациона без глутамата + глутамина на прибавку массы тела у крыс и свиней
ТАБЛИЦА 1Влияние рациона без глутамата + глутамина на прирост массы тела у крыс и свиней
Биосинтез аминокислот
Также возможно определить существенность и несущественность аминокислот в химических и метаболических терминах.Исследование аминокислот, которые обычно считаются важными с пищей, показывает, что каждая из них имеет определенную структурную особенность, синтез которой не может катализироваться ферментами млекопитающих (таблица 2). В связи с этим очень важно отметить, что потеря способности осуществлять эти биосинтеза появилась на ранней стадии эволюции и является общей чертой метаболизма эукариотических организмов в целом, а не только млекопитающих. Однако с этой точки зрения важным термином является синтез de novo.Это связано с тем, что некоторые незаменимые аминокислоты могут быть синтезированы из предшественников, которые очень похожи по структуре. Например, метионин можно синтезировать как путем переаминирования его аналога кетокислоты, так и путем реметилирования гомоцистеина. В этом смысле млекопитающее способно синтезировать лейцин, изолейцин, валин, фенилаланин и метионин. Однако это не новый синтез, потому что кетокислоты с разветвленной цепью и гомоцистеин первоначально были получены из аминокислот с разветвленной цепью и метионина соответственно.Согласно этому ограниченному метаболическому определению существенности, треонин и лизин (и, возможно, триптофан) являются единственными действительно незаменимыми аминокислотами.
ТАБЛИЦА 2Структурные особенности, которые делают аминокислоты незаменимыми компонентами рациона млекопитающих
Аминокислоты . Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Вторичный спирт Вторичный спирт Вторичный спирт Вторичный спирт Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо
ТАБЛИЦА 2Аминокислота . Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Вторичный спирт Вторичный спирт Вторичный спирт Вторичный спирт Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо Структурные особенности, которые делают аминокислоты незаменимыми компонентами рациона млекопитающих
.
Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Вторичный спирт Вторичный спирт Вторичный спирт Вторичный спирт Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо Аминокислота . Конструктивная особенность . Лейцин, изолейцин, валин Разветвленная алифатическая боковая цепь Лизин Первичный амин Треонин Вторичный спирт Вторичный спирт Вторичный спирт Индольное кольцо Фенилаланин Ароматическое кольцо Гистидин Имидазольное кольцо Обратное применимо к заменяемым аминокислотам.Строго говоря, действительно заменимая аминокислота — это аминокислота, которая может быть синтезирована de novo из не аминокислотного источника азота (например, ионов аммония) и подходящего источника углерода. Согласно этому метаболическому определению, единственными действительно метаболически незаменимыми аминокислотами являются глутаминовая кислота и серин. Если это так, то эти две аминокислоты являются конечными предшественниками других заменимых аминокислот. Этот вывод приводит к предсказанию, что вклад эндогенного синтеза в системные потоки глутамата и серина должен быть выше, чем его вклад в потоки других заменимых аминокислот.Похоже, это так (таблица 3). Интересно, что существует обратная взаимосвязь между вкладом эндогенного синтеза в плазменный поток данной заменимой аминокислоты и степенью, с которой кишечник метаболизирует пищевые аминокислоты при первом прохождении (см. Reeds et al.1996, Stoll et al. 1998).
ТАБЛИЦА 3Вклад эндогенного синтеза в системный поток заменимых аминокислот у людей
Аминокислоты . Флюс от синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 1 9020 76 78 Аланин 1 45 46 Глицин 1 35 35 Аргинин Пролин 2 0 7
ТАБЛИЦА 3Аминокислота . Флюс от синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 1 9020 76 78 Аланин 1 45 46 Глицин 1 35 35 Пролин 2 0 7 Вклад эндогенного синтеза в системный поток заменимых аминокислот у людей
Аминокислоты . Флюс от синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 1 9020 76 78 Аланин 1 45 46 Глицин 1 35 35 Аргинин Пролин 2 0 7 Аминокислота . Флюс от синтеза . . . Федеральное правительство . Постное состояние . % Глутамат 1 98 98 Серин 1 9020 76 78 Аланин 1 45 46 Глицин 1 35 35 Аргинин Пролин 2 0 7 Условно незаменимые аминокислоты
Хотя азот аминокислот, которые могут синтезировать млекопитающие, в конечном итоге происходит либо от глутамата, либо от серина, есть некоторые аминокислоты, которые синтезируются более сложными путями, чем простое переаминирование соответствующей кетокислоты.Эти аминокислоты часто называют «условно» незаменимыми; этот термин используется для обозначения измеримых ограничений скорости их синтеза. Когда этот предел достигнут, соответствующая аминокислота становится важным компонентом диеты. Ограничения могут быть результатом ряда факторов.
Во-первых, синтез этих аминокислот (таблица 4) требует предоставления другой аминокислоты, либо в качестве донора углерода, либо в качестве донора вспомогательной группы, такой как серная группа цистеина.Таким образом, способность организма синтезировать данную условно незаменимую аминокислоту определяется доступностью ее предшественника аминокислоты, что подчеркивал Роуз в своих исследованиях взаимодействия между глутаматом, пролином и аргинином в питании. В некоторых случаях, например, для поддержания запаса глицина у млекопитающих, вскармливаемых молоком, потребность в синтезе условно незаменимых аминокислот (Джексон и др., 1981) требует увеличения синтеза его предшественника, в данном случае серина. .
ТАБЛИЦА 4Прекурсоры условно незаменимых аминокислот
Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат N Пролин Глутамат / глутамин Глутамат / метиламин Глутамин ) Глицин Серин
ТАБЛИЦА 4Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат N Пролин Глутамат / глутамин Глутамат / метиламин Глутамин ) Глицин Серин Прекурсоры условно незаменимых аминокислот
Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат N Пролин Глутамат / глутамин Глутамат / метиламин Глутамин ) Глицин Серин Продукт . Прекурсор углерода . Другой прекурсор . Аргинин Глутамат / глутамин / пролин Аммиак и аспартат N Пролин Глутамат / глутамин Глутамат / метиламин Глутамин ) Глицин Серин Во-вторых, некоторые аминокислоты могут быть синтезированы только в ограниченном количестве тканей.Например, синтез пролина и аргинина в решающей степени зависит от метаболизма в кишечнике (Wakabayashi et al. 1994, Wu et al. 1997). Более того, в случае этих двух аминокислот имеющиеся данные свидетельствуют о том, что диетические, в отличие от системных, предшественники аминокислот являются обязательными (Beaumier et al. 1995, Berthold et al. 1995, Brunton et al. 1999, Murphy et al. 1996 г., Столл и др. 1999 г.). Из этого следует, что изменения либо в кишечном метаболизме, либо в способе питания могут иметь решающее значение для способности организма синтезировать эти аминокислоты.Об этом ярко свидетельствуют проблемы гомеостаза аргинина и аммиака, которые сопровождают полное парентеральное питание (Brunton et al. 1999).
В-третьих, большинство данных свидетельствует о том, что даже в присутствии обильных количеств соответствующих предшественников количества условно незаменимых аминокислот, которые могут быть синтезированы, могут быть весьма ограниченными (Beaumier et al. 1995, Berthold et al. 1995, Castillo et al. al. 1993, Fukagawa et al. 1996, Jaksic et al. 1987), поэтому можно утверждать, что существуют обстоятельства, особенно стрессовые обстоятельства, при которых метаболические потребности в аминокислотах возрастают до значений, превышающих биосинтетические возможности организм.Похоже, так обстоит дело с пролиновым питанием обожженных людей (Jaksic et al. 1991). Более того, у незрелых людей, таких как дети с низкой массой тела при рождении, возможно, что синтез условно незаменимых аминокислот может быть ограничен явным отсутствием ферментативной активности (Gaull et al. 1972).
Эти комментарии, однако, должны быть умеренными с осторожностью, потому что кажется вероятным, что метаболизм некоторых условно незаменимых аминокислот сильно разделен на части и, следовательно, измерения изотопов в пуле плазмы могут дать количественное неверное представление о масштабе биосинтез.Это, по-видимому, относится к метаболизму пролина, аргинина и цистеина, поскольку оценки скорости их синтеза на основе параллельных измерений потребления и протеолиза организма не согласуются с оценками, основанными на включении изотопов из меченых предшественников (см. Beaumier et al. 1995 и Berthold et al. 1995 для аргинина; Jaksic et al. 1987 и Berthold et al. 1995 для пролина). Кроме того, есть данные, позволяющие предположить, что вновь синтезированные условно незаменимые аминокислоты могут использоваться в их исходных клетках и, следовательно, не уравновешиваются с пулом плазмы (Miller et al.1996). Тем не менее, даже с учетом этих неопределенностей, кажется, что синтез этих аминокислот может стать ограничивающим для роста и других физиологических функций, и что можно определить абсолютные, а не относительные диетические потребности.
Аминокислоты и физиологическая функция
Как я подчеркивал здесь ранее, первоначальные определения терминов «незаменимый» и «необязательный» были сосредоточены на росте или, вернее, на отложении белка.Когда определения применяются таким образом, возникает относительно небольшая путаница, по крайней мере, в отношении незаменимых аминокислот. Количественная оценка минимальных потребностей в незаменимых аминокислотах для поддержки роста относительно проста, потому что они являются просто продуктом скорости отложения белка и аминокислотного состава откладываемых белков. В этом отношении существует хороший консенсус в отношении того, что относительные потребности отдельных аминокислот для поддержки отложения белка очень похожи среди видов млекопитающих (Таблица 5).Другими словами, потребности в аминокислотах для поддержки отложения белка у младенца человека отличаются от потребностей других млекопитающих только в той степени, в которой их соответствующие скорости отложения белка различаются.
ТАБЛИЦА 5Состав незаменимых аминокислот смешанного белка тела незрелых млекопитающих
ТАБЛИЦА 5Состав незаменимых аминокислот смешанного белка тела незрелых млекопитающих
У людей обязательные потребности в аминокислотах для отложения чистого белка составляют очень незначительная часть общей потребности в аминокислотах (Dewey et al.1996), и> 90% от общей потребности в аминокислотах, даже для маленького ребенка, связано с поддержанием запасов белка в организме (то есть азотного равновесия). Сформулировать потребности в аминокислотах для «поддержания» сложно и до сих пор остаются предметом споров (см. Young and Borgonha 2000).
Не менее важной, чем технические и экспериментальные трудности, связанные с измерением потребности в поддерживающих аминокислотах (Fuller and Garlick, 1994), является проблема идентификации процессов, которые потребляют аминокислоты, близкие к азотному равновесию.Часть этих потребностей, конечно, напрямую связана с метаболизмом белков и отражает два связанных фактора: аминокислоты, высвобождаемые в результате разложения тканевых белков, вряд ли будут повторно использоваться с полной эффективностью, и что наличие конечных концентраций свободных аминокислот неизбежно приводит к некоторой степени катаболизма. Также появляется все больше доказательств того, что значительная часть потребностей в некоторых незаменимых аминокислотах может отражать <100% эффективную переработку кишечных секретов (Fuller et al.1994, Fuller and Reeds, 1998. Этот аспект потребности в основных или поддерживающих аминокислотах поддается прямому измерению, хотя некоторые технические аспекты этих измерений, особенно связанные с метаболической функцией кишечного белка, представляют трудности (см. Fuller and Reeds, 1998). . Однако по мере накопления большего количества информации становится все более очевидным, что аминокислоты участвуют (и, следовательно, потребляются) в ряде физиологических функций, которые напрямую не связаны с самим метаболизмом белков.
Прежде чем перейти к обсуждению этих путей, необходимо подчеркнуть два дополнительных момента. Во-первых, при потреблении белка, достаточном для поддержания белкового равновесия в организме, ограничивающим питательным веществом может быть сам метаболический азот, а не какая-либо отдельная аминокислота. Другими словами, из-за дефицита азота способность организма синтезировать аминокислоты может быть снижена до такой степени, что потребление заменимых аминокислот может стать ограниченным. Это может быть особенно применимо к условиям, связанным с потреблением небольших количеств так называемых белков высокого качества (т.(например, белки, которые хорошо сбалансированы по отложению белков и, следовательно, с высоким соотношением незаменимых аминокислот и незаменимых аминокислот). Во-вторых, теперь есть данные, показывающие, что взрослый человек способен снижать катаболизм любой отдельной аминокислоты, близкий к нулю, если эта аминокислота сильно ограничивает (Raguso et al. 1999). Однако скорость катаболизма аминокислоты, наблюдаемая в этом случае, намного ниже, чем скорость катаболизма, наблюдаемая, когда белок в целом является ограничивающим диетическим питательным веществом.Одно из объяснений этого наблюдения состоит в том, что в условиях безбелкового питания пул свободных аминокислот происходит исключительно за счет протеолиза тканей, так что все аминокислоты одинаково ограничивают. Следствием этого является то, что использование любой отдельной аминокислоты для поддержки небелкового процесса автоматически ограничивает способность организма рециркулировать все остальные аминокислоты обратно в белковые запасы организма. Возникают вопросы: каковы эти небелковые пути потребления и каково их количественное влияние на потребность в аминокислотах в целом? Краткий ответ на оба вопроса прост: на текущий момент недостаточно информации, чтобы дать точные ответы.Тем не менее, можно предположить, какие пути могут быть наиболее важными на уровне общей физиологической функции.
Для развития этих гипотез полезно рассмотреть те функции, которые необходимы для поддержания здоровья. Это не новый подход, поскольку его полезность была явно оценена некоторыми основоположниками науки о питании. Например, Войт (1902), цитируемый Луском (1922), написал следующее:
«Поэтому я придерживаюсь своей« старой »точки зрения, точки зрения чистого метаболизма … тем более объединяющее развитие станет возможным по мере изучения того, что вещества разрушаются при различных обстоятельствах … и сколько различных материалов необходимо подавать, чтобы поддерживал тело в форме.”
На мой взгляд, для« поддержания в рабочем состоянии »критически важны четыре системы: кишечник для поддержания абсорбционной и защитной функций; иммунная система и другие аспекты защиты; скелетная мускулатура; и центральная нервная система. Внутри каждой системы можно определить критические метаболические роли некоторых конкретных аминокислот (таблица 6).
ТАБЛИЦА 6Участие аминокислот в физиологической и метаболической функции
Система . Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Glu, Asp, глутамин Пролиферация Нуклеиновые кислоты Глютамин Глютамин Глютамин Глютамин Глютамин Глютамин Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro Energyэнергия креатина энергия креатина энергия креатина Gly, Arg, Met Пероксидантная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic Adrenergic Adrenergic Adrenergic Serot Попробуйте 9 0204 Глютаминергический Glu Глицинергический Гли Аргидроксид Аргидроксид Нитативная защита ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита Глутатион Glyov201Глутатион Глутатион Регулировка артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly Система .
ТАБЛИЦА 6Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Glu, Asp, глутамин Пролиферация Нуклеиновые кислоты Глютамин Глютамин Глютамин Глютамин Глютамин Глютамин Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro Energyэнергия креатина энергия креатина энергия креатина Gly, Arg, Met Пероксидантная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic Adrenergic Adrenergic Adrenergic Serot Попробуйте 9 0204 Глютаминергический Глу Глицинергический Гли Аргидроксид Аргидроксид Аргидроксид ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита 01Глютатион Glyov201Глутатион Glyov201Глутатион ГлутатионРегуляция артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly аминокислот метаболизм Функция микросхемы
Система . Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Glu, Asp, глутамин Пролиферация Нуклеиновые кислоты Глютамин Глютамин Глютамин Глютамин Глютамин Глютамин Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro Energyэнергия креатина энергия креатина энергия креатина Gly, Arg, Met Пероксидантная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic Adrenergic Adrenergic Adrenergic Serot Попробуйте 9 0204 Глютаминергический Glu Глицинергический Гли Аргидроксид Аргидроксид Нитативная защита ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита Глутатион Glyov201Глутатион Глутатион Регулировка артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly Система .
Функция . Товар . Прекурсор . Кишечник Выработка энергии АТФ Glu, Asp, глутамин Пролиферация Нуклеиновые кислоты Глютамин Глютамин Глютамин Глютамин Глютамин Глютамин Cys, Glu, Gly Оксид азота Arg Mucins Thr, Cys, Ser, Pro Energyэнергия креатина энергия креатина энергия креатина Gly, Arg, Met Пероксидантная защита Таурин (?) Cys Нервная система Синтез передатчика Adrenergic Adrenergic Adrenergic Adrenergic Serot Попробуйте 9 0204 Глютаминергический Глу Глицинергический Гли Аргидроксид Аргидроксид Аргидроксид ) Cys Иммунная система Пролиферация лимфоцитов (?) Глутамин, Arg, Asp Пероксидантная защита 01Глютатион Glyov201Глутатион Glyov201Глутатион ГлутатионРегулирование артериального давления Оксид азота Arg Пероксидантная защита (?) Глутатион красных клеток Cys, Glu, Gly Пожалуй, самое интересное соображение Т 6 состоит в том, что, за исключением участия фенилаланина и триптофана в поддержании адренергической и серотонинергической систем нейротрансмиттеров, а также метионина в качестве донора метильной группы для синтеза креатина, необходимые предшественники являются несущественными или условно незаменимыми аминокислотами.Таким образом, возникает соблазн утверждать, что способность поддерживать синтез этих аминокислот имеет достаточно высокий функциональный приоритет, что в условиях, в которых белок (азот) ограничен, незаменимые аминокислоты используются для поддержания этих путей. В таблице 7 я попытался сравнить оценки оборота или потерь некоторых критических конечных продуктов с кинетикой их аминокислот-предшественников. Это сравнение предполагает, что некоторые пути, например, производство таурина и оксида азота, имеют небольшое количественное влияние на питание прекурсоров, тогда как другие имеют гораздо большее значение.Таким образом, синтез креатина (оцениваемый по экскреции креатинина) и обмен глутатиона (оцениваемый по измерениям в плазме и эритроцитах) имеют существенное влияние на утилизацию некоторых предшественников, особенно если скорость синтеза продукта сравнивается с потребление или чистый синтез предшественника. Продолжающийся синтез этих двух конечных продуктов, один из которых участвует в трансдукции энергии как в мускулатуре, так и в центральной нервной системе, а другой является критическим фактором в механизмах детоксикации, по-видимому, оказывает существенное потенциальное влияние на состояние питания человека.Действительно, данные, полученные у свиней с обедненным белком (Jahoor et al. 1995) и у бессимптомных ВИЧ-инфицированных пациентов (Jahoor et al. 1999), демонстрируют, что поступление белка и цистеина может заметно изменить способность организма поддерживать синтез глутатиона. .
ТАБЛИЦА 7Потенциальный вклад синтеза функционально важных конечных продуктов в потребности в аминокислотах у взрослых людей
. глутамат . Глицин . Цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9019 9019 9019 9019 9 3 1800 4 528 3 «Чистый» синтез 358 5 2730 5 96 96 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9020 1 Оксид азота 11 15 Глутатион 12 550 550 550 550 . глутамат . Глицин . Цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9019 9019 9019 9019 9 3 1800 4 528 3 «Чистый» синтез 358 5 2730 5 96 96 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9020 1 Оксид азота 11 15 Глутатион 12 550 550 550 Возможный вклад синтеза функционально важных конечных продуктов в потребности в аминокислотах у взрослых людей . глутамат . Глицин . Цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9019 9019 9019 9019 9 3 1800 4 528 3 «Чистый» синтез 358 5 2730 5 96 96 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9020 1 Оксид азота 11 15 Глутатион 12 550 550 550 550 . глутамат . Глицин . Цистеин . аргинин . метионин . Кинетика прекурсора [мкмоль / (кг · сут)] Плазменный поток 9019 9019 9019 9019 9 3 1800 4 528 3 «Чистый» синтез 358 5 2730 5 96 96 96 8 Производство конечного продукта [мкмоль / (кг · г)] Креатин 9 170 Таурин 10 7 9020 1 Оксид азота 11 15 Глутатион 12 550 950
обязательно Вкратце, я попытался изучить термины «незаменимый» и «необязательный» применительно к аминокислотам с трех точек зрения.Традиционный взгляд на питание, который сосредоточен именно на росте, четко отличает аминокислоты, которые должны поступать с пищей, от аминокислот, которые не обязательно должны поступать из этого источника. Метаболическая точка зрения приводит к несколько более сложной интерпретации; это показывает, что могут быть значительные ограничения на синтез некоторых аминокислот, что делает их потенциальными ограничениями для роста. Наконец, функциональная точка зрения не только указывает на важность всех аминокислот для определенных физиологических функций, но также приводит к выводу, что в условиях, когда белок является основным ограничением питания, способность поддерживать синтез некоторых традиционно заменимых аминокислот. может иметь решающее значение для постоянного здоровья и функциональной целостности человека.Очевидно, что сейчас все готово для дальнейшего, более детального количественного исследования этих важных вопросов. Я с нетерпением жду расширения наших знаний о функциях аминокислот, которое выходит за рамки традиционного внимания к белку. ЦИТАТУРА
Бертольд
,Х. К.
,Ридс
,П. Дж.
иКляйн
,П. Д.
(1995
)Изотопные доказательства дифференциальной регуляции синтеза аргинина и пролина у человека
.Метаболизм
44
:466
—473
.Beaumier
,L.
,Castillo
,L.
,Ajami
,AM
иYoung
,VR
(1995
)Промежуточная кинетика цикла нитрата и нормальная кинетика цикла мочевины и «терапевтическое» потребление аргинина людьми
.г. J. Physiol.
269
:E884
—E896
.Borman
,A.
,Wood
,TR
,Balck
,HC
,Anderson
,EG
,Oesterling
,MJ
,, Womack
,, Womack
,&
Rose
,WC
(1946
)Роль аргинина в росте с некоторыми наблюдениями за эффектами аргининовой кислоты
.J. Biol. Chem.
166
:585
—594
.Brunton
,JA
,Bertolo
,RF
,Pencharz
,PB
иBall
,RO
(1999
)Пролин не улучшает энтеральное кормление, но не улучшает энтеральное кормление новорожденные поросята
.г. J. Physiol.
277
:E223
—E231
.Кастильо
,Л.
,Бомье
,Л.
,Ajami
,AM
иYoung
,VR
(1996
)Синтез оксида азота в организме здоровых мужчин, определенный из [ 15 N] аргинина до — [ 15 N] цитруллин маркировка
.Proc. Natl. Акад. Sci. США
93
:11460
—11465
.Castillo
,L.
,Chapman
,T. E.
,Sanchez
,M.
,Yu
,YM
,Burke
,JF
,Ajami
,AM
,Vogt
,J.
иYoung
,VR
(as) кинетика аргинина и цитруллина у взрослых, получающих адекватную диету без аргинина.Proc. Natl. Акад. Sci. США
90
:7749
—7753
.Дэвис
,Т. А.
,Фиоротто
,М.L.
иReeds
,P. J.
(1993
)Аминокислотный состав тела и молочного белка изменяется в течение периода сосания у крыс
.J. Nutr.
123
:947
—956
.Dewey
,KG
,Beaton
,G.
,Fjeld
,C.
,Lonnerdal
,B.
иReeds
,P.
(1996)Потребность младенцев и детей в белке
.евро. J. Clin. Nutr.
50
(доп.1
):S119
—S147
.Fukagawa
,N. K.
,Ajami
,A. M.
иYoung
,V. R.
(1996
)Кинетика метионина и цистеина в плазме у взрослых людей в ответ на внутривенное введение глютатиона
.г. J. Physiol.
270
:E209
—E214
.Фуллер
,М.F.
иGarlick
,P. J.
(1994
)Потребности человека в аминокислотах: можно ли разрешить спор?
.Annu. Ред. Nutr
14
:217
—241
.Fuller
,MF
,Milne
,A.
,Harris
,CI
,Reid
,TM
иKeenan
,R.
( 1994) Потери кислоты в илеостомической жидкости при безбелковой диете.г. J. Clin. Nutr.
59
:70
—73
.Fuller
,M. F.
иReeds
,P. J.
(1998
)Эндогенный азот в кишечнике
.Annu. Rev. Nutr.
18
:385
—411
.Gaull
,G.
,Sturman
,J. A.
иRaiha
,N. C.
(1972
)Развитие серного обмена у млекопитающих: отсутствие цистатионазы в тканях плода человека
.Pediatr. Res.
6
:538
—547
.Hepburn
,F. N.
&Bradley
,W. B.
(1964
)Потребность в глутаминовой кислоте и аргинине для высоких темпов роста крыс, получавших аминокислотный рацион
.J. Nutr.
84
:305
—312
.Хорват
,К.
,Джами
,М.
,Хилл
,I.D.
,Papadimitriou
,JC
,Magder
,LS
иChanasongcram
,S.
(1996
)Изокалорийная безглютаминовая диета и морфология
тонкой кишки и ее морфология. .J. Парентеральное энтеральное питание.
20
:128
—134
.Джексон
,А. А.
,Шоу
,Дж. К.
,Барбер
,А.
иGolden
,M. H.
(1981
)Метаболизм азота у недоношенных детей, вскармливаемых человеческим донорским грудным молоком: возможная значимость глицина
.Pediatr. Res.
15
:1454
—1461
.Jahoor
,F.
,Jackson
,A.
,Gazzard
,B.
,Philips
,G.
,Sharpstone
,D. Frazer
,М.E.
иHeird
,W.
(1999
)Дефицит глутатиона эритроцитов при бессимптомной ВИЧ-инфекции связан со снижением скорости синтеза
.г. J. Physiol.
276
:E205
—E211
.Jahoor
,F.
,Wykes
,L. J.
,Reeds
,P. J.
,Henry
,J. F.
,del Rosario
,M.P.
иFrazer
,M. E.
(1995
)Свиньи с дефицитом белка не могут поддерживать пониженный гомеостаз глутатиона при воздействии стресса воспаления
.J. Nutr.
125
:1462
—1472
.Jaksic
,T.
,Wagner
,DA
,Burke
,JF
иYoung
,VR
(1987
)Плазменная регуляция кинетики пролина и синтеза человек
.Обмен веществ
36
:1040
—1046
.Jaksic
,T.
,Wagner
,DA
,Burke
,JF
иYoung
,VR
(1991
)Пациенты с ожогами метаболизма пролина и здоровые контрольные мужчины предметы
.г. J. Clin. Нутрь
54
:408
—413
.Луск
,г.
(1922
)Метаболизм пролина у взрослых мужчин с ожогами и здоровых контрольных субъектов
.The Science of Nutrition
Johnson Reprint Corporation
New York
, 1976.Mahan
,DC
иShields
,RG
, Jr (1998
)Состав незаменимых и несущественных аминокислот свиней от рождения до 145 кг массы тела, и сравнение с другими исследованиями
.J. Anim. Sci.
76
:513
—521
.Мэтьюз
,Д. Э.
иКэмпбелл
,Р. Г.
(1992
)Влияние потребления белка с пищей на глутамин и азотный обмен глутамина у людей
.г. J. Clin. Nutr.
55
:963
—970
.Meier
,P.
,Teng
,C.
,Battaglia
,F.C.
иМеския
,G.
(1981
)Скорость накопления аминокислотного азота и общего азота в плоде ягненка
.Proc. Soc. Exp. Биол. Med.
167
:463
—468
.Миллер
,RG
,Кешен
,TH
,Jahoor
,F.
,Shew
,SB
иJaksic
,T.
(
,, т.
) эндогенно синтезируемых аминокислот у новорожденных
.J. Surg. Res.
63
:199
—203
.Murphy
,J. M.
,Murch
,S. J.
&Ball
,R.O.
(1996
)Пролин синтезируется из глутамата во время внутрижелудочной инфузии свиней, но не во время внутривенной инфузии.
J. Nutr.
126
:878
—886
.Нейсмит
,Д.J.
,Rana
,S. K.
&Emery
,P. W.
(1987
)Метаболизм таурина во время репродукции у женщин
.Hum. Nutr. Clin. Nutr.
41
:37
—45
.Pellet
,P. L.
иKaba
,H.
(1972
)Аминокислоты туши крысы в условиях определения чистого использования белка
.J. Nutr.
102
:61
—68
.Raguso
,C. A.
,Pereira
,P.
иYoung
,VR
(1999
)Исследование с помощью трассирующих индикаторов обязательных окислительных потерь аминокислот у здоровых молодых людей
.г. J. Clin. Nutr.
70
:474
—483
.Трости
,P. J.
,Burrin
,D.G.
,Jahoor
,F.
,Wykes
,L.
,Henry
,J.
иFrazer
,ME
(1996
)Энтеральный глутамат метаболизируется при первом прохождении через желудочно-кишечный тракт детенышей свиней
.г. J. Physiol.
270
:E413
—E418
.Камыши
,P. J.
,Burrin
,D. G.
,Stoll
,B.
,Jahoor
,F.
,Wykes
,L.
,Henry
,J.
иFrazer
,ME
(1997
)Энтеральный источник глутамата является предпочтительным для синтез глутатиона слизистой у откормленных поросят
.г. J. Physiol.
273
:E408
—E415
.Stoll
,B.
,Burrin
,D. G.
,Henry
,J.
,Yu
,H.
,Jahoor
,F.
иReeds
,P. J.
(1999
)Окисление субстрата через портальные дренированные внутренности откормленных поросят
.г. J. Physiol.
277
:E168
—E175
.Stoll
,B.
,Henry
,J.
,Reeds
,P. J.
,Yu
,H.
,Jahoor
,F.
иBurrin
,D. G.
(1998
)Катаболизм доминирует в кишечном метаболизме первого прохождения незаменимых аминокислот у поросят, получавших молочный белок
.J. Nutr.
128
:606
—614
.Wakabayashi
,Y.
,Yamada
,E.
,Yoshida
,T.
иTakahashi
,H.
(1995
)аргинин становится незаменимой аминокислотой массивная резекция тонкой кишки крысы
.J. Biol. Chem.
269
:32667
—32671
.Widdowson
,E. M.
,Southgate
,D.A.T.
иHey
,E. N.
(1979
)Состав тела плода и младенца
.Visser
,H.K.A.
ред.Питание плода и младенца
:169
—177
Martinus Njihoff Publishers London
,England
.Williams
,A. P.
(1978
)Аминокислотный, коллагеновый и минеральный состав недожвачных телят
.J. Agri. Sci. (Камб.).
90
:617
—624
.Womack
,M.
иRose
,W. C.
(1947
)Роль пролина, гидроксипролина и глутаминовой кислоты в росте
.J. Biol. Chem.
171
:37
—50
.Wu
,G.
,Davis
,PK
,Flynn
,NE
,Knabe
,DA
иDavidson
,JT
( 9000) синтез аргинина играет важную роль в поддержании гомеостаза аргинина у растущих свиней после отъема.J. Nutr.
127
:2342
—2349
.Ву
,г.
,Отт
,Т.L.
,Knabe
,D. A.
&Bazer
,F. W.
(1999
)Аминокислотный состав плода свиньи
.J. Nutr.
129
:1031
—1038
.Янг
,V.
иR & Borgonha
,S.
(2000
)Требования к азоту и аминокислотам: модель потребностей в аминокислотах Массачусетского технологического института
.J. Nutr.
130
:1841S
—1849
S.Yu
,YM
,Yang
,RD
,Matthews
,DE
,Wen
,Wen
,,
JF
,Bier
,DM
иYoung
,VR
(1985
)Количественные аспекты азотистого обмена глицина и аланина у молодых мужчин после абсорбции: влияние уровня азота и потребления незаменимых аминокислот
.J. Nutr.
115
:399
—410
.© 2000 Американское общество диетологии
белков
белковБелки — один из основных компонентов живого вещества. Они состоят из длинные цепи аминокислот, которые связаны пептидными связями и таким образом называемые полипептиды. Аминокислот около 20, и больше всего атомов. среди них преобладают углерод, водород, кислород, азот и сера.Каждый аминокислота содержит конец карбоновой кислоты и конец амино. При pH 6-7 ( pH тела 7,3) амино-конец протонирован, а карбоксильный конец остается анион; это называется цвиттерионом. Некоторые аминокислоты не могут быть синтезированы телом и должны быть получены с пищей; это аргинин, гистидин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Простейшая аминокислота, глицин, показана ниже.
Пептидная связь возникает, когда конец карбоновой кислоты одной аминокислоты связывается с амино-конец другого.В результате получается огромная цепочка, молекулярная масса которой колеблется от 5000 до 1000000. Карбонильная группа, азот и водород вокруг пептидной связи, а также два атома углерода, к которым и карбонильные группы связаны, лежат в плоскости. Отрицательный заряд электронов делокализован вокруг всей пептидной связи, явление, называемое резонансом, и как карбонильная, так и углерод-азотная связи обладают характером двойной связи. Поскольку связь углерод-азот частично является двойной связью, не может быть свободное вращение вокруг него.
Порядок линейных связей между аминокислотами в белке называется его первичная структура. Однако сама молекула изгибается и принимает определенное строение, называемое его вторичной структурой. Такая общая конформация альфа-спираль, предложенная в 1951 году Линусом Полингом и Р. Кори, как показано здесь. Эта цепочка образует правая катушка, имеющая 3,7 аминокислот на полную повернуть. Водородная связь существует между водородом, связанным с азотом, и карбонильная группа аминокислоты на четыре звена вниз по цепи, обеспечивая жесткость и устойчивость конструкции.Несколько альфа-спиралей могут наматываются друг на друга, образуя пряди, которые удерживаются вместе дисульфидные мостики, такие как в белки, называемые альфа-кератинами.Увеличенное изображение этого белка.
Белки также могут существовать в виде складчатых листов или бета-кератинов. В них водород связь существует между соседними цепями, поскольку они лежат бок о бок. Другая конформация коллаген или волокнистый белок; это тройная спираль полипептидов, каждая из которых представляет собой левую спираль.Иллюстрация субъединицы белка с пятью дисульфидными связями: показано выше. Увеличенное изображение этого белка.
Когда несколько полипептидных единиц связаны друг с другом и с другим более простые молекулы, такие как сахара, неорганические остатки или коферменты, белок говорят, что он имеет четвертичную структуру. Функция белка зависит от как порядка аминокислот, так и «топографии» его поверхности; каждый фактор одинаково важен. Эта взаимозависимость основных единиц с общая форма иллюстрирует тему архитектоники нашего семинара, которая важность частей и целого как единой функции.Выше проиллюстрирована структура белка инсулина свиньи. Увеличенное изображение этого белка.
Эллисон Смит ’99.
Вернуться в архитектонику25 мая 1996 г.
Аминокислота — Энциклопедия Нового Света
Общее строение молекулы аминокислоты. Аминогруппа находится слева, а группа карбоновой кислоты — справа. Группа R уникальна для каждой аминокислоты.Аминокислота представляет собой органическую молекулу с тремя основными компонентами: аминогруппой (-Nh3), группой карбоновой кислоты (-COOH) и группой R или боковой цепью, уникальной для каждой аминокислоты.
Аминокислоты являются основными структурными строительными блоками белков. Точно так же, как буквы алфавита можно комбинировать по-разному, чтобы образовать бесконечное множество слов, ограниченное количество аминокислот может быть связано вместе в различных последовательностях, чтобы сформировать обширный массив белков. Уникальная трехмерная форма каждого белка, которая является результатом линейной последовательности аминокислот, определяет конкретную функцию белка в организме.
Растения синтезируют необходимые им аминокислоты, используя углерод и кислород из воздуха, водород из воды и азот, который был преобразован в пригодную для использования форму посредством фиксации азота.Животные могут синтезировать определенные аминокислоты. Те важные аминокислоты, которые не могут быть синтезированы животным или со скоростью, достаточной для удовлетворения его физиологических потребностей, и которые, следовательно, должны быть получены с пищей, называются незаменимыми аминокислотами . Незаменимые аминокислоты различаются в зависимости от типа животного. Хотя всем позвоночным необходимы определенные аминокислоты, которые их клетки не могут синтезировать, жвачные животные (например, крупный рогатый скот) несут в одном из желудков микробы, которые синтезируют аминокислоты, необходимые животным.Аминокислоты отражают взаимосвязь жизни, поскольку нежвачные животные зависят от растений для получения незаменимых аминокислот, жвачные животные зависят от микробов, находящихся внутри, в качестве источника, и даже растения зависят от бактерий, которые фиксируют азот в форме, которую они могут использовать для производства аминокислоты.
Хотя в природе существует более 100 аминокислот, человеческому организму для нормального функционирования требуется 20 аминокислот, называемых стандартными аминокислотами . Примерно половина этих стандартных аминокислот считаются незаменимыми аминокислотами, которые невозможно синтезировать и которые должны быть получены с пищей.
Источники аминокислот
Стандартные аминокислоты
У человека 20 аминокислот известны как стандартных аминокислот или протеиногенных аминокислот. Как следует из названия «протеиногенный» (буквально , здание белка ), эти аминокислоты кодируются стандартным генетическим кодом и участвуют в процессе синтеза белка. Они образуются из матрицы мРНК в процессе, называемом трансляцией, посредством которого генетическая информация, закодированная в форме нуклеиновых кислот, транслируется в аминокислоты, необходимые для синтеза белка.Комбинации этих аминокислот производят каждый отдельный белок, необходимый для гомеостаза (то есть поддержания стабильной внутренней среды) человеческого тела.
Химическая структура 20 стандартных аминокислот.
Из этих 20, 19 встречаются в природе как оптически активные левосторонние молекулы из-за асимметричного центрального атома углерода, а одна (глицин) оптически нейтральна. Стандартные аминокислоты, таким образом, демонстрируют образец 1 + 19. Этот образец 1 + 19 также встречается в ядерной химии, описывая двадцать элементов, которые встречаются как «чистые изотопы»; один элемент (бериллий) имеет четный атомный номер 4, а остальные девятнадцать элементов (F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi) имеют нечетные атомные номера.Такой же паттерн 1 + 19 встречается среди двадцати элементов, которые встречаются в виде двух стабильных изотопов. Соответствие узоров на разных уровнях природы — одна из неразгаданных загадок науки. [1]
Незаменимые аминокислоты
Примерно половина из 20 стандартных аминокислот называется незаменимыми аминокислотами, потому что они не могут быть синтезированы человеческим организмом из других соединений посредством химических реакций; вместо этого их нужно принимать с пищей. У человека незаменимыми аминокислотами являются лизин , изолейцин , фенилаланин , лейцин , метионин , триптофан , треонин и валин . Аргинин и гистидин также могут быть классифицированы как незаменимые аминокислоты, хотя обычно они считаются незаменимыми только для детей, чей неразвитый метаболизм не может их синтезировать. Таким образом, количество незаменимых аминокислот в организме человека по-разному перечисляется как 8 или 10.
Остальные стандартные аминокислоты несущественны; хотя они могут быть получены из пищи, организм также может синтезировать их по мере необходимости.
Нестандартные аминокислоты
Помимо 20 стандартных аминокислот и двух специальных аминокислот, селеноцистеина и пирролизина, которые кодируются ДНК нетипичным образом, существует большое количество нестандартных или непротеиногенных аминокислот .Последние либо не встречаются в белках (таких как аминокислоты карнитин, ГАМК или L-ДОПА), либо они не кодируются стандартным генетическим кодом (например, гидроксипролин и селенометионин), но могут быть результатом модификации стандартных аминокислоты после того, как белок был сформирован на стадии трансляции синтеза белка.
Некоторые из этих нестандартных аминокислот были обнаружены в метеоритах, особенно в углеродистых хондритах, состав которых считается типичным для солнечной туманности или газового облака, из которого образовалась солнечная система.Например, более 79 аминокислот были обнаружены в примитивном метеорите Мерчисон, разновидности углеродистого хондрита. Микроорганизмы и растения также могут продуцировать необычные аминокислоты, которые можно найти в пептидных антибиотиках, таких как низин, который используется в качестве пищевого консерванта.
Структура аминокислот
В биохимии термин «аминокислота» часто используется для обозначения альфа-аминокислот : тех аминокислот, в которых амино- и карбоксилатные группы присоединены к одному и тому же атому углерода, т.е. называемый α – углеродом (альфа-углерод).Общая структура этих протеиногенных альфа-аминокислот:
R | H 2 N-C-COOH | ЧАС, где R представляет собой боковую цепь , специфичную для каждой аминокислоты. Исключением из этой базовой структуры является пролин, боковая цепь которого циклизуется на основной цепи, образуя кольцевую структуру, в которой вторичная аминогруппа заменяет первичную аминогруппу.
Когда аминокислоты соединяются вместе с образованием белков, основная аминогруппа и кислая карбоксильная группа нейтрализуются.Вместо этого боковые цепи аминокислот определяют кислотно-основные свойства белков. Таким образом, аминокислоты обычно классифицируются по двум основным химическим свойствам боковой цепи: заряд группы R (который определяет, действует ли белок как слабая кислота или слабое основание) и его полярность (или склонность к взаимодействию с водой. при нейтральном pH).
Эти свойства влияют на взаимодействие аминокислот с другими структурами внутри белка, а также на их взаимодействие с другими белками.Например, растворимые белки имеют поверхность, богатую полярными аминокислотами, такими как серин и треонин. Напротив, интегральные мембранные белки имеют тенденцию иметь внешнее кольцо из гидрофобных аминокислот (которые, как правило, не взаимодействуют с водой), которые прикрепляют их к липидному бислою. Точно так же белки, которые должны связываться с положительно заряженными молекулами, имеют поверхности, богатые отрицательно заряженными аминокислотами, такими как глутамат и аспартат, в то время как белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхности, богатые положительно заряженными цепями, такими как лизин и аргинин.
Изомеры
Большинство аминокислот встречается в виде двух возможных оптических изомеров, называемых D и L. L-аминокислоты представляют собой подавляющее большинство аминокислот, содержащихся в белках. D-аминокислоты содержатся в некоторых белках, вырабатываемых экзотическими морскими организмами, такими как шишки. Они также являются многочисленными компонентами протеогликанов клеточных стенок бактерий.
Функции аминокислот в синтезе белка
Краткое описание образования пептидной связи. Нажмите на изображение, чтобы увидеть реакцию.Две аминокислоты связаны между собой пептидной связью, которая образуется, когда основная аминогруппа одной аминокислоты реагирует с кислой карбоксильной группой второй аминокислоты. Эта реакция конденсации (потеря воды) дает пептидную связь и молекулу воды. Аминокислотный остаток — это то, что остается от аминокислоты после того, как молекула воды (H + со стороны аминогруппы и OH — со стороны карбоксильной группы) была потеряна при образовании пептида. связь.
Белки затем создаются путем полимеризации аминокислот, процесса, в котором аминокислоты соединяются в цепи, называемые, в зависимости от их длины, пептидами или полипептидами.
Другие биологические роли аминокислот
Помимо своей функции в образовании белков, аминокислоты играют и другие биологически важные роли. Стандартные аминокислоты глицин и глутамат, которые содержатся в белках, также действуют как нейротрансмиттеры, которые соответственно подавляют и усиливают сигналы в нервной системе.Нестандартная аминокислота карнитин используется для транспорта липидов внутри клетки.
Многие аминокислоты используются для синтеза других молекул, помимо белков:
- Триптофан является предшественником серотонина, нейромедиатора, важного для регуляции настроения.
- Глицин является одним из реагентов при синтезе порфиринов, таких как гем, который является компонентом молекул гемоглобина, обнаруженных в красных кровяных тельцах.
- Аргинин используется для синтеза гормона оксида азота.
Вещества, полученные из аминокислот, находят важное применение в медицине и пищевой промышленности; например:
- Аспартам (аспартилфенилаланин-1-метиловый эфир) — это искусственный подсластитель, а глутамат натрия — пищевая добавка, усиливающая вкус.
- 5-HTP (5-гидрокситриптофан) использовался для лечения неврологических проблем, связанных с PKU (фенилкетонурия), а также депрессии (как альтернатива L-триптофану).
- L-ДОФА (L-дигидроксифенилаланин) — это лекарство, используемое для лечения симптомов болезни Паркинсона.
Таблица химических свойств
Ниже приводится таблица, в которой перечислены символы и химические свойства стандартных аминокислот. Указанная масса представляет собой средневзвешенное значение всех распространенных изотопов и включает массу H 2 О. Однобуквенный символ для неопределенной аминокислоты — X . Трехбуквенный символ Asx или однобуквенный символ B означает, что аминокислота представляет собой аспарагин или аспарагиновую кислоту, тогда как Glx или Z означает глутаминовую кислоту или глутамин.Трехбуквенный символ Sec или однобуквенный символ U относится к селеноцистеину. Буквы J и O не используются.
Незаменимые аминокислоты отмечены звездочкой.
Сокр. Полное имя Тип боковой цепи Масса pI pK 1
(α-COOH)pK 2
(α- + NH 3 50 p 9035Kr) 9035Kr )Примечания A Ala Аланин гидрофобный 89.09 6,01 2,35 9,87 Очень много и универсально. Он ведет себя довольно нейтрально и может располагаться как в гидрофильных областях снаружи белка, так и в гидрофобных внутренних областях. C Cys Цистеин гидрофобный (Nagano, 1999) 121,16 5,05 1,92 10,70 8,18 атомы тяжелых металлов связываются с ионами тяжелых металлов.В окислительных условиях два цистеина могут быть соединены дисульфидной связью с образованием аминокислоты цистина. Когда цистины являются компонентами белка, они усиливают третичную структуру и делают белок более устойчивым к разворачиванию и денатурации; поэтому дисульфидные мостики распространены в белках, которые должны функционировать в суровых условиях, пищеварительных ферментах (например, пепсине и химотрипсине), структурных белках (например, кератине) и белках, слишком малых для того, чтобы сохранять свою форму самостоятельно (например,инсулин). D Asp Аспарагиновая кислота кислая 133,10 2,85 1,99 9,90 3,90 Действует аналогично глутаминовой кислоте. Несет гидрофильную кислотную группу с сильным отрицательным зарядом. Обычно располагается на внешней поверхности белка, что делает его водорастворимым. Связывается с положительно заряженными молекулами и ионами, часто используется в ферментах для фиксации иона металла. E Глю Глутаминовая кислота кислая 147.13 3,15 2,10 9,47 4,07 Действует аналогично аспарагиновой кислоте. Имеет более длинную и чуть более гибкую боковую цепь. * F Phe Фенилаланин гидрофобный 165,19 5,49 2,20 9,31 Фенилаланин жесткая, тирозонная группа, боковая группа триптофана, и большая группа триптофана содержат на боковой цепи арптофан. Это самые большие аминокислоты. Подобно изолейцину, лейцину и валину, они гидрофобны и имеют тенденцию ориентироваться внутрь свернутой белковой молекулы. G Gly Глицин гидрофобный 75,07 6,06 2,35 9,78 Из-за того, что два оптически неактивных атома водорода у α-углерода, глицин является. Это самая маленькая аминокислота, она легко вращается и добавляет гибкости белковой цепи. Он может поместиться в самые тесные пространства (например, в тройную спираль коллагена). * H His Гистидин основной 155.16 7,60 1,80 9,33 6,04 Даже в слабокислых условиях происходит протонирование азота, изменяющее свойства гистидина и полипептида в целом. Он используется многими белками в качестве регулирующего механизма, изменяя конформацию и поведение полипептида в кислых областях, таких как поздняя эндосома или лизосома, вызывая изменение конформации ферментов. * I Ile Изолейцин гидрофобный 131.17 6,05 2,32 9,76 Изолейцин, лейцин и валин имеют большие алифатические гидрофобные боковые цепи. Их молекулы жесткие, и их взаимные гидрофобные взаимодействия важны для правильного сворачивания белков, поскольку эти цепи имеют тенденцию располагаться внутри молекулы белка. * K Lys Лизин основной 146,19 9,60 2,16 9,06 10.54 Действует аналогично аргинину. Содержит длинную гибкую боковую цепь с положительно заряженным концом. Гибкость цепи делает лизин и аргинин подходящими для связывания с молекулами со многими отрицательными зарядами на их поверхности. (например, ДНК-связывающие белки имеют свои активные области, богатые аргинином и лизином.) Сильный заряд делает эти две аминокислоты склонными к расположению на внешних гидрофильных поверхностях белков. * L Лей Лейцин гидрофобный 131.17 6,01 2,33 9,74 Действует аналогично изолейцину и валину. См. Изолейцин. * M Met Метионин гидрофобный 149,21 5,74 2,13 9,28 Всегда первая аминокислота, которая включается в белок; иногда удаляется после перевода. Как и цистеин, он содержит серу, но с метильной группой вместо водорода.Эта метильная группа может быть активирована и используется во многих реакциях, в которых новый атом углерода присоединяется к другой молекуле. N Asn Аспарагин гидрофильный 132,12 5,41 2,14 8,72 Нейтрализованная версия аспарагиновой кислоты. P Pro Пролин гидрофобный 115,13 6,30 1,95 10.64 Содержит необычное кольцо для N-концевой аминогруппы, которое заставляет амидную последовательность CO-NH принимать фиксированную конформацию. Может нарушать структуры сворачивания белка, такие как α-спираль или β-лист, вызывая желаемый излом в белковой цепи. Часто встречается в коллагене, где он подвергается посттрансляционной модификации гидроксипролина. Необычный в других местах. Q Gln Глютамин гидрофильный 146,15 5,65 2.17 9,13 Нейтрализованная версия глутаминовой кислоты. Используется в белках и как хранилище аммиака. * R Arg Аргинин базовый 174,20 10,76 1,82 8,99 12,48 Функционально аналогичен лизину. S Ser Серин гидрофильный 105,09 5,68 2,19 9.21 Серин и треонин имеют короткую группу, оканчивающуюся гидроксильной группой. Его водород легко удалить, поэтому серин и треонин часто действуют как доноры водорода в ферментах. Оба они очень гидрофильны, поэтому внешние области растворимых белков, как правило, богаты ими. * T Thr Треонин гидрофильный 119,12 5,60 2,09 9,10 Действует аналогично серину. * V Val Валин гидрофобный 117,15 6,00 2,39 9,74 Действует аналогично изолейцину и лейцину. См. Изолейцин. * W Trp Триптофан гидрофобный 204,23 5,89 2,46 9,41 Действует аналогично фенилаланину (см. Фениланиналанин).Предшественник серотонина. Y Tyr Тирозин гидрофобный 181,19 5,64 2,20 9,21 10,46 Действует аналогично фенилалтопанину (см. Фенилалтопан) Предшественник меланина, адреналина и гормонов щитовидной железы. Примечания
- ↑ Peter Plichta Plichta. Тайная формула Бога: расшифровка загадки Вселенной и код простого числа .Shaftesbury: Element Books, 1997. ISBN 1862040141
Ссылки
- Дулиттл, Р. Ф. 1989. Избыточность в белковых последовательностях. В Прогнозы структуры белка и принципы конформации белка , изд. Г.Д. Фасман, 599-623. Нью-Йорк, штат Нью-Йорк: Plenum Press.
- Nelson, D. L., and M. M. Cox. 2000. Принципы биохимии Ленингера , 3-е издание. Нью-Йорк, штат Нью-Йорк: Издательство Worth.
- Наганоа Н., Мотонори О. и К.Нисикава. 1999. Сильная гидрофобная природа остатков цистеина в белках. FEBS Letters 458 (1): 69-71. О гидрофобной природе цистеина.
Источники
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.

