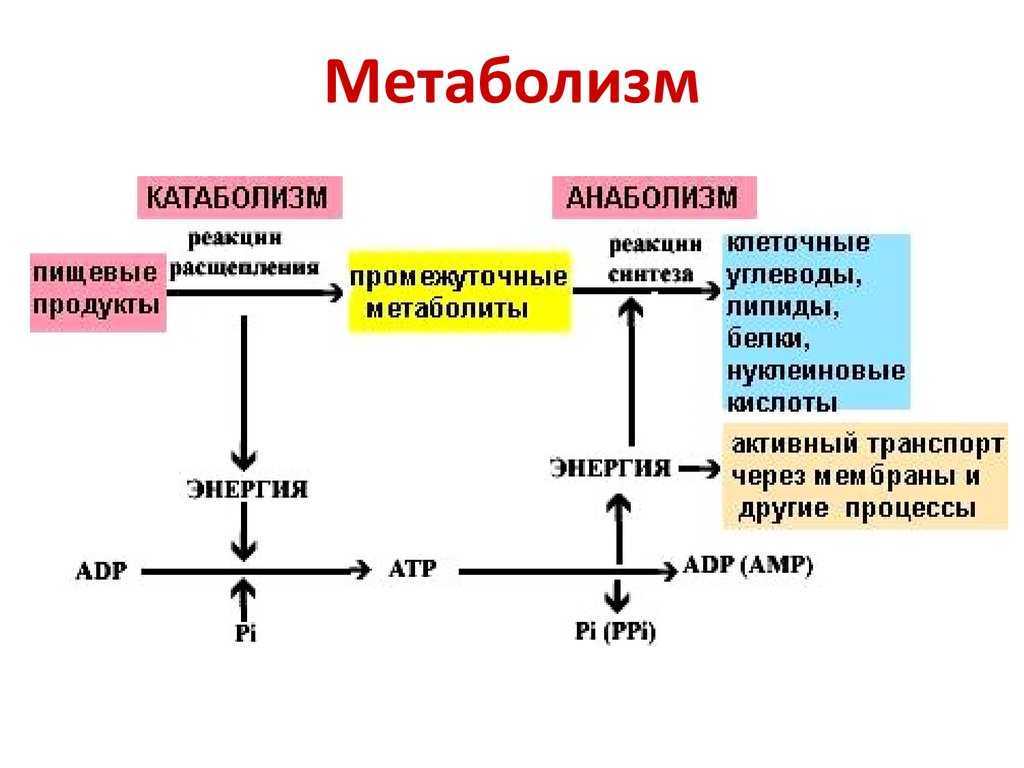
13. Отличия катаболизма от анаболизма:
Отличительный признак | Катаболизм | Анаболизм |
1. Энергия | Высвобождается (экзергонический процесс) | Затрачивается (эндергонический процесс) |
2. Характер процесса | Окислительный | Восстановительный |
3. Локализация в клетке (компартментация метаболических процессов) | Цитоплазма, митохондрии, лизосомы | Цитоплазма клетки, рибосомы, ЭПС, КГ, ядро |
4. Обратимость реакций | Практически необратимы | В основном обратимы |
Также
процессы катаболизма и анаболизма
различаются по
механизмам регуляции.
Уровни взаимосвязи между ката– и анаболизмом.
1. На уровне источников углерода (субстратов).
Продукты катаболизма – исходные субстраты для продуктов анаболизма. Важнейшие метаболиты, на уровне которых происходит пересечение метаболических путей: глюкозо-6-фосфат, пируват, ацетил-КоА.
2. На уровне восстановленных эквивалентов.
В процессе катаболизма происходит восстановление кофермента, который затем используется для анаболических процессов.
НАДФН – основной донор электронов в восстановительных реакциях биосинтеза. НАДН и ФАДН2 – основные акцепторы и переносчики электронов при окислении «топливных молекул».
3. На энергетическом уровне.
Катаболизм основных
пищевых веществ сопровождается
высвобождением энергии, которая может
аккумулироваться в форме АТФ. При
анаболических процессах происходит
потребление АТФ с образованием АДФ и
неорганического фосфата, используемых
в реакциях диссимиляции для нового
синтеза АТФ.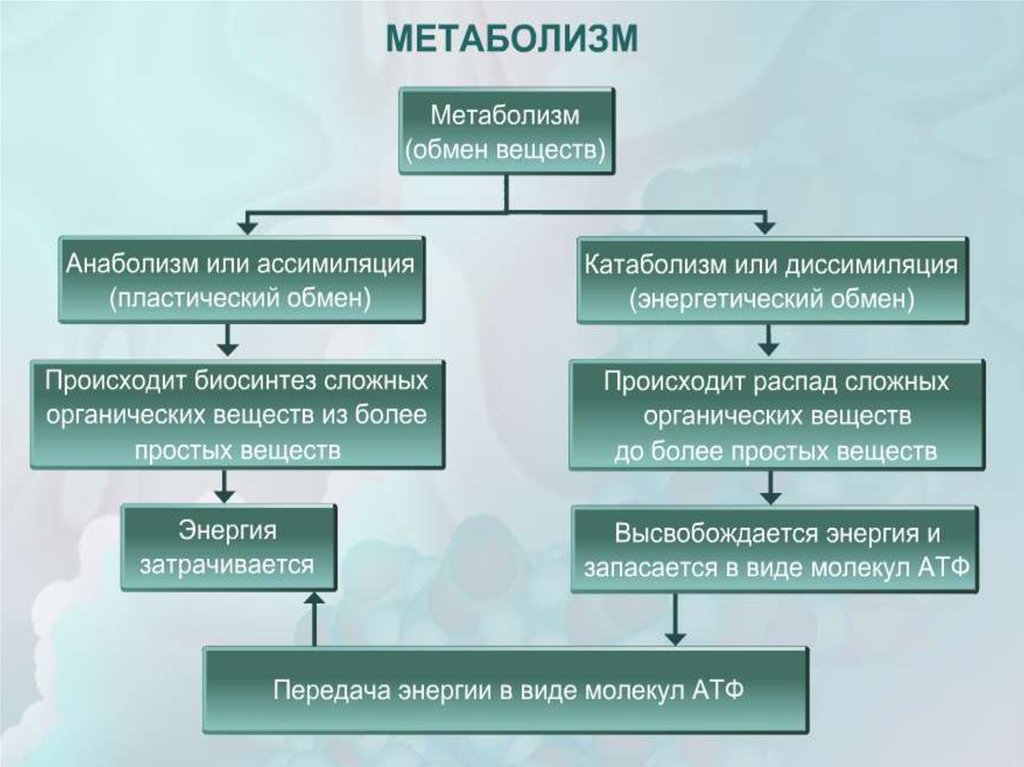
14. Макроэргические соединения (греч. makros большой + ergon работа, действие) – соединения, содержащие богатую энергией (макроэргическую) связь, при гидролизе которой изменения свободной энергии системы составляют более 5 ккал/моль.
Все известные М.с. содержат фосфорильную (—РО3Н2) или ацильную группы и могут быть описаны формулой Х—Y, где Х — атом азота, кислорода, серы или углерода, а Y — атом фосфора или углерода. Реакционная способность М.с. связана с повышенным сродством к электрону атома Y, что обусловливает высокую свободную энергию гидролиза макроэргической связи.
Примеры – фосфоенолпируват, 1,3-дифосфоглицерат, креатинфосфат, ацетил-КоА, АТФ, АДФ, пирофосфат.
15. Адениловая
система –
система адениловых нуклеотидов, которая
включает в себя АТФ, АДФ, АМФ, неорганический
фосфат и ионы Mg
Роль адениловой системы:
1) играет центральную роль в энергообмене всех клеток
2) благодаря
неустойчивости АТФ энергия ее концевой
фосфоангидридной связи АТФ может
использоваться на синтез фосфорилированных
метаболитов, имеющих свободную энергию
гидролиза меньше, чем АТФ. Обратное
превращение АДФ в АТФ требует энергии.
Обратное
превращение АДФ в АТФ требует энергии.
Основные процессы, использующие энергию гидролиза АТФ:
1. Синтез различных веществ.
2. Активный транспорт (транспорт веществ через мембрану против градиента их концентраций). 30% от общего количества расходуемого АТФ приходится на Na+,К+-АТФазу.
3. Механическое движение (мышечная работа).
16. Реакции и процессы, сопряженные с гидролизом атф, в клетках животных и растений:
1. Клетки скелетных мышц (главная функция – мышечное сокращение) широко используют катаболизм энергосубстратов ( анаэробный гликолиз у белых мышечных волокон и окислительное фосфорилирование в красных мышечных волокнах) и запасание выделяющейся энергии в форме АТФ – основного источника энергии для сокращения и расслабления.
2. Кардиомиоциты — постоянно сокращаются и расслабляются,
поэтому используют аэробный
катаболизм энергосубстратов и интенсивный синтез
АТФ, имеют высокую окислительную
способность.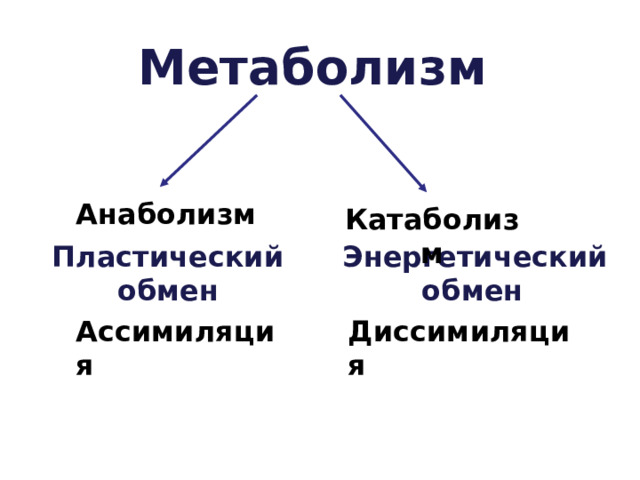
3. Гепатоциты– основные структуры обезвреживания веществ и биосинтеза, обеспечивают энергосубстратами мозг, мышцы и другие ткани. Содержат много митохондрий, активно идут процессы микросомного окисления, глюконеогенез, синтез мочевины и кетоновых тел.
4. Нейроны– основная работа – транспорт ионов для генерации ПД. Интенсивный дыхательный обмен, высокая
5. Адипоциты– основное место запасания, мобилизации и синтеза триацилглицеролов. Основной источник глицерол-3-фосфата в процессах синтеза – глюкоза. Пентозофосфатный путь.
6. Клетки
почек–
выполняют осмотическую работу, активный
мембранный транспорт в ходе образования
мочи, поддержание кислотно-щелочного
баланса. В качестве энергосубстратов
используют жирные кислоты, лактат,
кетоновые тела. Идет интенсивное образование
ионов аммония и глюконеогенез.
Идет интенсивное образование
ионов аммония и глюконеогенез.
7. Эритроциты– транспорт О2 и СО2. Не имеют митохондрий, получают энергию путем анаэробного гликолиза. Синтезируют 2,3-дифосфоглицерат, способствующий высвобождению О2 из гемоглобина в тканях.
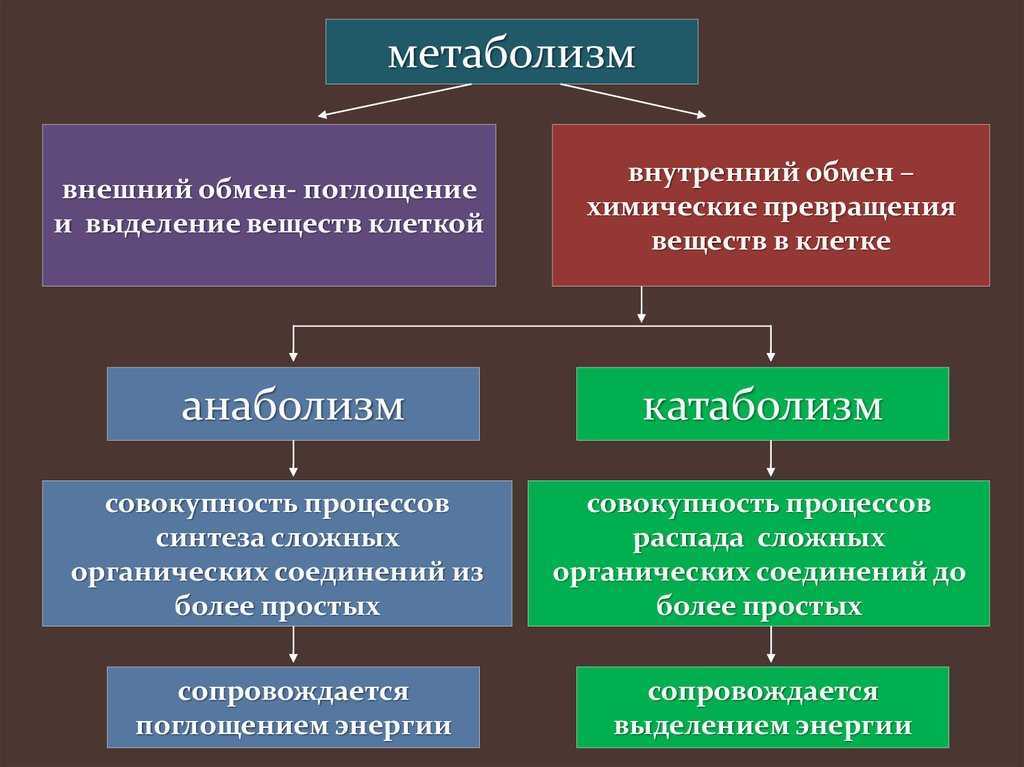
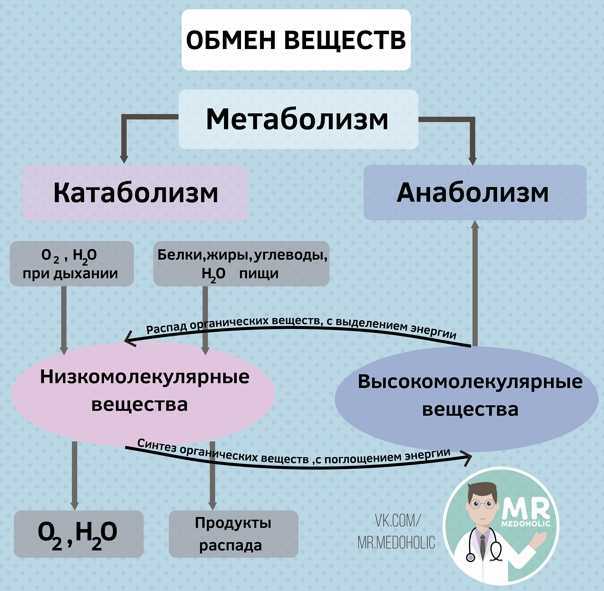
АНАБОЛИЗМ+КАТАБОЛИЗМ=МЕТАБОЛИЗМ Многие наверняка слышали такие понятия как анаболизм, катаболизм …
АНАБОЛИЗМ+КАТАБОЛИЗМ=МЕТАБОЛИЗМ
Многие наверняка слышали такие понятия как анаболизм, катаболизм и метаболизм. Но не каждый может правильно объяснить, что означают эти биологические термины. Тем не менее, слова употребляются не только в разговорах о медицине, но и когда речь идет о занятиях спортом. Пора выяснить всю правду о жизненно-важных процессах организма, а именно о взаимодействии анаболизма и катаболизма.
АНАБОЛИЗМ
Анаболизм представляет собой совокупность химических процессов,
проходящих в организме, которые составляют одну из сторон обмена
веществ и направлены на образование новых тканей и клеток. Примером
анаболизма является синтез белков и гормонов, накопление жиров и
создание мышечных волокон.
Примером
анаболизма является синтез белков и гормонов, накопление жиров и
создание мышечных волокон.
Некоторые ошибочно полагают, что в процессе анаболизма идет наращивание мышечной массы. На самом деле это также синтез гликогенов, что приводит к накоплению жировых отложений. Чтобы этого избежать, организму нужен запас энергии, которая поступает с пищей. Поэтому спортсменам, которые желают в короткие сроки увеличить свою мышечную массу, следует включить в рацион белок и позаботиться о достаточном количестве поступающих калорий.
Усилить процесс анаболизма в организме можно одним из следующих методов.
Белковая пища. Если увеличить в своем рационе количество протеина,
то появится больше «материала для строительства» клеток и мышечных
тканей. Однако следует отметить, что белок не будет приносить
пользу в сочетании с низкокалорийной пищей, так как в этом случае в
организме не будет хватать энергетических запасов. Поэтому меню
спортсмена должно быть максимально сбалансировано с учетом
регулярности, степени и количества физических нагрузок.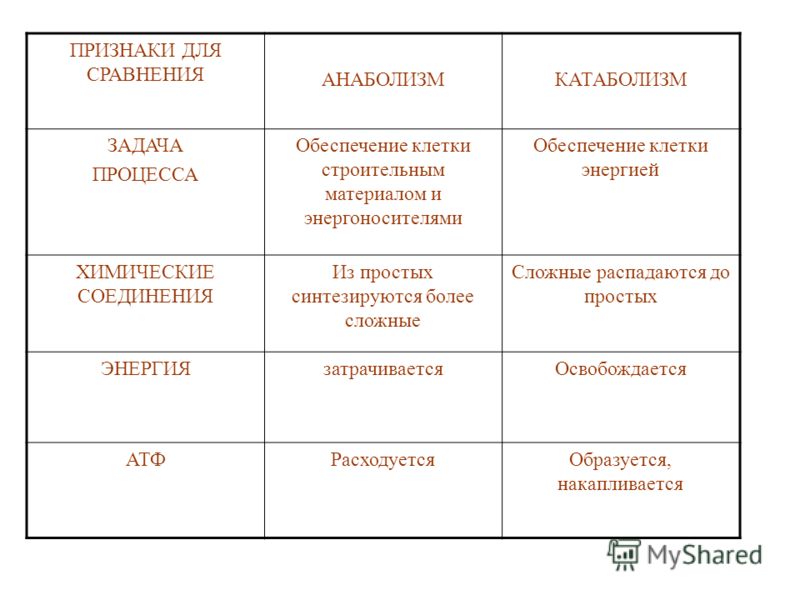
Уменьшение катаболизма. Один из самых непростых методов, хотя на первый взгляд может показаться довольно простым. Для того чтобы снизить катаболические процессы в организме и повысить анаболизм, необходимо много спать, вести здоровый образ жизни, соблюдать правильный режим питания, избегать переутомления и стрессовых ситуаций, а также тренироваться не на износ организма, а по мере своих сил.
КАТАБОЛИЗМ
Процесс катаболизма является противоположностью анаболизма. Если в первом случае идет создание новых клеток и мышечных волокон, то данное понятие означает расщепление сложных веществ до более простых, а также распад старых частей и окисление веществ.
Интенсивность процессов катаболизма регулируется гормонами. Так,
например, некоторые из них (глюкокортикоиды) повышают разложение
белков и аминокислот, но препятствуют образованию глюкозы, а другие
(инсулин), напротив, ускоряют катаболизм глюкозы, но тормозят
расщепление белков. Кроме того, повышает данный процесс гормон
адреналин, а в свою очередь тестостерон отвечает на преобладание
анаболизма в обмене веществ в организме.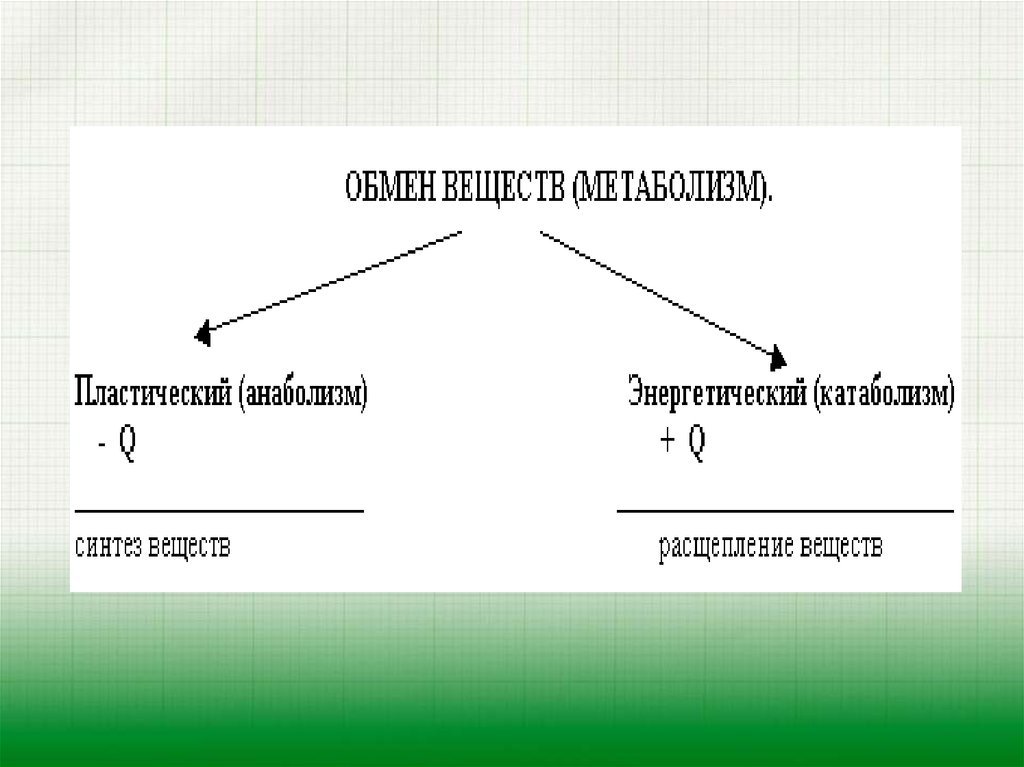
Не стоит рассматривать катаболические процессы с негативной точки зрения. Многие спортсмены полагают, что из-за катаболизма они теряют и с трудом наращивают мышечную массу. На самом деле в процессе расщепления веществ организм получает энергию, без которой не было бы сил для тренировок. Кроме того, в процессе разложения сложных веществ на простые, происходит уменьшение количества липидов (отложений жиров).
МЕТАБОЛИЗМ
Понять, что означает данный термин можно наглядным примером одной простой формулы: «Анаболизм + Катаболизм = Метаболизм». Процессы распада взаимодействуют с процессами обновления и в совокупности составляют обмен веществ, который и называется метаболизмом. Если каждая из сторон выполняет свои функции без сбоев и нарушений, то является залогом здоровья организма.
Скорость метаболических процессов по расщеплению углеводов и жиров зависит от следующих факторов:
Пол: согласно исследованиям ученых у мужчин метаболизм протекает
интенсивнее на 10-20% по сравнению с женским организмом.
Возраст: после 25 лет скорость метаболических процессов снижается
на 2-3% каждые 10 лет.
Вес: чем выше масса мышц, внутренних органов и костей и имеется
минимальное количество жировых отложений, тем быстрее происходит
процесс метаболизма в организме.
Физические нагрузки: при регулярных занятиях спортом происходит
рост скорости метаболизма — на 20-30% в течение первых двух часов
после тренировки и на 5% в течение суток.
Таким образом, анаболизм и катаболизм являются противоположными друг другу понятиями, но взаимодействуя между собой, они являются двумя основными частями единого процесса — метаболизма.
Сбалансированное сочетание процессов анаболизма и катаболизма является залогом правильного обмена веществ и здоровья всего организма.
Источник: http://vk.com/wall-33049742_194667
Обзор метаболизма
Это «Обзор метаболизма», раздел 10.2 из книги «Введение в питание» (версия 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.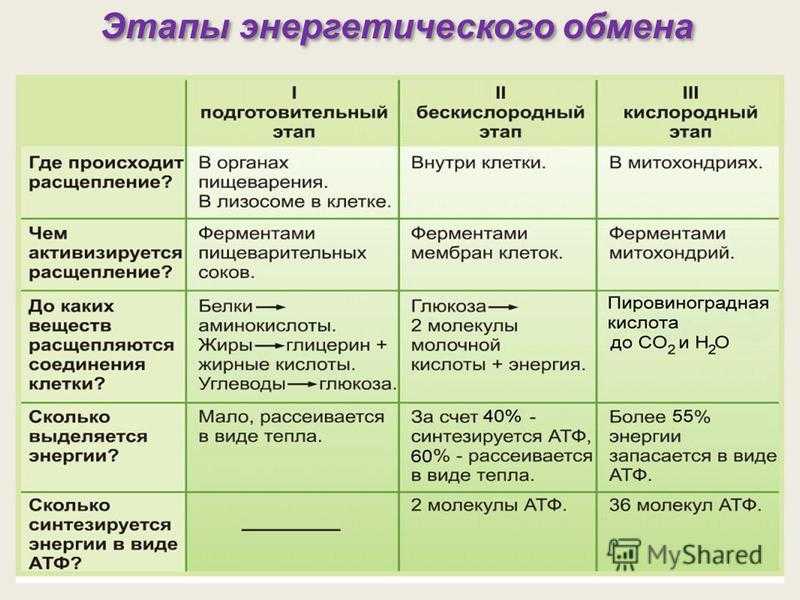
Для получения дополнительной информации об источнике этой книги или о том, почему она доступна бесплатно, посетите домашнюю страницу проекта. Там вы можете просматривать или скачивать дополнительные книги. Чтобы загрузить ZIP-файл с этой книгой для использования в автономном режиме, просто нажмите здесь.
Помогла ли вам эта книга? Подумайте о передаче:
Помощь Creative Commons
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной для вас.
Помогите государственной школе
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их школьные проекты, от художественных принадлежностей до книг и калькуляторов.
10.2 Обзор метаболизма
Цели обучения
- Обобщить, каким образом энергия из дающих энергию нутриентов получается и используется, а также как и где она хранится в организме для дальнейшего использования.
- Объясните роль энергии в процессе построения тканей и органов.
В разных главах этой книги мы исследовали метаболизм углеводов, липидов и белков. В следующем разделе мы соберем эту информацию, чтобы получить четкое представление о важности обмена веществ в питании человека.
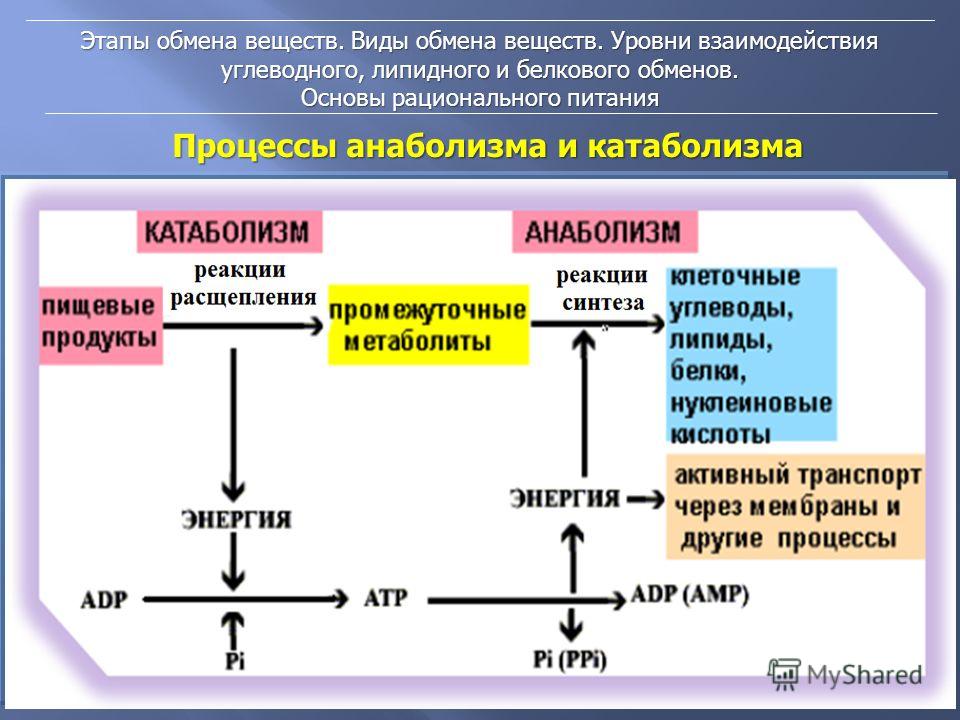
Метаболизм Сумма всех химических реакций, необходимых для поддержания клеточной функции и, следовательно, жизни организма. определяется как сумма всех химических реакций, необходимых для поддержания клеточной функции и, следовательно, жизни организма. Метаболизм классифицируется либо как катаболизм — все метаболические процессы, связанные с распадом молекул и высвобождением энергии, что относится ко всем метаболическим процессам, связанным с распадом молекул, либо как анаболизм — со всеми метаболическими процессами, участвующими в построении более крупных молекул, которые потребляют энергию, включая все вовлеченные метаболические процессы. в построении более крупных молекул. Как правило, катаболические процессы высвобождают энергию, а анаболические процессы потребляют энергию. Общими целями метаболизма являются передача энергии и транспорт веществ. Энергия из пищевых макроэлементов преобразуется в клеточную энергию, которая используется для выполнения клеточной работы. Метаболизм превращает макроэлементы в вещества, которые клетка может использовать для роста и размножения, а также в отходы. В главе 6 «Белки» вы узнали, что ферменты — это белки и что их задача — катализировать химические реакции. (Напомним, что слово «катализировать» означает ускорить химическую реакцию и уменьшить энергию, необходимую для завершения химической реакции, при этом катализатор не расходуется в ходе реакции.) Без ферментов химические реакции не происходили бы с достаточно высокой скоростью и потребовало бы слишком много энергии для существования жизни. Метаболический путь представляет собой серию ферментативных реакций, которые превращают исходный материал (известный как субстрат) в промежуточные продукты, которые являются субстратами для следующих ферментативных реакций в пути, пока, наконец, не будет синтезирован конечный продукт в результате последней ферментативной реакции в путь.
Как правило, катаболические процессы высвобождают энергию, а анаболические процессы потребляют энергию. Общими целями метаболизма являются передача энергии и транспорт веществ. Энергия из пищевых макроэлементов преобразуется в клеточную энергию, которая используется для выполнения клеточной работы. Метаболизм превращает макроэлементы в вещества, которые клетка может использовать для роста и размножения, а также в отходы. В главе 6 «Белки» вы узнали, что ферменты — это белки и что их задача — катализировать химические реакции. (Напомним, что слово «катализировать» означает ускорить химическую реакцию и уменьшить энергию, необходимую для завершения химической реакции, при этом катализатор не расходуется в ходе реакции.) Без ферментов химические реакции не происходили бы с достаточно высокой скоростью и потребовало бы слишком много энергии для существования жизни. Метаболический путь представляет собой серию ферментативных реакций, которые превращают исходный материал (известный как субстрат) в промежуточные продукты, которые являются субстратами для следующих ферментативных реакций в пути, пока, наконец, не будет синтезирован конечный продукт в результате последней ферментативной реакции в путь. Некоторые метаболические пути сложны и включают множество ферментативных реакций, а другие включают лишь несколько химических реакций.
Некоторые метаболические пути сложны и включают множество ферментативных реакций, а другие включают лишь несколько химических реакций.
Для обеспечения клеточной эффективности метаболические пути, участвующие в катаболизме и анаболизме, регулируются в соответствии с энергетическим статусом, гормонами и уровнями субстрата и конечного продукта. Согласованное регулирование метаболических путей предотвращает неэффективное построение клетками молекулы, когда она уже доступна. Точно так же, как было бы неэффективно строить стену одновременно с ее разрушением, для клетки метаболически неэффективно синтезировать жирные кислоты и одновременно разрушать их.
Катаболизм пищевых молекул начинается, когда пища попадает в рот, так как фермент амилаза слюны инициирует расщепление углеводов. Весь процесс пищеварения превращает большие полимеры в пище в мономеры, которые могут быть абсорбированы. Углеводы расщепляются до моносахаридов, липиды – до жирных кислот, а белки – до аминокислот. Эти мономеры всасываются в кровоток либо напрямую, как в случае с моносахаридами и аминокислотами, либо переупаковываются в клетках кишечника для транспорта непрямым путем через лимфатические сосуды, как в случае с жирными кислотами и другими жирорастворимыми молекулами. После всасывания кровь переносит питательные вещества к клеткам. Клетки, которым требуется энергия или строительные блоки, поглощают питательные вещества из крови и перерабатывают их катаболическим или анаболическим путем. Системы органов тела нуждаются в топливе и строительных блоках для выполнения многих функций организма, таких как пищеварение, всасывание, дыхание, перекачивание крови, транспортировка питательных веществ и отходов, поддержание температуры тела и создание новых клеток.
Эти мономеры всасываются в кровоток либо напрямую, как в случае с моносахаридами и аминокислотами, либо переупаковываются в клетках кишечника для транспорта непрямым путем через лимфатические сосуды, как в случае с жирными кислотами и другими жирорастворимыми молекулами. После всасывания кровь переносит питательные вещества к клеткам. Клетки, которым требуется энергия или строительные блоки, поглощают питательные вещества из крови и перерабатывают их катаболическим или анаболическим путем. Системы органов тела нуждаются в топливе и строительных блоках для выполнения многих функций организма, таких как пищеварение, всасывание, дыхание, перекачивание крови, транспортировка питательных веществ и отходов, поддержание температуры тела и создание новых клеток.
Энергетический обмен Метаболические пути, которые высвобождают или сохраняют энергию. более конкретно относится к метаболическим путям, которые высвобождают или сохраняют энергию. Некоторые из них являются катаболическими путями, такими как гликолиз (расщепление глюкозы), β-окисление (расщепление жирных кислот) и катаболизм аминокислот. Другие являются анаболическими путями и включают те, которые участвуют в хранении избыточной энергии (например, гликогенез) и синтезе триглицеридов (липогенез). Таблица 10.2 «Метаболические пути» суммирует некоторые катаболические и анаболические пути и их функции в энергетическом обмене.
Другие являются анаболическими путями и включают те, которые участвуют в хранении избыточной энергии (например, гликогенез) и синтезе триглицеридов (липогенез). Таблица 10.2 «Метаболические пути» суммирует некоторые катаболические и анаболические пути и их функции в энергетическом обмене.
Таблица 10.2 Метаболические пути
| Катаболические пути | Функция | Анаболические пути | Функция |
|---|---|---|---|
| Гликолиз | Распад глюкозы | Глюконеогенез | Синтез глюкозы |
| Гликогенолиз | Распад гликогена | Гликогенез | Синтезировать гликоген |
| β-окисление | Расщепление жирных кислот | Липогенез | Синтез триглицеридов |
| Протеолиз | Расщепление белка до аминокислот | Синтез аминокислот | Синтезировать аминокислоты |
Катаболизм: распад
Все клетки настроены на свой энергетический баланс. Когда уровень энергии высокий, клетки строят молекулы, а когда уровень энергии низкий, инициируются катаболические пути для производства энергии. Глюкоза является предпочтительным источником энергии для большинства тканей, но жирные кислоты и аминокислоты также могут катаболизироваться в молекулу клеточной энергии АТФ. Катаболизм питательных веществ в энергию можно разделить на три стадии, каждая из которых включает отдельные метаболические пути. Три стадии распада питательных веществ позволяют клеткам переоценить свои потребности в энергии, поскольку конечные продукты каждого пути могут быть либо дополнительно переработаны в энергию, либо направлены на анаболические пути. Кроме того, промежуточные продукты метаболических путей иногда могут быть перенаправлены на анаболические пути после удовлетворения клеточных энергетических потребностей. Три стадии распада питательных веществ следующие:
Когда уровень энергии высокий, клетки строят молекулы, а когда уровень энергии низкий, инициируются катаболические пути для производства энергии. Глюкоза является предпочтительным источником энергии для большинства тканей, но жирные кислоты и аминокислоты также могут катаболизироваться в молекулу клеточной энергии АТФ. Катаболизм питательных веществ в энергию можно разделить на три стадии, каждая из которых включает отдельные метаболические пути. Три стадии распада питательных веществ позволяют клеткам переоценить свои потребности в энергии, поскольку конечные продукты каждого пути могут быть либо дополнительно переработаны в энергию, либо направлены на анаболические пути. Кроме того, промежуточные продукты метаболических путей иногда могут быть перенаправлены на анаболические пути после удовлетворения клеточных энергетических потребностей. Три стадии распада питательных веществ следующие:
- Стадия 1. Гликолиз глюкозы, β-окисление жирных кислот или катаболизм аминокислот
- Стадия 2.
 Цикл лимонной кислоты (или цикл Кребса)
Цикл лимонной кислоты (или цикл Кребса) - Стадия 3. Цепь переноса электронов и синтез АТФ
Расщепление глюкозы начинается с гликолиза, который представляет собой десятиэтапный метаболический путь, дающий две молекулы АТФ на молекулу глюкозы; гликолиз происходит в цитозоле и не требует кислорода. Помимо АТФ, конечными продуктами гликолиза являются две трехуглеродные молекулы, называемые пируватом. Пируват может быть либо переведен в цикл лимонной кислоты, чтобы произвести больше АТФ, либо следовать анаболическому пути. Если клетка находится в отрицательном энергетическом балансе, пируват транспортируется в митохондрии, где сначала отщепляется один из его атомов углерода с образованием ацетил-КоА. Ацетил-КоА, двухуглеродная молекула, общая для метаболизма глюкозы, липидов и белков, вступает во вторую стадию энергетического обмена, цикл лимонной кислоты. Расщепление жирных кислот начинается с катаболического пути, известного как β-окисление, которое происходит в митохондриях. В этом катаболическом пути четыре ферментативных этапа последовательно удаляют двухуглеродные молекулы из длинных цепей жирных кислот, давая молекулы ацетил-КоА. В случае аминокислот, после удаления азота из аминокислоты, оставшийся углеродный скелет может быть ферментативно преобразован в ацетил-КоА или какой-либо другой промежуточный продукт цикла лимонной кислоты.
В этом катаболическом пути четыре ферментативных этапа последовательно удаляют двухуглеродные молекулы из длинных цепей жирных кислот, давая молекулы ацетил-КоА. В случае аминокислот, после удаления азота из аминокислоты, оставшийся углеродный скелет может быть ферментативно преобразован в ацетил-КоА или какой-либо другой промежуточный продукт цикла лимонной кислоты.
В цикле лимонной кислоты ацетил-КоА присоединяется к четырехуглеродной молекуле. В этом многоступенчатом пути два атома углерода теряются в виде двух молекул углекислого газа. Энергия, полученная от разрыва химических связей в цикле лимонной кислоты, трансформируется в еще две молекулы АТФ (или их эквиваленты) и высокоэнергетические электроны, переносимые молекулами никотинамидадениндинуклеотида (NADH) и флавинадениндинуклеотида (FADH ). 2 ). НАДН и ФАДН 2 переносят электроны на внутреннюю мембрану в митохондриях, где происходит третья стадия синтеза энергии, так называемая электрон-транспортная цепь.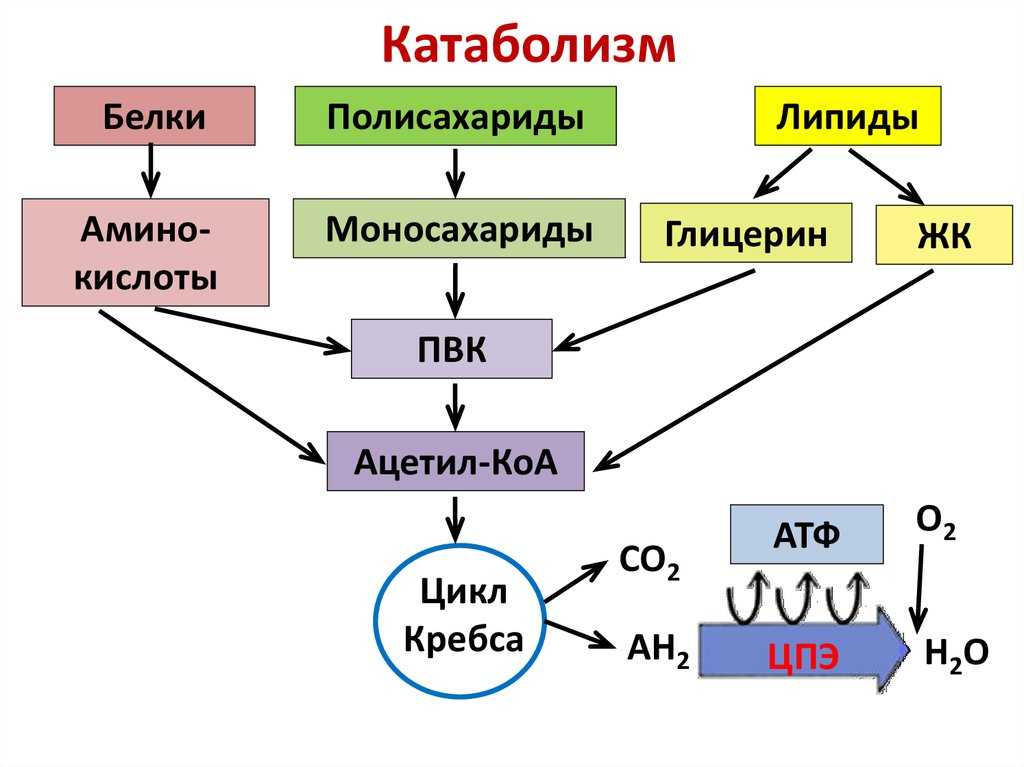 В этом метаболическом пути происходит последовательный перенос электронов между несколькими белками и синтез АТФ. Весь процесс катаболизма питательных веществ химически подобен горению, так как молекулы углерода сгорают с образованием углекислого газа, воды и тепла. Однако многие химические реакции при катаболизме питательных веществ замедляют распад молекул углерода, так что большая часть энергии может быть захвачена, а не преобразована в тепло и свет. Эффективность полного катаболизма питательных веществ составляет от 30 до 40 процентов, поэтому часть энергии высвобождается в виде тепла. Тепло является жизненно важным продуктом катаболизма питательных веществ и участвует в поддержании температуры тела. Если бы клетки были слишком эффективны в преобразовании энергии питательных веществ в АТФ, люди не дотянули бы до следующего приема пищи, так как они умерли бы от переохлаждения.
В этом метаболическом пути происходит последовательный перенос электронов между несколькими белками и синтез АТФ. Весь процесс катаболизма питательных веществ химически подобен горению, так как молекулы углерода сгорают с образованием углекислого газа, воды и тепла. Однако многие химические реакции при катаболизме питательных веществ замедляют распад молекул углерода, так что большая часть энергии может быть захвачена, а не преобразована в тепло и свет. Эффективность полного катаболизма питательных веществ составляет от 30 до 40 процентов, поэтому часть энергии высвобождается в виде тепла. Тепло является жизненно важным продуктом катаболизма питательных веществ и участвует в поддержании температуры тела. Если бы клетки были слишком эффективны в преобразовании энергии питательных веществ в АТФ, люди не дотянули бы до следующего приема пищи, так как они умерли бы от переохлаждения.
Анаболизм: Здание
Энергия, выделяемая катаболическими путями, питает анаболические пути при построении макромолекул, таких как белки РНК и ДНК, и даже целых новых клеток и тканей. Анаболические пути необходимы для создания новой ткани, такой как мышцы, после длительных упражнений или ремоделирования костной ткани, процесса, включающего как катаболические, так и анаболические пути. Анаболические пути также создают молекулы для хранения энергии, такие как гликоген и триглицериды. Промежуточные продукты катаболических путей энергетического метаболизма иногда отвлекаются от производства АТФ и вместо этого используются в качестве строительных блоков. Это происходит, когда клетка находится в положительном энергетическом балансе. Например, промежуточный продукт цикла лимонной кислоты, α-кетоглутарат, может быть анаболически преобразован в глутамат аминокислот или глутамин, если они необходимы. Вспомним из главы 6 «Белки», что человеческий организм способен синтезировать одиннадцать из двадцати аминокислот, входящих в состав белков. Все метаболические пути синтеза аминокислот ингибируются конкретной аминокислотой, которая является конечным продуктом данного пути. Таким образом, если в клетке достаточно глютамина, она отключает его синтез.
Анаболические пути необходимы для создания новой ткани, такой как мышцы, после длительных упражнений или ремоделирования костной ткани, процесса, включающего как катаболические, так и анаболические пути. Анаболические пути также создают молекулы для хранения энергии, такие как гликоген и триглицериды. Промежуточные продукты катаболических путей энергетического метаболизма иногда отвлекаются от производства АТФ и вместо этого используются в качестве строительных блоков. Это происходит, когда клетка находится в положительном энергетическом балансе. Например, промежуточный продукт цикла лимонной кислоты, α-кетоглутарат, может быть анаболически преобразован в глутамат аминокислот или глутамин, если они необходимы. Вспомним из главы 6 «Белки», что человеческий организм способен синтезировать одиннадцать из двадцати аминокислот, входящих в состав белков. Все метаболические пути синтеза аминокислот ингибируются конкретной аминокислотой, которая является конечным продуктом данного пути. Таким образом, если в клетке достаточно глютамина, она отключает его синтез.
Анаболические пути регулируются их конечными продуктами, но еще в большей степени энергетическим состоянием клетки. Когда энергии достаточно, более крупные молекулы, такие как белок, РНК и ДНК, будут строиться по мере необходимости. В качестве альтернативы, когда энергии недостаточно, белки и другие молекулы будут разрушаться и катаболизироваться для высвобождения энергии. Драматический пример этого наблюдается у детей с маразмом. Эти дети имеют серьезные нарушения функций организма, часто заканчивающиеся смертью от инфекции. Детям с маразмом не хватает калорий и белка, которые необходимы для выработки энергии и построения макромолекул. Отрицательно-энергетический баланс у детей с маразмом приводит к распаду мышечной ткани и тканей других органов в попытках организма выжить. Значительное уменьшение мышечной ткани делает детей с маразмом истощенными или «мышечно истощенными».
Рисунок 10.2 Метаболический путь глюконеогенеза
В гораздо менее тяжелом примере человек также находится в состоянии отрицательного энергетического баланса между приемами пищи. В это время уровень глюкозы в крови начинает падать. Чтобы восстановить уровень глюкозы в крови до нормального уровня, стимулируется анаболический путь, называемый глюконеогенезом. Глюконеогенез — это процесс образования молекул глюкозы из определенных аминокислот, происходящий главным образом в печени (рис. 10.2 «Метаболический путь глюконеогенеза»). Печень экспортирует синтезированную глюкозу в кровь для использования другими тканями.
В это время уровень глюкозы в крови начинает падать. Чтобы восстановить уровень глюкозы в крови до нормального уровня, стимулируется анаболический путь, называемый глюконеогенезом. Глюконеогенез — это процесс образования молекул глюкозы из определенных аминокислот, происходящий главным образом в печени (рис. 10.2 «Метаболический путь глюконеогенеза»). Печень экспортирует синтезированную глюкозу в кровь для использования другими тканями.
Хранилище энергии
Напротив, в состоянии «сытости» (когда уровень энергии высок) дополнительная энергия из питательных веществ будет храниться. Глюкоза может запасаться только в мышечной и печеночной тканях. В этих тканях он хранится в виде гликогена, высокоразветвленной макромолекулы, состоящей из тысяч мономеров глюкозы, соединенных химическими связями. Мономеры глюкозы соединяются вместе анаболическим путем, называемым гликогенезом. На каждую запасенную молекулу глюкозы расходуется одна молекула АТФ. Следовательно, для хранения энергии требуется энергия. Уровень гликогена быстро достигает своего физиологического предела, и когда это происходит, избыток глюкозы превращается в жир. Клетка с положительным энергетическим балансом обнаруживает высокую концентрацию АТФ, а также ацетил-КоА, вырабатываемых катаболическими путями. В ответ отключается катаболизм и включается синтез триглицеридов, происходящий анаболическим путем, называемым липогенезом. Новообразованные триглицериды транспортируются в жировые клетки, называемые адипоцитами. Жир является лучшей альтернативой гликогену для хранения энергии, поскольку он более компактен (на единицу энергии) и, в отличие от гликогена, организм не запасает воду вместе с жиром. Вода имеет значительный вес, и повышенные запасы гликогена, которые сопровождаются водой, резко увеличивают массу тела. Когда тело находится в положительном энергетическом балансе, избыток углеводов, липидов и белков метаболизируется в жир.
Уровень гликогена быстро достигает своего физиологического предела, и когда это происходит, избыток глюкозы превращается в жир. Клетка с положительным энергетическим балансом обнаруживает высокую концентрацию АТФ, а также ацетил-КоА, вырабатываемых катаболическими путями. В ответ отключается катаболизм и включается синтез триглицеридов, происходящий анаболическим путем, называемым липогенезом. Новообразованные триглицериды транспортируются в жировые клетки, называемые адипоцитами. Жир является лучшей альтернативой гликогену для хранения энергии, поскольку он более компактен (на единицу энергии) и, в отличие от гликогена, организм не запасает воду вместе с жиром. Вода имеет значительный вес, и повышенные запасы гликогена, которые сопровождаются водой, резко увеличивают массу тела. Когда тело находится в положительном энергетическом балансе, избыток углеводов, липидов и белков метаболизируется в жир.
Ключевые выводы
- Общими целями метаболизма являются передача энергии и транспорт веществ.
 Метаболизм определяется как сумма всех химических реакций, необходимых для поддержания клеточной функции, и подразделяется либо на катаболизм (относится ко всем метаболическим процессам, связанным с распадом молекул), либо к анаболизму (который включает все метаболические процессы, участвующие в построении более крупных молекул). Как правило, катаболические процессы высвобождают энергию, а анаболические процессы потребляют энергию.
Метаболизм определяется как сумма всех химических реакций, необходимых для поддержания клеточной функции, и подразделяется либо на катаболизм (относится ко всем метаболическим процессам, связанным с распадом молекул), либо к анаболизму (который включает все метаболические процессы, участвующие в построении более крупных молекул). Как правило, катаболические процессы высвобождают энергию, а анаболические процессы потребляют энергию. - Метаболический путь представляет собой серию ферментативных стадий, которые превращают субстрат (исходный материал) в промежуточные продукты, которые являются субстратами для протекающих ферментативных реакций до тех пор, пока в результате последней ферментативной реакции в пути не будет синтезирован конечный продукт.
- Системам органов тела требуется топливо и строительные блоки для переваривания, поглощения, дыхания, перекачки крови, транспортировки питательных веществ и отходов, поддержания температуры тела и создания новых клеток среди множества других функций.

- Когда уровень энергии высок, клетки строят молекулы, а когда уровень энергии низкий, катаболические пути стимулируются для высвобождения энергии.
- Энергия, высвобождаемая катаболическими путями, приводит в действие анаболические пути в построении более крупных макромолекул.
- В «сытом» состоянии (когда уровни энергии высоки) дополнительное питательное топливо будет храниться в виде гликогена или триглицеридов.
Начало обсуждения
- Обсудите практичность хранения энергии в ранних человеческих цивилизациях и последствия этих метаболических процессов в современном мире. Вернитесь к истории индейцев пима в главе 1 «Питание и вы» и к концепции «бережливого гена».
- Может ли человек с избыточным весом винить в своем избыточном весе более медленный обмен веществ?
Эволюционная перспектива иммунометаболизма
1. Buck MD, Sowell RT, Kaech SM, Pearce EL, Метаболическая инструкция по иммунитету. Клетка
169, 570–586 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Buck MD, Sowell RT, Kaech SM, Pearce EL, Метаболическая инструкция по иммунитету. Клетка
169, 570–586 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. О’Нил Л.А., Пирс Э.Дж., Иммунометаболизм регулирует функцию дендритных клеток и макрофагов. J Эксперт Мед 213, 15–23 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Пирс Э.Л., Поффенбергер М.С., Чанг Ч., Джонс Р.Г. Подпитка иммунитета: понимание метаболизма и функции лимфоцитов. Наука 342, 1242454 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Ниш С.А., Лин В.В., Райнер С.Л., Судьба и метаболизм лимфоцитов: клональный балансирующий акт. Тенденции Cell Biol 27, 946–954 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Хотамислигил Г.С., Основы иммунометаболизма и последствия для метаболического здоровья и болезней. Иммунитет 47, 406–420 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Lee YS, Wollam J, Olefsky JM, Комплексный взгляд на иммунометаболизм. Клетка
172, 22–40 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка
172, 22–40 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Stearns S, The Evolution of Life Histories. (Издательство Оксфордского университета; 1992). [Академия Google]
8. Флоран Г.Л., Метаболизм липидов у гибернаторов. Интегративная и сравнительная биология 38, 331–340 (1998). [Google Scholar]
9. Отис Дж. П., Пайк А. С., Торреальба Дж. Р., Кэри Х. В., Гибернация уменьшает повреждение клеток, вызванное реперфузией теплой печени у сусликов. J Comp Physiol B 187, 639–648 (2017). [PubMed] [Google Scholar]
10. Iaizzo PA, Laske TG, Harlow HJ, McClay CB, Garshelis DL, Заживление ран во время спячки у черных медведей (Ursus americanus) в дикой природе: выявление уменьшения образования рубцов. Интегр Зоол 7, 48–60 (2012). [PubMed] [Академия Google]
11. Матос-Крус В. и др., Молекулярные предпосылки снижения чувствительности к холоду у сусликов и хомяков. Представитель ячейки 21, 3329–3337 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Филенбах Н., Антеби А., C. elegans dauer формирование и молекулярная основа пластичности. Гены Дев
22, 2149–2165 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Филенбах Н., Антеби А., C. elegans dauer формирование и молекулярная основа пластичности. Гены Дев
22, 2149–2165 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Хашимото Т. et al., Экстремотолерантный геном тихоходок и улучшенная радиотолерантность культивируемых клеток человека за счет уникального белка тихоходок. Нац Коммуна 7, 12808 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Мали Б и др., Исследование транскриптома ангидробиотической тихоходки Milnesium tardigradum в сравнении с Hypsibius dujardini и Richtersius coronifer. Геномика BMC 11, 168 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Burnell AM, Houthoofd K, O’Hanlon K, Vanfleteren JR, Альтернативный метаболизм на стадии дауэра нематоды Caenorhabditis elegans. Опыт Геронтол 40, 850–856 (2005). [PubMed] [Google Scholar]
16. Ранке М.Б., Вит Дж.М. Гормон роста – прошлое, настоящее и будущее. Нат Рев Эндокринол 14. С. 285–300 (2018). [PubMed] [Академия Google]
17. Асеведо-Родригес А.
и др., Новое понимание регуляции гипоталамо-гипофизарно-гонадной (ГГГ) оси и взаимодействия с сигнализацией стресса. J Нейроэндокринол, (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Асеведо-Родригес А.
и др., Новое понимание регуляции гипоталамо-гипофизарно-гонадной (ГГГ) оси и взаимодействия с сигнализацией стресса. J Нейроэндокринол, (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Смит С.М., Вейл В.В., Роль гипоталамо-гипофизарно-надпочечниковой оси в нейроэндокринных реакциях на стресс. Диалоги Clin Neurosci 8, 383–395 (2006). [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Water Boron EB, Медицинская физиология. (1992).
20. Шломо Мелмед К.П., Рид Ларсен П., Кроненберг Генри, Эндокринология. (Эльзевир, 2015). [Google Scholar]
21. Хассельгрен П.О. Глюкокортикоиды и мышечный катаболизм. Curr Opin Clin Nutr Metab Care 2, 201–205 (1999). [PubMed] [Google Scholar]
22. Сюй С. и др., Прямое влияние глюкокортикоидов на липолиз в адипоцитах. Мол Эндокринол 23, 1161–1170 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Olofsson LE, Unger EK, Cheung CC, Xu AW, Модуляция функции AgRP-нейронов с помощью SOCS3 как инициирующее событие в индуцированной диетой резистентности гипоталамуса к лептину.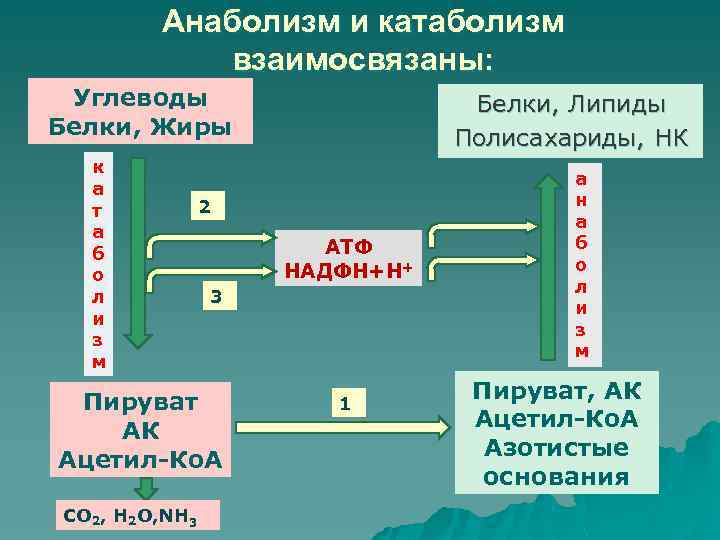 Труды Национальной академии наук Соединенных Штатов Америки
110, Е697–706 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Труды Национальной академии наук Соединенных Штатов Америки
110, Е697–706 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Lam TK, Gutierrez-Juarez R, Pocai A, Rossetti L, Регулирование уровня глюкозы в крови посредством метаболизма пирувата в гипоталамусе. Наука 309, 943–947 (2005). [PubMed] [Google Scholar]
25. Lam TK, Schwartz GJ, Rossetti L, Гипоталамическое определение жирных кислот. Нат Нейроски 8, 579–584 (2005). [PubMed] [Google Scholar]
26. Дитрих М.О., Хорват Т.Л. Гипоталамический контроль энергетического баланса: понимание роли синаптической пластичности. Тенденции в нейронауках 36, 65–73 (2013). [PubMed] [Академия Google]
27. Желтовато-коричневый CL и др., Теплочувствительные нейроны, контролирующие температуру тела. Клетка 167, 47–59 е15 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Чжао ЗД
и др., Гипоталамическая цепь, контролирующая температуру тела. Труды Национальной академии наук Соединенных Штатов Америки
114, 2042–2047 (2017).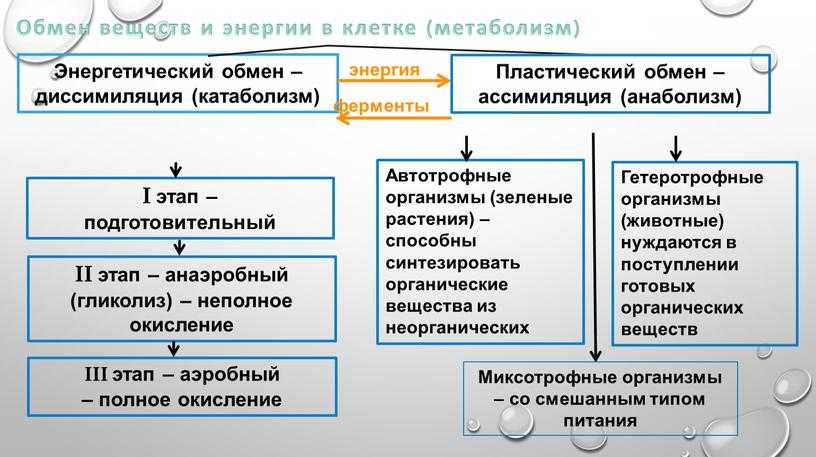 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Zimmerman CA и др. Нейроны жажды предвосхищают гомеостатические последствия еды и питья. Природа 537, 680–684 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Аллен В.Е. и др., Преоптические нейроны, связанные с жаждой, кодируют отталкивающее мотивационное влечение. Наука 357, 1149–1155 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Матарезе Г. и др., Нейроны гипоталамуса, стимулирующие чувство голода, модулируют эффекторные и регуляторные ответы Т-клеток. Труды Национальной академии наук Соединенных Штатов Америки 110, 6193–6198 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Ким М.С. и др., Быстрая связь врожденных иммунологических сигналов с адаптивным иммунитетом через ось мозг-жир. Нат Иммунол 16, 525–533 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Roa J, Herbison AE, Прямая регуляция возбудимости нейронов GnRH с помощью нейропептидов нейронов дугообразного ядра POMC и NPY у самок мышей.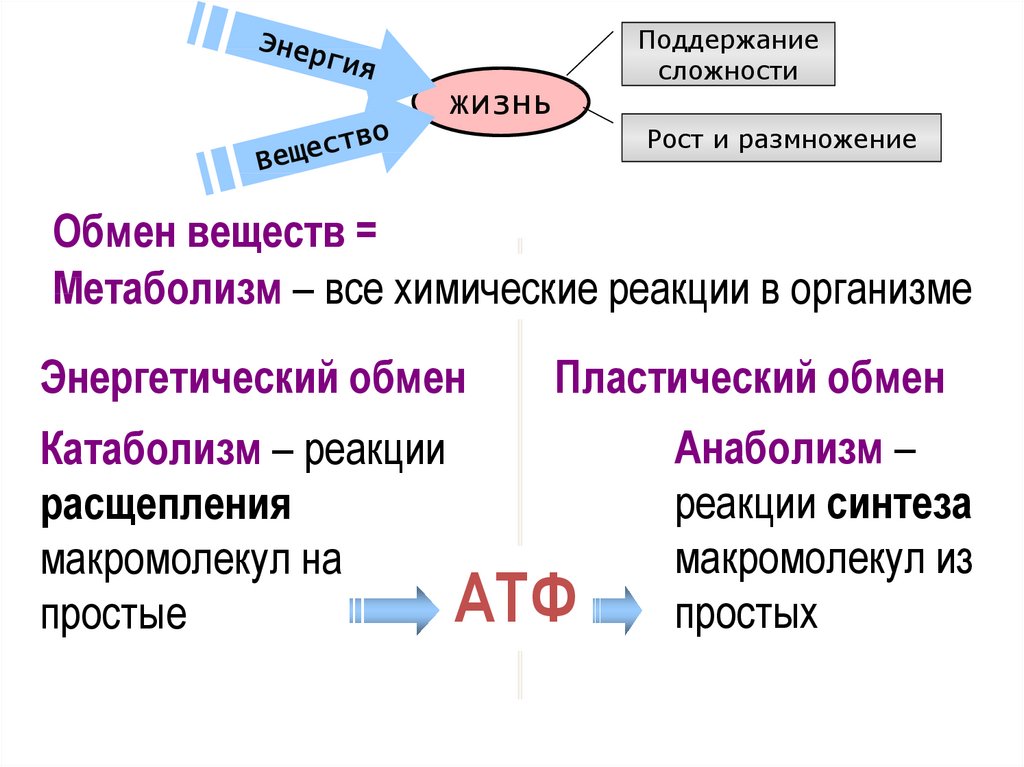 Эндокринология
153, 5587–5599 (2012). [PubMed] [Google Scholar]
Эндокринология
153, 5587–5599 (2012). [PubMed] [Google Scholar]
34. Падилья С.Л. et al., передача сигналов нейронов от AgRP к Kiss1 связывает состояние питания и фертильность. Труды Национальной академии наук Соединенных Штатов Америки 114, 2413–2418 (2017). [PMC free article] [PubMed] [Google Scholar]
35. Sasanuma H, Nakata M, Parmila K, Nakae J, Yada T, путь PDK1-FoxO1 в нейронах AgRP дугообразного ядра способствует формированию кости через GHRH-GH-IGF1 ось. Мол Метаб 6, 428–439(2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Кагеяма К. Регуляция гонадотропинов кортикотропин-рилизинг-фактором и урокортином. Фронт Эндокринол (Лозанна) 4, 12 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Li RL и др. Глубокая гипогликемия у голодающих мышей с дефицитом грелина вызвана снижением глюконеогенеза и реверсируется лактатом или жирными кислотами. Журнал биологической химии 287, 17942–17950 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Сахарова А.А.
и др. Роль гормона роста в регуляции липолиза, протеолиза и продукции глюкозы в печени во время голодания. Журнал клинической эндокринологии и обмена веществ
93, 2755–2759 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Сахарова А.А.
и др. Роль гормона роста в регуляции липолиза, протеолиза и продукции глюкозы в печени во время голодания. Журнал клинической эндокринологии и обмена веществ
93, 2755–2759 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Efeyan A, Comb WC, Sabatini DM, Механизмы и пути восприятия питательных веществ. Природа 517, 302–310 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Saxton RA, Sabatini DM, Сигнализация mTOR при росте, метаболизме и заболеваниях. Клетка 168, 960–976 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Majmundar AJ, Wong WJ, Simon MC, Факторы, индуцируемые гипоксией, и реакция на гипоксический стресс. Молекулярная клетка 40, 294–309 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Культц Д., Молекулярные и эволюционные основы клеточной реакции на стресс. Анну Рев Физиол 67, 225–257 (2005). [PubMed] [Google Scholar]
43. Humpton TJ, Vousden KH, Регуляция клеточного метаболизма и гипоксии с помощью p53. Колд Спринг Харб Перспект Мед
6, (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Колд Спринг Харб Перспект Мед
6, (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Сингх Р., Куэрво А.М., Аутофагия в клеточном энергетическом балансе. Сотовый метаб 13, 495–504 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Морено-Марин Н. et al., Арилуглеводородный рецептор способствует полиплоидизации печени и ингибирует передачу сигналов PI3K, ERK и Wnt/β-катенина. iScience 4, 44–63 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Vidal RL, Hetz C, Unspliced XBP1 контролирует аутофагию через FoxO1. Сотовые Res 23, 463–464 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Feng Z, Levine AJ, Регуляция энергетического метаболизма и путей IGF-1/mTOR белком p53. Тенденции Cell Biol 20, 427–434 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Chen YH
и др., Асимметричная активность PI3K в лимфоцитах, организованная PI3K-опосредованным путем полярности. Представитель ячейки
22, 860–868 (2018).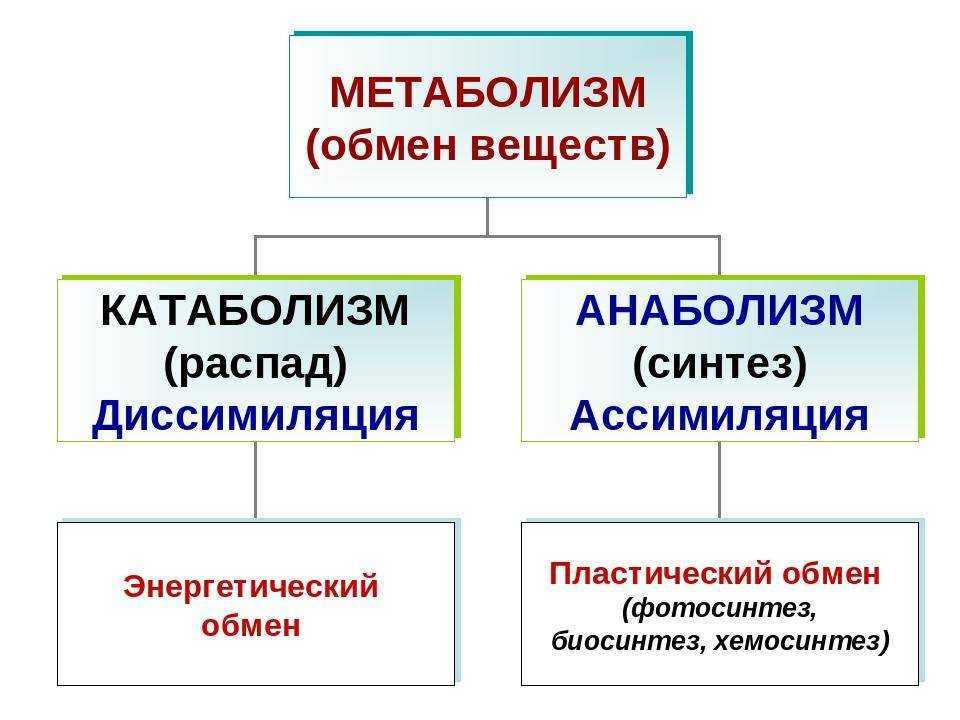 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Verbist KC и др., Метаболическое поддержание клеточной асимметрии после деления активированных Т-лимфоцитов. Природа 532, 389–393 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Pollizzi KN и др., Асимметричное наследование активности киназы mTORC1 во время деления определяет дифференцировку CD8(+) Т-клеток. Нат Иммунол 17, 704–711 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Lin WH и др., Асимметричная передача сигналов PI3K, управляющая бифуркацией развития и регенеративных клеточных судеб. Представитель ячейки 13, 2203–2218 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Айрес Дж. С., Шнайдер Д. С., Толерантность к инфекциям. Ежегодный обзор иммунологии 30, 271–294 (2012). [PubMed] [Google Scholar]
53. Soares MP, Gozzelino R, Weis S, Контроль повреждения тканей при толерантности к болезням. Тренды Иммунол 35, 483–494 (2014). [PubMed] [Google Scholar]
54. Лю Л.
и др., Провоспалительный сигнал подавляет пролиферацию и сдвигает метаболизм макрофагов с Myc-зависимого на HIF1-альфа-зависимый. Труды Национальной академии наук Соединенных Штатов Америки
113, 1564–1569 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лю Л.
и др., Провоспалительный сигнал подавляет пролиферацию и сдвигает метаболизм макрофагов с Myc-зависимого на HIF1-альфа-зависимый. Труды Национальной академии наук Соединенных Штатов Америки
113, 1564–1569 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Sag D, Carling D, Stout RD, Suttles J, Аденозин-5′-монофосфат-активируемая протеинкиназа способствует поляризации макрофагов к противовоспалительному функциональному фенотипу. Дж Иммунол 181, 8633–8641 (2008). [Статья бесплатно PMC] [PubMed] [Google Scholar]
56. Lorsbach RB, Murphy WJ, Lowenstein CJ, Snyder SH, Russell SW, Экспрессия гена синтазы оксида азота в мышиных макрофагах, активированных для уничтожения опухолевых клеток. Молекулярная основа синергизма между гамма-интерфероном и липополисахаридом. Журнал биологической химии 268, 1908–1913 (1993). [PubMed] [Google Scholar]
57. Клементи Э., Браун Г.К., Филиш М., Монкада С., Стойкое ингибирование клеточного дыхания оксидом азота: решающая роль S-нитрозилирования митохондриального комплекса I и защитного действия глутатиона.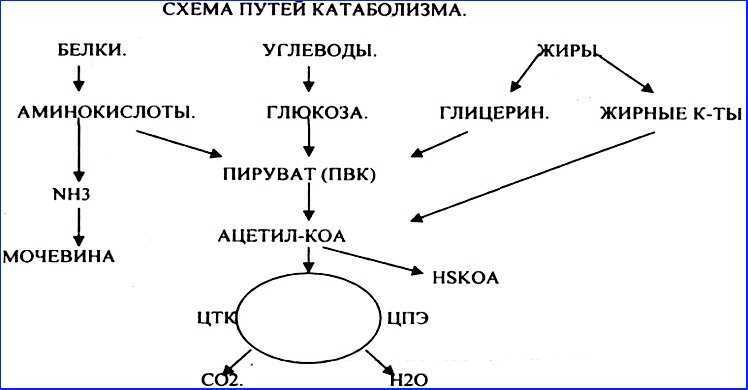 Труды Национальной академии наук Соединенных Штатов Америки
95, 7631–7636 (1998). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Труды Национальной академии наук Соединенных Штатов Америки
95, 7631–7636 (1998). [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Коваррубиас А.Дж., Аксойлар Х.И., Хорнг Т., Контроль метаболизма и активации макрофагов с помощью передачи сигналов mTOR и Akt. Семин Иммунол 27, 286–296 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Rodriguez-Prados JC и др., Судьба субстрата в активированных макрофагах: сравнение врожденной, классической и альтернативной активации. Дж Иммунол 185, 605–614 (2010). [PubMed] [Google Scholar]
60. Фримерман А.Дж. и др., Метаболическое перепрограммирование макрофагов: метаболизм глюкозы, опосредованный переносчиком глюкозы 1 (GLUT1), вызывает провоспалительный фенотип. Журнал биологической химии 289, 7884–7896 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Таннахилл ГМ
и др., сукцинат является воспалительным сигналом, который индуцирует ИЛ-1бета через HIF-1альфа. Природа
496, 238–242 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Moon JS и др., Индуцированный mTORC1 HK1-зависимый гликолиз регулирует активацию воспаления NLRP3. Представитель ячейки 12, 102–115 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Moon JS et al., синтаза жирных кислот, индуцированная UCP2, способствует активации инфламмасомы NLRP3 во время сепсиса. Джей Клин Инвест 125, 665–680 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar] Отозвано
64. Ip WKE, Hoshi N, Shouval DS, Snapper S, Medzhitov R, Противовоспалительное действие IL-10, опосредованное метаболическим перепрограммированием макрофагов. Наука 356, 513–519 (2017). [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Такахама М., Акира С., Сайтох Т. Аутофагия ограничивает активацию инфламмасом. Иммунол Rev 281, 62–73 (2018). [PubMed] [Google Scholar]
66. Carroll KC, Viollet B, Suttles J, Дефицит AMPKalpha1 усиливает провоспалительную миелоидную активность APC и передачу сигналов CD40. Дж. Лейкок Биол
94, 1113–1121 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Лейкок Биол
94, 1113–1121 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Everts B и др., Приверженность гликолизу поддерживает выживание NO-продуцирующих воспалительных дендритных клеток. Кровь 120, 1422–1431 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Янч Дж. и др., Гипоксия и индуцируемый гипоксией фактор-1 альфа модулируют липополисахарид-индуцированную активацию и функцию дендритных клеток. Дж Иммунол 180, 4697–4705 (2008). [PubMed] [Google Scholar]
69. Цао В. и др., Опосредованная Toll-подобным рецептором индукция интерферона типа I в плазмоцитоидных дендритных клетках требует чувствительного к рапамицину пути PI(3)K-mTOR-p70S6K. Нат Иммунол 9, 1157–1164 (2008). [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Buck MD, O’Sullivan D, Pearce EL, Метаболизм Т-клеток стимулирует иммунитет. J Эксперт Мед 212, 1345–1360 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Chang CH
и др., Посттранскрипционный контроль эффекторной функции Т-клеток посредством аэробного гликолиза. Клетка
153, 1239–1251 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка
153, 1239–1251 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Сена Л.А. et al., Митохондрии необходимы для антиген-специфической активации Т-клеток посредством передачи сигналов активных форм кислорода. Иммунитет 38, 225–236 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Бак, доктор медицины и др., Митохондриальная динамика контролирует судьбу Т-клеток посредством метаболического программирования. Клетка 166, 63–76 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Ron-Harel N и др., Митохондриальный биогенез и ремоделирование протеома способствуют одноуглеродному метаболизму для активации Т-клеток. Сотовый метаб 24, 104–117 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Adams WC и др., Связанный с анаболизмом митохондриальный стаз, управляющий дифференцировкой лимфоцитов по сравнению с самообновлением. Представитель ячейки 17, 3142–3152 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Цуй Г
et al., Индуцированный IL-7 транспорт глицерина и синтез ТАГ способствует долголетию Т-клеток памяти CD8+. Клетка
161, 750–761 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Цуй Г
et al., Индуцированный IL-7 транспорт глицерина и синтез ТАГ способствует долголетию Т-клеток памяти CD8+. Клетка
161, 750–761 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Grunwell JR et al., TGF-бета1 подавляет ответ IFN типа I и вызывает митохондриальную дисфункцию в альвеолярных макрофагах. Дж Иммунол 200, 2115–2128 (2018). [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Patsoukis N et al., PD-1 изменяет перепрограммирование метаболизма Т-клеток, ингибируя гликолиз и стимулируя липолиз и окисление жирных кислот. Нац Коммуна 6, 6692 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Бенгш Б. и др., Биоэнергетическая недостаточность из-за метаболических изменений, регулируемых ингибиторным рецептором PD-1, является ранним фактором истощения CD8 (+) Т-клеток. Иммунитет 45, 358–373 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Данцер Р., Келли К.В., Двадцать лет исследований поведения при болезни, вызванной цитокинами. Мозг, поведение и иммунитет
21, 153–160 (2007). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мозг, поведение и иммунитет
21, 153–160 (2007). [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Джин С. et al., Гипоталамический TLR2 запускает болезненное поведение через ось микроглия-нейрон. научный представитель 6, 29424 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Сапер С.Б., Романовский А.А., Скаммелл Т.Е. Нервные цепи, задействованные простагландинами во время синдрома болезни. Нат Нейроски 15, 1088–1095 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Герман А.П., Томашевска-Заремба Д., Влияние эндотоксина на экспрессию генов GnRH и GnRHR в гипоталамусе и передней доле гипофиза анэстриальных овец. Аним Репродукция Науки 120, 105–111 (2010). [PubMed] [Академия Google]
84. Умлавска В., Прусек-Дудкевич А. Задержка роста и задержка полового созревания у детей и подростков с ювенильным идиопатическим артритом. Arch Med Sci 6, 19–23 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Leon LR, White AA, Kluger MJ, Роль IL-6 и TNF в терморегуляции и выживании при сепсисе у мышей. Американский журнал физиологии
275, Р. 269–277 (1998). [PubMed] [Google Scholar]
Американский журнал физиологии
275, Р. 269–277 (1998). [PubMed] [Google Scholar]
86. Бланк Т и др., Эндотелиально- и эпителиально-специфическая цепь рецепторов интерферона головного мозга 1 вызывает вызванное вирусом болезненное поведение и когнитивные нарушения. Иммунитет 44, 901–912 (2016). [PubMed] [Google Scholar]
87. Laurencikiene J et al., NF-kappaB важен для индуцированного TNF-альфа липолиза в адипоцитах человека. Журнал исследований липидов 48, 1069–1077 (2007). [PubMed] [Google Scholar]
88. Хотамислигил Г.С., Шаргилл Н.С., Шпигельман Б.М. Жировая экспрессия фактора некроза опухоли-альфа: прямая роль в резистентности к инсулину, связанной с ожирением. Наука 259, 87–91 (1993). [PubMed] [Google Scholar]
89. Парк С и др., Ингибирующее действие стрептозотоцина, фактора некроза опухоли-альфа и интерлейкина-1бета на активность глюкокиназы в панкреатических островках и экспрессию генов GLUT2 и глюкокиназы. Арх Биохим Биофиз 362, 217–224 (1999). [PubMed] [Google Scholar]
90. de La Serre CB, de Lartigue G, Raybould HE, Хроническое воздействие низких доз бактериального липополисахарида ингибирует передачу сигналов лептина в афферентных нейронах блуждающего нерва. Физиол Поведение
139, 188–194 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
de La Serre CB, de Lartigue G, Raybould HE, Хроническое воздействие низких доз бактериального липополисахарида ингибирует передачу сигналов лептина в афферентных нейронах блуждающего нерва. Физиол Поведение
139, 188–194 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Feingold KR et al., FGF21 повышается под действием воспалительных стимулов и защищает мышей ob/ob с дефицитом лептина от токсичности сепсиса. Эндокринология 153, 2689–2700 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Ноногаки К. и др., интерлейкин-6 стимулирует секрецию триглицеридов печенью у крыс. Эндокринология 136, 2143–2149 (1995). [PubMed] [Google Scholar]
93. Тджердема Н. и др. Воспаление увеличивает уровень ангиопоэтиноподобного белка 4 в плазме у пациентов с метаболическим синдромом и диабетом 2 типа. BMJ Open Diabetes Res Care 2, e000034 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Ван А.
и др. Противоположные эффекты метаболизма натощак на толерантность тканей при бактериальном и вирусном воспалении. Клетка
166, 1512–1525 гг.
е1512 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка
166, 1512–1525 гг.
е1512 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Лихтенштейн Л. et al., Angptl4 защищает от тяжелых провоспалительных эффектов насыщенных жиров, ингибируя поглощение жирных кислот макрофагами мезентериальных лимфатических узлов. Сотовый метаб 12, 580–592 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Бадд А. и др., Повышение выживаемости после лечения гемфиброзилом тяжелого мышиного гриппа. Антимикробные препараты и химиотерапия 51, 2965–2968 (2007). [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Camara-Lemarroy CR и др., гемфиброзил ослабляет воспалительную реакцию и защищает крыс от абдоминального сепсиса. Экспериментальная и терапевтическая медицина 9, 1018–1022 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Kim DY и др., Кетоновые тела защищают нейроны неокортекса от окислительного стресса. Журнал нейрохимии 101, 1316–1326 (2007). [PubMed] [Google Scholar]
99. Симадзу Т.
и др., Подавление окислительного стресса с помощью β-гидроксибутирата, эндогенного ингибитора гистондеацетилазы. Наука
339, 211–214 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Симадзу Т.
и др., Подавление окислительного стресса с помощью β-гидроксибутирата, эндогенного ингибитора гистондеацетилазы. Наука
339, 211–214 (2013). [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Рахман М. et al., Рецептор β-гидроксибутирата HCA2 активирует нейропротективное подмножество макрофагов. Нац Коммуна 5, (2014). [PubMed] [Академия Google]
101. Сингх Н. и др., Активация Gpr109a, рецептора ниацина и комменсального метаболита бутирата, подавляет воспаление толстой кишки и канцерогенез. Иммунитет 40, 128–139 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Youm YH и др., Метаболит кетона бета-гидроксибутират блокирует воспалительное заболевание, опосредованное NLRP3. Нат Мед 21, 263–269 (2015). [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Du W, Amarachintha S, Wilson AF, Pang Q, SCO2 опосредует вызванный окислительным стрессом гликолиз на переключение окислительного фосфорилирования в гемопоэтических стволовых клетках.

