Состав протеина? | stalevar.com.ua — cпортивное питание
Состав протеина?
Протеины – это простые белки, которые относятся к сложным высокомолекулярным органическим веществам. Белки снабжают организм энергией. Их не заменят ни углеводы, ни жиры. В течение дня человек тратит много энергии, которую получает из пищевых продуктов. Во время непрерывного процесса обмена веществ происходит реакция расщепления белков и их потеря с потом и мочой. Людям с малой активностью достаточно около 1,5 грамма белка на килограмм веса в день, а спортсменам потребуется 2-3раза больше граммов, так что люди, ведущие активный образ жизни, занимающиеся спортом, нуждаются в дополнительных источниках энергии. Обычно килокалориями организм снабжается продуктами питания, но они не могут обеспечить необходимой комбинацией белков, углеводов и жиров. Эти дополнительные калории дают им специально разработанные пищевые добавки, то есть протеины. Протеин в переводе с английского языка означает белок. Он особенно необходим спортсменам-бодибилдерам, атлетам, занимающимся силовыми видами спорта, которые хотят, чтобы их мускулы стали упругими, рельефными. Чтобы добиться желаемого результата, спортсмены интенсивно тренируются и тратят много энергии. Протеины как концентрированное средство, заменяют им белки животного и растительного происхождения.
Чтобы добиться желаемого результата, спортсмены интенсивно тренируются и тратят много энергии. Протеины как концентрированное средство, заменяют им белки животного и растительного происхождения.
Виды протеина и их состав
Протеин, созданный искусственным способом, не содержит в себе вредные химические вещества. Получают его по принципу создания смесей для детского питания, поэтому в нем нет угрозы здоровью спортсменов.
Бодибилдеры пользуются обычно 3 –мя видами протеина:
- сывороточным;
- казеиновым;
- соевым.
Первые два вида по составу относятся к животным белкам, а соевый протеин – представитель растительного белка. Они обладают эффективностью и удобством в применении.
Сывороточный белок
Сывороточный протеин давно стал популярным видом источником белка. Он отличается способностью быстро активизироваться и вызвать усиление метаболизма в мышцах, помогает в поддержании чистой мышечной массы. Такой вид протеина выделяется из коровьего молока с применением особой технологии. В составе коровьего молока соотношение сыворотки и казеина бывает 80% к 20%. Технология перекрестной фильтрации дает возможность получения высококачественного продукта без жира и лактозы, с сохранением биоактивных пептидов.
Такой вид протеина выделяется из коровьего молока с применением особой технологии. В составе коровьего молока соотношение сыворотки и казеина бывает 80% к 20%. Технология перекрестной фильтрации дает возможность получения высококачественного продукта без жира и лактозы, с сохранением биоактивных пептидов.
На рынке спортивного питания выделяются два типа протеина из сыворотки:
- в виде концентрата;
- изолята.
Первый из них считается не самым чистым продуктом, так содержание белка в нем составляет от 40 до 80 %. При изготовлении его пользуются простой технологией. В процессе выделения из сыворотки белка лактоза и жиры в ней остаются. Изолят протеина является более чистым по составу порошком, содержание белка в нем доходит до 90%. В нем нет лактозы и жиров, которые мешают усвоению белка.
Состав протеина из сыворотки содержит много аминокислот с разветвленными цепями ВССА, протеин обогащен витаминами, микроэлементами железом и фосфором, калием и натрием, а также кальцием, важным для строения костей.
Например, протеин Syntha-6 состоит из шести высококачественных белков:
- концентрата сывороточного протеина;
- изолята сывороточного протеина;
- казеината кальция;
- мицеллярного казеина;
- изолята молочного протеина;
- яичного альбумина.
Глютамин- аминокислота, с ее помощью мышцы набирают массу. Бромелаин и папаин в составе способствуют быстрому усвоению протеина для подпитки мышечной массы.
В составе Optimum Nutrition Opti-Men содержится 8 самых основных аминокислот , 8 видов экстрактов различных фруктов, 25 витаминов и минеральные вещества, в числе которых группа витаминов В, цинк, медь, селен, кальций, марганец, инк и другие. Сывороточный вид протеин ценится спортсменами за качество, он идеальный вариант для компенсирования дефицита белков не только после тренировок, но и после них.
Казеиновый протеин
Казеиновый протеин получают створаживанием молока, который в желудке переваривается долгое время и обеспечивает организм человека важными аминокислотами. Он подавляет аппетит, его употребляет больше всего опытные спортсмены для сжигания жира и сохранения мышц. Казеин принимают на ночь, так как он усваивается в течение 6-7 часов, его применяют те, кто страдает от аллергии на яйца. Казеином пользуются женщины для снижения веса, применяя его вместо обеда или ужина, потому что он надолго дает чувство сытости.
Он остоит из:
Триптофана и валина, лейцина, изолейцина, лизина, метионина и аргинина, глицина и других аминокислот. Все они помогают в снятии нервного напряжения и психической усталости после длительных физических тренировок.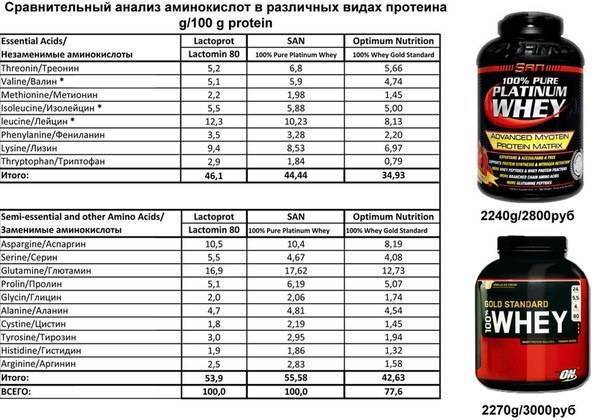 Есть в этом протеине глютамин для роста мышц, аланин для поддержки их тонуса.
Есть в этом протеине глютамин для роста мышц, аланин для поддержки их тонуса.
Соевый протеин
Соевый протеин относится к растительным белкам, в нем мало аминокислот для поступления «строительных кирпичиков» в организм, поскольку содержание белков в нем около 50% в чистом виде.
Но исследованиями последних лет доказано, что в соевом протеине содержится более высокий процент (35%) важных для организма аминокислот, например, лизина и глютамина, а также аргинина, которые играют большую роль в выработке энергии в мышцах, в укреплении иммунитета. Лизин является компонентом соединительной ткани, помогает усвоению кальция. Эти аминокислоты облегчают последствия напряженных тренировок.
В сое аминокислоты метионина мало, но сейчас многие производители соевого протеина добавляют его в состав спортивного питания. Поэтому соевые пищевые добавки не отстают по качеству от молочных и яичных протеинов.
Опасные ингредиенты протеина
Перед выбором протеина надо внимательно изучить состав смеси, потому что производители добавляют разные вещества, которые могут нанести вред здоровью. Спортсмены знают, что, кроме белков, углеводы тоже нужны в процессе набора мышечной массы, которые выполняют энергетическую, транспортную и защитную функцию. Именно поэтому они присутствуют в составе многих пищевых добавок для спортсменов и не представляют опасность организму.
Спортсмены знают, что, кроме белков, углеводы тоже нужны в процессе набора мышечной массы, которые выполняют энергетическую, транспортную и защитную функцию. Именно поэтому они присутствуют в составе многих пищевых добавок для спортсменов и не представляют опасность организму.
Для придания сладкого вкуса протеину некоторые производители добавляют небольшое количество сахара. В таких минимальных количествах сахар в протеине вреда не приносит. Но в дешевых БАДах содержится вредный для организма сахарозаменитель аспартам, с помощью которого производители хотят подсластить и замаскировать вкус добавки. Таурин добавляется с целью, чтобы спортсмен чувствовал прилив энергии. Но постоянная подпитка организма стимуляторами может привести к проблемам со сном. Нежелательно присутствие в составе протеина загустителей типа каррагенана и ксантановой камеди, добавляют их сделать продукт более густым. Но они просто заполняют желудок и ухудшают усвояемость протеина. К выбору протеина надо относиться со всей серьезностью. Любой его вид следует применить, заранее изучив его свойства, только тогда он будет помогать во время длительных тренировок.
Любой его вид следует применить, заранее изучив его свойства, только тогда он будет помогать во время длительных тренировок.
Так же вы можете получить консултацию и приобрести нужную вам продукцию по номеру телфона:
МТС:
+38 (095) 874-48-84
Киевстар:
+38 (096) 834-48-84
Статьи – АКАДЕМИЯ-Т
Протеин представляет собой полезный белок, который обладает высокой степенью как пищевой, так и биологической ценности. Очень многие производители стараются добавлять в протеиновые смеси дополнительные витамины и минералы. Основной задачей белка является восстановление и увеличение мышечной массы тела человека.
Основные виды протеина по сырьевой классификации:
- сывороточный протеин – содержит большое количество важных аминокислот, за cчет чего восстанавливает организм после тренировки или сна;
- яичный – самый высокий по степени усвояемости человеком;
- казеин – обеспечивает дополнительную «подпитку»;
- соевый – понижает уровень холестерина, является заменителем для молочной продукции;
- коллагеновый – способствует быстрому восстановлению суставов, соединительных тканей, связок и кожных покровов; дополнительно применяется в протеиновых смесях;
- молочный – сохраняет особенности сывороточных и казеиновых веществ в соотношении 20/80%.

Помимо основных оздоровительных качеств, правильный состав белковой смеси позволяет набрать дополнительную мышечную массу тем, кто хочет иметь идеальную фигуру – в этом случае белковые смеси просто незаменимы. Немаловажным является то, что употребляя протеины можно восстановить иммунитет и здоровье.
Коктейли с белковыми добавками сегодня не просто актуальны, они стали доступны не только для спортсменов, а для каждого, кто следит за своим здоровьем и телом.
Правильное употребление белка позволяет создать необходимый фундамент для дальнейшего образования мышц. Естественно одним приемом протеина не нарастишь необходимую массу, исходя из чего, следует использовать комплексные программы по питанию и тренировкам, включать в рацион дополнительные витамины, минералы. Однако почему именно протеин считается основным и фундаментальным элементом питания спортсменов?
Аминокислотный состав протеина представляется в двадцати наименованиях соединений, которые делятся на незаменимые и заменимые: лейцин, изолейцин, валин, гистидин, лицин, метионин, треонин, триптофан; цистин, серин, тирозин, глютамин, глютаминовая кислота, пролин, ланин, аргенин, глицин, аспарагин и аспарагиновая кислота.
Помимо этого, по аминокислотному составу белки делят на: полноценные, неполноценные, простые и сложные. Каждый тип определяет необходимую степень воздействия на организм.
Естественно, можно сделать только один вывод – протеин очень важен для организма каждого человека, для его физической подготовки и здоровья. При употреблении в комплексе должны выполняться постоянные тренировки, физические нагрузки и особенно правильное питание.
Следует так же помнить, что качественный белковый порошок следует брать у проверенных отечественных производителей, которые тщательно проводят исследования и выпускают лучшие смеси. В здоровом теле – здоровый дух.
Весь список акций ПоделитьсяДругие акции
Как похудеть просто и доступно
10 правил безопасного применения витаминов и минералов
Набор массы, особенности питания и тренировок
Пищевые волокна что такое и для чего
Связанные товары
Подписаться
Подробнее
Подробнее
Подписаться
Подробнее
Подробнее
В корзину
Подробнее
В корзину
Подробнее
В корзину
Подробнее
Белковый состав и структура — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1346
 Белки имеют первичную, вторичную и третичную структуру. Первичная структура состоит из аминокислот, которые связаны пептидными связями и образуют линейные цепи полипептидов. Вторичная структура состоит из полипептидных цепей, которые складываются в трехмерные структуры. Третичные структуры представляют собой водорастворимые белки, которые конденсируются в компактные структуры.
Белки имеют первичную, вторичную и третичную структуру. Первичная структура состоит из аминокислот, которые связаны пептидными связями и образуют линейные цепи полипептидов. Вторичная структура состоит из полипептидных цепей, которые складываются в трехмерные структуры. Третичные структуры представляют собой водорастворимые белки, которые конденсируются в компактные структуры.- Вторичная структура полипептидной цепи
- График Рамачандрана
- α-спирали
- α-спираль
- β-складчатые листы
- α-складчатые листы
- Третичная структура
- Четвертичная структура
Белковые структуры
• Первичная структура (линейный полимер аминокислот)
(скреплены пептидными связями)
• Вторичная структура (стандартные трехмерные модели)
(а-спираль, ß-лист, удерживаемые Н-связями между атомами основной цепи)
• Третичная структура (детальная трехмерная конформация)
(связи между атомами боковой цепи)
• Четвертичная структура (комбинированная полимерные цепи)
Вторичная структура полипептидной цепи
Вторичная структура относится к форме сворачивающегося белка, обусловленного исключительно водородными связями между амидной и карбонильной группами его основной цепи.
Двумя наиболее часто встречающимися вторичными структурами полипептидной цепи являются альфа-спирали и бета-складчатые листы. Эти структуры являются первыми основными шагами в сворачивании полипептидной цепи, и они устанавливают важные топологические мотивы, которые определяют последующую третичную структуру и окончательную функцию белка.
Пептидные связи влияют на вторичную структуру
Напомним, что плоская амидная связь ограничивает плоскости изгибов цепи: нет вращения вокруг связей CO-N, но плоскости вращаются вокруг
Связи α-C-N (Φ) и α-C-C=O (Ψ)
График Рамачандрана
Показывает группировку комбинаций φψ и связывает их со структурами в реальных белках. Часто встречаются повторяющиеся структуры (α-спирали, β-листы)
http://commons.wikimedia.org/wiki/Fi…neral_100K. jpg
jpg
α-спирали
спираль аминокислотных остатков на полипептидной цепи, обычно в пределах от 4 до 40 остатков. Этот виток удерживается вместе водородными связями между кислородом C=O в верхнем витке и водородом NH в нижнем витке. Такая водородная связь образуется ровно через каждые 4 аминокислотных остатка, а каждый полный оборот спирали составляет всего 3,6 аминокислотных остатка. Этот регулярный рисунок придает альфа-спирали весьма определенные черты в отношении толщины витка и длины каждого полного витка вдоль оси спирали.
Структурная целостность альфа-спирали частично зависит от правильной стерической конфигурации. Аминокислоты, у которых R-группы слишком велики (триптофан, тирозин) или слишком малы (глицин), дестабилизируют альфа-спирали. Пролин также дестабилизирует альфа-спирали из-за своей неправильной геометрии; его R-группа снова связывается с азотом амидной группы, что вызывает стерические затруднения. Кроме того, отсутствие водорода в азоте пролина не позволяет ему участвовать в образовании водородных связей.
Другим фактором, влияющим на стабильность альфа-спирали, является общий дипольный момент всей спирали за счет отдельных диполей групп С=О, участвующих в водородных связях. Стабильные альфа-спирали обычно заканчиваются заряженной аминокислотой для нейтрализации дипольного момента.
α-спираль
- 3,6 аминокислоты на виток
- 0,54 нм на виток
- боковые цепи указаны
- Н-связи параллельны оси
- n-4 Н-связи
- дипольный момент (отрицательный при C конец)
- нет про, менее гли, сер
- ограничено сходные заряды боковых цепей
α-спирали имеют дипольный момент; некоторые боковые цепи являются предпочтительными
β
— СКЛАДИРОВАННЫЕ ЛИСТЫЭта структура возникает, когда два (или более, например, пси-петля) сегмента полипептидной цепи накладываются друг на друга и образуют ряд водородных связей друг с другом. Это может происходить при параллельном расположении:
Или при встречно-параллельном расположении:
Параллельное и антипараллельное расположение является прямым следствием направленности полипептидной цепи. При антипараллельном расположении С-конец одного сегмента находится на той же стороне, что и N-конец другого сегмента. При параллельном расположении С-конец и N-конец находятся на одних и тех же сторонах для обоих сегментов. «Складка» возникает из-за чередующихся плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию с обращенной друг к другу на обращенную в противоположных направлениях.
При антипараллельном расположении С-конец одного сегмента находится на той же стороне, что и N-конец другого сегмента. При параллельном расположении С-конец и N-конец находятся на одних и тех же сторонах для обоих сегментов. «Складка» возникает из-за чередующихся плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию с обращенной друг к другу на обращенную в противоположных направлениях.
Параллельное расположение менее стабильно, потому что геометрия отдельных молекул аминокислот вынуждает водородные связи располагаться под углом, что делает их более длинными и, следовательно, более слабыми. Наоборот, при антипараллельном расположении водородные связи располагаются прямо напротив друг друга, что делает связи более прочными и стабильными.
Обычно антипараллельный бета-складчатый слой образуется, когда полипептидная цепь резко меняет направление. Это может происходить в присутствии двух последовательных остатков пролина, которые создают угловой изгиб в полипептидной цепи и загибают ее обратно на себя. Это не обязательно для отдаленных сегментов полипептидной цепи, чтобы сформировать бета-складчатые листы, но для проксимальных сегментов это является определенным требованием. На коротких расстояниях два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, причем 4 — минимальное количество остатков.
Это не обязательно для отдаленных сегментов полипептидной цепи, чтобы сформировать бета-складчатые листы, но для проксимальных сегментов это является определенным требованием. На коротких расстояниях два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, причем 4 — минимальное количество остатков.
Обратный поворот (ß-изгиб):
- R2 (сторона C=O) часто G,A
- R3 (сторона N-H) часто D
- Proline часто R2 или R3
α
— СКЛАДИРОВАННЫЕ ЛИСТЫ Структура, аналогичная бета-складчатому листу, представляет собой альфа-складчатый лист. Эта структура энергетически менее выгодна, чем бета-складчатый лист, и довольно редко встречается в белках. Альфа-складчатый лист характеризуется выравниванием карбонильных и аминогрупп; все карбонильные группы выровнены в одном направлении, а все группы NH выровнены в противоположном направлении. Поляризация амино- и карбонильных групп приводит к чистому дипольному моменту на альфа-складчатом листе. Карбонильная сторона приобретает суммарный отрицательный заряд, а амино-сторона приобретает суммарный положительный заряд.
Карбонильная сторона приобретает суммарный отрицательный заряд, а амино-сторона приобретает суммарный положительный заряд.
Третичная структура
http://commons.wikimedia.org/wiki/fi…_structure.png
Тертичная структура включает в себя связи между и между боковыми частями:
•-Hyduriary-a-H-H-H-HID-H-H-HID-H-H-HID-HANS (
. -)
•Ионные (обычно отталкивающие: -Ch3-Nh5+:::::::+h5N-Ch3-)
• Ван-дер-Ваальсовы (ближнее притяжение)
• Дисульфидные (ковалентные: -Ch3-S-S- Ch3-)
• Гидрофобный
Третичные связи влияют на положение вторичных структур.
А положение вторичной структуры в белке будет влиять на типы боковых цепей (третичная структура).
α-спираль на поверхности белка будет иметь гидрофильные боковые цепи с одной стороны оси спирали и гидрофобные боковые цепи с другой. α-спираль внутри белка будет иметь в основном гидрофобные боковые цепи. α-спираль, подвергающаяся воздействию раствора со всех сторон (необычно), будет иметь гидрофильные боковые цепи со всех сторон оси спирали (в основном).
Четвертичная структура
Четвертичные структуры включают отдельные полипептиды, удерживаемые вместе слабыми связями различной симметрии
Симметрии:
Гомомультимер::гетеромультимер полипептидные цепи, содержащие два или более идентичных компонента
гетеромультимер : белок с несколькими полипептидными цепями, содержащий два или более различных компонента
Изологичный::гетерологичный
Closed::open
Сворачивание белка снижает свободную энергию (ΔG) системы.
Сворачивание белка включает в себя как белок, так и растворитель.
ΔG = GF- GU
= ΔH — TΔS
=
+ ΔH(белок)
+ ΔH(растворитель)
— TΔS(белок)
— TΔS (растворитель)
ΔG для фолдинг
мал (от -20 до -60 кДж/моль) и в основном за счет гидрофобных взаимодействий
Почему так мало?
Изменения формы являются важной частью функции белка и контроля. Например: изменение формы позволяет ДНК-метилтрансферазе выбирать полуметилированный me CG/GC для биметилирования до me CG/Gme C
Protein Composition and Structure распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать оглавление
- нет
- Теги
- Вет1
Четыре типа белковой структуры
Классификация белков Первичная структура белка Вторичная структура белка Третичная структура белка Четвертичная структура белка
Белковые структуры образуются путем конденсации аминокислот с образованием пептидных связей. Последовательность аминокислот в белке называется его первичной структурой. Вторичная структура определяется двугранными углами пептидных связей, третичная структура складкой белковых цепей в пространстве. Ассоциация свернутых полипептидных молекул со сложными функциональными белками приводит к четвертичной структуре.
Вторичная структура определяется двугранными углами пептидных связей, третичная структура складкой белковых цепей в пространстве. Ассоциация свернутых полипептидных молекул со сложными функциональными белками приводит к четвертичной структуре.
Определение структуры белка
Структура белка определяется как полимер аминокислот, соединенных пептидными связями.
Связанные темы
- Аминокислоты
- Пептидная связка
- Денатурация белков
- Ферменты
- Гормоны
Давайте посмотрим, как образуется пептидная связь из следующей реакции:
Образование пептидной связи
Таким образом, мы видим, что пептидная связь (-CO-NH) образуется между аминогруппой одной молекулы и карбоксильной группой соседней молекулы с последующим отщеплением молекулы воды. В противном случае эта связь является амидной связью. Когда пептидные связи устанавливаются между более чем десятью аминокислотами, они вместе образуют полипептидную цепь. Очень часто, когда полипептидная цепь имеет массу более 10000 ед и количество аминокислот в цепи более 100, мы получаем белок.
Очень часто, когда полипептидная цепь имеет массу более 10000 ед и количество аминокислот в цепи более 100, мы получаем белок.
Читайте также: Денатурация белков
Рекомендуемые видео
Классификация белков
В зависимости от молекулярной формы белки можно разделить на два типа.
1. Волокнистые белки:
Когда полипептидные цепи идут параллельно и удерживаются вместе водородными и дисульфидными связями, формируется волокнообразная структура. Такие белки обычно нерастворимы в воде. Это водонерастворимые белки.
Пример – кератин (присутствует в волосах, шерсти и шелке) и миозин (присутствует в мышцах) и т. д.
2. Глобулярные белки:
Эта структура получается, когда цепи полипептидов обвиваются вокруг , придавая сферическую форму. Обычно они растворимы в воде.
Пример – Инсулин и альбумины являются распространенными примерами глобулярных белков.
Уровни белковой структуры
1. Первичная структура белка
- Первичная структура белков – это точное упорядочение аминокислот, образующих их цепи.
- Точная последовательность белков очень важна, поскольку она определяет окончательную укладку и, следовательно, функцию белка.
- Количество полипептидных цепей, вместе образующих белки. Эти цепи имеют аминокислоты, расположенные в определенной последовательности, характерной для конкретного белка. Любое изменение в последовательности изменяет весь белок.
На следующем рисунке представлена первичная структура белка (аминокислотная цепь). Как и следовало ожидать, последовательность аминокислот в полипептидной цепи имеет решающее значение для правильного функционирования белка. Эта последовательность зашифрована в генетическом коде ДНК. Если в ДНК присутствует мутация и изменена аминокислотная последовательность, это может повлиять на функцию белка.
Первичная структура белка представляет собой последовательность аминокислот в его полипептидной цепи. Если бы белки были нитками для попкорна, предназначенными для украшения рождественской елки, то первичная структура белка — это последовательность, в которой различные формы и сорта воздушной кукурузы нанизаны друг на друга.
Если бы белки были нитками для попкорна, предназначенными для украшения рождественской елки, то первичная структура белка — это последовательность, в которой различные формы и сорта воздушной кукурузы нанизаны друг на друга.
Ковалентные пептидные связи, соединяющие аминокислоты вместе, поддерживают первичную структуру белка.
Все задокументированные генетические нарушения, такие как муковисцидоз, серповидно-клеточная анемия, альбинизм и т. д., вызваны мутациями, приводящими к изменениям первичных белковых структур, которые, в свою очередь, приводят к изменениям вторичной, третичной и, возможно, четвертичной структуры.
Аминокислоты представляют собой небольшие органические молекулы, состоящие из хирального углерода с четырьмя заместителями. Из них только четвертая боковая цепь отличается среди аминокислот.
2. Вторичная структура белка
Вторичная структура белка относится к локальным складчатым структурам, которые образуются внутри полипептида благодаря взаимодействиям между атомами остова.
- Белки существуют не только в виде простых цепочек полипептидов.
- Эти полипептидные цепи обычно складываются за счет взаимодействия между аминогруппой и карбоксильной группой пептидного звена.
- Структура относится к форме, в которой может существовать длинная полипептидная цепь.
- Обнаружено, что они существуют в двух различных типах структур α – спиральных и β – гофрированных листовых структур.
- Эта структура возникает из-за регулярной укладки остова полипептидной цепи за счет водородных связей между группами -CO и -NH пептидной связи.
- Однако сегменты белковой цепи могут приобретать собственную локальную складку, которая гораздо проще и обычно имеет форму спирали, вытянутой формы или петли. Эти локальные складки называются вторичными элементами и образуют вторичную структуру белков.
(а) α – спираль:
α — Спираль — это один из наиболее распространенных способов, при котором полипептидная цепь образует все возможные водородные связи, закручиваясь в правый винт, при этом группа -NH каждого аминокислотного остатка связана водородной связью с -CO соседнего витка. спирали. Полипептидные цепи закручены в правый винт.
спирали. Полипептидные цепи закручены в правый винт.
(b) β – гофрированный лист:
При таком расположении полипептидные цепи вытянуты одна рядом с другой, а затем связаны межмолекулярными Н-связями. В этой структуре все пептидные цепи вытянуты почти до максимального растяжения, а затем уложены бок о бок, что удерживается вместе межмолекулярными водородными связями. Структура напоминает складчатые складки драпировки и поэтому известна как β – складчатый лист 9.0360
3. Третичная структура белка
- Эта структура возникает в результате дальнейшего сворачивания вторичной структуры белка.
- Н-связи, электростатические силы, дисульфидные связи и силы Вандер-Ваальса стабилизируют эту структуру.
- Третичная структура белков представляет собой общую укладку полипептидных цепей, дальнейшую укладку вторичной структуры.
- Он дает две основные молекулярные формы, называемые волокнистой и шаровидной.
- Основными силами, стабилизирующими вторичную и третичную структуры белков, являются водородные связи, дисульфидные связи, ван-дер-ваальсовы и электростатические силы притяжения.

4. Четвертичная структура белка
Пространственное расположение различных третичных структур порождает четвертичную структуру. Некоторые белки состоят из двух или более полипептидных цепей, называемых субъединицами. Пространственное расположение этих субъединиц по отношению друг к другу известно как четвертичная структура.
Точная аминокислотная последовательность каждого белка заставляет его сворачиваться в собственную уникальную и биологически активную трехмерную складку, также известную как третичная структура. Белки состоят из различных комбинаций вторичных элементов, одни из которых являются простыми, а другие более сложными. Части белковой цепи, которые имеют свою трехмерную складку и могут быть отнесены к какой-либо функции, называются «доменами» . Сегодня они считаются эволюционными и функциональными строительными блоками белков.
Многие белки, большинство из которых являются ферментами, содержат органические или элементарные компоненты, необходимые для их активности и стабильности. Таким образом, изучение эволюции белков дает не только представление о структуре, но и связывает белки из совершенно разных звеньев метаболизма.
Таким образом, изучение эволюции белков дает не только представление о структуре, но и связывает белки из совершенно разных звеньев метаболизма.
Читайте также: Лабораторный анализ белков
Правила строения белка
- Тип определяет функцию белка.
- Форма белка определяется его первичной структурой (аминокислотной последовательностью).
- Аминокислотная последовательность в белке определяется кодирующей последовательностью нуклеотидов в гене (ДНК).
Краткая информация о структуре белка
Linderstrom-Lang (1952), в частности, впервые предложил иерархию белковой структуры с четырьмя уровнями: центральным, вторичным, третичным и четвертичным. Вы уже знакомы с этой иерархией, потому что эта структурная группировка является наиболее полезной отправной точкой для изучения базовой структуры белка.
- Первичная структура белка представляет собой базовый уровень иерархии и представляет собой особую линейную последовательность аминокислот, включающую одну полипептидную цепь.

- Вторичная структура представляет собой следующий уровень по сравнению с первичной структурой и представляет собой регулярное складывание областей в определенные структурные паттерны внутри одной полипептидной цепи. Водородные связи между карбонильным кислородом и амидным водородом пептидной связи обычно удерживаются вместе вторичными структурами.
- Третичная структура представляет собой следующий уровень после вторичной структуры и представляет собой конкретное трехмерное расположение всех аминокислот в одной полипептидной цепи. Эта структура обычно конформационная, нативная и активная и удерживается вместе за счет множественных нековалентных взаимодействий.
- Четвертичная структура представляет собой следующую «ступеньку» между двумя или более полипептидными цепями по сравнению с третичной структурой и представляет собой специфическое пространственное расположение и взаимодействие.
Часто задаваемые вопросы – Часто задаваемые вопросы
Q1
Из чего состоит структура белка?
Первичная структура белка относится к последовательности аминокислот в полипептидной цепи. Пептидные связи, образующиеся в процессе биосинтеза белка, удерживают первичную структуру вместе.
Пептидные связи, образующиеся в процессе биосинтеза белка, удерживают первичную структуру вместе.
Q2
Каковы 4 стадии структуры белка?
Четыре уровня строения белков. Основные, вторичные, третичные и четвертичные уровни структуры белка представляют собой четыре стадии. Чтобы полностью понять, как функционирует белок, полезно понять назначение и роль каждого уровня белковой структуры.
Q3
Что такое процесс сворачивания белка?
Сворачивание белков — это механизм, посредством которого структура белка принимает свою функциональную форму или конформацию. Обе молекулы белка представляют собой гетерогенные неразветвленные цепи аминокислот. Они могут выполнять свою биологическую функцию, скручиваясь и складываясь в определенную трехмерную форму.
Q4
Как образуются белки?
Аминокислоты образуют полипептид. Другими словами, когда аминокислоты связаны последовательностью пептидных связей, это приводит к образованию белков. Затем полипептид сворачивается в определенную конформацию на основе взаимодействий (напряженные линии) между его боковыми цепями аминокислот.
Затем полипептид сворачивается в определенную конформацию на основе взаимодействий (напряженные линии) между его боковыми цепями аминокислот.
Q5
Является ли ДНК белком?
ДНК часто связана с белками в ядре, называемыми гистонами, но сама по себе ДНК не является белком. Нет. ДНК представляет собой нуклеиновую кислоту, состоящую из фосфатных и сахарных групп, оснований (пуриновых и пиримидиновых), а белки представляют собой большие молекулы, состоящие из одной или нескольких длинных цепочек аминокислот.
Q6
Что стабилизирует структуру белка?
Водородные связи в полипептидной цепи и между группами «R» аминокислот помогают сохранить структуру белка, удерживая белок в форме, образованной гидрофобными взаимодействиями. Такого рода связи образуют так называемые дисульфидные мостики.
Q7
Что определяет структуру белка?
В полипептидной цепи основная структура белка связана с аминокислотной последовательностью.

