Протеин. Свойства, виды, применение.
Протеин в переводе с англ. «protein» — это белок. Основополагающий элемент при строительстве тканей в организме, в том числе мышечной. Протеин — это совокупность заменимых и незаменимых аминокислот, соединенных между собой. В спорте под протеином подразумевает — спортивную добавку, состоящую из высокой концентрации белка.
Это полностью натуральный продукт, полученный из белков растительного и животного происхождения!
Виды протеина
В зависимости от происхождения протеин делят на:
1.Сывороточный протеин.- концентрат
- изолят
- гидролизат
- казеинат кальция
- мицеллерный казеин
- Соевый
- конопляный
- бобовый
- гороховый
5. Рыбный протеин.

6. Яичный протеин.Сывороточный протеин (whey protein)
Самый популярный на сегодняшний день продукт спортивного питания — это сывороточный протеин. Он изготавливается из обычной молочной сыворотки, путем удаления жиров и других небелковых элементов в процессе фильтрации. Сывороточный протеин является быстроусвояемым, поэтому идеален для употребления до и после тренировки. Он активизирует обмен веществ, замедляет усвоение жиров и насыщает организм нужными аминокислотами для строительства мышц.
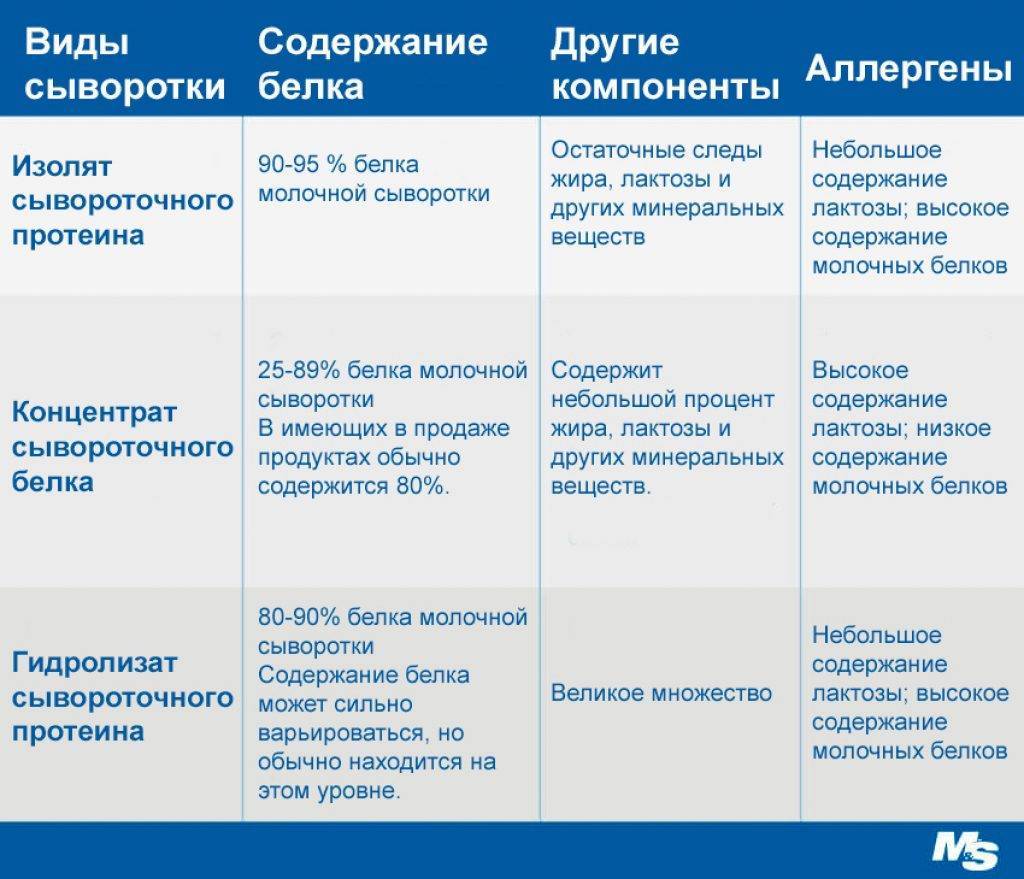
В зависимости от концентрации белка и степени очистки сывороточный протеин бывает следующих видов:
Концентрат сывороточного протеина. Содержит до 80% белка, при этом сохраняет в своем составе небольшое количество жиров и лактозы. Усваивается за 1,5-2 часа.
Сывороточный изолят. Содержит 80-95% белка – такой уровень достигается за счет более глубокой фильтрации. Усваивается за 1-1,5 часа.
 Практически не содержит жиров и лактозы.
Практически не содержит жиров и лактозы.Сывороточный гидролизат. Содержит 90-99% белка и предполагает очень быстрое усвоение (за 1 час). Гидролизат имеет самую высокую биологическую ценность среди сывороточных протеинов. Чем выше концентрация белка в протеиновом порошке, тем дороже его стоимость. Наиболее популярным продуктом на рынке спортивного питания является концентрат сывороточного протеина из-за оптимальной цены и высокой эффективности.
Что нужно знать о сывороточном протеине:
Быстро усваивается, поэтому сывороточный протеин идеален для приема до и после тренировки.
Имеет высокую биологическую ценность.
Содержит практически весь набор важных аминокислот.
Хорошо растворяется, имеет приятный вкус.
Из-за высокой скорости усвоения его нецелесообразно употреблять на ночь и между приемами пищи.
Время «работы» 1-2 часа.
Казеиновый протеин — это «медленный» белок, который усваивается организмом в течение длительного времени.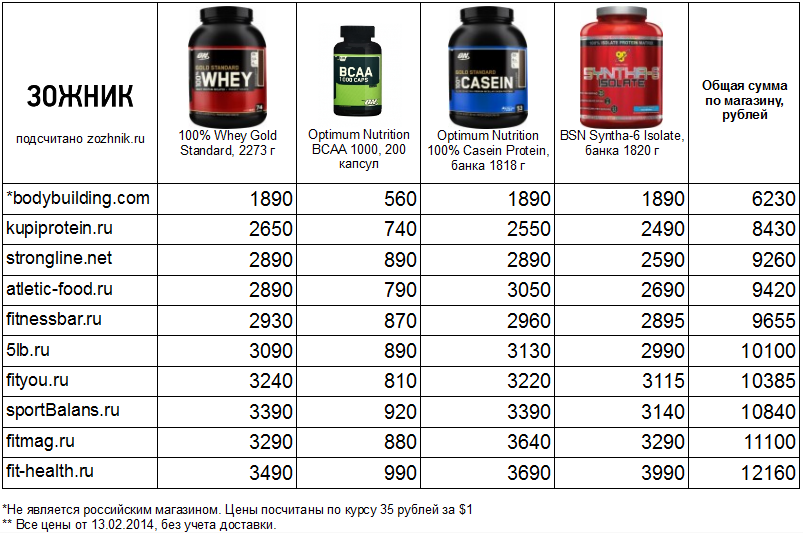 По этой причине он не подходит для употребления до и после тренировки. Казеин также изготавливается из молока: одна его часть идет на изготовление сывороточного протеина, а другая часть – на изготовление казеинового протеина. Из-за низкой скорости усвоения, казеин является идеальным продуктом для употребления перед сном. В течение всей ночи ваши мышцы будут подпитываться «долгоиграющим» белком.
По этой причине он не подходит для употребления до и после тренировки. Казеин также изготавливается из молока: одна его часть идет на изготовление сывороточного протеина, а другая часть – на изготовление казеинового протеина. Из-за низкой скорости усвоения, казеин является идеальным продуктом для употребления перед сном. В течение всей ночи ваши мышцы будут подпитываться «долгоиграющим» белком.
Что нужно знать о казеине:
Медленно всасывается, обеспечивая непрерывный и продолжительный приток аминокислот к мышечным волокнам.
По этой причине казеин идеален для употребления перед сном.
Нежелателен для употребления до и после тренировки.
Казеин богат кальцием.
Относительно других протеинов плохо растворяется, имеет неидеальные вкусовые качества.
Время «работы» 4-10 часов.
Молочный протеин заметно уступает по популярности сывороточному. Этот вид протеина на 20% состоит из сывороточного белка, а на 80% – из казеина. Благодаря тому, что большая часть молочного протеина состоит из медленных белков, его можно употреблять на ночь или между приемами пищи.
Благодаря тому, что большая часть молочного протеина состоит из медленных белков, его можно употреблять на ночь или между приемами пищи.
Что нужно знать о молочном протеине:
Можно употреблять между приемами пищи из-за высокого содержания казеина.
Нежелателен для употребления до и после тренировки.
Содержит лактозу, поэтому не всем подходит из-за особенностей пищеварения.
Имеет невысокую стоимость.
Время «работы» 3-4 часа.
Соевый протеин (Soy Proteine)
Соевый протеин полностью состоит из растительных белков, поэтому его аминокислотный состав не до конца полноценен. Кроме того, он не оказывает такого благоприятного воздействия на рост мышц, как, например, сывороточный протеин. Однако именно соевый протеиновый порошок отлично подходит вегетарианцам и тем, у кого непереносимость молочных продуктов. Соевый протеин обычно выбирают девушки, поскольку он положительно влияет на выработку женских гормонов.
Что нужно знать о соевом протеине:
Имеет неполноценный аминокислотный состав и самую низкую биологическую ценность среди всех вышеназванных белков.
Идеален для женского организма, поскольку соя повышает уровень женских половых гормонов в организме – эстрогенов, одновременно понижая количество тестостерона.
Уменьшает уровень холестерина в организме.
Плохо растворяется в воде, имеет неидеальные вкусовые качества.
Соя – полностью растительный продукт, поэтому подойдет вегетарианцам.
Можно употреблять после тренировки и между приемами пищи.
Время «работы» 3-5 часов
Яичный протеин имеет самуювысокую биологическую ценность, это наиболее приближенный к идеальному белку продукт. Этот вид протеина производится из яичных белков и обладает наивысшей степенью усвояемости. Не пользуется особой популярностью как самостоятельный продукт из-за высокой стоимости. Может подойти тем, у кого непереносимость молочных продуктов.
Что нужно знать о яичном протеине:
Идеален для употребления утром, до и после тренировки.
Имеет самую высокую биологическую ценность
Содержит самый полной набор аминокислот, яичный протеин можно назвать идеальным белком.
Самый дорогой по стоимости.
Время «работы» 3-5 часов.
Многокомпонентный протеин представляет собой смесь различных видов протеина (сывороточного, молочного, яичного, соевого и т.д.), что позволяет сразу получить полный набор различных аминокислот. В отличие от сывороточного он медленнее усваивается, поэтому более универсален в применении. Многокомпонентный протеин подойдет для употребления как после тренировки, так и в течение дня. Такой вид протеина часто имеют в своем составе дополнительные аминокислоты, ВСАА, глютамин, полезные жиры и даже креатин.
Что нужно знать о многокомпонентном протеине:
Можно употреблять после тренировки или между приемами пищи.
У многокомпонентного протеина не самая высокая биологическая ценность.
Имеет невысокую стоимость.
Время «работы» 3-6 часов.
Важно заметить, что каждый вид протеина (не только сывороточный) в зависимости от степени фильтрации может быть изготовлен как концентрат, изолят и гидролизат.
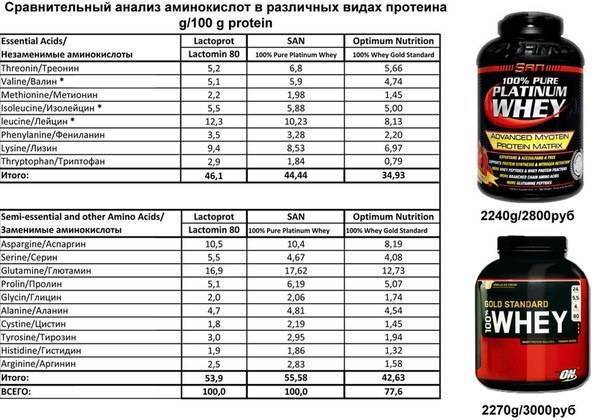
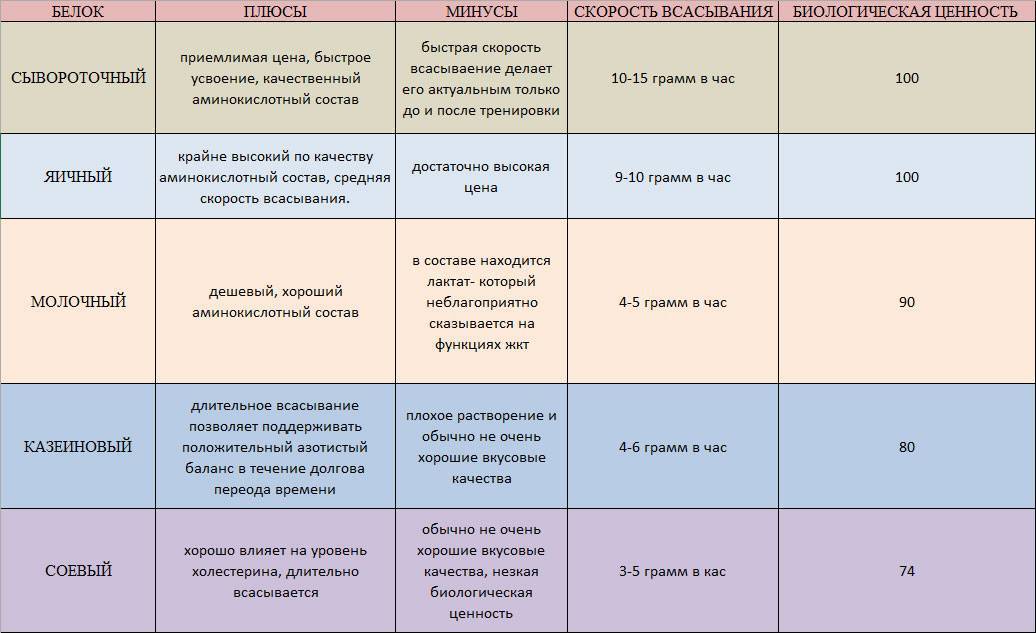
Таблица, где приведены скорость усвоения белков, биологическая ценность, примущества и недостатки.
Сколько белка принимать?Таблица средней суточной нормы белка на 1 кг веса (граммы)
Например, если вы мужчина с весом 60 кг, и ваша цель — набор мышечной массы, то вам необходимо 60 кг (вес тела)*2 гр. = 120 грамм белка минимум потреблять ежедневно, что достичь данную цель.
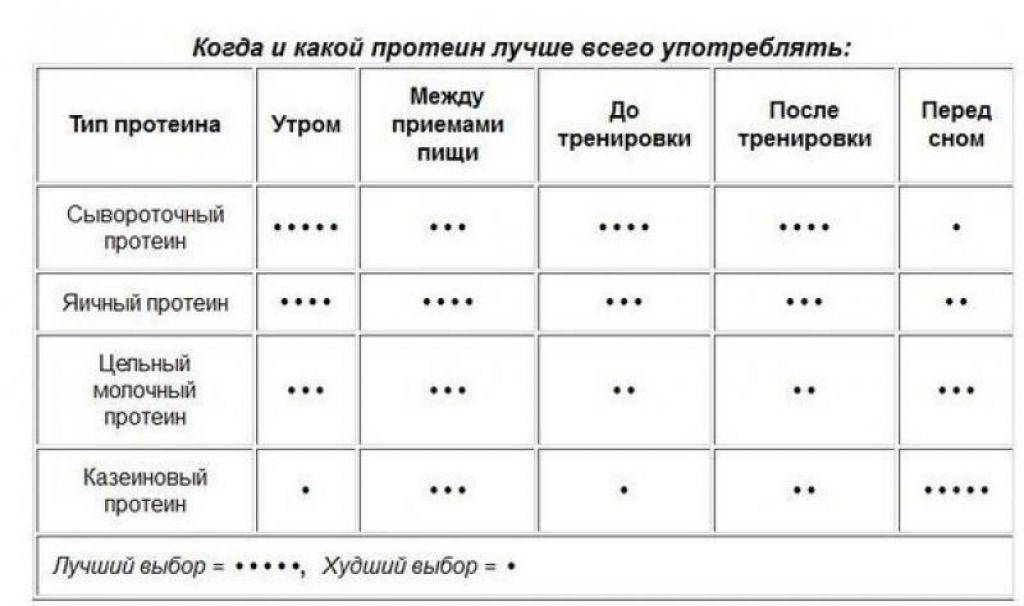
Когда принимать протеин?Таблица оптимально времени приёма протеина.
Все о видах и формах протеина
Белок — это главный строительный материал для тела. Он составляет основу мышечной ткани, поэтому должен обязательно присутствовать в питании спортсменов.
Если не хватает выносливости на тренировке, а после физических нагрузок не остается сил, необходимо ввести в рацион белковые добавки — протеиновые коктейли. Однако большой ассортимент спортивного питания в магазинах сбивает с толку начинающих атлетов. В статье рассказываем, какой бывает протеин и как подобрать смесь для достижения поставленных целей.
В статье рассказываем, какой бывает протеин и как подобрать смесь для достижения поставленных целей.
Классификация добавок по способу очистки
Перед покупкой полезно узнать, как и из чего изготавливается протеин. От этого зависит вкус продукта, скорость его усвоения и действие на организм.
По способу очистки выделяют три основные формы протеина:
- Концентрат. Сырье проходит простую фильтрацию, в результате которой остается 35–85% чистого белка. Концентрат протеина содержит жиры и углеводы. Вещества помогают поддерживать иммунитет и улучшают кровообращение после интенсивных нагрузок. Добавку можно принимать в любое время суток до и после тренировок.
- Изолят. Максимально очищенный продукт без жиров и углеводов, содержит 90–95% белка. Изолят протеина восполняет недостаток аминокислот и усваивается быстрее, чем концентрат, поэтому подходит для приема перед соревнованиями.
- Гидролизат. Продукт отличается высокими степенью очистки и количеством белка — более 90%.
 Гидролизат протеина мгновенно усваивается в организме и дает хороший анаболический эффект. Добавку принимают до и после тренировок, чтобы восстановиться и пополнить запасы гликогена.
Гидролизат протеина мгновенно усваивается в организме и дает хороший анаболический эффект. Добавку принимают до и после тренировок, чтобы восстановиться и пополнить запасы гликогена.
Чем выше степень фильтрации продукта, тем больше его стоимость. Поэтому новичкам часто советуют начать с приятного на вкус и простого в приготовлении концентрата. Если у человека есть проблемы с пищеварением, специалисты рекомендуют приобрести гидролизат, который быстро расщепляется, не нагружая желудок.
Виды протеина по источнику сырья
Чтобы повысить результаты тренировок и восполнить дефицит веществ с помощью протеина, нужно, чтобы белок из него быстро усваивался и приносил пользу организму. Этот процесс зависит от того, из какого сырья изготовлен продукт.
Различают 7 видов протеина:
- Сывороточный. Один из популярных видов порошка. Изготавливают из сыворотки, которая остается при производстве сыров. Содержит небольшое количество лактозы и жиров.
 Плюс добавки — высокая скорость усвоения и безопасность для организма. Эффективно восполняет потребность в аминокислотах и поступает в мышцы уже через 40–60 минут после приема.
Плюс добавки — высокая скорость усвоения и безопасность для организма. Эффективно восполняет потребность в аминокислотах и поступает в мышцы уже через 40–60 минут после приема. - Казеиновый. Как и сывороточный, производится из молочного белка. Отличается тем, что переваривается в течение 5–7 часов, поэтому им можно заменить несколько приемов пищи. Казеин снижает скорость распада белка в мышцах и замедляет всасывание аминокислот, что позволяет восстанавливать мускулатуру и постепенно снабжать организм полезными нутриентами.
- Яичный. Эталонный вид белка по времени переваривания. В продаже редко встречается в чистом виде. Смеси содержат мало углеводов и много полезных аминокислот. Прием показан спортсменам с непереносимостью лактозы.
- Соевый. Распространенный вид протеина растительного происхождения. Подходит для вегетарианцев и людей, которые не усваивают молочный белок. Добавка содержит большое количество незаменимых аминокислот, минералов и витаминов, которые необходимы для нормальной работы организма.
 Похожими свойствами обладает протеин из пшеницы.
Похожими свойствами обладает протеин из пшеницы. - Растительный. Кроме соевого, в магазинах спортивного питания есть гороховый, тыквенный, подсолнечный, конопляный и рисовый протеин. Растительные виды восполняют недостаток белка у спортсменов, которые придерживаются вегетарианского питания или религиозного поста. Наиболее распространена горохово-конопляная смесь, которая не вызывает аллергических реакций и содержит оптимальный аминокислотный профиль.
- Мясной или говяжий. Наименее популярный вид протеина из-за специфического привкуса, аллергической активности и высокой цены. Но мясной протеин содержит много полезных веществ и богат креатином.
- Комплексный. Состоит из нескольких видов белка и часто содержит дополнительные компоненты — витамины, минералы и другие полезные компоненты. Поставляет в организм комплекс ценных аминокислот и обеспечивает долговременное питание мышц.
Помните, что спортивное питание не может заменить природные белки из продуктов.
Какой протеин выбрать?
Производители выпускают различные виды протеина, которые отличаются составом и ценой. Поэтому перед покупкой посоветуйтесь с тренером или специалистом по спортивному питанию. Они помогут определить состояние здоровья, физическую форму и подберут препарат в зависимости от поставленных целей.
Подходящие формы и виды протеина для решения разных задач:
- роста мышц — гидролизат, сывороточный, растительный;
- похудения — изолят, соевый, казеиновый;
- поддержания формы — концентрат, говяжий;
- универсальных целей — яичный.
Среди видов протеина невозможно выделить лучший. Выбор зависит от времени суток, целей и состояния организма.
Купить сертифицированные добавки можно в спортивных магазинах Минска. Широкий ассортимент позволяет выбрать протеин любого вкуса, аромата и консистенции. Продавец-консультант посоветует подходящий препарат и рассчитает оптимальную дозировку.
Продавец-консультант посоветует подходящий препарат и рассчитает оптимальную дозировку.Вернуться к списку
Белки — определение, свойства, структура, классификация, функции
Сагар Арьял
Содержание
Что такое белки? Белки являются наиболее распространенными биологическими макромолекулами, присутствующими во всех клетках. Это также самая универсальная органическая молекула живых систем, встречающаяся в большом разнообразии; тысячи различных видов, размер которых варьируется от относительно небольших пептидов до крупных полимеров. Белки представляют собой полимеры аминокислот, ковалентно связанных пептидными связями. Строительными блоками белков являются двадцать встречающихся в природе аминокислот. Таким образом, белки представляют собой полимеры аминокислот.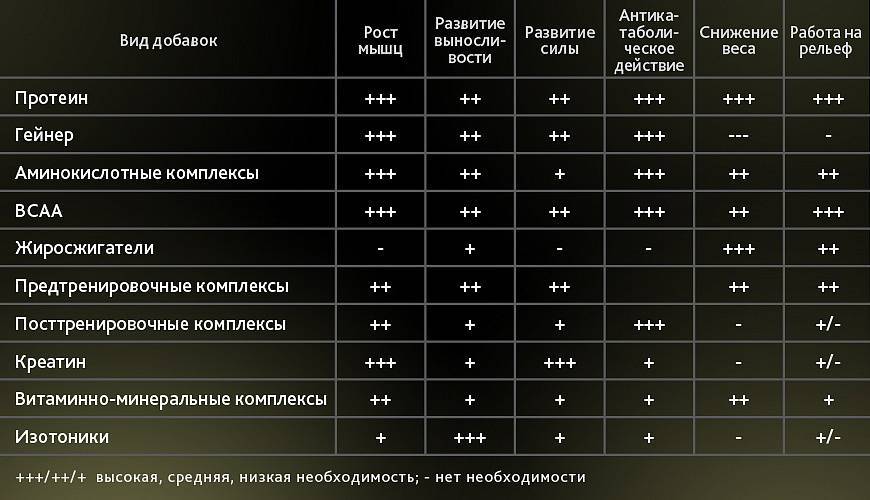
- Связь белков с водой сложна.
- Вторичная структура белков во многом зависит от взаимодействия пептидных связей с водой посредством водородных связей.
- Водородные связи также образуются между белком (альфа- и бета-структуры) и водой. Богатый белком статический шар более растворим, чем спиральные структуры.
- В третичной структуре вода вызывает ориентацию цепей и гидрофильных радикалов наружу молекулы, в то время как гидрофобные цепи и радикалы имеют тенденцию реагировать друг с другом внутри молекулы (гидрофобный эффект).
- Белки могут быть денатурированы такими агентами, как тепло и мочевина, которые вызывают разворачивание полипептидных цепей, не вызывая гидролиза пептидных связей.
- Денатурирующие агенты разрушают вторичную и третичную структуры, не затрагивая первичную структуру.
.jpg)
- Если денатурированный белок возвращается в свое нативное состояние после удаления денатурирующего агента, этот процесс называется ренатурацией.
Некоторые из денатурирующих агентов включают
Физические агенты : Тепло, излучение, pH
Химические агенты
: Раствор мочевины, который образует новые водородные связи в белке, органические растворители, детергенты. КоагуляцияКогда белки денатурируют под воздействием тепла, они образуют нерастворимые агрегаты, известные как коагулянт. Все белки не коагулируют при нагревании, лишь немногие, такие как альбумины и глобулины, способны коагулировать при нагревании.
Изоэлектрическая точка- Изоэлектрическая точка (pI) — это pH, при котором количество положительных зарядов равно количеству отрицательных зарядов, а общий заряд аминокислоты равен нулю.
- В этот момент под действием электрического поля белки не движутся ни к аноду, ни к катоду, поэтому это свойство используется для выделения белков.

- Средняя молекулярная масса аминокислоты принята равной 110.
- Общее количество аминокислот в белке, умноженное на 110, дает приблизительную молекулярную массу этого белка.
- Различные белки имеют разный аминокислотный состав и, следовательно, их молекулярные массы различаются.
- Молекулярная масса белков колеблется от 5000 до 10
- Происходит после синтеза белка на рибосоме.
- Фосфорилирование, гликозилирование, рибозилирование АДФ, метилирование, гидроксилирование и ацетилирование влияют на заряд и взаимодействие между аминокислотными остатками, изменяя трехмерную конфигурацию и, таким образом, функцию белка.
При добавлении 1 мл раствора нингидрина к 1 мл белкового раствора и нагревании образование фиолетовой окраски свидетельствует о наличии α-аминокислот.
- Линейная последовательность аминокислотных остатков в полипептидной цепи определяет трехмерную конфигурацию белка, а структура белка определяет его функцию.
- Все белки содержат элементы углерода, водорода, кислорода, азота и серы, некоторые из них могут также содержать фосфор, йод и следы металлов, таких как ионы меди, цинка и марганца.
- Белок может содержать 20 различных видов аминокислот. Каждая аминокислота имеет аминогруппу на одном конце и кислотную группу на другом и характерную боковую цепь.
- Основная цепь одинакова для всех аминокислот, тогда как боковая цепь отличается от одной аминокислоты к другой.
Структуру белков можно разделить на четыре уровня организации:
1. Первичная структура- Первичная структура белка состоит из аминокислотной последовательности вдоль полипептидной цепи.
- Аминокислоты соединены пептидными связями.
- Поскольку в пептидных связях нет диссоциирующих протонов, заряды полипептидной цепи обусловлены только N-концевой аминогруппой, С-концевой карбоксильной группой и боковыми цепями аминокислотных остатков.
- Первичная структура определяет дальнейшие уровни организации белковых молекул.
- Вторичная структура включает различные типы локальных конформаций, в которых не участвуют атомы боковых цепей.
- Вторичные структуры образованы регулярно повторяющимся паттерном образования водородных связей между атомами основной цепи.
- Вторичная структура включает α-спирали, β-слои и другие типы складок, которые возникают из-за регулярно повторяющегося паттерна образования водородных связей.
- Вторичная структура белка может быть:
- Альфа-спираль
- Бета-спираль
- α-спираль – это правосторонняя спираль.
- Заместители боковой цепи аминокислотных групп в α-спирали простираются наружу.
- Водородные связи образуются между кислородом C=O каждой пептидной связи в цепи и водородом группы N-H пептидной связи на четыре аминокислоты ниже нее в спирали.

- Заместители аминокислот в боковых цепях подходят рядом с группами N-H.
- Водородная связь в ß-листе возникает между цепями (межцепочечными), а не внутри цепей (внутрицепочечными).
- Конформация листа состоит из пар нитей, лежащих бок о бок.
- Карбонильные атомы кислорода одной цепи водородно связаны с атомами водорода аминогруппы соседней цепи.
- Две нити могут быть либо параллельными, либо антипараллельными в зависимости от того, являются ли направления нитей (N-конец к C-концу) одинаковыми или противоположными.
- Антипараллельный ß-лист более стабилен из-за более хорошо выровненных водородных связей.
- Третичная структура белка относится к его общей трехмерной конформации.
- Типы взаимодействий между аминокислотными остатками, которые создают трехмерную форму белка, включают гидрофобные взаимодействия, электростатические взаимодействия и водородные связи, все из которых являются нековалентными.

- Встречаются также ковалентные дисульфидные связи.
- Образуется в результате взаимодействия между аминокислотными остатками, которые могут располагаться на значительном расстоянии друг от друга в первичной последовательности полипептидной цепи.
- Гидрофобные аминокислотные остатки имеют тенденцию собираться внутри глобулярных белков, где они исключают воду, тогда как гидрофильные остатки обычно находятся на поверхности, где они взаимодействуют с водой.
- Четвертичная структура относится к взаимодействию одной или нескольких субъединиц с образованием функционального белка с использованием тех же сил, которые стабилизируют третичную структуру.
- Это пространственное расположение субъединиц в белке, состоящем из более чем одной полипептидной цепи.
На основании химической природы, структуры, формы и растворимости белки классифицируются как:
- Простые белки : Они состоят только из аминокислотных остатков.
 При гидролизе эти белки дают только составляющие аминокислоты. Далее он делится на:
При гидролизе эти белки дают только составляющие аминокислоты. Далее он делится на:- Волокнистый белок: кератин, эластин, коллаген
- Глобулярный белок: альбумин, глобулин, глютелин, гистоны
- Конъюгированные белки : Они объединены с небелковым компонентом. Например. Нуклеопротеин, Фосфопротеин, Липопротеин, Металлопротеин и др.
- Производные белки : Это производные или продукты деградации простых и конъюгированных белков. Они могут быть :
- Первичные производные белки: белки, метапротеины, коагулированные белки
- Белки вторичного происхождения: протеосы или альбунозы, пептоны, пептиды.
Белки необходимы для роста и восстановления, и их функции безграничны. Они также обладают огромным разнообразием биологических функций и являются наиболее важными конечными продуктами информационных путей.
- Белки, состоящие из аминокислот, выполняют множество функций в организме (например, в качестве ферментов, структурных компонентов, гормонов и антител).
- Они действуют как структурные компоненты, такие как кератин волос и ногтей, коллаген костей и т. д.
- Белки — это молекулярные инструменты, с помощью которых выражается генетическая информация.
- Они осуществляют свою деятельность в транспорте кислорода и углекислого газа гемоглобином и специальными ферментами в эритроцитах.
- Они участвуют в гомеостатическом контроле объема циркулирующей крови и интерстициальной жидкости через белки плазмы.
- Они участвуют в свертывании крови посредством тромбина, фибриногена и других белковых факторов.
- Действуют как защита от инфекций с помощью белковых антител.
- Осуществляют наследственную передачу посредством нуклеопротеидов клеточного ядра.
- Овальбумин, глютелин и др. являются запасными белками.
- Актин, миозин действуют как сократительные белки, важные для сокращения мышц.
- Смит, К.М., Маркс, А.
 Д., Либерман, М.А., Маркс, Д.Б., и Маркс, Д.Б. (2005). Базовая медицинская биохимия Маркса: клинический подход. Филадельфия: Липпинкотт Уильямс и Уилкинс.
Д., Либерман, М.А., Маркс, Д.Б., и Маркс, Д.Б. (2005). Базовая медицинская биохимия Маркса: клинический подход. Филадельфия: Липпинкотт Уильямс и Уилкинс. - Родвелл, В. В., Ботам, К. М., Кеннелли, П. Дж., Вейл, П. А., и Бендер, Д. А. (2015). Иллюстрированная биохимия Харпера (30-е изд.). Нью-Йорк, штат Нью-Йорк: McGraw-Hill Education LLC.
- Джон В. Пелли, Эдвард Ф. Гольян (2011). Биохимия. Третье издание. Филадельфия: США.
- https://chemistry.tutorvista.com/biochemistry/proteins.html
- http://www.biologydiscussion.com/proteins/proteins-definition-importance-and-classification-biochemistry/41903
- https://www.particlesciences.com/news/technical-briefs/2009/protein-structure.html
- http://www.biologydiscussion.com/proteins/proteins-functions-structure-properties-and-classification/16912
Об авторе
Сагар Арьял
Сагар Арьял — микробиолог и научный блоггер. Он учился в Колледже Святого Ксавьера в Майтигаре, Катманду, Непал, чтобы получить степень магистра наук в области микробиологии. С февраля 2015 г. по июнь 2019 г. он работал преподавателем в колледже Св. Ксаверия, Майтигар, Катманду, Непал.. После преподавания микробиологии более четырех лет он поступил на Центральный факультет микробиологии Трибхуванского университета, чтобы получить степень доктора философии. в сотрудничестве с Институтом фармацевтических исследований Гельмгольца Саара (HIPS), Саарбрюккен, Германия. Он интересуется исследованиями актинобактерий, миксобактерий и натуральных продуктов. Он опубликовал более 15 исследовательских статей и глав в книгах в международных журналах и известных издательствах.
С февраля 2015 г. по июнь 2019 г. он работал преподавателем в колледже Св. Ксаверия, Майтигар, Катманду, Непал.. После преподавания микробиологии более четырех лет он поступил на Центральный факультет микробиологии Трибхуванского университета, чтобы получить степень доктора философии. в сотрудничестве с Институтом фармацевтических исследований Гельмгольца Саара (HIPS), Саарбрюккен, Германия. Он интересуется исследованиями актинобактерий, миксобактерий и натуральных продуктов. Он опубликовал более 15 исследовательских статей и глав в книгах в международных журналах и известных издательствах.
Белки Определение, свойства, структура, классификация, функции
Определение белков
Белки — это самые большие макромолекулы в биологии, присутствующие в каждой клетке. Они также являются наиболее адаптируемыми органическими молекулами в живой системе и встречаются во многих различных видах, размер которых варьируется от небольших полимеров до огромных пептидов. Белки представляют собой полимеры, состоящие из аминокислот, соединенных пептидными связями.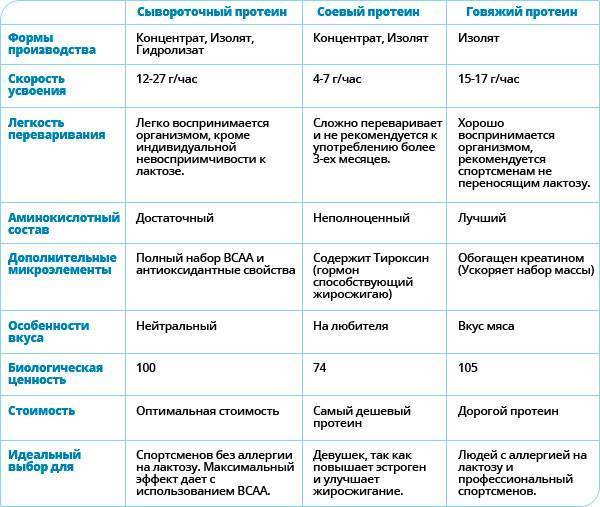 Белки, строительные блоки белков, представляют собой двадцать природных аминокислот. Таким образом, белки представляют собой мультимеры, состоящие из аминокислот.
Белки, строительные блоки белков, представляют собой двадцать природных аминокислот. Таким образом, белки представляют собой мультимеры, состоящие из аминокислот.
Свойства белков
Растворимость в воде
Связь между белками и водой является сложной. Вторичная структура белков в основном зависит от взаимодействия пептидных связей и воды посредством водородных связей. Водородные связи также могут образовываться между белками (альфа- или бета-формами), а также водой. Статический шар с высоким содержанием белка более растворим, чем спиральная структура. В третичной структуре вода отвечает за направление цепей и радикалов, которые гидрофильны снаружи молекулы. Напротив, гидрофобные радикалы и цепи склонны реагировать друг с другом внутри молекул (гидрофобное воздействие).
Денатурация и ренатурация
Белки денатурируются с помощью таких агентов, как тепло и мочевина, которые вызывают распад полипептидных цепей, но без гидролиза пептидной связи. Денатурирующие агенты повреждают вторичную и третичную структуру, не изменяя основной структуры. Когда денатурированный белок возвращается в исходное состояние после удаления денатурирующего агента, этот процесс известен как «ренатурация».
Когда денатурированный белок возвращается в исходное состояние после удаления денатурирующего агента, этот процесс известен как «ренатурация».
Некоторые из денатурирующих агентов включают
- Физические агенты: Тепло, излучение, pH
- Химические агенты: Раствор мочевины, образующий новые водородные связи в белке, органические растворители, детергенты.
Коагуляция
Если белки разрушаются при нагревании, они превращаются в нерастворимые агрегаты, называемые коагуляцией. Большинство белков не коагулируют при нагревании. Только некоторые, такие как альбумины, глобулины и глобулины, коагулируют.
Изоэлектрическая точка
Точка изоэлектричества (pI) может быть определена как рН, при котором количество положительных зарядов равно количеству отрицательных зарядов, а общий заряд аминокислоты равен нулю. При воздействии электрического поля белки не движутся ни к катоду, ни к аноду. это свойство используется для разделения белков.
это свойство используется для разделения белков.
Молекулярная масса белков
Средняя молекулярная масса аминокислоты может быть оценена как 110. Количество аминокислот, присутствующих в белке, умноженное на, является приблизительной молекулярной массой белка. Различные белки имеют разный аминокислотный состав и разную молекулярную массу. Молекулярная масса белков колеблется от 5000 до 109дальтоны.
Посттрансляционные модификации
Происходит после того, как белок синтезируется рибосомой. Гликозилирование, фосфорилирование, метилирование АДФ, рибозилирование в процессе гидроксилирования, а также ацетилирование изменяют заряд и взаимодействие между аминокислотными остатками. Это изменяет трехмерную структуру и, следовательно, назначение белка.
Химические свойства белков
- Биуретовый тест: Если 2 мл испытуемых растворов смешать с таким же объемом 10-процентного раствора NaOH, а также с одной каплей 10-процентного раствора CuSO4, то образование фиолетовой окраски является признаком связывающие пептиды.

- Нингидриновый тест: Тест проводится при добавлении 1 мл раствора нингидрина к 1 мл белкового раствора и последующем нагревании до температуры около 165°С, появление фиолетовой окраски является признаком наличия а-аминокислоты.
Структура белка
- Линейная структура аминокислот внутри полипептидной цепи определяет трехмерную структуру белка. структура белка определяет его назначение.
- Все белки состоят из элементов углерода, водорода, кислорода, азота и серы. Некоторые из них могут также содержать фосфор, йод и следовые количества металлов, таких как ионы цинка, меди, а также марганца.
- Белок может содержать 20 видов аминокислот. Каждая аминокислота состоит из аммиачной группы в одной точке и кислотной группы в противоположной, а также отдельной боковой цепи.
- Основная цепь у всех аминокислот идентична, тогда как боковая цепь у одной аминокислоты отличается от другой.
Структуру белков можно разделить на четыре различных уровня:
1.
 Первичная структура
Первичная структураОсновная структура белков состоит из цепи аминокислот, которая проходит вдоль цепи полипептидов. Аминокислоты соединяются за счет связей между пептидами. Поскольку в пептидной связи нет диссоциирующих протонов, а заряды, присоединенные к полипептидной цепи, обусловлены аминогруппой на N-конце и карбоксильной группой на С-конце, а также аминокислотными остатками. Структура, являющаяся первичной, определяет остальные уровни строения белков.
2. Вторичная структура
Вторичная структура состоит из различного рода локальных конформаций, в которых атомы боковых цепей не играют роли. Вторичные структуры формируются за счет регулярности водородных связей между элементами основной цепи. Вторичные структуры включают в себя b-листы, a-спирали и различные другие модели складок, возникающие из-за регулярного строения водородной связи. Вторичная структурная особенность белков может включать:
- Альфа-спираль
- Бета-спираль
А-спираль можно описать как правую спиральную струну.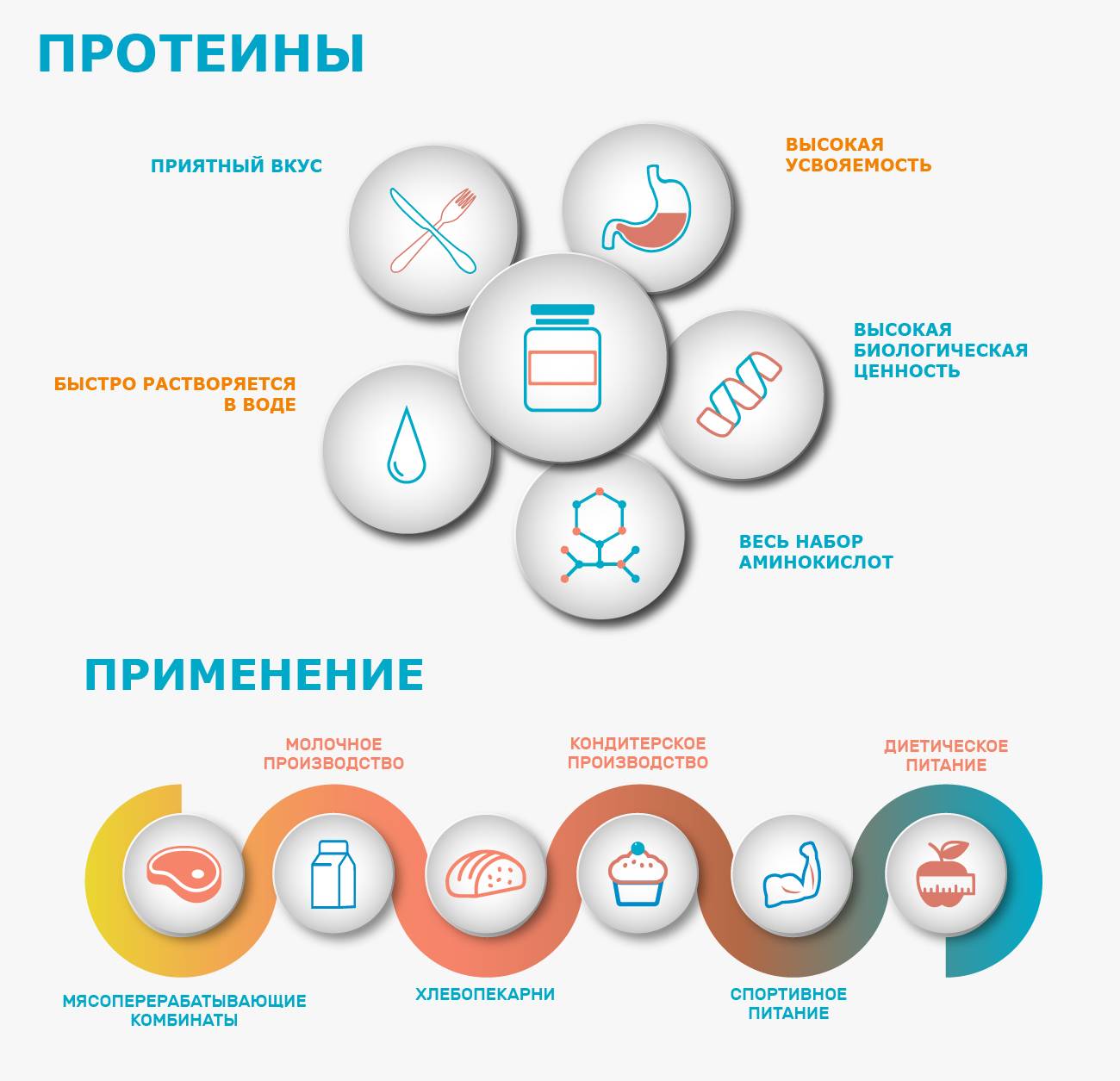 Заместители боковой цепи для аминокислотных групп внутри а-спирали выходят наружу. Водородные связи образуются между кислородом из C = O в каждой цепи пептидных связей вместе с водородом из группы NH в пептидной связи, которая находится на четыре аминокислоты ниже нее внутри спирали. Заместители аминокислот в боковой цепи расположены в том же месте, что и группы NH. Водородная связь, которая возникает в конформации листа, находится между цепями (межцепочечными), а не внутри цепей (внутрицепочечными). Конформация листа состоит из нитей, уложенных вместе. Карбонильные атомы кислорода, присутствующие в одной цепи, связаны водородными связями с атомами водорода аминогруппы на соседней цепи. Две нити могут быть параллельными или антипараллельными, в зависимости от того, являются ли направления нити (N-конец от С-конца к N-концу) противоположными или одинаковыми. Антипараллельный ss-лист прочнее из-за более выровненных водородных связей.
Заместители боковой цепи для аминокислотных групп внутри а-спирали выходят наружу. Водородные связи образуются между кислородом из C = O в каждой цепи пептидных связей вместе с водородом из группы NH в пептидной связи, которая находится на четыре аминокислоты ниже нее внутри спирали. Заместители аминокислот в боковой цепи расположены в том же месте, что и группы NH. Водородная связь, которая возникает в конформации листа, находится между цепями (межцепочечными), а не внутри цепей (внутрицепочечными). Конформация листа состоит из нитей, уложенных вместе. Карбонильные атомы кислорода, присутствующие в одной цепи, связаны водородными связями с атомами водорода аминогруппы на соседней цепи. Две нити могут быть параллельными или антипараллельными, в зависимости от того, являются ли направления нити (N-конец от С-конца к N-концу) противоположными или одинаковыми. Антипараллельный ss-лист прочнее из-за более выровненных водородных связей.
3. Третичная структура
Третичная структура белков относится к их общей трехмерной форме. Различными видами взаимодействия между аминокислотными остатками, создающими трехмерную форму белка, являются электростатические взаимодействия, гидрофобные взаимодействия и водородные связи, каждое из которых является нековалентным. Существуют также ковалентные дисульфидные связи.
Различными видами взаимодействия между аминокислотными остатками, создающими трехмерную форму белка, являются электростатические взаимодействия, гидрофобные взаимодействия и водородные связи, каждое из которых является нековалентным. Существуют также ковалентные дисульфидные связи.
Образуется за счет взаимодействия аминокислотных остатков, находящихся далеко друг от друга в основной структуре полипептидной цепи. Кислотные остатки, обладающие гидрофобными свойствами, чаще накапливаются во внутренней части глобулярных белков. Там они способны исключать воду, тогда как гидрофильные остатки обычно находятся на поверхности белка, в котором они находятся в контакте с водой.
4. Четвертичная структура
Четвертичные структуры относятся к взаимодействию между двумя или более субъединицами для создания функциональных белков с использованием тех же сил, которые стабилизируют третичную структуру. Это расположение субъединиц в белке, состоящем из нескольких полипептидных цепей.
Классификация белков
На основании их химической структуры, формы и растворимости белки классифицируются как:
- Простые белки: состоят из аминокислотных остатков. При гидролизе белки образуют в качестве составляющих только аминокислоты. Белок дополнительно классифицируется на:
- Волокнистый белок: Кератин, эластин, коллаген
- Глобулярный белок: Альбумин, глобулин, глютелин, гистоны
- Конъюгированные белки: Они смешаны с небелковыми часть. Например. Нуклеопротеин, фосфопротеин, липопротеин, металлопротеин и др.
- Производные белки: Производные белки представляют собой деградированные и производные конъюгированных и простых белков. Они могут включать:
- Первичные производные белки: Белки, метапротеины, коагулированные белки
- Вторичные производные белки: Протеозы или альбунозы, пептоны, пептиды.

Функции белков
Белки необходимы для восстановления и роста, и их роли безграничны. Они также выполняют огромное количество разнообразных биологических функций. Они являются одним из наиболее важных конечных продуктов информационных путей.
- Белки, состоящие из аминокислот, используются в организме в различных ролях (например, в качестве структурных компонентов, ферментов, гормонов, а также антител).
- Они функционируют как структурные элементы, такие как кератин волос и коллаген ногтей, костный коллаген и кость и т. д.
- Белки — это молекулы, которые позволяют выражать генетическую информацию.
- Они выполняют свои задачи за счет транспортировки углекислого газа через гемоглобин, а также специфические ферменты, обнаруженные в эритроцитах.
- Они участвуют в гомеостатической регуляции количества циркулирующей крови и интерстициальной жидкости через белки плазмы.
- Они участвуют в процессе свертывания крови посредством фибриногена, тромбина и других связанных с белками факторов.