Аминокислоты в продуктах питания | Незаменимые и заменимые аминокислоты
Обратно в Состав продуктовВо всех живых системах первоочередное значение имеют белки, они же протеины. Все химические и биохимические процессы, поддерживающие жизнь клетки и организма, выполняют исключительно ферменты, молекулы белковой природы. Белки также выполняют строительную функцию, как на уровне клеток, так и на уровне организма в целом. Функциональное разнообразие протеинов обусловлено их пространственной структурой, расположением, но прежде всего их химическим составом.
С химической точки зрения белки являются полимерами, состоящими из аминокислот. Данное название отражает структуру этих веществ, содержащих, по меньшей мере, одну аминогруппу -Nh3 и одну карбоксильную группу -COOH. Различаются они только по строению своего радикала, который, собственно, и определяет их индивидуальные физико-химические свойства.
Природные протеиногенные аминокислоты
В органах и тканях человека основная роль этих соединений – участие в белковом синтезе, на это уходит подавляющая часть всех поступивших или образовавшихся аминокислот. Но есть и отдельные аминокислоты, которые обладают самостоятельными функциями. Так, тирозин является ответственным за окраску волос, кожи, глаз, придает темный цвет пищевым продуктам, например, ржаному хлебу, так как с его участием синтезируются темноокрашенные пигменты – меланины.
Помимо протеинов, из аминокислот состоят более короткие молекулы, играющие важную роль в организме: олигопептиды. Среди них есть и не очень короткие цепочки аминокислотных остатков, например, гормон инсулин, и совсем короткие, вплоть до дипептидов (или бипептидов), которые состоят всего из двух аминокислотных остатков (для сравнения: белки насчитывают сотни аминокислотных остатков). Важнейшими дипептидами являются карнитин и карнозин, сильнейший природный антиоксидант.
Заменимые и незаменимые аминокислоты
Источником аминокислот в пищевых продуктах являются белки. Все белки пищевых продуктов различаются по своему аминокислотному составу.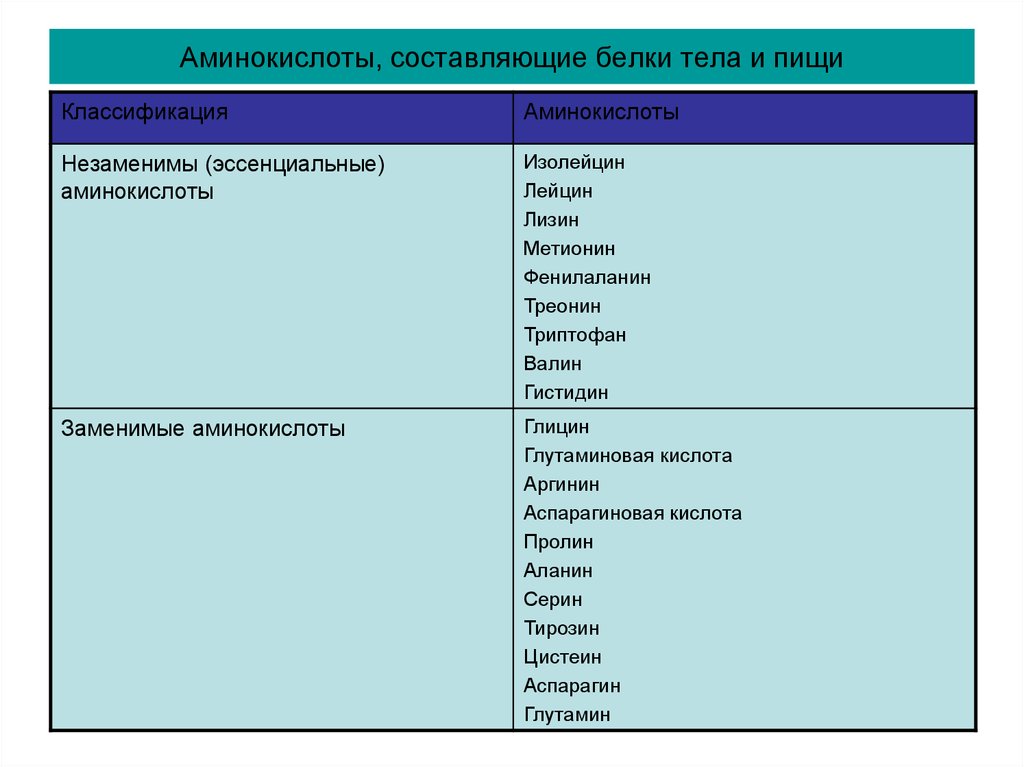 Это имеет большое значение в подборе полноценных рационов в связи с тем, что ряд аминокислот являются незаменимыми (эссенциальными) — они могут быть получены только с пищевыми продуктами. К незаменимым протеиногенным аминокислотам относятся валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан. В отличие от них, заменимые аминокислоты могут быть синтезированы в организме человека из предшественников. Это глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин. К частично заменимым относят аргинин и гистидин, так как в организме они синтезируются довольно медленно.
Это имеет большое значение в подборе полноценных рационов в связи с тем, что ряд аминокислот являются незаменимыми (эссенциальными) — они могут быть получены только с пищевыми продуктами. К незаменимым протеиногенным аминокислотам относятся валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан. В отличие от них, заменимые аминокислоты могут быть синтезированы в организме человека из предшественников. Это глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин. К частично заменимым относят аргинин и гистидин, так как в организме они синтезируются довольно медленно.
Дефицит или полное отсутствие в рационе даже одной незаменимой аминокислоты приводит к отрицательному азотистому балансу, что в свою очередь со временем вызывает тяжелые клинические последствия типа авитаминоза: нарушение деятельности центральной нервной системы, остановку роста и т.д.
Крайне важно отметить, что если в дефиците какая-то одна незаменимая аминокислота, то это приводит к неполному усвоению других. Данная закономерность подчиняется закону Либиха, по которому развитие живых организмов определяется тем незаменимым веществом, которое присутствует в наименьшем количестве.
Данная закономерность подчиняется закону Либиха, по которому развитие живых организмов определяется тем незаменимым веществом, которое присутствует в наименьшем количестве.
В каких же продуктах питания содержатся незаменимые аминокислоты? Это все пищевые ингредиенты, богатые белком.
Продукты питания как источники незаменимых аминокислот
Крайне редко аминокислоты представлены в свободном виде. Последнее встречается в специальных пищевых продуктах, например, спортивном питании, куда их непосредственно добавляют в свободном состоянии для более быстрого и полного усвоения. В основном же они поступают в организм в составе белков и затем высвобождаются в ходе гидролиза последних. Высвободившиеся в результате гидролиза аминокислоты или небольшие пептиды уже могут всасываться в кишечнике.
Наиболее важными источниками незаменимых аминокислот в необходимом соотношении являются следующие продукты питания, где содержатся легкоусвояемые протеины: молоко, молочные продукты, яйца, мясо и мясопродукты, рыба, морепродукты, соя, бобовые (горох, чечевица, фасоль, соя), крупы, хлеб, картофель и др.
Наряду с аминокислотным составом, биологическая ценность протеинов определяется и степенью их усвоения после переваривания. Степень переваривания, в свою очередь, зависит, с одной стороны, от состояния организма (активности ферментов, глубины гидролиза в желудочно-кишечном тракте), и с другой стороны, от вида предварительной обработки белков в процессах приготовления пищи (тепловой, гидротермической, СВЧ и проч.). Тепловая обработка, разваривание, протирание и измельчение ускоряют переваривание белка, особенно растительного, тогда как нагревание до очень высоких температур свыше 100°С его затрудняет.
Обратно в Состав продуктов
Отличия между аминокислотами.
13 Апреля 2020
14 Августа 2020
3 минуты
6713
ProWellness
Оглавление
- Для чего нужны аминокислоты?
- Чем отличаются аминокислоты друг от друга?
- Химическая классификация
- Физическая классификация
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами.
Отличия между аминокислотами.
Аминокислоты – это мелкие структурные единицы, которые входят в состав белков и образуют их. Известно около 150 видов аминокислот.
Для чего нужны аминокислоты?
Разные аминокислоты отвечают за определенные функции:
- Глицин активизирует работу мозга, помогает избавиться от тяжелых психоэмоциональных нагрузок, повышает настроение и работоспособность.
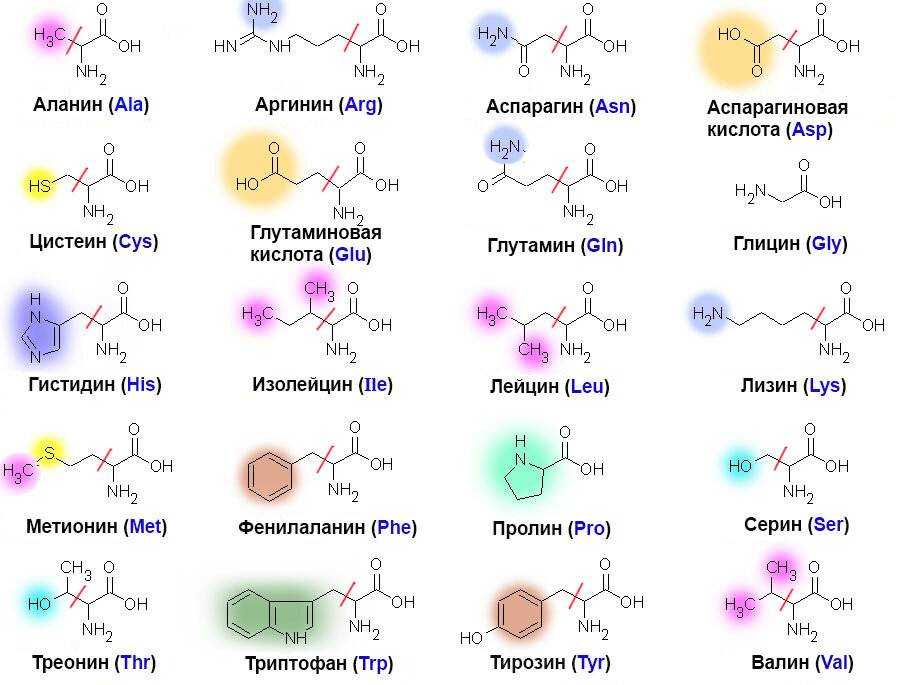
- Аспарагин поддерживает функционирование нервной системы.
- Цистеин выводит токсичные вещества из организма, нормализует пищеварение.
- Изолейцин повышает выносливость мышц, восстанавливает поврежденные ткани тела.
- Валин выстраивает новые мышечные волокна.
- Лейцин укрепляет иммунитет, обеспечивает организм энергией.
- Метионин препятствует развитию нервных расстройств и депрессивных состояний.
- Таурин запускает восстановительные процессы в мышцах.
- Треонин улучшает функционирование печени.
- Аргинин отвечает за гормоны роста.
- Триптофан помогает плодотворно трудиться, обеспечивает хорошее настроение.
- Аланин поддерживает мышечную систему в тонусе.
- Пролин обеспечивает здоровье соединительных тканей.
- Серин укрепляет иммунитет.
- Глютамин восстанавливает поврежденные клетки.
- Фенилаланин избавляет от плохого настроения и депрессии.

- Лизин участвует в формировании мышц и хрящей.
- Гистидин выводит из тела тяжелые металлы.
- Гидроксипролин очищает организм.
- Цитруллин отвечает за питание мышц.
- Тирозин защищает от нервных перенапряжений.
Чем отличаются аминокислоты друг от друга?
Данные вещества можно классифицировать по-разному. По самой популярной классификации аминокислоты подразделяются на заменимые и незаменимые. Классификацию также называю биологической.
Заменимые аминокислоты попадают в организм из продуктов питания и напитков. Организм может их синтезировать из других аминокислот.
Внимание! Незаменимые аминокислоты организм не в состоянии синтезировать. Он получает их только из еды.
Из каких продуктов можно получить незаменимые аминокислоты:
- молочные продукты;
- зародыши пшеницы;
- овсяная мука и крупа;
- бобовые культуры;
- мясо птицы;
- семечки и орехи;
- яйца;
- картофель;
- продукты из сои;
- морская рыба;
- свежий чеснок.

Химическая классификация
Существует классификация аминокислот по функциональным аминогруппам, которую еще называют химической. Этих групп выделяют несколько:
- Алифатическая. Самая многочисленная группа аминокислот, в которую входят вещества с различными зарядами и боковыми радикалами.
- Ароматическая. К ней относятся соединения, обладающие замкнутым ароматическим строением.
- Гетероциклическая. Включает в себя аминокислоты с атомами и цепями углерода.
- Иминокислоты. Самая малочисленная группа, к которой относят только одно вещество – пролин.
Физическая классификация
Физическая классификация аминокислот используется реже. Она основана на физический свойствах этих веществ и их различиях и включает следующие группы.
- Гидрофобные. Компоненты радикалов данных аминокислот содержат в составе молекулы углерода и ароматические кольца.

- Гидрофильные. Отличаются тем, что не имеют заряда. В их составе содержатся различные полярные группировки. Дополнительно они способны взаимодействовать с молекулами воды.
- Полярные отрицательные. В любой среде приобретают отрицательный заряд.
- Полярные положительные. В любой среде приобретают положительный заряд.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Эксперт: Екатерина Подваленчук Эксперт в области правильного питания и здоровья
Рецензент: Екатерина Воробьева Адепт здорового и активного образа жизни
Читайте другие статьи по схожим темам
аминокислотавиды аминокислотклассификация аминокислотзаменимые аминокислотынезаменимые аминокислотыбелки
Оцените статью
(1 голосов, в среднем 5)
Поделиться статьей
Таблица аминокислот с объяснением всех типов
Как лучше всего организму получать аминокислоты?
Аминокислоты в основном поступают с пищей. Большинство людей могут обеспечить себе достаточное количество аминокислот, соблюдая сбалансированную диету. Тем не менее, другие, такие как спортсмены, работники физического труда, люди с заболеваниями и пожилые люди, могут получить пользу от большего количества аминокислот, чем то, что они могут получить из пищи.
Помимо диеты, вы можете увеличить количество аминокислот в организме двумя способами.
Пищевые добавки для приема внутрь
Так как многие препараты с аминокислотами связаны с улучшением спортивных результатов, существует множество доступных вариантов. Добавки доступны в виде таблеток или порошков, которые можно добавлять или превращать в напитки. Они доступны в Интернете или в местных аптеках.
Организм усваивает пероральные аминокислотные добавки так же, как он усваивает их из пищи – через пищеварительную систему. Это также означает, что некоторые из добавок будут потеряны/не усвоятся, поскольку они расщепляются организмом.
Внутривенные инфузии
Внутривенные инфузии состоят из специализированных ингредиентов, обычно выбираемых для достижения определенных целей в отношении здоровья. Поскольку внутривенные инфузии вводят лекарства непосредственно в кровоток, они на 100% усваиваются организмом и могут начать действовать быстрее.
Внутривенные инфузии также увлажняют организм, позволяя ему вымывать тяжелые металлы и другие токсины. Хотя внутривенные инфузии безопасны при правильном проведении, их должен проводить и контролировать медицинский работник.
Хотя внутривенные инфузии безопасны при правильном проведении, их должен проводить и контролировать медицинский работник.
Кто может получить наибольшую пользу от внутривенной терапии аминокислотами?
Если вы считаете, что добавки с аминокислотами могут принести вам пользу, вам следует проконсультироваться с лечащим врачом, который может изучить вашу историю болезни и потребности. Тем не менее, существуют обстоятельства, повышающие вероятность того, что кому-то будет полезна внутривенная терапия аминокислотами, например:
- Профессиональные спортсмены: Прием незаменимых аминокислот незадолго до или после тренировки может способствовать увеличению мышечного роста. Также считается, что аминокислоты способствуют восстановлению после тренировки, но в настоящее время исследования не определили, существует ли существенная разница в результатах между приемом аминокислот или просто соблюдением диеты с высоким содержанием белка.
- Люди, которым необходимо способствовать правильному функционированию мышц: Сюда могут входить работники физического труда или люди, выздоравливающие после серьезной болезни или травмы.
 Аминокислоты помогают сбалансировать мышечную атрофию и рост. Незаменимые аминокислоты могут помочь обеспечить ваши скелетные мышцы достаточным количеством аминокислот и могут увеличить снабжение организма азотом.
Аминокислоты помогают сбалансировать мышечную атрофию и рост. Незаменимые аминокислоты могут помочь обеспечить ваши скелетные мышцы достаточным количеством аминокислот и могут увеличить снабжение организма азотом. - Для людей с кожными заболеваниями: Добавки с аминокислотами могут помочь улучшить уровень влажности кожи и общее состояние.
Люди, пытающиеся поддерживать нормальный уровень сахара в крови. Некоторые люди с диабетом 2 типа могут снизить уровень сахара в крови с помощью добавок аминокислот. Следует отметить, что это не влияет на уровень инсулина, и неизвестно, есть ли какое-либо долгосрочное влияние добавок аминокислот на уровень сахара в крови.
Существуют ли какие-либо риски или побочные эффекты при приеме аминокислот?
Аминокислотные добавки могут быть полезны для восполнения дефицита незаменимых аминокислот. Медицинский работник может оценить вашу диету, чтобы определить, подходит ли вам это лечение. Есть некоторые побочные эффекты и противопоказания к приему аминокислот, о которых следует помнить.
Дополнительный прием аминокислот в течение длительного времени может привести к побочным эффектам, включая головную боль, боль и тошноту. Вы также можете перегрузиться аминокислотами, поэтому эксперты рекомендуют избегать добавок, содержащих только одну аминокислоту. Аминокислоты, которые, как известно, имеют худшие побочные эффекты в результате перегрузки, включают цистеин, гистидин и метионин.
Аминокислоты также могут взаимодействовать с лекарствами и медицинскими процедурами. Хотя аминокислоты могут помочь снизить уровень сахара в крови, они также взаимодействуют с большинством лекарств от диабета. Поскольку добавки с аминокислотами могут влиять на уровень глюкозы в крови, вам следует избегать их приема до или после операции или медицинской процедуры. Аминокислоты также могут влиять на лечение щитовидной железы. Если вы принимаете лекарства, отпускаемые по рецепту, вам следует проконсультироваться с врачом, прежде чем принимать аминокислоты.
Как мне может помочь внутривенное лечение?
Наши препараты для внутривенного вливания представляют собой современные смеси, разработанные для удовлетворения ваших потребностей.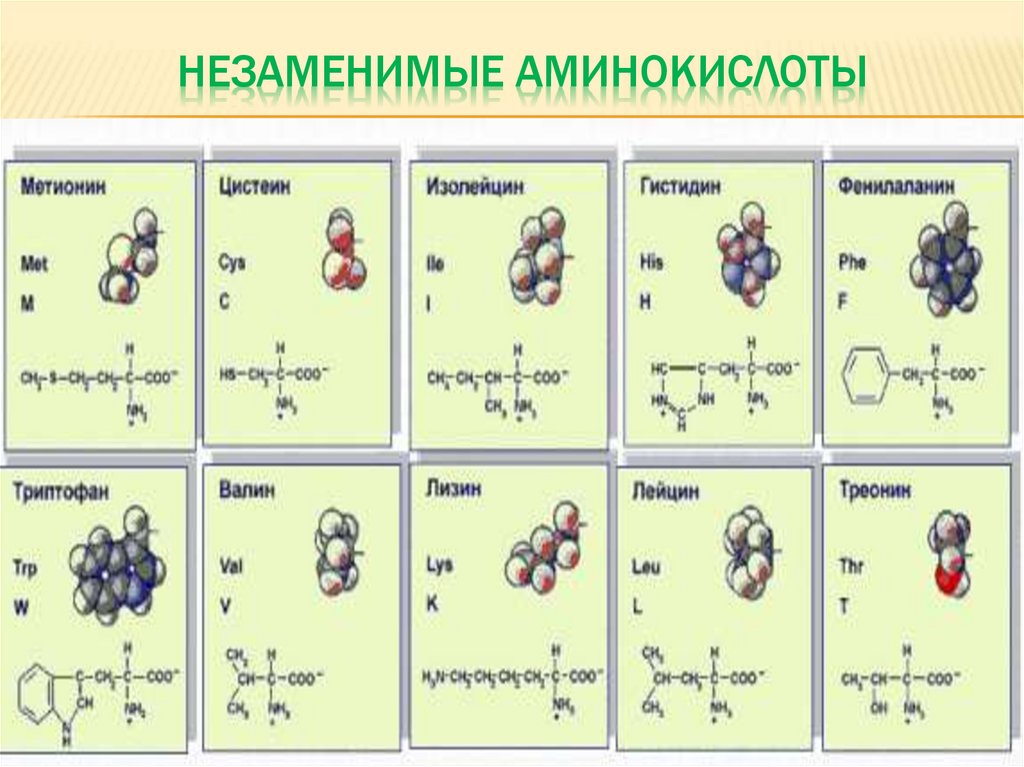 Вот несколько примеров:
Вот несколько примеров:
- Повышение энергии: Это внутривенное лечение предназначено для пополнения и восстановления общего состояния здоровья и уровня энергии. Комплекс витаминов группы В поддерживает сердечно-сосудистую систему и укрепляет иммунную функцию, витамин В12 повышает уровень энергии и концентрацию, а витамин С поддерживает мышцы, систему кровообращения и иммунную систему.
- Желудочный грипп: Этот препарат помогает быстрее избавиться от симптомов желудочного гриппа. В дополнение к ингредиентам, содержащимся в Energy Boost, присутствует Pepcid, который помогает облегчить изжогу и снизить уровень желудочной кислоты. Зофран также является частью этого лечения, чтобы облегчить симптомы тошноты и рвоты.
- Потеря веса: Наша процедура для похудения представляет собой смесь наших ингредиентов Energy Boost с Lipostat plus, смесью аминокислот, минералов и витаминов, которые помогают ускорить обмен веществ и вывести токсины из организма.
 Мы также добавляем L-карнитин, который помогает сжигать жир и заряжает вас энергией.
Мы также добавляем L-карнитин, который помогает сжигать жир и заряжает вас энергией. - Все включено: Наша комплексная внутривенная терапия предназначена для омоложения и восстановления. В дополнение к комплексу витаминов группы В, витамину В 12, витамину С и липостату плюс, мы также добавляем магний для поддержания здоровой мышечной, сердечно-сосудистой и иммунной функций. Глутатионовый толчок снабжает ваше тело мощными антиоксидантами для детоксикации организма и повышения энергии и ясности ума.
- NAD+ Boost: Для тех, кто серьезно относится к своему здоровью и хочет обратить вспять старение и повысить уровень энергии, наша терапия NAD+ IV может помочь вам чувствовать себя и выглядеть лучше. Наши процедуры предназначены для повышения энергии и иммунной поддержки, одновременно очищая мозг и улучшая память и концентрацию.
Связанный:
- Что такое аминокислоты и зачем они вам нужны?
- 10 преимуществ внутривенной терапии аминокислотами
- Продукты, богатые необходимыми аминокислотами
- Преимущества основной молекулы: глутатион – при внутривенной терапии
2.
 2: Структура и функция — аминокислоты
2: Структура и функция — аминокислоты- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 7809
- Кевин Ахерн, Индира Раджагопал и Таралин Тан
- Университет штата Орегон
Источник: BiochemFFA_2_1.pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
.Все белки на Земле состоят из одних и тех же 20 аминокислот. Связанные вместе в длинные цепи, называемые полипептидами, аминокислоты являются строительными блоками для огромного количества белков, присутствующих во всех живых клетках.
«Это одно из наиболее поразительных обобщений биохимии.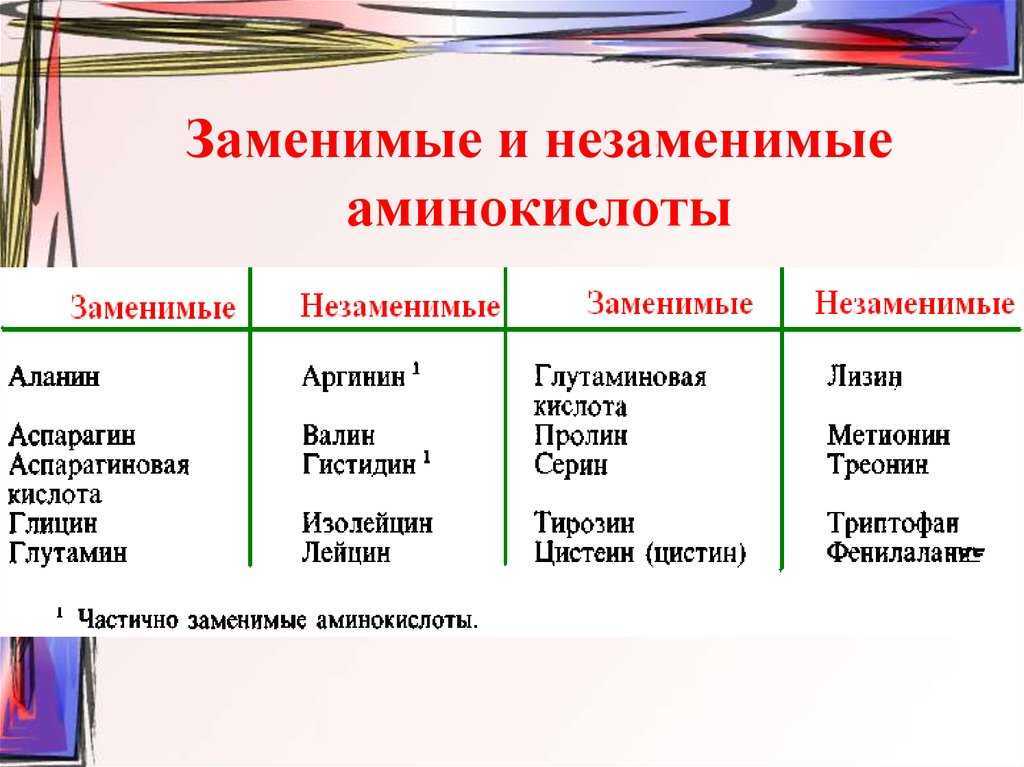 .. что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе». — Фрэнсис Крик
.. что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе». — Фрэнсис Крик
Все аминокислоты имеют одинаковую основную структуру, которая показана на рис. 2.1. В «центре» каждой аминокислоты находится углерод, называемый α-углеродом, и к нему присоединены четыре группы: водород, α-карбоксильная группа, α-аминогруппа и R-группа, которую иногда называют боковая цепь. α-углеродная, карбоксильная и аминогруппы являются общими для всех аминокислот, поэтому R-группа является единственной уникальной особенностью каждой аминокислоты. (Небольшим исключением из этой структуры является структура пролина, в котором конец R-группы присоединен к α-амину.) За исключением глицина, R-группа которого состоит из атома водорода, все аминокислоты в белках связаны с четырьмя различными группами и, следовательно, могут существовать в двух формах зеркального отображения, L и D. За очень небольшими исключениями, каждая аминокислота, обнаруженная в клетках и белках, имеет L-конфигурацию.
В белках содержится 22 аминокислоты, и только 20 из них определены универсальным генетическим кодом. Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенофосфатсинтетазы. Пирролизинсодержащие белки встречаются гораздо реже и в основном приурочены к археям.
Заменимые и незаменимые
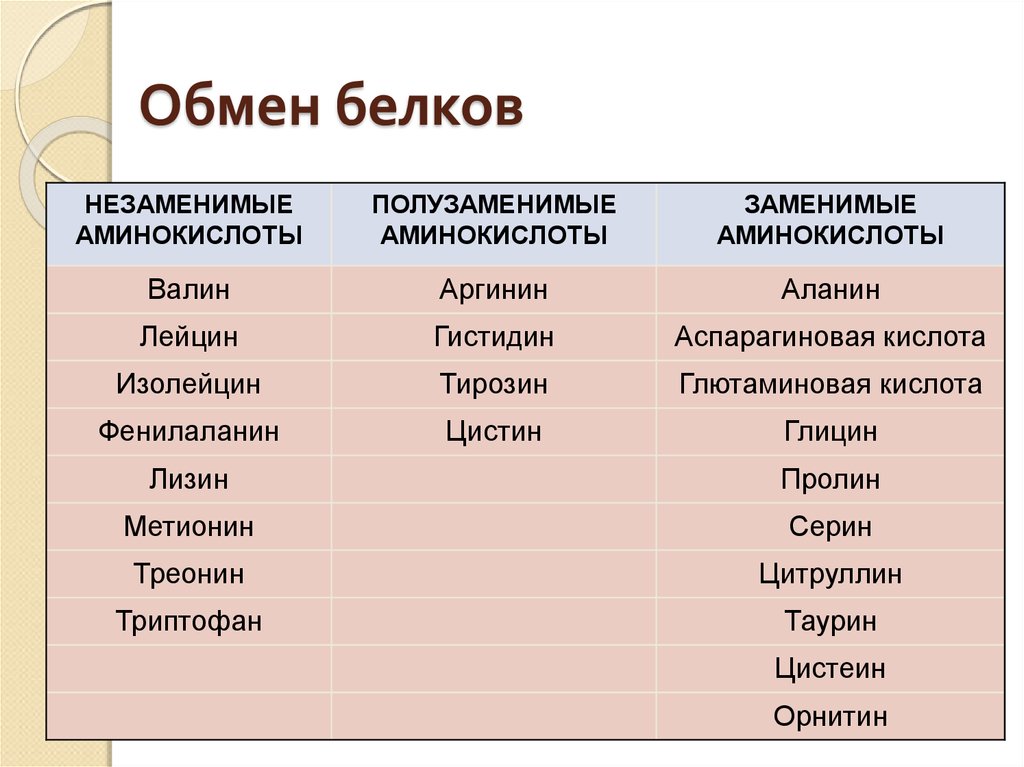
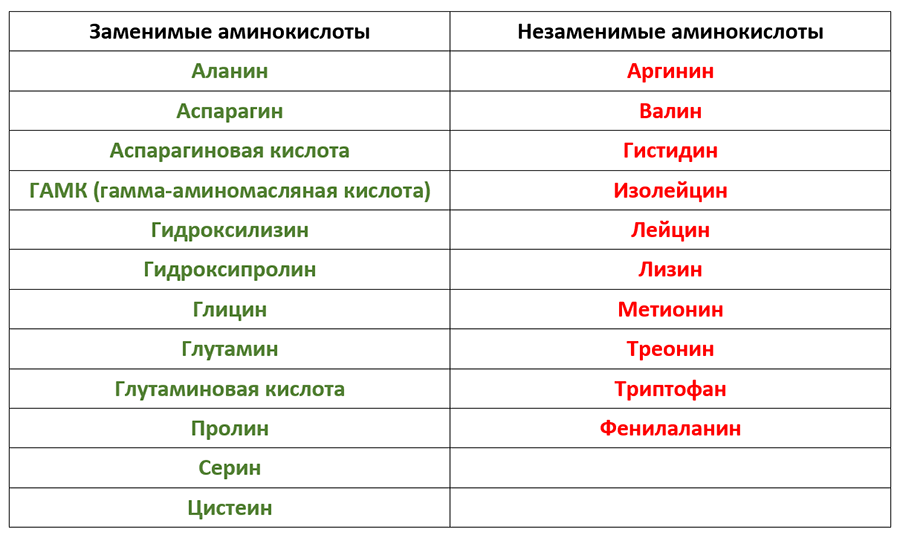
Диетологи делят аминокислоты на две группы – незаменимые аминокислоты (должны быть в рационе, потому что клетки не могут их синтезировать) и заменимые аминокислоты (могут вырабатываться клетками). Эта классификация аминокислот имеет мало общего со структурой аминокислот. Незаменимые аминокислоты значительно различаются от одного организма к другому и даже различаются у людей, в зависимости от того, взрослые они или дети. В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
Некоторые аминокислоты, которые обычно не являются незаменимыми, в определенных случаях может потребоваться получать с пищей. Людям, которые не синтезируют достаточное количество аргинина, цистеина, глутамина, пролина, селеноцистеина, серина и тирозина, например, из-за болезни, могут потребоваться пищевые добавки, содержащие эти аминокислоты.
Таблица 2.1 – Заменимые и незаменимые аминокислоты
Небелковые аминокислоты
В клетках также обнаружены α-аминокислоты, которые не включены в белки. Общие из них включают орнитин и цитруллин. Оба этих соединения являются промежуточными продуктами цикла мочевины. Орнитин является метаболическим предшественником аргинина, а цитруллин может образовываться при распаде аргинина. Последняя реакция производит оксид азота, важную сигнальную молекулу. Цитруллин является побочным продуктом метаболизма. Иногда его используют в качестве пищевой добавки для уменьшения мышечной усталости. 9Таблица 2.2. Категории аминокислот (на основе свойств R-групп) Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту, классифицируемую разными авторами по-разному. Действительно, мы классифицируем тирозин и как ароматическую аминокислоту, и как гидроксильную аминокислоту. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) сходными боковыми группами будут функционировать сходным образом, например, во время фолдинга белка.
9Таблица 2.2. Категории аминокислот (на основе свойств R-групп) Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту, классифицируемую разными авторами по-разному. Действительно, мы классифицируем тирозин и как ароматическую аминокислоту, и как гидроксильную аминокислоту. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) сходными боковыми группами будут функционировать сходным образом, например, во время фолдинга белка.
Неполярные аминокислоты
- Аланин (Ala/A) является одной из самых распространенных аминокислот в белках, уступая по распространенности только лейцину. D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG.

- Глицин (Gly/G) представляет собой аминокислоту с самой короткой боковой цепью, имеющую R-группу, состоящую только из одного водорода. В результате глицин является единственной аминокислотой, которая не является хиральной. Его небольшая боковая цепь позволяет ему легко вписываться как в гидрофобные, так и в гидрофильные среды.
- Глицин определяется в генетическом коде GGU, GGC, GGA и GGG. Для человека это несущественно.
- Изолейцин (Ile/I) представляет собой незаменимую аминокислоту, кодируемую AUU, AUC и AUA. Он имеет гидрофобную боковую цепь, а также хиральную боковую цепь.
- Лейцин (Leu/L) представляет собой аминокислоту с разветвленной цепью, гидрофобную и незаменимую. Лейцин является единственной диетической аминокислотой, которая напрямую стимулирует синтез белка в мышцах, но следует соблюдать осторожность, поскольку 1) существуют противоречивые исследования и 2) токсичность лейцина опасна, что приводит к «четырем D»: диарее, дерматиту, деменции.
 и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG.
и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG. - Метионин (Met/M) является незаменимой аминокислотой, которая является одной из двух серосодержащих аминокислот, а другой является цистеин. Метионин неполярен и кодируется исключительно кодоном AUG. Это аминокислота-«инициатор» в синтезе белка, она первой включается в белковые цепи. В прокариотических клетках формилируется первый метионин в белке.
- Пролин (Pro/P) – единственная аминокислота, обнаруженная в белках с R-группой, которая соединяется со своей собственной α-аминогруппой, образуя вторичный амин и кольцо. Пролин является заменимой аминокислотой и кодируется CCU, CCC, CCA и CCG. Это наименее гибкая из белковых аминокислот и, таким образом, придает конформационную жесткость, когда присутствует в белке. Присутствие пролина в белке влияет на его вторичную структуру. Это разрушитель α-спиралей и β-цепей. Пролин часто подвергается гидроксилированию в коллагене (для реакции требуется витамин С — аскорбат), что повышает конформационную стабильность белка.
 Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода.
Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода. - Валин (Val/V) — незаменимая неполярная аминокислота, синтезируемая в растениях. Это примечательно для гемоглобина, поскольку, когда он заменяет глутаминовую кислоту в положении номер шесть, он вызывает аномальную агрегацию гемоглобина в условиях низкого содержания кислорода, что приводит к серповидно-клеточной анемии. Валин кодируется в генетическом коде GUU, GUC, GUA и GUG.
Карбоксильные аминокислоты
- Аспарагиновая кислота (Asp/D) представляет собой заменимую аминокислоту с карбоксильной группой в R-группе. Его легко получить переаминированием оксалоацетата. С рКа 3,9, боковая цепь аспарагиновой кислоты заряжена отрицательно при физиологическом рН. Аспарагиновая кислота определяется в генетическом коде кодонами GAU и GAC.
- Глутаминовая кислота (Glu/E), кодируемая GAA и GAG, представляет собой заменимую аминокислоту, легко получаемую трансаминированием α-кетоглутарата.
 Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Аминовые аминокислоты
- Аргинин (Arg/R) представляет собой аминокислоту, которая в некоторых случаях является незаменимой, а в других – заменимой. Недоношенные дети не могут синтезировать аргинин. Кроме того, хирургическая травма, сепсис и ожоги увеличивают потребность в аргинине. Однако большинству людей добавки с аргинином не нужны. Боковая цепь аргинина содержит сложную группу гуанидиния с рКа более 12, что делает его положительно заряженным при клеточном рН. Он кодируется шестью кодонами — CGU, CGC, CGA, CGG, AGA и AGG.
- Гистидин (His/H) является единственной из белковых аминокислот, содержащей функциональную группу имидазола. Это незаменимая аминокислота для человека и других млекопитающих. С pKa боковой цепи, равным 6, его заряд может легко измениться при небольшом изменении pH.
 Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
- Лизин (Lys/K) – незаменимая аминокислота, кодируемая AAA и AAG. Он имеет R-группу, которая может легко ионизироваться с зарядом +1 при физиологическом pH и может быть посттрансляционно модифицирована с образованием ацетиллизина, гидроксилизина и метиллизина. Он также может быть убиквитинирован, сумоилирован, неддилирован, биотинилирован, карбоксилирован и купилирован. O-гликозилирование гидроксилизина используется для пометки белков для экспорта из клетки. Лизин часто добавляют в корма для животных, поскольку он является лимитирующей аминокислотой и необходим для оптимизации роста свиней и цыплят.
Ароматические аминокислоты
Рисунок 2.6. Ароматические аминокислоты- Фенилаланин (Phe/F) — неполярная незаменимая аминокислота, кодируемая UUU и UUC. Это метаболический предшественник тирозина.
 Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама.
Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама. - Триптофан (Trp/W) представляет собой незаменимую аминокислоту, содержащую индольную функциональную группу. Это метаболический предшественник серотонина, ниацина и (в растениях) фитогормона ауксина. Несмотря на то, что он считается снотворным, нет четких результатов исследований, указывающих на это.
- Тирозин (Tyr/Y) — заменимая аминокислота, кодируемая UAC и UAU. Он является мишенью для фосфорилирования белков тирозиновыми протеинкиназами и играет роль в процессах передачи сигналов. В дофаминергических клетках головного мозга тирозингидроксилаза превращает тирозин в L-допу, непосредственный предшественник дофамина. Дофамин, в свою очередь, является предшественником норадреналина и адреналина. Тирозин также является предшественником гормонов щитовидной железы и меланина.
Гидроксиаминокислоты
- Серин (Ser/S) — одна из трех аминокислот, имеющих R-группу с гидроксилом (остальные — треонин и тирозин). Он кодируется UCU, UCC, UCA, UGC, AGU и AGC. Будучи способной образовывать водородные связи с водой, она классифицируется как полярная аминокислота. Для человека это не принципиально. Серин является предшественником многих важных клеточных соединений, в том числе пуринов, пиримидинов, сфинголипидов, фолиевой кислоты и аминокислот глицина, цистеина и триптофана. Гидроксильная группа серина в белках является мишенью для фосфорилирования некоторыми протеинкиназами. Серин также является частью каталитической триады сериновых протеаз.
- Треонин (Thr/T) – незаменимая полярная аминокислота. Это одна из трех аминокислот, несущих гидроксильную группу (другими являются серин и тирозин), и поэтому она является мишенью для фосфорилирования в белках. Он также является мишенью для гликозилирования белков.
 Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге. Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге. Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Тирозин — см. ЗДЕСЬ.
Рисунок 2.8 – Свойства аминокислот ВикипедияДругие аминокислоты
- Аспарагин (Asn/N) – заменимая аминокислота, кодируемая AAU и AAC. Его карбоксиамид в R-группе придает ему полярность. Аспарагин участвует в образовании акриламида в продуктах, приготовленных при высоких температурах (жарка во фритюре), когда он реагирует с карбонильными группами. Аспарагин может быть получен в организме из аспартата путем реакции амидирования с амином из глютамина. При распаде аспарагина образуется малат, который может окисляться в цикле лимонной кислоты.
- Цистеин (Cys/C) — единственная аминокислота с сульфгидрильной группой в боковой цепи.
 Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона. Цистеин определяется кодонами UGU и UGC.
Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона. Цистеин определяется кодонами UGU и UGC.
- Глутамин (Gln/Q) – это аминокислота, которая обычно не является незаменимой для человека, но может быть у людей, подвергающихся интенсивным спортивным тренировкам или страдающих желудочно-кишечными расстройствами. Он имеет карбоксиамидную боковую цепь, которая обычно не ионизируется при физиологических pH, но придает полярность боковой цепи. Глютамин кодируется CAA и CAG и легко производится амидированием глутамата. Глютамин является наиболее распространенной аминокислотой в циркулирующей крови и одной из немногих аминокислот, которые могут преодолевать гематоэнцефалический барьер.

- Селеноцистеин (Sec/U) является компонентом селенопротеинов, встречающихся во всех царствах жизни. Он является компонентом нескольких ферментов, включая глутатионпероксидазы и тиоредоксинредуктазы. Селеноцистеин встраивается в белки по необычной схеме с участием стоп-кодона UGA. Клетки, выращенные в отсутствие селена, обрывают синтез белка на УГА. Однако, когда присутствует селен, некоторые мРНК, которые содержат последовательность вставки селеноцистеина (SECIS), вставляют селеноцистеин, когда встречается UGA. Элемент SECIS имеет характерные нуклеотидные последовательности и паттерны спаривания оснований вторичной структуры. Двадцать пять белков человека содержат селеноцистеин.
- Пирролизин (Pyl/O) представляет собой двадцать вторую аминокислоту, но редко встречается в белках. Как и селеноцистеин, он не закодирован в генетическом коде и должен быть включен необычными способами. Это происходит на стоп-кодонах UAG. Пирролизин обнаружен в метаногенных архейских организмах и по крайней мере в одной метанпродуцирующей бактерии.
 Пирролизин входит в состав ферментов, образующих метан.
Пирролизин входит в состав ферментов, образующих метан.
Ионизирующие группы
Значения pKa для боковых цепей аминокислот сильно зависят от химической среды, в которой они находятся. Например, карбоксильная группа R, обнаруженная в аспарагиновой кислоте, имеет значение pKa 3,9.в свободном состоянии в растворе, но может достигать 14 в определенных средах внутри белков, хотя это необычно и экстремально. Каждая аминокислота имеет по крайней мере одну ионизируемую аминогруппу (α-амин) и одну ионизируемую карбоксильную группу (α-карбоксил). Когда они связаны пептидной связью, они больше не ионизируются. Некоторые, но не все аминокислоты имеют R-группы, способные к ионизации. Тогда заряд белка возникает из зарядов α-аминной группы, α-карбоксильной группы. и сумма зарядов ионизированных R-групп. Титрование/ионизация аспарагиновой кислоты изображено на рис. 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Большинство белков имеют относительно узкие диапазоны оптимальной активности, которые обычно соответствуют среде, в которой они находятся (рисунок 2.11). Стоит отметить, что образование пептидных связей между аминокислотами приводит к удалению ионизируемых водородов как из α-аминной, так и из α-карбоксильной групп аминокислот. Таким образом, ионизация/деионизация в белке происходит только с 1) амино-конца; 2) карбоксильный конец; 3) R-группы; или 4) другие функциональные группы (такие как сульфаты или фосфаты), добавленные к аминокислотам посттрансляционно — см. ниже.
Карнитин
Не все аминокислоты в клетке входят в состав белков. Наиболее распространенные примеры включают орнитин (метаболизм аргинина), цитруллин (цикл мочевины) и карнитин (рис. 2.12). Когда жирные кислоты, предназначенные для окисления, перемещаются в митохондрии для этой цели, они проходят через внутреннюю мембрану, прикрепленную к карнитину. Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Жирные кислоты из экзогенных источников должны активироваться при попадании в цитоплазму путем присоединения к коферменту А. Часть молекулы КоА заменяется карнитином в межмембранном пространстве митохондрии в реакции, катализируемой карнитинацилтрансферазой I. В результате Молекула ацилкарнитина переносится через внутреннюю митохондриальную мембрану с помощью карнитинацилкарнитинтранслоказы, а затем в матриксе митохондрии карнитинацилтрансфераза II заменяет карнитин коферментом А (рис. 6.88).
Рисунок 2.11 – Ферментативная активность изменяется при изменении pH Изображение Aleia KimКатаболизм аминокислот
Мы классифицируем аминокислоты как незаменимые и заменимые в зависимости от того, может ли организм их синтезировать. Однако все аминокислоты могут расщепляться всеми организмами. На самом деле они являются источником энергии для клеток, особенно во время голодания или для людей, придерживающихся диеты с очень низким содержанием углеводов. С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные продукты, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные продукты превращаются в ацетил-КоА. На рис. 2.13 показаны метаболические судьбы катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются одновременно глюкогенными и кетогенными.
С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные продукты, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные продукты превращаются в ацетил-КоА. На рис. 2.13 показаны метаболические судьбы катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются одновременно глюкогенными и кетогенными.
Посттрансляционные модификации
После синтеза белка боковые цепи аминокислот внутри него могут быть химически модифицированы, что приводит к большему разнообразию структуры и функций (рис. 2.14). Общие изменения включают фосфорилирование гидроксильных групп серина, треонина или тирозина. Лизин, пролин и гистидин могут иметь гидроксилы, присоединенные к аминам в их R-группах. Другие модификации аминокислот в белках включают добавление жирных кислот (миристиновой кислоты или пальмитиновой кислоты), изопреноидных групп, ацетильных групп, метильных групп, йода, карбоксильных групп или сульфатов. Они могут иметь эффекты ионизации (добавление фосфатов/сульфатов), деионизации (присоединение ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины имеют углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Они могут иметь эффекты ионизации (добавление фосфатов/сульфатов), деионизации (присоединение ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины имеют углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Некоторые аминокислоты являются предшественниками важных соединений в организме. Примеры включают адреналин, гормоны щитовидной железы, Ldopa и дофамин (все из тирозина), серотонин (из триптофана) и гистамин (из гистидина).
Рисунок 2.14 – Посттрансляционно модифицированные аминокислоты. Модификации показаны зеленым цветом. Рисунок 2.15. Фосфорилированные аминокислотыСтроительные полипептиды
Хотя аминокислоты выполняют в клетках и другие функции, их наиболее важная роль заключается в том, что они входят в состав белков. Белки, как мы отмечали ранее, представляют собой полимеры аминокислот.
Аминокислоты связаны друг с другом пептидными связями, в которых карбоксильная группа одной аминокислоты присоединяется к аминогруппе следующей с потерей молекулы воды. Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много). Конец пептида со свободной аминогруппой называется N-концом (для Nh3), а конец со свободным карбоксилом называется С-концом (для карбоксила).
Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много). Конец пептида со свободной аминогруппой называется N-концом (для Nh3), а конец со свободным карбоксилом называется С-концом (для карбоксила).
Как мы отмечали ранее, функция зависит от структуры, и цепочка аминокислот должна складываться в определенную трехмерную форму или конформацию, чтобы сделать функциональный белок. Сворачивание полипептидов в их функциональные формы является темой следующего раздела.
Эта страница под заголовком 2.2: Структура и функции — Аминокислоты распространяется по лицензии CC BY-NC-SA, ее авторами, ремиксами и/или кураторами являются Кевин Ахерн, Индира Раджагопал и Таралин Тан.

