Тестовая работа по биологии 9класс
Тест по теме «Молекулярный уровень»
Вариант I
1. Какое из названных химических соединений не является биополимером?
а) Белок;
б) глюкоза;
в) дезоксирибонуклеиновая кислота;
г) целлюлоза.
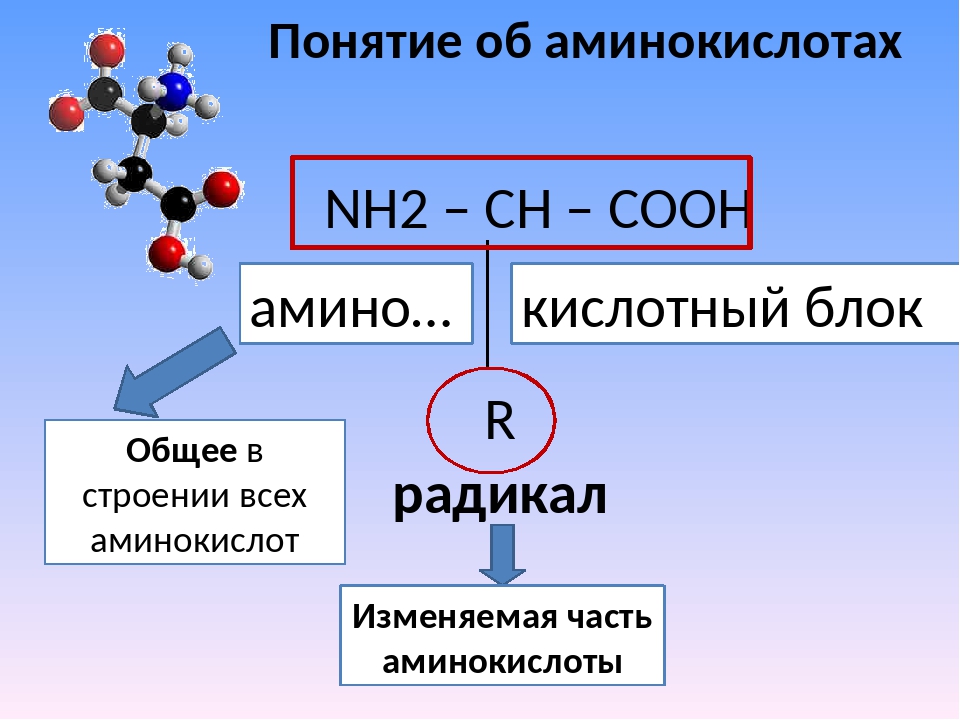
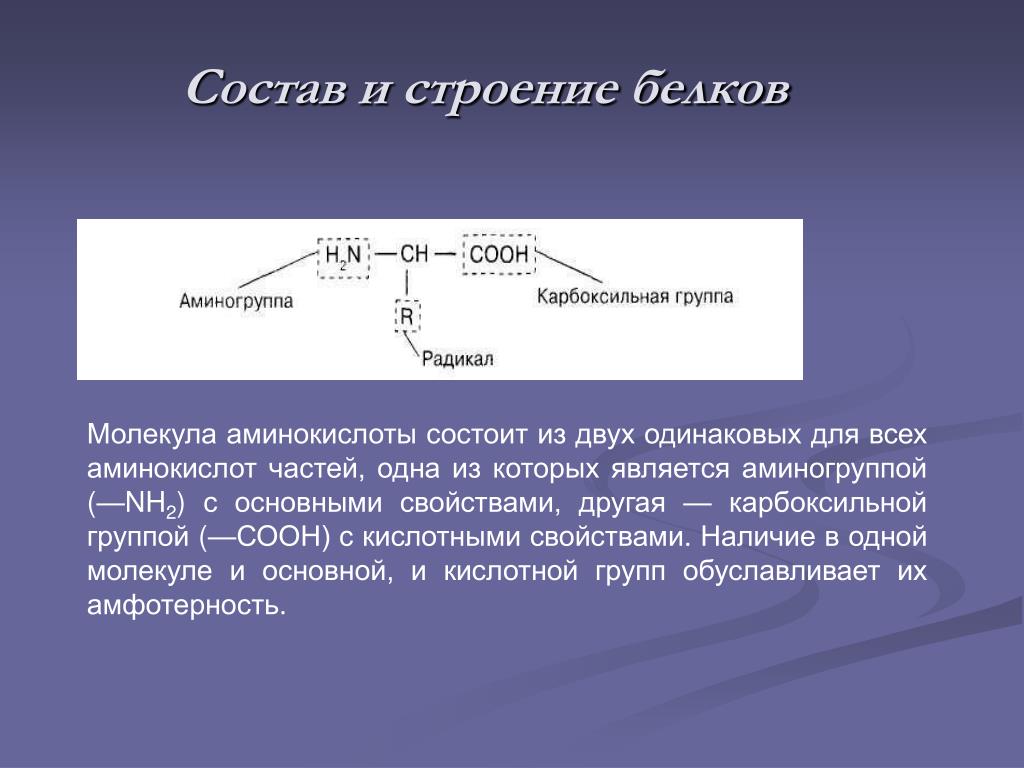
2. Изменяемыми частями аминокислоты являются:
а) аминогруппа и карбоксильная группа;
б) радикал;
в) карбоксильная группа;
г) радикал и карбоксильная группа.
3. В процессе биохимических реакций ферменты:
а) ускоряют реакции, а сами при этом не изменяются;
б) ускоряют реакции и изменяются в результате реакции;
в) замедляют реакции, не изменяясь;
г) замедляют реакции, изменяясь.
4. Мономерами ДНК и РНК являются:
а) азотистые основания;
б) дезоксирибоза и рибоза;
в) азотистые основания и фосфатные группы;
г) нуклеотиды.
5. Вторичная структура белка поддерживается:
а) пептидными связями;
б) водородными связями;
в) дисульфидными связями;
г) связями между радикалами кислот;
г) всеми перечисленными видами связи.
6. К полимерам относятся:
а) крахмал, белок, целлюлоза;
б) белок, гликоген, жир;
в) целлюлоза, сахароза, крахмал;
г) рибоза, белок, жир.
7. Из аминокислотных остатков построены молекулы:а) углеводов;
б) белков;
в) липидов;
г) жиров.
8. К моносахаридам относятся:
а) лактоза, глюкоза;
б) дезоксирибоза, сахароза;
в) глюкоза, фруктоза;
г) гликоген, мальтоза.
9. Какую функцию выполняет рибосомальная РНК?
а) Формирует рибосомы;
б) снятие и перенос информации с ДНК;
в) перенос аминокислоты на рибосомы;
г) все перечисленные функции.
10. Соединение двух цепей ДНК в спираль осуществляют связи:
а) ионные;
б) водородные;
в) гидрофобные;
г) электростатические.
11. Белковая оболочка, в которую заключен геном вируса, называется
а) вирион
б) капсула
в) вироид
г) капсид
12. Вирусы размножаются
Вирусы размножаются
а) только в клетке хозяина
б) самостоятельно, вне клеток хозяина
в) оба варианта верные
Задача: фрагмент одной из цепей ДНК имеет следующее строение: ААГ-ГЦТ-АЦГ-ТТГ. Постройте на ней и-РНК.
Вариант II
1. Какое из веществ хорошо растворяется в воде?
а) Клетчатка;
б) белок;
в) глюкоза;
г) липиды.2. Молекулы белков отличаются друг от друга:
а) последовательностью чередования аминокислот;
б) количеством аминокислот в молекуле;
в) формой третичной структуры;
г) всеми указанными особенностями.
3. В каком случае правильно указан состав нуклеотида ДНК:
а) рибоза, остаток фосфорной кислоты, тимин;
б) фосфорная кислота, урацил, дезоксирибоза;
в) остаток фосфорной кислоты, дезоксирибоза, аденин;
г) фосфорная кислота, рибоза, гуанин.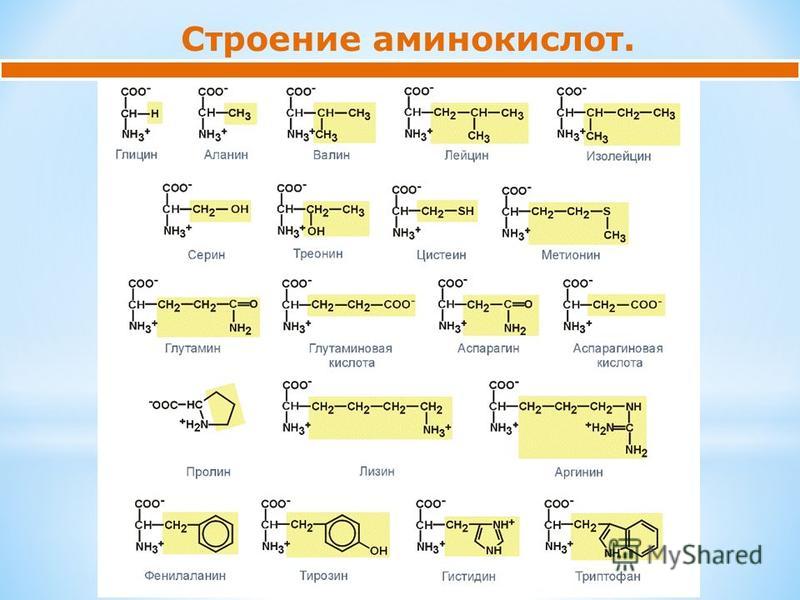
4. Мономерами нуклеиновых кислот являются:
а) азотистые основания;
б) рибоза или дезоксирибоза;
в) дезоксирибоза и фосфатные группы;
г) нуклеотиды.
5. Аминокислоты в молекуле белка соединены посредством:
а) ионной связи;
б) пептидной связи;
в) водородной связи;
г) связи между радикалами кислот.
6. Какую функцию выполняет транспортная РНК?
а) Перенос аминокислоты на рибосомы;
б) снятие и перенос информации с ДНК;
в) формирует рибосомы;
г) все перечисленные функции.
7. Ферменты – это биокатализаторы, состоящие:
а) из белков;
б) липидов;
в) нуклеотидов;
г) жиров.
8. К полисахаридам относятся:
а) крахмал, рибоза;
б) гликоген, глюкоза;
в) целлюлоза, крахмал;
г) крахмал, сахароза.
9. Углерод как элемент входит в состав:
а) белков и углеводов;
б) углеводов и липидов;
в) углеводов и нуклеиновых кислот;
г) всех органических соединений клетки.
10. Клетка содержит ДНК:
а) в ядре и митохондриях:
б) ядре, цитоплазме и различных органоидах;
в) ядре, митохондриях и цитоплазме;
г) ядре, митохондриях и хлоропластах.
11.Вирусы — это …
а) неклеточная форма жизни
б) древнейшие эукариоты
в) примитивные бактерии
12.
а) белков и нуклеиновой кислоты
б) целлюлозы и белков
в) ДНК и РНК
г) ядра и цитоплазмы
Задача: фрагмент и-РНК имеет следующее строение: ГАУ-ГАГ-УАЦ-УУЦ-ААА. Определите антикодоны т-РНК. Также напишите фрагмент молекулы ДНК, на котором была синтезирована эта и-РНК.
Ответы:
Вариант I: 1 – б, 2 – б, 3 – а, 4 – г, 5 – б, 6 – а, 7 – б, 8 – в, 9 – а, 10 – б, 11-г, 12-а.
Решение: по правилу комплементарности определяем фрагмент и-РНК и разбиваем его на триплеты: УУЦ-ЦГА-УГЦ-ААЦ.
Вариант II: 1 – в, 2 – г, 3 – в, 4 – г, 5 – б, 6 – а, 7 – а, 8 – в, 9 – г, 10 – г, 11-а, 12-в.
Решение: разбиваем и-РНК на триплеты ГАУ-ГАГ-УАЦ-УУЦ-ААА. В данном фрагменте содержится 5 триплетов, поэтому в синтезе будет участвовать 5 т-РНК. Их антикодоны определяем по правилу комплементарности: ЦУА-ЦУЦ-АУГ-ААГ-УУУ. Также по правилу комплементарности определяем фрагмент ДНК (по и-РНК!!!): ЦТАЦТЦАТГААГТТТ.
Их антикодоны определяем по правилу комплементарности: ЦУА-ЦУЦ-АУГ-ААГ-УУУ. Также по правилу комплементарности определяем фрагмент ДНК (по и-РНК!!!): ЦТАЦТЦАТГААГТТТ.
Самостоятельная работа «Молекулярный уровень» 9 кл
Обобщающий урок по теме «Молекулярный уровень организации живой природы»
Цель: повторить и обобщить материал, изученный в разделе «Молекулярный уровень».
задание № 1 Тест
Вариант I
1. Какое из названных химических соединений не является биополимером?
а) Белок;
б) глюкоза;
в) дезоксирибонуклеиновая кислота;
г) целлюлоза.
2. Изменяемыми частями аминокислоты являются:
а) аминогруппа и карбоксильная группа;
б) радикал;
в) карбоксильная группа;
г) радикал и карбоксильная группа.
3. В процессе биохимических реакций ферменты:
а) ускоряют реакции, а сами при этом не изменяются;
б) ускоряют реакции и изменяются в результате реакции;
в) замедляют реакции, не изменяясь;
г) замедляют реакции, изменяясь.
4. Мономерами ДНК и РНК являются:
а) азотистые основания;
б) дезоксирибоза и рибоза;
в) азотистые основания и фосфатные группы;
г) нуклеотиды.
5. Вторичная структура белка поддерживается:
а) пептидными связями;
б) водородными связями;
в) дисульфидными связями;
г) связями между радикалами кислот;
г) всеми перечисленными видами связи.
6. К полимерам относятся:
а) крахмал, белок, целлюлоза;
б) белок, гликоген, жир;
в) целлюлоза, сахароза, крахмал;
г) рибоза, белок, жир.
7. Из аминокислотных остатков построены молекулы:
а) углеводов;
б) белков;
в) липидов;
г) жиров.
8. К моносахаридам относятся:
а) лактоза, глюкоза;
б) дезоксирибоза, сахароза;
в) глюкоза, фруктоза;
г) гликоген, мальтоза.
9. Какую функцию выполняет рибосомальная РНК?
а) Формирует рибосомы;
б) снятие и перенос информации с ДНК;
в) перенос аминокислоты на рибосомы;
г) все перечисленные функции.
10. Соединение двух цепей ДНК в спираль осуществляют связи:
а) ионные;
б) водородные;
в) гидрофобные;
г) электростатические.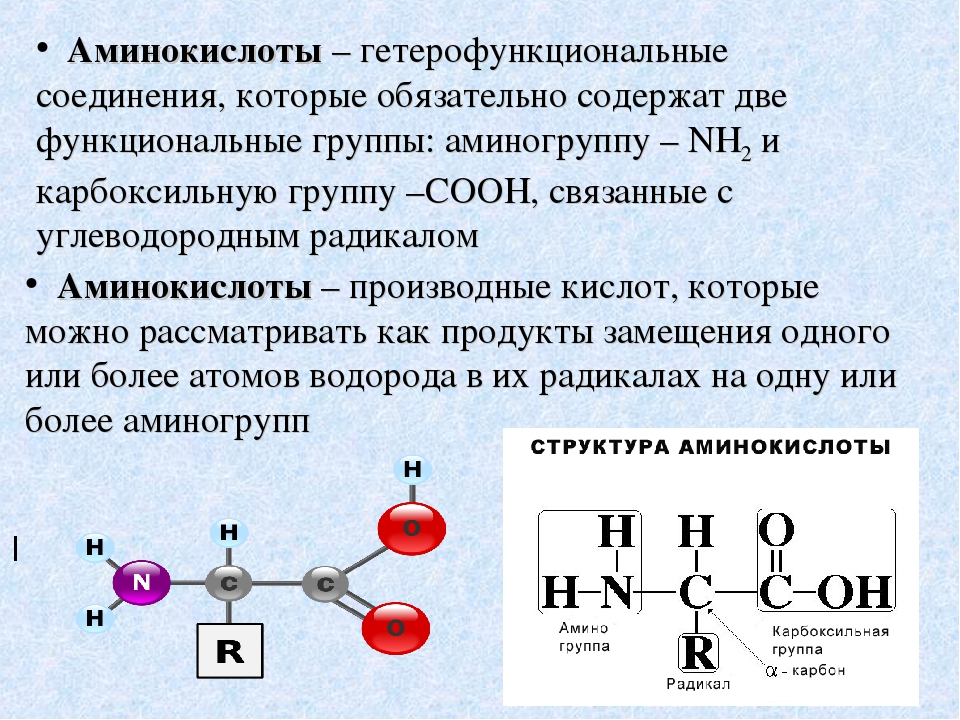
Задание № 2 Дайте определения терминам:
Пептид-…
Хитин-…………..
Гормон-………….
Протеин-………….
Глобула-……………
ДНК-………….
Нуклеотид-…………..
Витамины-………….
Фермент-…………..
Вирус-……….
Вариант II
1. Какое из веществ хорошо растворяется в воде?
а) Клетчатка;
б) белок;
в) глюкоза;
г) липиды.
2. Молекулы белков отличаются друг от друга:
а) последовательностью чередования аминокислот;
б) количеством аминокислот в молекуле;
в) формой третичной структуры;
г) всеми указанными особенностями.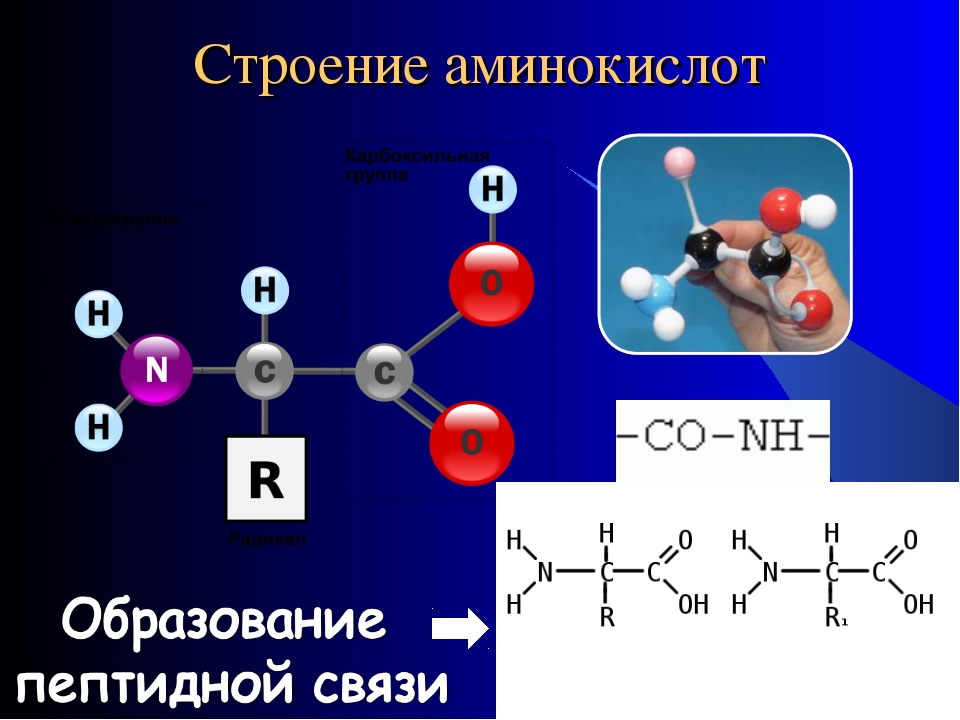
3. В каком случае правильно указан состав нуклеотида ДНК:
а) рибоза, остаток фосфорной кислоты, тимин;
б) фосфорная кислота, урацил, дезоксирибоза;
в) остаток фосфорной кислоты, дезоксирибоза, аденин;
г) фосфорная кислота, рибоза, гуанин.
4. Мономерами нуклеиновых кислот являются:
а) азотистые основания;
б) рибоза или дезоксирибоза;
в) дезоксирибоза и фосфатные группы;
г) нуклеотиды.
5. Аминокислоты в молекуле белка соединены посредством:
а) ионной связи;
б) пептидной связи;
в) водородной связи;
г) связи между радикалами кислот.
6. Какую функцию выполняет транспортная РНК?
а) Перенос аминокислоты на рибосомы;
б) снятие и перенос информации с ДНК;
в) формирует рибосомы;
г) все перечисленные функции.
7. Ферменты – это биокатализаторы, состоящие:
а) из белков;
б) липидов;
в) нуклеотидов;
г) жиров.
8. К полисахаридам относятся:
а) крахмал, рибоза;
б) гликоген, глюкоза;
в) целлюлоза, крахмал;
г) крахмал, сахароза.
9. Углерод как элемент входит в состав:
а) белков и углеводов;
б) углеводов и липидов;
в) углеводов и нуклеиновых кислот;
г) всех органических соединений клетки.
10. Клетка содержит ДНК:
а) в ядре и митохондриях:
б) ядре, цитоплазме и различных органоидах;
в) ядре, митохондриях и цитоплазме;
г) ядре, митохондриях и хлоропластах.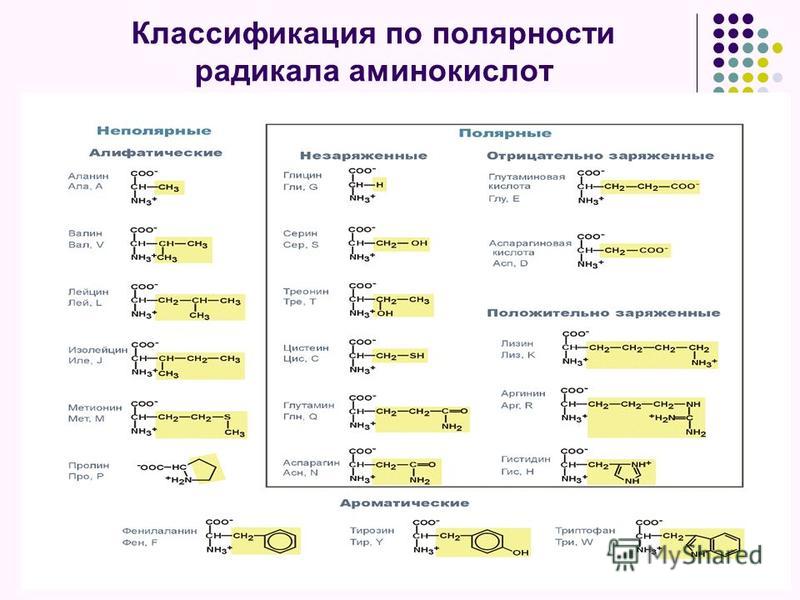
Задание № 2 Дайте определения терминам:
Мономер-
Белки-
Глюкоза-
Жиры-
Аминокислота-
Денатурация-
АТФ-
Катализатор-
Кофермент-
Капсид-
Ответы:
Вариант I: 1 – б, 2 – б, 3 – а, 4 – г, 5 – б, 6 – а, 7 – б, 8 – в, 9 – а, 10 – б.
Вариант II: 1 – в, 2 – г, 3 – в, 4 – г, 5 – б, 6 – а, 7 – а, 8 – в, 9 – г, 10 – г.
Контрольная работа к промежуточной аттестации по биологии в 10 классе за I полугодие
Контрольная работа к промежуточной аттестации по биологии в 10 классе за I полугодие
1 вариант
Часть А (задания с одним правильным ответом)
1) Все ферменты являются:
а) углеводами б) липидами в) аминокислотами г) белками
2) Строительная функция углеводов состоит в том, что они:
а) образуют целлюлозную клеточную стенку у растений в) являются биополимерами
б) способны растворяться в воде г) служат запасным веществом животной клетки
3) Основная функция жиров в клетке:
а) транспорт веществ в) входят в состав биологических мембран
б) ускорение химических реакций г) двигательная функция
4) Основной функцией углеводов в сравнении с белками является:
а) строительная б) защитная в) каталитическая г) энергетическая
5) Какой углевод входит в состав нуклеотидов РНК?
а) рибоза б) глюкоза в) урацил г) дезоксирибоза
6) К полимерам относятся:
а) крахмал, белок, целлюлоза в) целлюлоза, сахароза, крахмал
б) белок, гликоген, жир г) глюкоза, аминокислота, нуклеотид.
7) Какую функцию выполняют рибосомы ?
а) фотосинтез б) синтез белков в) синтез жиров г) синтез АТФ
8) Генетическая информация бактериальной клетки содержится в :
а) белке б) цитоплазме в) нуклеотиде г)ядре
9). Хлоропласты есть в клетках:
а) корня дуба б) печени орла в) плодового тела трутовика г) листа садовой земляники
10). Зрелые эритроциты человека живут ограниченный срок в связи с отсутствием :
а )митохондрий б) цитоплазмы в) ядра; г) рибосом
11). Какие органеллы цитоплазмы имеют двухмембранное строение?
а) ЭПС б) митохондрии в) рибосомы г) комплекс Гольджи
12) Главные отличия клеток прокариот от эукариот:
а) наличие ядерной оболочки б) отсутствие ядерной оболочки, в) наличие ядрышка г) способ питания
13) Углеводы при фотосинтезе синтезируются из:
а) О2 и Н2О; б) СО2 Н2; в) СО2 и Н2О; г) СО2 и Н2СО3.
14). Разрушение природной структуры белка называется:
а) ренатурацией; б) репарацией; в) дегенерацией; г) денатурацией.
15). Исключите лишнее понятие:
а) радикал; б) аминогруппа; в)карбоксильная группа; г) глюкоза
Часть В
1.Задание с выбором нескольких правильных ответов
В состав молекулы ДНК входит
А) фосфорная кислота Б) аденин В) рибоза Г) дезоксирибоза Д) урацил Е) катион железа
2. Установите соответствие между функцией соединения и биополимером, для которого она характерна. В нижеприведенной таблице под каждым номером, определяющим позиции первого столбца, запишите букву, соответствующей позиции второго столбца.
ФУНКЦИЯ БИОПОЛИМЕР
1) образование клеточных стенок А) полисахарид
2) транспортировка аминокислот Б) нуклеиновая кислота
3) хранение наследственной информации
4) служит запасным питательным веществом
5) обеспечивает клетку энергией
Часть С
В чем проявляется сходство хлоропластов и митохондрий?
2 вариант
Часть А (задания с одним правильным ответом)
1) Мономером белка является:
а) глюкоза, б) жирная кислота в) аминокислота г) нуклеотид.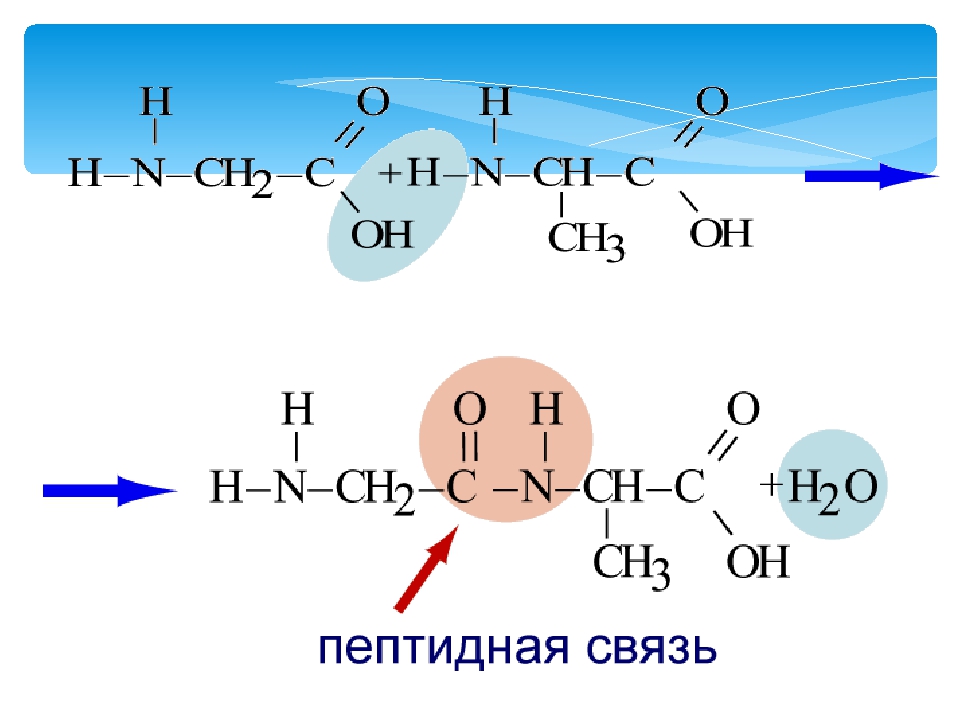
2) Важную роль в жизни клетки играют липиды, так как они:
а) являются ферментами в) служат источником энергии
б) поддерживают постоянную среду в клетке г) растворяются в воде.
3) Какие пары нуклеотидов образуют водородные связи в молекуле ДНК?
а) аденин и тимин в) гуанин и тимин
б) аденин и цитозин г) аденин и урацил
4) Защитная функция белков проявляется в том, что они:
а) подвергаются разрушению в) служат антителами
б) участвуют в построении клетки г) транспортируют газы
5) Какое запасное питательное вещество, служит энергетическим резервом клетки?
а) крахмал б) аминокислота в) нуклеиновая кислота г) полисахарид — хитин
6) К мономерам относятся:
а) крахмал, белок, целлюлоза в) целлюлоза, сахароза, крахмал
б) белок, гликоген, жир г) глюкоза, аминокислота, нуклеотид
7)Какое строение имеют митохондрии?
а) одномембранное б) двухмембранное в) немембранное
8). Основное отличие прокариот от эукариот связано с отсутствием у прокариот:
Основное отличие прокариот от эукариот связано с отсутствием у прокариот:
а)рибосом б) ДНК в) клеточного строения г) настоящего ядра
9). Какие органеллы цитоплазмы имеют двухмембранное строение?
а) ЭПС б)пластиды в)рибосомы г) комплекс Гольджи
10) У каких клеток поверх наружной клеточной мембраны находится целлюлозная стенка?
а) растительная, б) животная
11).Запасным углеводом в клетках печени человека является:
а) целлюлоза; б) крахмал; в) глюкоза; г) гликоген.
12). Неизменяемыми частями аминокислот являются:
а) аминогруппа и карбоксильная группа; б) только радикал;
в) только карбоксильная группа; г) радикал и карбоксильная группа
13). Сколько аминокислот образует все многообразие белков:
а) 170; б) 26; в) 20; г)10.
14). Какую структуру имеет молекула гемоглобина:
а) первичную; б) вторичную; в) третичную; г) четвертичную.
15). Мономерами ДНК и РНК являются:
а) азотистые основания; б) дезоксирибоза и рибоза; в) азотистые основания и фосфатные группы; г) нуклеотиды.
Часть В
1.Задание с выбором нескольких правильных ответов.
В состав молекулы РНК входит
А )рибоза Б) гуанин В) катион магния Г) дезоксирибоза Д) аминокислота Е) фосфорная кислота
2. Установите соответствие между функцией соединения и биополимером, для которого она характерна. В нижеприведенной таблице под каждым номером, определяющим позиции первого столбца, запишите букву, соответствующей позиции второго столбца.
ФУНКЦИЯ БИОПОЛИМЕР
1) хранение наследственной информации А) белок
2) образование новых молекул путем самоудвоения Б) ДНК
3) ускорение химических реакции
4) является обязательным компонентом мембраны клетки
5) обезвреживание антигенов
Часть С
Почему бактерии относят к прокариотам?
Ответы к контрольной работе. 10 класс
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1 в
г
а
в
г
а
а
б
б
г
в
б
б
в
г
г
2 в
в
в
а
в
а
г
б
г
б
а
г
а
в
г
г
1 вариант В1: а,б,г В2: А: 1,4,5 Б: 2,3
2 вариант В1: а,б,е В2: А: 3,4,5 Б: 1,2
1 вариант: 1.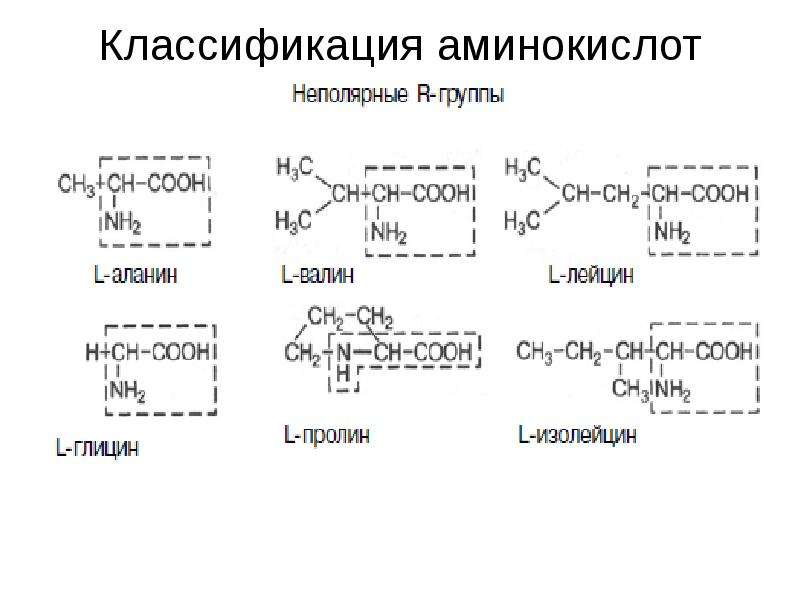 В чем проявляется сходство хлоропластов и митохондрий?
В чем проявляется сходство хлоропластов и митохондрий?
Ответ: 1) двумембранные органоиды; 2) содержат собственную ДНК; 3)имеют рибосомы
2 вариант: 1. Почему бактерии относят к прокариотам?
Ответ: Потому что в их клетках отсутствует оформленное ядро
Молекулярный уровень 9 класс | Тест по биологии (9 класс):
9 класс
Тема: Молекулярный уровень.
Вариант 1
- Укажите вещество, которое не входит в состав нуклеотидов:
А) сахар Б) аминокислота В) азотистое основание Г) остаток фосфорной кислоты
- Какой углевод выполняет запасающую функцию в растительных клетках?
А) крахмал Б) глюкоза В) гликоген Г) целлюлоза
З.Что представляют собой соединения, образованные из жирных кислот и многоатомного спирта глицерина?
А) липиды Б) белки В) углеводы Г) нуклеотиды
4. Какое азотистое основание не входит в состав нуклеотидов РНК?
А) гуанин Б) цитозин В) тимин Г) урацил
5. Сколько типов аминокислот являются мономерами белка?
Сколько типов аминокислот являются мономерами белка?
А) 4 Б) 20 В) 60 | Г) более 100 |
6. Какие функции в клетке выполняет вода?
| Б) терморегуляция Г) все перечисленные функции |
- Что такое первичная структура белка?
- регулярная укладка звеньев белковой молекулы за счет образования между ними водородных связей
Б) последовательность аминокислот в полипептидной цепи
- трехмерная пространственная конфигурация белковой молекулы, образованная за счет ковалентных связей и гидрофобных взаимодействий
Г) объединение нескольких полипептидных цепей в агрегат
- Из каких мономеров состоят нуклеиновые кислоты?
А) из нуклеотидов Б) из моносахаридов В) из аминокислот Г) из фосфолипидов
- Какое азотистое основание входит в состав АТФ?
А) тимин Б) урацил В) гуанин Г) аденин
- Какое вещество является мономером гликогена?
А) нуклеотид Б) глюкоза В) аминокислота Г) фосфолипид
- Запасным полисахаридом животных и большинства грибов является:
А) гликоген Б) крахмал В) мальтоза Г) лактоза
- Какой из химических элементов одновременно входит в состав костной ткани и нуклеиновых кислот?
А) калий Б) фосфор В) кальций Г) цинк
- У детей развивается рахит при недостатке:
А) марганца и железа Б) кальция и фосфора В) меди и цинка Г) серы и азота
- Какое из названных химических соединений не является биополимером?
А) белок Б) глюкоза В) дезоксирибонуклеиновая кислота Г) целлюлоза
- Клетки какого организма наиболее богаты углеводами?
- клетки мышц человека Б) клетки клубня картофеля
- клетки кожицы лука Г) подкожная клетчатка медведя
16. Функциональная группа -СООН в составе молекулы аминокислоты называется:
Функциональная группа -СООН в составе молекулы аминокислоты называется:
А) карбоксильной Б) аминогруппой В) гидроксильной группой Г) радикалом
17.Изменяемыми частями аминокислот являются:
А) аминогруппа и карбоксильная группа Б) радикал В) карбоксильная группа Г) радикал и карбоксильная группа
18.Молекулы белков отличаются друг от друга:
А) последовательностью чередования аминокислот Б) количеством аминокислот в молекуле В) формой третичной структуры Г) всеми указанными особенностями
19.В процессе биохимических реакций ферменты
- ускоряют реакции и сами при этом не изменяются
Б) ускоряют реакции и изменяются в результате реакции
- замедляют химические реакции не изменяясь
Г) замедляют химические реакции изменяясь
20.Молекуле тимина в составе ДНК комплементарна молекула:
А) цитозина Б) урацила В) гуанина Г) аденина
21.В каком случае правильно названы все отличия и-РНК от ДНК?
- одноцепочная, содержит дезоксирибозу, хранит информацию
Б) двуцепочная, содержит рибозу, передает информацию
- одноцепочная, содержит рибозу, передает информацию
Г) двуцепочная, содержит дезоксирибозу, хранит информацию
- Установите соответствие между видами нуклеиновых кислот и их признаками:
Признаки Нуклеиновые кислоты
- молекула представляет собой двойную спираль 1.
 ДНК
ДНК
Б) состоит из одной цепочки мономеров 2. РНК
- в состав нуклеотидов входят азотистые основания А, Ц, Г, У
Г) в состав нуклеотидов входят азотистые основания А, Ц, Г, Т
Д) в строении присутствует принцип комплементарности
Е) выделяются различные виды в зависимости от выполняемых функций
Ж) в состав входит рибоза
3) в состав входит дезоксирибоза
И) располагается в цитоплазме и рибосомах
К) располагается в ядре, митохондриях, пластидах
23. Если цепь ДНК содержит 28% нуклеотида А, то чему примерно должно равняться количество нуклеотида Г? А) 28% Б) 14% В) 22% Г) 44%
9 класс
Тема: Молекулярный уровень.
Вариант 2
- К неорганическим веществам относится:
А) белок Б) глюкоза В) фосфорная кислота Г) целлюлоза
- Клетки какого организма наиболее богаты липидами?
- клетки мышц человека Б) клетки кожицы лука
- подкожная клетчатка медведя Г) клетки клубня картофеля
- Функциональная группа -Nh3 в составе молекулы аминокислоты называется:
А) карбоксильной Б) аминогруппой В) гидроксильной группой Г) радикалом
- Неизменяемыми частями аминокислот являются:
- аминогруппа и карбоксильная группа Б) радикал
- карбоксильная группа Г) радикал и карбоксильная группа
- Как называется нарушение пространственной структуры молекулы белка?
А) денатурация Б) гидролиз В) ренатурация Г) полимеризация
- Какое из соединений не построено из аминокислот?
А) гемоглобин Б) инсулин В) гликоген Г) альбумин
- В процессе биохимических реакций ферменты:
- ускоряют реакции и сами при этом не изменяются
Б) ускоряют реакции и изменяются в результате реакции
- замедляют химические реакции не изменяясь
Г) замедляют химические реакции изменяясь
- От каких условий зависит действие ферментов в организме? .
А) от температуры Б) от pH среды В) от концентрации реагирующих
веществ и концентрации фермента Г) от всех перечисленных условий
- Какую из функций выполняет информационная РНК?
- перенос аминокислот на рибосомы Б) снятие и перенос информации с ДНК
- формирование рибосом Г) все перечисленные функции
- Какая из молекул самая длинная?
А) т-РНК Б) р-РНК В) и-РНК
И. Укажите вещество, которое не входит в состав нуклеотидов:
А) сахар Б) аминокислота В) азотистое основание Г) остаток фосфорной кислоты
- Какой углевод выполняет запасающую функцию в животных клетках?
А) крахмал Б) глюкоза В) гликоген С) целлюлоза
- Что представляют собой соединения, образованные азотистым основанием, пентозой и остатком фосфорной кислоты?
А) липиды Б) белки В) углеводы Г) нуклеиновые кислоты
- Какое азотистое основание не входит в состав нуклеотидов ДНК?
А) гуанин Б) цитозин В) тимин Г) урацил
- Сколько типов аминокислот являются мономерами белка?
А) 4 Б) 20 В) 60 Г) более 100
- Что такое вторичная структура белка?
- регулярная укладка звеньев белковой молекулы за счет образования между ними водородных связей
Б) последовательность аминокислот в полипептидной цепи
- трехмерная пространственная конфигурация белковой молекулы, образованная за счет ковалентных связей и гидрофобных взаимодействий
Г) объединение нескольких полипептидных цепей в агрегат
- Из каких мономеров состоят крахмал и целлюлоза?
А) из нуклеотидов Б) из моносахаридов В) из аминокислот Г) из фосфолипидов
- Молекуле цитозина в составе ДНК комплементарна молекула:
А) тимина Б) урацила В) гуанина Г) аденина
- Аминокислоты соединяются между собой при помощи связи:
А) водородной Б) ковалентной В) пептидной Г) ионной
- Для лечения тяжелых форм сахарного диабета больным необходимо вводить:
А) гемоглобин Б) инсулин В) антитела Г) гликоген
21. В каком случае правильно названы все отличия ДНК от и-РНК ?
В каком случае правильно названы все отличия ДНК от и-РНК ?
- одноцепочная, содержит дезоксирибозу, хранит информацию
Б) двуцепочная, содержит рибозу, передает информацию
- одноцепочная, содержит рибозу, передает информацию
Г) двуцепочная, содержит дезоксирибозу, хранит информацию
22. Установите соответствие между классами органических веществ и их функциями:
Классы веществ Функции
- Белки А) регуляторная
- Нуклеиновые кислоты Б) хранение и передача наследственной информации
В) энергетическая
Г)строительная
Д) запасающая
Е) каталитическая
Ж) защитная
3) сигнальная
И) двигательная
23.Если цепь ДНК содержит 22% нуклеотида Т, то чему примерно должно равняться количество нуклеотида Ц? А) 28% Б) 14% В) 22% Г) 44%
Аминокислоты — Википедия
Материал из Википедии — свободной энциклопедии
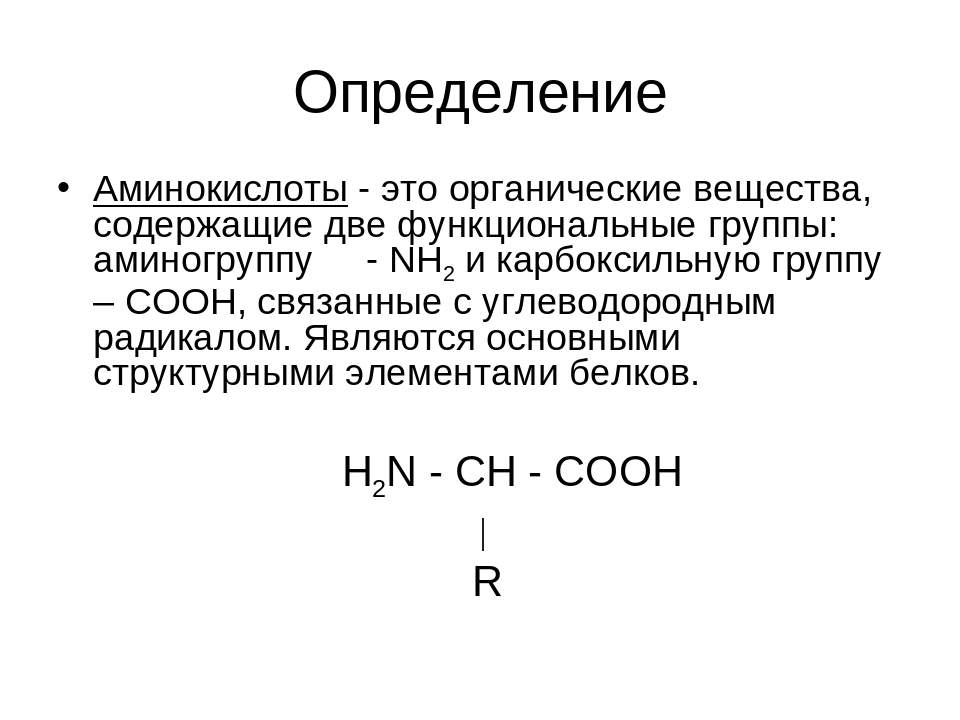
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А.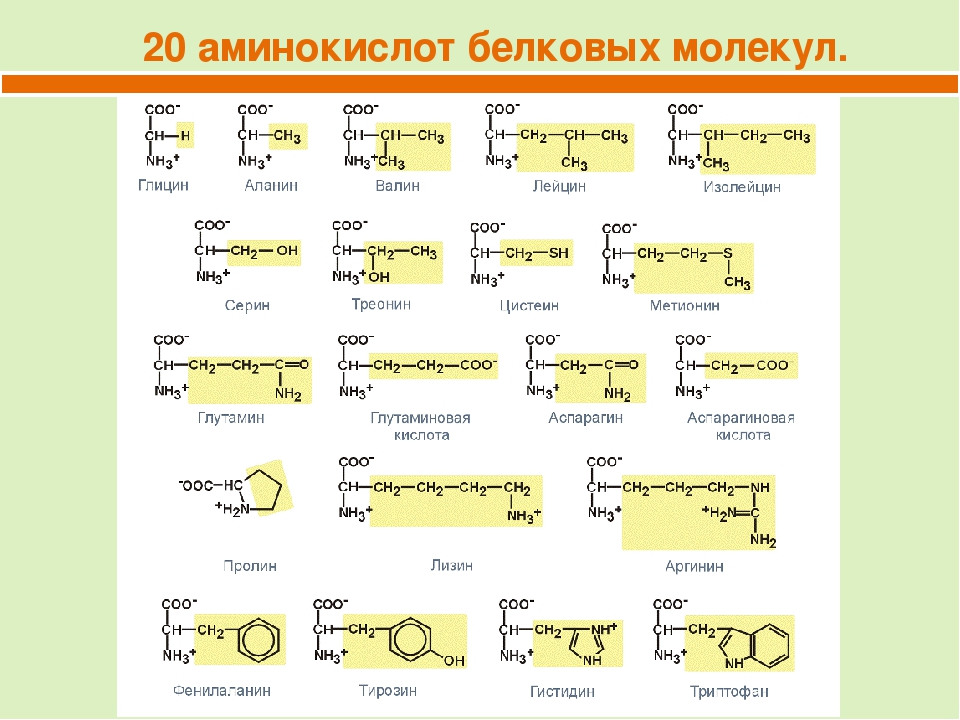 Штреккер, Т. Вейль Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Введение в биологию. Часть №2: evan_gcrm — LiveJournal
Часть №2: evan_gcrm — LiveJournal
Оригинал взят у caenogenesisВведение в биологию (начало)
Введение в биологию. Часть №1
Тема III
БЕЛКИ
Белки, или протеины — огромные молекулы, которые есть во всех современных живых организмах. Термин “белок” (albumin) был в ходу еще с XVIII века и относился к веществам, подобным белку куриного яйца. Термин “протеин” (от греч. πρώτειος, “первичный”) предложил в 1838 году Йенс Якоб Берцелиус (Jöns Jakob Berzelius), известный также как автор терминов “изомерия”, “аллотропия”, “катализ”, “органическая химия” (Vickery, 1950). По-русски “белок” и “протеин” — синонимы.
Берцелиус имел в виду, что “протеины” суть некие первичные строительные блоки живых организмов, и был совершенно прав. По смыслу “протеин” безусловно точнее, чем “белок”, но так уж исторически сложилось, что в русском научном языке “белок” употребляется гораздо чаще, и мы будем этому следовать.
Белки относятся к полимерам, то есть молекулам, состоящим из множества однотипных (но не обязательно одинаковых) звеньев-мономеров.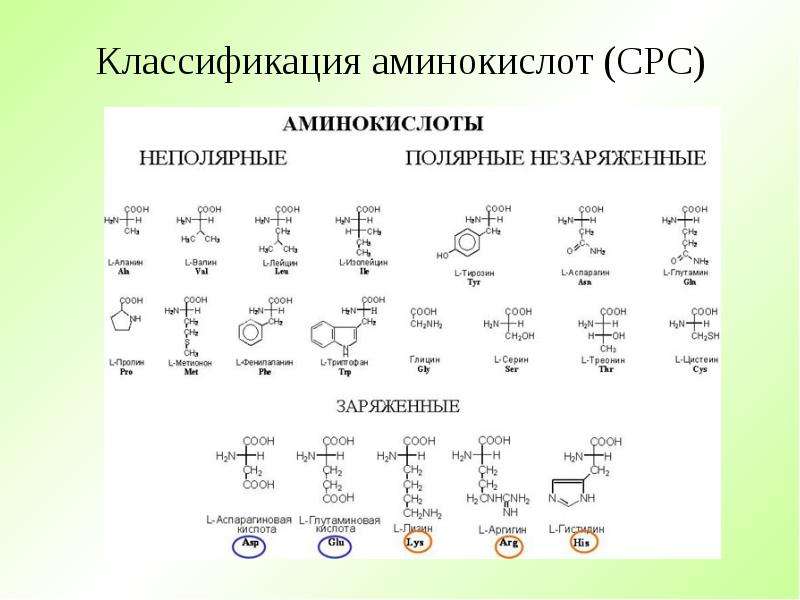 На картинке — два примера случайно выбранных простых полимеров, не имеющих к белкам никакого отношения. Это углеводороды — полиэтилен и полистирол.
На картинке — два примера случайно выбранных простых полимеров, не имеющих к белкам никакого отношения. Это углеводороды — полиэтилен и полистирол.
Мономерами всех белков являются альфа-аминокислоты, то есть такие аминокислоты, у которых аминогруппа и карбоксильная группа связаны с одним и тем же атомом углерода. Перед нами их общая формула. R (радикал) — как всегда, изменяемая часть молекулы.
Напомним, что аминогруппа и карбоксильная группа, которые по определению есть в любой аминокислоте, в водном растворе ионизируются. Вот тут альфа-аминокислота изображена в двух вариантах: слева — стандартный вид, справа — цвиттер-ион, где карбоксильная группа потеряла протон, а аминогруппа, наоборот, приобрела его. Заодно можно обратить внимание на то, что отрицательный заряд в цвиттер-ионе на самом деле делокализован («размазан») между двумя атомами кислорода карбоксильной группы, а не привязан строго к одному из них.
Почему альфа-аминокислоты называются «альфа» и при чем тут вообще греческие буквы? Чтобы разобраться, посмотрим внимательно вот на эту формулу:
Атомы углерода, образующие аминокислоту, принято обозначать по порядку греческими буквами, считая от карбоксильной группы (сама она в счет не идет).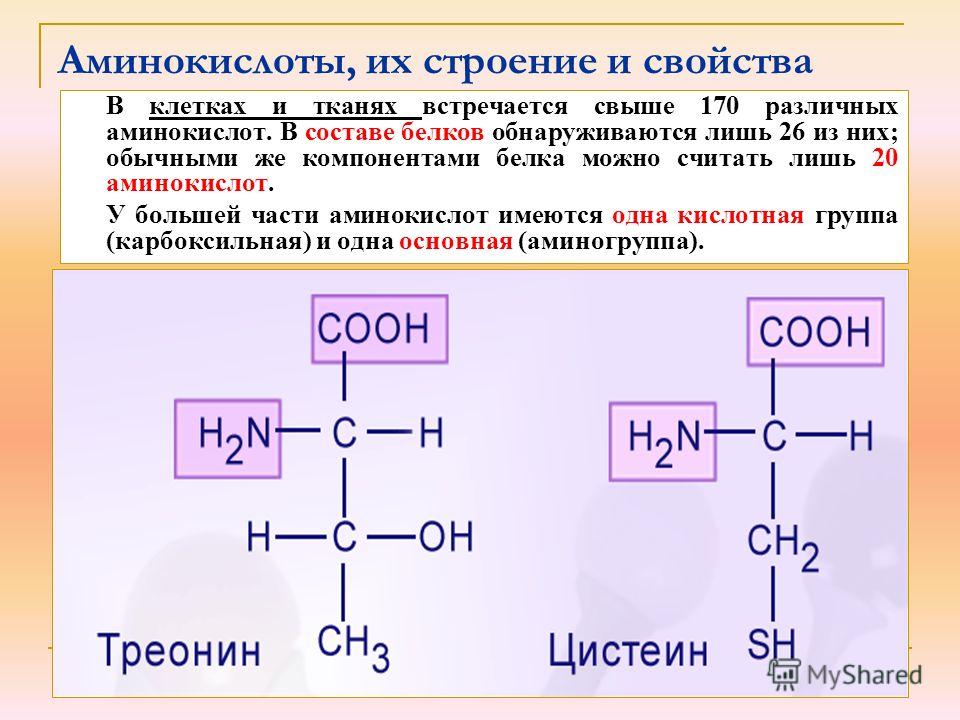 Таким образом, первый атом углерода после карбоксила — это альфа-атом, второй — бета-атом, третий — гамма-атом и так далее. Аминокислоты классифицируются по тому, к какому атому углерода присоединена аминогруппа: альфа-аминокислоты — к первому, бета-аминокислоты — ко второму, и так далее, опять же. В состав белков, как уже сказано, входят только альфа-аминокислоты. А вот на картинке у нас в данном случае гамма-аминокислота. Конкретно это соединение называется гамма-аминомасляной кислотой (ГАМК) и присутствует в некоторых живых организмах, во-первых, как промежуточный продукт обмена, а во-вторых, как нейротрансмиттер — сигнальное вещество, передающее возбуждение от одной нервной клетки к другой. Ни в какие белки ГАМК, разумеется, не входит.
Таким образом, первый атом углерода после карбоксила — это альфа-атом, второй — бета-атом, третий — гамма-атом и так далее. Аминокислоты классифицируются по тому, к какому атому углерода присоединена аминогруппа: альфа-аминокислоты — к первому, бета-аминокислоты — ко второму, и так далее, опять же. В состав белков, как уже сказано, входят только альфа-аминокислоты. А вот на картинке у нас в данном случае гамма-аминокислота. Конкретно это соединение называется гамма-аминомасляной кислотой (ГАМК) и присутствует в некоторых живых организмах, во-первых, как промежуточный продукт обмена, а во-вторых, как нейротрансмиттер — сигнальное вещество, передающее возбуждение от одной нервной клетки к другой. Ни в какие белки ГАМК, разумеется, не входит.
Вот простенькая иллюстрация того, как альфа-аминокислоты соединяются в белок. От карбоксила одной аминокислоты отщепляется -OH, от аминогруппы другой -H, из них образуется вода (H-O-H), а остатки аминокислот соединяются по свободным валентностям связью, которая называется пептидной. Цепочка аминокислот, соединенных пептидными связями, соответственно называется пептидом. Это более широкое понятие, чем белок; иначе говоря, все белки — пептиды, но не все пептиды — белки.
Цепочка аминокислот, соединенных пептидными связями, соответственно называется пептидом. Это более широкое понятие, чем белок; иначе говоря, все белки — пептиды, но не все пептиды — белки.
Тут мы видим более красивую и подробную схему, изображающую, однако, абсолютно то же самое. Разберемся в ней. Во-первых, после замыкания пептидной связи в возникшей новой молекуле тем самым образуется пептидная группа -CO-NH-. Во-вторых, обе аминокислоты теперь показаны в ионизированном виде — как мы уже знаем, это скорее всего соответствует действительности, хотя и не имеет для нас сейчас принципиального значения. В-третьих, радикалы аминокислот — R1 и R2 — в общем случае, конечно, могут быть разными. И в-четвертых, реакция образования пептида тут показана идущей в обе стороны, то есть обратимой. В самом деле, пептиды могут как синтезироваться, так и распадаться обратно на отдельные аминокислоты.
Короткие пептиды называются или по числу аминокислотных остатков (дипептид, трипептид, тетрапептид. ..), или просто олигопептидами.
..), или просто олигопептидами.
В состав белков входит 20 стандартных аминокислот. Самые простые из них — глицин и аланин. У глицина радикал представляет собой просто атом водорода, а у аланина метильную группу. Аминокислоты, входящие в состав белков, коротко называют протеиногенными.
Для читателей-эрудитов добавим, что нестандартные аминокислоты (селеноцистеин, пирролизин, гидроксилизин, гидроксипролин) так или иначе являются производными стандартных и нас пока не интересуют. Наша задача — разобраться с основами.
Так выглядит образование дипептида из глицина и аланина. Обратим внимание, что это всего лишь один из двух возможных вариантов. Тут в создании пептидной связи участвуют карбоксильная группа глицина и аминогруппа аланина. Могло бы быть и наоборот, и тогда это был бы другой дипептид.
Еще три аминокислоты с углеводородными радикалами, более сложными, чем у аланина. Видим, что лейцин и изолейцин — изомеры, они отличаются всего лишь положением одной метильной группы.
Две аминокислоты с ароматическим ядром в радикале: фенилаланин и тирозин. Стрелка показывает, что тирозин является биохимическим производным фенилаланина. У фенилаланина радикал чисто углеводородный, у тирозина там есть еще спиртовая группа.
Еще две интересные аминокислоты — серин и цистеин. В серине есть гидроксильная группа, то есть, иначе говоря, радикал у него спиртовой. В цистеине есть ранее не встречавшаяся нам сульфгидрильная группа -SH. Валентность серы (S) здесь 2.
Теперь посмотрим на эту молекулу. Свежего человека такая формула, возможно, напугала бы, но у нас сейчас уже достаточно знаний, чтобы разглядеть в ней функциональные группы и сказать: это трипептид из остатков аланина, тирозина и цистеина. На его концах, как и положено, находятся свободные амино- и карбоксильная группы (на самом деле в растворе они ионизированы). Для краткости конец пептида со свободной аминогруппой всегда называют N-концом, а конец со свободной карбоксильной группой — C-концом.
Все протеиногенные аминокислоты, перечисленные до сих пор, являются нейтральными (как показанный на картинке для примера валин). Это означает, что в растворе такая аминокислота имеет нулевой заряд: карбоксильная группа и аминогруппа, будучи обе ионизированными, компенсируют друг друга, а других заряженных групп тут нет. На самом деле заряд такой аминокислоты будет строго нулевым не всегда, а только при определенной кислотности раствора, но мы сейчас берем идеальный случай.
Существуют отрицательно заряженные аминокислоты, у которых в радикале есть карбоксильная группа. Перед нами две такие аминокислоты — аспартат и глутамат. Отличаются они фактически только на один атом углерода в цепочке-радикале.
Примечание. В биохимии названия кислот и их солей очень часто используются как синонимы: в растворе, в диссоциированном виде, они все равно неотличимы. Например, аспартат — это на самом деле соль аспарагиновой кислоты, а глутамат — соль глутаминовой кислоты, но реально «глутаминовая кислота» и «глутамат» — это одно и то же; последнее название предпочитают просто для краткости.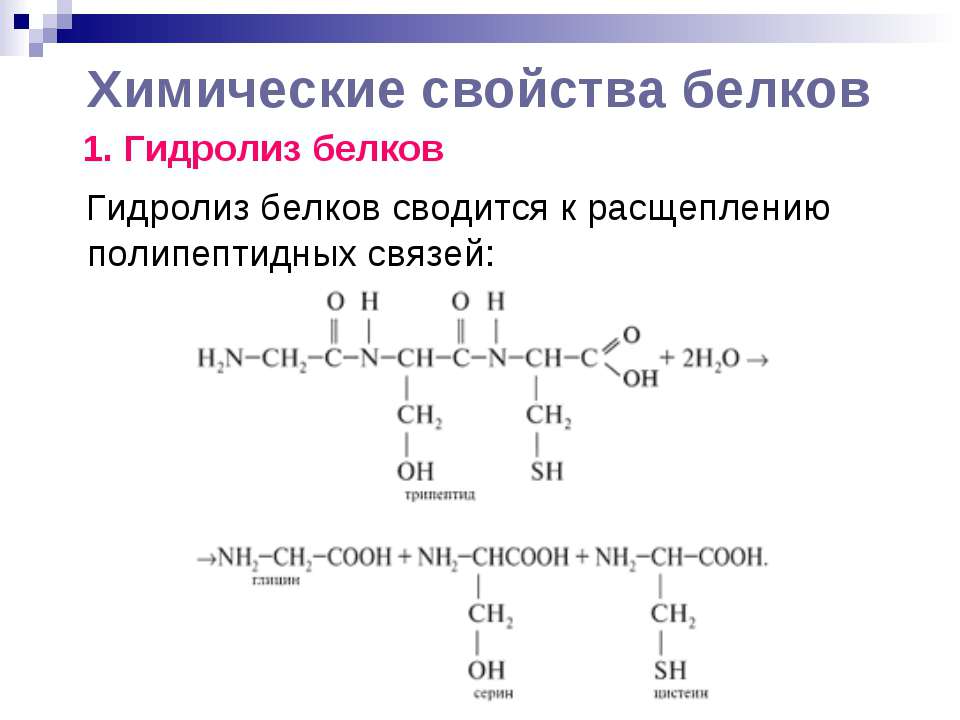 Дело в том, что соль — это по сути не что иное, как кислота, у которой на месте протона любой другой катион. Если такая молекула ионизирована и не имеет никаких катионов вообще, то за ней обычно оставляют название соответствующей соли. Именно это мы на примере аспартата с глутаматом и видим.
Дело в том, что соль — это по сути не что иное, как кислота, у которой на месте протона любой другой катион. Если такая молекула ионизирована и не имеет никаких катионов вообще, то за ней обычно оставляют название соответствующей соли. Именно это мы на примере аспартата с глутаматом и видим.
Аспарагиновая и глутаминовая кислоты в неионизированном виде. Сейчас это именно кислоты, но их все равно могут обозвать аспартатом и глутаматом для удобства.
Глутамат интересен не только тем, что входит в состав белков, но и тем, что является очень важным и широко распространенным нейротрансмиттером, то есть веществом, передающим сигналы в нервной системе. К тому же к глутамату чувствительны наши вкусовые рецепторы, и его часто добавляют в пищу, причем как в виде кислоты (пищевая добавка E620), так и в виде натриевой соли (пищевая добавка Е621).
Пример положительно заряженной аминокислоты — лизин (в ионизированном и стандартном виде). Тут, как видим, в радикале присутствует аминогруппа, которая ведет себя, как аминогруппе и положено — приобретает протон.
Аргинин — положительно заряженная аминокислота, в радикал которой входит довольно экзотичная гуанидиновая группа (больше она нам нигде не встретится). Положительный заряд в радикале аргинина делокализован между двумя атомами азота, поэтому электростатическое действие у него эффективнее, чем у такого же заряда в лизине; грубо говоря, он надежнее притягивает к себе «минус». Также обратим внимание, что на правой картинке углеродные атомы по порядку подписаны греческими буквами; в данном случае гуанидиновая группа соединена с эпсилон-атомом.
Подводя итог, мы можем разделить известные нам аминокислоты на четыре группы по типам радикалов:
● Нейтральные гидрофобные (аланин, валин, лейцин, изолейцин, фенилаланин).
● Нейтральные гидрофильные (серин, цистеин, тирозин).
● Отрицательно заряженные (аспартат, глутамат).
● Положительно заряженные (лизин, аргинин).
Особое положение занимает самая простая из всех возможных аминокислот — глицин, у которого вместо радикала атом водорода.
Очевидно, что свойства радикалов сильно влияют на поведение пептидной цепочки в растворе.
Посмотрим на схему типичного пептида, в данном случае состоящего всего из пяти аминокислот. Надо заметить, что это очень мало. Длинные пептиды с многими десятками аминокислотных остатков (от 50 и больше) называются полипептидами. Все белки — полипептиды. Аминокислотных остатков в них чаще всего даже не десятки, а сотни. Порядок аминокислот в белке принято принято перечислять от N-конца (аминогруппа) к C-концу (карбоксил).
А теперь представим, что молекулу пептида бросили в воду. Очевидно, что она не останется там вытянутой в линию, а будет как-то сворачиваться. Иными словами, молекула белка в воде обязательно примет некоторую трехмерную форму (конформацию), которая будет зависеть от взаимодействий между ее частями и особенно между радикалами аминокислот. А ведь эти радикалы, как мы уже знаем, бывают очень разными.
Принято выделять четыре уровня структуры белка:
● Первичная структура — последовательность аминокислотных остатков, соединенных пептидными связями.
● Вторичная структура — взаимодействия между аминокислотами в составе одной и той же пептидной цепочки, расположенными близко (через считанные остатки друг от друга).
● Третичная структура — взаимодействия между аминокислотами в составе одной и той же пептидной цепочки, расположенными сколь угодно далеко, хоть на разных ее концах.
● Четвертичная структура — взаимодействия между разными пептидными цепочками, собранными в функциональный белок. Если белок состоит из одной полипептидной цепи, то четвертичной структуры у него нет.
Первичная структура одномерна, все остальные — трехмерны. К первичной структуре относятся пептидные связи, к остальным уровням — любые другие взаимодействия между аминокислотными остатками.
Первичная структура — это просто сама последовательность аминокислот, например: глицин, пролин, глицин, треонин, глицин, глутамат… и так далее. Показанный слева пептид из 24 аминокислот — условность, настоящие белки очень редко бывают такими маленькими. Показанный справа белок из 129 аминокислот — гораздо более типичная штука, хотя даже такой белок считается небольшим. В обоих случаях цепи нарисованы изогнутыми исключительно для удобства и наглядности, на самом деле с таким же успехом можно было бы просто перечислить аминокислоты в строчку (как это и делается в соответствующих базах данных).
Объемная структура белковой молекулы (вторичная, третичная и четвертичная) держится на следующих типах взаимодействий между аминокислотными остатками:
● Водородные связи (как между полярными боковыми цепями аминокислот, так и между пептидными группами).
● Электрическое притяжение между положительно и отрицательно заряженными боковыми цепями.
● Гидрофобные взаимодействия между углеводородными боковыми цепями. Напомним, что гидрофобными называются молекулы или части молекул, в которых нет полярных связей и которые поэтому плохо взаимодействуют с водой. А вот слипаться вместе, чтобы уменьшить поверхность собственного взаимодействия с водой, они как раз склонны. Такое слипание может быть довольно прочным — оно и называется гидрофобным взаимодействием или даже гидрофобной связью.
● Дисульфидные мостики между остатками аминокислоты цистеина.
Все эти взаимодействия, кроме дисульфидных мостиков — нековалентные. А вот о самих дисульфидных мостиках мы еще не говорили. Они образуются между остатками аминокислоты цистеина, боковая цепь которой имеет вид -CH2-SH. Уже после того, как белок синтезирован, между входя
Поверхностно-активные вещества на основе аминокислот для биомедицинского применения
3.1. Одноцепочечные поверхностно-активные вещества
Природа аминокислотного остатка определяет основные различия в адсорбционных, агрегационных и биологических свойствах среди ААС. Самосборка поверхностно-активных веществ в водных средах была тщательно изучена, и были установлены некоторые корреляции между структурой ААС и свойствами поверхностно-активного вещества. Таким образом, увеличение длины гидрофобной цепи обычно сопровождается уменьшением CMC, аналогично обычным поверхностно-активным веществам, где гидрофобное взаимодействие является движущей силой для процесса самосборки.Для AAS нековалентные взаимодействия, возникающие из боковых цепей аминокислотных остатков, вносят дополнительный вклад, и эффективная сольватация головных групп также является важным фактором, влияющим на самосборку [6, 10, 21].
ККМ является важным параметром для биомедицинского применения ААС, поскольку взаимодействия с биоинтерфейсами и клеточными компонентами в значительной степени различаются в зависимости от присутствия мицелл или мономерных молекул поверхностно-активного вещества. Хотя CMC часто уменьшается с увеличением гидрофобности аминокислоты, специфические внутри- и / или межмолекулярные взаимодействия между аминокислотными остатками могут изменить эту тенденцию [22, 23].
Присутствие ароматических или объемных заместителей и присутствие донорных / акцепторных групп водородных связей может сильно влиять на упаковку молекул на границах раздела и стабилизацию мицелл. Межмолекулярные водородные связи между головными группами могут происходить для AAS с аминокислотными остатками с гидроксильными, амидо, амино и карбоксильными группами в их боковых цепях, что способствует их адсорбционным и мицеллообразовательным свойствам в растворе [6, 10, 21].
ААС N -ацилфенилаланина обычно показывают более низкую КМЦ, чем другие N -ациламинокислоты с такой же длиной ацильной цепи из-за внутримицеллярных π-π взаимодействий между ароматическими кольцами боковых цепей аминокислот, которые способствуют стабилизации мицелл.Эти взаимодействия также происходят в твердом состоянии, способствуя более высокой температуре Kraft фенилаланиновых ААС. С другой стороны, сложное самосборное поведение пролиновых ААС связано с ван-дер-ваальсовым отталкиванием между объемными боковыми цепями, в то время как неспособность образовывать водородные связи отражается на большой площади поверхности в результате менее компактной упаковки молекул на граница раздела воздух / вода [10, 21, 23, 24].
Значения ККМ, найденные для N -деканоиллейцина, метионина, пролина и серина, следовали тенденции, связанной с гидрофильностью основной группы аминокислот, при этом менее гидрофильное поверхностно-активное вещество показывает более низкую ККМ [24].Измерения DLS показали, что производные лейцина и метионина образуют сферические мицеллы размером около 3-5 нм, в то время как поверхностно-активные вещества серина и пролина образуют более крупные супрамолекулярные агрегаты (11-14 нм), вероятно, удлиненные стержневидные мицеллы из-за присутствия гидроксильная группа на сериновых ААС и конформационная жесткость в пролиновых ААС. Стерические препятствия пирролидиновой части в пролиновых ААС, а также гидроксилсодержащая боковая цепь в производном серина, которые препятствуют простому внедрению гидрофобной цепи внутрь мембраны эритроцитов, также ответственны за их более низкую гемолитическую активность [24].
Гидроксильная группа в фенольном кольце гидрохлорида додецилового эфира тирозина оказывает сильное влияние на конформацию молекулы, обеспечивая более компактные структуры на границе раздела и способствуя меньшей площади поверхности раздела по сравнению с более гидрофобным производным фенилаланина, как продемонстрировано молекулярным моделированием. исследования [25].
Для поверхностно-активных веществ с амидными связями, таких как N -ацил AAS, способность амидной связи участвовать во внутри- и межмолекулярных водородных связях может сильно влиять на свойства поверхностно-активного вещества как на границах раздела, так и в растворе.Роль амидной связи для самосборки ААС в растворе и их адсорбция на границе раздела воздух / вода и на твердых поверхностях изучалась различными методами с использованием лауроилглицината натрия N и лауроилсаркозината натрия N . в качестве модельных ПАВ [26]. Первые могут образовывать межмолекулярные водородные связи через амидную группу, но не вторые из-за метилирования амидного азота. Было обнаружено, что амидная связь вносит вклад в гидрофильность обоих поверхностно-активных веществ, при этом для производного саркозината наблюдается несколько более низкая ККМ из-за гидрофобности дополнительной метильной группы.Способность глицинатного поверхностно-активного вещества образовывать межмолекулярные водородные связи привела к более плотной упаковке на границе раздела воздух / вода и на гидрофобных поверхностях. Более высокая степень ионизации, обнаруженная для саркозинатного поверхностно-активного вещества, также соответствует менее плотной упаковке поверхностно-активного вещества в мицеллах в водном растворе.
Помимо мицелл, AAS может образовывать другие супрамолекулярные структуры в водной среде из-за хиральной природы аминокислотного остатка, который может вызывать упаковку молекул в самоорганизующиеся трубочки, стержни, спиральные и скрученные ленты или волокна.Более того, хиральная природа ААС позволяет им избирательно взаимодействовать с энантиомерами хиральных растворенных веществ, что имеет важное практическое значение. Хиральные ААС обычно используются в качестве материала для наполнения колонки в хиральной хроматографии для разделения рацемических смесей и в качестве энантиодискриминационных растворителей ЯМР. Сообщалось о хиральной дискриминации ААС в твердом состоянии, в жидкокристаллических фазах, в монослоях Ленгмюра и даже в мицеллах [6, 10].
Рацемические смеси натриевых солей N, -лауроилфенилаланина и N -лауроилвалина, а также динатриевых солей N -ацилглутаминовой кислоты показали более высокую КМЦ, чем чистые энантиомеры.Эффект объясняли различиями в конформации аминокислотной части ПАВ на поверхности мицелл. Рацемический N -стеароилсерин также показал немного более высокую ККМ по сравнению с чистыми L- или D-энантиомерами, а сильные вариации в спектрах кругового дихроизма энантиомерно чистых мицелл предполагали образование повторяющегося расположения полярных головных групп на поверхности мицелл, стабилизированных с помощью межмолекулярные водородные связи между амидными группами [6, 10].Предпочтение гомохирального (L-L или D-D) взаимодействия по сравнению с гетерохиральным (D-L) взаимодействием зависит от стабильности водородной связи, образованной между аминокислотными остатками, в сочетании со стереохимическими эффектами.
Влияние хиральности на мицеллярные свойства AAS, по-видимому, зависит от структурных эффектов, связанных с аминокислотным остатком, таких как размер и стереохимические помехи, поскольку не было обнаружено различий между КМЦ рацемических смесей и КМЦ энантиомерно чистые энантиомеры натриевых солей N -пальмитоилфенилаланина, лейцина, треонина, метионина и пролина, а также калиевых солей N -лауроилаланина или катионных поверхностно-активных веществ, полученных из N -лауроиларгинина [23].Супрамолекулярная хиральность успешно применялась в асимметричном органическом синтезе [27].
ААС, разработанные в промышленном масштабе, в основном представляют собой анионные ААС N -ацил из-за их мягких свойств, низкой токсичности, способности к биологическому разложению и легкого синтеза по процессу Шоттена-Бауммана, включающему конденсацию аминокислоты с жирным ацилхлоридом ( из жирной кислоты) в водно-щелочных условиях. Более того, многие N -ацил-ААС обладают эмульгирующими и антимикробными свойствами и могут быть полезны в качестве добавок для рецептур в пищевой, фармацевтической и косметической промышленности.
Хотя большинство ААС, описанных в литературе, основаны на соединениях, полученных путем конденсации аминокислоты с чистыми жирными кислотами, многие коммерческие ААС производятся из смесей аминокислот и / или жирных кислот, полученных из гидролизатов белков или гидролиза триглицеридов, соответственно, из-за в пользу преимущества [28]. Часто ААС со смешанными цепями жирных кислот имеют лучшие характеристики по сравнению с чистыми соединениями из-за синергетического взаимодействия. Кокоилглицинат показал значительно более низкую КМЦ, чем натриевые соли лауроилглицината, лауроилсаркозината и N -стеароиламинокислоты, что может быть связано с присутствием ацилглицинатов с разной длиной ацильной цепи [19].
На выставке представлены натриевые соли N -ацилфенилаланинов и N -ацилизолейцинов, полученные из смесей жирных кислот, полученных из кокосового ореха, пальмы, ядра пальмы, ятропы, каранжи, Sterculia foetida , касторового и высокоолеинового подсолнечного масла. превосходные поверхностно-активные свойства, такие как поверхностное натяжение, КМЦ, устойчивость к кальцию, смачивающая способность, пенообразование и стабильность эмульсии по сравнению с эталонным поверхностно-активным веществом лаурилсульфатом натрия (SLS) [12, 29]. За исключением N -ацилфенилаланината из кокосового масла, все остальные N -ацилфенилаланины показали многообещающую цитотоксичность против линий раковых клеток человека [12].
N -ацил-ААС из аспарагиновой и глутаминовой кислоты — это мягкие поверхностно-активные вещества, широко используемые в косметических препаратах и средствах личной гигиены из-за их низкой токсичности и мягкости для кожи и глаз. Динатриевые соли N -лауроил-аспартата и N -лауроилглутамата показывают значения ККМ 73 и 74 ммоль / л соответственно, что намного выше, чем у натрия N -лауроилглицината (14 ммоль / л) из-за наличие дополнительной карбоксилатной группы [30]. На КМЦ и степень мицеллярной ионизации также влияет выбор одновалентного противоиона, возрастающий в порядке Li +
Значительные различия были обнаружены в способности дикарбоксилатных поверхностно-активных веществ хелатировать кальций [30]. Лауроил аспартат образует внутримолекулярный комплекс с ионами кальция, в то время как лауроил глутамат образует межмолекулярный комплекс, что приводит к более высокой толерантности к кальцию, плотной упаковке на границе раздела воздух / вода и очень низким значениям поверхностного натяжения (ниже 30 мН / м).С другой стороны, способность образовывать внутримолекулярные хелаты способствует адсорбции на кальцийсодержащих поверхностях, причем лауроил аспартат сильно адсорбируется на гидроксиапатите, тогда как лауроилглутамат проявляет слабую адсорбцию [30].
Степень нейтрализации также влияет на свойства дикарбоксилатного ААС. Согласно исследованиям с помощью просвечивающей электронной микроскопии, структура гелевой сетки формировалась как в объемной фазе, так и в пенных пленках лауроилглутамата натрия при определенной температуре и диапазоне pH [32].Изменение прочности геля в пленке пены при изменении pH и температуры влияет на стабильность пены. Образование слабого геля в пленке пены способствует стабильности пены, тогда как образование твердого геля дает противоположный эффект. Наивысшая стабильность пены, а также минимальное поверхностное натяжение были обнаружены при pH 7, когда в растворе не образовывался гель, что свидетельствует о более плотном расположении молекул поверхностно-активного вещества на границе раздела воздух / вода пленки пены, как описано с помощью моделирования молекулярной динамики.
N α , N ε -Диоктиллизинатные соли с различными противоионами (Li + , Na + , K + , Lys + и Tris + ) имеют исследованы как в сухом состоянии, так и в водном растворе.Было обнаружено, что КМЦ почти не зависит от противоиона, который оказывает сильное влияние на гемолитическую активность. Поверхностно-активные вещества взаимодействуют с мембранами эритроцитов двухфазным образом, защищая от гипотонического гемолиза при низких концентрациях, но вызывая гемолиз при более высоких концентрациях [33]. Все соединения защищали эритроциты от гипотонического гемолиза со значениями HC 50 (концентрация сурфактанта, вызывающего 50% гемолиз в изотонической среде) в диапазоне 260,7–560,0 мкг / мл, которые увеличивались в порядке Na +
Структура солей диоктиллизината в сухом состоянии зависела от размера противоиона. Крупные органические противоионы предпочитают ламеллярную структуру, тогда как небольшие неорганические противоионы предпочитают бинепрерывные кубические структуры [34]. Влияние длины ацильной цепи на структуру в сухом состоянии диациллизиновых поверхностно-активных веществ показало, что длинные алкильные цепи благоприятствуют ламеллярной структуре, в то время как цепи средней длины создают кубические бинепрерывные структуры.С другой стороны, короткие цепи способствовали образованию обратной гексагональной структуры.
Аминокислоты — использование, преимущества и источники
Аминокислоты являются строительными блоками белков и очень важной частью человеческого тела. Белки состоят из сотен более мелких единиц, называемых аминокислотами, которые связаны друг с другом пептидными связями. Существует 20 различных аминокислот, девять из которых являются незаменимыми, а 11 — несущественными. Все 20 аминокислот необходимы организму в разных концентрациях для здорового функционирования организма.
Типы аминокислот
Есть два типа аминокислот: —
- Незаменимые аминокислоты — Это аминокислоты, которые наш организм не может синтезировать самостоятельно. Эти аминокислоты получают из различных пищевых добавок.
- Незаменимые аминокислоты — Эти аминокислоты синтезируются нашим организмом. Эти аминокислоты являются неотъемлемой частью белков, их не обязательно включать в рацион каждый день.
Преимущества аминокислот
- Аминокислоты являются строительными блоками белков.
- Аминокислоты действуют как источник энергии для организма.
- Они синтезируют нейротрансмиттеры.
- Они помогают поддерживать хороший обмен веществ.
- Они помогают поддерживать хороший уровень артериального давления, следовательно, полезны для здоровья сердечно-сосудистой системы.
Пищевые источники аминокислот
- Яйца и молочные продукты содержат достаточное количество аминокислот.
- Чашка йогурта содержит 14 граммов белка, а яйцо — 6 граммов белка.
- Моцарелла содержит 9 граммов белка, а нежирный швейцарский сыр содержит 8 граммов белков.
- Красное мясо — один из продуктов с самым высоким содержанием белка.
Источники растительного происхождения
- Квиноа и соевые продукты содержат незаменимые аминокислоты.
- Одна чашка киноа содержит 8 граммов белка.
- Одна чашка сои содержит 29 граммов белка.
- Фасоль и орехи также содержат значительное количество аминокислот.
- Тофу и соевое молоко также содержат значительное количество аминокислот.
Дефицит аминокислот
Когда в нашей диете дефицит аминокислот, это может привести к серьезным проблемам со здоровьем, называемым квашиоркор. Квашиоркор — это состояние, характеризующееся недоеданием.
Симптомы могут включать: —
- Воспаленные и красные пятна на коже.
- Усталость
- Сонливость
- Неправильный рост
- Потеря мускулов
- Трещины на ногтях
- Горшок
Другие проблемы
Из-за низкобелковой диеты в организме возникает дефицит аминокислот.Из-за этого человек может быть более подвержен простуде или другим проблемам со здоровьем. Кроме того, происходит медленное заживление мелких травм или порезов.
Побочные эффекты высокого потребления аминокислот
Потребление большого количества белка или аминокислот может привести к ухудшению здоровья, которое также может включать: —
- Из-за потребления большого количества аминокислот приводит к повышенной уровни этих соединений в кровотоке. Из-за этого почки должны отфильтровывать большое количество этих соединений из крови, что приводит к нагрузке на почки.
- Высокое потребление аммиака может привести к накоплению аммиака в печени, что может оказать негативное воздействие на печень.
- Чрезмерное потребление мочи увеличивает риск обезвоживания.
Нужны ли вам аминокислоты?
Примечание редактора: это часть 4 руководства Ultimate Protein Guide. В этой версии умы Examine.com (где блеск везде) решают вопрос об аминокислотах. В частности, мы рассматриваем аминокислоты с разветвленной цепью (BCAA), незаменимые аминокислоты (EAA) и глутамин и рассматриваем их роль в наращивании и восстановлении мышц.
Приведенная ниже информация представляет собой чисто научный анализ преимуществ, которые вы получаете от различных типов аминокислот. В целом, если вы получаете достаточно белка с пищей, вам, вероятно, не «нужно» добавлять дополнительные аминокислоты.
Я испытал (ненаучные) преимущества от приема дополнительных BCAA, будь то восстановление или рост мышц. Поэтому они, как правило, являются частью моих тренировок, особенно при соблюдении диеты в стиле Альфа, такой как та, что предписана в Человеке 2.0.
Знаете ли вы: использование глутамина для наращивания мышечной ткани у здоровых людей полностью не поддерживается.
Чтобы определить, следует ли вам добавлять аминокислоты в свой рацион, прочтите это и решите сами. -AB
Нужно ли вам принимать добавки с аминокислотами?
Куртис Франк и Сол Оруэлл
Аминокислоты с разветвленной цепью (BCAA)
Аминокислоты с разветвленной цепью (BCAA) представляют собой набор из трех аминокислот с разветвленной боковой цепью.Это лейцин, изолейцин и валин (обычно в соотношении 2: 1: 1).
Они продаются в основном спортсменам в периоды калорийной депривации, поскольку эти BCAA содержатся во всех источниках белка. Их ниша заключается в том, что иногда вам нужны только эти три аминокислоты, а все остальные просто добавляют ненужные калории.
Известно, что лейцин сам по себе является анаболическим фактором и сигналом для синтеза мышечного белка, и в присутствии неадекватного питания (вы едите меньше, чем обычно) этот анаболический сигнал, по-видимому, останавливает потерю мышечных клеток.
Однако этот анаболический эффект распространяется на большинство типов клеток, а не только на мышцы. Хотя BCAA, как правило, содержат много лейцина, все полноценные источники белка содержат достаточно лейцина, чтобы обеспечить пользу.
Если посмотреть на исследования, то сравнение BCAA с отсутствием потребления белка показывает, что BCAA действительно приносят пользу. Однако ограниченные исследования, сравнивающие BCAA с другим источником белка, показали, что BCAA не лучше.
Несмотря на то, что на этикетке пищевых продуктов с BCAA могут отсутствовать калории, это связано с тем, что FDA допускает, что все, что меньше 5 калорий (на порцию), должно быть указано как 0 калорий.
BCAA могут играть роль в сохранении массы скелетных мышц в периоды серьезной калорийной депривации, но это не то, с чем сталкивается большинство людей (и, опять же, это можно уменьшить, потребляя белок). Решение использовать BCAA может сводиться к выбору между 30 и 120 калориями.
Итог: BCAA сэкономят вам немного калорий, но их преимущества перед другими источниками белка в лучшем случае незначительны.
Незаменимые аминокислоты (EAAs)
Незаменимые аминокислоты находятся в серой зоне между BCAA и источниками цельного белка, и вместо того, чтобы давать только три BCAA, они дают все аминокислоты, которые имеют вышеупомянутый статус незаменимых.
Наиболее практичным использованием незаменимых аминокислот было бы добавление к диете вегана, который обычно недополучает протеин и не использует протеиновые добавки. Кроме того, они обладают теми же преимуществами, что и BCAA, хотя и имеют немного более высокую калорийность.
На практике, однако, предыдущий выбор между 30 и 120 калориями теперь превратился в педантичный 80 калорий и 120 калорий. Практические ситуации, в которых полезны ЕАА, сильно ограничены временами, когда каждая калория становится критической.
Итог: EAA полезны, если у вас нет источника белка. Иначе сложно увидеть какие-либо дополнительные преимущества.
Глютамин
Глютамин получил здесь особое упоминание из-за его популярности в качестве отдельной добавки.
Если смотреть на изолированные мышечные клетки, то введение глутамина выше нормального уровня, по-видимому, вызывает дозозависимое увеличение синтеза мышечного белка. Именно благодаря этой информации, а также клиническому применению глутамина у жертв ожогов (для помощи в регенерации тканей) глютамин продается как средство для наращивания мышечной массы.
В настоящее время использование глутамина для наращивания мышечной ткани у здоровых людей полностью не поддерживается. (Извините, производители пищевых добавок.) Дефицит глютамина, необходимое условие для наращивания мышечной массы глютамином, вероятно, более редок в доклинических условиях, чем цинга.
При этом, поскольку кишечник в такой степени связывает глутамин, добавка действительно является хорошей добавкой для здоровья кишечника (которая также может быть имитирована источниками белка с высоким содержанием глутамина, такими как казеин).

