Белка натуральная 2500 | Шкурки.Ру
Описание:
Шкурки белки. Выделка шкурок фабричная, с соответствующим штампом. Размер 15-20см.
Шкурки белки измеряются от глаз до основания хвоста.
Посмотреть отзывы о нашей белке
Артикул: 2500
Цена:
300 Р
Выберите размер
| Артикул | Размер | Качество | Цена | |
| b1 | 15-20см | Без хвоста | 300 | |
| b2 | 15-20см | С хвостом | 750 |
Узнать условия доставки в
+
−
Купить за 1 кликУзнайте больше информации
по данному товару
8-800-775-82-92
Заказать обратный звонок
Описание:
Шкурки белки. Выделка шкурок фабричная, с соответствующим штампом. Размер 15-20см.
Выделка шкурок фабричная, с соответствующим штампом. Размер 15-20см.
Шкурки белки измеряются от глаз до основания хвоста.
Посмотреть отзывы о нашей белке
Артикул: 2500
Выберите размер:
| Артикул | Размер | Качество | Цена | |
| b1 | 15-20см | Без хвоста | 300 | |
| b2 | 15-20см | С хвостом | 750 |
Цена:
300 Р
Узнать условия доставки в
+
−
Купить за 1 кликУзнайте больше информации
по данному товару
8-800-775-82-92
Заказать обратный звонок
Похожие товары
Узнавай первым об акциях, скидках и распродажах! Подпишись на наш Telegram! Подписаться
Новости
22.
Появились новые цвета кролика рекс Темно-зеленый…
09.11.2022
Поступление овчиныДобавили в ассортимент новые цвета овчины: красн…
28.03.2022
Овчина меховая! Расширение ассортимента!В нашем ассортименте появились варианты меховой …
06.12.2021
Мы появились на ВайлдберизДрузья, мы появились на Вайлдбериз. Теперь в удо…
Все новости
Отзывы
Наталья
21.11.2022 г. получила шкурку черной норки. И шкурка очень и понравилась и доставка была быстрая. Рекомендую и товар и этого продавца!
И шкурка очень и понравилась и доставка была быстрая. Рекомендую и товар и этого продавца!
Наталья
21.11.2022 получила шкурку черной норки. И шкурка прекрасная и отправление оперативное! Всем рекомендую этого продавца!!
Большое спасибо менеджеру Наташе, за внимательно отношение, терпение, желание учесть все пожелания. Приятное общение, все честно и в сроки. Заказыва…
Заказала шкурки кролика Рекс качество идеальное пришло быстро.спасибо огромное
Евгения
Покупаю здесь шкурки кролика рекс для моих изделий. Для меня они идеальны. Прекрасная и разнообразная цветовая палитра. Шкурки прекрасного качества,…
Все отзывы
Подпишись на акции, скидки и распродажи:
Я принимаю условия пользовательского соглашения компании
Ученые создали искусственные мышцы из натуральных белков
Разработка получит применение в адаптивной робототехнике, будет использоваться для создания медицинских нанороботов
Related video
Группе исследователей из Фрайбургского университета удалось разработать искусственные мышцы, которые используют естественные процессы в организме. Команда под руководством Стивена Шиллера продемонстрировала автономную сгибающуюся мышцу, которая движется, потребляя химическое топливо, подобно аналогам у людей или у животных, сообщает Advanced Science News.
Команда под руководством Стивена Шиллера продемонстрировала автономную сгибающуюся мышцу, которая движется, потребляя химическое топливо, подобно аналогам у людей или у животных, сообщает Advanced Science News.
Сжатие материала можно контролировать с помощью изменения кислотности среды и температуры.
Наша искусственная мышца все еще является прототипом. Однако высокая биосовместимость материала и возможность корректировки его состава для соответствия конкретным тканям и технологическим применениям могут проложить путь для будущих применений в реконструктивной медицине, протезировании, фармацевтике или мягкой робототехнике, — рассказывает Стивен Шиллер.
В прошлом ученые применяли натуральные белки для создания искусственных мышечных систем, встраивая их в крошечные молекулярные машины или полимеры. Однако им не удавалось разработать полностью биологические синтетические мышцы.
Искусственные мышцы из эластина
Натуральный белок, используемый командой из Фрайбурга, основан на природном волокнистом белке, называемом эластином. Исследователи разработали два синтетических эластиноподобных белка, один из которых реагирует на колебания кислотности среды, а другой — на изменения температуры.
Исследователи разработали два синтетических эластиноподобных белка, один из которых реагирует на колебания кислотности среды, а другой — на изменения температуры.
Ученые объединили два белка с помощью фотохимического перекрестного связывания, чтобы сформировать слоистый материал, которому можно легко придать форму, чтобы задать направление его движения. Затем им удалось вызвать ритмичные сокращения с помощью химического источника топлива, сульфита натрия. В колебательной химической реакции, в которой кислотность меняется циклами из-за особой связи нескольких реакций, добавленная энергия превращалась в механическую энергию.
Таким образом, исследователи заставили материал циклически сокращаться автономно. Они также могли включать и выключать сокращения с помощью изменения температуры. При этом можно было запрограммировать определенные состояния материала, и снова сбросить их с помощью другого стимула. Таким образом, ученые создали простую систему реализации «заучивания и забывания» на материальном уровне.
Поскольку он получен из встречающегося в природе белка эластина и производится с помощью биотехнологических средств, наш материал отличается высокой устойчивостью, которая также актуальна для технических применений, — поясняет Шиллер.
В будущем материал может быть доработан для реагирования на другие раздражители, такие как электричество, концентрация соли в окружающей среде, и для потребления других источников энергии, например, полученной из биомассы. Мы находимся в состоянии, когда мы можем разрабатывать концепции белкового материала, имитирующие сложные биологические функции, даже в отношении памяти и обучения, — подвел итог Шиллер.
В будущем ученые предполагают создавать белковые материалы, которые используют АТФ, «валюту», которой обмениваются клетки, чтобы использовать новые подходы в биомедицинских приложениях, таких как регенерация тканей и новое поколение нанотехнологических роботов для доставки лекарств в человеческие органы.
Ранее Фокус сообщал, что уже к концу 2022 года на Земле появятся «леса» из искусственных деревьев, которые будут поглощать углерод из атмосферы.
В Сингапуре ученые разработали искусственный синапс, который можно будет использовать для создания мозга наподобие человеческого.
Аналогичную задачу решала команда из Массачусетского технологического института, которая создает искусственный мозг на основе нейросети.
Наши любимые натуральные источники белка и продукты с высоким содержанием белка
Белок — вы знаете, что он нужен вашему организму, но знаете ли вы, почему? Сегодня мы поговорим о некоторых из лучших натуральных источников белка!
Что такое белок?Многие знают, что белок является ключевым компонентом здорового питания, но мало кто знает, почему это так.
Белок является основным питательным веществом, обеспечивающим создание и восстановление здоровой ткани. Он встречается по всему телу, от костного мозга до бицепсов и волосяных фолликулов. Белок состоит примерно из двадцати различных строительных блоков, которые называются аминокислотами.
Девять из этих аминокислот известны как незаменимые аминокислоты, потому что ваш организм не может синтезировать их самостоятельно. Вместо этого вам нужно найти эти аминокислоты в пище, которую вы едите.
Польза белка для здоровья
Белок имеет решающее значение для здорового организма, поэтому неудивительно, что он обладает многими природными преимуществами для здоровья.
Если сейчас сезон простуды и гриппа, вам поможет белок. Если ваши мышцы нуждаются в восстановлении, протеин должен быть вашим первым выбором.
Белок является неотъемлемым компонентом любой здоровой иммунной системы. Без белка ваш организм не сможет бороться с вирусами. Бактерии защищают организм от вирусов и бактериальных инфекций, поэтому они могут быть очень полезны для укрепления вашей иммунной системы.
Он также может помочь восстановить ваши мышечные клетки после интенсивной тренировки. Вот почему вы можете увидеть, как многие знатоки тренировок пьют протеиновый напиток после пота, чтобы помочь восстановить крошечные разрывы в мышцах. Белок также может помочь восстановить клетки и создать новые. Кроме того, также говорят, что белок может создавать чувство сытости и способствовать снижению веса.
Белок также может помочь восстановить клетки и создать новые. Кроме того, также говорят, что белок может создавать чувство сытости и способствовать снижению веса.
Сколько белка мне нужно есть?
Важно найти правильное количество белка в вашем рационе, но сколько достаточно?
По данным Гарвардской медицинской школы, количество белка, которое человек должен потреблять с пищей, обычно указывается следующим образом:
- Мужчины: 56 граммов белка в день
- Женщины: 46 г белка в день
Конечно, это число является широким обобщением. Ваши истинные потребности в белке во многом зависят от вашего возраста, размера и среднего уровня физической активности. Женщине среднего телосложения, которая регулярно занимается спортом, требуется гораздо больше белка, чем мужчине такого же телосложения, который ходит всего тридцать минут каждый день.
Если вас беспокоит потребление белка, поговорите со своим врачом о том, какое количество вам подходит.
Можете ли вы съесть слишком много белка?
Несмотря на множество преимуществ, у протеина есть и свои недостатки.
Избыточное потребление белка в течение длительного времени может привести к высокому уровню холестерина, повышенному риску сердечно-сосудистых заболеваний, повышенному риску рака, заболеваниям почек и образованию камней в почках, увеличению веса, а также запорам или диарее. Людям с проблемами почек, диабетом или высоким кровяным давлением обычно следует избегать диеты с высоким содержанием белка. Лучше сначала поговорить с врачом, если вы планируете диету с высоким содержанием белка.
Что такое высокобелковая диета?
По данным клиники Майо, люди, стремящиеся к краткосрочной потере веса или занимающиеся бодибилдингом, являются идеальными кандидатами на высокобелковую диету.
Диета с высоким содержанием белка в первую очередь направлена на потребление значительного количества белка при ограничении потребления углеводов или жиров.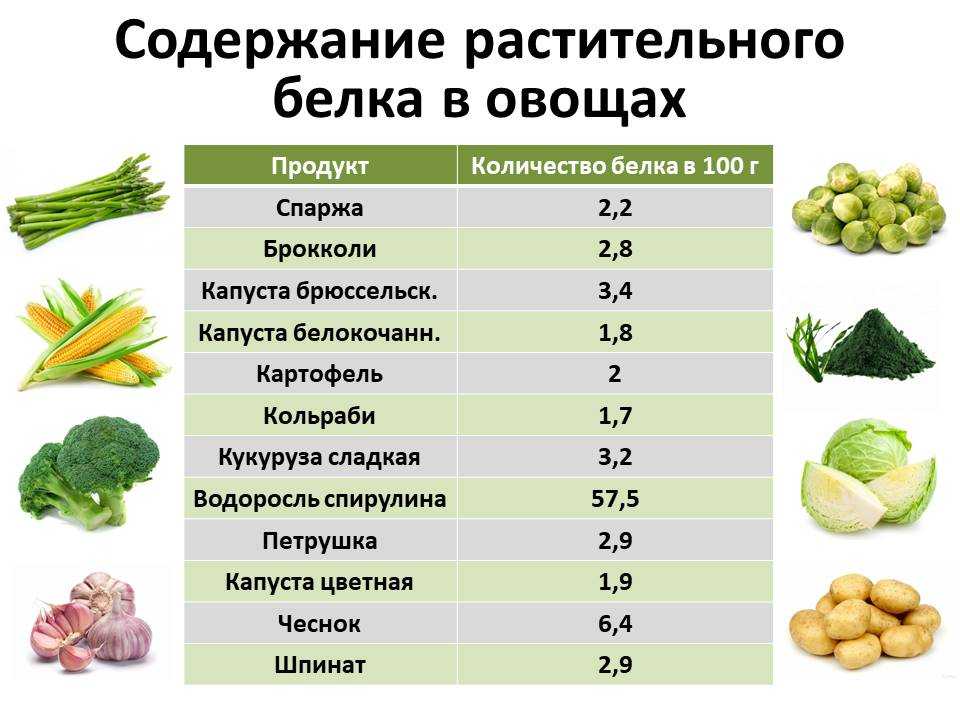 Эту диету иногда путают с низкоуглеводной диетой, но при низкоуглеводной диете вы можете потреблять жир вместо того, чтобы пытаться его ограничить.
Эту диету иногда путают с низкоуглеводной диетой, но при низкоуглеводной диете вы можете потреблять жир вместо того, чтобы пытаться его ограничить.
Итак, где мы можем найти наш белок? Есть много продуктов со значительным содержанием белка, но вот некоторые из них:
- Яйца
- Киноа
- Тофу
- Эдамаме
- Турция
- Миндаль
- Черный
- Фасоль
- Семена чиа
- Греческий йогурт
- Творог
- Панир
- Арахисовое масло
- Сыр
- Лосось
- Постная куриная грудка
- Постные свиные отбивные
- Тунец
- Постная говядина
- Чечевица
Когда вы думаете о белке, естественно предположить, что вы должны получать его из источника мяса. Однако это не совсем так. Существует множество растительных источников белка, которые обеспечивают достаточное количество белка в вашем рационе. Мы выбрали для вас 5 лучших веганских растительных или лучших натуральных источников белка.
Однако это не совсем так. Существует множество растительных источников белка, которые обеспечивают достаточное количество белка в вашем рационе. Мы выбрали для вас 5 лучших веганских растительных или лучших натуральных источников белка.
Есть веская причина, по которой мамы и папы обожают овсянку по утрам. Он дольше сохраняет чувство сытости, а овес также содержит 10 граммов белка на 100-граммовую порцию.
Бобовые (бобовые) и тофуБобовые, или съедобные семена семейства бобовых, не только чрезвычайно богаты белком. Они также очень вкусные. В том же духе тофу (соевый творог) также содержит достаточное количество белка — 8 г на 100 г. Вот некоторые другие бобовые с высоким содержанием белка:
- Чечевица (коричневая, зеленая и красная) — 9 г белка на 100 г
- Нут, включая хумус: 7 г
- Садовый горошек — 7 грамм
- Фасоль (черноглазая, пинто, сливочная, каннеллини, соевая, эдамаме и почковая) — от 7 до 10 граммов
- Запеченная фасоль — 5 грамм
Орехи и семечки помогут быстро избавиться от голода. Они служат отличными закусками с высоким содержанием белка. Идеально подходит для здорового питания на ходу или в сочетании с обедом!
Они служат отличными закусками с высоким содержанием белка. Идеально подходит для здорового питания на ходу или в сочетании с обедом!
- Семена конопли – 5 г на столовую ложку с горкой
- Миндаль – 3 г белка на каждые шесть орехов миндаля
- Грецкие орехи – около 3 г белка на каждые три цельных грецких ореха
- Семена тыквы – 4 г на столовую ложку
- Орехи кешью – 3 г на 10 орехов кешью
- Бразильские орехи – 4 г на шесть бразильских орехов
- Киноа — 100 г киноа (приготовленный вес) обеспечивают почти четыре грамма белка. Согласно BBC, это также полноценный белок, содержащий все 22 аминокислоты, что делает его отличной альтернативой углеводам, таким как рис и кускус.
- Коричневый и дикий рис. Рис — это вкусное и сытное блюдо, к которому можно добавлять бесконечные приправы. Рис содержит 4 г белка на 100 г, что делает его богатым белком! Соедините его с вашими любимыми овощами или тофу для совершенно вкусной еды.

Пища — это больше, чем просто энергия, а белок — это больше, чем просто макроэлемент. Мы считаем, что вы должны смаковать каждый кусочек, будь то сытная горсть миндаля или вкусный кусочек курицы Тикка Масала Наанвич.
Именно поэтому мы любим белок в наших блюдах с курицей и кокосовым карри, куриным виндалу и жареным томатным карри с капустой и нутом.
Если вам интересно, как втиснуть больше питательных веществ в насыщенную вкусами диету, прочитайте наш блог, чтобы узнать о восхитительных рецептах фьюжн, таких как наш бургер из баранины Vindaloo со свежей мятой и курица тандури на гриле с двойным йогуртом.
Натуральные белки: источники, выделение, характеристика и применение
1. Hermann JR. Белок и тело. Кооперативная служба распространения знаний Оклахомы, Отдел сельскохозяйственных наук и природных ресурсов. Государственный университет Оклахомы : T–3163–1 – T–3163–4 [Google Scholar]
2. McArdle WD, Katch FI, Katch VL. Физиология упражнений: энергия, питание и работоспособность человека. 5-е изд. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2001. Витамины, минералы и вода; стр. 47–81. [Google Scholar]
McArdle WD, Katch FI, Katch VL. Физиология упражнений: энергия, питание и работоспособность человека. 5-е изд. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2001. Витамины, минералы и вода; стр. 47–81. [Google Scholar]
3. Millward DJ. Пищевая ценность растительных диет по отношению к потребностям человека в аминокислотах и белках. Proc Nutr Soc. 1999а; 58: 249–60. [PubMed] [Google Scholar]
4. Streitwieser A, Jr, Heathcock CH. 3-е изд., 1985. «Введение в органическую химию» [Google Scholar]
5. Фурст П., Штеле П. «Каковы основные элементы, необходимые для определения потребностей человека в аминокислотах?» Дж Нутр. 2004; 134 (6 Дополнение): 1558–65S. [PubMed] [Google Scholar]
6. Сатьянараяна У., Чакрапани У. 3-е изд. 2006 г. Книги по биохимии. [Google Scholar]
7. Бахмайр А., Финли Д., Варшавский А. Период полураспада белка in vivo зависит от его амино-концевого остатка. Наука. 1986; 234: 179–86. [PubMed] [Google Scholar]
8. Пейс К.Н., Вайдос Ф., Фи Л., Гримсли Г., Грей Т. Как измерить и предсказать молярный коэффициент поглощения белка. Белковая наука. 1995; 11:2411–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Пейс К.Н., Вайдос Ф., Фи Л., Гримсли Г., Грей Т. Как измерить и предсказать молярный коэффициент поглощения белка. Белковая наука. 1995; 11:2411–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Edelhoch H. Спектроскопическое определение триптофана и тирозина в белках. Биохимия. 1967; 6: 1948–54. [PubMed] [Академия Google]
10. Gill SC, von Hippel PH. Расчет коэффициентов экстинкции белка по данным аминокислотной последовательности. Анальная биохимия. 1989; 182: 319–26. [PubMed] [Google Scholar]
11. Икаи А. Термостабильность и алифатический индекс глобулярных белков. Дж Биохим. 1980; 88: 1895–8. [PubMed] [Google Scholar]
12. Kyte J, Doolittle RF. Простой метод отображения гидропатического характера белка. Дж Мол Биол. 1982; 157: 105–32. [PubMed] [Google Scholar]
13. Альтерман М.А., Ханцикер П. Методы молекулярной биологии, анализ аминокислот, методы и протоколы. 2012 [Академия Google]
14. Крейтон Т.Е. Нью-Йорк: Фримен В.Х.; 1993. Белки: структуры и молекулярные свойства. [Google Scholar]
Белки: структуры и молекулярные свойства. [Google Scholar]
15. Кун Дж.Дж. Столкновения или электроны? Анализ белковой последовательности в 21 st в. Анальная хим. 1980; 81: 3208–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Bender W, Smith M. Population, Food and Nutrition. Народный Бык. 1997; 51: 5–25. [Google Scholar]
17. Fink HH, Mikesky AE, Burgoon LA. 3-е изд. 2012. Практические приложения в спортивном питании; стр. 1–569. [Google Scholar]
18. Yue H, Defa L, Xianglan P, Xiangshu P. Экстракт Forsythia suspensa снижает гиперчувствительность, вызванную соевым β-конглицинином у поросят-отъемышей. J Этнофармакол. 2010; 128:412–8. [PubMed] [Google Scholar]
19. Gu X, Campbell LJ, Euston SR. Влияние различных масел на свойства эмульсий и гелей изолята соевого белка. Фуд Рез Инт. 2009;42:925–32. [Google Scholar]
20. Ширли С.Л., Ван Л.Х., Нг Т.Б. Очистка и характеристика новых рибосом, инактивирующих белков, альфа- и бета-писавинов из семян гороха садового Pisum sativum . Biochem Biophys Res Commun. 1998; 253:135–42. [PubMed] [Google Scholar]
Biochem Biophys Res Commun. 1998; 253:135–42. [PubMed] [Google Scholar]
21. Ye XY, Ng TB. Выделение писумина, нового противогрибкового белка, из бобовых растений сахарного гороха Pisum sativum var. макрокарпон . Comp Biochem Physiol C Toxicol Pharmacol. 2003; 134: 235–40. [PubMed] [Google Scholar]
22. Ираш Дж. М., Бергуньо Л., Эспелета И., Геген Дж., Ореккьони А. М. Оптимизация и in vitro стабильность наночастиц легумина, полученных методом коацервации. Инт Дж Фарм. 1995;126:103–9. [Google Scholar]
23. Ezpeleta I, Irache JM, Stainmesse S, Chabenat C, Gueguen J, Orecchioni AM. Получение конъюгатов наночастиц лектин-вицилин с использованием метода карбодиимидного связывания. Инт Дж Фарм. 1996а; 142: 227–33. [Google Scholar]
24. Ezpeleta I, Irache JM, Gueguen J, Orecchioni AM. Свойства нано- и микрочастиц вицилина глутарового альдегида Crosslink. J Микрокапсула. 1997; 14: 557–65. [PubMed] [Google Scholar]
25. Ng TB. Противогрибковые белки и пептиды бобового и небобового происхождения, кафедра биохимии, медицинский факультет, Китайский университет Гонконга, Шатин, Новые территории, Гонконг, Китай. Пептиды. 2004; 25:1215–22. [PubMed] [Академия Google]
Противогрибковые белки и пептиды бобового и небобового происхождения, кафедра биохимии, медицинский факультет, Китайский университет Гонконга, Шатин, Новые территории, Гонконг, Китай. Пептиды. 2004; 25:1215–22. [PubMed] [Академия Google]
26. Нестеренко А., Алрик И., Сильвестр Ф., Дюрье В. Влияние структурных модификаций соевого белка на их свойства микрокапсулирования: получение микрочастиц атокоферола. Фуд Рез Инт. 2012; 48: 387–96. [Google Scholar]
27. Dagar A, Friedman H, Lurie S. Тауматин-подобные белки и их возможная роль в защите плодов персика от холода. Послеуборочная биотехнология. 2010;57:77–85. [Google Scholar]
28. Ducel V, Richard J, Saulnier P, Popineau Y, Boury F. Доказательства и характеристика сложных коацерватов, содержащих растительные белки: применение к микроинкапсуляции капель масла. Коллоидный прибой. 2004б; 232:239–47. [Google Scholar]
29. Ducel V, Richard J, Popineau Y, Boury F. Реологические межфазные свойства коацерватов растительного белка аравийской камеди на границе масло-вода. Биомакромолекулы. 2005; 6: 790–6. [PubMed] [Google Scholar]
Биомакромолекулы. 2005; 6: 790–6. [PubMed] [Google Scholar]
30. Ezpeleta I, Irache JM, Stainmesse S, Chabenat C, Gueguen J, Popineau Y, et al. Наночастицы глиадина для контролируемого высвобождения полностью трансретиноевой кислоты. Инт Дж Фарм. 1996б; 131:191–200. [Google Scholar]
31. Ивами К., Хаттори М., Накатани С., Ибуки Ф. Высушенные распылением порошки глиадина, содержащие линолевую кислоту (микрокапсулы): их сохраняемость, усвояемость и применение в хлебопекарном производстве. Сельскохозяйственная биохимия. 1987;51:3301–7. [Google Scholar]
32. Mauguet MC, Legrand J, Brujes L, Carnelle G, Larre C, Popineau Y. Матрицы глиадина для процессов микроинкапсуляции простым методом коацервации. J Микрокапсула. 2002; 19: 377–84. [PubMed] [Google Scholar]
33. Yu JY, Lee WC. Микрокапсулирование пирролнитрина из Pseudomonas cepacia с использованием глютена и казеина. Джей Фермент Биоинж. 1997; 84: 444–8. [Google Scholar]
34. Серия материалов «Богатство Индии», Национальный институт научных коммуникаций и информационных ресурсов, CSIR, Нью-Дели. 2010 [Google Академия]
2010 [Google Академия]
35. Чо С.Ю., Ри С., Висс Л. Механические свойства и паропроницаемость пищевых пленок, изготовленных из фракционированных соевых белков методом ультрафильтрации. U-Технологии. 2004; 37: 833–9. [Google Scholar]
36. Subirade M, Kelly I, Gueguen J, Pezolet M. Молекулярная основа образования пленки из соевого белка: сравнение конформации глицинина в водном растворе и в пленке. Int J Биол Макромоль. 1998; 23: 241–9. [PubMed] [Google Scholar]
37. Renkema JM, Vliet TV. Индуцированное нагреванием гелеобразование соевых белков при нейтральном pH. J Agric Food Chem. 2002;50:1569–73. [PubMed] [Google Scholar]
38. Хаард Н.Ф., Чизм Г.В. Характеристики съедобной растительной ткани. В: Феннема О, редактор. Пищевая химия. Нью-Йорк, штат Нью-Йорк: Марсель Деккер; 1996. с. 1067. [Google Scholar]
39. Кинселла Дж. Э. Взаимосвязь между структурой и функциональными свойствами пищевых белков. В: Фон, Кодон, редакторы. Пищевые белки. Нью-Йорк: издательство Springer; 1982. С. 51–104. [Google Scholar]
С. 51–104. [Google Scholar]
40. Кирстен Д., Пегги М.Т., Фиби К. Структура и функция пищевых пленок и покрытий на белковой основе. Пищевые пленки и покрытия для пищевых продуктов. 2009 г.: 25–56. [Google Scholar]
41. Шукла Р, Черян МЗ. Промышленный белок из кукурузы. Ind Crops Prod. 2001; 13: 171–92. [Google Scholar]
42. Koyoro H, Powers JR. Функциональные свойства глобулиновых фракций гороха. Зерновые хим. 1987; 64: 97–101. [Google Scholar]
43. Нестеренко А., Алри И., Сильвестр Ф.О., Дюрье В. Растительные белки в микрокапсулировании: обзор недавних вмешательств и их эффективность. Ind Crops Prod. 2013;42:469–79. [Академия Google]
44. Хамада Дж.С. Характеристика и функциональные свойства белков рисовых отрубей, модифицированных коммерческими экзопротеазами и эндопротеазами. Дж. Пищевая наука. 2000;65:305–10. [Google Scholar]
45. Bienvenido OJ. Рис в организации питания человека ETL Организации Объединенных Наций, Сила сельского хозяйства, Рим. 1994 [Google Scholar]
1994 [Google Scholar]
46. Kaewka K, Therakulkait C, Cadwallader KR. Влияние условий приготовления на состав и сенсорно-ароматические характеристики кислотно-гидролизованного белкового концентрата рисовых отрубей. J Зерновые науки. 2009 г.;50:56–60. [Google Scholar]
47. Пинчироли М., Видал А.А., Анон М.С., Мартинес Э.Н. Сравнение функциональных свойств белков двух сортов риса. Технологии пищевых наук. 2009; 42:1605–10. [Google Scholar]
48. Хата С., Вибунсирикул Дж., Маэда А., Кимура Й., Адачи С. Экстракция обезжиренных рисовых отрубей путем обработки воды в докритических условиях. Biochem Eng J. 2008; 40:44–53. [Google Scholar]
49. Сериваттханавут И., Прапинтип С., Ваттираруджи К., Гото М., Сасаки М., Шотипрук А. Экстракция белка и аминокислот из обезжиренных рисовых отрубей путем гидролиза воды в докритических условиях. Биоресурсная технология. 2008;99: 555–61. [PubMed] [Google Scholar]
50. Чанди Г.К., Соги Д.С. Функциональные свойства белкового концентрата рисовых отрубей. Дж Фуд Инж. 2007; 79: 592–7. [Google Scholar]
Дж Фуд Инж. 2007; 79: 592–7. [Google Scholar]
51. Агбула С., Нг Д., Миллс Д. Характеристика и функциональные свойства изолятов австралийского рисового белка. J Зерновые науки. 2005; 41: 283–90. [Google Scholar]
52. Ordonez C, Asenjo MG, Benitez JL, Gonzalez JL. Получение белкового концентрата из цельной обезжиренной подсолнечной муки. Биоресурсная технология. 2001; 78: 187–9.0. [PubMed] [Google Scholar]
53. Gonzalez-Perez S, Vereijken JM. Белки подсолнечника: обзор их физико-химических, структурных и функциональных свойств. J Sci Food Agric. 2007; 87: 2173–91. [Google Scholar]
54. Линден Г.Л. Массон, Париж: 1994. Агропромышленная компания Biochimie: Valorisation alimentaire de la pro-duction agricole. [Google Scholar]
55. Audic JL, Chaufer B, Daufin G. Непищевое применение компонентов молока и молочных побочных продуктов: обзор. Логово. 2003; 83: 417–38. [Академия Google]
56. Суэйсгуд Х.Э. Обзор и обновление химии казеина. Дж. Молочная наука. 1993;76:3054–61. [PubMed] [Google Scholar]
1993;76:3054–61. [PubMed] [Google Scholar]
57. Swaisgood HE. Характеристики молока. В: Феннема О, редактор. Пищевая химия. Нью-Йорк: Марсель Деккер; 1996. с. 1067. [Google Scholar]
58. Роземберг М., Янг С.Л. Сывороточные протеины как микроинкапсулирующие агенты. Микрокапсулирование оценки структуры безводного молочного жира. Пищевая структура. 1993; 12:31–41. [Google Scholar]
59. Ливней Ю.Д. Белки молока как транспортные средства для биоактивных веществ. Curr Opin Коллоидный интерфейс Sci. 2010; 15:73–83. [Академия Google]
60. Morr CV, Ha EY. Концентраты и изоляты сывороточного белка: технологические и функциональные свойства. Crit Rev Food Sci Nutr. 1993; 33: 431–76. [PubMed] [Google Scholar]
61. DeWit JN, Klarenbeek G. Влияние различных термообработок на структуру и растворимость сывороточных белков. Дж. Молочная наука. 1983; 67: 2701–10. [Google Scholar]
62. Кинселла Дж. Э. Белки молока: физико-химические и функциональные свойства.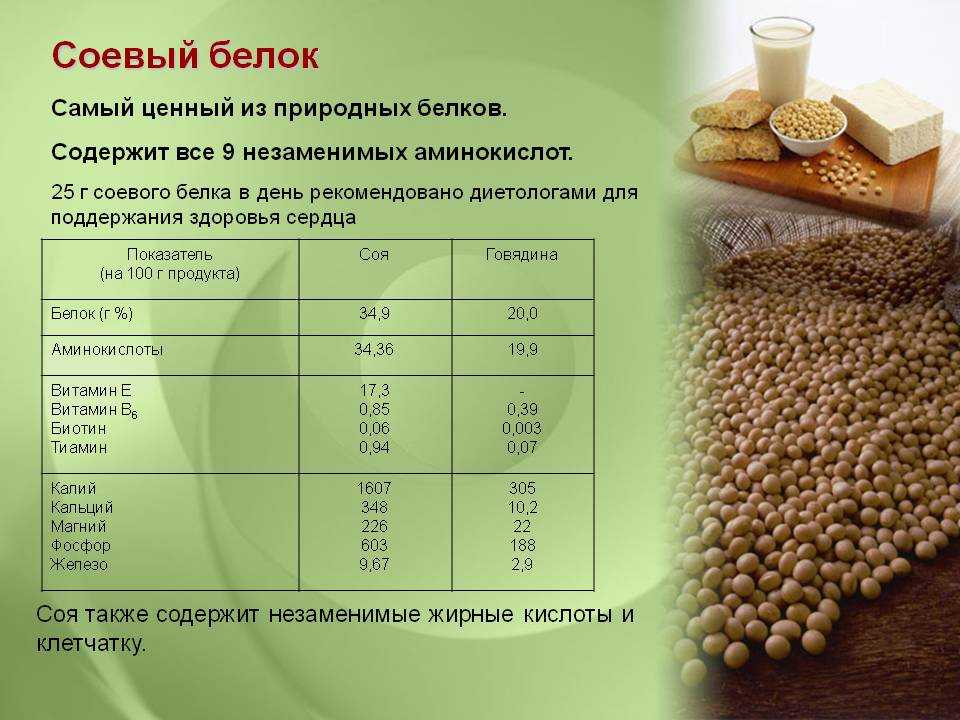 Crit Rev Food Sci Nutr. 1984; 21: 197–262. [PubMed] [Академия Google]
Crit Rev Food Sci Nutr. 1984; 21: 197–262. [PubMed] [Академия Google]
63. Сойер Л., Контопидис Г., Ву С.Ю. Бета-лактоглобулин: трехмерная перспектива. Int J Food Sci Tech. 1999; 34: 409–18. [Google Scholar]
64. Хауг И.Дж., Драгет К.И., Смидсрод О. Физические и реологические свойства желатина рыб по сравнению с желатином млекопитающих. Пищевой гидроколл. 2004;18:203–13. [Google Scholar]
65. Badii F, Howell NK. Рыбий желатин: структура, желирующие свойства и взаимодействие с белками яичного белка. Пищевой гидроколл. 2006; 20: 630–40. [Академия Google]
66. Mine Y. Последние достижения в понимании функциональности яичного белка. Тенденции Food Sci Technol. 1995; 6: 225–32. [Google Scholar]
67. Нумата К., Каплан Д.Л. Системы доставки биоактивных молекул на основе шелка. Adv Drug Deliv Rev. 2010; 62: 1497–508. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Altman GH, Diaz F, Jakuba C, Calabro T, Horan RL, Chen J, et al. Биоматериалы на основе шелка. Биоматериалы. 2003; 24: 401–16. [PubMed] [Академия Google]
Биоматериалы. 2003; 24: 401–16. [PubMed] [Академия Google]
69. Ротштейн Ф. Дифференциальное осаждение белков. В: Харрисон Р.Г., редактор. В технологии очистки белков. Нью-Йорк: Марсель Деккер; 1994. С. 115–208. [Google Scholar]
70. Tanford C. In Physical Chemistry of Macromolecules. Нью-Йорк: Джон Уайли и сыновья; 1996. Множественные равновесия; стр. 561–4. [Google Scholar]
71. Edsall JT, Wyman I. New York: Academic Press; 1958. Биофизическая химия; стр. 591–662. [Google Scholar]
72. Хеймс Б.Д., Риквуд Д. 2-е изд. Нью-Йорк: Издательство Оксфордского университета; 1990. Гель-электрофорез белков: практический подход. [Google Scholar]
73. Агилар М.И. ВЭЖХ пептидов и белков: методы и протоколы. Том. 251. Тотова, Нью-Джерси: Humana Press Inc; 1996. Методы молекулярной биологии. [Google Scholar]
74. Агилар М.И., Хирн М.Т. Высокоэффективная жидкостная хроматография с обращенной фазой высокого разрешения для пептидов и белков. Методы Энзимол. 1996; 270:3–26. [PubMed] [Google Scholar]
1996; 270:3–26. [PubMed] [Google Scholar]
75. Mant CT, Hodges RS. Анализ пептидов методом высокоэффективной жидкостной хроматографии. Методы Энзимол. 1996;271:3–50. [PubMed] [Google Scholar]
76. Purcell AW, Aguilar MI, Hearn MT. Конформационные эффекты в ОФ-ВЭЖХ полипептидов. II: Роль цепей А и В инсулина в хроматографическом поведении инсулина. J Хроматогр. 1995; 711: 71–9. [PubMed] [Google Scholar]
77. Лин С., Каргер Б.Л. Хроматографическое поведение белков с обращенной фазой в различных развернутых состояниях. J Хроматогр. 1990; 499: 89–102. [PubMed] [Google Scholar]
78. Mann M, Hendrickson RC, Pandey A. Анализ белков и протеомов с помощью масс-спектрометрии. Анну Рев Биохим. 2001; 70: 437–73. [PubMed] [Академия Google]
79. Йейтс Дж.Р. Поиск в базе данных по данным масс-спектрометрии. Электрофорез. 1998; 19: 893–900. [PubMed] [Google Scholar]
80. Tessier B, Schweizer M, Fournier F, Framboisier I, Chevalot R, Vanderesse C, Harscoat I. Marc Прогнозирование аминокислотного состава малых пептидов, содержащихся в гидролизате растительного белка, с помощью LC –МС и КЭ–МС. Фуд Рез Инт. 2005; 38: 577–84. [Google Scholar]
Marc Прогнозирование аминокислотного состава малых пептидов, содержащихся в гидролизате растительного белка, с помощью LC –МС и КЭ–МС. Фуд Рез Инт. 2005; 38: 577–84. [Google Scholar]
81. Эльзохби А.О., Або Эль-Фотох В.С., Эльгинди Н.А. Препараты на основе казеина как перспективные системы доставки лекарств с контролируемым высвобождением. J Управление выпуском. 2011;153:206–16. [PubMed] [Академия Google]
82. Эльзохби А.О., Самый В.М., Елгинды Н.А. Наночастицы на основе альбумина как потенциальные системы доставки лекарств с контролируемым высвобождением. J Управление выпуском. 2012; 157:168–82. [PubMed] [Google Scholar]
83. Yuko Y, Keito N, Megumi Y, Hui Z, Kunihiko O, Masayoshi T, et al. Антигипертензивная активность генетически модифицированных семян сои, накапливающих новокинин. Пептиды. 2008; 29: 331–37. [PubMed] [Google Scholar]
84. Эсмаили М., Гаффари М.С., Мусави-Мовахеди З., Атри М.С., Шаризаде А., Фархади М. и др. Бета-казеин-мицелла как наноноситель для повышения растворимости куркумина: применение в пищевой промышленности в LWT.

