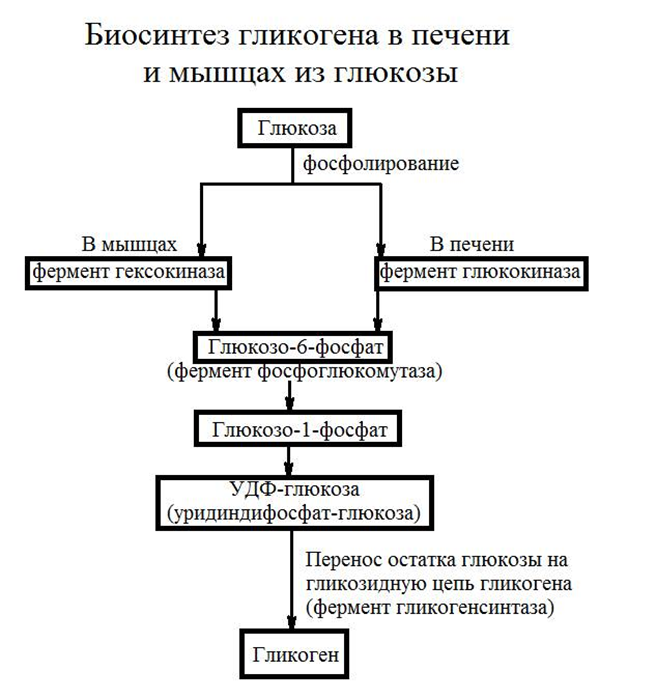
4.2. Мобилизация гликогена
Гликоген, как резерв глюкозы, накапливается в клетках во время пищеварения и расходуется в постабсорбционном периоде. Расщепление гликогена в печени или его мобилизация осуществляется при
участии фермента гликогенфосфоррилазы часто называемой просто
фосфорилазой. Этот фермент катализирует фосфоролитическое расщепление a-1,4-гликозидных связей концевых остатков глюкозы полимера:
(С6 Н10О5)n + Н3РО4——> (C6 Н10О5)n-1 + Гл-1-Ф
Для расщепления молекулы в районе разветвлений необходимы два дополнительных фермента: так называемый дебранчинг (деветвящий) — фермент и амило-1,6-гликозидаза, причем в результате действия последнего фермента в клетках образуется свободная глюкоза, которая может или покинуть клетку, или подвергнуться фосфорилированию.
Гл-1-ф
в клетках изомеризуется с участием
фосфоглюкомутазы в гл-6-ф.
Гл-6-ф + Н2О ——> Глюкоза + Н3РО4
которая может проникать через наружную клеточную мембрану и поступать в кровяное русло. Если же глюкозо-6-фосфатазы в клетках нет, то дефосфорилирования глюкозы не происходит и глюкозный остаток может быть утилизирован только данной конкретной клеткой. Заметим, что расщепление гликогена до глюкозы не нуждается в дополнительном притоке энергии.
В большинстве органов
и тканей человека глюкозо-6-фосфатаза
отсутствует, поэтому запасенный в них
гликоген используется лишь для собственных
нужд. Типичным представителем таких
тканей является мышечная ткань.
Глюкозо-6-фосфатаза имеется лишь в
печени, почках и кишечнике, но наиболее
существенным является наличие фермента
в печени ( точнее, в гепатоцитах ), т.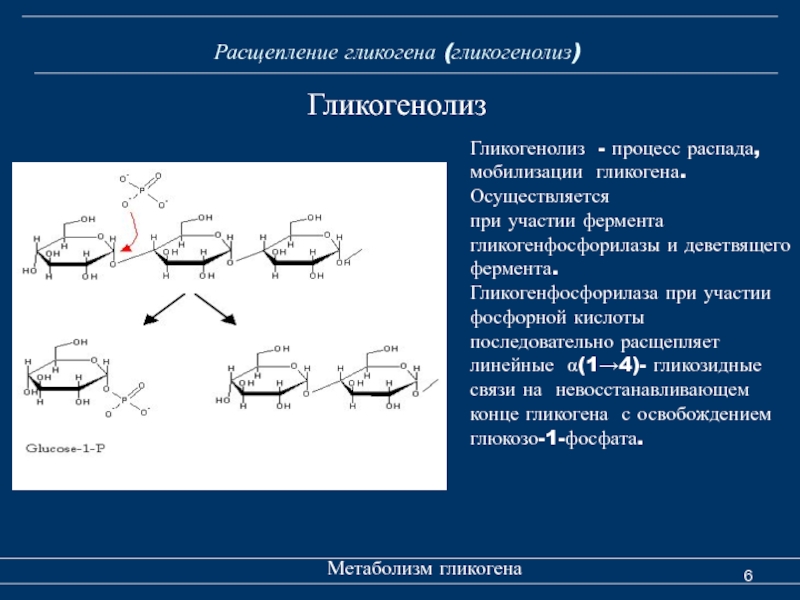
| |
Н2О Н3РО4
Это обстоятельство дает возможность раздельно регулировать обсуждаемые процессы. Регуляция осуществляется на уровне двух ферментов: гликогенсинтетазы, участвующей в синтезе гликогена, и фосфорилазы, катализирующей расщепление гликогена.
Основным механизмом регуляции активности этих ферментов является их ковалентная модификация путем фосфорилирования-дефосфорилирования. Фосорилированная фосфорилаза или фосфорилаза «a» высокоактивна, в то же время фосфорилированная гликогенсинтетаза или синтетаза «b» неактивна. Таким образом, если оба фермента находятся в фосфорилированной форме, в клетке идет расщепление гликогена с образованием глюкозы. В дефосфорилированном состоянии, наоборот, неактивна фосфорилаза ( в форме «b») и активна гликогенсинтетаза ( в форме «a» ), в этой ситуации в клетке идет синтез гликогена из глюкозы.
Поскольку гликоген
печени играет роль резерва глюкозы для
всего организма, его синтез или распад
должен контролироваться надклеточными
регуляторными механизмами, работа
которых должна быть направлена на
поддержание постоянной концентрации
глюкозы в крови. Эти механизмы должны
обеспечивать включение синтеза гликогена
в гепатоцитах при повышенных концентрациях
глюкозы в крови и усиливать расщепление
гликогена при падении содержания глюкозы
в крови.
Эти механизмы должны
обеспечивать включение синтеза гликогена
в гепатоцитах при повышенных концентрациях
глюкозы в крови и усиливать расщепление
гликогена при падении содержания глюкозы
в крови.
Итак, первичным сигналом, стимулирующим мобилизацию гликогена в печени, является снижение концентрации глюкозы в крови. В
ответ на него альфа-клетки поджелудочной железы выбрасывают в
кровь свой гормон — глюкагон. Глюкагон, циркулирующий в крови,
взаимодействует со своим белком-рецептором, находящемся на внешней стороне наружной клеточной мембраны гепатоцита. образуя гор —
мон-рецепторный комплекс. Образование гормон-рецепторного комплекса приводит с помощью специального механизма к активации фермента аденилатциклазы, находящегося на внутренней поверхности наружной клеточной мембраны. Фермент катализирует образование в клетке циклической 3,5-АМФ ( цАМФ ) из АТФ.
В
свою очередь, цАМФ активирует в клетке
фермент цАМФ—за— висимую
протеинкиназу.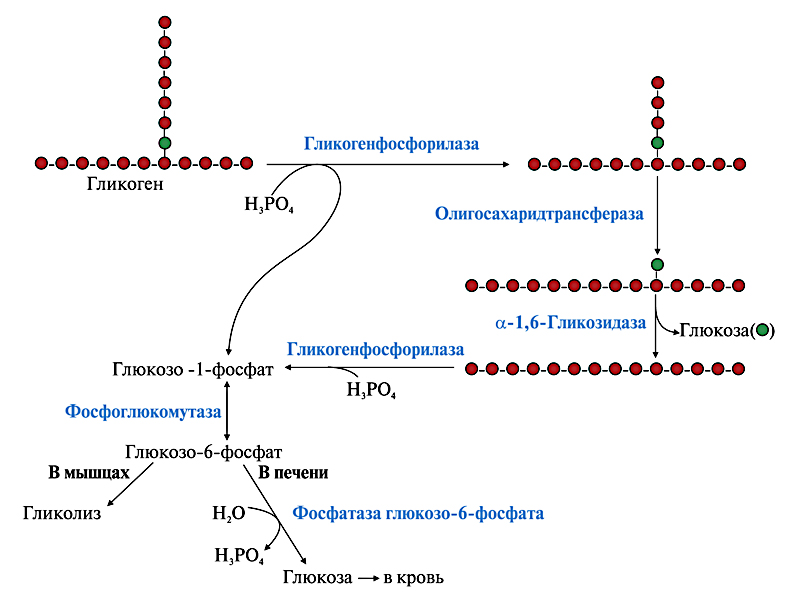 Неактивная форма протеинкиназы
представляет собой олигомер, состоящий
из четырех субъединиц: 2 регулятор-
Неактивная форма протеинкиназы
представляет собой олигомер, состоящий
из четырех субъединиц: 2 регулятор-
ных и двух каталитических. При повышении концентрации цАМФ в клетке к каждой из регуляторных субъединиц протеинкиназы присоединяется по 2 молекулы цАМФ, конформация регуляторных субъединиц —
изменяется и олигомер распадается на регуляторные и каталитичес — кие субъединицы. Свободные каталитические субъединицы катализирует фосфорилирование в клетке ряда ферментов, в том числе фосфорилирование гликогенсинтетазы с переводом ее в неактивное состояние, выключая таким образом синтез гликогена . Одновременно идет фос — форилирование киназы фосфорилазы, а этот фермент, активируясь при его фосфорилировании, в свою очередь катализирует фосфорилирование фосфорилазы с переводом его в активную форму, т.е. в форму «a». В результате активации фосфорилазы включается расщепление гликогена и гепатоциты начинают поставлять глюкозу в кровь.
Попутно отметим,
что при стимуляции расщепления гликогена
в печени катехоламинами в качестве
главных посредников выступают b —
рецепторы гепатоцитов, связывающие
адреналин. | тазы
| тазы
Образование | Фосфорилирование |
гормон-реце- | гликогенфосфори- Блокирование
пторного | лазы синтеза
комплекса | | гликогена
| | Активация расщеп-
Активация | ления гликогена
аденилатцик- ——— |
лазы Поступление глюкозы
в кровь
Повышение концентрации глюкозы в крови является внешним сигналом для гепатоцитов в отношении стимуляции синтеза гликогена и связывания таким образом излишней глюкозы из русла крови.
Схема активации синтеза гликогена в печени
Повышение Повышение Активация
содержания ——> содержания ———-> фосфопротеинглюкозы в глюкозы в фосфатазы
крови гепатоцитах | |
Активация Инактива-
гликоген- ция фосфо-
синтетазы рилазы
|
Активация синтеза
гликогена
|
Снижение содержания глюкозы в крови
Срабатывает
следующий механизм: при повышении
концентрации глюкозы в крови возрастает
и ее содержание в гепатоцитах.
В снижении фосфорилазной активности в гепатоцитах определенную роль играет гормон b-клеток поджелудочной железы инсулин. Он выделяется b-клетками в ответ на повышение содержания глюкозы в крови. Его связывание с инсулиновыми рецепторами на поверх-
ности гепатоцитов приводит к активации в клетках печени фермента
фосфодиэстеразы, катализирующего превращение цАМФ в обычную АМФ,
не обладающую
способность стимулировать образование
активной протеинкиназы. Этим путем
прекращается нарабатывание в гепатоцитах
активной фосфорилазы, что также имеет
значение для ингибирования расщепления
гликогена.
Вполне естественно, что механизмы регуляции синтеза и распа-
да гликогена в клетках различных органов имеют свои особенности. В качестве примера можно указать, что в миоцитах покоящихся мышц
или мышц, выполняющих небольшую по интенсивности работу, практически нет фосфорилазы «a», но расщепление гликогена все же идет. Дело в том, что мышечная фосфорилаза, находящаяся в дефосфорилированном состоянии или в форме «b», является аллостерическим ферментом и активируется имеющимися в миоцитах АМФ и неорганическим фосфатом. Активированная таким образом фосфорилаза «b» обеспечивает скорость мобилизации гликогена, достаточную для выполнения умеренной физической работы.
Однако при выполнении интенсивной работы, в особенности если нагрузка резко возрастает, этого уровня мобилизации гликогена становится недостаточно. В таком случае срабатывают надклеточные механизмы регуляции. В ответ на внезапно возникшую потребность в
интенсивной мышечной
деятельности в кровь поступает гормон
адреналин из мозгового вещества
надпочечников. Адреналин, связываясь
Адреналин, связываясь
с рецепторами на поверхности мышечных клеток, вызывает ответную реакцию миоцитов, близкую по своему механизму к только что описанной реакции гепатоцитов на глюкагон. В мышечных клетках появляется фосфорилаза «a» и инактивируется гликогенсинтетаза, а образовавшийся гл-6-ф используется как энергетическое «топливо», окислительный распад которого обеспечивает энергией мышечное сокращение.
Следует заметить, что высокие концентрации адреналина, наблюдающиеся в крови людей в условиях эмоционального стресса, ускоряют расщепление гликогена в печени, повышая тем самым содержание глюкозы в крови — защитная реакция, направленная на экстренную мобилизация энергетических ресурсов.
УГЛЕВОДЫ-2 Мобилизация гликогена Это процесс распада гликогена
УГЛЕВОДЫ-2
Мобилизация гликогена Это процесс распада гликогена в печени до свободной глюкозы, которая должна поступить из печени в кровь. Цель этого процесса – поддерживать концентрацию глюкозы в крови на постоянном уровне в те периоды, когда не происходит поступления глюкозы из пищи (например, ночное время).
Цель этого процесса – поддерживать концентрацию глюкозы в крови на постоянном уровне в те периоды, когда не происходит поступления глюкозы из пищи (например, ночное время).
Этапы мобилизации гликогена Гормоны (глюкогон, адреналин, норадреналин) при снижении уровня глюкозы в крови активируют рецепторы на поверхности гепатоцита, образуется комплекс гормон-рецептор, который активирует аденилатциклазу. Этот фермент синтезирует циклический АМФ, который являясь медиатором (посредником) активирует работу ферментной цепи от протеинкиназы до гликогенфосфорилазы. Главная цель – фосфорилирование концевой глюкозы в молекуле гликогена, находящейся внутри гепатоцита.
Заключительный этап мобилизации гликогена Фосфорилированная по первому углеродному атому молекула глюкозы отрывается от гликогена в виде глюкозо-1 -фосфата и превращается в глюкозо-6 -фосфат под действием фосфоглюкомутазы. Фосфорилированная глюкоза не может выйти из клетки и попасть в кровь (ловушка для глюкозы). Фермент глюкокозофосфотаза гидролитическим путем отщепляет фосфатную группу и свободная глюкоза через плазматическую мембрану проходит из клетки в кровяное русло.
Фермент глюкокозофосфотаза гидролитическим путем отщепляет фосфатную группу и свободная глюкоза через плазматическую мембрану проходит из клетки в кровяное русло.
Химизм мобилизации гликогена
Превращение фруктозы в глюкозу
Превращение галактозы в глюкозу
Концентрация глюкозы в крови В норме концентрация глюкозы составляет 4, 2 – 5, 5 ммоль/л. Почки не пропускают глюкозу из крови в мочу, но если концентрация ее в крови составляет 9 -10 ммоль/л – глюкоза выходит в мочу. Этот показатель называется почечный порог для глюкозы. Понятие сахар крови является более широким, чем глюкоза крови и цифры несколько выше.
Источники поддержания концентрации глюкозы крови Главный источник – поступление из кишечника при всасывании. Другой источник – мобилизация гликогена из печени. Еще один – реабсорбция глюкозы в почках. Кроме того – глюконеогенез, то есть синтез глюкозы заново из других веществ (аминокислот, пирувата, лактата, глицерина).
Пути превращения глюкозы
ГЛИКОЛИЗ (анаэробно, в цитоплазме) Это процесс расщепления глюкозы до ПВК, после которого ПВК превращается в конечный продукт гликолиза – лактат. Если процесс начинается от гликогена – это гликогенолиз. Роль этих процессов – быстро получить энергию для работы мышц, даже при недостатке О 2. Понятие аэробный гликолиз – это дальнейшее окисление ПВК до СО 2 и Н 2 О, идущее в митохондриях, включая цикл Кребса.
Эффективность гликолиза и гликогенолиза В начальных реакциях гликолиза на активацию гексоз расходуется 2 АТФ, затем синтезируется 4 АТФ. Накопление (чистый прирост) составляет 2 АТФ. А при гликогенолизе на активацию расхо-дуется 1 АТФ, синтезируется 4 АТФ (прирост 3 АТФ). Эффект спиртового брожения глюкозы такой же, как у гликолиза: С 6 Н 12 О 6 + 2 АТФ + 2 Н 3 РО 4 = 2 С 2 Н 5 ОН + 2 СО 2 + 2 АТФ
Особенности гликолиза • Большинство реакций гликолиза обратимы, но три из них, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой – необратимы. В обратную сторону они возможны только с помощью обходных реакций. • Образовавшийся лактат поступает в кровь, поглощается печенью и сердечной мышцей и окисляется до СО 2, Н 2 О или восстанавливается в глюкозу (глюконеогенез). • Водород от НАДН (6 -я реакция) идет в реакцию 11 (гликолитическая оксидоредукция).
В обратную сторону они возможны только с помощью обходных реакций. • Образовавшийся лактат поступает в кровь, поглощается печенью и сердечной мышцей и окисляется до СО 2, Н 2 О или восстанавливается в глюкозу (глюконеогенез). • Водород от НАДН (6 -я реакция) идет в реакцию 11 (гликолитическая оксидоредукция).
Гексокиназная обходная реакция гликолиза
Фосфофруктокиназная обходная реакция гликолиза
Пируваткиназная обходная реакция гликолиза
Челночные механизмы Гликолиз идет в цитоплазме и полученный там НАДН не может передать атомы Н в митохондрию в дыхательную цепь для синтеза АТФ и тепла. С этой целью существуют системы переноса Н – челночные механизмы. Глицерофосфатный передает Н от НАДН цитоплазмы на ФАД митохондрий (потеря 1 АТФ), малатный — от НАДН на НАДН митохондрий (без потерь). Первый активен в мышцах и мозге, второй – в печени, почках и сердце.
Глицерофосфатный челночный механизм
Малатный челночный механизм
Цикл Кребса
Цикл Кребса (продолжение)
Эффективность аэробного распада глюкозы (цифры по учебнику) Первая стадия аэробного распада глюкозы (до ПВК) обеспечивает синтез 10 АТФ (малатный челнок) или 8 АТФ (глицерофосфатный). Вторая стадия (окислительное декарбоксилирование ПВК) – 6 АТФ. Третья стадия (цикл Кребса) – 24 АТФ Итого – 40 (38) АТФ, а при гликогенолизе 39 (37) АТФ. Накапливается чистых АТФ, с учетом акти-вации процесса, на 2 АТФ меньше
Вторая стадия (окислительное декарбоксилирование ПВК) – 6 АТФ. Третья стадия (цикл Кребса) – 24 АТФ Итого – 40 (38) АТФ, а при гликогенолизе 39 (37) АТФ. Накапливается чистых АТФ, с учетом акти-вации процесса, на 2 АТФ меньше
Эффект Пастера Если условия в клетке переключаются на аэробные, то анаэробный гликолиз тормозится, как менее эффектный. При этом образование лактата снижается. Это происходит путем ингибирования ключевого фермента гликолиза — фосфофруктокиназы. Регуляторную роль в этом переключении играют дефицит АДФ, Н 3 РО 4 и избыток АТФ.
Роль глюкозы, инсулина и глюкагона в мобилизации гликогена в гепатоцитах человека
. 1991 г., февраль; 40(2):263-8. doi: 10.2337/диабет.40.2.263.М Пилар Лопес 1 , M J Gómez-Lechón, J V Castell
принадлежность
- 1 Исследовательский центр, больница Ла Фе, Валенсия, Испания.

- PMID: 1846828
- DOI: 10.2337/диабет.40.2.263
М. Пилар Лопес и др. Диабет. 1991 Февраль
. 1991 г., февраль; 40(2):263-8. doi: 10.2337/диабет.40.2.263.Авторы
М Пилар Лопес 1 , М. Дж. Гомес-Лехон, Дж. В. Кастелл
принадлежность
- 1 Исследовательский центр, больница Ла Фе, Валенсия, Испания.
- PMID: 1846828
- DOI:
10.
 2337/диабет.40.2.263
2337/диабет.40.2.263
Абстрактный
В этом исследовании изучалась роль глюкозы, инсулина и глюкагона в активации катаболизма гликогена в культивируемых гепатоцитах человека. Базальный гликогенолиз в нестимулированных гепатоцитах человека был низким (за 4 ч инкубации расщеплялось только 19% исходного содержания гликогена) и нечувствительным к изменению внешней концентрации глюкозы (от 10 до 0 мМ). Как гликогенолиз, так и выход глюкозы могут быть значительно стимулированы 35 нг/л глюкагона или 10(5) пМ дибутирил цАМФ; полумаксимальный эффект был обнаружен при 28 x 10 (2) нг/л глюкагона и 4 x 10 (5) пМ дибутирил цАМФ. После 3-часового воздействия 35 x 10(3) нг/л глюкагона более 9Было мобилизовано 0% гликогена гепатоцитов человека. Это вызывало увеличение скорости выхода глюкозы в среду в 4,6 раза по сравнению с нестимулированными клетками. Около 85% расщепленного гликогена превратили глюкозу в среду.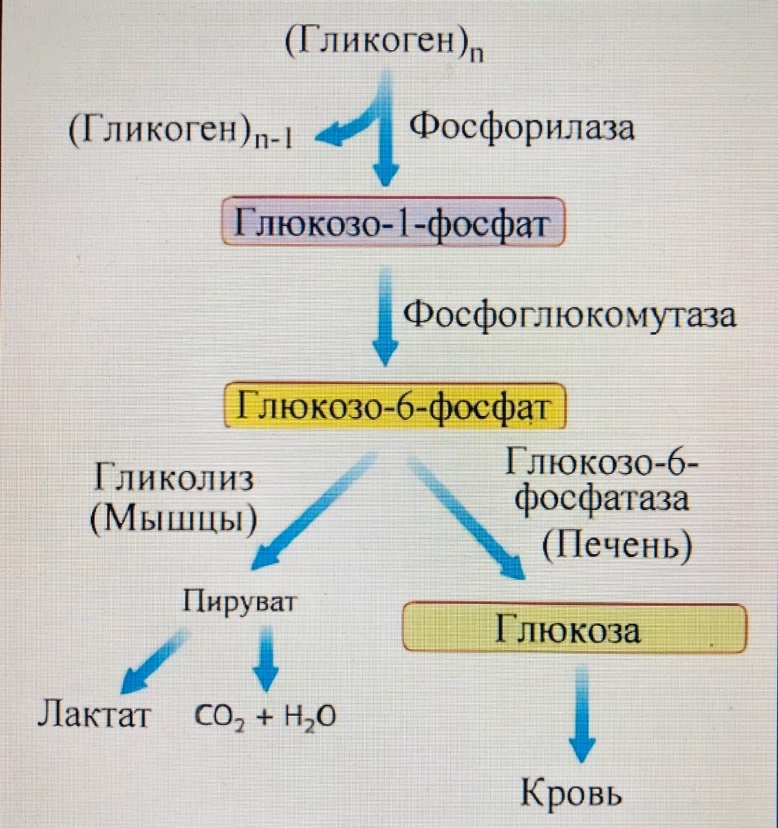 Инсулин (10(4) пМ) был способен полностью подавлять базальный гликогенолиз; инсулин был также необходим для реверсии действия глюкагона в гепатоцитах, инкубированных с глюкагоном, тогда как глюкоза сама по себе, даже в постпрандиальной концентрации, была неспособна обратить действие глюкагона. Таким образом, эти эксперименты показывают, что мобилизация запасов гликогена в гепатоцитах человека, как это происходит в периоды постабсорбции у людей, в значительной степени зависит от присутствия глюкагона, а не просто из-за уменьшения внешней глюкозы. Инсулин, с другой стороны, был необходим для подавления как базального, так и активируемого глюкагоном гликогенолиза.
Инсулин (10(4) пМ) был способен полностью подавлять базальный гликогенолиз; инсулин был также необходим для реверсии действия глюкагона в гепатоцитах, инкубированных с глюкагоном, тогда как глюкоза сама по себе, даже в постпрандиальной концентрации, была неспособна обратить действие глюкагона. Таким образом, эти эксперименты показывают, что мобилизация запасов гликогена в гепатоцитах человека, как это происходит в периоды постабсорбции у людей, в значительной степени зависит от присутствия глюкагона, а не просто из-за уменьшения внешней глюкозы. Инсулин, с другой стороны, был необходим для подавления как базального, так и активируемого глюкагоном гликогенолиза.
Похожие статьи
- Овечий плацентарный лактоген ингибирует глюкагон-индуцированный гликогенолиз в эмбриональных гепатоцитах крысы.
Фримарк М., Хандвергер С. Фримарк М. и др. Эндокринология.
 1985 г., апрель; 116(4):1275-80. дои: 10.1210/эндо-116-4-1275.
Эндокринология. 1985.
PMID: 2982583
1985 г., апрель; 116(4):1275-80. дои: 10.1210/эндо-116-4-1275.
Эндокринология. 1985.
PMID: 2982583 - Контроль выхода глюкозы в печень с помощью глюкагона и инсулина у интактной собаки.
Черрингтон А.Д., Чиассон Дж.Л., Лильенквист Дж.Е., Лейси В.В., Парк CR. Черрингтон А.Д. и др. Biochem Soc Symp. 1978;(43):31-45. Biochem Soc Symp. 1978 год. PMID: 373768 Обзор.
- Ингибирование гликогенолиза и гликогенфосфорилазы инсулином и проинсулином в культурах гепатоцитов крысы.
Хартманн Х., Пробст И., Юнгерманн К., Кройтцфельдт В. Хартманн Х. и др. Диабет. 1987 мая; 36(5):551-5. doi: 10.2337/diab.36.5.551. Диабет. 1987. PMID: 3552790
- Гликогенолитический ответ на глюкагон культивируемых фетальных гепатоцитов.
 Рефрактерность после предшествующего воздействия глюкагона.
Рефрактерность после предшествующего воздействия глюкагона.Плас С, Нуньес Х. Плас С и др. Дж. Биол. Хим. 1975 г., 25 июля; 250 (14): 5304-11. Дж. Биол. Хим. 1975 год. PMID: 167009
- Использование гепатоцитов в первичной культуре для биохимических исследований функций печени.
Итихара А., Накамура Т., Танака К. Итихара А. и др. Мол Селл Биохим. 1982 2 апреля; 43 (3): 145-60. дои: 10.1007/BF00223006. Мол Селл Биохим. 1982. PMID: 6123941 Обзор.
Посмотреть все похожие статьи
Цитируется
- Исследование метаболизма глюкозы в печени с помощью 13 C ЯМР-спектроскопии перфузии печени – применение в разработке лекарств.
Миллер СО, Цао Дж.
 Миллер СО и соавт.
Метаболиты. 2021 20 октября; 11 (11): 712. doi: 10.3390/metabo11110712.
Метаболиты. 2021.
PMID: 34822370
Бесплатная статья ЧВК.
Обзор.
Миллер СО и соавт.
Метаболиты. 2021 20 октября; 11 (11): 712. doi: 10.3390/metabo11110712.
Метаболиты. 2021.
PMID: 34822370
Бесплатная статья ЧВК.
Обзор. - Метаболизм глюкозы в эндотелиальных клетках и ангиогенез.
Du W, Ren L, Hamblin MH, Fan Y. Ду В. и др. Биомедицины. 2021 3 февраля; 9 (2): 147. doi: 10.3390/биомедицины
47. Биомедицины. 2021. PMID: 33546224 Бесплатная статья ЧВК. Обзор. - Глюкагон снижает гликемию, когда активны β-клетки.
Капоцци М.Э., Уэйт Дж.Б., Коч Дж., Гордон А.Н., Кох Р.В., Свендсен Б., Финан Б., Д’Алессио Д.А., Кэмпбелл Дж.Е. Капоцци М.Е. и др. Взгляд JCI. 201923 июля; 5(16):e129954. doi: 10.1172/jci.insight.129954. Взгляд JCI. 2019. PMID: 31335319 Бесплатная статья ЧВК.

- Стабильные жидкие препараты глюкагона для неотложной терапии и бигормональной поджелудочной железы замкнутого цикла.
Джексон М.А., Капуто Н., Касл Дж.Р., Дэвид Л.Л., Робертс С.Т. младший, Уорд В.К. Джексон М.А. и соавт. Curr Diab Rep. 2012 Dec;12(6):705-10. дои: 10.1007/s11892-012-0320-5. Представитель Карр Диаб, 2012 г. PMID: 22972416 Бесплатная статья ЧВК. Обзор.
термины MeSH
вещества
Присутствие и мобилизация гликогена в р-клетках поджелудочной железы млекопитающих | Эндокринология
Фильтр поиска панели навигации EndocrinologyThis issueEndocrine Society JournalsClinical MedicineEndocrinology and DiabetesMedicine and HealthBooksJournalsOxford Academic Мобильный телефон Введите поисковый запрос
ЗакрытьФильтр поиска панели навигации EndocrinologyThis issueEndocrine Society JournalsClinical MedicineEndocrinology and DiabetesMedicine and HealthBooksJournalsOxford Academic Введите поисковый запрос
Расширенный поиск
Журнальная статья
БО ХЕЛМАН,БО ХЕЛМАН
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
ЛАРС-ОКЕ ИДАЛЬЛАРС-ОКЕ ИДАЛЬ
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Эндокринология , том 84, выпуск 1, 1 января 1969 г.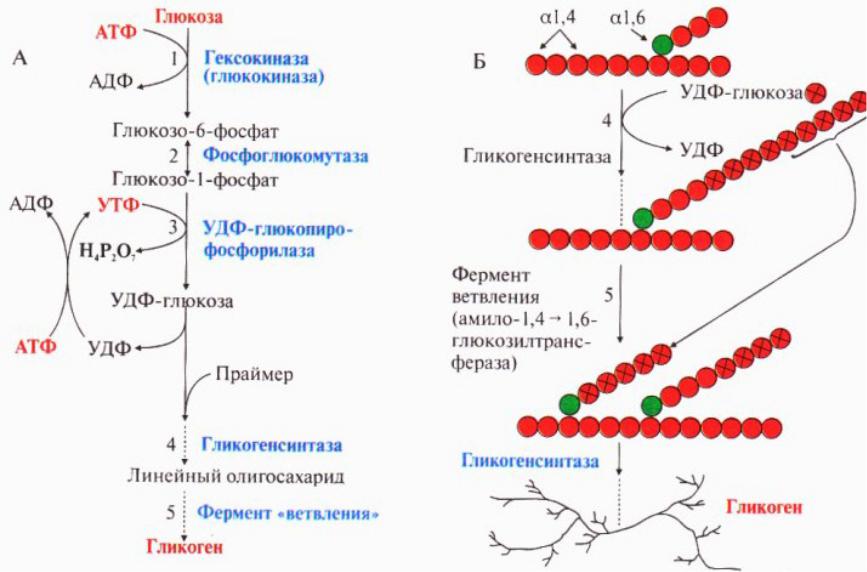 , страницы 1–8, https://doi.org/10.1210/endo-84-1-1
, страницы 1–8, https://doi.org/10.1210/endo-84-1-1
Опубликовано:
1 января 1969 г.
История статьиПолучено:
06 мая 1968 г.
Опубликовано:
01 января 1969 г.
Фильтр поиска панели навигации EndocrinologyThis issueEndocrine Society JournalsClinical MedicineEndocrinology and DiabetesMedicine and HealthBooksJournalsOxford Academic Мобильный телефон Введите поисковый запрос
ЗакрытьФильтр поиска панели навигации EndocrinologyThis issueEndocrine Society JournalsClinical MedicineEndocrinology and DiabetesMedicine and HealthBooksJournalsOxford Academic Введите поисковый запрос
Advanced Search
Комбинируя ферментативный метод, основанный на реакции на гликогенфосфорилазу, с конечными флуорометрическими измерениями небольших количеств НАДФН методом «ферментативного циклирования», стало возможным продемонстрировать, что гликоген представляет собой нормальную составляющую поджелудочной железы млекопитающих β клетки.

 org/10.1210/endo-84-1-1
org/10.1210/endo-84-1-1