Как задать энергетическую и пищевую ценность продуктов — Yumapos
Каждый продукт питания имеет свою энергетическую и пищевую ценность (КБЖУ).
Энергетическая ценность, или калорийность — это количество энергии, высвобождаемой в организме человека из продуктов питания в процессе пищеварения, при условии её полного усвоения. Энергетическая ценность измеряется в килокалориях (ккал) на 100 г продукта.
Пищевая ценность — одна из основных характерстик продукта питания, которая определяет содержание и соотношение белков, жиров и углеводов, содержащихся в продукте. Пищевая ценность измеряется в граммах на 100 г продукта.
Примечание: Юмапос отображает энергетическую и пищевую ценность элементов меню и модификаторов на сайте магазина и в Мобильном приложении. Данная информация важна для клиентов, соблюдающих диету и интересующихся здоровым образом жизни.
В этом разделе рассказывается, как задать энергетическую и пищевую ценность для продуктов (часто обозначается КБЖУ)- элементов складского учета и элементов меню.
Как задать КБЖУ для элементов меню
Чтобы задать энергетическую и пищевую ценность элемента меню без технологической карты (или если вы не хотите, чтобы эти параметры брались из технологической карты), выполните следующие шаги:
- В Бэк-офисе откройте страницу соответствующего элемента меню и перейдите на вкладку Основная информация (подробнее смотрите раздел Список элементов):
- Включите переключатель Не обновлять калории.
- Заполните поля Ккал (на 100г), Белки (на 100 г), Жиры (на 100 г) и Углеводы (на 100 г) и нажмите на Обновить.
Как задать КБЖУ для продуктов без технологической карты
Чтобы задать энергетическую и пищевую ценность продукта без технологической карты (или если вы не хотите, чтобы эти параметры брались из технолгической карты), выполните следующие шаги:
- В Бэк-офисе откройте страницу складского остатка соответствующего продукта и перейдите на вкладку Основная информация (подробнее смотрите раздел Как внести изменения в элементы складского учета):
- Включите переключатель Не обновлять калории.
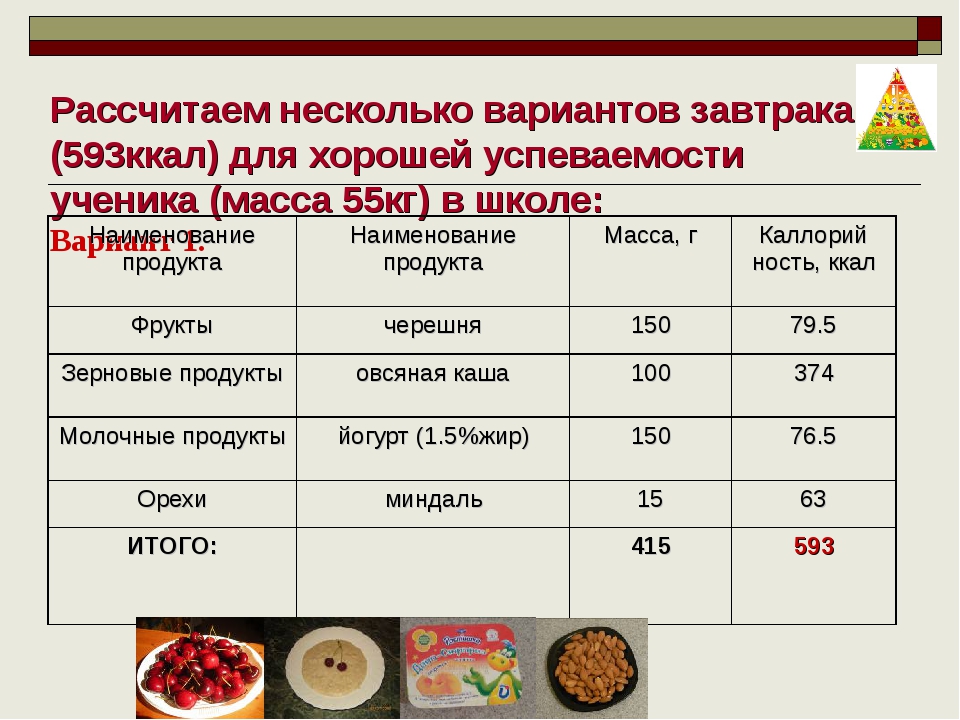
- Заполните поля Ккал (на 100г), Белки (на 100 г), Жиры (на 100 г) и Углеводы (на 100 г) и нажмите на Обновить.
Как задать КБЖУ для продуктов с технологической картой
Если у продукта имеется технологическая карта, то его энергетическая и пищевая ценность рассчитывается автоматически, по специальному алгоритму, где учитывается вклад каждого компонента , пропорционально его весу. Поэтому для корректного рассчета КБЖУ продукта необходимо корректно задать вес каждого компонента и его пищевую и энергетическую ценность.
Важно: Чтобы в технологической карте правильно отображалась информация об энергетической ценности продукта (в ккал на 100 г продукта), а также о его пищевой ценности — содержании белков, жиров и углеводов (в граммах на 100 г продукта), необходимо, чтобы данная информация (килокалории, белки, жиры и углеводы), а также вес (нетто и брутто), была правильно заполнена для каждого компонента технологической карты.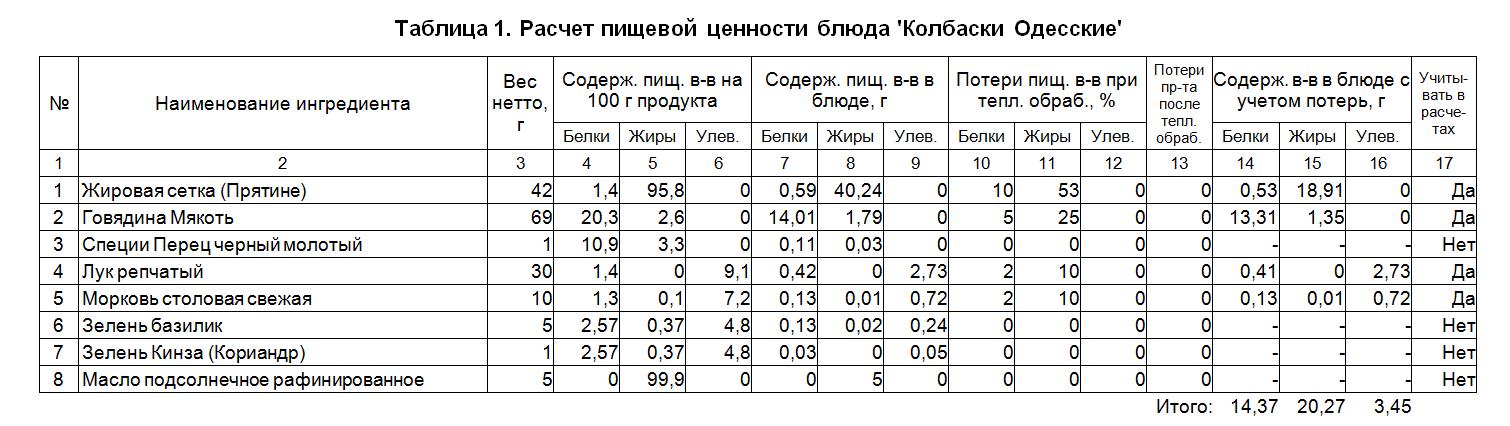 Для каждого компонента ввести данную информацию можно на вкладке Основная информация.
Для каждого компонента ввести данную информацию можно на вкладке Основная информация.
Примечание: Есть возможность отображать только энергетическую ценность продукта (в ккал), не показывая содержание белков, жиров и углеводов. Для этого необходимо указать энергетическую ценность для каждого компонента технологической карты, а в полях Белки, Жиры и Углеводы поставить 0 (ноль) или оставить их пустыми. В отдельных случаях, часть компонентов технологической карты может не иметь энергетической ценности- в этом случае, для таких компонентов в поле Ккал поставьте 0 (ноль) — оставлять пустым это поле нельзя.
Пример: технологическая карта для шоколадного безе
Шоколадное безе изготавливается из замороженного шоколада и яичного белка, которые и входят в технологическую карту шоколадного безе, как показано на скриншотах ниже.
Чтобы автоматически рассчитать калорийность безе, достаточно правильно заполнить его технологическую карту, указав корректные веса, а также правильно заполнить калорийность на вкладке Общая информация для Замороженого шоколада и Яичного белка, как показано ниже:
4.
 Расчет энергетической ценности
Расчет энергетической ценностиСравнение энергетической ценности различных групп пищевых продуктов
Энергетическая ценность – количество энергии (ккал, кДж), высвобождаемой в организме человека из пищевых веществ продуктов питания для обеспечения его физиологических функций.
Для расчета энергетической ценности пищевого продукта необходимо знать его химический состав и энергетическую ценность пищевых веществ.
4.1. Энергетическую ценность (ЭЦ) пищевого продукта рассчитывают по формуле:
ЭЦ = Б4,0 + Ж9,0 + У4,0 + ОК3,0,
где, ЭЦ – энергетическая ценность 100 г пищевого продукта, ккал;
Содержание в г/100 г продукта: Б – белков, Ж – жиров, У – углеводов,
ОК – органических кислот;
Количество ккал образующихся при сгорании пищевых веществ:
Б –
4,0; Ж – 9,0; У = 4,0; ОК = 3,0.
Усвояемость пищевых веществ зависит от их способности всасываться из желудочно-кишечного тракта. Количественную способность к всасыванию (коэффициент усвояемости) выражают в процентах к общему содержанию данного пищевого вещества в продукте или рационе. Коэффициенты усвояемости пищевых веществ зависят от особенностей входящих в рацион продуктов, способов их кулинарной обработки, состояния органов пищеварения. При смешанном (состоящем из животных и растительных продуктов) питании коэффициент усвояемости белков составляет в среднем 84,5%, жиров —94%, углеводов (сумма усвояемых и неусвояемых углеводов) — 95,6 %. Эти коэффициенты используют при расчетах питательной ценности отдельных блюд и всего рациона.
Энергетическую ценность (ЭЦ) пищевого продукта с учетом коэффициентов усвоения пищевых веществ рассчитывают по формуле:
ЭЦ = 0,845Б4,0 + 0,94Ж9,0 + 0,956У4,0 + ОК3,0,
При
необходимости получения результатов
в кДж общее количество ккал умножается
на коэффициент 4,184. ЭЦ выражается в целых
единицах.
ЭЦ выражается в целых
единицах.
Пример 4.1. Рассчитать энергетическую ценность для хлеба орловского формового.
Из таблиц химического состава выписываем содержание белков, жиров, усвояемых углеводов и органических кислот в г на 100г продукта.
Содержание белка – 6,1г в 100г продукта, жира – 1,1г в 100г продукта, усвояемых углеводов 40,6г в 100г продукта и органических кислот -0,8г в 100г продукта.
ЭЦ = 0,8456,14,0 +0,941,19,0 + 0,95640,64,0 + 0,83,0 = 187,58 ккал
Пример 4.2. Рассчитать энергетическую ценность халвы тахинной.
Из таблиц химического состава выписываем содержание белков, жиров, усвояемых углеводов и органических кислот в г на 100г продукта.
Содержание белка – 12,7г в 100г продукта, жира – 29,9г в 100г продукта, усвояемых углеводов 50,9г в 100г продукта, органических кислот — нет
ЭЦ = 0,84512,74,0 +0,9429,99,0 + 0,95650,94,0 + 03,0 = 490,52 ккал
Пример
4. 3. Рассчитать энергетическую ценность
для макаронных изделий высшего сорта
«мозаика» Из таблиц химического состава
выписываем содержание белков, жиров,
усвояемых углеводов и органических
кислот в г на 100г продукта.
3. Рассчитать энергетическую ценность
для макаронных изделий высшего сорта
«мозаика» Из таблиц химического состава
выписываем содержание белков, жиров,
усвояемых углеводов и органических
кислот в г на 100г продукта.
Содержание белка – 11,2г в 100г продукта, жира – 1,1г в 100г продукта, усвояемых углеводов 68,9г — в 100г продукта и органических кислот — нет.
ЭЦ = 0,84511,24,0 +0,941,19,0 + 0,9568,94,0 + 03,0 = 309 ккал
(название продукта)
Содержание основных пищевых веществ приведено в таблице 1.
ЭЦ = 0,845… 4,0 + 0,94… 9,0 + 0,956…4,0 + … 3,0 = ккал
Полученные
данные сводим в таблицу 10.
Таблица 10 — Проведение расчетов и сравнение энергетической ценности пищевых продуктов
№ п/п | Наименование пищевого продукта | Основные пищевые вещества, г на 100 г продукта | Энергетическая ценность, ккал | ||||
Белки | Жиры | Орган. кислоты | Углеводы | ||||
крахмал и декстрины | Моно- и дисахариды | ||||||
1 | |||||||
2 | |||||||
3 | |||||||
4 | |||||||
5 | |||||||
Вывод: _________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Gibbs (бесплатно) Энергия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1951
Цели обучения
- Получить общее представление об энергии Гиббса и ее общем использовании в химии.

- Понять, как энергия Гиббса относится к свойствам реакций
- Понять, как энергия Гиббса относится к свойствам равновесия
- Понять, как энергия Гиббса относится к электрохимическим свойствам
Свободная энергия Гиббса, обозначаемая \(G\), объединяет энтальпию и энтропию в одно значение. Изменение свободной энергии \(\Delta G\) равно сумме энтальпии плюс произведение температуры и энтропии системы. \( \Delta G\) может предсказать направление химической реакции при двух условиях:
- постоянная температура и
- постоянное давление.
Если \(ΔG\) положительное, то реакция несамопроизвольная (т.е. для протекания реакции необходим подвод внешней энергии), а если отрицательное, то самопроизвольная (происходит без подвода внешней энергии) .
Введение
Энергия Гиббса была разработана в 1870-х годах Джозией Уиллардом Гиббсом. Первоначально он назвал эту энергию «доступной энергией» в системе. В опубликованной в 1873 году статье «Графические методы в термодинамике жидкостей» изложено, как его уравнение может предсказывать поведение систем при их объединении. Эта величина представляет собой энергию, связанную с химической реакцией, которая может быть использована для совершения работы, и представляет собой сумму ее энтальпии (H) и произведения температуры и энтропии (S) системы. Это количество определяется следующим образом: 93\))
В опубликованной в 1873 году статье «Графические методы в термодинамике жидкостей» изложено, как его уравнение может предсказывать поведение систем при их объединении. Эта величина представляет собой энергию, связанную с химической реакцией, которая может быть использована для совершения работы, и представляет собой сумму ее энтальпии (H) и произведения температуры и энтропии (S) системы. Это количество определяется следующим образом: 93\))
Энергия Гиббса в реакциях
Спонтанная — это реакция, которая считается естественной, потому что это реакция, которая происходит сама по себе без какого-либо внешнего воздействия на нее. Несамопроизвольный — требует постоянной внешней энергии, чтобы процесс продолжался, и как только вы остановите внешнее действие, процесс прекратится. При решении уравнения, если изменение G отрицательно, то оно спонтанное.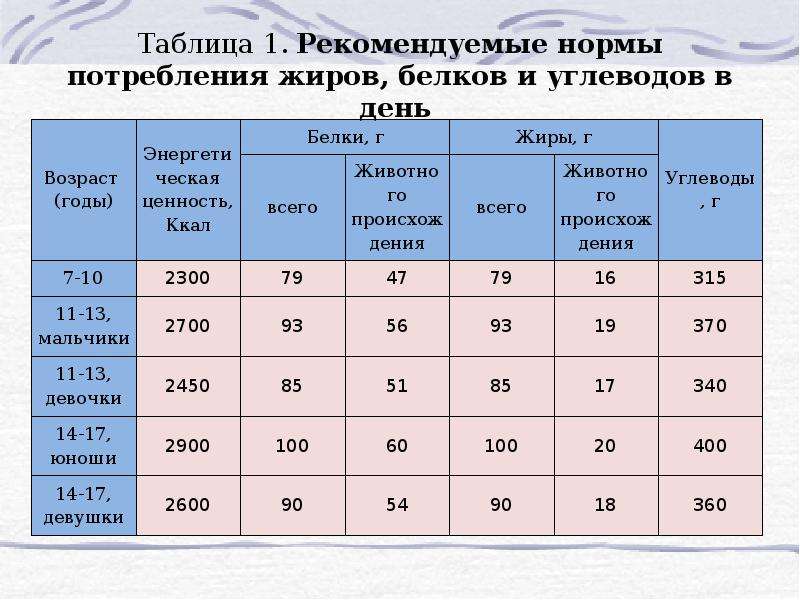 Если изменение G положительное, то оно несамопроизвольное. Символ, который обычно используется для обозначения СВОБОДНОЙ ЭНЕРГИИ, — это G. Его можно более правильно рассматривать как «стандартное изменение свободной энергии» 9.0038
Если изменение G положительное, то оно несамопроизвольное. Символ, который обычно используется для обозначения СВОБОДНОЙ ЭНЕРГИИ, — это G. Его можно более правильно рассматривать как «стандартное изменение свободной энергии» 9.0038
В химических реакциях, связанных с изменением термодинамических величин, часто встречается вариант этого уравнения:
\[ \underset{\text {изменение свободной энергии} }{\Delta G } = \underset{ \text {change в энтальпии}}{ \Delta H } — \underset{\text {(температура) изменение энтропии}}{T \Delta S} \label{1.3} \]
Пример 1.1
Рассчитайте ∆G при 290 K для следующая реакция:
\[\ce{2NO(г) + O2(г) \rightarrow 2NO2(г)} \nonumber \]
Дано
- ∆H = -120 кДж
- ∆S = -150 ДжК -1
Решение
Теперь все, что вам нужно сделать, это подставить все указанные числа в уравнение 3 выше. Не забудьте разделить \(\Дельта S\) на 1000 \(Дж/кДж\), так что после умножения на температуру \(Т\) она будет иметь те же единицы \(кДж\), что и \(\ Дельта Н\).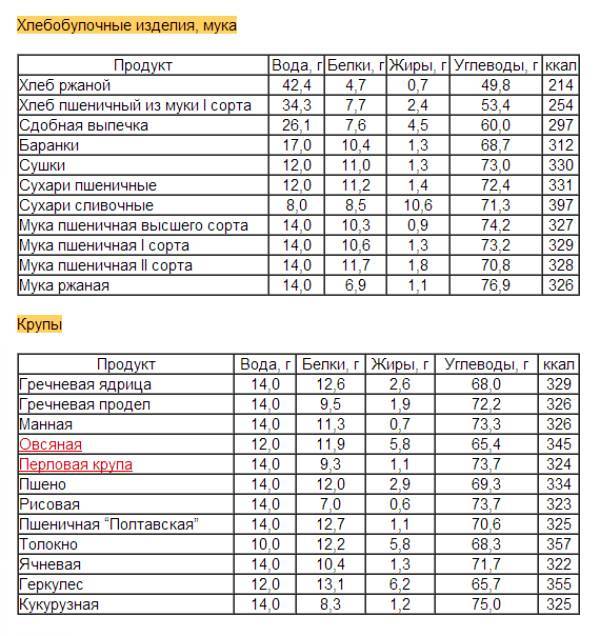
\[\Delta S = -150 \cancel{J}/K \left( \dfrac{1\; kJ}{1000\;\cancel{J}} \right) = -0,15\; кДж/К \номер\]
и подставляя в уравнение 3:
\[\begin{align*} ∆G &= -120\; кДж — (290 \;\cancel{K})(-0,150\; кДж/\cancel{K}) \\[4pt] &= -120 \;kJ + 43 \;kJ \\[4pt] &= — 77\; kJ \end{align*} \]
Упражнение 1.1: Процесс Габера
Какова \(\Delta G\) образование аммиака из газообразного азота и водорода.
\[\ce{N_2 + 3H_2 \rightleftharpoons 2NH_3} \nonumber \]
Стандартные образования свободной энергии: NH 3 =-16,45 H 2 =0 N 2 =0 90 038 9{-1} \номер \]
Поскольку изменение энтропии химической реакции не поддается прямому измерению, энтропия обычно не используется в качестве критерия. Чтобы обойти эту трудность, мы можем использовать \(G\). Знак ΔG указывает направление химической реакции и определяет, является ли реакция самопроизвольной или нет.
- \( \Delta G < 0 \): реакция идет самопроизвольно в указанном направлении (т.
 е. реакция экзэргоническая )
е. реакция экзэргоническая ) - \( \Delta G =0 \): система находится в равновесии и нет чистых изменений ни в прямом, ни в обратном направлении.
- \( \Delta G > 0 \): реакция не самопроизвольная и процесс протекает самопроизвольно в резервном направлении. Чтобы запустить такую реакцию, нам нужно иметь свободную энергию (т.е. реакция эндергоническая )
Факторы, влияющие на \( \Delta G \) реакции (предположим, что \( \Delta H \) и \( \Delta S \) не зависят от температуры):
| \(\Delta H\) | \(\Дельта S\) | \(\Дельта G\) | Пример |
|---|---|---|---|
| + | + | при низкой температуре: + , при высокой температуре: — | 2HgO(тв) -> 2Hg (ж) + O 2 (г) |
| + | — | при всех температурах: + | 3O 2 (г) -> 2O 3 (г) |
| — | + | при всех температурах: — | 2H 2 O 2 (л) -> 2H 2 O (л) + O 2 (г) |
| — | — | при низкой температуре: — , при высокой температуре: + | NH 3 (г) + HCl (г) -> NH 4 Cl (т) |
Примечание:
- \( \Delta G \) зависит только от разности свободных энергий продуктов и реагентов (или конечного состояния и начального состояния).
 \( \Delta G \) не зависит от пути превращения и не зависит от механизма реакции. 9o \label{1.7} \]
\( \Delta G \) не зависит от пути превращения и не зависит от механизма реакции. 9o \label{1.7} \]Примечание
- Если \( \left | \Delta H \right | >> \left | T\Delta S \right |\): реакция энтальпийная
- Если \( \Delta H \) << \( T\Delta S \): реакция управляется энтропией
Свободная энергия образования при стандартном состоянии
- Парциальное давление любого газа, участвующего в реакции, составляет 0,1 МПа.
- Концентрация всех водных растворов составляет 1 М. 9оС\). Будет ли реакция происходить самопроизвольно?
\[NH_{3(g)} + HCl_{(g)} \rightarrow NH_4Cl_{(s)} \nonumber \]
дано для реакции
- \(\Delta{H} = -176.0 \ ;кДж\)
- \(\Дельта{S} = -284,8\;Дж/К\)
Решение
вычислить \(\Delta{G}\) по формуле
\[\Delta{G} = \Delta{H} — T\Delta{S} \nonumber \]
но сначала нам нужно для преобразования единиц измерения \(\Delta{S}\) в кДж/К (или преобразования \(\Delta{H}\) в Дж) и температуры в Кельвин 9оС = 298\;К\)
Определение энергии Гиббса может быть использовано напрямую \;kJ — (298 \cancel{K}) (-0,284,8\; kJ/\cancel{K}) \nonumber \]
\[\Delta{G} = -176,0 \;kJ — (-84,9 \; кДж) \номер \]
\[\Delta{G} = -91,1 \;кДж \номер \]
Да, эта реакция протекает самопроизвольно при комнатной температуре, так как \(\Delta{G}\) отрицательна .
Энергия Гиббса в равновесии 9o \label{1.25} \]
Несколько замечаний о «свободной» энергии Гиббса
- Свободная энергия не обязательно является «свободной» : Название «свободная энергия» для G привело к такой путанице, что многие ученые теперь будем называть ее просто энергией Гиббса. «Свободная» часть старого названия отражает происхождение термодинамики от паровой машины с ее интересом к преобразованию тепла в работу: ΔG — это максимальное количество энергии, которое может быть «высвобождено» из системы для выполнения полезной работы. Под «полезной» мы подразумеваем работу, отличную от той, которая связана с расширением системы. Чаще всего это электрическая работа (перемещение электрического заряда через разность потенциалов), но возможны и другие формы работы (осмотическая работа, увеличение площади поверхности).
- Свободная энергия не является энергией : Гораздо более серьезная трудность с функцией Гиббса, особенно в контексте химии, заключается в том, что, хотя G имеет единицы измерения энергии (джоули, или в его интенсивной форме, Дж моль –1 ), ему не хватает одного из самых важных атрибутов энергии, заключающегося в том, что он не сохраняется.
 Таким образом, хотя свободная энергия всегда падает при расширении газа или при самопроизвольном протекании химической реакции, нет необходимости в компенсирующем увеличении энергии где-либо еще. Ссылка на G как на энергию также подкрепляет ложное, но широко распространенное представление о том, что любое изменение должно сопровождаться падением энергии. Но если принять, что энергия сохраняется, становится очевидным, что единственным необходимым условием изменения (будь то падение груза, расширение газа или химическая реакция) является перераспределение энергии. Величина –ΔG, связанная с Процесс представляет собой количество энергии, которая «разделяется и распределяется», что, как мы уже объяснили, является значением увеличения энтропии. Фактор -ΔG/T фактически идентичен ΔStotal, изменению энтропии мира, увеличение которого является первичным критерием любого изменения.
Таким образом, хотя свободная энергия всегда падает при расширении газа или при самопроизвольном протекании химической реакции, нет необходимости в компенсирующем увеличении энергии где-либо еще. Ссылка на G как на энергию также подкрепляет ложное, но широко распространенное представление о том, что любое изменение должно сопровождаться падением энергии. Но если принять, что энергия сохраняется, становится очевидным, что единственным необходимым условием изменения (будь то падение груза, расширение газа или химическая реакция) является перераспределение энергии. Величина –ΔG, связанная с Процесс представляет собой количество энергии, которая «разделяется и распределяется», что, как мы уже объяснили, является значением увеличения энтропии. Фактор -ΔG/T фактически идентичен ΔStotal, изменению энтропии мира, увеличение которого является первичным критерием любого изменения. - Свободная энергия даже не «реальна» : G отличается от термодинамических величин H и S еще одним существенным образом: она не имеет физической реальности как свойство материи, тогда как H и S могут быть связаны с количеством и распределением энергии в совокупности молекул (например, третий закон термодинамики).
 Свободная энергия — это просто полезная конструкция, которая служит критерием изменения и упрощает расчеты.
Свободная энергия — это просто полезная конструкция, которая служит критерием изменения и упрощает расчеты.
Ссылки
- Чанг, Рэймонд. Физическая химия для биологических наук . Сансалито, Калифорния: Университетские науки, 2005. .
- Аткинс, Питер и де Паула, Хулио. Физическая химия для наук о жизни . Нью-Йорк, штат Нью-Йорк: WH Freeman and Company, 2006. Стр. 153–163, 286. .
- Страйер, Люберт. Биохимия (третье издание) . Нью-Йорк, штат Нью-Йорк: WH Фриман и компания, 1988. стр. 181-184.
Gibbs (Free) Energy распространяется в соответствии с лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Стивен Лоуэр, Кэти Доан, Хан Ле и Хан Ле.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- автор @ Кэти Доан
- автор @ Хан Ле
- автор @ Стивен Лоуэр
- Энергия Гиббса
- Свободная энергия Гиббса
Объяснение единиц энергии и калькуляторов
- Бочки или галлоны для жидких нефтяных топлив (таких как бензин, дизельное топливо и топливо для реактивных двигателей) и биотоплива (этанол и биодизель)
- Кубические футы для природного газа
- Тонны угля (короткая тонна равна 2000 фунтов; метрическая тонна равна примерно 2205 фунтам)
- Киловатт-часы электроэнергии
Чтобы сравнить виды топлива друг с другом, нам необходимо привести их измерения к одним и тем же единицам измерения.

ты знал
?
Баррель — это единица объема или веса, которая различается в зависимости от того, кто использует этот термин и что он содержит.
- 1 баррель (б) сырой нефти или нефтепродуктов = 42 галлона США
- 1 баррель портландцемента = 376 фунтов
- 1 баррель муки = 196 фунтов
- 1 баррель свинины или рыбы = 200 фунтов
- 1 баррель сухого вещества (США) = 3,29122 бушеля или 4,2104 кубических фута
- Бочка может называться бочкой , но обычно бочка вмещает 55 галлонов.
- Бочка достаточно большая, чтобы перебросить человека через Ниагарский водопад.
Единицы для сравнения энергии
Некоторые популярные единицы для сравнения энергии включают британские тепловые единицы (БТЕ), баррели нефтяного эквивалента, метрические тонны нефтяного эквивалента, метрические тонны угольного эквивалента и тераджоули.
В Соединенных Штатах БТЕ, мера тепловой энергии, является наиболее распространенной единицей для сравнения источников энергии или топлива.
 Поскольку энергия, используемая в разных странах, поступает из разных мест, содержание БТЕ в топливе незначительно варьируется от страны к стране.
Поскольку энергия, используемая в разных странах, поступает из разных мест, содержание БТЕ в топливе незначительно варьируется от страны к стране.Содержание БТЕ каждого вида топлива, указанного ниже (за исключением сырой нефти), представляет собой среднее теплосодержание топлива, потребляемого в Соединенных Штатах.
Содержание БТЕ в обычных энергетических единицах (предварительные оценки на 2022 год 1 )
- 1 баррель (42 галлона) сырой нефти, добываемой в США = 5 684 000 БТЕ
- 1 галлон готового автомобильного бензина (содержащего около 10% топливного этанола по объему) = 120 214 БТЕ
- 1 галлон дизельного топлива или мазута (с содержанием серы менее 15 частей на миллион) = 137 381 БТЕ
- 1 галлон мазута (с содержанием серы от 15 до 500 частей на миллион) = 138 500 БТЕ
- 1 баррель мазута = 6 287 000 БТЕ
- 1 кубический фут природного газа = 1036 БТЕ
- 1 галлон пропана = 91 452 БТЕ
- 1 короткая тонна (2000 фунтов) угля (потребляемого электроэнергетическим сектором) = 18 820 000 БТЕ
- 1 киловатт-час электроэнергии = 3412 БТЕ
Примеры преобразования источников энергии в различных физических единицах в БТЕ
Пример 1:
В вашем доме есть газовая печь, в которой прошлой зимой для отопления использовалось 67 000 кубических футов природного газа.
 У вашего соседа такой же дом, но с топкой на мазуте, которая прошлой зимой израсходовала 500 галлонов мазута. Вы можете преобразовать данные о потреблении природного газа и мазута в БТЕ, чтобы определить, какой дом использует больше энергии для отопления.
У вашего соседа такой же дом, но с топкой на мазуте, которая прошлой зимой израсходовала 500 галлонов мазута. Вы можете преобразовать данные о потреблении природного газа и мазута в БТЕ, чтобы определить, какой дом использует больше энергии для отопления.- 67 000 кубических футов (ваш дом)
- х
- 1036 БТЕ на кубический фут
- =
- 69 412 000 БТЕ
- 500 галлонов (дом соседа)
- х
- 137 381 БТЕ на галлон
- =
- 68 690 476 БТЕ
Результат: Вы использовали больше энергии для обогрева дома. (Обратите внимание, что на количество энергии, фактически используемой домохозяйством для отопления, влияет множество факторов, а теплосодержание топлива может различаться в зависимости от местоположения и поставщика.)
Пример 2:
Вы и ваш сосед хотите сравнить цену на топлива для отопления ваших домов на равных условиях. Вы можете сравнить средние цены на топливо за зиму (с октября по март) в долларах за миллион БТЕ, разделив средние месячные зимние цены на природный газ и мазут на единицу топлива на содержание БТЕ в топливе.


