Инсулинорезистентность: ее роль в патогенезе сахарного диабета 2 типа и возможности коррекции | #05/05
Инсулинорезистентность — это состояние, сопровождающееся снижением чувствительности периферических тканей к биологическому действию инсулина и встречающееся не только при сахарном диабете (СД) 2 типа, но и при других заболеваниях, сопровождающихся нарушениями обмена веществ.
На чувствительность тканей к инсулину влияют различные факторы, в том числе возраст, наличие избыточной массы тела и особенно распределение жировой ткани, показатели артериального давления, наличие гипертензии, дислипидемии, общее физическое состояние и тренированность организма, курение, ишемическая болезнь сердца и, наконец, семейный анамнез по диабету.
Состояния, сопровождающиеся инсулиновой резистентностью
Физиологическая инсулинорезистентность: пубертат; беременность; ночной сон; диета, богатая жиром.
Метаболическая инсулинорезистентность: диабет 2 типа; декомпенсация диабета 1 типа; диабетический кетоацидоз; ожирение; выраженная недостаточность питания; гиперурикемия; инсулинвызванная гипогликемия; избыточный прием алкоголя.
Эндокринная инсулинорезистентность: тиреотоксикоз; гипотиреоз; синдром Кушинга; акромегалия; феохромоцитома.
Неэндокринная инсулинорезистентность: эссенциальная гипертензия; хроническая почечная недостаточность, цирроз печени; ревматоидный артрит; acanthosis nigricans, раковая кахексия; сердечная недостаточность; миотоническая дистрофия; травма, ожоги, сепсис, хирургические вмешательства.
Инсулинорезистентность встречается более чем в 25% случаев у практически здоровых лиц без ожирения, причем степень ее выраженности в этом случае сопоставима с показателями инсулинорезистентности у больных СД 2 типа.
Причины инсулинорезистентности при СД 2 типа гетерогенны. В ее развитии четко прослеживается наличие двух компонентов: генетического и приобретенного. Так, родственники первой степени родства с нарушенной и даже с нормальной толерантностью к глюкозе имеют выраженную инсулинорезистентность по сравнению с лицами контрольной группы.
Несмотря на то что к инсулиновой резистентности имеется четкая генетическая предрасположенность, до сих пор не идентифицированы точные генетические нарушения, лежащие в основе ее развития. Это свидетельствует о полигенном характере инсулиновой резистентности. При генетическом обследовании больных, имеющих СД, дислипидемию, гипертензию, которые, как известно, являются компонентами синдрома инсулиновой резистентности, были идентифицированы несколько точечных мутаций в гене рецептора к лептину, в гене субстрата инсулинового рецептора-1 (СИР-1) и PPAR (peroxisome proliferator-activated receptor γ) (G. S. Barsh и соавт., 2000).
Механизмы развития инсулиновой резистентности при СД 2 типа также гетерогенны. Одной из причин появления вторичной инсулинорезистентности является глюкозотоксичность или глюкозовызванная инсулиновая резистентность, т. е. состояние длительной гипергликемии, приводящее к снижению биологического действия инсулина. При СД 1 типа инсулинорезистентность развивается как следствие плохого контроля сахарного диабета, а улучшение компенсации углеводного обмена у этих больных сопровождается выраженным повышением чувствительности к инсулину, что, в свою очередь, требует коррекции суточных доз инсулина, применяемых у больных после достижения хорошей компенсации диабета. Инсулинорезистентность у больных СД 1 типа в большей степени проявляется в мышечных тканях, носит обратимый характер и имеет прямую корреляцию с содержанием гликогемоглобина в крови. У больных СД 2 типа инсулинорезистентность больше зависит от наследственного компонента, и хотя степень ее выраженности также уменьшается при достижении компенсации углеводного обмена, но в значительно меньшей степени по сравнению с показателями, отмечающимися у пациентов с СД 1 типа.
е. состояние длительной гипергликемии, приводящее к снижению биологического действия инсулина. При СД 1 типа инсулинорезистентность развивается как следствие плохого контроля сахарного диабета, а улучшение компенсации углеводного обмена у этих больных сопровождается выраженным повышением чувствительности к инсулину, что, в свою очередь, требует коррекции суточных доз инсулина, применяемых у больных после достижения хорошей компенсации диабета. Инсулинорезистентность у больных СД 1 типа в большей степени проявляется в мышечных тканях, носит обратимый характер и имеет прямую корреляцию с содержанием гликогемоглобина в крови. У больных СД 2 типа инсулинорезистентность больше зависит от наследственного компонента, и хотя степень ее выраженности также уменьшается при достижении компенсации углеводного обмена, но в значительно меньшей степени по сравнению с показателями, отмечающимися у пациентов с СД 1 типа.
Инсулинорезистентность сопровождается снижением инсулинстимулированного транспорта глюкозы в жировую и мышечную ткани, что было достаточно убедительно показано в исследованиях in vitro (культура фибробластов, преадипоцитов или интактных мышечных клеток). W. T. Garvey и соавт. (1988) первыми отметили синергетическое влияние инсулина и глюкозы в механизмах десенситизации глюкозотранспортной системы в культуре адипоцитов, что позволило им сформулировать новую концепцию инсулинорезистентности. Нарушение гена гликогенсинтазы и ее киназ сопровождается инсулиновой резистентностью. Синтез гликогена в мышцах представлен на
W. T. Garvey и соавт. (1988) первыми отметили синергетическое влияние инсулина и глюкозы в механизмах десенситизации глюкозотранспортной системы в культуре адипоцитов, что позволило им сформулировать новую концепцию инсулинорезистентности. Нарушение гена гликогенсинтазы и ее киназ сопровождается инсулиновой резистентностью. Синтез гликогена в мышцах представлен на
В ходе изучения состояния транспортной системы, осуществляющей поступление глюкозы в клетку, S. Marshall и соавт. (1992) выявили, что для десенситизации глюкозной транспортной системы в клетках жировой ткани, инкубированных при высоких концентрациях глюкозы и инсулина, необходим хотя бы в минимальных количествах обмен глюкозы/фосфатов и гексоз. При этом удалось установить, что инсулин осуществляет пермиссивную функцию в глюкозовызванной десентизации и этот эффект не зависит от комплексирования инсулина с рецептором.
Глюкоза, проникшая с помощью глюкозных транспортеров (в основном GLUT-4) внутрь клетки, благодаря участию фермента гексокиназы превращается в глюкозо-6-фосфат, который, в свою очередь, используется: а) для образования гликогена, б) в системе гликолиза (около 95–97%), в) в пентозофосфатном шунте и г) лишь 2–3% — в глюкозаминовом шунте. При гипергликемии, вследствие повышенного поступления глюкозы внутрь клетки, увеличивается включение углеродов глюкозы в фруктозо-6-фосфат или уменьшается доступ глюкозы в систему гликолиза и образования гликогена. Механизм, с помощью которого гипергликемия снижает скорость поступления глюкозы в клетку под влиянием инсулина, называется гексозаминовым шунтом. Увеличение внутриклеточного количества продуктов гексозаминового шунта (гексозфосфатов) по принципу обратной связи регулирует механизмы поглощения глюкозы клеткой, снижая его, что и наблюдается при инсулинрезистентных состояниях.
Свободные жирные кислоты (СЖК) оказывают ингибирующее влияние на окисление глюкозы (цикл Рэндла) и участвуют в поддержании и усилении состояния инсулинорезистентности (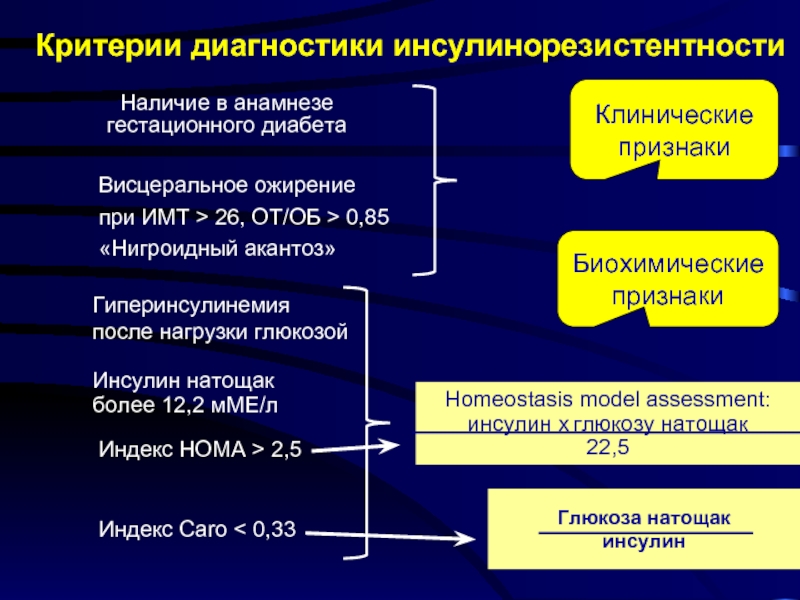 2). Однако, как показали исследования последних лет, неэстерифицированные жирные кислоты (НЭЖК) необходимы для нормальной глюкозостимулированной секреции инсулина. Эффективное и быстрое снижение НЭЖК в крови у здоровых и больных диабетом людей, в свою очередь, влияет на уменьшение базального уровня секреции инсулина (G. Boden, 1999).
2). Однако, как показали исследования последних лет, неэстерифицированные жирные кислоты (НЭЖК) необходимы для нормальной глюкозостимулированной секреции инсулина. Эффективное и быстрое снижение НЭЖК в крови у здоровых и больных диабетом людей, в свою очередь, влияет на уменьшение базального уровня секреции инсулина (G. Boden, 1999).
В эксперименте на модели «ожирелых» диабетических крыс (Zucker diabetic fatty rat) было показано, что значительное повышение в плазме крови концентрации НЭЖК и триглицеридов в предиабетический период сочетается с резким увеличением содержания триглицеридов в островках поджелудочной железы. Это ингибирующее влияние повышенной концентрации липидов на функцию β-клеток поджелудочной железы получило название липотоксичности.
Механизмы развития инсулиновой резистентности при нарушении жирового обмена (повышение НЭЖК или СЖК) у больных СД 2 типа представлены на рис. 3.
Полученные в последние годы данные позволили внести некоторые коррективы в гипотезу о механизмах, участвующих в развитии инсулиновой резистентности под влиянием повышенного уровня СЖК в крови (рис. 2).
2).
При СД 2 типа отмечаются как снижение количества и аффинности рецепторов к инсулину, так и нарушение инсулино-рецепторного взаимодействия, что сопровождается усилением клинических проявлений инсулинорезистентности и восстановлением этих показателей почти до нормы при снижении массы тела. Помимо рецепторных, имеется значительное число пострецепторных механизмов, участвующих как в генезе инсулинорезистентности, так и в процессах, приводящих к развитию диабета. Инициация передачи гормонального сигнала инсулина начинается с фосфорилирования β-субъединицы инсулинового рецептора, которое осуществляется при помощи тирозинкиназы. Это фосфорилирование, а затем и аутофосфорилирование рецептора инсулина необходимы для реализации последующих этапов пострецепторного действия инсулина, и в частности для активирования и транслокации глюкозных транспортеров (GLUT), наиболее важным из которых является GLUT-4. Экспрессия этого транспортера имеет место только в скелетных мышцах, мышцах сердца и жировой ткани.
Учитывая значимость инсулиновой резистентности в патогенезе сахарного диабета, становится понятна необходимость применения для лечения СД 2 типа препаратов, влияющих в первую очередь на снижение инсулиновой резистентности. Проводимые в течение последних почти 20 лет исследования по созданию таких препаратов завершились успехом, и в настоящее время в клинической практике появились лекарственные средства, объединенные по механизму их действия в группу сенситайзеров инсулина (глитазоны, или тиазолидиндионы).
Они усиливают действие инсулина в мышцах скелета, жировой ткани и в печени. К препаратам этой группы относятся роcиглитазон и пиоглитазон. Механим их действия заключается в способности взаимодействовать с определенным недавно идентифицированным классом ядерных рецепторов PPARγ, играющим основную роль в регуляции дифференцировки адипоцитов и обмена липидов. Оставаясь центральным регулятором адипогенеза, PPARγ осуществляет дифференцировку преадипоцитов в адипоциты. Эту координирующую роль он выполняет в тесной кооперации с другими факторами транскрипции (R. Walczak и P. Tontonoz, 2002). Модулируя инсулиновую чувствительность периферических тканей к инсулину, глитазоны участвуют также в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (ФНО-a, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), что влияет на снижение скорости развития сосудистых осложнений диабета, вплоть до возможности их обратного развития.
Оставаясь центральным регулятором адипогенеза, PPARγ осуществляет дифференцировку преадипоцитов в адипоциты. Эту координирующую роль он выполняет в тесной кооперации с другими факторами транскрипции (R. Walczak и P. Tontonoz, 2002). Модулируя инсулиновую чувствительность периферических тканей к инсулину, глитазоны участвуют также в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (ФНО-a, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), что влияет на снижение скорости развития сосудистых осложнений диабета, вплоть до возможности их обратного развития.
Клиническое применение тиазолидиндионов показывает, что одним из побочных эффектов указанных препаратов является увеличение у пациентов и без того высокой массы тела. Однако на основании специально проведенных исследований можно сделать вывод, что увеличение массы тела при применении этих лекарственных средств происходит за счет подкожного, а не висцерального депо жировой ткани, количество которого имеет статистически высокодостоверное влияние на степень выраженности инсулиновой резистентности и развития сердечно-сосудистых осложнений.
Доказано, что умеренное увеличение массы тела, наблюдаемое у больных СД 2 типа, находящихся на терапии глитазонами, происходит за счет подкожного жирового депо. Так, D. E. Kelley и соавт. (2002) установили, что на фоне приема роcиглитазона при умеренном увеличении массы тела отмечается уменьшение на 10% количества висцерального депо жира, что снижает риск развития сердечно-сосудистых заболеваний.
Тиазолидиндионы (сенситайзеры, или глитазоны) являются высокоаффинными агонистами PPARγ и повышают чувствительность тканей к инсулину, что сопровождалось снижением уровня глюкозы, липидов и инсулина в сыворотке крови как в экспериментах на животных с диабетом, так и у больных СД 2 типа.
Содержание PPARγ в жировой ткани в 10–100 раз выше, чем в других тканях-мишенях для инсулина (мышцы и печень). Под влиянием глитазонов четко отмечается увеличение экспрессии PPARγ, поэтому и в других (нежировых) тканях организма значительно снижается резистентность к инсулину.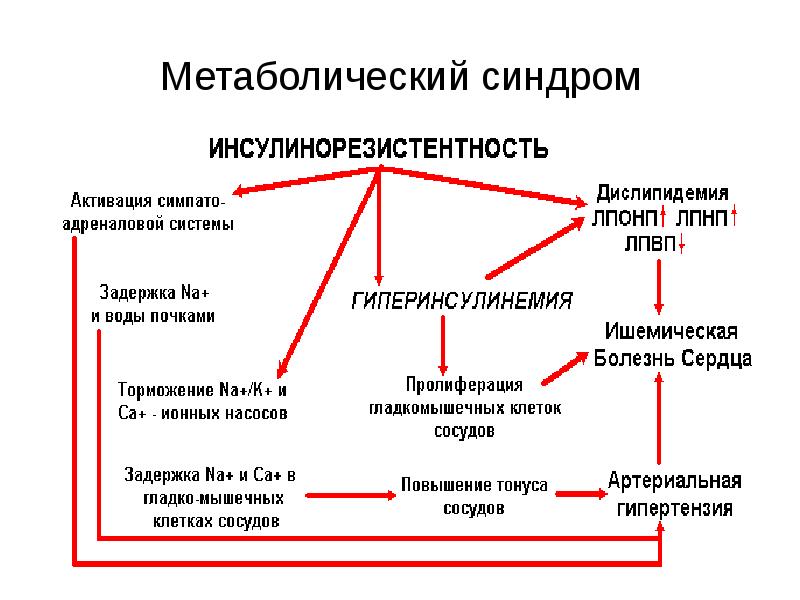 Имеются данные о непосредственном влиянии глитазонов и на другие гены, участвующие в гомеостазе углеводов в организме; так, глитазоны усиливают экспрессию гена GLUT-4, основного транспортера глюкозы в мышечной и жировой ткани. Агонисты PPARγ, в том числе роcиглитазон (авандиа) и пиоглитазон (актос), увеличивая дифференцировку адипоцитов в жировой ткани, изменяют соотношение мелких и крупных адипоцитов в сторону преобладания первых, которые, в свою очередь, имеют более высокую чувствительность к инсулину по сравнению с крупными адипоцитами.
Имеются данные о непосредственном влиянии глитазонов и на другие гены, участвующие в гомеостазе углеводов в организме; так, глитазоны усиливают экспрессию гена GLUT-4, основного транспортера глюкозы в мышечной и жировой ткани. Агонисты PPARγ, в том числе роcиглитазон (авандиа) и пиоглитазон (актос), увеличивая дифференцировку адипоцитов в жировой ткани, изменяют соотношение мелких и крупных адипоцитов в сторону преобладания первых, которые, в свою очередь, имеют более высокую чувствительность к инсулину по сравнению с крупными адипоцитами.
Глитазоны, повышая чувствительность тканей к инсулину, способствуют усилению утилизации глюкозы периферическими тканями, что проявляется компенсацией углеводного обмена у больных СД 2 типа.
В США тиазолидиндионы в качестве антидиабетических препаратов применяются с 1997 г. и представлены тремя препаратами из этой группы — троглитазон (с 1997 г.), роcиглитазон и пиоглитазон (с мая и июля 1999 г. соответственно).
Троглитазон — первый препарат этой группы — синтезирован в 1983 г., обладает рядом свойств как тиазолидиндиона, так и витамина Е. С 1997 г. препарат применялся для лечения больных диабетом 2 типа в США, но вследствие гепатотоксичности с марта 2000 г., по решению Комиссии по лекарствам и питанию (FDA), в США троглитазон был изъят из списка лекарственных веществ, рекомендованных для применения в клинической практике.
Тщательный анализ всех случаев развития нарушения функции печени на фоне приема троглитазона показал, что более часто такие побочные явления развивались у тех больных, у которых до начала терапии отмечалось повышение активности аланинаминотрансферазы (АЛТ) в 3 раза выше верхней границы нормальных значений. В противопоказаниях к лечению глитазонами указано, что терапию можно проводить тем пациентам, у которых до начала лечения уровень АЛТ в сыворотке не превышает в 2, 5 раз верхнюю границу нормы. В период лечения глитазонами необходимо осуществлять мониторинг содержания АЛТ в сыворотке крови не реже 1 определения в квартал.
Клиническое применение пиоглитазона показало значительную его эффективность в терапии больных, страдающих СД 2 типа. В ходе многоцентрового двойного слепого плацебоконтролируемого исследования (M. Brockley и R. L. Schneider, 2000) удалось показать, что применение пиоглитазона в разовой дозе 15 и 30 мг в день в качестве монотерапии сопровождалось улучшением клинических проявлений у больных СД 2 типа и достоверным снижением у них уровней гликемии и гликогемоглобина.
В ходе другого двойного слепого исследования (S. Shaffer и соавт., 2000) изучалось влияние различных доз пиоглитазона (7,5; 15; 30 и 45 мг) на компенсацию СД 2 типа. Было установлено, что терапия пиоглитазоном хорошо переносится больными, а снижение уровня гликемии и НbА1с статистически достоверно и зависит от дозы препарата. Отмечались хорошая переносимость препарата и отсутствие каких-либо признаков гепатотоксичности.
Сравнительное изучение сахароснижающего действия пиоглитазона и акарбозы, проведенное B. Gora (2000) у 118 больных СД 2 типа, показало, что у пациентов, получающих пиоглитазон, уровень гликогемоглобина в крови снизился на 1,1%, уровень глюкозы в крови натощак — на 2,7 ммоль/л, инсулина — на 9 мкЕД/мл, тогда как у пациентов, получавших лечение акарбозой, перечисленные показатели уменьшились лишь на 0,3% и 1,2 ммоль/л соответственно, а содержание инсулина в крови даже повысилось на 1,5 мкЕД/мл. Одновременно отмечено снижение содержания триглицеридов и липопротеидов низкой плотности (ЛПНП) у больных, получавших лечение пиоглитазоном, тогда как при приеме акарбозы эти показатели оставались неизменными или даже были выше, чем до проводимой терапии.
Gora (2000) у 118 больных СД 2 типа, показало, что у пациентов, получающих пиоглитазон, уровень гликогемоглобина в крови снизился на 1,1%, уровень глюкозы в крови натощак — на 2,7 ммоль/л, инсулина — на 9 мкЕД/мл, тогда как у пациентов, получавших лечение акарбозой, перечисленные показатели уменьшились лишь на 0,3% и 1,2 ммоль/л соответственно, а содержание инсулина в крови даже повысилось на 1,5 мкЕД/мл. Одновременно отмечено снижение содержания триглицеридов и липопротеидов низкой плотности (ЛПНП) у больных, получавших лечение пиоглитазоном, тогда как при приеме акарбозы эти показатели оставались неизменными или даже были выше, чем до проводимой терапии.
Убедительные данные, полученные D. Einhorn и соавт. (2000), свидетельствуют о синергетическом влиянии пиоглитазона и метформина на состояние углеводного, липидного обмена. У 328 больных, получавших терапию пиоглитазона (30 мг) с метформином, наблюдалось статистически достоверное снижение HbA1c и гликемии натощак по сравнению с группой больных, получавших плацебо + метформин. В другом исследовании, проведенном этой же группой авторов (D. Einhorn и соавт., 2001), прослеживалось влияние лечения пиоглитазоном у 727 больных (монотерапия — 56 больных, пиоглитазон + препараты сульфонилмочевины — 236, пиоглитазон + инсулин — 313 и пиоглитазон + метформин — 154 больных) на протяжении 72 нед. Препарат хорошо переносился больными — за период наблюдения не отмечалось никаких нежелательных явлений.
В другом исследовании, проведенном этой же группой авторов (D. Einhorn и соавт., 2001), прослеживалось влияние лечения пиоглитазоном у 727 больных (монотерапия — 56 больных, пиоглитазон + препараты сульфонилмочевины — 236, пиоглитазон + инсулин — 313 и пиоглитазон + метформин — 154 больных) на протяжении 72 нед. Препарат хорошо переносился больными — за период наблюдения не отмечалось никаких нежелательных явлений.
Особый интерес представляет исследование P. C. Davidson и соавт. (2001), в ходе которого изучалось влияние пиоглитазона (45 мг) и роcиглитазона (8 мг) на течение диабета у больных, ранее получавших лечение троглитазоном. Если при приеме троглитазона у больных СД 2 типа содержание гликогемоглобина в крови снизилось с 8,1 до 7,5%, то под влиянием пиоглитазона у этих пациентов отмечалось дальнейшее его снижение — до 7,1%, причем максимального эффекта удавалось достичь через 6 мес. В группе больных, получавших роcиглитазон, уровень гликозилированного гемоглобина не изменился. Снижение триглицеридов и повышение холестерина липопротеидов высокой плотности (ЛПВП) в сыворотке крови было более выраженным у больных, получавших пиоглитазон, по сравнению с роcиглитазоном. Что касается общего холестерина и холестерина ЛПНП, то у больных, получавших пиоглитазон, отмечалось уменьшение этих показателей, тогда как у пациентов, находившихся на терапии роcиглитазоном, указанные показатели повысились. Однако у лиц, получавших пиоглитазон, за период лечения отмечена прибавка массы тела в среднем на 2,5 кг, тогда как у больных, применявших роcиглитазон, масса тела снизилась в среднем на 400 г.
Снижение триглицеридов и повышение холестерина липопротеидов высокой плотности (ЛПВП) в сыворотке крови было более выраженным у больных, получавших пиоглитазон, по сравнению с роcиглитазоном. Что касается общего холестерина и холестерина ЛПНП, то у больных, получавших пиоглитазон, отмечалось уменьшение этих показателей, тогда как у пациентов, находившихся на терапии роcиглитазоном, указанные показатели повысились. Однако у лиц, получавших пиоглитазон, за период лечения отмечена прибавка массы тела в среднем на 2,5 кг, тогда как у больных, применявших роcиглитазон, масса тела снизилась в среднем на 400 г.
Проведенные исследовании позволили установить новые аспекты действия агонистов PPARγ-рецепторов, что расширяет сферу применения препаратов этой группы при терапии сахарного диабета. Так, показано, что агонисты оказывают влияние на ангиогенез. Сосудистый эндотелиальный фактор роста (СЭФР, или VEGF) является ключевым регулятором внутриглазных ангиогенных заболеваний, к которым относятся диабетическая ретинопатия, возрастная дегенерация макулы и преждевременная ретинопатия. Как показали исследования T. Murata и соавт. (2001), тиазолидиндионы ингибируют интраокулярный ангиогенез.
Как показали исследования T. Murata и соавт. (2001), тиазолидиндионы ингибируют интраокулярный ангиогенез.
На основании экспериментальных и клинических исследований можно сделать вывод, что пиоглитазон является новым эффективным сахароснижающим препаратом, который может использоваться как в качестве монотерапии, так и в сочетании с другими препаратами (пероральные сахароснижающие препараты, метформин, акарбоза, инсулин). Наряду с этим при лечении пиоглитазоном наблюдается тенденция к нормализации липидного обмена, и в первую очередь триглицеридов и холестерина ЛПВП. Препарат хорошо переносится и не обладает гепатотоксичностью. Он показан при СД 2 типа, который, как известно, сопровождается инсулинорезистентностью.
Росиглитазон, или авандиа, также относится к препаратам из группы тиазолидиндионов. В апреле 1999 г., после многолетних, многоцентровых и широкомасштабных клинических исследований, роcиглитазон был зарегистрирован в Мексике, в мае того же года — в США, в июле 2000 г. — в странах ЕС.
— в странах ЕС.
Росиглитазон быстро и практически полностью абсорбируется в желудочно-кишечном тракте, биодоступность препарата составляет в среднем — 99% (P. J. Cox и соавт., 2000). Прием пищи и рН желудочного сока не влияют на абсорбцию роcиглитазона в желудочно-кишечном тракте.
Росиглитазон является высокоселективным PPARγ-агонистом, его активность в 100 раз превышает таковую у троглитазона и в 30 раз — у пиоглитазона.
Исследования, проведенные в клеточной культуре на интактных мышиных 3Т3-L1 или адипоцитах человека (P. W. Young и соавт., 1998), показали, что у роcиглитазона аффинность к комплексированию с рецепторами выше, чем у пиоглитазона, тогда как у троглитазона аффинность к комплексированию с рецептором ниже, чем у тиоглитазона. Изучение степени выраженности сахароснижающего действия тиазолидиндионов in vivo показывает, что, исходя из их относительной сахароснижающей активности, препараты следует распределить следующим образом: роcиглитазон>пиоглитазон>троглитазон (J. Berger и соавт., 1996; P. W. Young и соавт., 1998).
Berger и соавт., 1996; P. W. Young и соавт., 1998).
Механизм действия роcиглитазона, как и других препаратов из этой группы, обусловлен его взаимодействием с PPARγ, который принадлежит к суперсемейству транскрипционных факторов рецепторов ядерных гормонов и экспрессируется в основном в белом жире, а у животных — в «буром» жире. Экспериментальные и клинические данные показывают, что основное действие тиазолидиндионов осуществляется в жировой ткани, где они оказывают стимулирующее влияние на дифференцировку адипоцитов. Однако имеется ряд убедительных свидетельств в пользу того, что этот класс препаратов обладает не только периферическим, но и центральным действием. Так, установлено, что роcиглитазон оказывает влияние на метаболизм глюкозы в печени (S. L. Grossman и J. Lessem, 1997) и мышцах.
Изучая влияние роcиглитазона на регуляцию экспрессии генов в адипоцитах человека, J. Rieusset и соавт. (1999) впервые продемонстрировали, что стимуляция PPARγ вызывает экспрессию мРНК субъединицы р85a фосфатидилинозитол-3-киназы, которая является одной из важных субъединиц рецептора к инсулину, участвующей в трансдукции биологического действия инсулина и влияющей на транспорт и внутриклеточный метаболизм глюкозы. Этот механизм в какой-то мере объясняет влияние тиазолидиндионов на повышение тканевой чувствительности к инсулину.
Этот механизм в какой-то мере объясняет влияние тиазолидиндионов на повышение тканевой чувствительности к инсулину.
Дальнейшим подтверждением прямого влияния росиглитазона на секреторную активность β-клеток послужили исследования C. Yang и соавт. (2001), в ходе которых было показано, что роcиглитазон в дозе 0,045–4,5 мкгмоль/л стимулировал секрецию и высвобождение инсулина, статистически достоверно повышая как первую (на 80,7%), так и вторую фазу (на 52,4%) его секреции. Представляют интерес наблюдения L. Chao и соавт. (2000), которые показали, что у мышей с высокой гипергликемией, гиперлипидемией и инсулиновой резистентностью, но без жировой ткани, роcиглитазон восстанавливал нарушенный липидный обмен, тогда как показатели углеводного обмена и секреции инсулина оставались без изменений. Эти исследования являются свидетельством того, что от наличия жировой ткани в организме зависит проявление антидиабетических эффектов роcиглитазона, но не коррекция нарушений обмена липидов.
Роcиглитазон, как и другие препараты из группы тиазолидиндионов, способствует повышению массы тела и ИМТ, в основном за счет увеличения подкожно-жирового депо, при этом снижаются количество висцерального депо и степень выраженности печеночного стеатоза (гепатоза) и гепатомегалии (D. G. Carey и соавт., 2000). Однако это побочное действие роcиглитазона может быть сведено к минимуму или даже полностью нивелироваться при одновременном применении низкокалорийной диеты (B. C. Richard и соавт., 2002). Длительная терапия тиазолидиндионами в ряде случаев сопровождается увеличением объема циркулирующей плазмы при снижении концентрации гемоглобина в крови (результат разведения), при этом происходит задержка жидкости в организме, наблюдавшаяся как у здоровых добровольцев, получавших в течение 8 нед по 8 мг препарата в сут, так и у больных СД 2 типа (M. A. Kahn и соавт., 2002). По данным P. Dogterom и соавт. (1999), роcиглитазон не влияет на эритропоэз или на преждевременную деструкцию эритроцитов.
Применение роcиглитазона у больных СД 2 типа сопровождалось статистически достоверным снижением гликемии и уровня гликозилированного гемоглобина (Y. Miyazaki и соавт, 2001; J. J. Holan и соавт., 2000). Следует отметить, что снижение гликемии наступает лишь через 2–4 нед от начала терапии, а уменьшение гликозилированного гемоглобина — после 8-й нед лечения.
M. A. Khan и соавт. (2002) провели сравнительную оценку эффективности роcиглитазона (2–8 мг/сут) и пиоглитазона (15–45 мг/сут) у 60 больных СД 2 типа, которым до этого проводилось лечение троглитазоном. У больных обеих групп после 4 мес лечения уровень гликозилированного гемоглобина в крови остался на исходном уровне, но при этом у всех пациентов отмечалось увеличение массы тела почти на 2 кг.
У больных, получавших лечение пиоглитазоном, улучшился липидный профиль, тогда как в группе больных, леченных роcиглитазоном, — практически не изменился.
K. A. Virtanen и соавт. (2002) изучали влияние роcиглитазона и метформина на поглощение глюкозы жировой тканью у больных СД 2 типа. На фоне приема роcиглитазона отмечалось повышение инсулинстимулированного поглощения глюкозы в висцеральную жировую ткань, и особенно в подкожно-жировую ткань области бедер, что проявлялось улучшением чувствительности к инсулину. У больных, получавших метформин, отмечалось уменьшение количества подкожно-жировой клетчатки в области живота с повышением поглощения глюкозы в этой области.
(2002) изучали влияние роcиглитазона и метформина на поглощение глюкозы жировой тканью у больных СД 2 типа. На фоне приема роcиглитазона отмечалось повышение инсулинстимулированного поглощения глюкозы в висцеральную жировую ткань, и особенно в подкожно-жировую ткань области бедер, что проявлялось улучшением чувствительности к инсулину. У больных, получавших метформин, отмечалось уменьшение количества подкожно-жировой клетчатки в области живота с повышением поглощения глюкозы в этой области.
Показано, что повышение СЖК в сыворотке крови больных СД 2 типа сопровождается более выраженной инсулиновой резистентностью и ухудшением течения диабета (G. Boden, 1999). Тиазолидиндионы, видимо, посредством повышения чувствительности периферических тканей к инсулину модифицируют липолиз, приводя к снижению уровня СЖК в сыворотке крови больных. Так, под влиянием 26-недельной терапии роcиглитазоном в дозе 4 или 8 мг в день, L. S. Phillips и соавт. (2001) отметили снижение СЖК на 7 и 19% от исходного уровня, тогда как у пациентов, получавших плацебо, выявлено повышение уровня СЖК на 4%. Более выраженное снижение уровня СЖК (на 14 и 23% соответственно) на фоне терапии авандиа наблюдалось в исследовании V. Fonseca и соавт. (2000).
Более выраженное снижение уровня СЖК (на 14 и 23% соответственно) на фоне терапии авандиа наблюдалось в исследовании V. Fonseca и соавт. (2000).
Недостаточная функция β-клеточного аппарата подтверждается повышением уровня проинсулина в сыворотке крови и увеличением соотношения проинсулин/инсулин. Изменение этого состояния в сторону уменьшения отношения проинсулин/инсулин в сыворотке крови указывает на восстановление функциональной активности островкового аппарата поджелудочной железы. Изучая влияние роcиглитазона на функцию β-клеток у больных СД 2 типа, L. E. Porter и соавт. (2000) впервые отметили тенденцию к нормализации отношения проинсулин/инсулин и повышению уровня инсулина в сыворотке крови, тогда как у больных, получающих плацебо или глибурид, этот эффект отсутствовал. В дальнейшем это положительное влияние роcиглитазона было подтверждено F. Ovalle и D. S. H. Bell (2002). Представляет интерес тот факт, что другой широко использующийся препарат из группы тиазолидиндионов — актос, или пиоглитазон, не оказывает подобного влияния на функцию островкового аппарата поджелудочной железы (K. Kubo, 2002).
Kubo, 2002).
Помимо сахароснижающего действия, роcиглитазон достоверно уменьшает степень выраженности инсулинорезистентности, характерной для СД 2 типа. Назначение роcиглитазона повышает чувствительность тканей к инсулину, и этот эффект усиливается благодаря ограничениям в пищевом рационе (L. Pickavance и соавт., 1999). Применение роcиглитазона в дозе от 2 до 8 мг/сут в качестве монотерапии у больных СД 2 типа сопровождалось статистически достоверным снижением инсулинорезистентности, тогда как у пациентов, получавших глибенкламид (T. B. Leonard и соавт., 2001) или плацебо (J. Gerich и соавт., 2001), показатели инсулинорезистентности оставались без изменений. Уменьшение степени выраженности инсулиновой резистентности у больных СД 2 типа под влиянием терапии роcиглитазоном снижает на 9–27% риск развития сердечно-сосудистых заболеваний (T. B. Leonard и соавт., 2001).
Таким образом, тиазолидиндионы улучшают гликемический контроль диабета посредством изменения инсулинорезистентности и функциональной активности β-клеток; их эффективность является результатом первичного уменьшения гликогенолитического и глюконеогенного компонентов образования глюкозы в печени. Следовательно, тиазолидиндионы (актос и авандия) представляют собой новый класс сахароснижающих препаратов, обладающих патогенетическим влиянием на уменьшение степени выраженности инсулиновой резистентности при СД 2 типа, которая, в свою очередь, является одной из основных причин развития сахарного диабета.
Следовательно, тиазолидиндионы (актос и авандия) представляют собой новый класс сахароснижающих препаратов, обладающих патогенетическим влиянием на уменьшение степени выраженности инсулиновой резистентности при СД 2 типа, которая, в свою очередь, является одной из основных причин развития сахарного диабета.
По вопросам литературы обращайтесь в редакцию.
Е. М. Клебанова, кандидат медицинских наук
М. И. Балаболкин, доктор медицинских наук, профессор
В. М. Креминская, кандидат медицинских наук
ММА им И. М. Сеченова, Москва
Инсулинорезистентность:
Что делать, если у вас инсулинорезистентность?
Проект Selfrebootcamp направлен, в первую очередь, на работу с людьми в той или иной мере страдающими от лишнего веса. То есть, на работу с теми, кто или находится в зоне особого риска или уже страдает инсулинорезистентностью.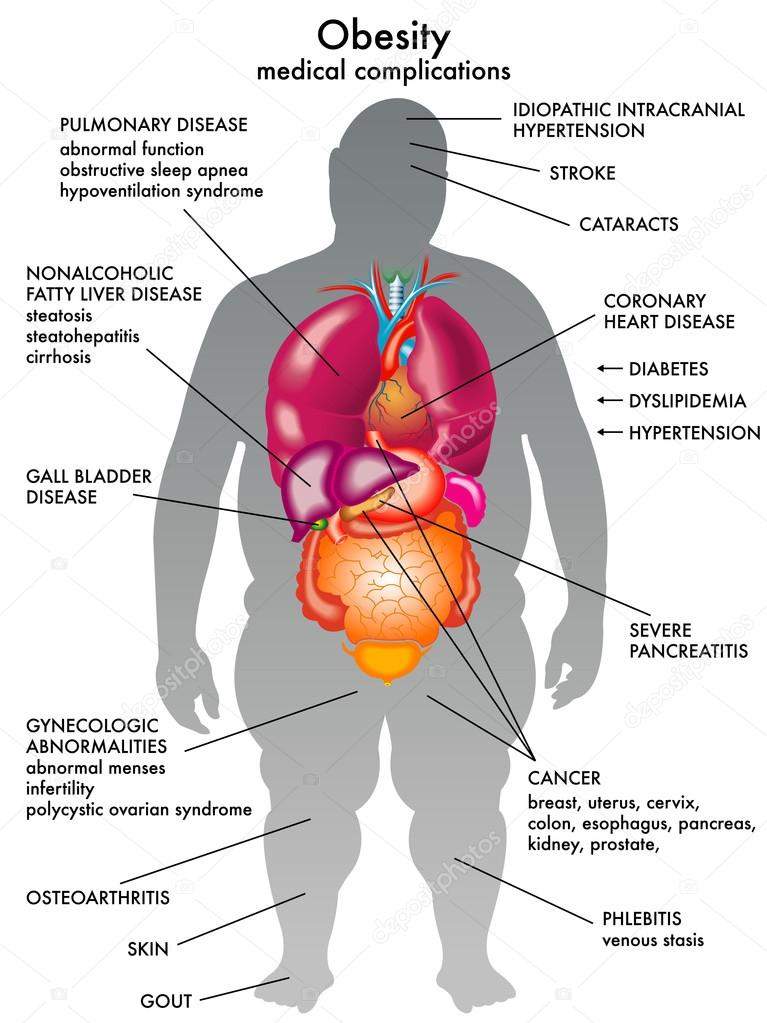 Довольно часто с людьми сильно нарушившими свой обмен веществ жесткими диетами и голоданиями.
Довольно часто с людьми сильно нарушившими свой обмен веществ жесткими диетами и голоданиями.
Цель проекта — дать участникам знания и выработать привычки помогающие изменить образ жизни. Для этого с самого начала ко всем участникам предъявляются определенные требования: пятиразовое питание в соответствии с концепцией и расписанием и каждодневная физическая нагрузка — десять тысяч шагов.
В питании в концепции Selfrebootcamp присутствуют все питательные вещества: белки, жиры, углеводы в достаточном для человека количестве. У нас есть общие рекомендации — среднестатистические пропорции. Но в процессе участия в проекте человек получает индивидуальные поправки к рациону. Они соответствуют не только его привычкам и предпочтениям, но и тому обмену веществ, который образовался у него в процессе жизни.
Вот тут-то и проявляются особенности. В частности, инсулинорезистентность. Мы видим признаки, которые перечислила Екатерина Бузина в первой части статьи. Особенно настораживает, если человек благодаря нашей системе худеет (выполняя требования и рекомендации, он не может не худеть), а живот остается. В этом случае, мы рекомендуем срочно сдать необходимые анализы и, если инсулинорезистентность подтверждается, наблюдаться у эндокринолога.
В этом случае, мы рекомендуем срочно сдать необходимые анализы и, если инсулинорезистентность подтверждается, наблюдаться у эндокринолога.
Параллельно мы дополнительно корректируем рекомендации по питанию. Например ограничиваем простые быстрые углеводы (сахар, фрукты и другие десерты).
Надо сказать, что с самого начала, еще до любой диагностики, питание в проекте подразумевает осторожное обращение со сладким: это всегда отдельный прием пищи, никогда не натощак, а через 1,5 – 2 ч после основного приема пищи и не позднее 16:00. Не на завтрак, не в обед и уж ни в коем случае не на ужин.
Также очень важно, что завтрак должен быть не позже, чем через два часа после сна. При этом важно, когда именно вы просыпаетесь, потому что интенсивность выработки инсулина организмом зависит от времени суток. Время от ужина до сна не меньше четырех часов. Все это, в сочетании с физическими нагрузками, поддерживает режим функционирования поджелудочной железы, позволяет человеку наладить метаболизм и приостановить развитие инсулинорезистентности, если она не обусловлена патологическими изменениями организма.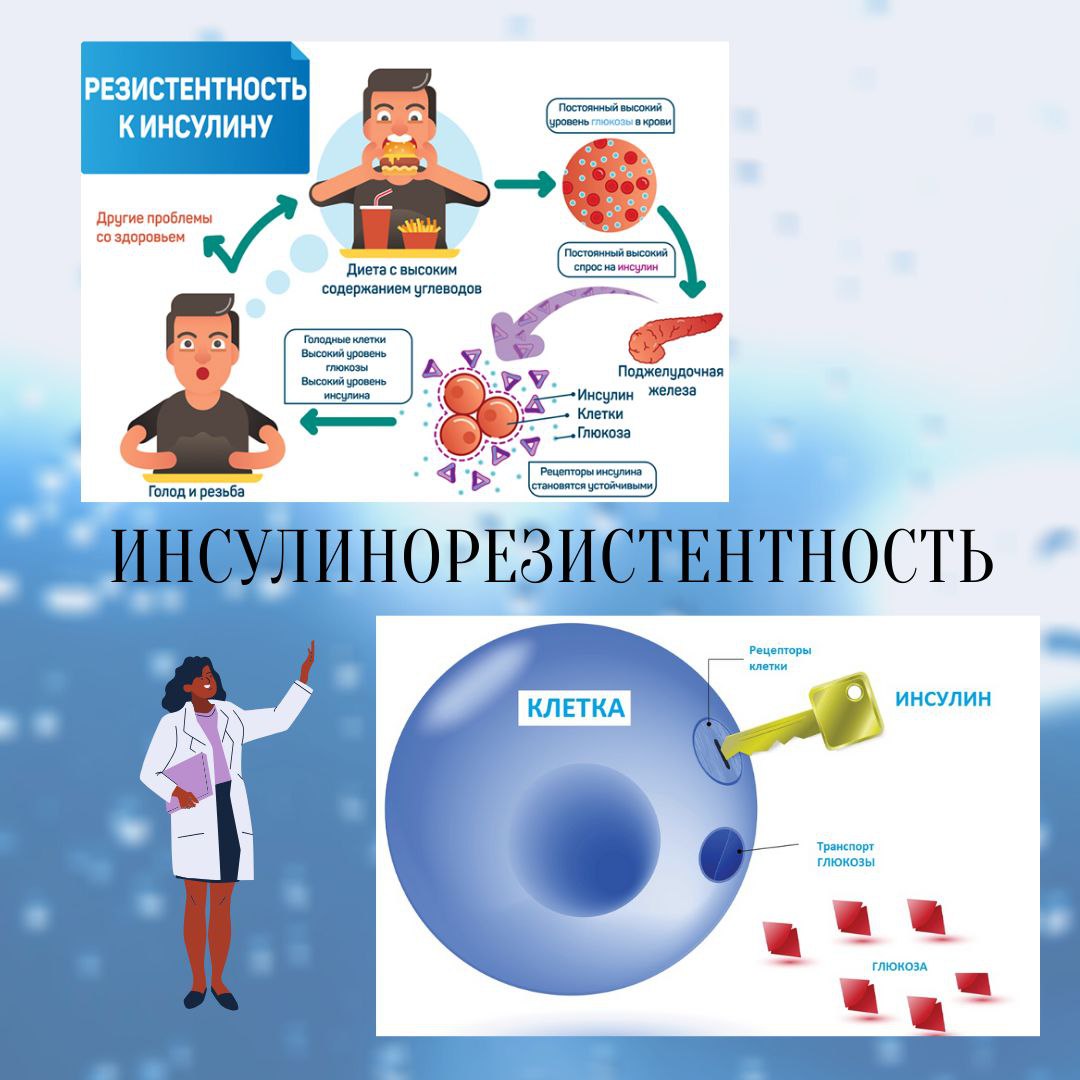 А мы даем необходимые знания, чтобы человек начал разбираться в своей «внутренней кухне» и смог осознанно подойти к питанию. Но, что еще более важно, мы поддерживаем участников на пути к осознанности, а наши разработки помогают выработать и закрепить необходимые привычки.
А мы даем необходимые знания, чтобы человек начал разбираться в своей «внутренней кухне» и смог осознанно подойти к питанию. Но, что еще более важно, мы поддерживаем участников на пути к осознанности, а наши разработки помогают выработать и закрепить необходимые привычки.
Если изменения в работе поджелудочной железы уже есть (это покажет ГТТ), то к сожалению, вернуть организм к прежнему, здоровому состоянию не выйдет. Но можно остановить процесс в той точке, где он находится сейчас. Изменение образа жизни играет в решении этой задачи ключевую роль. В борьбе с инсулинорезистентностью очень важна система. Даже если вы добились потрясающих успехов, без системы их не удержать. И об этом надо помнить.
Резистентность к инсулину (для родителей) — Nemours KidsHealth
en español: резистентность к инсулину
Отзыв: Чиджиоке Икоми, доктор медицины
Что такое резистентность к инсулину?
Инсулинорезистентность возникает, когда организм не реагирует на гормон инсулин должным образом, что затрудняет проникновение глюкозы в клетки.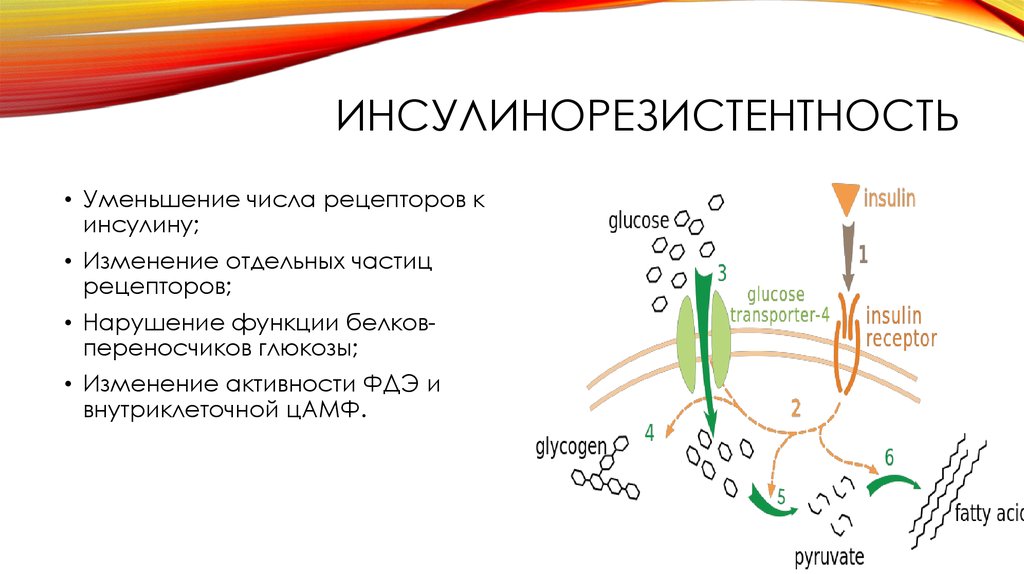 Глюкоза поступает из пищи и является основным источником энергии для организма. Обычно инсулин помогает глюкозе проникать в клетки.
Глюкоза поступает из пищи и является основным источником энергии для организма. Обычно инсулин помогает глюкозе проникать в клетки.
Резистентность к инсулину может повысить риск развития у ребенка диабета 2 типа и других проблем со здоровьем. Чтобы улучшить реакцию организма на инсулин, врачи рекомендуют детям и подросткам:
- Набрать и поддерживать здоровый вес.
- Соблюдайте сбалансированную диету, богатую цельными зернами, фруктами и овощами, а также нежирным белком.
- Регулярно делайте физические упражнения.
Каковы признаки и симптомы резистентности к инсулину?
Люди с резистентностью к инсулину могут иметь:
- высокий индекс массы тела (ИМТ) и окружность талии
- высокий уровень сахара в крови натощак
- acanthosis nigricans, потемнение кожи в складках и складках, например, на шее и в подмышечных впадинах
Другие медицинские проблемы, связанные с резистентностью к инсулину и ожирением, включают:
- ожирение печени (избыток жира в печени)
- синдром поликистозных яичников (СПКЯ), когда у девочек обильные или нерегулярные менструации или даже отсутствие менструаций
- высокое кровяное давление (гипертония)
- обструктивное апноэ сна
Кто получает резистентность к инсулину?
Инсулинорезистентность чаще всего встречается у людей с избыточным весом и избытком жира на животе. Резистентность к инсулину также связана с некоторыми генетическими синдромами, состояниями, которые влияют на уровень гормонов и уровень стресса, а также с некоторыми лекарствами.
Резистентность к инсулину также связана с некоторыми генетическими синдромами, состояниями, которые влияют на уровень гормонов и уровень стресса, а также с некоторыми лекарствами.
Ожирение и резистентность к инсулину обычно передаются по наследству. К другим факторам, которые подвергают человека риску инсулинорезистентности, относятся:
- отсутствие физической активности
- высокоуглеводная диета
- курение
Как диагностируется резистентность к инсулину?
Врачи могут подумать, что это резистентность к инсулину, если у человека с избыточным весом или ожирением есть черный акантоз или в семейном анамнезе диабет или болезни сердца. Они могут:
- проверить ИМТ и объем талии
- измерить артериальное давление
- сделать анализы крови, в том числе:
- глюкоза натощак и/или гемоглобин A1c
- инсулин натощак
- липидный профиль
Инсулинорезистентность и ожирение, как правило, идут рука об руку. Поэтому врачи могут назначить дополнительные анализы для выявления других проблем, связанных с весом, таких как ожирение печени, синдром поликистозных яичников и апноэ во сне.
Поэтому врачи могут назначить дополнительные анализы для выявления других проблем, связанных с весом, таких как ожирение печени, синдром поликистозных яичников и апноэ во сне.
Как лечить резистентность к инсулину?
Инсулинорезистентность лечится позитивными изменениями образа жизни. Потеря веса может привести к значительному повышению уровня сахара в крови, липидов и артериального давления. У детей, которые все еще растут, также может помочь замедление скорости набора веса или поддержание здорового веса.
Семьи могут сотрудничать со своим лечащим врачом, диетологом или участвовать в программе контроля веса, чтобы выработать здоровые привычки. К ним могут относиться:
- ограничение нездоровой пищи и сладких напитков
- есть больше фруктов и овощей
- выбор цельного зерна
- сокращение экранного времени
- получаю больше упражнений
- не курить
Что еще я должен знать?
Иногда резистентность к инсулину и другие проблемы не исчезают после изменения образа жизни. Некоторым детям может потребоваться лечение таких вещей, как высокое кровяное давление. Некоторым подросткам с резистентностью к инсулину и тяжелым ожирением врачи могут порекомендовать операцию по снижению веса.
Некоторым детям может потребоваться лечение таких вещей, как высокое кровяное давление. Некоторым подросткам с резистентностью к инсулину и тяжелым ожирением врачи могут порекомендовать операцию по снижению веса.
Отзыв: Чиджиоке Икоми, доктор медицины
Дата проверки: февраль 2020 г.
Делиться:
/content/kidshealth/misc/medicalcodes/parents/articles/инсулинорезистентные
Причины, признаки и что с этим делать
Диабет
по Бэйлор Скотт и Уайт Хелс
Декабрь 2, 2021
Инсулинорезистентность сейчас является горячей темой и часто всплывает в разговорах о диабете, контроле веса и СПКЯ. Это имеет смысл, если посмотреть на текущее состояние здоровья в нашей стране:
Это имеет смысл, если посмотреть на текущее состояние здоровья в нашей стране:
- 3% населения США имеют резистентность к инсулину, и она увеличивается в семь раз, если у вас преддиабет или диабет.
- Если у вас избыточный вес, особенно если у вас есть лишний жир на животе, у вас также больше шансов быть резистентными к инсулину, включая детей.
- Если вы женщина, у которой были проблемы с беременностью, у вас может быть то, что называется синдромом поликистозных яичников (СПКЯ) — до 12% или 15 миллионов американских женщин — и тогда вы также более склонны к резистентности к инсулину, удвоение риска диабета 2 типа к 40 годам.
Итог: резистентность к инсулину затрагивает многих людей. Итак, давайте поговорим о том, что это такое, как определить, что у вас инсулинорезистентность и что с этим делать.
Что такое инсулинорезистентность?
Когда ваше тело функционирует так, как было задумано, пища, которую вы едите, расщепляется до сахара в крови.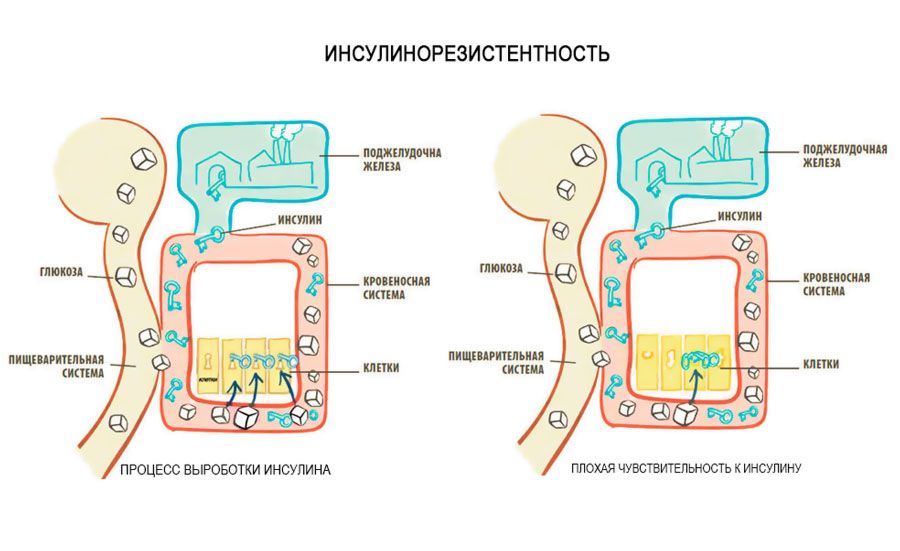 Затем он попадает в ваш кровоток и сигнализирует вашей поджелудочной железе о необходимости выработки инсулина, чтобы он мог поступать в клетки ваших мышц для получения всей своей ежедневной энергии, пока тело не сообщит поджелудочной железе, что ему достаточно.
Затем он попадает в ваш кровоток и сигнализирует вашей поджелудочной железе о необходимости выработки инсулина, чтобы он мог поступать в клетки ваших мышц для получения всей своей ежедневной энергии, пока тело не сообщит поджелудочной железе, что ему достаточно.
По мере того, как вы приближаетесь к диабету 2 типа, те же самые клетки перестают реагировать на весь этот инсулин, что приводит к увеличению уровня сахара в крови — или высокому уровню сахара в крови — в кровотоке. Это называется резистентностью к инсулину. Инсулинорезистентность также известна как нарушение чувствительности к инсулину.
«Это как если бы инсулин «стучал» в дверь мышц. Мышца слышит стук, открывается и впускает глюкозу. Но при резистентности к инсулину мышца не может слышать стук инсулина (мышца «резистентна»). Поджелудочная железа вырабатывает больше инсулина, что увеличивает уровень инсулина в крови и вызывает более громкий «стук». В конце концов, поджелудочная железа вырабатывает гораздо больше инсулина, чем обычно, и мышцы продолжают сопротивляться этому удару.
Пока человек может производить достаточно инсулина, чтобы преодолеть это сопротивление, уровень глюкозы в крови остается нормальным. Как только поджелудочная железа перестает справляться, уровень глюкозы в крови начинает расти, сначала после еды, а в конечном итоге даже натощак».
— Медицинский словарь MedicineNet, 2021
Есть ли разница между инсулинорезистентностью и преддиабетом?
Оба состояния связаны с нарушением баланса сахара в крови. Предиабет — это состояние, которое возникает, когда уровень глюкозы в крови выше, чем должен быть, но еще недостаточно высок, чтобы считаться диагнозом диабета 2 типа.
У предиабета есть две основные причины: либо ваша поджелудочная железа не способна вырабатывать достаточное количество инсулина, либо ваши инсулиновые рецепторы перестают реагировать на инсулин должным образом. Этот второй случай описывает резистентность к инсулину.
Как определить, что у вас резистентность к инсулину
Вы не можете определить, что у вас резистентность к инсулину, по самочувствию. Для предиабета или диабета существуют стандартные анализы крови: A1C, глюкоза плазмы натощак (ГПН) и случайная глюкоза плазмы (РПГ). Несмотря на то, что существуют клинические тесты на резистентность к инсулину, самый точный, золотой стандарт измерения — гиперинсулинемический-эугликемический клэмп-метод глюкозы — сложен и используется в основном для исследований.
Для предиабета или диабета существуют стандартные анализы крови: A1C, глюкоза плазмы натощак (ГПН) и случайная глюкоза плазмы (РПГ). Несмотря на то, что существуют клинические тесты на резистентность к инсулину, самый точный, золотой стандарт измерения — гиперинсулинемический-эугликемический клэмп-метод глюкозы — сложен и используется в основном для исследований.
Тем не менее, даже без теста, Национальный институт здоровья говорит, что есть генетические вопросы или вопросы об образе жизни, которые вы можете задать, чтобы оценить свой риск резистентности к инсулину. Чем больше критериев вы видите, тем больше у вас риска:
- Избыточный вес или ожирение?
- Возраст 45 лет или старше?
- Родитель, брат или сестра больны диабетом?
- Афроамериканец, коренной житель Аляски, американский индеец, американец азиатского происхождения, латиноамериканец/латиноамериканец, коренной житель Гавайев или тихоокеанских островов Американская этническая принадлежность?
- Отсутствие физической активности?
- Заболевания, такие как высокое кровяное давление или аномальный уровень холестерина?
- Гестационный диабет в анамнезе?
- Болезнь сердца или инсульт в анамнезе?
- Курите?
- Проблемы со сном, такие как апноэ во сне или регулярная потеря сна на 1-3 часа в сутки?
- Синдром поликистозных яичников, также называемый СПКЯ?
Существуют также определенные биологические признаки, на которые следует обратить внимание:
- Талия более 40 дюймов у мужчин и 35 дюймов у женщин
- Артериальное давление 130/80 или выше
- Уровень глюкозы натощак более 100 мг/ дл
- Уровень триглицеридов натощак более 150 мг/дл
- Уровень холестерина ЛПВП менее 40 мг/дл у мужчин и 50 мг/дл у женщин.
 резистентности к инсулину — чем более резистентны вы, тем больше работы и тем больше инсулина вам потребуется, чтобы поддерживать уровень сахара в крови в нормальном или целевом диапазоне и предотвратить любое из ряда осложнений, связанных с диабетом. Это также не просто отличительная черта людей с преддиабетом или диабетом 2 типа. В то время как резистентность к инсулину не вызывают диабет 1 типа, у вас может быть резистентность к инсулину, если у вас диабет 1 типа.
резистентности к инсулину — чем более резистентны вы, тем больше работы и тем больше инсулина вам потребуется, чтобы поддерживать уровень сахара в крови в нормальном или целевом диапазоне и предотвратить любое из ряда осложнений, связанных с диабетом. Это также не просто отличительная черта людей с преддиабетом или диабетом 2 типа. В то время как резистентность к инсулину не вызывают диабет 1 типа, у вас может быть резистентность к инсулину, если у вас диабет 1 типа.Как повысить чувствительность к инсулину
Мы знаем, что улучшение питания, повышение физической активности и снижение веса снижают уровень глюкозы в крови и помогают предотвратить прогрессирование предиабета в диабет. Исследования предполагают, что эти же изменения образа жизни также играют важную роль в улучшении резистентности к инсулину, хотя, по данным Американской диабетической ассоциации, она «редко восстанавливается до нормального уровня». На сегодняшний день:
- Ни один из режимов питания не показал наиболее эффективного воздействия на резистентность к инсулину, хотя недавнее исследование женщин, соблюдающих растительную средиземноморскую диету, снизило риск сердечно-сосудистых заболеваний, включая такие факторы, как резистентность к инсулину, у некоторых на 25%.
 .
. - Хотя не существует лекарств, одобренных специально для лечения резистентности к инсулину, лекарства от диабета, такие как метформин и тиазолидиндионы (TZD), являются сенсибилизаторами инсулина, которые снижают уровень сахара в крови за счет снижения резистентности к инсулину.
- Результаты подтверждают, что такие поведения, как здоровое питание, регулярная физическая активность и качественный сон, являются ключевыми контролируемыми поведениями, связанными с хорошей чувствительностью к инсулину, и, особенно в сочетании, такими как потеря веса и физические упражнения, значительно улучшают чувствительность к инсулину по сравнению с любым одним поведением по отдельности.
Поэтому попросите своего врача дать вам направление к зарегистрированному диетологу, который поможет вам разработать индивидуальный план борьбы с резистентностью к инсулину. Например, мы можем разработать для вас индивидуальный план питания для контроля веса, а также стратегию упражнений, которая вам подходит.

- Ни один из режимов питания не показал наиболее эффективного воздействия на резистентность к инсулину, хотя недавнее исследование женщин, соблюдающих растительную средиземноморскую диету, снизило риск сердечно-сосудистых заболеваний, включая такие факторы, как резистентность к инсулину, у некоторых на 25%.

