Цитоплазма. Большая российская энциклопедия
Клетки
- Области знаний:
- Клетки и неклеточные элементы тканей, Клеточная биология
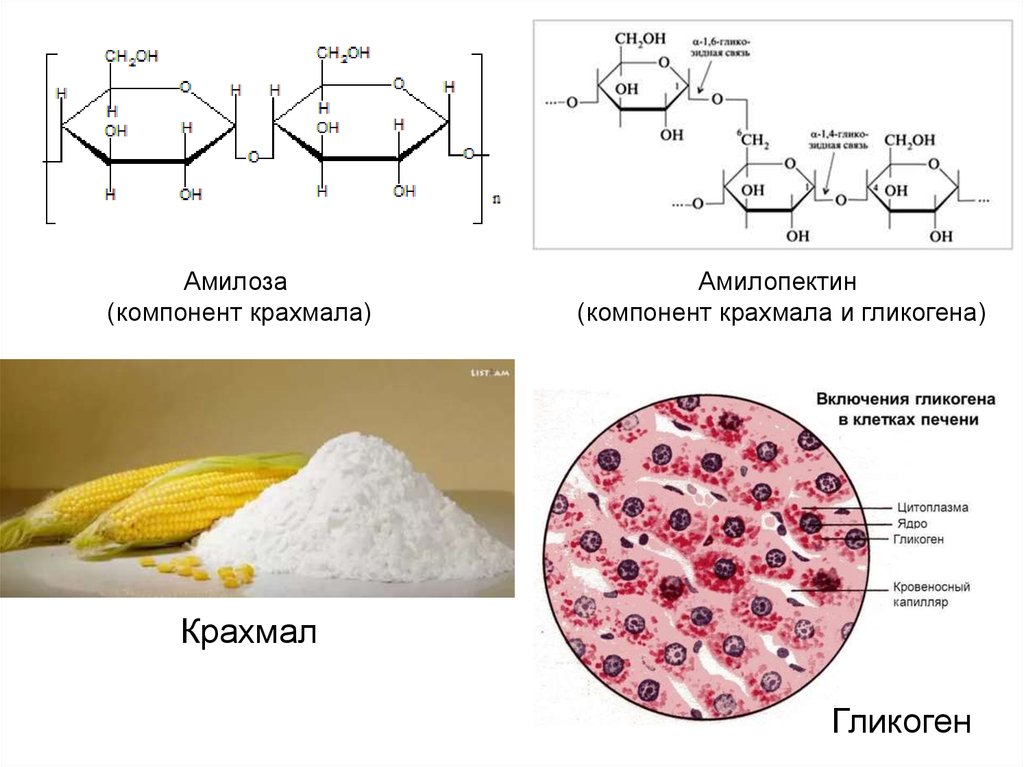
Цитопла́зма (от цито… и греч. πλάσμα – вылепленное, оформленное) у эукариот – часть клетки, заключённая между плазматической мембраной и ядром; высокоупорядоченная многофазная коллоидная система – цитозоль (основное вещество, гиалоплазма, цитоплазматический матрикс) с находящимися в ней органеллами и необязательными включениями, представляющими собой отложения запасных веществ (например, гранулы гликогена, жировые капли) или скопления продуктов обмена веществ. Иногда цитоплазмой называют только цитозоль.
В цитоплазме осуществляются все процессы клеточного метаболизма, кроме синтеза нуклеиновых кислот, происходящего в ядре. Через плазматическую мембрану осуществляется обмен веществами между цитоплазмой и внешней средой, через ядерную оболочку – ядерно-цитоплазматический обмен. Цитоплазма находится под контролем клеточного ядра и, как правило, неспособна без него к длительному автономному существованию (в безъядерных клетках она дегенерирует).
У прокариот цитоплазма не отделена от генома, структурно связанного с плазматической мембраной, не содержит органелл, кроме рибосом, и цитоскелета.
Историческая справка
Термин «цитоплазма» введен Р. А. фон Кёлликером в 1863 г. первоначально как синоним термина «протоплазма» [обозначающей живое внутреннее содержимое клетки (Mohl, 1846)], но позже стал обозначать клеточное вещество и органеллы вне ядра. Существовали разногласия в определении цитоплазмы растительных клеток, поскольку немецкий ботаник Э. Страсбургер в 1882 г. предложил исключать из него некоторые органеллы, особенно вакуоли (занимающие большое пространство внутри клетки) и пластиды (Strasburger. 1882).
Во второй половине 19 в. сформулированы основные положения теории симбиогенеза (эндосимбиотической теории), объясняющей происхождение отдельных органелл (митохондрий и пластид) в составе цитоплазмы как симбионтов, сохранивших собственные ДНК. Окончательное подтверждение теория симбиогенеза нашла уже в 21 в.
Структура
В цитоплазме животных клеток (рис. 1) различают два слоя: наружный – эктоплазму (лишена гранул и большинства органелл, обладает относительно высокой вязкостью; под плазматической мембраной в ней наблюдается сплетение микрофиламентов) и внутренний – эндоплазму (содержит различные органеллы и гранулы, обладает относительно меньшей вязкостью).
Рис. 1. Строение животной клетки.В цитоплазме растительных клеток (рис. 2) имеются специальные органеллы – пластиды, а аппарат Гольджи представлен рассеянными по цитоплазме диктиосомами.
Рис. 2. Строение растительной клетки.Цитоплазма пронизана белковыми структурами – микротрубочками, филаментами и микрофиламентами, совокупность которых составляет цитоскелет, формирующий опорно-двигательную систему клетки. Благодаря своим перемещениям он способен обратимо менять фазовое состояние гиалоплазмы из геля в золь и наоборот.
Высказано предположение, что цитоплазма ведет себя как затвердевающая жидкость, сходная по свойствам со стеклом, в которой зафиксированы цитоплазматические компоненты.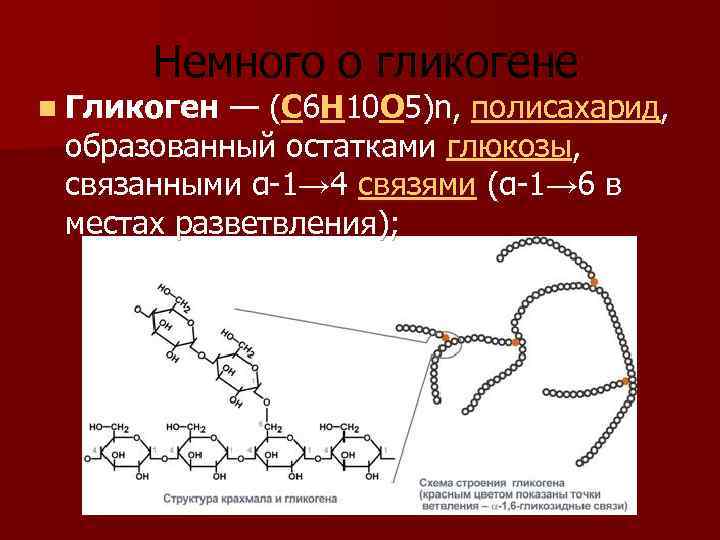 Они обретают подвижность после разжижения цитоплазмы в результате метаболической активности (The bacterial cytoplasm has glass-like properties … 2014). Способность содержимого клетки к затвердеванию в отсутствие метаболической активности (в периоды покоя) служит защитной стратегией, предотвращая повреждение органелл, но не препятствует транспорту мелких белковых молекул и метаболитов, помогая запустить рост и обмен веществ после возвращения клетки в активное состояние.
Они обретают подвижность после разжижения цитоплазмы в результате метаболической активности (The bacterial cytoplasm has glass-like properties … 2014). Способность содержимого клетки к затвердеванию в отсутствие метаболической активности (в периоды покоя) служит защитной стратегией, предотвращая повреждение органелл, но не препятствует транспорту мелких белковых молекул и метаболитов, помогая запустить рост и обмен веществ после возвращения клетки в активное состояние.
У различных типов клеток цитоплазма занимает разный объём: в лимфоцитах человека он близок к объёму ядра, в железистых клетках печени (гепатоцитах) занимает до 94 % от общего объёма клетки, а в нейронах в 600 раз превышает объём ядра. Кроме того, в клетках одного типа объём цитоплазмы может меняться в ходе клеточного цикла или в процессе клеточной дифференцировки.
Компоненты
Цитозоль – жидкая часть цитоплазмы, разделённая мембранами на компартменты, включает в себя сложный комплекс белковых структур цитоскелета, воду и растворённые в ней органические и неорганические вещества (The vault complex.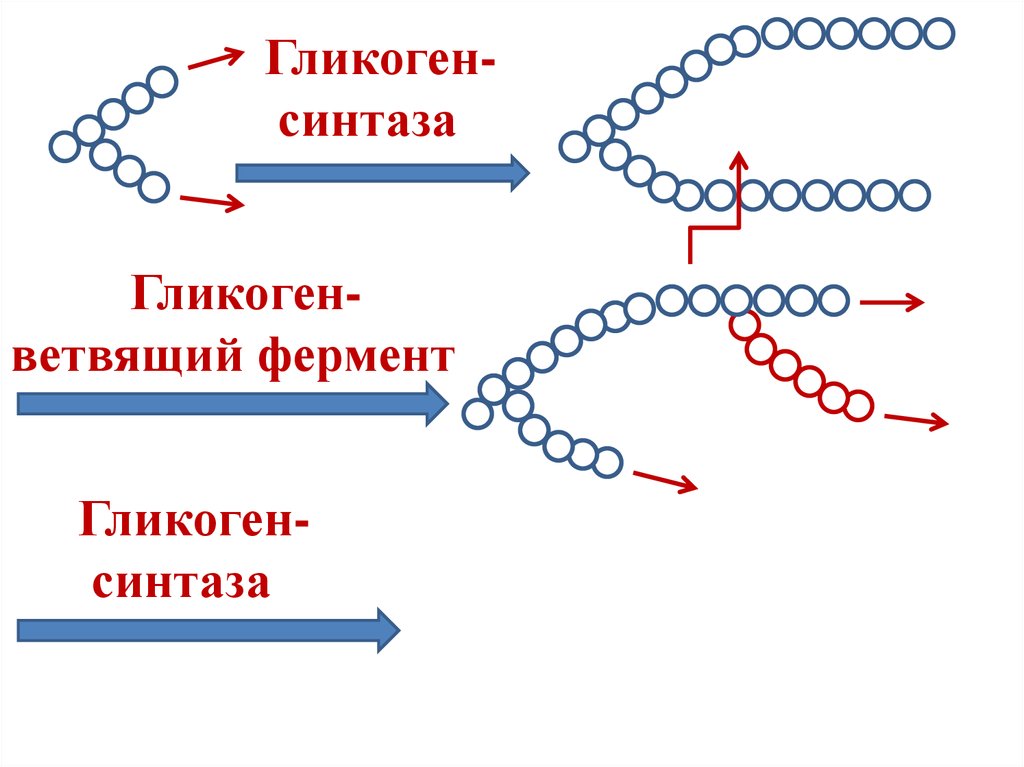 2003): минеральные соли, глюкоза и аминокислоты образуют истинный раствор, белки – коллоидный. В цитозоле присутствуют нерастворимые отходы обменных процессов и запасные питательные вещества.
2003): минеральные соли, глюкоза и аминокислоты образуют истинный раствор, белки – коллоидный. В цитозоле присутствуют нерастворимые отходы обменных процессов и запасные питательные вещества.
Органеллы – специализированные субъединицы, выполняющие определённую функцию: мембранные (митохондрии, пластиды, эндоплазматическая сеть (ретикулум), комплекс Гольджи, лизосомы, пероксисомы) и немембранные (рибосомы, нуклеоиды у прокариот). Органеллы идентифицируют с помощью микроскопии, также они могут быть выделены путем клеточного фракционирования.
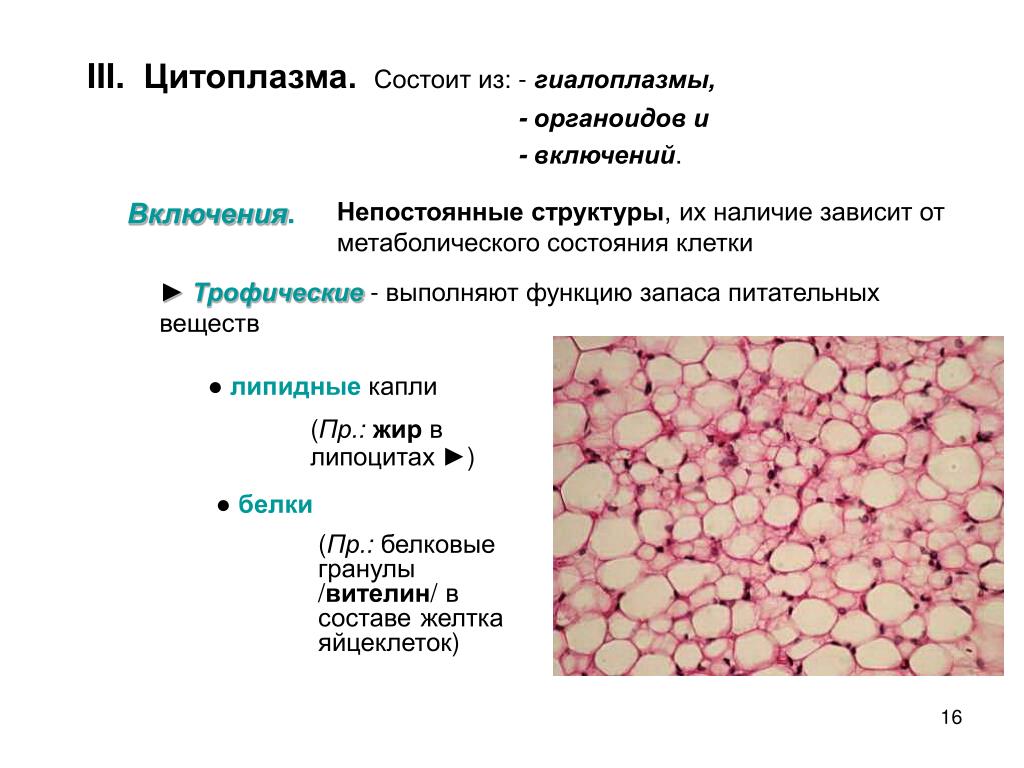
Включения – молекулы веществ, не связанных с мембранами: запасные питательные вещества; секреторные продукты, синтезированные клеткой; гранулы пигментов (Amenta. 1997). Примерами запасных включений являются гранулы гликогена (наиболее распространённой формой запасания глюкозы у животных), расположенные рядом с эндоплазматической сетью в клетках печени и мышц, и капли липидов (в форме триглицеридов), которые хранятся в специализированных клетках-адипоцитах.
Функции
Метаболическая функция
Важнейшая роль цитоплазмы – объединение всех клеточных структур (компонентов и компартментов) и обеспечение их химического взаимодействия. В ней протекают почти все процессы обмена веществ клетки, например, многие метаболические пути, включая гликолиз. Органеллы цитоплазмы обеспечивают её компартментализацию: в эндоплазматической сети происходит синтез белков и липидов, в комплексе Гольджи – созревание и модификация белков, в лизосомах – ферментативное расщепление поступивших в клетку макромолекул и надмолекулярных частиц.
Передача сигналов
В цитоплазме осуществляется передача сигнала от мембраны к ядру и органеллам, т. н. вторичный мессенджинг. Он важен для запуска ответа клетки на секрецию определённых гормонов – синтез белков, переход к следующей стадии клеточного цикла, рост, дифференцировка и движение клеток. Цитоплазма опосредует и другие сигналы, например, передает сигналы для везикулярного транспорта и формирования пространственной структуры (фолдинга) белков, а также через сигнальные молекулы – в генетический аппарат, и пр.
Транспортная функция
Проницаемость цитоплазмы определяет способ перемещения цитоплазматических компонентов (Spatial modeling of cell signaling networks. 2012): за счет диффузии перемещаются небольшие молекулы, например ионы кальция, для перемещения более крупных молекул и надмолекулярных структур требуется транспортная система микротрубочек.
У растений цитоплазма поддерживает тургорное давление внутри клетки за счёт транспорта воды по осмотическому градиенту через клеточную стенку, плазматическую мембрану и тонопласт. Тургорное давление препятствует дальнейшему проникновению воды в клетку.
Механическая (двигательная) функция
Цитоплазма постоянно движется, перетекает внутри живой клетки, меняя агрегатное состояние, перемещая вместе с собой различные вещества, включая и органеллы (Protein structures … 2005), формируя эндоплазматический поток (циклоз), в котором могут участвовать микрофиламенты. Эндоплазматический поток может быть спонтанным, постоянным или происходить под действием внешних факторов (изменение температуры, освещённости, концентрации химических веществ и др. ). Другие формы движения компонентов цитоплазмы определяются её моторными белками и элементами цитоскелета (Probing the stochastic, motor-driven properties of the cytoplasm … 2014).
). Другие формы движения компонентов цитоплазмы определяются её моторными белками и элементами цитоскелета (Probing the stochastic, motor-driven properties of the cytoplasm … 2014).
Дата публикации: 27 января 2023 г. в 15:34 (GMT+3)
«Переборки» между гепатоцитами определяют уникальное строение печени
Иллюстрация 3 из исследования. Изображение a: разветвление желчного канальца между тремя клетками (электронная микроскопия продольного среза дифференцированных гепатоцитов in vitro; GG — гранулы гликогена). На изображении b — увеличенная версия прямоугольного участка из a, на изображениях c и d — увеличенные участки из b. Изображение f — модель желчного канальца с периодическими похожими на переборки сросшимися участками клеточных мембран (см. наконечники стрелок) в просвете. Источник: © 2021 Belicova et al. Originally published in Journal of Cell Biology. https://doi.org/10.1083/jcb.202103002
Ученые Сколтеха и их коллеги из Германии и США обнаружили новые структуры в клетках печени, отвечающие за формирование и регулирование просвета между гепатоцитами. Авторы исследования, опубликованного в Journal of Cell Biology, также установили белок, необходимый для формирования этих ранее неизвестных «перемычек», похожих на переборки судна.
Авторы исследования, опубликованного в Journal of Cell Biology, также установили белок, необходимый для формирования этих ранее неизвестных «перемычек», похожих на переборки судна.
В организме человека есть множество поверхностей, покрытых эпителиальными клетками. При этом в сосудах или кишечнике клетки повернуты внутрь канала так называемыми апикальными участками мембраны, из которых и складывается внутренняя поверхность «трубки». Однако гепатоциты — самые распространенные клетки печени — в этом смысле ведут себя иначе: они формируют полости попарно, объединяясь лишь с клетками непосредственно по соседству. В результате образуется разветвленная трехмерная сеть из очень узких просветов.
До сих пор не было понятно, что стоит за этой особенностью гепатоцитов. При этом клетки печени другого типа, холангиоциты, образуют каналы гораздо большего диаметра и делают это по той же схеме, что и обычные эпителиальные клетки. И хотя ученые подозревали, что форма просвета между гепатоцитами и образование ими сетей объясняются детерминированным локальным механическим взаимодействием между клетками, эта гипотеза прежде носила общий характер и не подкреплялась экспериментальными данными.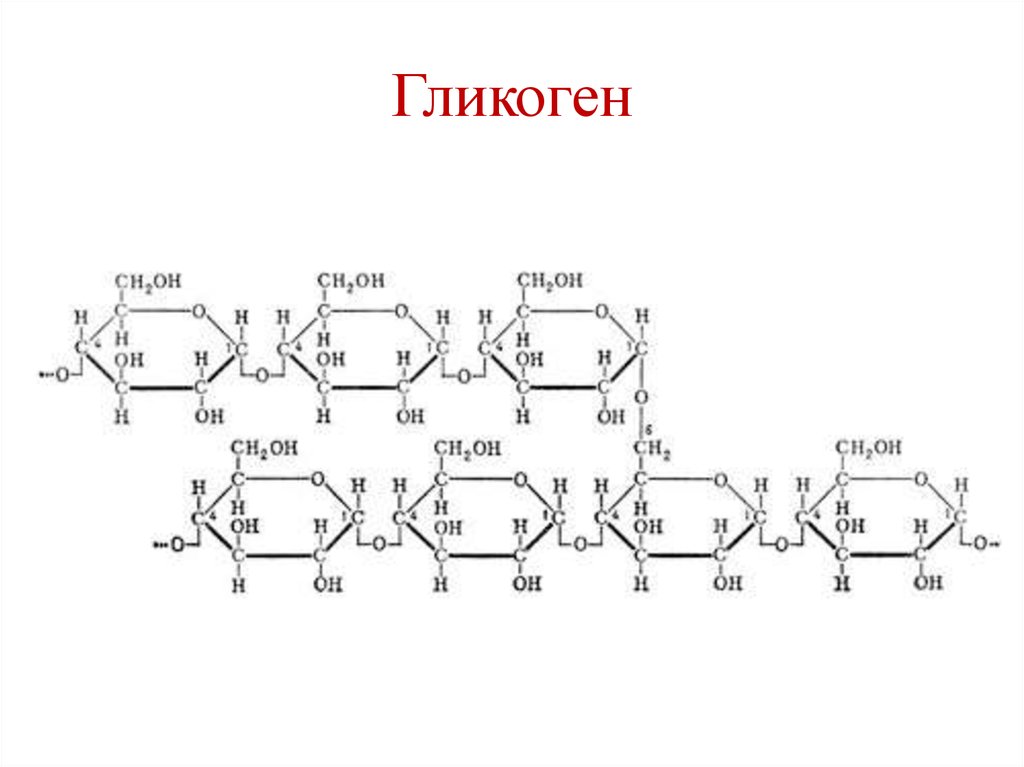
Апикальные перемычки
Ученые из Института молекулярно-клеточной биологии и генетики им. Макса Планка во главе с Марино Зериалом совместно с группой исследователей Сколтеха под руководством доцента Тимофея Зацепина и специалистами других организаций обнаружили на апикальной поверхности просвета между гепатоцитами выросты, которые образуют внутри канала структуры, напоминающие по форме переборки — ребра жесткости в корпусе судна. Исследовав их с помощью электронного микроскопа, ученые показали, что узость просвета и сложность сети желчных канальцев обусловлены именно наличием этих структур.
Обе структуры — и рукотворные переборки между бортами судна, и их естественный аналог в просвете между гепатоцитами — служат обеспечению жесткости «конструкции». Только переборки делят корпус судна на отсеки, а апикальные перемычки оставляют канал непрерывным.
Чтобы убедиться, что перемычки — не артефакт, привнесенный процедурой наблюдения за культурой клеток, коллектив исследовал эмбриональную печень мыши при помощи электронного микроскопа. Этот эксперимент in vivo подтвердил наличие схожих с переборками судна структур в формирующихся просветах в печени эмбриона. Также было однозначно показано, что перемычки не делят просвет канала на отдельные отсеки. Те же структуры были обнаружены и в печени взрослой мыши. Кроме того, эксперимент in vivo позволил исключить путаницу между перемычками и микроворсинками — ранее изученным образованием на клеточной мембране гепатоцитов.
Этот эксперимент in vivo подтвердил наличие схожих с переборками судна структур в формирующихся просветах в печени эмбриона. Также было однозначно показано, что перемычки не делят просвет канала на отдельные отсеки. Те же структуры были обнаружены и в печени взрослой мыши. Кроме того, эксперимент in vivo позволил исключить путаницу между перемычками и микроворсинками — ранее изученным образованием на клеточной мембране гепатоцитов.
Генетика образования перемычек
Исследователи рассмотрели ряд белков, которые могут принимать участие в образовании перемычек. Коллектив уделил основное внимание белку Rab35, который прежде никак не связывали со строением просвета между гепатоцитами. Используя методы электронной микроскопии и 3D-моделирование, ученые показали, что при отключении экспрессии гена Rab35 перемычки между гепатоцитами не образуются, а просвет получается таким, как между холангиоцитами.
«Важно отметить, что гепатоцит и холангиоцит имеют общего предшественника — гепатобласт, поэтому это наблюдение позволяет определить Rab35 как непосредственного участника событий. Мы знаем, что белок Rab35 напрямую не управляет формированием перемычек, — рассказывает Тимофей Зацепин. — Он известен как переносчик и, по всей видимости, отвечает за транспортировку внутри клетки какого-то комплекса или комплексов белков, которые, в свою очередь, приводят к образованию перемычек. Поиском этих комплексов мы сейчас и занимаемся — мы хотим полностью изучить механизм, который делает печень такой отличающейся от других органов».
Мы знаем, что белок Rab35 напрямую не управляет формированием перемычек, — рассказывает Тимофей Зацепин. — Он известен как переносчик и, по всей видимости, отвечает за транспортировку внутри клетки какого-то комплекса или комплексов белков, которые, в свою очередь, приводят к образованию перемычек. Поиском этих комплексов мы сейчас и занимаемся — мы хотим полностью изучить механизм, который делает печень такой отличающейся от других органов».
Исследователи предполагают, что обнаруженные ими перемычки важны для дальнейших исследований с возможными приложениями в медицине. «Эти структуры сами по себе очень интересны и красивы. Апикальные перемычки встречаются квазипериодически на расстоянии друг от друга, равном диаметру просвета, что внешне напоминает несущие элементы инженерных конструкций, — поясняет Тимофей Зацепин. — Мы планируем воспользоваться возможностью регулирования этого механизма для исследования работы печени и ее регенерации в условиях ожирения и фиброза печени».
Исследование проводилось с участием специалистов Сколковского института науки и технологий (Сколтеха), Института молекулярно-клеточной биологии и генетики им. Макса Планка, Института молекулярной генетики им. Макса Планка, Кильского университета им. Кристиана Альбрехта и Йенского университета им. Фридриха Шиллера (Германия), а также МГУ им. М. В. Ломоносова (Россия) и Nelson Laboratories LLC (США).
Макса Планка, Института молекулярной генетики им. Макса Планка, Кильского университета им. Кристиана Альбрехта и Йенского университета им. Фридриха Шиллера (Германия), а также МГУ им. М. В. Ломоносова (Россия) и Nelson Laboratories LLC (США).
Иллюстрация 3e из исследования. 3D-реконструкция: цитоплазма двух образующих просвет клеток показана зеленым и синим цветами. Плотные межклеточные соединения (TJ) выделены красным. Источник: © 2021 Belicova et al. Originally published in Journal of Cell Biology. https://doi.org/10.1083/jcb.202103002
Контакты:
Skoltech Communications
+7 (495) 280 14 81
*protected email*
*protected email*
Динамическая жизнь гранулы гликогена
1. Рыбицкая К.К. (1996) Гликосомы – органеллы метаболизма гликогена. Клетка ткани 28, 253–265 10.1016/С0040-8166(96)80013-9 [PubMed] [CrossRef] [Google Scholar]
2.
Meyer F.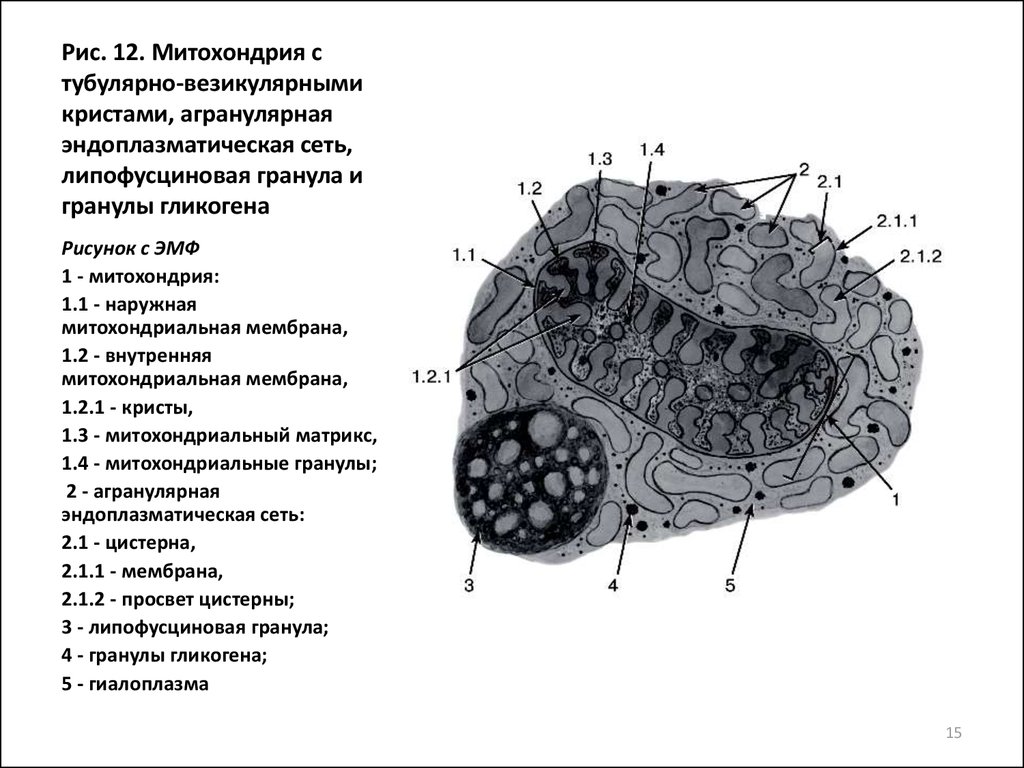 , Heilmeyer L.M. Jr., Haschke R.H. и Fischer E.H. (1970) Контроль активности фосфорилазы в частице мышечного гликогена. I. Выделение и характеристика белково-гликогенового комплекса. Дж. Биол. хим. 245, 6642–6648
[PubMed] [Академия Google]
, Heilmeyer L.M. Jr., Haschke R.H. и Fischer E.H. (1970) Контроль активности фосфорилазы в частице мышечного гликогена. I. Выделение и характеристика белково-гликогенового комплекса. Дж. Биол. хим. 245, 6642–6648
[PubMed] [Академия Google]
3. Дрохманс П. (1962) Морфология гликогена. Электронно-микроскопическое исследование негативных пятен частиц гликогена. Дж. Ультраструктур. Рез. 6, 141–163 10.1016/С0022-5320(62)
-3 [PubMed] [CrossRef] [Google Scholar]
4. Торнелл Л. Е. (1974) Тонкая структура гликогена волокна Пуркинье. Сравнительное исследование отрицательно окрашенных и цитохимически окрашенных частиц. Дж. Ультраструктур. Рез. 49, 157–166 10.1016/С0022-5320(74)80029-8 [PubMed] [CrossRef] [Академия Google]
5.
Салливан М. А., Арони С. Т., Ли С., Уоррен Ф. Дж., Джу Дж. С., Мак К. С., Стэплтон Д. И., Белл-Андерсон К. С. и Гилберт Р. Г. (2014) Изменения в структуре гликогена в течение цикла кормления проливают новый свет на контроль уровня глюкозы в крови.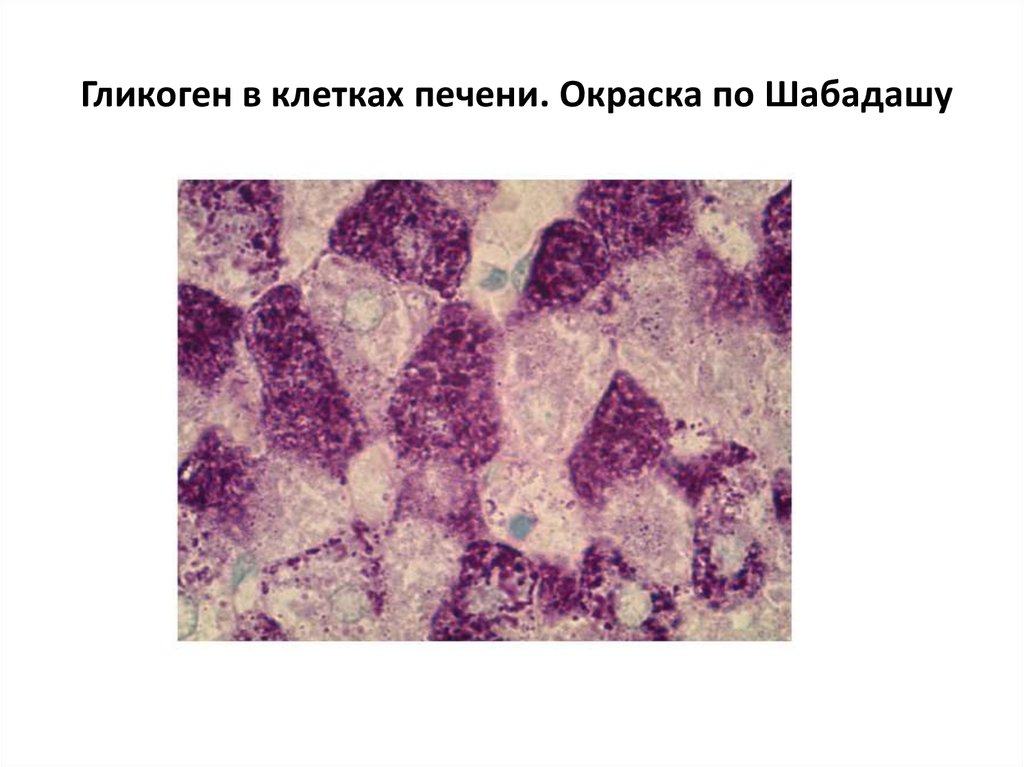 Биомакромолекулы
15, 660–665
10.1021/бм401714в
[PubMed] [CrossRef] [Google Scholar]
Биомакромолекулы
15, 660–665
10.1021/бм401714в
[PubMed] [CrossRef] [Google Scholar]
6. Смайт К. и Коэн П. (1991) Открытие гликогенина и первичного механизма биогенеза гликогена. Евро. Дж. Биохим. 200, 625–631 10.1111/j.1432-1033.1991.tb16225.x [PubMed] [CrossRef] [Google Scholar]
7. Мелендес Р., Мелендес-Хевиа Э. и Касканте М. (1997) Как эволюционировала структура гликогена, чтобы удовлетворить потребность в быстрой мобилизации глюкозы? Проблема физических ограничений при строительстве конструкций. Дж. Мол. Эвол. 45, 446–455 10.1007/PL00006249 [PubMed] [CrossRef] [Google Scholar]
8. Голдсмит Э., Спранг С. и Флеттерик Р. (1982) Структура мальтогептаозы с помощью разностных методов Фурье и модель гликогена. Дж. Мол. биол. 156, 411–427 10.1016/0022-2836(82)
-9 [PubMed] [CrossRef] [Google Scholar] 9.
Ширер Дж. и Грэм Т.Е. (2004) Новые аспекты гликогена скелетных мышц и его регуляция во время отдыха и упражнений. Упражнение Спортивная наука. Откр.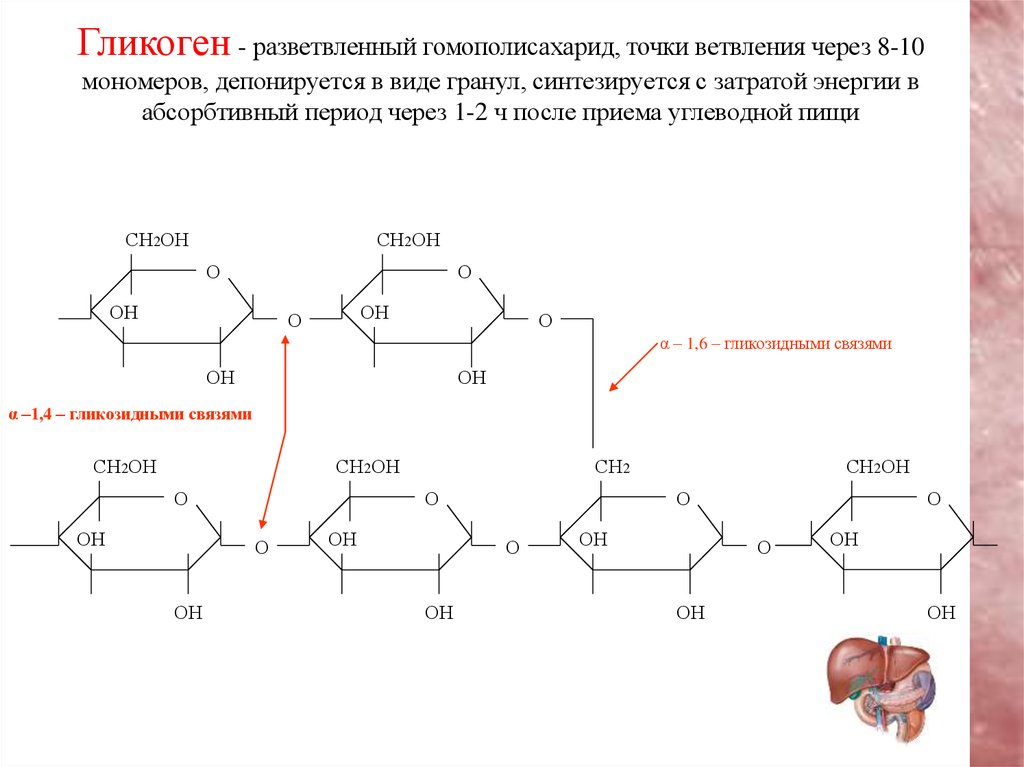 32, 120–126.
10.1097/00003677-200407000-00008
[PubMed] [CrossRef] [Google Scholar]
32, 120–126.
10.1097/00003677-200407000-00008
[PubMed] [CrossRef] [Google Scholar]
10. Мелендес-Хевиа Э., Уодделл Т.Г. и Шелтон Э.Д. (1993) Оптимизация молекулярного дизайна в эволюции метаболизма: молекула гликогена. Биохим. Дж. 295, 477–483. 10.1042/bj2950477 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Orrell S.A. и Bueding E. (1964) Сравнение продуктов, полученных с помощью различных процедур, используемых для экстракции гликогена. Дж. Биол. хим. 239, 4021–4026 [PubMed] [Google Scholar]
12. Салливан М. А., Вилаплана Ф., Кейв Р. А., Стэплтон Д., Грей-Уил А. А. и Гилберт Р. Г. (2010) Природа α- и β-частиц в гликогене с использованием распределения молекулярных размеров. Биомакромолекулы 11, 1094–1100 гг. 10.1021/бм100074п [PubMed] [CrossRef] [Google Scholar]
13.
Смайт К., Виллар-Паласи К. и Коэн П. (1989) Структурно-функциональные исследования гликогенина печени кролика. Евро. Дж. Биохим. 183, 205–209
10.1111/j.1432-1033. 1989.tb14914.x
[PubMed] [CrossRef] [Google Scholar]
1989.tb14914.x
[PubMed] [CrossRef] [Google Scholar]
14. Салливан М.А., О’Коннор М.Дж., Умана Ф., Роура Э., Джек К., Стэплтон Д.И. и Гилберт Р.Г. (2012) Молекулярный анализ образования α-частиц гликогена. Биомакромолекулы 13, 3805–3813 10.1021/бм3012727 [PubMed] [CrossRef] [Google Scholar]
15. Геддес Р., Харви Дж. Д. и Уиллс П. Р. (1977) Молекулярный размер и форма гликогена печени. Биохим. Ж. 163, 201–209.10.1042/bj1630201 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Wilstfittcr R. и Rohdewald M. (1934) Uber den zustand des glykogens in der leben, in muskel, und in leukocyten. Z Хоппе Сейлера . Физиол. хим. 225, 103–124 10.1515/bchm2.1934.225.2-3.103 [CrossRef] [Google Scholar]
17. Розати Г. (1967) Ферментативная обработка частиц гликогена в печени и мышцах крыс. Дж. Ультраструктур. Рез. 18, 444–455 10.1016/С0022-5320(67)80129-1 [PubMed] [CrossRef] [Академия Google]
18.
Роу Дж. Х., Бейли Дж. М., Грей Р. Р. и Робинсон Дж. Н. (1961) Полное удаление гликогена из тканей путем экстракции холодным раствором трихлоруксусной кислоты. Дж. Биол. хим. 236, 1244–1246 гг.
[PubMed] [Google Scholar]
и Робинсон Дж. Н. (1961) Полное удаление гликогена из тканей путем экстракции холодным раствором трихлоруксусной кислоты. Дж. Биол. хим. 236, 1244–1246 гг.
[PubMed] [Google Scholar]
19. Ломако Дж., Ломако В.М. и Уилан В.Дж. (1991) Прогликоген: низкомолекулярная форма мышечного гликогена. ФЭБС лат. 279, 223–228 10.1016/0014-5793(91)80154-У [PubMed] [CrossRef] [Google Scholar]
20. Ломако Дж., Ломако В. М., Уилан В. Дж., Домбро Р. С., Нири Дж. Т. и Норенберг М. Д. (1993) Синтез гликогена в астроците: от гликогенина к прогликогену к гликогену. FASEB J. 7, 1386–1393 гг. 10.1096/fasebj.7.14.8224611 [PubMed] [CrossRef] [Google Scholar]
21. Адамо К.Б. и Грэм Т.Е. (1998) Сравнение традиционных измерений с анализом макрогликогена и прогликогена мышечного гликогена. Дж. Заявл. Физиол. 84, 908–913 10.1152/яппл.1998.84.3.908 [PubMed] [CrossRef] [Google Scholar]
22.
Янссон Э. (1981) Кислоторастворимый и нерастворимый гликоген в скелетных мышцах человека. Акта Физиол.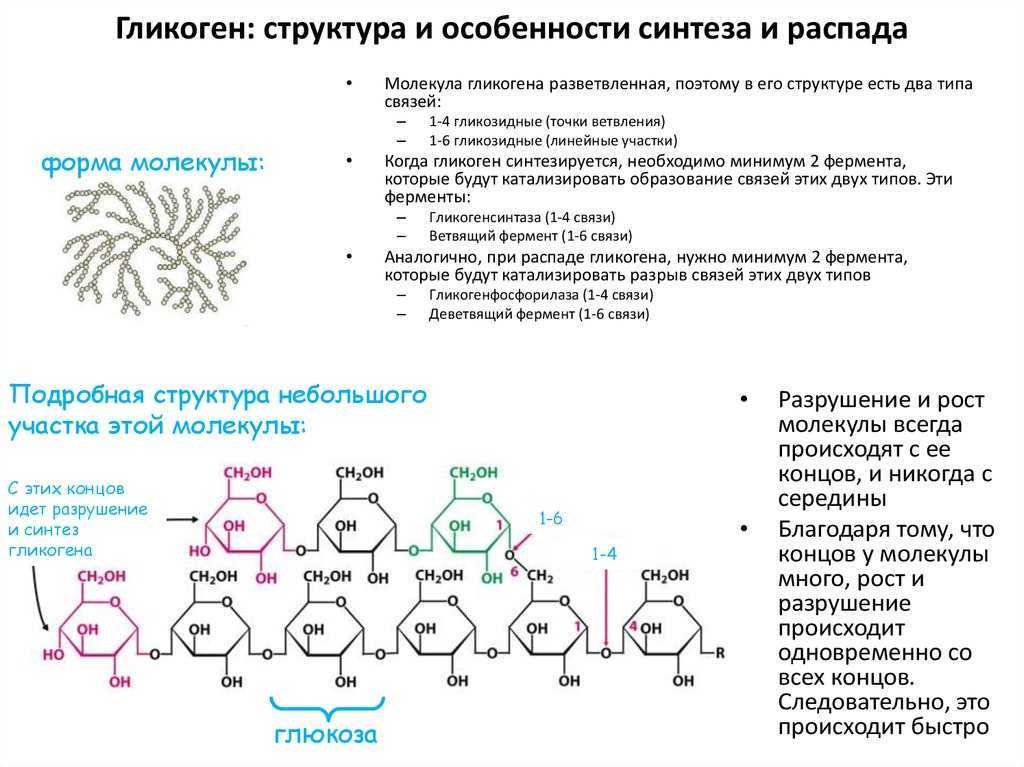 Сканд. 113, 337–340
10.1111/j.1748-1716.1981.tb06904.x
[PubMed] [CrossRef] [Google Scholar]
Сканд. 113, 337–340
10.1111/j.1748-1716.1981.tb06904.x
[PubMed] [CrossRef] [Google Scholar]
23. Джеймс А. П., Барнс П. Д., Палмер Т. Н. и Фурнье П. А. (2008) Прогликоген и макрогликоген: артефакты экстракции гликогена? Метаболизм 57, 535–543 10.1016/j.metabol.2007.11.017 [PubMed] [CrossRef] [Google Scholar]
24. Hurley T.D., Walls C., Bennett J.R., Roach P.J. и Wang M. (2006)Прямое обнаружение продуктов реакции гликогенина во время инициации гликогена. Биохим. Биофиз. Рез. коммун. 348, 374–378 10.1016/j.bbrc.2006.07.106 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Smythe C., Caudwell F.B., Ferguson M. и Cohen P. (1988) Выделение и структурный анализ пептида, содержащего новую тирозил-глюкозную связь в гликогенине. EMBO J. 7, 2681–2686. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Lin A., Mu J., Yang J. и Roach P.J. (1999) Самоглюкозилирование гликогенина, инициатора биосинтеза гликогена, включает межсубъединичную реакцию.
27. Скурат А.В., Дитрих А.Д. и Роуч П.Дж. (2006) Взаимодействие между гликогенином и гликогенсинтазой. Арка Биохим. Биофиз. 456, 93–97 10.1016/j.abb.2006.09.024 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Смайт С., Уатт П. и Коэн П. (1990) Дальнейшие исследования роли гликогенина в биосинтезе гликогена. Евро. Дж. Биохим. 189, 199–204 10.1111/j.1432-1033.1990.tb15477.x [PubMed] [CrossRef] [Google Scholar]
29. Тон В. Дж., Халил М. и Кэннон Дж. Ф. (1993) Выделение кДНК фермента разветвления гликогена человека путем скрининга комплементации в дрожжах. Дж. Биол. хим. 268, 7509–7513 [PubMed] [Google Scholar]
30. Мелендес Р., Мелендес-Хевиа Э. и Канела Э. И. (1999) Фрактальная структура гликогена: умное решение для оптимизации клеточного метаболизма. Биофиз. Дж. 77, 1327–1332 гг. 10.1016/С0006-3495(99)76982-1 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Мелендес Р., Мелендес-Эвиа Э., Мас Ф., Мах Дж. и Касканте М., Р. (1998) Физические ограничения синтеза гликогена, влияющие на его структурную однородность: двумерный подход. Биофиз. Ж. 75, 106–114.
10.1016/С0006-3495(98)77498-3
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мелендес Р., Мелендес-Эвиа Э., Мас Ф., Мах Дж. и Касканте М., Р. (1998) Физические ограничения синтеза гликогена, влияющие на его структурную однородность: двумерный подход. Биофиз. Ж. 75, 106–114.
10.1016/С0006-3495(98)77498-3
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Баке С., Гиноварт Дж. Дж. и Феррер Дж. К. (1997) Гликогенин, праймер синтеза гликогена, связывается с актином. ФЭБС лат. 417, 355–359 10.1016/С0014-5793(97)01299-4 [PubMed] [CrossRef] [Google Scholar]
33. Сид Э., Сифуэнтес Д., Баке С., Феррер Дж. К. и Гиноварт Дж. Дж. (2005) Детерминанты ядерно-цитоплазматического перемещения мышечной гликогенсинтазы. ФЕБС Дж. 272, 3197–3213 10.1111/j.1742-4658.2005.04738.x [PubMed] [CrossRef] [Google Scholar]
34. Уилсон В. А., Бойер М. П., Дэвис К. Д., Берк М. и Роуч П. Дж. (2010) Субклеточная локализация дрожжевой гликогенсинтазы зависит от содержания гликогена. Может. Дж. Микробиол. 56, 408–420 10.1139/В10-027 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Оу Х., Ян Л., Османович С., Гринберг С.С. и Брэди М.Дж. (2005)Пространственная реорганизация гликогенсинтазы при активации в адипоцитах 3T3-L1. Эндокринология
146, 494–502
10.1210/en.2004-1022
[PubMed] [CrossRef] [Google Scholar]
Оу Х., Ян Л., Османович С., Гринберг С.С. и Брэди М.Дж. (2005)Пространственная реорганизация гликогенсинтазы при активации в адипоцитах 3T3-L1. Эндокринология
146, 494–502
10.1210/en.2004-1022
[PubMed] [CrossRef] [Google Scholar]
36. Фернандес-Новелл Дж. М., Беллидо Д., Виларо С. и Гиноварт Дж. Дж. (1997) Глюкоза индуцирует транслокацию гликогенсинтазы в кору клеток гепатоцитов крысы. Биохим. Дж. 321, 227–231. 10.1042/bj3210227 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Prats C., Cadefau JA, Cussó R., Qvortrup K., Nielsen JN, Wojtaszewski JF, Wojtaszewki JF, Hardie DG, Stewart G., Hansen BF и Ploug T. (2005) Зависимая от фосфорилирования транслокация гликогенсинтазы в новая структура во время ресинтеза гликогена. Дж. Биол. хим. 280, 23165–23172 10.1074/jbc.M502713200 [PubMed] [CrossRef] [Академия Google]
38.
Prats C., Helge JW, Nordby P., Qvortrup K., Ploug T., Dela F. и Wojtaszewski JF (2009) Двойная регуляция мышечной гликогенсинтазы во время упражнений путем активации и компартментализации. Дж. Биол. хим. 284, 15692–15700
10.1074/jbc.M
Дж. Биол. хим. 284, 15692–15700
10.1074/jbc.M
5200 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Маршан И., Чорнейко К., Тарнопольский М., Гамильтон С., Ширер Дж., Потвин Дж. и Грэм Т.Е. (2002)Количественная оценка субклеточного гликогена в мышцах человека в состоянии покоя: размер, количество и расположение гранул. Дж. Заявл. Физиол. 93, 1598–1607 гг. 10.1152/japplphysiol.00585.2001 [PubMed] [CrossRef] [Google Scholar]
40. Elsner P., Quistorff B., Hansen G.H. и Grunnet N. (2002)Частично упорядоченный синтез и расщепление гликогена в культивируемых крысиных мышечных трубках. Дж. Биол. хим. 277, 4831–4838 10.1074/jbc.M108226200 [PubMed] [CrossRef] [Google Scholar]
41. Девос П. и Херс Х.Г. (1979) Молекулярный порядок в синтезе и деградации гликогена в печени. Евро. Дж. Биохим. 99, 161–167 10.1111/j.1432-1033.1979.tb13242.x [PubMed] [CrossRef] [Google Scholar]
42.
Oe Y., Baba O., Ashida H., Nakamura KC и Hirase H. (2016) Распределение гликогена в мозге мышей, фиксированных микроволновым излучением, выявляет гетерогенные астроцитарные паттерны. Глия
64, 1532–1545 гг.
10.1002/глиа.23020
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Глия
64, 1532–1545 гг.
10.1002/глиа.23020
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Накамура-Цурута С., Ясуда М., Накамура Т., Шинода Э., Фуруясики Т., Какутани Р., Таката Х., Като Ю. и Ашида Х. (2012) Сравнительный анализ особенностей связывания углеводов двух моноклональные антитела к гликогену с помощью ИФА и поверхностного плазмонного резонанса. углевод. Рез. 350, 49–54 10.1016/j.carres.2011.12.029 [PubMed] [CrossRef] [Google Scholar]
44. Скурат А.В., Лим С.С. и Роуч П.Дж. (1997)Биогенез гликогенина в фибробластах крысы-1, экспрессирующих гликогенин мышц кролика. Евро. Дж. Биохим. 245, 147–155 10.1111/j.1432-1033.1997.t01-1-00147.x [PubMed] [CrossRef] [Google Scholar]
45. Скурат А.В., Пэн Х.Л., Чанг Х.Ю., Кэннон Дж.Ф. и Роуч П.Дж. (1996) Стадии, определяющие скорость биосинтеза гликогена в клетках COS. Арка Биохим. Биофиз. 328, 283–288 10.1006/abbi.1996.0174 [PubMed] [CrossRef] [Google Scholar]
46.
Цао Ю., Скурат А. В., ДеПаоли-Роуч А.А. и Роуч П.Дж. (1993) Инициация синтеза гликогена: контроль гликогенина с помощью гликогенфосфорилазы. Дж. Биол. хим. 268, 21717–21721
[PubMed] [Google Scholar]
В., ДеПаоли-Роуч А.А. и Роуч П.Дж. (1993) Инициация синтеза гликогена: контроль гликогенина с помощью гликогенфосфорилазы. Дж. Биол. хим. 268, 21717–21721
[PubMed] [Google Scholar]
47. Hansen B.F., Derave W., Jensen P. и Richter E.A. (2000) Отсутствие ограничивающей роли гликогенина в определении максимально достижимых уровней гликогена в скелетных мышцах крыс. Являюсь. Дж. Физиол. Эндокринол. Метаб. 278, Е398–Е404 10.1152/айпендо.2000.278.3.E398 [PubMed] [CrossRef] [Google Scholar]
48. Монтори-Грау М., Гитарт М., Гарсия-Мартинес С., Ороско А. и Гомес-Фойкс А. (2011) Дифференциальная картина накопления гликогена после сверхэкспрессии субъединицы PPP1R6, нацеленной на гликоген протеинфосфатазы 1, по сравнению с PPP1R3C и PPP1R3A , в клетках скелетных мышц. БМС Биохим. 12, 57 10.1186/1471-2091-12-57 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49.
Тальябраччи В.С., Жирар Дж.М., Сегвич Д., Мейер С., Тернбулл Дж., Чжао Х., Минасян Б.А., Депаоли-Роуч А. А. и Роуч П.Дж. (2008)Аномальный метаболизм гликогенфосфата как причина болезни Лафора. Дж. Биол. хим. 283, 33816–33825
10.1074/jbc.M807428200
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
А. и Роуч П.Дж. (2008)Аномальный метаболизм гликогенфосфата как причина болезни Лафора. Дж. Биол. хим. 283, 33816–33825
10.1074/jbc.M807428200
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Тальябраччи В.С., Тернбулл Дж., Ван В., Жирар Дж.-М., Чжао X., Скурат А.В., Дельгадо-Эскуэта А.В., Минасян Б.А., Депаоли-Роуч А.А. и Роуч П.Дж. (2007) Лафорин представляет собой гликогенфосфатазу, дефицит которого приводит к повышенному фосфорилированию гликогена in vivo . проц. Натл. акад. науч. США 104, 19262–19266 гг. 10.1073/пнас.0707952104 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51.
Тернбулл Дж., Тиберия Э., Перейра С., Чжао Х., Пенсеа Н., Уилер А. Л., Ю В. К., Ивович А., Наранян Т., Исраэлян Н., Драгинов А., Пилигуян М., Франкланд П. В., Ван P., Ackerley C.A., et al. (2013) Дефицит белка, связанного с гликогенсинтазой, Epm2aip1, вызывает снижение синтеза гликогена и резистентность печени к инсулину. Дж. Биол. хим. 288, 34627–34637
10. 1074/jbc.M113.483198
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1074/jbc.M113.483198
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Джентри М.С., Гиноварт Дж.Дж., Минасян Б.А., Роуч П.Дж. и Серратоса Дж.М. (февраль 26, 2018) Гликоген, болезнь Лафора предлагает уникальное окно в нейроны. Дж. Биол. хим. 293, 7117–7125 10.1074/jbc.R117.803064 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Ломако Дж., Ломако В.М., Киркман Б.Р. и Уилан В.Дж. (1994) Роль фосфата в мышечном гликогене. Биофакторы 4, 167–171 [PubMed] [Академия Google]
54. Беккер Дж. А., Влах Дж., Рабен Н., Нагараю К., Адамс Э. М., Херманс М. М., Реузер А. Дж., Брукс С. С., Тиффт С. Дж., Хиршхорн Р., Хьюи М. Л., Николино М. и Плотц П. Х. (1998) Африканское происхождение распространенной мутации у афроамериканских пациентов с болезнью накопления гликогена II типа. Являюсь. Дж. Хам. Жене. 62, 991–994 10.1086/301788 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55.
Wanson JC и Drochmans P. (1972) Роль саркоплазматического ретикулума в метаболизме гликогена.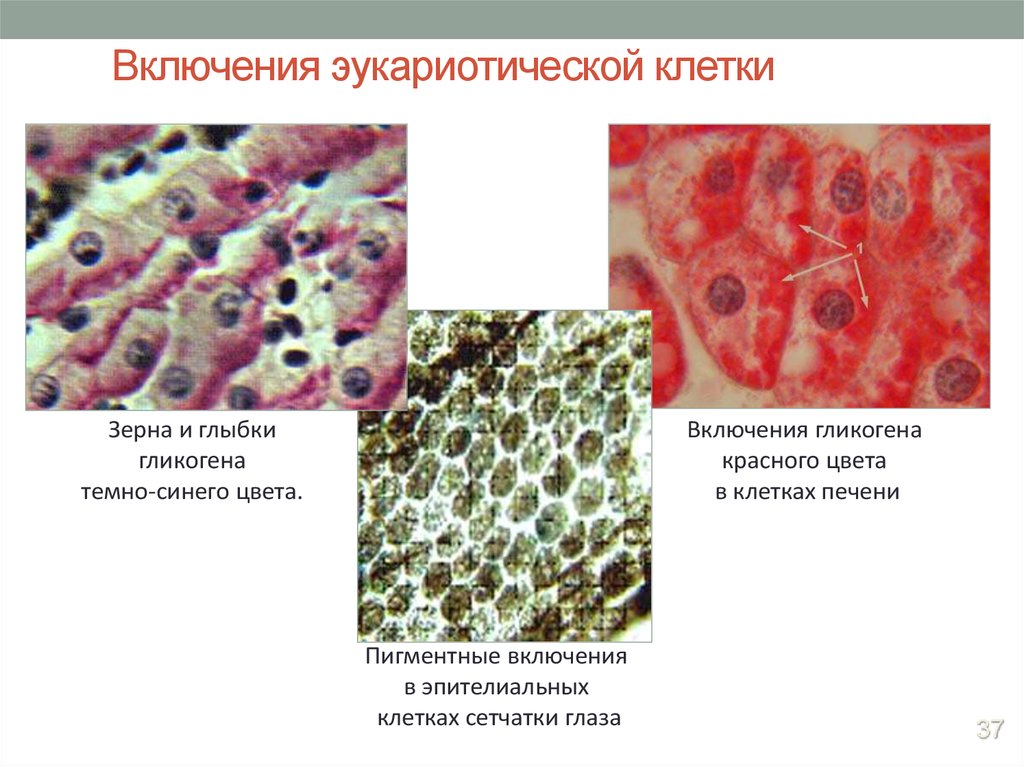 Связывание комплексов фосфорилазы, киназы фосфорилазы и праймера с сарковезикулами скелетных мышц кролика. Дж. Клеточная биология. 54, 206–224
10.1083/jcb.54.2.206
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Связывание комплексов фосфорилазы, киназы фосфорилазы и праймера с сарковезикулами скелетных мышц кролика. Дж. Клеточная биология. 54, 206–224
10.1083/jcb.54.2.206
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Энтман М.Л., Кесленский С.С., Чу А. и Ван Винкль В.Б. (1980)Саркоплазматический ретикулум-гликогенолитический комплекс в быстро сокращающихся скелетных мышцах млекопитающих. Предложен аналог in vitro гликогенолитического пула, активируемого сокращением. Дж. Биол. хим. 255, 6245–6252 [PubMed] [Google Scholar]
57. Энтман М.Л., Борнет Э.П., Ван Винкль В.Б., Гольдштейн М.А. и Шварц А. (1977) Ассоциация гликогенолиза с кардиальным саркоплазматическим ретикулумом: II. Эффект истощения гликогена, солюбилизация дезоксихолата и ишемия сердца: свидетельство мембранного комплекса фосфорилазы киназы. Дж. Мол. Клетка. Кардиол. 9, 515–528 10.1016/С0022-2828(77)80367-2 [PubMed] [CrossRef] [Google Scholar]
58.
Müller M.S., Fox R., Schousboe A. , Waagepetersen H.S. и Bak L.K. (2014)Гликогенолиз астроцитов запускается депо-управляемым входом кальция и обеспечивает метаболическую энергию для клеточного гомеостаза кальция. Глия
62, 526–534
10.1002/глиа.22623
[PubMed] [CrossRef] [Google Scholar]
, Waagepetersen H.S. и Bak L.K. (2014)Гликогенолиз астроцитов запускается депо-управляемым входом кальция и обеспечивает метаболическую энергию для клеточного гомеостаза кальция. Глия
62, 526–534
10.1002/глиа.22623
[PubMed] [CrossRef] [Google Scholar]
59. Schmid H., Pfeiffer-Guglielmi B., Dolderer B., Thiess U., Verleysdonk S. и Hamprecht B. (2009)Экспрессия мозговых и мышечных изоформ гликогенфосфорилазы в сердце крысы. Нейрохим. Рез. 34, 581–586 10.1007/s11064-008-9825-3 [PubMed] [CrossRef] [Google Scholar]
60. Мюллер М.С., Педерсен С.Е., Уоллс А.Б., Ваагепетерсен Х.С. и Бак Л.К. (2015)Изоформно-селективная регуляция гликогенфосфорилазы путем лишения энергии и фосфорилирования в астроцитах. Глия 63, 154–162 10.1002/глиа.22741 [PubMed] [CrossRef] [Google Scholar]
61.
Jakobsen E., Bak LK, Walls AB, Reuschlein A.-K., Schousboe A. и Waagepetersen HS (2017)Активность гликогенового шунта и гликолитическая суперкомпенсация в астроцитах могут быть явно опосредованы через мышечную форму гликогенфосфорилазы.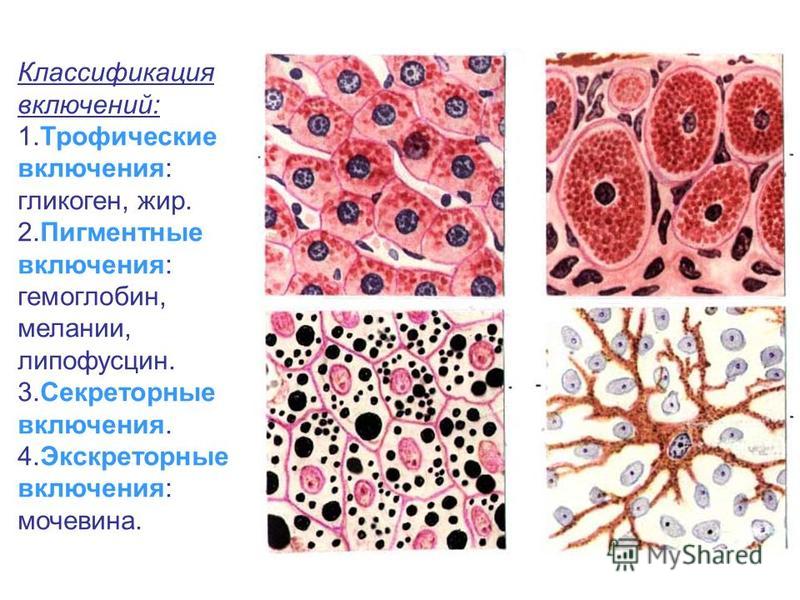 Нейрохим. Рез. 42, 2490–2494
10.1007/с11064-017-2267-з
[PubMed] [CrossRef] [Google Scholar]
Нейрохим. Рез. 42, 2490–2494
10.1007/с11064-017-2267-з
[PubMed] [CrossRef] [Google Scholar]
62. Геддес Р., Джеяратан П. и Тейлор Дж. А. (1992) Молекулярные и метаболические аспекты лизосомального гликогена. углевод. Рез. 227, 339–349 10.1016/0008-6215(92)85083-С [PubMed] [CrossRef] [Google Scholar]
63. Котулас О.Б., Каламидас С.А. и Кондомеркос Д.Дж. (2004) Аутофагия гликогена. микроск. Рез. Тех. 64, 10–20 10.1002/жемт.20046 [PubMed] [CrossRef] [Google Scholar]
64. Роуч П.Дж., Депаоли-Роуч А.А., Херли Т.Д. и Тальябраччи В.С. (2012)Гликоген и его метаболизм: некоторые новые разработки и старые темы. Биохим. Дж. 441, 763–787. 10.1042/БДЖ20111416 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Schneider JL, Suh Y. и Cuervo A.M. (2014) Дефицит шаперон-опосредованной аутофагии в печени приводит к метаболической дисрегуляции. Клеточный метаб. 20, 417–432 10.1016/j.cmet.2014.06.009 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Голдберг А.Л. (2003)Распад белков и защита от неправильно свернутых или поврежденных белков. Природа
426, 895–899
10.1038/природа02263
[PubMed] [CrossRef] [Google Scholar]
Голдберг А.Л. (2003)Распад белков и защита от неправильно свернутых или поврежденных белков. Природа
426, 895–899
10.1038/природа02263
[PubMed] [CrossRef] [Google Scholar]
67. Ченг А., Чжан М., Джентри М.С., Уорби С.А., Диксон Дж.Е. и Салтиель А.Р. (2007) Роль убиквитинирования AGL в нарушениях накопления гликогена при болезни Лафора и Кори. Гены Дев. 21, 2399–2409 10.1101/гад.1553207 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Worby C.A., Gentry M.S. и Dixon J.E. (2008)Малин уменьшает накопление гликогена, способствуя деградации белка, направленного на гликоген (PTG). Дж. Биол. хим. 283, 4069–4076 10.1074/jbc.M708712200 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69.
Вилчес Д., Рос С., Сифуэнтес Д., Пухадас Л., Валлес Х., Гарсия-Фохеда Б., Криадо-Гарсия О., Фернандес-Санчес Э., Медраньо-Фернандес И., Домингес Х., Гарсия- Роча М., Сориано Э., Родригес де Кордоба С. и Гиноварт Дж. Дж. (2007) Механизм подавления синтеза гликогена в нейронах и его гибель при прогрессирующей миоклонусной эпилепсии.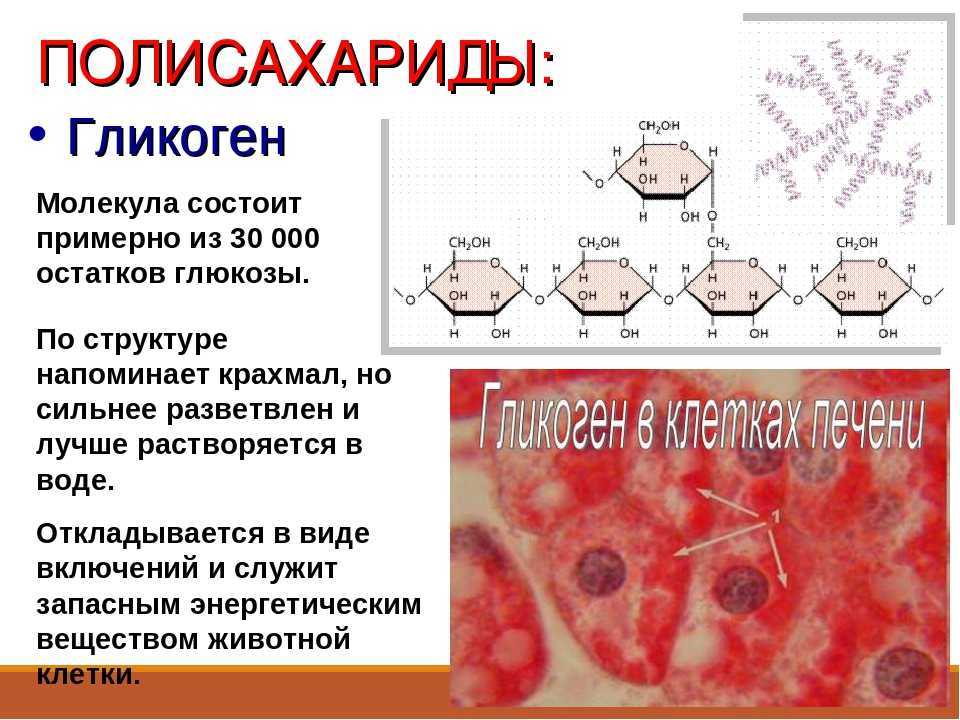 Нац. Неврологи. 10, 1407–1413 гг.
10.1038/nn1998
[PubMed] [CrossRef] [Google Scholar]
Нац. Неврологи. 10, 1407–1413 гг.
10.1038/nn1998
[PubMed] [CrossRef] [Google Scholar]
70. Цзян С., Хеллер Б., Тальябраччи В.С., Чжай Л., Иримиа Дж.М., ДеПаоли-Роуч А.А., Уэллс К.Д., Скурат А.В. и Роуч П.Дж. (2010) Белок 1/генетонин 1, содержащий крахмалсвязывающий домен, является новым участником метаболизм гликогена. Дж. Биол. хим. 285, 34960–34971 10.1074/jbc.M110.150839 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Jiang S., Wells CD и Roach PJ (2011)Белок 1, содержащий домен связывания крахмала (Stbd1), и метаболизм гликогена: идентификация взаимодействующего мотива семейства Atg8 (AIM) в Stbd1, необходимого для взаимодействия с GABARAPL1. Биохим. Биофиз. Рез. коммун. 413, 420–425 10.1016/j.bbrc.2011.08.106 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72.
Такадо Ю., Нотт Г., Хамбель Б. М., Эскриг С., Масуди М., Мейбом А. и Комментарий А. (2015) Визуализация метаболизма гликогена в печени и мозге в нанометровом масштабе.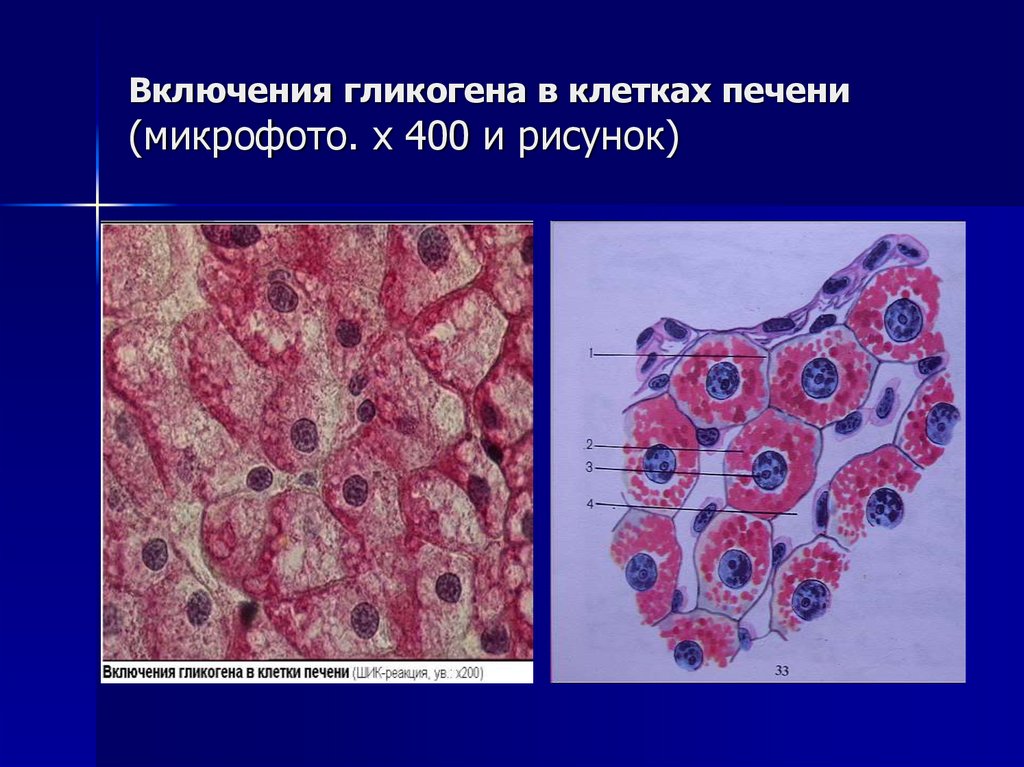 Наномедицина
11, 239–245
10.1016/j.nano.2014.09.007
[PubMed] [CrossRef] [Google Scholar]
Наномедицина
11, 239–245
10.1016/j.nano.2014.09.007
[PubMed] [CrossRef] [Google Scholar]
73. Nielsen J., Schrøder H.D., Rix C.G. и Ortenblad N. (2009) Отчетливые эффекты субклеточной локализации гликогена на время тетанической релаксации и выносливость в скелетных мышечных волокнах крыс с механически снятой кожей. Дж. Физиол. 587, 3679–3690 10.1113/jphysiol.2009.174862 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Нильсен Дж., Холмберг Х.-К., Шредер Х.Д., Салтин Б. и Ортенблад Н. (2011)Утилизация гликогена скелетных мышц человека при истощающих упражнениях: роль субклеточной локализации и типа волокон. Дж. Физиол. 589, 2871–2885 10.1113/Жфизиол.2010.204487 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75.
Деметриаду А., Моралес-Санфрутос Дж., Неарху М., Баба О., Кириаку К., Тейт Э. В., Друсиоту А. и Петру П. П. (2017) Мышь Stbd1 — 9 лет0033 N — миристоилируется и влияет на ассоциацию ER-митохондрий и митохондриальную морфологию.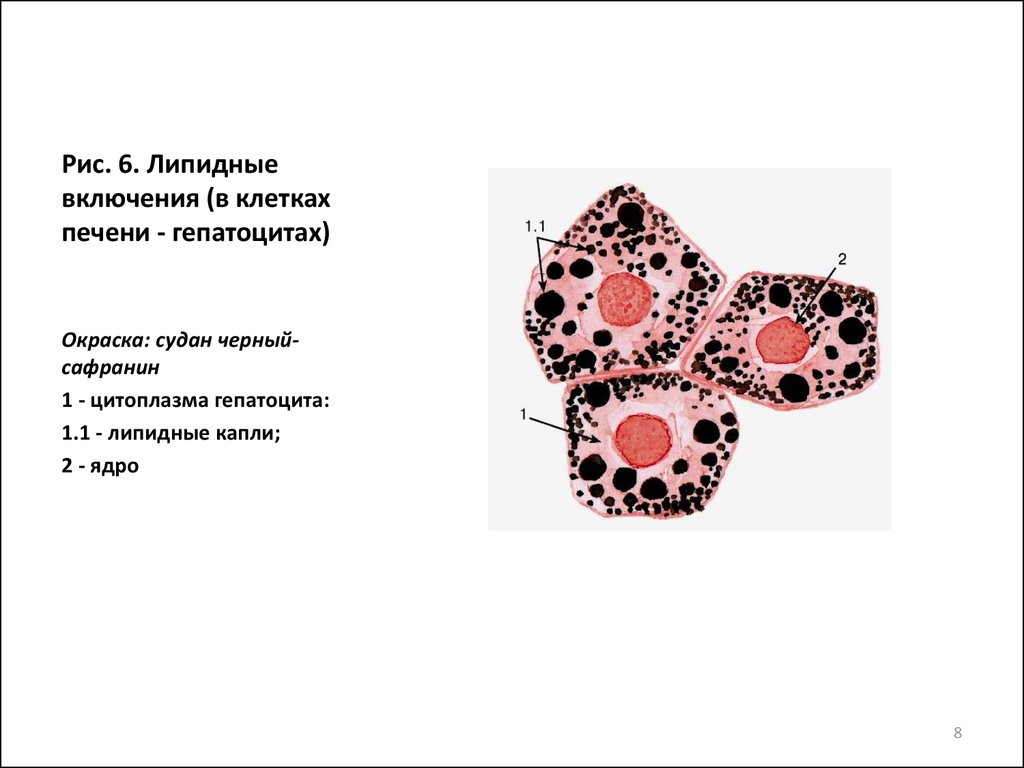 Дж. Клеточные науки. 130, 903–915
10.1242/jcs.195263
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Клеточные науки. 130, 903–915
10.1242/jcs.195263
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Серратоса Дж. М., Минасян Б. А. и Ганеш С. (2012) Прогрессирующая миоклонус-эпилепсия Лафоры в «Основных механизмах эпилепсии» Джаспера (Нобельс Дж. Л., Аволи М., Рогавски М. А., Олсен Р. В. и Дельгадо-Эскуэта А. В., ред.) 4-е изд. , NCBI, Бетесда, Мэриленд: [Академия Google]
77. Ганеш С., Пури Р., Сингх С., Миттал С. и Дубей Д. (2006) Недавние достижения в изучении молекулярной основы прогрессирующей миоклонусной эпилепсии Лафоры. Дж. Хам. Жене. 51, 1–8 10.1007/s10038-005-0321-1 [PubMed] [CrossRef] [Google Scholar]
78. Барнс П.Д., Сингх А. и Фурнье П.А. (2009) Зависимые от гомогенизации ответы кислоторастворимого и кислотонерастворимого гликогена на упражнения и возобновление питания в мышцах человека. Метаболизм 58, 1832–1839 гг. 10.1016/j.метабол.2009.06.016 [PubMed] [CrossRef] [Академия Google]
79.
Карделл Р.Р. и Карделл Э. Л. (1990) Неоднородность распределения гликогена в гепатоцитах. Дж. Электрон Микроск. Тех. 14, 126–139
10.1002/жемт.1060140206
[PubMed] [CrossRef] [Google Scholar]
Л. (1990) Неоднородность распределения гликогена в гепатоцитах. Дж. Электрон Микроск. Тех. 14, 126–139
10.1002/жемт.1060140206
[PubMed] [CrossRef] [Google Scholar]
80. Апвайлер Р., Байрох А., Ву Ч. Х., Баркер В. К., Бекманн Б., Ферро С., Гастайгер Э., Хуанг Х., Лопес Р., Магране М., Мартин М. Дж., Натале Д. А., О’Донован К., Редаски Н. и Е Л.-С. (2004) UniProt: база знаний Universal Protein. Нуклеиновые Кислоты Res. 32, Д115–Д11910.1093/нар/гх231 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Чатр-Арьямонтри А., Утред Р., Буше Л., Раст Дж., Чанг С., Колас Н.К., О’Доннелл Л., Остер С., Тисфельд С., Селлам А., Старк С., Брайткройц Б.- Дж., Долински К. и Тайерс М. (2017) База данных взаимодействия BioGRID: обновление 2017 года. Нуклеиновые Кислоты Res. 45, Д369–Д379 10.1093/нар/gkw1102 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82.
Орчард С., Аммари М., Аранда Б., Бреуза Л., Бриганти Л., Брокес-Картер Ф., Кэмпбелл Н. Х., Чавали Г. , Чен К., Дель-Торо Н., Дюсбери М., Дюмуссо М. , Galeota E., Hinz U., Iannuccelli M., et al. (2014) Проект MINtAct – IntAct как общая платформа для курирования 11 баз данных молекулярного взаимодействия. Нуклеиновые Кислоты Res. 42, Д358–Д363
10.1093/нар/гкт1115
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Чен К., Дель-Торо Н., Дюсбери М., Дюмуссо М. , Galeota E., Hinz U., Iannuccelli M., et al. (2014) Проект MINtAct – IntAct как общая платформа для курирования 11 баз данных молекулярного взаимодействия. Нуклеиновые Кислоты Res. 42, Д358–Д363
10.1093/нар/гкт1115
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
«Glycogen Granule» Revisited | Микроскопия Сегодня
Фильтр поиска панели навигации Микроскопия сегодняЭтот выпускБиологические наукиКнигиЖурналыOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации Микроскопия сегодняЭтот выпускБиологические наукиКнигиЖурналыOxford Academic Введите поисковый запрос
Расширенный поиск
Журнальная статья
Кристина Рыбицкая
Кристина Рыбицкая
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Microscopy Today , том 2, выпуск 7, 1 октября 1994 г.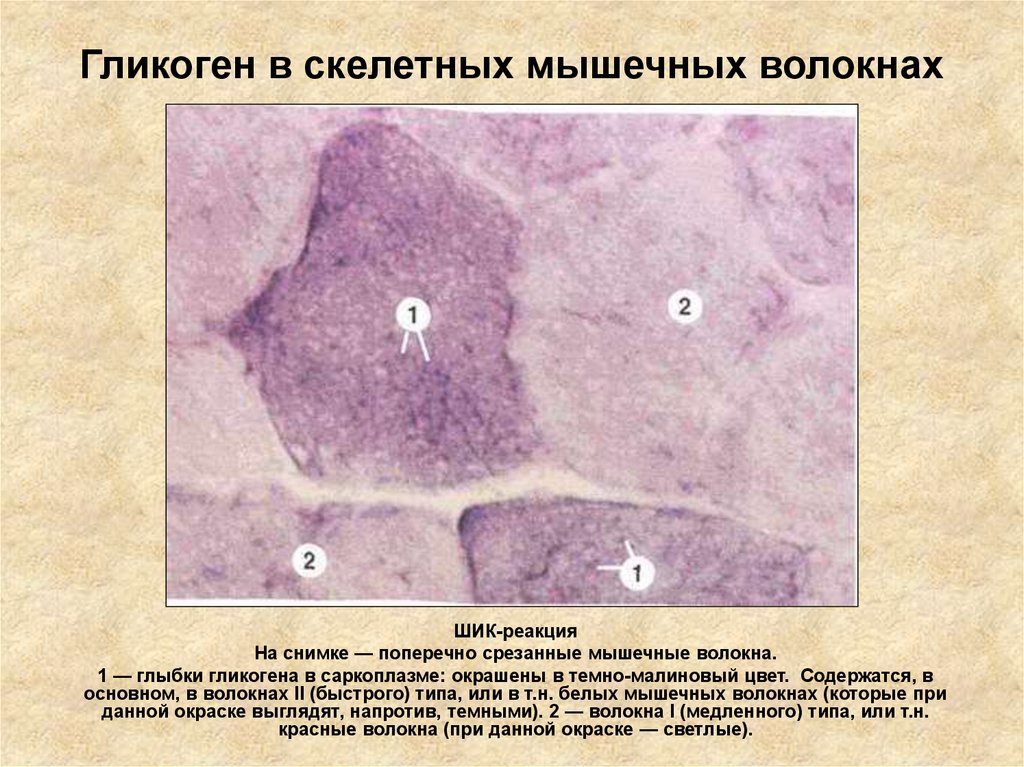 , страницы 16–18, https://doi.org/10.1017/S1551929500066670
, страницы 16–18, https://doi.org/10.1017/S1551929500066670
Опубликовано:
14 марта 2018 г.
Фильтр поиска панели навигации Микроскопия сегодняЭтот выпускБиологические наукиКнигиЖурналыOxford Academic Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации Микроскопия сегодняЭтот выпускБиологические наукиКнигиЖурналыOxford Academic Введите поисковый запрос
Advanced Search
Существует разрыв между биохимическими данными и ультраструктурной интерпретацией «гранул гликогена». Биохимики признали, что гликоген содержит ковалентно связанные белки. К ним относятся ферменты, участвующие в метаболизме гликогена: гликогенин (белковый праймер, ответственный за инициацию синтеза гликогена), гликогенсинтаза и фосфорилаза и, предположительно, другие регуляторные ферменты. Структуры, образованные ассоциацией гликогена и белка, получили название белково-гликогеновых комплексов, рассматриваемых как протеогликаны, или как динамические клеточные органеллы, гликосомы.
Биохимики признали, что гликоген содержит ковалентно связанные белки. К ним относятся ферменты, участвующие в метаболизме гликогена: гликогенин (белковый праймер, ответственный за инициацию синтеза гликогена), гликогенсинтаза и фосфорилаза и, предположительно, другие регуляторные ферменты. Структуры, образованные ассоциацией гликогена и белка, получили название белково-гликогеновых комплексов, рассматриваемых как протеогликаны, или как динамические клеточные органеллы, гликосомы.
Возникает вопрос, почему биохимическое распознавание белкового компонента в гликосомах не подтверждено электронной микроскопией (ЭМ)? Этот белок виден на каждом срезе, окрашенном солями урана (U) и свинца (Pb), где он проявляется в виде гранул размером 20-30 нм (рис. 1). Однако эти гранулы обычно интерпретируются как гликоген, несмотря на то, что гликоген не реагирует с ионными соединениями и поэтому не окрашивается U-Pb.
1.
Майер
F
и др. .
.
1970
.
Журнал биол. хим.
246
,
6642
-6
2.
Смайт 9
8
3 9 &
Коэн
P
1991
Евро. Дж. Биохим.
200
,
625
-31.
3.
Белый
WJ
1986
BioEssays
5
,
036 036 036
036 0003
4.
Scott
RB
и
Still
WJS
1968
.
Дж. Клин. Вкладывать деньги.
47
,
353
-9
5.
Рыбицкая
3 К
901
02 1979
.
Вирхов. Арка B. Сотовый путь.
30
.
356
-47
6.
Тьери
JP
1967
.
J. Микроскоп.
6
,
987
–
1018
.
7.
Росати
G
1967
Дж.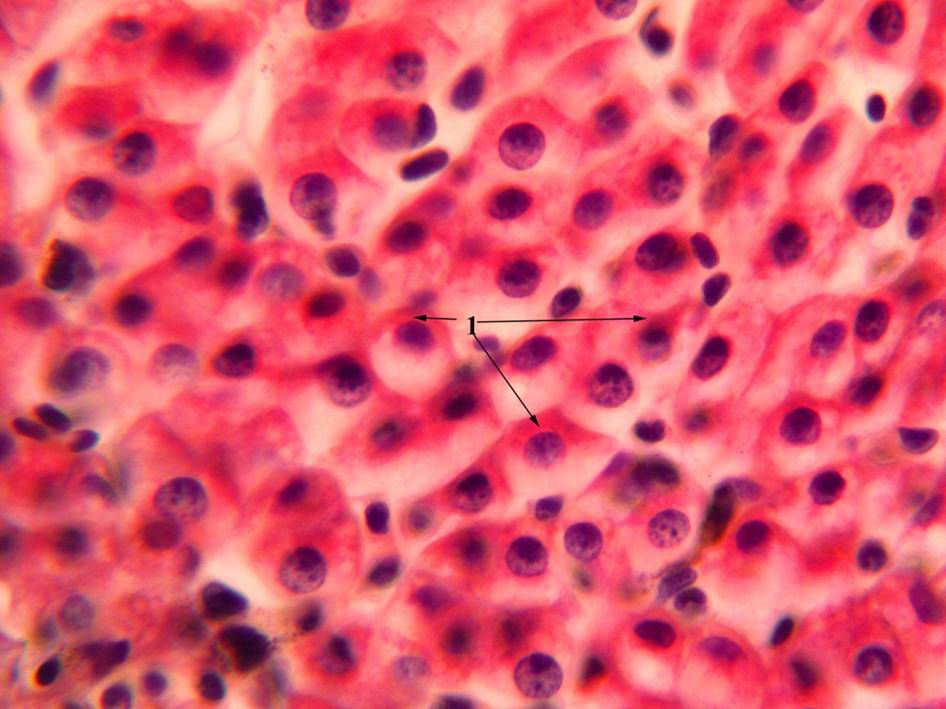 Ультраструктур. Рез.
Ультраструктур. Рез.
18
,
444
-55.
8.
Альбертс
B
и др. .
1994
.
Молекулярная биология клетки
.
Гирлянда Изд. Inc.
,
Нью-Йорк
.
9.
Рыбицкая
К
1981
.
J. Histochem. Цитохим.
29
,
553
-60.
10.
Orell
SA
и др.
1964
.
Контроль метаболизма гликогена
.
Дж. А. Черчилль
,
Лондон
, стр.
29
–
52
.
11.
Эрлих
P
1883
.
Цайтшр. Клиника медицины
,
6
,
33
–
53
Этот контент доступен только в формате PDF.
© Американское общество микроскопии, 1994 г.
Раздел выпуска:
Исследовательская статья
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Ссылки на статьи по телефону
Последний
Самые читаемые
Самые цитируемые 902:30
Новости о продуктах и новости отрасли, март 2023 г.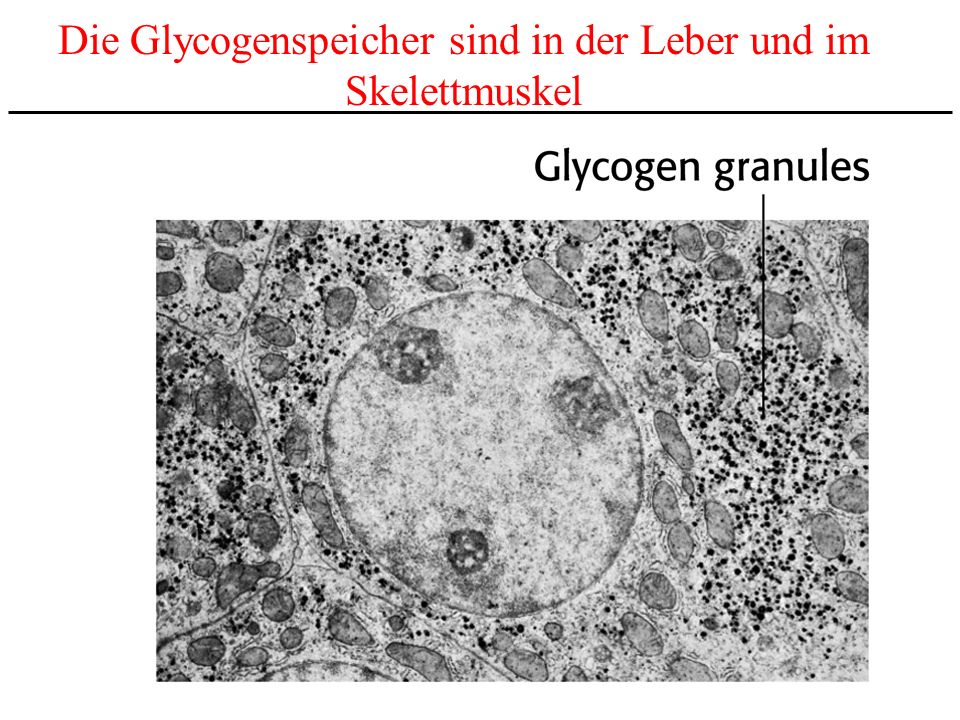

 org/10.1017/S1551929500066670
org/10.1017/S1551929500066670