Роль гликогена в организме человека (развернуто)
Основной функцией гликогена в организме человека является хранение энергии. Запасы этого вещества откладываются в печени и мышцах. После приема пищи организм забирает столько глюкозы, поступившей в кровь из сложных углеводов, сколько ему необходимо для обеспечения двигательной и умственной активности. Излишек глюкозы преобразуется в гликоген и тут же откладывается как бы «про запас». Но когда человек начинает активную деятельность, организм тратит эти самые запасы энергии, причем достаточно логично: весь запас гликогена не может быть использован, так как организм запланировал потратить его на восстановление после нагрузки. Поэтому, если не пополнить запасы энергии, то нервная система начинает активно сигнализировать об этом, что становится причиной раздражительности и рассеянности.
Организм может синтезировать гликоген двумя способами: сразу после еды и в моменты активной умственной (физической) деятельности или голода. Но в каждом из случаев, мозг обязательно получит сигнал о том, что организм нуждается в энергии.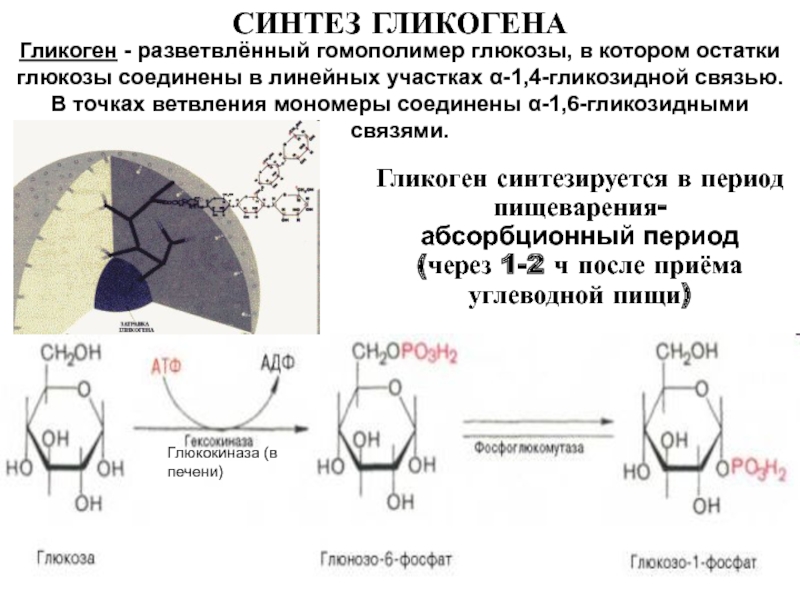
Печень является не только самой тяжелой железой во всем организме, но и вторым по величине органом человеческого тела. Она берет на себя множество функций, в число которых входит также углеводный обмен. Ее можно считать самым настоящим фильтром, через который проходит кровь из желудочно-кишечного тракта. И одной из важнейших задач печени – поддержание нормального уровня глюкозы в крови.
В мышцах гликоген необходим для хранения энергетических запасов. Именно поэтому спортивное питание строится так, чтобы мышцы до отказа были наполнены гликогеном, ведь перед тренировкой необходимо полное их восстановление. Синтез гликогена проходит замечательно, если рацион человека сбалансирован. Причем, большую роль при этом играет дробное питание, в результате которого усвоение веществ происходит быстрее. Так, питание 5 раз в день маленькими порциями — залог усиленного темпа синтеза гликогена.
Роль углеводов в восстановлении организма после нагрузок
12. 03.2020
03.2020
 Effects of diet on muscle triglyceride and endurance performance.
Effects of diet on muscle triglyceride and endurance performance.
Основы энергетического метаболизма
Способность организма выполнять физические упражнения с высокой интенсивностью определяется возможностями его скелетных мышц запасать и восстанавливать аденозинтрифосфат (АТФ) – основной и универсальный источник энергии для мышечной работы.
Генерирование АТФ в скелетных мышцах обеспечивается двумя путями – аэробным и анаэробным, разница в том, что первому нужен кислород, а второму – нет. К примеру, во время спринта высокий уровень продукции АТФ обеспечивается анаэробным энергетическим обменом. Но в тоже время поддержание функционирования сердца и других внутренних органов обеспечивается АТФ, который организм вырабатывает в процессе аэробного метаболизма
Аэробная продукция АТФ – результат деградации внутримышечных запасов фосфокреатина (PCr) и гликогена, полимера глюкозы. По объему фосфокреатина в скелетных мышцах в 5 раз больше, чем гликогена. При этом гликоген активно разрушается во время мышечных сокращений, чтобы генерировать необходимые объемы АТФ, в результате образуются ионы лактата и водорода2. Для наглядности: во время 6-секундного спринта гликогенез (разрушение гликогена) обеспечивает 50% продукции АТФ, фосфокреатин дает еще 48%, а оставшиеся 2% обеспечиваются собственными запасами АТФ в мышцах 3.
По объему фосфокреатина в скелетных мышцах в 5 раз больше, чем гликогена. При этом гликоген активно разрушается во время мышечных сокращений, чтобы генерировать необходимые объемы АТФ, в результате образуются ионы лактата и водорода2. Для наглядности: во время 6-секундного спринта гликогенез (разрушение гликогена) обеспечивает 50% продукции АТФ, фосфокреатин дает еще 48%, а оставшиеся 2% обеспечиваются собственными запасами АТФ в мышцах 3.
Аэробная деградация гликогена (с кислородом) происходит гораздо медленнее, чем процессы анаэробного метаболизма, но дает в 12 раз больше АТФ (примерно 36 ммоль). При окислении жирных кислот получается еще больше АТФ – до 140 ммоль, но этот процесс еще медленнее. То есть аэробный метаболизм АТФ за счет низкой скорости протекания не дает нам ничего в кратковременной интенсивной нагрузке (спринт). С другой стороны – в перерывах между нагрузками, аэробный метаболизм также отвечает за ресинтез фосфокреатина, который, как мы помним, обеспечивает мышцы половиной нужного объема АТФ. Плюс именно фосфокреатин позволяет работать под пиковой кратковременной нагрузкой.
Плюс именно фосфокреатин позволяет работать под пиковой кратковременной нагрузкой.
Нюанс в том, что у тренированных спортсменов организм учится эффективнее использовать аэробные процессы восстановления АТФ во время длительных нагрузок, поэтому профессиональные бегуны могут бежать значительно дольше любителей
Углеводы и мышечная активность
Первые исследования, проведенные еще в 1920-х годах, показали, что: а) углеводы нужны для мышечной работы6, б) концентрация глюкозы в крови коррелирует с накоплением усталости во время фарафона7, в) дополнительный прием углеводов до и во время марафона отодвигает момент наступления мышечной усталости8.
Спустя почти 100 лет ученые, наконец, смогли объяснить, почему так происходит. Есть целый ряд механизмов, например – дефицит гликогена в саркоплазматической сети мышц пропорционально ухудшает их сократительную способность9,10. Также истощение гликогена в условиях гипогликемии, вызванной физической активностью, снижает скорость доставки глюкозы в мозг, что замедляет работу нервной системы 11. Подтверждающие эксперименты показали, что дополнительный прием углеводов во время тренировки влияет в том числе на восприятие нагрузок – спортсмены, принимавшие углеводную добавку, охотнее выполняли новые упражнения, чем группа, принимавшая плацебо12.
Есть целый ряд механизмов, например – дефицит гликогена в саркоплазматической сети мышц пропорционально ухудшает их сократительную способность9,10. Также истощение гликогена в условиях гипогликемии, вызванной физической активностью, снижает скорость доставки глюкозы в мозг, что замедляет работу нервной системы 11. Подтверждающие эксперименты показали, что дополнительный прием углеводов во время тренировки влияет в том числе на восприятие нагрузок – спортсмены, принимавшие углеводную добавку, охотнее выполняли новые упражнения, чем группа, принимавшая плацебо12.
Сегодня рядом экспериментов подтверждено, что достаточное количество углеводов в рационе, плюс их дополнительный прием во время и после тренировки увеличивает ее продолжительность и позволяет быстрее восстанавливаться13,14,15. Любопытно, что для достижения требуемого эффекта не обязательно употреблять углеводы в пищу – достаточно полоскать ротовую полостью углеводным раствором16. Также доказано, что ключевой фактор работоспособности во время тренировки – достаточный запас гликогена в мышцах, а его ресинтез напрямую влияет на общее восстановление и работоспособность
Также доказано, что ключевой фактор работоспособности во время тренировки – достаточный запас гликогена в мышцах, а его ресинтез напрямую влияет на общее восстановление и работоспособность
Роль гликогена в тренировочном процессе
В среднем в организме взрослого человека 600 гр гликогена – параметр зависит от антропометрии, веса, возраста, общей физической активности. Еще имеет значение, была ли недавно (в пределах 1-2 дней) тренировка – в ближайшее время после тренировки запасы гликогена ниже19.
Во время интенсивной мышечной работы запасы гликогена закономерно снижаются20. Что касается гликогена в печени, то его объем меняется постоянно в течение дня и зависит в том числе от распорядка приемов пищи. При этом доказано, что хотя мышечный и печеночный гликоген вместе составляют лишь 4% энергетических запасов организма, именно мышечный гликоген расходуется на обеспечение физической активности средней и продолжительной интенсивности21,22.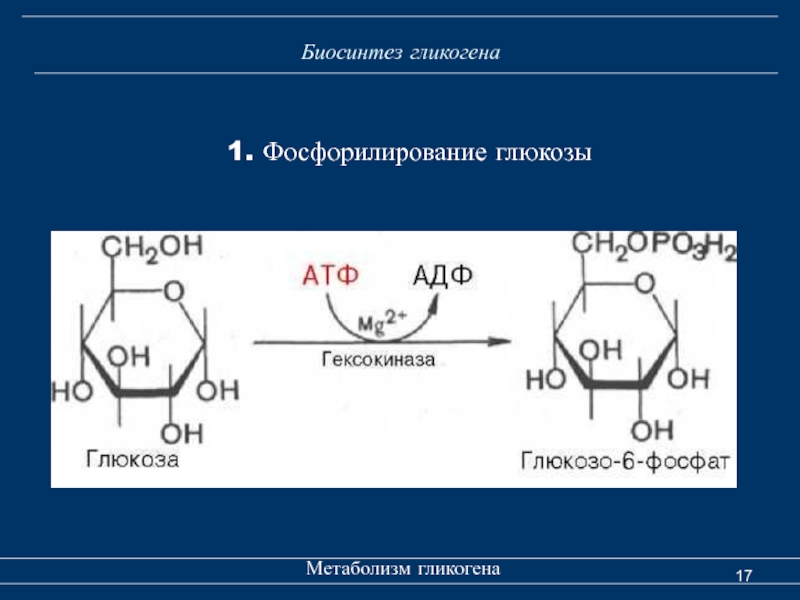
Важно, что гликоген – это не только топливо, но и топливный датчик – он регулирует сигнальные пути, обеспечивающие адаптацию к физическим нагрузкам23,24. Улучшение физической формы посредством тренировок приводит к суперкомпенсации гликогена – его запасы полностью восстанавливаются в период 24-48 часов и у профессиональных спортсменов со временем предел содержания гликогена в мышцах увеличивается25.
Мышечный гликоген, который восстанавливается употреблением углеводов, выступает важным субстратом в тренировках с отягощением, при которых его уровень может снижаться на 20-40% от изначального26,27.Однако исследования показывают, что низкий уровень гликогена никак не влияет на синтез мышечного белка и факторы анаболизма28,29.
Экспериментально подтверждено, что для полного восстановления гликогена после тренировки в течение 24 часов необходимо употреблять 9,8 гр углеводов на 1 кг массы тела – такой режим восстанавливает 93% гликогена, затраченного на 2-часовой бег при maxVO2 65% Низкоуглеводная диета (1,9 гр углеводов на 1 кг массы тела) восстановила только 13% израсходованного гликогена. В тоже время необходимость восстановить объем гликогена определяется активностью и продолжительностью тренинга. Дело в том, что у синтеза гликогена есть максимальный предел по скорости – 10 ммоль/кг/час, то есть при достаточном употреблении углеводов в течение суток истощение гликогена на уровне 40 ммоль/кг восстанавливается за 4-5 часов. Если же истощение гликогена составляло 150 ммоль/кг, в этом случае для восполнения до исходного уровня необходимо не меньше 24 часов31,32.
Низкоуглеводная диета (1,9 гр углеводов на 1 кг массы тела) восстановила только 13% израсходованного гликогена. В тоже время необходимость восстановить объем гликогена определяется активностью и продолжительностью тренинга. Дело в том, что у синтеза гликогена есть максимальный предел по скорости – 10 ммоль/кг/час, то есть при достаточном употреблении углеводов в течение суток истощение гликогена на уровне 40 ммоль/кг восстанавливается за 4-5 часов. Если же истощение гликогена составляло 150 ммоль/кг, в этом случае для восполнения до исходного уровня необходимо не меньше 24 часов31,32.
Для суперкомпенсации гликогена необходимо 24-72 часа отдыха при дневном рационе 8-10 гр углеводов на 1 кг массы тела33. При этом если имело место повреждение мышц и запустились процессы мышечной гипертрофии, восстановление гликогена замедляется сильнее34.
Углеводы для восстановления
Мета-анализ имеющихся исследований показывает, что для долгосрочного восстановления гликогена (более 24 часов) тип и время приема углеводов не имеют значения, важен только общий объем, который должен покрывать расход во время тренировки35. Однако экспериментально подтверждено, что фруктоза быстрее других углеводов восстанавливает печеночный гликоген, а глюкоза – мышечный36.
Однако экспериментально подтверждено, что фруктоза быстрее других углеводов восстанавливает печеночный гликоген, а глюкоза – мышечный36.
Хотя большинство людей при своей обычной диете потребляют достаточное количество глюкозы и фруктозы из пищи, коктейли, представляющие смесь глюкозы, фруктозы и сахарозы, употребляемые во время и после тренировок, увеличивают скорость абсорбции жидкости из проксимального отдела тонкой кишки и повышают скорость окисления углеводов во время упражнений, то есть стимулируют два важнейших фактора для поддержания работоспособности37,38. При этом форма углеводной смеси (жидкая или твердая) не имеет значения39.
Углеводы для производительности
В 2016 году издание Journal of Strength and Conditioning Research провело обзор исследований по вопросу влияния употребления углеводов на производительность спортсменов во время тренировок41. Все эксперименты, включенные в обзор, – это тренировки средней и высокой интенсивности, длительностью более 60 минут. Всего проведено 30 экспериментов, в которых приняли участие 76 женщин и 505 мужчин.
Всего проведено 30 экспериментов, в которых приняли участие 76 женщин и 505 мужчин.
Группы добровольцев, употреблявшие во время тренировки углеводные смеси, показали лучший результат, чем группы, употреблявшие плацебо. Однако статистически значимый прирост производительности наблюдался только при длительных забегах – более 2 часов, при более коротком беге (90-120 минут) эффект был значительно ниже, а для 60-минутной тренировки разницы вообще не было.
Также исследования показали, что если углеводы употребляются по принципу «во время тренировки» без продуманного плана дневного рациона, такой подход почти никогда не приводит к повышению производительности и даже может вызвать дисфункции ЖКТ. Популярные на рынке легкой атлетики углеводные гели ни в одном из экспериментов не дали прибавку производительности. Однако при беге длительностью более 2 часов углеводная смесь, употребляемая в объеме 1,3 гр в минуту, дала значимый прирост. При этом лучший результат показала комбинация фруктоза + глюкоза.
Потенциально эти эксперименты подтвердили, что употребление углеводов во время тренировки задействует следующие механизмы – сохраняет мышечный гликоген, стимулирует центральную нервную систему, предотвращает падение уровня глюкозы в крови.
Выводы
Научные исследования показывают, что ключевой фактор восстановления после тренировки – достаточное количество углеводов в дневном рационе, а не время их употребления. Тем не менее, дополнительный прием углеводов во время бега действительно повышает производительность, а прием углеводных коктейлей после силовых упражнений ускоряет ресинтез гликогена.
- Williams C. Carbohydrate Nutrition and Team Sport Performance.
- Girard O. Repeated-sprint ability — part I: factors contributing to fatigue.
- Cheetham M. Human muscle metabolism during sprint running.
- Balsom P. High-intensity exercise and muscle glycogen availability in humans.
- Parolin M.
 Regulation of skeletal muscle glycogen phosphorylase and PDH during maximal intermittent exercise.
Regulation of skeletal muscle glycogen phosphorylase and PDH during maximal intermittent exercise. - Krogh A. The Relative Value of Fat and Carbohydrate as Sources of Muscular Energy: With Appendices on the Correlation between Standard Metabolism and the Respiratory Quotient during Rest and Work.
- Samuel A. SOME CHANGES IN THE CHEMICAL CONSTITUENTS OF THE BLOOD FOLLOWING A MARATHON RACE WITH SPECIAL REFERENCE TO THE DEVELOPMENT OF HYPOGLYCEMIA.
- Burgess G. SUGAR CONTENT OF THE BLOOD IN RUNNERS FOLLOWING A MARATHON RACE WITH ESPECIAL REFERENCE TO THE PREVENTION OF HYPOGLYCEMIA: FURTHER OBSERVATIONS.
- Nielsen J. Human skeletal muscle glycogen utilization in exhaustive exercise: role of subcellular localization and fibre type.
- Gejl K. Muscle glycogen content modifies SR Ca2+ release rate in elite endurance athletes.
- Nybo L. CNS fatigue and prolonged exercise: effect of glucose supplementation.
- Backhouse S.
 Carbohydrate ingestion during prolonged high-intensity intermittent exercise: impact on affect and perceived exertion.
Carbohydrate ingestion during prolonged high-intensity intermittent exercise: impact on affect and perceived exertion. - Hawley J. Carbohydrate Dependence During Prolonged, Intense Endurance Exercise.
- Nutrition and Athletic Performance.
- Chung M. Fructose, high-fructose corn syrup, sucrose, and nonalcoholic fatty liver disease or indexes of liver health: a systematic review and meta-analysis.
- Burke L. The Governor has a sweet tooth — mouth sensing of nutrients to enhance sports performance.
- Nutrition and Athletic Performance.
- Burke L. Postexercise muscle glycogen resynthesis in humans.
- Farrell P. ACSM’s advanced exercise physiology: Second edition.
- Burke L. Postexercise muscle glycogen resynthesis in humans.
- Burke L. The Governor has a sweet tooth — mouth sensing of nutrients to enhance sports performance.
- Dunford M. Sports Nutrition: A Practice Manual for Professionals.

- Burke L. Postexercise muscle glycogen resynthesis in humans.
- Philp A. More than a store: regulatory roles for glycogen in skeletal muscle adaptation to exercise.
- Ahlborg B. Immediate and delayed metabolic reactions in well-trained subjects after prolonged physical exercise.
- Pascoe D. Glycogen resynthesis in skeletal muscle following resistive exercise.
- Tesch P. Muscle metabolism during intense, heavy-resistance exercise.
- Knuiman P. Glycogen availability and skeletal muscle adaptations with endurance and resistance exercise.
- Camera D. Resistance exercise with low glycogen increases p53 phosphorylation and PGC-1α mRNA in skeletal muscle.
- Raymond D. Effects of diet on muscle triglyceride and endurance performance.
- Louise M. Postexercise muscle glycogen resynthesis in humans.
- Dunford M. Sports Nutrition: A Practice Manual for Professionals.
- Bergström J.
 Diet, Muscle Glycogen and Physical Performance.
Diet, Muscle Glycogen and Physical Performance. - Asp S. Eccentric exercise decreases glucose transporter GLUT4 protein in human skeletal muscle.
- Burke L. Postexercise muscle glycogen resynthesis in humans.
- Blom P. Effect of different post-exercise sugar diets on the rate of muscle glycogen synthesis.
- Baker L. Optimal composition of fluid-replacement beverages.
- Jentjens R. High Oxidation Rates from Combined Carbohydrates Ingested during Exercise.
- Keizer H. Influence of Liquid and Solid Meals on Muscle Glycogen Resynthesis, Plasma Fuel Hormone Response, and Maximal Physical Working Capacity.
- Cramer M. Postexercise Glycogen Recovery and Exercise Performance is Not Significantly Different Between Fast Food and Sport Supplements.
- Wilson P. Does Carbohydrate Intake During Endurance Running Improve Performance? A Critical Review.
Печень и ее функции в нашем организме — (клиники Di Центр)
Печень — самый большой внутренний орган человека. Она находится справа в полости живота под диафрагмой (в правом подреберье) и очень редко печень может находится слева. Печень — непарный орган, то есть второго такого органа в организме нет, и нарушение функции печени опасно для жизни. Поэтому при заболеваниях печени необходимо постоянное наблюдение специалиста, обследование для контроля за состоянием здоровья и лечением.
Она находится справа в полости живота под диафрагмой (в правом подреберье) и очень редко печень может находится слева. Печень — непарный орган, то есть второго такого органа в организме нет, и нарушение функции печени опасно для жизни. Поэтому при заболеваниях печени необходимо постоянное наблюдение специалиста, обследование для контроля за состоянием здоровья и лечением.
Печень выполняет важные функции в нашем организме. Компоненты пищи, поступившие в желудочно-кишечный тракт, всасываются в кровь и доставляются в первую очередь в печень. В ней происходят процессы их преобразования, образуются необходимые для жизнедеятельности вещества. Она принимает участие во всех видах обмена веществ — в обмене белков, жиров, углеводов. Только в печени образуется необходимый организму белок альбумин, многие факторы свертывания крови. В ней образуется и накапливается гликоген — источник энергии для организма. Печень участвует в обмене витаминов и микроэлементов. Ее важной функцией является дезинтоксикационная. В нее поступают образующиеся в организме в процессе пищеварения и в процессе жизнедеятельности вещества, лекарственные препараты. Некоторые из них могут быть токсичными для организма. В печени эти вещества преобразуются в малотоксичные продукты. В ней происходит дезактивация гормонов и других биологически активных веществ.
Так же печень обезвреживает всевозможные чужеродные для организма вещества, такие как аллергены, токсины и яды, превращает их в менее токсичные или проще выводимые соединения. Она участвует в обмене билирубина — пигмента, образующегося при естественном распаде красных кровяных клеток. Нарушение функции печени при различных заболеваниях приводит к нарушениям обмена и выведения билирубина с желчью и появлению желтушного окрашивания кожи и склер. Образующаяся в ней желчь имеет важное значение для процессов пищеварения. Таким образом, печень можно назвать большим химическим заводом, на котором синтезируется и преобразуется огромное количество веществ. Кроме того, печень естественное депо крови, предусмотренное самой природой. При нормальном функционировании в ней содержится более полулитра крови. Это позволяет поддерживать необходимый объем циркулирующей крови и работу органов кровообращения, что является особенно важным при кровопотерях.
Берегите свою печень, выполняйте периодическое обследование! Консультируйтесь с врачом и ваша печень ответит Вам взаимностью!
Печень — один из немногих органов, способных к регенерации, то есть восстановлению. За счет деления клеток (гепатоцитов) печень может восстанавливать свой первоначальный объем при сохранении лишь 25−30% нормальной ткани. Это очень важно для поддержания жизнедеятельности при различных заболеваниях.
*Способность печени к восстановлению отражена в мифе о Прометее. Прометей — один из титанов древнегреческой мифологии, защитник людей от произвола богов, царь скифов. Прометей тайно проник на священную гору Олимп и похитил огонь для людей. Он так же научил людей всему, что сам знал: счету, письму, ремеслам. Но действовал Прометей втайне от величайшего позволения Зевса, бога неба, грома и молний, ведающего всем миром. За это Прометей был обречен Зевсом на вечные муки — прикован к скале, куда каждый день прилетал орел, чтобы выклевать у него печень. На следующий день у Прометея отрастала новая печень. Так продолжалось долго, пока Геракл не сразил орла, разбил оковы и освободил Прометея.
Гликоген биологическое значени — Справочник химика 21
Гомополисахариды, построенные из остатков >-глюкозы, имеют большое биологическое значение. Крахмал — главное резервное энергетическое вещество растений гликоген играет ту же роль у животных. Целлюлоза (клетчатка) является главным компонентом опорных частей растений. Как крахмал, так и гликоген, построены из 1)-глюкозных единиц, связанных а-1-+4-связями (как в мальтозе), и имеют разветвления, образующиеся за счет а-1-)-6-связей . [c.260]Медиков особенно интересуют высокомолекулярные соединения человеческого организма. К ним относятся прежде всего белки и их производные — нуклеопротеиды, глюкопротеиды, липопротеиды и пр., а также гликоген. Эти соединения являются основным строительным материалом для протоплазмы и ядер-ного вещества клеток и, кроме того, в значительном количестве содержатся во многих биологических жидкостях. Значение этих соединений для процессов жизнедеятельности организмов чрезвычайно велико, оно подробно рассматривается в курсе биохимии. [c.226]
В основе всех жизненных процессов, а также структур живых организмов, тканей и клеток лежат такие вещества, как белки, нуклеиновые кислоты, крахмал, гликоген, целлюлоза, построенные из гигантских цепных молекул. Продукты питания (хлеб, мясо, рыба, овощи), одежда и обувь (текстильные ткани, искусственное волокно, кожа, резина, пластмассы) образованы различного рода коллоидными системами. Изменение структуры и поглощающих свойств почв, выветривание горных пород, вынос частиц ила и глин реками, образование облаков и туманов — тесно связаны с коллоидными процессами. Производство строительных материалов (цемент, гипс), добыча и переработка нефти (бурение скважин, обезвоживание нефти), обогащение ценных руд методом флотации, производство лаков и красок, кинофотоматериалов, бумаги, сажи, удобрений в значительной степени основано на использовании свойств различных суспензий и эмульсий. В фармацевтической промышленности многие лекарственные вещества производятся в форме тонких суспензий или эмульсий, мазей, паст, кремов. Важное значение в промышленности, в сельском хозяйстве и в военном деле имеют различные дымы и туманы. Развитие авиационной и автомобильной промышленности, машиностроения и приборостроения было бы невозможно без резины и различных пластмасс. Изделия из целлюлозы, резины, пластмасс, искусственного волокна приобретают все большее значение в технике и в быту. Можно сказать, что материальная основа современной цивилизации и самого существования человека и всего биологического мира связана с коллоидными системами. [c.7]
По реакции с иодом полисахариды условно разделяют на крахмалоподобные (синяя окраска) и гликогеноподобные (различная бурая окраска). По структуре полисахариды могут быть линейными (амилаза), разветвленными (амилопектин, гликоген), циклическими (декстрины Шар-дингера). По биологическому значению полисахариды делятся на конструктивные (целлюлоза, хитин и др.), энергетические или запасные (крахмал, гликоген, эремуран), физиологически активные (гепарин — антикоагулянт крови и регулятор липидного обмена, гиалуроновая кислота — регулятор проницаемости тканей и минерального обмена), иммунополисахариды (полисахариды крови, декстран, полисахариды пневмококков, крахмал и др. обладают антигенными свойствами). [c.30]
Сравнение целлюлозы и гликогена. Практически чистая целлюлоза. Полученная из волокон, окружающих семена растений вида Gossypium (хлопчатник), представляет собой Прочное, волокнистое, совершенно нерастворимое в воде вещество. Гликоген же, выделенный из мыщц или печени, напротив, легко диспергируется в горячей воде, образуя мутный раствор. Несмотря на различие в физических свойствах, оба этих вещества-полимеры, обладающие близкими молекулярными массами и состоящие из остатков D-глюкозы, соединенных 1, 4ч вязями. Какими особенностями строения обусловлены различия в свойствах этих двух полисахаридов Какое биологическое значение имеют особенности физических свойств этих соединений [c.324]
Коллоидные системы имеют большое биологическое и народнохозяйственное значение. Достаточно сказать, что основным субстратом жизненных процессов и структур живых организмов являются такие вещества, как белки, крахмал, целлюлоза, гликоген, нуклеиновые кислоты, построенные из гигантских цепных молекул. То же можно сказать о продуктах питания человека, его одежде, обуви. В фармацевтической практике многие лекарственные вещества применяются в форме эмульсий, суспензий, мазей и паст. Авиа- и автопромышленность не могут существовать без резины и пластмасс. [c.5]
Правовращающий изомер молочной кислоты был выделен из мышц тканей животных и называется мясомолочной кислотой. Имеет большое биологическое значение при спокойном состоянии организма переходит в гликоген — запасное питательное вещество. Гликоген расходуется при интенсивной физической и умственной работе, что вызывает ощущение голода, усталости. Большое накопление (+)-молочной кислоты вредно для организма. [c.156]
Что структура типа природных гликогенов не возникает при любом свободном действии двух ферментов, а лишь в очень узком диапазоне соотношения активностей ферментов, в этом можно убедиться при описанном выше синтезе гликогенов. Однако имеет ли структура гликогена определенное биологическое значение [c.201]
Биологическое значение полисахаридов многообразно. Это — запасные питательные вещества (крахмал, гликоген, инулин) в организмах растений и кивотных. Некоторые полисахариды несут в основном структурную и защитную функции (хонд-роитин-серная кислота, целлюлоза и др.). Маннаны и галактаны используются в качестве строительного и питательного материала, а гиалуроновая кислота, наряду со структурной функцией, участвует в регуляции распределения жизненно необходимых веществ тканей, епарин обладает важными биологическими свойствами, являясь антикоагулянтом крови в организме человека и животных. Полисахариды входят в состав групп специфических веществ крови и многочисленных сложных соединений — гликопротеидов и липополисахаридов, выполняющих в организме ряд важных функций. Они — основной энергетический материал организма. [c.199]
Питательные свойства белков можно оценить с помощью двух характеристик-хилбиологической ценности. В первом случае после полного гидролиза определяют аминокислотный состав белка и сравнивают его со стандартом-белком, полученным из молока и яиц. При этом определяют потенциальную химическую ценность белка. Мерой биологической ценности белка служит величина, обратно пропорциональная количеству данного белкового продукта, которое необходимо для поддержания азотистого баланса у взрослого человека или экспериментального животного, т. е. состояния, при котором количество поступающего в организм азота точно соответствует его количеству, выводимому с мочой и калом. Если в данном белке есть все незаменимые аминокислоты в необходимых пропорциях и все они могут всасываться в кишечнике, то биологическая ценность такого-белка условно принимается равной 100. Для полностью перевариваемых белков с неполным содержанием аминокислот или с полным содержанием аминокислот, но не полностью перевариваемых это значение будет заведомо ниже. В соответствии с этим критерием биологическая ценность белка, в котором отсутствует хотя бы одна незаменимая аминокислота, будет равна нулю. Если белок характеризуется низкой биологической ценностью, он должен присутствовать в пище в очень больших количествах, чтобы обеспечить потребности организма в незаменимой аминокислоте, содержание которой в таком белке минимально. Остальные аминокислоты будут поступать в организм при этом в количествах, превышающих его потребности. Лишние аминокислоты будут подвергаться в печени дезаминированию и превращаться в гликоген или жир либо просто сгорать в качестве топлива. [c.824]
Из органических высокомолекулярных соединений построено большое количество биологически и технически важных веществ. К ним относятся вещества, из которых состоят растения и природные волокна,— целлюлоза и другие полисахариды, шерсть, шелк к ним принадлежат также коллаген и эластин, основная часть белков — протеиды и нуклеотиды, гликоген и крахмал, натуральные полипрены — каучук и гуттаперча. Синтетические высокомолекулярные соединения охватывают область пластических масс и синтетических волокон. Химия высокомолекулярных соединений изучает методы синтеза, характеристики и исследования этих веществ, а также превращения природных и синтетических полимеров в их производные. Если учесть значение перечисленных выше соединений, то представляется обоснованным выделение химии высокомолекулярных органических соединений в особую область органической химии. В строении макромолекул полимеров, а также в их химических и физических свойствах и в методах идентификации и характеристики этих соединений имеется столько особенностей, что необходимо самостоятельное рассмотрение этих вопросов. Однако следует учесть, что как для высокомолекулярных, так и для низкомолекулярных органических соединений в основном характерны одни и те же типы связи атомов в молекуле. Таким образом, все законы органической химии в полной мере относятся также и к химии высокомолекулярных соединений. [c.11]
Биологическое значение и применение. П. выполняют в организмах весьма важные функции. По биоло-гич. функции П. делят на структурные (напр., целлюлоза, хитин), запасные, или энергетические (крахмал, гликоген, эремураи), и физиологически активные (гепарин, П. веществ группы крови). Многие П. обладают высокой биологич. активностью, напр, гепарин — сильный антикоагулянт крови, влияет на лишздный обмен гиалуроновая к-та участвует в минеральном обмене и регулирует проницаемость тканей. Большинство П. обладает иммунными свойствами. Особенно большое значение имеют П., к-рые входят в состав биополимеров смешанных, напр. П. веществ группы крови. [c.20]
Все жизненные процессы требуют для своего осуществления определенного расходования энергии. Всякий организм как растительный, так и животный, при превращении веществ, сопряженном с расходованием энергии, черпает последнюю из биологических процессов, происходящих в нем. Из них гю распространенности и значению на первом месте стоит так называемое кислородное дыхание. Во время дыхания освобождается накопленная в органическом веществе в процессе фотосинтеза энергия. Процесс дыхания происходит непрерывно в течение всей жизни организма и связан с расходом органического вещества. Углеводы, главным образом крахмал, гликоген и глюкоза, являются основными источниками энергии для животных и растений, а также для бесчисленного количества микроорганизмов. Распад углеводов сопровождается освобождением большей или меньшей части энергии, заключающейся в их молекуле. Степень использования освобождающейся энергии для биологических нужд организма зависит от природы тех химических превращений, которые данный организм в состоянии осуществлять, [c.374]
Полисахариды по всему своему химическому облику являются ти-пичными высокомолекулярными веществами, и именно это свойство, очевидно, должно быть принято за критерий, отделяющий типичные полисахариды от моио- и олигосахаридов. Полисахариды имеют исключительно большое значение. Они — один из важнейших типов природных биогенных поли.меров, участвующих в различных процессах жизнедеятельности. Их биологическое значение может быть сравнено со значением белков, хотя пока еще гораздо менее изучено. К полисахаридам ]1 их ближайшим производным относятся, например, такие важнейгиие в биологическом отношении типы соединений, как полисахариды плазмы крови, определяющие ее групповую принадлежность, полисахариды, определяющие специфичность иммунологических реакций, гликоген — полисахарид, являющийся главным углеводным резервом животного организма, гликопептиды, специфические полисахаридн микроорганизмов и т. д. и т. п. [c.151]
Появление вторичных изоферментов (группы 4—6 в табл. 12.4) может быть обусловлено рядом причин. Они образуются в результате модификации одиночной полипептидной цепи, причем эта модификация может иметь, а может и не иметь биологическое значение. Например, свойства нескольких ферментов, участвующих в обмене гликогена, зависят от того, в каком состоянии они находятся, фосфорилированном или де-фосфорилированном [818]. В результате гликоген-фосфорилаза,, киназа фосфорилазы и гликоген-синтаза существуют по крайней мере в двух формах — фосфорилированной и дефосфорили-рованной — и различаются по каталитической активности и свойствам эти группы ферментов должны быть включены в группу 4а. Ферменты, которые могут находиться в разных конформациях, например в результате аллостерических превращений, должны быть отнесены к группе 6, хотя специфика этих взаимопревращений и легкость, с какой они происходят, крайне затрудняет разделение таких форм. Конформационные изменения, по-видимому, совершенно необходимы для функционирования большинства ферментов они участвуют в осуществлении каталитического и регуляторного действия, но предположение о том, что ферменты могут находиться в более чем одной стабильной конформации, не связанной с катализом, не получило особого признания. Изоферменты этого типа, так называемые конформеры , пытались обнаружить с помощью метода обратимой денатурации [1273], и обычно эти попытки оказывались безуспешными. Тем не менее можно привести пример фермента такого рода — это кислая фосфатаза эритроцитов [1790]. [c.113]
Роль углеводов в организме — Школа пациента Нутриэн
Что такое углеводыУглеводы – это органические вещества, в состав которых входят углерод, водород и кислород. Эти элементы соединены в молекуле углевода таким образом, что углеводы способны активно взаимодействовать в организме с белками, липидами (жирами или похожими на них веществами) и даже друг с другом. В последнем случае из самых простых углеводных молекул — можно сказать, «углеводных звеньев» — получаются длинные полимерные цепочки сложных углеводов.Строение такого «звена» выглядит непростым, хотя чаще всего оно построено только из трех видов атомов: углерода, водорода и кислорода.
Например, на картинке — формула глюкозы.Если такие молекулы глюкозы соединятся в длинные цепочки – обозначим остатки глюкозы красными кружочками на рисунке, то получится неразветвленный вариант молекулы крахмала (зеленые точки – атомы кислорода из глюкозы) – ниже:
По количеству структурных «звеньев» в молекуле углеводы делят на:
-
Моносахариды (простые углеводы): состоят из одного «углеводного звена» — например, глюкоза и фруктоза
-
Олигосахариды: от 2 до 10 «звеньев». К ним относятся дисахариды (тоже простые углеводы), которые состоят из двух «углеводных звеньев» — например, сахароза
-
Полисахариды (сложные углеводы): больше 10 – например, крахмал
Почему количество простых фрагментов углевода имеет значение? От этого зависит, как усваивается углевод в пищеварительной системе человека и какую роль играет в работе всего организма и отдельных органов.
Основные функции углеводов
- Поступающие с пищей углеводы — главный источник энергии. Сложные углеводы (полисахариды) расщепляются ферментами человека и превращаются в глюкозу. Окисление глюкозы дает энергию для всех жизненных процессов.
-
Углеводы и их производные входят в самые важные молекулы человека: ДНК и РНК, антитела, интерфероны, некоторые гормоны и вещества на поверхности клеток, по которым организм узнает: клетка «своя» или «чужая».
-
Полисахариды создают энергетический резерв в организме – у человека это гликоген.
-
Не усваиваемые человеком сложные углеводы помогают кишечнику хорошо работать и «кормят» полезную микрофлору в нем – это пищевые волокна.
Таким образом, если рассматривать роль углеводов, попадающих в организм человека с едой, то они дают энергию и обеспечивают нормальное пищеварение. В пище встречаются простые и сложные углеводы.
Простые углеводы, или сахараЭто сладкие, хорошо растворимые в воде вещества, относятся к моно- и дисахаридам.
— фруктоза, глюкоза, галактоза – самые простые сахара.
— сахароза, мальтоза, лактоза – состоят из химически связанных по двое самых простых сахаров. В кишечнике человека углеводы расщепляются до моносахаридов и всасываются в кровь.
Сложные углеводы
Это полимеры – вещества с длинными молекулами. Состоят из химически связанных в цепочку моносахаридов. Их можно разделить на перевариваемые и неперевариваемые человеком.
- Перевариваемые: например, крахмал, мальтодекстрин, гликоген.Расщепляются в организме медленно, дают плавное увеличение уровня глюкозы в крови, в отличие от простых углеводов
- Неперевариваемые: относятся к пищевым волокнам.Некоторые из них растворяются в воде: инулин, альгинаты, пектины, камеди. Они питают полезных бактерий в кишечнике.Другие не растворяются в воде: целлюлоза. Они помогают пище продвигаться по кишечнику, уносят с собой токсины и ускоряют наступление сытости
Как усваиваются простые и сложные перевариваемые углеводы из пищи? После всасывания в кровь они превращаются в производные фруктозы и глюкозы, потом расходуются в реакциях, дающих энергию организму. Эти превращения углеводов, происходящие в организме человека, называются «метаболизм углеводов».
Метаболизм углеводов
Чтобы превратиться в энергию для поддержания жизни, углеводы проходят несколько этапов превращений:
- Переваривание (расщепление) углеводов. Всасывание их в кровь клетками пищеварительного тракта. Переваривание углеводов начинается во рту, продолжается в кишечнике. В процессе переваривания углеводы расщепляются до моносахаридов. Чаще всего это глюкоза, фруктоза и галактоза, причем среди этих трех сахаров больше всего глюкозы
- Транспорт глюкозы, фруктозы и галактозы в печень и другие ткани и органы. В крови поддерживается постоянный уровень глюкозы, все сверх него идет в печень.
- Создание углеводного запаса в печени.
- Клетки печени превращают глюкозу в гликоген. Это сложный углевод, похожий на крахмал. Он запасается, чтобы быстро выровнять уровень глюкозы в крови при его снижении.Печень способна превращать фруктозу и галактозу в глюкозу.
- Получение энергии из сахаров в других тканях тела.Там глюкоза после серии превращений окисляется. Эти реакции, протекающие в организме, приводят к выделению энергии. Энергия расходуется, например, для работы мышц.
- Получение других полисахаридов, которые связываются, например, с белками, встроены в молекулы, хранящие и использующие наследственную информацию. Пример такого соединения — ДНК.
Хотя человек в принципе может обходиться практически без углеводов в пище какое-то время, он станет себя хуже чувствовать, если сахара отсутствуют. Ведь именно сахара являются источником «быстрой» энергии. Если снижается уровень глюкозы крови ниже нормы, первыми реагируют на это клетки головного мозга, которые очень нуждаются в энергии глюкозы. Именно поэтому, когда нет возможности нормально пообедать, надо всегда иметь с собой кусочек сахара, шоколада или обычного белого хлеба, чтобы быстро восстановить силы и не испытывать слабость. Жиры тоже служат источником энергии. Каждый грамм жира при расщеплении дает в 2 раза больше энергии по сравнению с углеводами, но эта энергия «медленная», т.к. жиры перевариваются долго и трудно. Энергия – это самое главное, что требует живой организм, поэтому в случае нехватки углеводов и жиров, которые являются основными источниками энергии, даже белки начинают выполнять энергетическую функцию. В этом случае страдают мышцы человека, которые стремительно уменьшаются в объеме, т.к. энергия добывается в первую очередь из мышечных белков. Если с едой поступает мало пищевых волокон, то страдает микрофлора кишечника, а, значит, кишечник не способен нормально работать, снижается иммунитет.
Сколько же углеводов человек должен получать ежедневно? Нужно ли ограничивать поступление в организм углеводов и каких именно?
Фруктовые соки, каши, напитки с добавлением большого количества сахаров, различные сладости, варенье, джемы легко и быстро усваиваются. Их избыток приводит к болезням – диабету, ожирению, атеросклерозу, нарушениям работы сердца. Натуральные овощи, фрукты, ягоды, темный шоколад с минимальным добавлением сахара, продукты, содержащие злаки, обогащают рацион энергией и способствуют нормальной работе всего организма.
Специальные смеси линейки Nutrien содержат более полезные сложные углеводы. Из этих смесей можно приготовить напиток, который даст вам энергию, полноценный белок, витамины и микроэлементы.
Среди продуктов Nutrien есть смеси, которые подойдут и здоровым людям старше 1 года, и тем, кому нужна специальная диета из-за болезни.
Biochemical Titration of Glycogen In vitro
Гликоген multibranched полимер из остатков глюкозы, который присутствует в цитоплазме многих типах клеток. Это один из основных форм накопления энергии в клетках и играет важную роль в метаболизме глюкозы. Большинство клеток млекопитающих способны производить и хранить гликоген, который можно быстро разлагается на глюкозу для продвижения гликолиза и производство АТФ при метаболическом стрессе. Гепатоциты производить огромное количество гликогена регулировать уровень сахара в крови, тем самым, обеспечивая непрерывную подачу глюкозы в организме. В противоположность этому, концентрация гликогена в других клетках (мышцы, клетки крови, и т.д.) является относительно низким. Тем не менее, на местном уровне, эти величины являются достаточными для обеспечения энергии в краткосрочной перспективе, когда клетки вдруг подвергается среде, лишенной питательных веществ.
Синтез гликогена и распад гликогена те же шаги во всех тканях (рис. 1). Во-первых, глюкозапроникает в клетку путем переносчиков глюкозы (излишкам), и быстро превращается из глюкозо-6-фосфата (G6P) в глюкозо-1-фосфата (G1P) по фосфоглюкомутазы. G1P затем модифицируется на UDP-глюкозы, и атом углерода, С1 UDP-глюкозы прикреплен к остатка тирозина, glycogenin анкерного белка гликогена. Эта молекула, считается гликогена грунтовка, продлевается на крепления UDP-глюкозы в терминал глюкозы с помощью α (1 → 4) облигаций через гликогенсинтазы. Наконец, когда линейной цепочки более 11 остатков глюкозы образуется, ветвления фермент передает терминала олигосахарид, образованную как минимум 6 глюкозных остатков глюкозы в другой цепи около через α (1 → 6) связей. Повторение этого процесса дает массивный фрактальной структуры, содержащий ветви, которые образуют спираль с 6,5 глюкозы на очереди. Гликоген может быть обратно гидролизованный до глюкозы согласованных действийиз обрезка сучьев ферменты, которые гидролиза α (1 → 6) связан и гликогенфосфорилазы, что гидролизует α (1 → 4) гликозидную грань между последним остатком глюкозы филиала и молекулы гликогена. Эта реакция называется гликогенолиз активируется за счет увеличения уровня АМФ (отражающие потребление АТФ), и ингибируется глюкозой и АТФ 2,3.
С помощью электронного микроскопа, молекулы гликогена были описаны во многих типах клеток, как β свободных частиц (или гликогена monoparticles) 15-30 нм в диаметре. В конкретных типов клеток, таких как гепатоцитов, β частицы могут быть собраны в комплексе с образованием розетки, также известный как α частиц, которые изменяются в диаметре от 80 нм до не более 200 нм 4>. Как эти частицы β присоединены, образуют более крупные кластеры частиц α еще полностью не выяснены. Некоторые данные, как правило, доказать, что β частицы могут быть соединены путем ковалентного связывания 5, водородных связей, или даже через белок-белковых взаимодействий 6. Количество гликогена, запасенного в клетках зависит от многих параметров: (I) количество glycogenin в клетке, который инициирует синтез гликогена; (II) активность гликоген-синтазы и фосфорилазы, регулируемой фосфорилирования белка / дефосфорилирования; (III) концентрация глюкозы в клетках, который зависит от нескольких параметров, таких как поставку глюкозы из сосудистой системы и усвоения глюкозы клетками. Запасы гликогена жестко регулируется аллостерической регуляции биосинтеза гормонов через промежуточные метаболиты, гормонами, регулирующими энергетический обмен, а питательных зондирования сигнальных путей 7.
Важно бытьв состоянии определить количество гликогена в биологических образцах, чтобы лучше понять важность обмена гликогена в всего тела и клеточном уровне. Мы описываем здесь точное, воспроизводимое и удобный биохимические в анализе пробирке для гликогена. Этот метод основан на флуоресценции количественное глюкозы до и после определенного гидролиза гликогена.
Другие методы существуют, чтобы оценить уровень гликогена в клетках, но большинство из них не являются количественными. Одним из первых методов, описанных для количественного определения гликогена в клетках была основана на измерении [14 C]-глюкозы в гликоген включения 8,9. Использование радиоактивности делает этот процесс более сложным делом, но оно имеет преимущество в обеспечении скорости глюкозы в гликоген включения и в различении между распределением остатков глюкозы на внешних ветвей и в сердцевине молекулы (это также требует дополнительная β-amylolyсестра и хроматографический шаг). Другой метод был разработан в последнее время и основан на включении 2-NBDG (2 — {N-[7-nitrobenz-2-окса-1 ,3-тиадиазол-4-ил] амино}-2-дезоксиглюкозы), 2-дезоксиглюкозы люминесцентные производная, в гликоген 10. Измеренная интенсивность флуоресценции отражает количество гликогена, полученный и может быть измерена с читателем флуоресценции. Распределение флуоресценции в клетке также может быть оценена с помощью конфокальной микроскопии.
Среди других неколичественных методов, Периодическая кислота-Шифф окрашивание (PAS) является, пожалуй, наиболее распространенным. Он может быть использован для обнаружения гликогена в фиксированных клеток, тканевых срезов в парафин, либо заморожены. Это гистологические цвета техника, не специально полисахариды, гликолипиды, гликопротеины, целлюлоза и нейтральные муцины в фиолетовый. Специфичность этого теста может быть увеличена путем обработки основных клеток или срезов ткани с диастаза, который специфически переваривает гликоген. После этогоуровень гликогена может быть качественно оценивается путем сравнения негидролизованной образцы (все углеводов изменение макромолекулы) гидролизованными образцов (углеводов изменение макромолекулы кроме гликогена). PAS окрашивания и микроскопический анализ, в отличие от биохимических анализов гликогена, предоставляет информацию о распределении гликогена в клетке, которая может быть рассеянный или сконцентрированных в определенной части клетки. Однако, даже если оценках окрашивания PAS различий в накоплении гликогена между различными условиях, это не количественный 11.
Мышиные моноклональные антитела первоначально с использованием нижнечелюстной мыщелкового хряща в качестве антигена было показано, реагируют с гликогена в клетках и очищенной гликогена в пробирке 12. Как это антитело специфически распознает гликогена, связанных сахарных цепей, это является полезным инструментом для выявления гликогена по иммуногистохимии в более конкретном способом, чем окрашивания PAS.
>Электронная микроскопия является другая техника, которая позволяет визуализировать зерен гликогена в клетках и оценки степени гликогена. На самом деле, гликогена β частицы легко узнаваемы с электронной микроскопии как электронных плотных гранул 1.
Subscription Required. Please recommend JoVE to your librarian.
Влияние острой алкогольной интоксикации на содержание гликогена в печени при общем переохлаждении организма | Терехина
1. Акимов П.А., Орбиданс А.Г., Терехин Г.А., Терехина Н.А. Влияние острой алкогольной интоксикации на содержание гликогена в печени и скелетных мышцах // Патологическая физиология и экспериментальная терапия. — 2010. — № 2. — С. 15-17.
2. Акимов П.А., Терехин Г.А., Орбиданс А.Г., Терехина Н.А. Диагностическое значение определения содержания гликогена в тканях при острой алкогольной интоксикации // Клинико-лабораторная диагностика. — 2013. — № 9. — С. 118-118.
3. Витер В.И., Акимов П.А. Анализ содержания алкоголя в крови и моче при смертельной гипотермии // Медицинская экспертиза и право. — 2012. — № 3. — С. 27-28.
4. Об обнаружении и определении этилового алкоголя в крови и моче методом газо-жидкостной хроматографии: метод. письмо / № 10-95/14-32 от 22.04.1968 г. Главн. управл. леч.-проф. помощи Мин. здравоохр. СССР. М., 1968. 12 с.
5. Определение гликогена в миокарде, печени, скелетной мышце как метод лабораторной дифференциальной диагностики при смерти от острого отравления этанолом, ишемической болезни сердца и общего охлаждения: письмо / № 1688 от 28.07.88 г. Главн. суд.-мед. эксперт. М., 1988. 8 с.
6. Патент 2453849 RU. Способ определения метаболитов углеводного обмена в биологических тканях / П.А. Акимов, Н.А. Тере-хина. — № 2011109275/15; заявл. 11.03.2011; опубл. 20.06.2012; бюл. № 17. — 5 с.
7. Шигеев В.Б., Шигеев С.В., Колударова Е.М. Холодовая смерть. — М. — 2004. — 184 с.
8. Chronic ethanol consumption disrupts diurnal rhythms of hepatic glycogen metabolism in mice / Udoh U. S., Swain T.M., Filiano A.N. et al. // Am. J. Physiol. Gastrointest. Liver Physiol. — 2015. — Vol. 308, № 11. — P. 964-974.
9. Ethanol stimulates glycogenolysis and inhibits both glycogenesis via gluconeogenesis and from exogenous glucose in perfused rat liver / Mokuda O., Tanaka H., Hayashi T. et al. // Ann. Nutr. Metab. — 2004. — Vol. 48, № 4. — P. 276-280.
10. Lopez C.H., Suzuki-Kemmelmeier F., Constantin J., Bracht A. Zonation of the action of ethanol on gluconeogenesis and ketogen-esis studied in the bivascularly perfused rat liver. // Chem. Biol. Interact. — 2009. — Vol. 177, № 2. — P. 89-95.
11. Time-dependent effect of ethanol force-feeding on glycogen repletion: NMR evidence of a link with ATP turnover in rat liver / Beauvieux M.C., Gin H., Roumes H. et al. // Alcohol. — 2015. — Vol. 49, № 6. — P. 607-615.
12. Van Horn C.G., Cunningham C.C. Contributions of dietary carbohydrate and ethanol to alterations in liver glycogen levels and glycolytic activity // Alcohol. — 1999. — Vol. 19, № 2. — P. 139-144.
13. Van Horn C.G., Ivester P., Cunningham C.C. Chronic ethanol consumption and liver glycogen synthesis // Arch. Biochem. Biophys. — 2001. — Vol. 392, № 1. — P. 145-152.
Метаболизм гликогена — Биохимия — Книжная полка NCBI
Гликоген — это легко мобилизуемая форма хранения глюкозы. Это очень большой разветвленный полимер из остатков глюкозы (), который может расщепляться с образованием молекул глюкозы, когда требуется энергия. Большинство остатков глюкозы в гликогене связаны α-1,4-гликозидными связями. Разветвления примерно у каждого десятого остатка образованы α-1,6-гликозидными связями. Напомним, что α-гликозидные связи образуют открытые спиральные полимеры, тогда как β-связи образуют почти прямые цепи, которые образуют структурные фибриллы, как в целлюлозе (Раздел 11.2.3).
Рисунок 21.1
Структура гликогена. В этой структуре двух внешних ветвей молекулы гликогена остатки на невосстанавливающих концах показаны красным цветом, а остаток, который начинает ветвь, показан зеленым. Остальная часть молекулы гликогена представлена R.
Гликоген не так восстановлен, как жирные кислоты, и, следовательно, не так богат энергией. Почему животные хранят энергию в виде гликогена? Почему бы не превратить все лишнее топливо в жирные кислоты? Гликоген является важным запасом топлива по нескольким причинам.Контролируемый распад гликогена и высвобождение глюкозы увеличивают количество глюкозы, доступной между приемами пищи. Следовательно, гликоген служит буфером для поддержания уровня глюкозы в крови. Роль гликогена в поддержании уровня глюкозы в крови особенно важна, потому что глюкоза фактически является единственным топливом, используемым мозгом, за исключением длительного голодания. Более того, глюкоза из гликогена легко мобилизуется и, следовательно, является хорошим источником энергии для внезапной, напряженной деятельности. В отличие от жирных кислот, высвобождаемая глюкоза может обеспечивать энергию в отсутствие кислорода и, таким образом, обеспечивать энергию для анаэробной активности.
Двумя основными местами хранения гликогена являются печень и скелетные мышцы. Концентрация гликогена выше в печени, чем в мышцах (10% против 2% по весу), но больше гликогена хранится в скелетных мышцах в целом из-за их гораздо большей массы. Гликоген присутствует в цитозоле в виде гранул диаметром от 10 до 40 нм (). В печени синтез и деградация гликогена регулируются для поддержания уровня глюкозы в крови, необходимого для удовлетворения потребностей организма в целом.Напротив, в мышцах эти процессы регулируются для удовлетворения энергетических потребностей самой мышцы.
Рисунок 21.2
Электронная микрофотография печеночной клетки. Плотные частицы в цитоплазме представляют собой гранулы гликогена. [С любезного разрешения д-ра Джорджа Паладе.]
21.0.1. Обзор метаболизма гликогена:
Распад и синтез гликогена — это относительно простые биохимические процессы. Распад гликогена состоит из трех этапов: (1) высвобождение глюкозо-1-фосфата из гликогена, (2) ремоделирование субстрата гликогена для дальнейшей деградации и (3) превращение глюкозо-1-фосфата в глюкозо-6-фосфат. для дальнейшего обмена веществ.Глюкозо-6-фосфат, полученный при расщеплении гликогена, имеет три судьбы (): (1) он является исходным субстратом для гликолиза, (2) он может обрабатываться пентозофосфатным путем с образованием НАДФН и производных рибозы; и (3) он может быть преобразован в свободную глюкозу для попадания в кровоток. Это преобразование происходит в основном в печени и, в меньшей степени, в кишечнике и почках.
Рисунок 21.3
Судьбы 6-фосфата глюкозы. Глюкозо-6-фосфат, полученный из гликогена, может (1) использоваться в качестве топлива для анаэробного или аэробного метаболизма, например, в мышцах; (2) превращаться в свободную глюкозу в печени и впоследствии выделяться в кровь; (более…)
Для синтеза гликогена необходима активированная форма глюкозы, уридиндифосфат-глюкоза (UDP-глюкоза), которая образуется в результате реакции UTP и глюкозо-1-фосфата. UDP-глюкоза добавляется к невосстанавливающему концу молекулы гликогена. Как и в случае деградации гликогена, молекула гликогена должна быть реконструирована для продолжения синтеза.
Регулирование этих процессов довольно сложно. Некоторые ферменты, участвующие в метаболизме гликогена, аллостерически реагируют на метаболиты, которые сигнализируют о потребностях клетки в энергии. Эти аллостерические ответы позволяют регулировать активность фермента в соответствии с потребностями клетки, в которой ферменты экспрессируются. Метаболизм гликогена также регулируется каскадами, стимулируемыми гормонами, которые приводят к обратимому фосфорилированию ферментов, изменяющему их кинетические свойства. Регулирование гормонами позволяет метаболизму гликогена адаптироваться к потребностям всего организма. По обоим этим механизмам деградация гликогена интегрирована с синтезом гликогена.Сначала мы исследуем метаболизм, затем ферментативную регуляцию, а затем сложную интеграцию механизмов контроля.
Рисунок
Сигнальные каскады приводят к мобилизации гликогена для производства глюкозы, источника энергии для бегунов. [(Слева) Майк Пауэлл / Allsport.]
Гликоген и диабет — роль, хранение, высвобождение и упражнения
Гликоген — это хранимая форма глюкозы. Это большой разветвленный полимер глюкозы, который накапливается в ответ на инсулин и расщепляется на глюкозу в ответ на глюкагон
Гликоген в основном хранится в печени и мышцах и обеспечивает организм легкодоступным источником энергии, если уровень глюкозы в крови снижается.
Роль гликогена
Энергия может храниться в организме в различных формах.
Одна форма запасенной энергии — это жир, а другой — гликоген. Жирные кислоты более богаты энергией, но глюкоза является предпочтительным источником энергии для мозга, а глюкоза также может обеспечивать энергией клетки в отсутствие кислорода, например, во время анаэробных упражнений.
Гликоген, следовательно, полезен для обеспечения легкодоступного источника глюкозы для организма.
Накопление гликогена при диабете
В здоровом организме поджелудочная железа будет реагировать на более высокие уровни глюкозы в крови, например, в ответ на еду, высвобождением инсулина, который снижает уровень глюкозы в крови, побуждая печень и мышцы поглощать глюкозу. из крови и храните его как гликоген.
Люди с диабетом либо не вырабатывают достаточно собственного инсулина, либо их инсулин работает недостаточно эффективно.
В результате поджелудочная железа не может достаточно эффективно реагировать на повышение уровня глюкозы в крови.
Высвобождение гликогена
Гликоген может выделяться печенью по ряду причин, в том числе:
В этих ситуациях, когда организм чувствует потребность в дополнительной глюкозе в крови, поджелудочная железа выделяет гормон глюкагон, который запускает преобразование гликогена в глюкозу для выпуска в кровоток.
Гликоген и упражнения
Гликоген играет важную роль в поддержании энергии наших мышц при выполнении упражнений. Когда мы тренируемся, наши мышцы будут использовать накопленный гликоген. Глюкоза в нашей крови и гликоген, хранящийся в печени, также могут использоваться для поддержания энергии в наших мышцах.
По окончании тренировки наши мышцы пополняют запасы гликогена. Время, необходимое для полного пополнения запасов гликогена, может зависеть от того, насколько интенсивно и как долго мы тренируемся, и может варьироваться от нескольких часов до нескольких дней.
Таким образом, упражнения могут быть полезным способом снижения уровня глюкозы в крови и могут быть особенно полезны для людей с диабетом 2 типа. После упражнений мышцы будут пытаться пополнить свои запасы гликогена и, следовательно, будут принимать доступную глюкозу из крови для выполнения своих задач. таким образом, помогая снизить уровень глюкозы в крови за этот период.
Лучшие продукты для выработки гликогена | Здоровое питание
Мелоди Энн Обновлено 12 декабря 2018 г.
Во время пищеварения ваше тело расщепляет углеводы из пищи, которую вы едите, и превращает их в глюкозу или сахар в крови.Вам нужна глюкоза, чтобы обеспечить топливом каждую клетку вашего тела. Клеткам мозга требуется достаточное количество глюкозы, чтобы они могли отправлять и получать сообщения. Ваше тело сразу же использует необходимую ему глюкозу, а остальную часть откладывает в виде гликогена в печени и мышцах. Гликоген — это полисахарид, который ваша система быстро превращает обратно в глюкозу, когда углеводы не сразу доступны из пищи. Поскольку гликоген является резервным источником топлива для вашего организма, важно есть определенные продукты, чтобы поддерживать адекватный уровень гликогена в вашей системе.
Фрукты
Свежие фрукты богаты простыми углеводами в виде фруктового сахара или фруктозы. Эти типы углеводов довольно быстро перевариваются в тонком кишечнике за один этап. Ферментные соки превращают простые углеводы в глюкозу, которая всасывается непосредственно через клеточные стенки. 4 унции яблока или банана, 1/2 стакана кусочков ананаса, 1/4 стакана малины или 300 грамм винограда содержат 15 граммов простых углеводов, которые помогут увеличить запасы гликогена.В качестве дополнительного бонуса свежие фрукты также богаты клетчаткой, чтобы вы на некоторое время остались довольны после еды.
Крахмалистые овощи
Крахмал — это сложный тип углеводов, который начинает расщепляться во рту. Как и простые углеводы, крахмал в конечном итоге абсорбируется в виде глюкозы. Слюна расщепляет сложные молекулы крахмала на мальтозу, которая представляет собой простой углевод. Как только мальтоза попадает в тонкую кишку, она мгновенно превращается в глюкозу и попадает прямо в кровоток. Крахмалистые овощи, такие как картофель, кабачки и сладкий картофель, содержат много крахмала.Порция любого из этих овощей на 1/2 чашки содержит 15 граммов сложных углеводов крахмала. Ваш пищеварительный тракт быстро преобразует необходимый ему крахмал, а остальное сохранит в виде гликогена.
Цельнозерновые продукты
Один ломтик цельнозернового хлеба, 1/3 стакана пшеничной пасты или 1/3 стакана коричневого риса содержат 15 граммов углеводов. Большинство углеводов сложны, но эти продукты могут также содержать простые углеводы. Выбор цельнозерновых продуктов вместо белых или обработанных продуктов гарантирует, что вы получите достаточное количество клетчатки, которая поможет пищеварению.Это важно, потому что нормальное пищеварение необходимо для преобразования углеводов и поступления глюкозы в кровь для хранения в виде гликогена.
Ежедневные рекомендации по углеводам
Большая часть вашего рациона должна состоять из углеводов, чтобы в организме оставалось достаточно гликогена. От 45 до 65 процентов ваших общих калорий должны поступать из углеводов, поясняют Центры по контролю и профилактике заболеваний. При средней диете в 2000 калорий вам необходимо от 225 до 325 граммов углеводов в день.Поскольку гликоген является резервным источником топлива, обязательно есть определенные продукты, чтобы накапливать запасы гликогена, если вы планируете интенсивную тренировку. Таким образом, у вас будет достаточно энергии для поддержания высокого уровня активности. Если вы спортсмен, вам нужно от 55 до 60 процентов калорий, которые должны поступать из углеводов, чтобы накапливать достаточные запасы гликогена.
Модель всего тела для регуляции гликогена показывает критическую роль цикла субстратов в поддержании гомеостаза глюкозы в крови
Abstract
Своевременная, а иногда и быстрая метаболическая адаптация к изменениям в поставках пищи имеет решающее значение для выживания, поскольку организм переходит из состояния голодания в состояние сытости и наоборот.Эти переходы требуют серьезных метаболических изменений для поддержания энергетического гомеостаза, поскольку источник глюкозы в крови перемещается от проглоченных углеводов через запасы гликогена в печени к глюконеогенезу. Интеграция регуляции печеночного гликогена с внепеченочной энергетикой является ключевым аспектом этих адаптивных механизмов. Здесь мы используем компьютерное моделирование для изучения регуляции гликогена в печени в условиях питания и голодания в контексте модели всего тела. Модель была проверена по сравнению с предыдущими экспериментальными результатами, касающимися динамики гликогенфосфорилазы а (активной) и гликоген синтазы а.Модель качественно воспроизводила физиологические изменения, происходящие при переходе от сытого к голодному состоянию. Анализ модели показывает критическую роль в ингибировании фосфатазы гликогенсинтазы с помощью гликогенфосфорилазы a. Эта негативная регуляция приводит к высоким уровням активности гликогенсинтазы во время голодания, что, в свою очередь, увеличивает (бесполезный) круговорот субстрата, подготавливая систему к быстрому ответу после восстановления внешнего источника глюкозы. Эта работа демонстрирует, что механистическое понимание принципов конструкции, используемых схемами метаболического контроля для поддержания гомеостаза, может выиграть от включения математических описаний этих сетей в контекстные модели «всего тела», которые имитируют in vivo условия .
Информация об авторе
Гомеостаз концентрации глюкозы в крови во время циркадных сдвигов в деятельности, связанной с выживанием, сном и доступностью пищи, имеет решающее значение для выживания млекопитающих. Этот процесс зависит от потребления глюкозы, кратковременного хранения в виде гликогена и глюконеогенеза. Интеграция анаболической и катаболической динамики гликогена в печени с энергетикой всего тела имеет решающее значение для выживания. В этой статье мы используем компьютерное моделирование, чтобы исследовать потенциальное преимущество выживания субстрата (бесполезного) цикла гликогена и предшественников гликогена.Наше моделирование в сочетании с опубликованными экспериментальными результатами других исследователей показывает, что когда организм входит в состояние голодания, активность ферментов, участвующих в синтезе гликогена, увеличивается, что приводит к усилению круговорота субстрата. Это усиление круговорота субстрата позволяет системе быстрее реагировать, как только становятся доступными новые внешние источники глюкозы. Вычислительная модель всего тела, разработанная для этой работы, позволяет изучать схему метаболического контроля в смоделированных условиях in vivo, обеспечивая функциональную информацию, которая не очевидна, когда отдельные модули схемы регуляции гликогена исследуются изолированно.
Образец цитирования: Xu K, Morgan KT, Todd Gehris A, Elston TC, Gomez SM (2011) Модель всего тела для регуляции гликогена показывает критическую роль цикла субстратов в поддержании гомеостаза глюкозы в крови. PLoS Comput Biol 7 (12): e1002272. https://doi.org/10.1371/journal.pcbi.1002272
Редактор: Натан Д. Прайс, Институт системной биологии, Соединенные Штаты Америки
Поступила: 22 ноября 2010 г .; Одобрена: 27 сентября 2011 г .; Опубликовано: 1 декабря 2011 г.
Авторские права: © 2011 Xu et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Финансовая поддержка этих исследований была частично предоставлена за счет гранта Агентства по охране окружающей среды США (RD833825). Однако исследование, описанное в этой статье, не подвергалось экспертной оценке и анализу политики Агентства и, следовательно, не обязательно отражает точку зрения Агентства, и не следует делать вывод об официальном одобрении.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Глюкоза является основным метаболическим топливом млекопитающих, при этом ее поддержание на соответствующих уровнях в организме имеет решающее значение для нормального функционирования, в то время как нарушение регуляции связано с такими заболеваниями, как сахарный диабет, галактоземия и болезни накопления гликогена [1].Поддержание уровня глюкозы требует высокочувствительной системы управления, способной уравновешивать широкий спектр условий окружающей среды, возможно, самым основным из которых является управление усвоением питательных веществ из пищи через нерегулярные промежутки времени. В частности, переходы между состояниями сытости и голодания требуют быстрого переключения между накоплением избыточной глюкозы в форме гликогена в печени и мышцах и расщеплением этих запасов для доставки глюкозы в другие органы. У здоровых людей правильное функционирование этой системы гарантирует, что доступные питательные вещества эффективно захватываются и сохраняются в периоды избытка, а также эффективно управляются и распределяются во время голодания.
Скорость, с которой организм реагирует на эти изменения, может сыграть решающую роль в выживании. Оптимизация хранения энергии важна во время конкуренции за скудные запасы пищи, в то время как быстрая доставка этих запасов энергии во время поспешного отступления от хищников может означать разницу между жизнью и смертью [2]. Ключевым фактором в энергетике, особенно в отношении функции эритроцитов и мозга, является концентрация глюкозы в крови.
Печень является центральным органом регуляции глюкозы и гликогена и действует как главный распределитель питательных веществ через кровь в другие ткани.В голодном состоянии печень расщепляет запасы гликогена, производя глюкозу для других тканей. После еды печень переходит в состояние потребления глюкозы, захватывая почти 26% глюкозы, представленной ей портальной системой во время первого прохода [3]. Почти 10–15% [4], [5] веса печени составляют запасы гликогена при заполнении.
Регулирование глюкозы в печени осуществляется гликогеновой цепью, которая контролирует как хранение глюкозы в виде гликогена (гликогенез), так и ее расщепление на глюкозо-6-фосфат из печеночных запасов (гликогенолиз).Важным является тот факт, что гликогенолиз и гликогенез не являются результатом одной обратимой реакции, а представляют собой два отдельных, строго регулируемых пути. Двумя ключевыми молекулярными игроками в этих путях являются гликогенсинтаза (GS) и гликогенфосфорилаза (GP). GS управляет синтезом гликогена, его активность регулируется множеством механизмов, включая аллостерическую активацию, ковалентную модификацию, а также ферментативную транслокацию [6] — [8]. GP катализирует лимитирующую стадию гликогенолиза, и он также активно регулируется посредством фосфорилирования по одному остатку на Nh3-конце, а также посредством аллостерической регуляции [6] — [8].Оба эти фермента существуют в активированном (GSa и GPa), а также в инактивированном (GSb и GPb) состояниях.
Поскольку синтез гликогена и его расщепление на глюкозу происходит по разным путям, существует вероятность того, что произойдет круговорот субстрата, при котором глюкоза и гликоген постоянно взаимопревращаются. Фактически, цепь гликогена проявляет различное поведение в зависимости от уровня гликогена в печени (рис. 1). В состоянии сытости глюкозы в крови много, а уровни гликогена в печени относительно высоки, что приводит к активации GS и синтезу гликогена.Когда наступает состояние натощак, уровни гликогена в печени высоки, а уровни глюкозы в крови поддерживаются за счет расщепления этого гликогена на глюкозо-6-фосфат под действием ГПа. Наконец, в состоянии полного голодания запасы гликогена в печени существенно истощаются. Именно здесь, в контексте истощения гликогена, наблюдается чередование гликогена и глюкозо-6-фосфата [9], [10].
Рис. 1. Архитектура схемы контроля уровня гликогена в печени.
Гликоген синтезируется GSa и расщепляется на глюкозо-6-фосфат под действием ГПа.Уровни гликогена в печени показаны в режимах кормления, голодания и голодания в виде заштрихованных квадратов, а полные запасы гликогена в печени показаны сплошным черным прямоугольником в части контура кормления. Стрелки указывают, какая ветвь пути активна. Цикл субстрата происходит при истощении гликогена (пустое поле), голодном состоянии.
https://doi.org/10.1371/journal.pcbi.1002272.g001
Давно предполагалось, что циклирование субстратов является общим механизмом, который потенциально может улучшить такие свойства, как чувствительность и время отклика системы, позволяя чистый синтез при наличии небольшой сдвиг в концентрациях субстрата [7], [10] — [13].Однако демонстрации езды на велосипеде и его функциональной значимости в физиологическом контексте все еще относительно редки. В этой работе мы были особенно заинтересованы в исследовании потенциальной роли цикла — отсутствие циклической архитектуры цепи гликогена, проявляющейся во время перехода от состояния сытости к состоянию голодания. Хотя польза от предотвращения цикличности субстрата очевидна, поскольку во время этого процесса энергия рассеивается в виде тепла, неясно, почему цикл гликогена выгоден в голодном состоянии, как показано на рисунке 1.
Математические модели, обеспечивающие один из способов исследования таких вопросов, были успешно применены во многих биологических областях, но их применение было ограничено в случае наук о питании [14]. Количество математических моделей метаболизма энергии в печени, связанных с хранением гликогена в печени, медленно увеличивается в ответ на интерес к влиянию физических упражнений на энергетику в случае диабета [14], диеты [15] и спортивных тренировок [ 16]. Кроме того, недавно были разработаны крупномасштабные реконструкции метаболизма, обычно основанные на моделях потока или ограничений, для систем многих органов, включая печень [17] — [21].Эти основанные на стехиометрии подходы могут использоваться для анализа соответствующей биологической сети исключительно на основе ограничений системного баланса массы и реакционной способности, когда кинетическая информация отсутствует [22], [23]. Однако, поскольку эти подходы основаны на предположениях об устойчивом состоянии и не учитывают специфические кинетические свойства, они обеспечивают принципиально иное представление о метаболизме и метаболической динамике, чем подробные механистические модели.
В отсутствие подходящей модели для настоящей работы, мы разработали физиологическую модель, основанную на центральной цепи управления гликогеном Hers et al.[7] и Муталик и др. [24], с биоэнергетикой всего тела, описанной в [25] — [29], а также с контурами управления с обратной связью и прямой связью, описанными в [30] — [33], для поддержания гомеостаза глюкозы в различных условиях голодания и кормления. Мы уделили особое внимание исследованию роли езды на велосипеде — архитектуры отсутствия цикла в метаболических функциях. Основываясь на предыдущих описаниях биохимического и количественного моделирования, эта модель включила гликогеновый контур печени в физиологическую систему, состоящую из мышц, жировой ткани и компартментов крови.Контролируя скорость введения глюкозы в кровоток, мы смогли смоделировать реакцию системы в широком диапазоне условий кормления / голодания. Наши результаты моделирования воспроизводят ранее опубликованные экспериментальные наблюдения и дополнительно указывают на то, что схема циклирования на Рисунке 1 обеспечивает механизм для уменьшения количества времени, необходимого для преобразования глюкозы в гликоген в состоянии натощак.
Результаты / Обсуждение
Обзор модели
Теперь мы даем краткий обзор нашей модели с полными деталями и полным набором уравнений модели, представленных в Протоколе S1.Обратите внимание, что полный пакет MATLAB вместе с файлом описания предоставляется в протоколах S2 и S3 соответственно. Код SBML также предоставляется в протоколе S4 для более широкого использования и реализации. Как отмечалось ранее, гликоген создается из глюкозы во время кормления и впоследствии расщепляется с высвобождением глюкозо-6-фосфата во время голодания. Цепь печеночного гликогена, контролирующая этот процесс, встроена в гепатоцит в центре нашей физиологической модели (рис. 2). Кровь изображается в виде замкнутой петли, которая переносится по всему телу и соединяет несколько отделов тканей, включая печень, мышцы и жир.Таким образом, кровь функционирует как транспортная система в рамках нашей модели, предоставляя ресурсы, необходимые для производства и хранения гликогена в печени во время состояния сытости, при этом унося его основной продукт распада, глюкозу, во время состояния натощак для использования другими тканями. Печень в настоящее время является наиболее детализированным отделом в этой модели, включая отдельные аспекты гликогенолиза, гликогенеза, гликолиза, глюконеогенеза, цикла TCA, липогенеза, липолиза и кетогенеза (уравнения модели см. В протоколе S1).
Рисунок 2. Схематическое изображение основных характеристик физиологической модели.
Общие принципы построения модели основаны на установленной биоэнергетической физиологии [1]. Печень, расположенная в центре этого схематического изображения «тела», содержит цепь гликогена, которая находится внутри гепатоцитов, связанных с другими органами сосудистой системой (показаны красным). Кровь в сосудистой системе перемещается по телу, перенося материалы между печенью и другими органами, с продолжительностью цикла около одной минуты.Ключ: Gluc = глюкоза; FFA = свободные жирные кислоты; Ket = кетоны; ТАГ = триацилглицерин; ACoA = ацетил-КоА; Алан = аланин. Обратите внимание, что почки, мозг и эритроциты не включены в текущую модель.
https://doi.org/10.1371/journal.pcbi.1002272.g002
По мере того, как животное проходит через состояния питания, голодания и голодания, его тело переключается на различные типы метаболического топлива для стабилизации концентрации глюкозы в крови. Этот переход в значительной степени контролируется уровнями в крови инсулина и глюкагона, которые реципрокно вырабатываются поджелудочной железой в ответ на изменение уровня глюкозы в крови.Инсулин и глюкагон взаимно антагонистичны по отношению ко многим аспектам промежуточного метаболизма и их влиянию на биоэнергетику [25], [34]. Инсулин является ключевым регулятором углеводного и жирового обмена в организме. Он увеличивает захват глюкозы в крови с образованием триглицеридов и гликогена и подавляет такие пути, как глюконеогенез и гликогенолиз [35]. Глюкагон, с другой стороны, секретируется поджелудочной железой, когда концентрация глюкозы в крови низкая. Он подавляет гликолиз и стимулирует гликогенолиз в печени и глюконеогенез в печени за счет увеличения концентрации цАМФ [36].Повышенный уровень цАМФ, в свою очередь, активирует каскад ферментов в цепи контроля гликогена, которые усиливают деградацию молекул гликогена [7]. Инсулин и глюкагон, взаимодействуя друг с другом в сочетании с другими гормональными регуляторами, такими как лептин и адреналин, поддерживают гомеостаз глюкозы в биологических системах. Наша физиологическая модель также включает аспекты цикла Кори, где лактат из мышц и эритроцитов переносится в печень и превращается в глюкозу для повторного использования этими тканями.
Глюкоза в крови поступает из абсорбированных углеводов во время кормления до завершения пищеварения, после чего эту роль берут на себя запасы гликогена в печени. Истощение печеночного гликогена происходит в течение 12-24 часов, хотя это сильно зависит от уровня активности [7], [37]. Когда запасы гликогена в печени расходуются, уровень глюкозы в крови поддерживается за счет глюконеогенеза. В этом процессе используется энергия, полученная из жировых отложений в форме ацетил-КоА и углеродных скелетов гликогенных аминокислот.В настоящей физиологической модели гликогенные аминокислоты представлены аланином, полученным из мышц. Основными участками глюконеогенеза являются почки и печень, здесь представлены только последние. Поскольку уровень глюкозы в крови падает из-за истощения гликогена в печени, уровень инсулина в крови падает, а уровень глюкагона повышается, что приводит к биохимическим изменениям, приводящим к использованию альтернативных видов топлива в виде свободных жирных кислот и кетонов, и глюконеогенезу, который требует использования такой энергии как уже упоминалось выше.
В тканях, таких как сердце и мышцы, ряд факторов регулирует использование альтернативных источников энергии, чтобы сэкономить глюкозу в крови для использования эритроцитами (что зависит исключительно от уровня глюкозы в крови [38]) и головным мозгом (что в основном зависит от уровень глюкозы в крови, но можно использовать кетоновые тела в качестве альтернативы во время голодания [39]). Наша общая биоэнергетическая модель включает ряд тканевых и биохимических компонентов, которые были выбраны на основе их связи с метаболизмом гликогена.Время этих событий и динамика инсулина в крови, глюкагона, глюкозы, свободных жирных кислот, кетонов и уровней запасов гликогена в печени в ответ на циклы голодания и кормления из нашего моделирования показаны на рисунке 3 и согласуются с теми, которые были ранее описано в [25] — [29].
Рис. 3. Результаты моделирования: динамические реакции выбранных гормонов и субстратов в течение 24-часового периода голодания.
Обратите внимание, что концентрации гормона и субстрата нормализованы по их максимальным значениям во время моделирования.Для лучшего обзора концентрация глюкозы в крови имеет множитель 0,8. Обозначения: bl gluc = глюкоза в крови; pl глюкагон = глюкагон плазмы; pl ins = инсулин плазмы; pl FFA = свободные жирные кислоты плазмы; bl ket = кетоновые тела крови.
https://doi.org/10.1371/journal.pcbi.1002272.g003
Циклический АМФ (цАМФ) индуцировал схему глюкозо-гликоген
Внутренние сигналы: цАМФ активирует каскад ферментов.
Цепь гликогена активируется внутри- и внеклеточными сигналами, включая цАМФ, глюкозу и глюкозо-6-фосфат.Когда глюкоза в крови начинает падать в постабсорбционном состоянии, глюкагон секретируется поджелудочной железой и вызывает повышение уровня цАМФ [36]. Увеличение сигнала цАМФ приводит к активации цАМФ-зависимой протеинкиназы (CAPK), которая, в свою очередь, активирует киназу фосфорилазы (PK). PK фосфорилирует GS (менее активный, b-форма) и GP (более активный, a-форма) и заставляет систему войти в катаболическое состояние, когда молекулы гликогена расщепляются для обеспечения выработки глюкозы в печени и поддержания уровня глюкозы в крови.Обратите внимание, что GP может подавляться непосредственно высокими уровнями глюкозы [10], как показано на рисунке 4. Белковая фосфатаза-1 (PP-1) является еще одним ключевым элементом в этой регуляции, действуя как первичная фосфатаза, катализирующая дефосфорилирование PK, GP. , и GS. Различные данные показывают, что GPa оказывает ингибирующее действие на дефосфорилирование (активацию) GS в условиях кормления [7], [40], как показано в нижней части рисунка 4. Это ингибирование опосредуется прямым связыванием GPa с фосфатаза гликогенсинтазы (GS-фосфатаза), основной фермент, катализирующий превращение GS из D (b — фосфорилированная, менее активная) в I (a — нефосфорилированную, активную) форму.Чтобы смоделировать этот ингибирующий эффект, мы включили константу диссоциации () между GPa и GS-фосфотазой, как впервые было предложено Mutalik et al. [24]. В целом, внутриклеточная концентрация цАМФ определяет уровень активированных киназ и фосфатаз в клетке, что, в свою очередь, определяет уровни GPa и GSa и, следовательно, скорость деградации и синтеза гликогена [7], [24].
Рисунок 4. Центральная схема управления гликогеном (изменена по сравнению с рисунком 3.1 в [ 43 ]).Прямоугольники и кружки заключают названия или сокращения ферментов и субстратов соответственно. Жирными стрелками показаны реакции в результате увеличения концентрации цАМФ. цАМФ = циклический аденозинмонофосфат; R2C2 = цАМФ-зависимая протеинкиназа; C = каталитическая субъединица R2C2; PKb = неактивная киназа фосфорилазы; PKa = активная киназа фосфорилазы; GPb = неактивная гликогенфосфорилаза; GPa = активная гликогенфосфорилаза; GSb = неактивная гликогенфосфорилаза; GSb = неактивная гликогенсинтаза; GSa = активная гликогенсинтаза; P = фосфат; г-6-р = глюкозо-6-фосфат; PP1, протеинфосфатаза-1.
https://doi.org/10.1371/journal.pcbi.1002272.g004
Как упоминалось выше, GPa инактивирует GS-фосфатазу путем прямого связывания в условиях кормления. Фактически, Stalmans et al. [40] наблюдали, что только после того, как уровни GPa упадут ниже 10% от общего фермента (a + b), GS в печени будет активирован. Также было показано, что ингибирование GS-фосфатазы GPa зависит от концентрации гликогена в печени и что для этого ингибирования требуется минимальное количество гликогена [41], [42].Следовательно, уровень ингибирования GS-фосфатазы GPa сильно зависит как от состояния активации, вызванного внешней глюкозой и гормональными сигналами, так и от внутреннего состояния запасов гликогена в печени (показано красной стрелкой на рисунке 4). Поскольку это ингибирование индуцируется прямым связыванием GPa с GS-фосфатазой, один из способов моделирования разницы в ингибировании — использование константы диссоциации () этих двух ферментов, как впервые было предложено Mutalik et al. [24]. Обратите внимание, что в их работе a of было установлено, чтобы соответствовать состоянию голодания, а a of соответствовало состоянию сытости.Как описано ниже, мы аналогичным образом используем константу диссоциации GS-фосфатазы и ГПа в качестве средства для моделирования несоответствия ферментативной активности в состояниях сытости и голодания. За подробным обсуждением отсылаем читателей к [24].
Внешние сигналы: инсулин, глюкагон и цАМФ.
Инсулин и глюкагон — два ключевых гормона, которые регулируют и регулируют концентрацию глюкозы в крови. Концентрации этих двух гормонов регулируются уравнениями [43] 🙁 1) (2) где и — скорости базальной секреции, и — скорости разложения инсулина и глюкагона, соответственно.Мы предполагаем, что скорость высвобождения инсулина в кровь увеличивается с увеличением уровня глюкозы в соответствии с кинетикой Хилла с коэффициентом Хилла. Максимальная скорость индуцированного инсулина высвобождения равна, а концентрация глюкозы, при которой эта скорость составляет половину максимальной, равна. Точно так же, чтобы смоделировать снижение глюкагона при высоких уровнях глюкозы в крови, мы предполагаем, что скорость высвобождения глюкагона снижается в соответствии с кинетикой Хилла. Коэффициент Хилла равен, максимальная скорость индуцированного высвобождения равна, а концентрация глюкозы, при которой скорость высвобождения составляет половину от максимальной, равна.Значения параметров в двух вышеупомянутых уравнениях выбраны таким образом, чтобы концентрации инсулина и глюкагона находились в диапазоне и взяты из физиологически значимых диапазонов, определенных в исследованиях на грызунах [27].
цАМФ является вторичным мессенджером, который регулируется как инсулином, так и глюкагоном. После падения уровня глюкозы в крови цАМФ активирует CAPK в соответствии со следующей реакцией: (3) Вышеупомянутая реакция включает две стадии и приводит к высвобождению 2 молекул каталитической субъединицы C из CAPK с помощью 4 молекул цАМФ.Уравнение, определяющее концентрацию цАМФ, тогда [43] 🙁 4) где мы предполагаем кинетику типа Михаэлиса-Ментен для регуляторных функций инсулина и глюкагона в отношении цАМФ. Две константы Михаэлиса-Ментен и были установлены как средние значения концентраций глюкагона и инсулина и, соответственно, в то время как параметры, участвующие в активации CAPK, взяты из [24].
Количество каталитической субъединицы C определяет уровень активности GP и GS [7], [24]. Вместе эти два фермента регулируют метаболизм гликогена в печени: если GS более активен, система преобразует избыточную глюкозу в гликоген для кратковременного хранения; если GP в основном активен, система использует гликоген для производства глюкозы для удовлетворения потребностей других органов.Уравнение для концентрации гликогена [43] 🙁 5), где мы снова используем кинетику Михаэлиса-Ментен для описания ферментативной активности.
Наконец, концентрации глюкозы в печени и крови приведены в уравнениях (6) и (7) соответственно [43], где и — скорости транспорта глюкозы из кровотока в печень, жировую ткань и мышцы, а — реакция Скорость превращения глюкозы в g6p и g6p обратно в глюкозу — это скорость разложения глюкозы в крови и функция питания глюкозы в крови, которая может изменяться при различных режимах питания.(6) (7)
Степень цикличности субстрата зависит от константы диссоциации
Муталик и Венкатеш [24] вычислили кривые зависимости реакции от дозы ферментов в цепи гликогена на основе их эмпирически полученных входных функций для глюкозо-6-фосфата (G6p) и цАМФ. Опять же, мы отмечаем, что константа диссоциации () GS-фосфатазы и ГПа является ключевым фактором при определении количества циклических циклов субстрата в установившемся состоянии. Фактически, Муталик и др. [24] определили различные физиологические состояния на основе значения, где меньшее значение () соответствовало состоянию сытости, а большее () соответствовало состоянию голодания.Мы следовали аналогичному подходу для построения кривых доза-ответ для этих ферментов. В отличие от [24], схема гликогена была включена в четырехкомпонентную физиологическую модель. В результате динамика цАМФ и глюкозо-6-фосфата моделировалась непосредственно в нашей модели, и вся система может быть смоделирована более реалистично, просто контролируя концентрацию глюкозы в плазме.
Кривые доза-реакция для GSa и GPa при двух указанных значениях показаны на рисунке 5.Здесь система была запущена в устойчивое состояние с фиксированной концентрацией глюкозы в крови между 5 мМ и 10 мМ, что является типичным диапазоном для экспериментов с кормлением натощак на грызунах [27], [44] — [46]. При увеличении константы от до точка кроссовера ГПа и GSa сдвигалась от более высокой концентрации глюкозы к более низкой (от до) с соответственно более высокой активированной фракцией (от 5% до 60%). Эта фракция представляет собой максимальный процент одновременной активности обоих ферментов, таким образом, это показатель степени цикличности субстрата в системе.Отметим, что ингибирующий эффект GPa на активацию GS через прямое связывание с GS фосфатазой частично высвобождается с большим.
Рисунок 5. График фракционной активации GPa и GSa в зависимости от концентрации глюкозы в крови при двух выбранных
. A: соответствует более сильному связыванию между гликогенфосфорилазой а (GPa) и GS-фосфатазой, что приводит к сильному ингибированию активации гликогенсинтазы (GSa). B: соответствует более слабому связыванию между GPa и GS-фосфатазой, где ингибирование GPa частично снимается.
https://doi.org/10.1371/journal.pcbi.1002272.g005
Время реакции на синтез гликогена уменьшается с увеличением значения в состоянии истощения гликогена
Из приведенного выше обсуждения очевидно, что ингибирование активации GS посредством GPa посредством прямой регуляции GS-фосфатазы варьируется в зависимости от состояния голодания. Чем больше, тем выше максимальное количество циклов субстрата (коактивированная фракция GS и GP) в устойчивом состоянии.Здесь мы дополнительно исследовали динамику GS и GP, но в контексте истощенной гликогеном печени.
Чтобы смоделировать реакцию системы на глюкозу в состоянии истощения гликогена, мы обеспечили постоянный ввод глюкозы и запустили моделирование до устойчивого состояния. Затем мы постепенно снижали поступление глюкозы и ждали, пока гликоген в печени полностью не истощится. Затем поступление глюкозы повторно поступало в кровоток в виде ступенчатой функции при t = 0, после чего наблюдалась динамика гормональных, ферментных и субстратных ответов.Результаты для двух значений и показаны на рисунке 6А. Отметим, что период наблюдения начался в. Подробное описание функции подачи глюкозы в плазме представлено на рисунке S5 в протоколе S1.
Рис. 6. Кривые зависимости выбранных ферментов и субстратов от времени.
A: Кривые зависимости GSa и GPa от времени для двух выбранных после того, как стимул глюкозы попадает в кровоток при истощенной гликогеном печени. Переход GSa и GPa происходит через 13,4 и 30,6 минут соответственно.B: Концентрация гликогена в печени в зависимости от времени для двух выбранных.
https://doi.org/10.1371/journal.pcbi.1002272.g006
На рисунках 6A – B показаны активности отдельных ферментов и концентрация гликогена в зависимости от времени. Обратите внимание, что «концентрация гликогена» здесь и в более позднем контексте относится к количеству глюкозы, превращенной в гликоген, поскольку одна молекула гликогена включает неопределенное количество (сотни или тысячи) субъединиц глюкозы. При этом запасы гликогена в печени полностью истощены, и ГП в основном активен (более 70% в форме и ).Внезапное увеличение концентрации глюкозы в крови привело к переходу от GP-доминантного к GS-доминантному сценарию. Было существенное различие в том, когда и где произошло пересечение кривых активности GPa и GSa для двух выбранных значений. Ниже точка пересечения произошла на 60% и (Рисунок 6A — левая панель). Напротив, эта точка сместилась на 5% и с рисунком 6B, правая панель.
На рис. 6В показана концентрация гликогена в печени как функция времени. Опять же, наблюдения начались там, где возобновилось поступление глюкозы в кровь.Было очевидно медленное, но почти мгновенное увеличение концентрации гликогена при уровне ниже (черная линия с точками). Напомним, что при этом значении уровень ингибирования фосфатазы GS с помощью GPa был значительно снижен, что позволило сосуществовать 60% GSa и GPa. Напротив, концентрация гликогена в печени оставалась на незначительном уровне до тех пор, пока с (сплошная линия с квадратами) цикличность субстрата не снизилась до 5%. Таким образом, система смогла быстро отреагировать на стимул глюкозы и запустить немедленный синтез гликогена с более высоким уровнем цикла субстрата.В обоих случаях резкое изменение скорости синтеза гликогена произошло там, где пересекаются GSa и GPa (15 минут и 30,6 минут соответственно).
Далее мы исследовали взаимосвязь между временем отклика системы и уровнем цикла субстрата в печени с истощенным гликогеном. Вместо двух значений (отмеченных красным квадратом () и треугольником () на рисунке 7) мы рассмотрели диапазон значений от до. Существует два разных способа определения времени реакции системы на стимул глюкозы: (1) время, когда кривые GSa и GPa пересекаются, или (2) время, когда концентрация гликогена превышает пороговое значение.Мы выбрали пороговое значение 0,5 мМ, концентрация гликогена, достигнутая в конце моделирования () с наименьшей. Кривые времени отклика для обоих определений были показаны на Фигуре 7A в виде синей и черной линий соответственно. Различия во времени отклика, показанные на обеих кривых, составляли порядка 30 минут между наибольшим и наименьшим. На рисунке 7B мы представили процент совместной активности GS и GP в точке пересечения.
Результаты этого анализа дают возможное объяснение того, почему биологическая система имеет разные метаболические механизмы (разные) при разных состояниях голодания.В состоянии истощения гликогена важно иметь высокочувствительную систему, готовую восполнить запасы энергии, как только станут доступны питательные вещества. Результаты нашего моделирования ясно показали, что высокая степень цикличности субстрата, происходящая в состоянии натощак, ускоряла реакцию системы в этом отношении примерно на 30 минут, что было бы физиологически значимым для выживания. И наоборот, избегание цикличности субстрата в сытом состоянии также желательно с точки зрения расхода энергии, поскольку комбинация реакций с участием GS, GP, глюкозо-1-фосфатуридилтрансферазы и нуклеозиддифосфаткиназы приводит к реакции с потреблением АТФ ().
Сравнение с экспериментами
Мы показали, что уровень ингибирования GS-фосфатазы с помощью ГПа через константу диссоциации или, что эквивалентно, уровень субстратного цикла, определяет время отклика системы в печени, обедненной гликогеном. Предыдущие исследования показали, что это ингибирование зависит от гликогена [41], [42]. Watts et al. [47] сообщили, что активность GS-фосфатазы снижалась в печени голодных, накормленных и gsd / gsd (нарушение накопления гликогена в печени) мышей, а добавление гликогена к гомогенатам печени голодных крыс снижало активность гликоген-синтазной фосфатазы.Совсем недавно Армстронг и др. [48] указали, что существуют уникальные сайты связывания для GPa, PP-1 и гликогена в субъединице нацеливания на гликоген в печени протеинфосфатазы 1 (), GS-фосфатазы, специфичной для печени. Следовательно, разумно предположить, что эта ингибирующая регуляция изменяется в зависимости от уровня гликогена в печени. Мы смоделировали этот эффект, используя следующее выражение для константы диссоциации: (8) где [глик] — концентрация гликогена в печени,,, и константа Хилла.Обратите внимание, что параметры были выбраны в соответствии с экспериментальными результатами [49], как показано на рисунке 8.
Рис. 8. Предыдущие экспериментальные результаты Hue et al.
Активность гликогенфосфорилазы a (GPa) и гликоген-синтазы a (GSa) в гепатоцитах в условиях питания (A) и натощак (B) перерисована из экспериментальных результатов Hue et al. [49]). Слева направо, сверху вниз на панелях A и B: 4 увеличения концентрации глюкозы с 5,5 до 55 мМ в среде инкубации вызвали последовательную инактивацию гликогенфосфорилазы и активацию гликогенсинтазы.
https://doi.org/10.1371/journal.pcbi.1002272.g008
Мы сравнили прогнозы нашей модели с экспериментальными исследованиями, в которых изучались уровни GS и GP в печени после еды и натощак в модельной системе грызунов [49]. В этой работе Hue et al. измеряли активность GP и GS с течением времени в изолированных гепатоцитах при последовательном изменении концентрации глюкозы (от 5,5 мМ до 55 мМ) в среде инкубации. Результаты этого исследования были перерисованы на Рисунке 8.
Важно отметить, что мы сравниваем моделирование «всего тела» с результатами, полученными на культивируемых клетках, которые не взаимодействуют с событиями, вызванными другими тканями, такими как жир и мышцы.Тем не менее, это сравнение демонстрирует явное сходство между этими данными клеточных культур и нашим моделированием в отношении ответов схемы регуляции гликогена на концентрацию глюкозы в крови. Мы начали наше моделирование в устойчивом состоянии с кормлением и установили систему модели на два разных времени: 250 и 1200 минут, чтобы представить печень после еды и голодания соответственно. В моделировании для печени с кормлением было выбрано время голодания 250 минут, чтобы воссоздать среду голодания, как показано в начале экспериментов (рис. 8A), где GP в основном находится в активной форме, а более 90% GS находится в неактивной форме [ 49].Обратите внимание, что через 250 минут уровень гликогена в печени составлял примерно 75% от стабильного состояния с кормлением. В моделировании для печени натощак было выбрано 1200 минут, после которых осталось менее 1% гликогена. Затем мы сравнили реакцию обеих печенек при 4 различных нормах кормления глюкозой (), как показано на Рисунке 9. Поскольку мы сделали наше наблюдение только после того, как глюкоза снова поступила в кровоток, мы сдвинули время моделирования вперед на 250 минут и 1200. мин в сытой и голодной печени и обозначил их как.
Рисунок 9. Результаты моделирования путем компьютерного моделирования (параллельное сравнение с Рисунок 8 ).Активности гликоген-синтазы а (закрашенные кружки) и гликогенфосфорилазы а (светлые кружки) нанесены на график в зависимости от времени при 4 различных скоростях поступления глюкозы в печень с пищей (A) и голоданием (B). Слева направо, сверху вниз:. Обратите внимание, что по оси ординат отложено процентное соотношение активного фермента к общему количеству ферментов.
https://doi.org/10.1371/journal.pcbi.1002272.g009
Многие аспекты наших результатов моделирования совпадают с экспериментальными наблюдениями [49].Например, моделирование и эксперименты показали, что активация GS сильно подавляется ГПа в состоянии подпитки. При самой низкой скорости введения глюкозы GS вообще не активируется, что также наблюдалось в экспериментах Hue et al. (Рисунок 8A). Как экспериментальные, так и результаты моделирования показали, что в конце эксперимента / моделирования процент активного GS был выше в голодном, чем в сытом состоянии (). Кроме того, как в экспериментальных исследованиях, так и в моделировании GS всегда реагировал быстрее (порядка 10-15 минут, как определено точкой пересечения GSa и GPa) в обедненном гликогеном состоянии по сравнению с состоянием сытости.По мере увеличения скорости инъекции глюкозы время ответа GSa сокращалось. Обратите внимание, что концентрации гликогена из нашего моделирования представлены на рисунке S6 в протоколе S1, который также указывает на более быструю реакцию голодной печени. Хотя мы можем точно зафиксировать изменения времени ответа при различных концентрациях глюкозы, ясно, что мы рассмотрели только ограниченные аспекты соответствующих метаболических путей и связанных с ними регуляторных компонентов. Например, известно, что биоэнергетика регулируется рядом механизмов, включая пуш-пу [50] и отрицательную обратную связь, последняя является неотъемлемым компонентом наших моделей всего тела и гликоген-специфичных моделей.Кроме того, регуляция уровня транскрипта необходима для фиксации вариаций концентрации ферментов, возникающих при различных условиях голодания. Такие исследования выходят за рамки текущей модели.
Выводы
Клетки, ткани, органы, тела и популяции всех живых организмов находятся в постоянном состоянии восприятия и реакции на многочисленные внешние и самогенерируемые стимулы [51]. Петли обратной связи, как положительные, так и отрицательные, играют важную роль в гомеостатической регуляции биологических систем.Петли отрицательной обратной связи лежат в основе большинства равновесий в природе, от отношений хищник-жертва до биохимических сетей, и явно подвергаются эволюционному давлению [52]. Отрицательная обратная связь является обычным способом контроля для сигнальных сетей [53], сокращая время, необходимое для достижения устойчивого состояния [30], обеспечивая механизм для уменьшения колебаний уровней экспрессии белка и активности пути. В отличие от стабилизирующей активности, при наличии достаточных временных задержек отрицательная обратная связь может иметь дестабилизирующий эффект и генерировать выбросы и случайные колебания, что делает шум сложной проблемой при моделировании биохимических сетей [54].Не было предпринято никаких попыток включить стохастичность в настоящие исследования. Биологические системы используют отрицательную обратную связь в сочетании с контролируемыми временными задержками как средство возбуждения функциональных колебаний. Такие внутренне генерируемые колебания в значительной степени ответственны за циркадные ритмы и клеточный цикл [55], которые в настоящей работе тесно связаны с предметом циклов кормления и голодания.
В этой работе мы разработали физиологическую модель, которая моделирует выбранные основные компоненты биоэнергетики, как описано в [25] — [27].Внешняя общая биоэнергетическая модель (внешнее кольцо на рис. 2) была создана как «испытательный стенд» [56], [57] для цепи гликогена, который позволяет моделировать схему регуляции гликогена в ответ на физиологические изменения, имитирующие эффекты голодание и питание на энергетику всего тела. Поскольку мы не смогли найти такого испытательного стенда для цепи регуляции гликогена в печени, которую мы исследовали, и поскольку такие цепи потенциально непредсказуемым образом взаимодействуют с другими системами организма через сосудистую, нервную и другие системы связи, мы попытались создать такую программную платформу. для наших исследований.Анализ этой модели предполагает, что контекстно-зависимая архитектура цепи гликогена (после еды или натощак) позволяет значительно увеличить время реакции, когда организм находится в состоянии голодания. Подавление цикличности субстрата в состоянии подачи может обеспечить стратегию энергосбережения, ведущую к оптимальному хранению энергии.
Текущая работа также обеспечивает платформу для дальнейшего исследования биоэнергетических заболеваний, таких как диабет и болезнь накопления гликогена (GSD). GSD типа VI и IX, составляющие 25–30% от общего числа случаев, связаны либо с дефицитом гликогенфосфорилазы, либо с аномалией фермента, который ее активирует [58].Следовательно, крайне важно понимать метаболизм глюкозы и гликогена в окружающей среде всего организма, особенно механизмы регуляции некоторых ключевых ферментов в этих путях, таких как гликогенсинтаза и гликогенфосфорилаза. Интересно, что эта работа также может быть полезна для исследования оптимизации протоколов питания спортсменов или солдат, которые должны работать в условиях стресса. Суперкомпенсация гликогена, когда способность накапливать гликоген увеличивается после истощения гликогена при потреблении высокоуглеводной диеты, является важной проблемой для производительности спортсменов.Были проведены многочисленные исследования для изучения взаимосвязи между количеством и типом потребляемых углеводов и максимальной скоростью ресинтеза гликогена [59] — [61]. Связанный интерес представляет исследование Roberts et al. [62] продемонстрировали, что метаболизм простых сахаров приводит к более высокой скорости ресинтеза гликогена, чем метаболизм сложных углеводов. В рамках существующей платформы вычислительной модели эти наблюдения могут быть дополнительно исследованы в непрерывном пространстве параметров, и оптимальный план питания для этих людей может быть предсказан с учетом потоков энергии.Вычислительные модели, подобные разработанной здесь, могут помочь в разработке планов питания для спортсменов и людей, страдающих биоэнергетическими проблемами, включая диабет.
Материалы и методы
Одна из целей нашей метаболической модели состояла в том, чтобы уловить ключевые особенности динамики внутренних источников энергии, от состояния питания до состояния натощак, включая глюкозу в крови, гликоген печени, FFA и кетоновые тела, регулируемые плазмой. глюкагон и инсулин. Динамика этих субстратов и ферментов описана в [25] — [27], а энергетика всего тела рассмотрена в [26], [28], [29].Сводка этих временных событий приведена в [63]. Такое моделирование затем обеспечит динамическую основу для проверки поведения основных схем управления, как для гликогена в настоящем исследовании. Когда физиологическая система переходит в состояние натощак, концентрация глюкозы в крови падает, переключаясь на обратный переключатель в отношении концентраций инсулина и глюкагона в плазме [28], [36]. Затем цАМФ отвечает и передает сигнал цепи гликогена для регулирования активности GP и GS [7].В результате печеночный гликоген истощается, поскольку он катаболизируется для поддержания уровня глюкозы в крови в пределах физиологического диапазона, необходимого для выживания. Уровень свободных жирных кислот и кетоновых тел в плазме также повышается, обеспечивая альтернативное топливо для метаболизма. Диаграмма концентраций выбранных метаболитов в зависимости от времени после начала голодания представлена на рисунке 3. За исключением аналогичного характерного поведения, описанного ранее в [25] — [29], наша модель также способна уловить затухающие колебания в начало нового местного стабильного государства.
Метаболические пути
Здесь мы даем краткий обзор четырех основных компонентов нашей физиологической модели, ориентированной на печень, как показано на рисунке 2. Подробное описание этих путей, уравнений модели и параметров см. В Протоколе S1. Также был проведен подробный анализ чувствительности на основе параметров, и результаты показали, что глюкоза крови нечувствительна к 10-кратным изменениям параметров, описывающих активность каждого фермента. Результаты представлены в таблицах S8 – S10 в протоколе S1.
Печень.
Являясь центром биоэнергетической регуляции, печень способна преобразовывать глюкозу, которая является избытком для немедленной потребности в энергии, в форму краткосрочного хранения энергии, гликоген, и использовать ее для поддержания гомеостаза глюкозы в крови на ранних стадиях голодания. Помимо своих регулирующих функций в гликогенезе и гликогенолизе, печень также способна перерабатывать аминокислоты и свободные жирные кислоты из мышечной и жировой ткани, соответственно, для стабилизации уровня глюкозы в крови при истощении печеночного гликогена.Признавая ее незаменимую роль в метаболизме, печень широко моделируется в нашей физиологической сети. Восемь упрощенных путей в печени включают гликолиз, глюконеогенез, гликогенез, гликогенолиз, цикл TCA, липогенез, липолиз и кетогенез.
Жировая ткань.
Как упоминалось выше, гликоген является эффективным краткосрочным запасом энергии, поскольку он может быстро катаболизироваться, чтобы удовлетворить острую потребность в глюкозе. Однако с точки зрения длительного хранения энергии он не так эффективен, как триглицериды, которые представляют собой гораздо более компактное устройство для хранения энергии, которое в основном содержится в жировых тканях.Поскольку наша модель сосредоточена на роли печени в метаболизме, в наши симуляции включен краткий набросок метаболических взаимодействий между этим органом и органами в жировой и мышечной ткани. Важная роль жира заключается в том, что глюкоза поглощается жиром инсулинозависимым образом и сохраняется в виде триацилглицерина в жире в качестве энергетического депо, которое может управлять глюконеогенезом, когда уровень глюкозы в крови падает и требуется выработка глюкозы. Превращение глюкозы в жирные кислоты и свободные жирные кислоты в жировой ткани описано в Протоколе S1.Единственные метаболиты, моделируемые для жировой ткани, — это глюкозо-6-фосфат, ацил-КоА, триацилглицерин и свободные жирные кислоты.
Мышца.
Мышцы — еще одно важное место для хранения гликогена. Однако мышечный гликоген не может вносить непосредственный вклад в глюкозу плазмы, поскольку в мышцах отсутствует глюкозо-6-фосфатаза, важный фермент в пути глюконеогенеза. Вместо этого конечный продукт гликолиза, пируват, может образовывать лактат или аланин (наш представитель аминокислот и белков), который транспортируется в печень.Аланин является прямым субстратом для глюконеогенеза в печени, в то время как лактат помогает поддерживать уровень глюкозы в крови в течение цикла Кори, в котором лактат используется в глюконеогенезе в печени. В нашей модели мышца моделируется как поглотитель метаболического топлива, такого как глюкоза и кетоновые тела, а также альтернативный источник энергии для производства лактата и аланина. Метаболитами, моделируемыми для мышц, являются гликоген, глюкозо-6-фосфат, пируват, лактат, аланин и кетоновые тела.
Кровь.
Для упрощения все метаболические процессы (кроме деградации) в крови игнорируются. Он служит только транспортной системой, транспортирующей питательные вещества между основными органами, моделируемыми моделью.
Все описанные выше транспортные процессы показаны на рисунке S4 в протоколе S1, и там же представлено более подробное описание.
Вклад авторов
Задумал и спроектировал эксперименты: KX KTM ATG TCE SMG. Провел эксперименты: KX ATG.Проанализированы данные: KX KTM ATG TCE SMG. Предоставленные реагенты / материалы / инструменты для анализа: KX KTM ATG TCE SMG. Написал бумагу: KX KTM TCE SMG.
Ссылки
- 1. Девлин Т.М. (2010) Учебник биохимии с клиническими соотношениями. Нью-Джерси: Вили-Лисс.
- 2. Парсонс П.А. (2005) Окружающая среда и эволюция: взаимодействие между стрессом, нехваткой ресурсов и энергетической эффективностью. Биол Рев Кембридж Филос Соц 80: 589–610.
- 3.Пардридж WM, Джефферсон LS (1975) Поглощение печенью аминокислот и углеводов во время одного циркулирующего прохода. Am J Physiol 228: 1155–1161.
- 4. Otter W, Boxtel ABTG (1971) Связь между содержанием гликогена в печени и массой печени и ее значение для энзимологии. Cell Mol Life Sci 27: 1271–1272.
- 5. Бонжорн В.М., Латур М.Г., Беланжер П., Лавуа Дж. М. (2002) Влияние предшествующих упражнений и содержания гликогена в печени на чувствительность печени к глюкагону.J Appl Physiol 92: 188–194.
- 6. Roach P (2002) Гликоген и его метаболизм. Curr Mol Med 2: 101–120.
- 7. Hers H (1976) Контроль метаболизма гликогена в печени. Анну Рев Биохим 45: 167–189.
- 8. Greenberg C, Jurczak MJ, Danos AM, Brady MJ (2006) Гликоген разветвляется: новые взгляды на роль метаболизма гликогена в интеграции метаболических путей. Am J Physiol Endocrinol Metab 291: E1 – E8.
- 9.Роден М. (2007) Клинические исследования диабета: методы и методы. Чиестер: Wiley- Interscience. 145 с.
- 10. Hers HG, Hue L (1983) Глюконеогенез и связанные с ним аспекты гликолиза. Анну Рев Биохим 52: 617–653.
- 11. Айшвария К., Рачана К., Пракаш Е.С. (2005) Бесполезная цикличность в физиологических системах контроля: цена, уплаченная за точный контроль. Adv Physiol Educ 29: 132–135.
- 12. Newsholme EA, Challissa RAJ, Crabtreeb B (1984) Субстратные циклы: их роль в улучшении чувствительности в метаболическом контроле.Trends Biochem Sci 9: 277–280.
- 13. Chao YP, Liao JC (1994) Метаболические ответы на бесполезный цикл субстрата в Escherichia coli. J Biol Chem 269: 5122–5126.
- 14. де Грааф А.А., Фрейдиг А.П., Де Роос Б., Джамшиди Н., Хайнеманн М. и др. (2009) Моделирование биологии пищевых систем: от молекулярных механизмов к физиологии. PLoS Comput Biol 5: e1000554.
- 15. Холл К.Д. (2009) Прогнозирование метаболической адаптации, изменения массы тела и потребления энергии у людей.Am J Physiol Endocrinol Metab 298: E449 – E466.
- 16. Гастин П.Б. (2001) Взаимодействие энергетической системы и относительный вклад во время максимальной нагрузки. Sports Med 31: 725–741.
- 17. Дуарте Н., Беккер С., Джамшиди Н., Тиле И., Мо М. и др. (2007) Глобальная реконструкция метаболической сети человека на основе геномных и библиомических данных. Proc Natl Acad Sci U S A 104: 1777–1782.
- 18. Гилле С., Беллинг С., Хоппе А., Булик С., Хоффманн С. и др.(2010) Hepatonet1: комплексная метаболическая реконструкция гепатоцита человека для анализа физиологии печени. Мол Сист Биол 6: 411.
- 19. Jerby L, Shlomi T, Ruppin E (2010) Вычислительная реконструкция тканеспецифичных метаболических моделей: применение к метаболизму печени человека. Мол Сист Биол 6: 401.
- 20. Ма Х, Сорокин А, Мазеин А, Сельков А, Сельков Э и др. (2007) Эдинбургская реконструкция метаболической сети человека и ее функциональный анализ.Мол сист Биол 3: 135
- 21. Maier K, Hofmann U, Reuss M, Mauch K (2010) Динамика и контроль центрального углеродного метаболизма в клетках гепатомы. BMC Syst Biol 4: 54
- 22. Эдвардс Дж., Ибарра Р., Палссон Б. (2001) Предсказания in silico метаболических возможностей кишечной палочки согласуются с экспериментальными данными. Nat Biotechnol 19: 125–130.
- 23. Орт Дж., Тиле И., Палссон Б. (2010) Что такое анализ баланса потоков? Nat Biotechnol 28: 245–248.
- 24. Муталик В., Венкатеш К. (2005) Количественная оценка каскадной системы гликогена: сверхчувствительные ответы гликогенсинтазы печени и мышечной фосфорилазы обусловлены различными регуляторными структурами. Theor Biol Med Modell 2: 19.
- 25. Роден М., Бернройдер Э. (2003) Метаболизм глюкозы в печени у человека, его роль в здоровье и болезнях. Лучшая практика Res Clin Endocrinol Metab 17: 365–383.
- 26. Кэхилл Г.Дж. (2006) Топливный метаболизм при голодании.Анну Рев Нутр 26: 1–22.
- 27. Balks H, Jungermann K (1984) Регулирование периферических уровней инсулина / глюкагона печенью крысы. Eur J Biochem 141: 645–650.
- 28. Макдональд И.А., Уэббер Дж. (1995) Кормление, голодание и голодание: факторы, влияющие на использование топлива. Proc Nutr Soc 54: 267–274.
- 29. Фрейн К.Н. (1997) Интеграция субстратного потока in vivo: некоторые сведения о метаболическом контроле. Clin Nutr 16: 277–282.
- 30. Алон У. (2007) Введение в системную биологию: принципы построения биологических цепей.Флорида: Chapman & Hall / CRC.
- 31. Mangan S, Alon U (2003) Структура и функция мотива петлевой сети с прямой связью. Proc Natl Acad Sci U S A 100: 11980–11985.
- 32. Алон У (2003) Биологические сети: Мастер как инженер. Наука 301: 1866–1867.
- 33. Лахав Г., Розенфельд Н., Сигал А., Гева-Заторский Н., Левин А. Дж. И др. (2004) Динамика петли обратной связи p53-mdm2 в отдельных клетках. Нат Генет 36: 147–150.
- 34. Кловер П., Муни Р.А. (2004) Гепатоциты: критические для гомеостаза глюкозы. Int J Biochem Cell Biol 36: 753–758.
- 35. Хан К., Пессин Дж. (2002) Инсулиновая регуляция поглощения глюкозы: сложное взаимодействие внутриклеточных сигнальных путей. Диабетология 45: 1475–1483.
- 36. Jiang G, Zhang BB (2003) Глюкагон и регуляция метаболизма глюкозы. Am J Physiol Endocrinol Metab 284: E671 – E678.
- 37. Dohm GL, Tapscott EB, Barakat HA, Kasperek GJ (1983) Влияние голодания на истощение гликогена у крыс во время физических упражнений.J Appl Physiol 55: 830–833.
- 38. Wijk R, Solinge WW (2003) Энергетические эритроциты теряются: ферментативные нарушения гликолиза эритроцитов. Кровь 106: 4034–4042.
- 39. Magistretti PJ, Pellerin L (1996) Клеточные основы энергетического метаболизма мозга и их значение для функциональной визуализации мозга: доказательства выдающейся роли астроцитов. Cereb Cortex 6: 50–61.
- 40. Stalmans W, Wulf H, Hue L, Hers H (1974) Последовательная инактивация гликогенфосфорилазы и активация гликоген синтетазы в печени после введения глюкозы мышам и крысам.Eur J Biochem 41: 117–134.
- 41. Massillon D, Bollen M, Wulf H, Overloop K, Vanstapel F и др. (1995) Демонстрация цикла гликоген / глюкозо-1-фосфат в гепатоцитах голодных крыс. J Biol Chem 270: 19351-19356.
- 42. Mvumbi L, Stalmans W (1987) Высокоаффинное связывание гликоген-синтазной фосфатазы с частицами гликогена в печени. Biochem J 246: 367–374.
- 43. Тодд А. (2008) Включение математической модели регуляции гликогена в контекстную структуру метаболизма [Ph.Докторская диссертация. Чапел-Хилл (Северная Каролина): Университет Северной Каролины в Чапел-Хилл.
- 44. Kelsall IR, Rosenzweig D, Cohen P (2009) Нарушение аллостерической фосфорилазы, регуляции гликоген-целевой протеинфосфатазы 1 в печени, улучшает толерантность к глюкозе in vivo. Сигнализация клетки 21: 1123–1134.
- 45. Andrikopoulos S, Blair AR, Deluca N, Fam BC, Proietto J (2008) Оценка теста на толерантность к глюкозе у мышей. Am J Physiol Endocrinol Metab 295: E1323 – E1332.
- 46. Klueh U, Liu Z, Cho B, Ouyang T, Feldman B и др. (2006) Непрерывный мониторинг глюкозы у нормальных мышей и мышей с преддиабетом и диабетом. Diabetes Technol Ther 8: 402–412.
- 47. Watts C, Malthus RS (1980) Гликогенсинтаза печени у крыс с нарушением накопления гликогена. Eur J Biochem 108: 73–77.
- 48. Armstrong CG, Doherty MJ, Cohen PTW (1998) Идентификация отдельных доменов в субъединице нацеливания на гликоген в печени протеинфосфатазы 1, которые взаимодействуют с фосфорилазой а, гликогеном и протеинфосфатазой 1.Biochem J 336: 699–704.
- 49. Hue L, Bontemps F, Hers H (1975) Влияние глюкозы и ионов калия на взаимное превращение двух форм гликогенфосфорилазы и гликоген синтетазы в изолированных препаратах печени крыс. Biochem J 152: 105–114.
- 50. Cortassa S, ORourke B, L WR, Aon MA (2009) Контроль и регулирование интегрированной митохондриальной функции в метаболических и транспортных сетях. Int J Mol Sci 10: 1500–1513.
- 51.LeDuc PR, Messner WC, Wikswo JP (2011) Как подходы, основанные на контроле, входят в биологию? Анну Рев Биомед Анг 13: 369–396.
- 52. Робертсон Д.С. (1991) Теория обратной связи и дарвиновская эволюция. Дж. Теор Биол 152: 469–484.
- 53. Тайсон Дж. Дж., Чен К., Новак Б. (2001) Сетевая динамика и клеточная физиология. Nat Rev Mol Cell Biol 2: 908–916.
- 54. Sun L, Becskei A (2010) Системная биология: стоимость управления с обратной связью. Природа 467: 163–164.
- 55. Новак Б., Тайсон Дж. Дж. (2008) Принципы проектирования биохимических осцилляторов. Nat Rev Mol Cell Biol 9: 981–991.
- 56. Цисковски М.А., Оверленд Д. (2006) Управление процессами для расширенного жизнеобеспечения, биологический испытательный стенд. Int Conf Environ Syst. 2006-01-2124.
- 57. Чжан X, Ху К.А. (2005) Моделирование и контрольные исследования интегрированной системы биологической очистки сточных вод. Int Conf Environ Syst. 2005-01-2963.
- 58. Дагган С., Уоткинс Дж., Уокер В. (2008) Питание в педиатрии: фундаментальные науки, клиническое применение.Онтарио: BC Decker Inc. 511 с.
- 59. Костилл Д., Шерман В., Гинд С., Мареш С., Виттен М. и др. (1981) Роль пищевых углеводов в ресинтезе мышечного гликогена после напряженных упражнений. Am J Clin Nutr 34: 1831–1836.
- 60. Blom P, Hostmark A, Baage O, Kardel K, Machlum S (1987) Влияние различных сахарных диет после упражнений на скорость синтеза мышечного гликогена. Медико-спортивные упражнения 19: 491–496.
- 61. Keizer H, Kuipers H, Van Kranenburg G, Geurten P (1987) Влияние жидкой и твердой пищи на ресинтез гликогена в мышцах, реакцию гормонов плазмы и максимальную физическую работоспособность.Int J Sports Med 8: 99–101.
- 62. Робертс А., Нобл Д., Хайден Д., Талиор А. (1988) Простые и сложные диеты, богатые углеводами, и содержание гликогена в мышцах марафонцев. Eur J Appl Physiol 57: 70–74.
- 63. Мюррей Р.К., Бендер Д.А., Ботам К.М., Кеннелли П.Дж., Родвелл В.В. и др. (2009) Иллюстрированная биохимия Харпера. Нью-Джерси: McGraw-Hill Medical, 28-е издание. 140 с.
ESPN.com: ТРЕНИРОВОЧНЫЙ ЗАЛ — Углеводы — актив спортсмена
Углеводы — актив спортсмена
Шэрон Ховард, Р.D., M.S., C.D.E. ФАДА
Гарви, известный своей ловкостью и скоростью на футбольном поле, почувствовал себя вялым и усталым после трех дней тренировок. Ко второй половине игры в пятницу он не успел и остаток дня провел вне игры. Может ли его недостаток энергии быть простудой? Плохая методика тренировок? Или о низкоуглеводной диете, которую он перешел в смокинг на танцы на следующей неделе?
Мышцам нужны углеводы
Углеводы — основной предпочтительный источник энергии для организма; они являются важными питательными веществами для спортсмена, которому во время физической активности требуется много энергии.Выносливость, сила и выносливость зависят от достаточного количества углеводов в рационе. Продукты с высоким содержанием углеводов включают сложные крахмалы, такие как злаки, зерна, рис, хлеб, бобовые, овес, овощи и простые сахара, такие как фрукты, фруктовые соки, молоко и сладости.
Углеводы хранятся в организме в ограниченном количестве. Вот почему продукты, содержащие углеводы, должны составлять около 60 процентов дневного рациона. Например, когда вы едите макароны, крахмал быстро превращается в простой сахар, глюкозу, которая циркулирует в вашей крови, чтобы обеспечить немедленную энергию для каждой клетки или накапливаться в печени и мышцах в виде гликогена для дальнейшего использования.Когда вы двигаетесь, запасенный в мышцах гликоген готов к сжиганию в качестве топлива. В ваших мышцах содержится около трех часов мышечного гликогена в качестве топлива, а в печени сохраняется ограниченный запас гликогена для поддержания уровня глюкозы в крови между приемами пищи и во время сна. Если запасы углеводов не поддерживаются с помощью адекватной диеты, запасы гликогена будут истощены, и спортивные результаты пострадают. Яркий пример — марафонец, который «бьет об стену»: он с трудом поднимает ноги и не может ясно мыслить.Эта длительная интенсивная тренировка истощила его гликоген, что привело к усталости и снижению работоспособности. Спортивные напитки, содержащие глюкозу, созданы для того, чтобы дать марафонцу конкурентное преимущество.
Исследования показывают, что углеводы — лучшее топливо для ваших мышц. В одном классическом исследовании спортсмены сидели на низкоуглеводной диете и три дня подряд выполняли двухчасовые тренировки. К третьему дню они израсходовали почти весь свой гликоген и почувствовали усталость. Это называется истощением гликогена.На высокоуглеводной диете пополнение мышечного гликогена позволяло спортсменам тренироваться на высоком уровне три дня подряд. У футболиста Гарви кончились запасы углеводов, чтобы питать мышцы, и в результате он устал.
Углеводы повышают работоспособность
Самая быстрая замена гликогена в мышцах происходит в течение первых двух часов после тренировки. То, что спортсмены едят для восстановления после тяжелой тренировки, имеет решающее значение для их продолжения работы.Мышцы «запасаются» гликогеном для следующей тренировки. По этой причине полезно есть и пить продукты или напитки с высоким содержанием углеводов вскоре после тренировки.
Регулярные тренировки увеличивают количество гликогена, которое спортсмены могут накапливать в своих мышцах. У тренированных спортсменов в мышцах может быть вдвое больше гликогена, чем у людей, ведущих малоподвижный образ жизни, что дает им больше выносливости. Увеличение количества гликогена, запасаемого в мышечных тканях, является частью набора формы.Полноценный спортсмен может тренироваться дольше и тяжелее в конце сезона, чем в начале.
Некоторые бегуны используют технику «углеводной загрузки», чтобы попытаться получить конкурентное преимущество в длительной гонке. Используя эту технику, бегуны сначала интенсивно тренируются без ограничения углеводов, затем постепенно сокращают предсоревновательные тренировки за неделю до соревнований, придерживаются высокоуглеводной диеты и позволяют мышцам загружаться углеводами.
Когда человек начинает тренироваться в течение первых 20 минут или около того, пятая часть общих запасов гликогена в организме расходуется быстро.Мышцы увеличивают поглощение гликогена из печени, чтобы удовлетворить потребность. Через 20 минут использование гликогена замедляется, и организм начинает использовать больше жира в качестве топлива. Глюкоза должна присутствовать для сжигания жиров для получения энергии, поэтому углеводы являются ограничивающим фактором в этом метаболизме. Нетренированные мышцы используют больше гликогена быстрее, чем мышцы тренированного спортсмена.
Когда вам нужна энергия для упражнений, ваше тело будет использовать смесь гликогена (углеводов) и жиров в качестве топлива. Чем выше интенсивность упражнения, тем больше используется гликоген.Такие виды спорта, как теннис или спринт, требуют в качестве основного топлива мышечного гликогена. Упражнения на выносливость, такие как бег трусцой, езда на велосипеде или плавание, сначала используют немного гликогена, а затем полагаются на запасы жира в качестве топлива.
Как получить углеводы
Какие углеводы самые лучшие — из газированных напитков или из макарон? Мышцы хранят сахар и крахмал (которые превращаются в сахар) наравне с гликогеном. Тем не менее, сложные углеводы довольно питательны и содержат витамины группы В, железо и клетчатку для поддержки всех функций организма.Фрукты, овощи и бобовые также обладают антиоксидантными свойствами. Простой сахар, газированные напитки и сладости содержат много простых в употреблении углеводов, но не обладают большой питательной ценностью. Фрукты и молочные продукты содержат простые сахара в форме фруктозы и лактозы, но среды, содержащие эти простые сахара, обеспечивают гораздо больше, чем просто калории. Апельсиновый сок и газированные напитки содержат примерно одинаковое количество углеводных калорий, но апельсиновый сок дает вам вдвое больше дневной нормы витамина С, плюс калий, чтобы восполнить потери от потоотделения.Молочные продукты содержат кальций, калий и белок.
Сколько углеводов должен употреблять спортсмен? Целевая спортивная диета состоит из 60% углеводов, 15% белков и 25% жиров. Это может немного отличаться в зависимости от целей упражнений или вида спорта. Большинство спортсменов должны потреблять от 200 до 300 граммов углеводов в день или больше. Избыточные углеводы, превышающие потребности организма в энергии, могут быть преобразованы в накопленные жиры и сожжены для получения энергии после первых двадцати минут упражнений.
Продукты с высоким содержанием углеводов — это фрукты, хлеб, злаки, макаронные изделия, овощи, фруктовые соки и молочные продукты. Давайте посмотрим на содержание углеводов в некоторых избранных продуктах.
| Продукты питания | Размер порции | Углеводы | калорий |
| бублик | 1/2 | 19 | 100 |
| цельнозерновой хлеб | 1 ломтик | 13 | 70 |
| черничный маффин | 1 малая | 22 | 140 |
| овсянка | 1/2 стакана | 13 | 73 |
| сырная пицца | 1/4 12-дюймового пирога | 32 | 218 |
| спагетти | 1 стакан | 39 | 220 |
| банан | 1 | 27 | 105 |
| печеный картофель | 1 большой | 51 | 220 |
| ванильный молочный коктейль | 12 унций | 51 | 314 |
| жареный цыпленок | 3 унции | 0 | 139 |
| апельсиновый сок | 1 стакан | 26 | 112 |
Вы можете достичь ежедневного потребления 250 граммов углеводов, употребляя следующие группы продуктов:
- 4 порции из молочной группы
- 2 или более порции из мясной группы
- 8 или более порций из фруктов и овощей
- 8 или более порций из злаков, хлеба и круп
Помните, что жиры не содержат углеводов, но содержат калории.
Лучшие продукты с высоким содержанием углеводов — овощи, фрукты, злаки, цельнозерновые продукты, макаронные изделия, рис и картофель — предлагают организму полноценное питание, а также доступную энергию. Эти продукты следует употреблять как часть сбалансированной диеты. Строгое ограничение калорий без надлежащих упражнений и баланса питания может привести к потере мышечной массы и физической формы. Еда, особенно углеводы, — это актив спортсмена.
Заявление об ограничении ответственности:
Информация, включая мнения и рекомендации, содержащаяся на этом веб-сайте, предназначена только для образовательных целей.Такая информация не предназначена для замены профессионального медицинского совета, диагноза или лечения. Никто не должен действовать в соответствии с какой-либо информацией, представленной на этом веб-сайте, без предварительной консультации с квалифицированным врачом.
(PDF) Емкость гликогена и de novo липогенез во время массового перекармливания углеводов у человека
УДАЛЕНИЕ УГЛЕВОДОВ ПРИ ПЕРЕПИТКЕ 241
лет в течение 10 дней, включая 7 дней, в течение которых было проглочено
излишков углеводов.
Субъекты и методы
Субъекты
Трое здоровых юношей, один из которых участвовал в соревнованиях по плаванию
университетского уровня, (21-22 года, 62-72 кг, 174-180 см,
и 1 1- 14% жира в организме) без семейного анамнеза диабета или ожирения и которые не принимали никаких лекарств, приняли участие в
этом исследовании. Каждому из субъектов был предоставлен подробный отчет о
протоколе, который ранее был рассмотрен и принят
этическим комитетом института, прежде чем они отправили свое согласие на участие.
Протокол
Эксперимент длился 14 дней подряд. В течение первых
3 дня испытуемые соблюдали ограниченную диету с высоким содержанием жиров и низким содержанием углеводов
и выполняли программу упражнений. На полпути
через этот период субъекты были помещены в дыхательную камеру, в которой измерения дыхательного обмена
должны были продолжаться в течение 10 дней. После 36 часов пребывания в камере диета
была изменена на диету с высоким содержанием углеводов и низким содержанием жиров, которая составляла
в течение следующих 7 дней.В течение последних 2 дней, все еще находясь в камере
, субъекты получали ограниченное количество диеты с высоким содержанием белка
(белок-сберегающее модифицированное голодание [PSMF], ‘2,5 МДж
или 600 ккал), по существу лишенное углевод. Затем испытуемые
покинули дыхательную камеру, но продолжали потреблять
диеты с высоким содержанием жиров и низким содержанием углеводов в ограниченных количествах в течение еще
в течение следующих 2 дней.
Потребление энергии
Диеты были составлены квалифицированными диетологами Института физиологии
.Ограниченная диета с высоким содержанием жиров и низким содержанием углеводов
, потребляемая в дни 1-3 и 13-14, обеспечила ‘—6,70 МДж (1600
ккал), состоящую из 15% белка, 75% жира и 10% углеводов. —
дрейт. Во время периода перекармливания (дни 4-10 включительно) диета с высоким содержанием углеводов и низким содержанием жиров
обеспечивала -- 1 5 МДж (3600 ккал,
, состоящее из 11% белка, 3% жира и 86% углеводов. ) на
день 4. Затем потребление энергии постепенно увеличивалось каждый день
, при этом состав оставался постоянным для обеспечения 6.28 МДж
(1500 ккал) превышают расход энергии в предыдущий день,
, который был измерен в дыхательной камере (8). Таким образом, к 10-му дню
потребление энергии увеличилось до «-21 Ми» (5000 ккал).
В течение следующих (и последних) 2 дней пребывания в дыхательной камере субъекты с суб-
потребляли низкокалорийную диету с высоким содержанием белка (PSMF, --2,5
МДж или 600 ккал). Затем диету меняли на ту же самую диету с высоким содержанием жиров и низким содержанием углеводов, которую ели в дни 1-3, на
последних 2 дня эксперимента, проведенных вне камеры.Каждый съеденный продукт питания
взвешивали с точностью до грамма на весах
Mettler PlO (Mettler, Greifensee, Switzerland), и его потребление
корректировали на любые остатки, оставшиеся на тарелке. Потребление энергии
и состав рациона рассчитывали на основе пищевых таблиц
(9) с помощью настольного компьютера (HP 9830, Hewlett Packard
(Schweiz) AG, Шлирен, Швейцария). Коэффициенты 16,74,
,, 37,67 и 16,74 кДж / г (4, 9 и 4 ккал) были использованы для расчета
метаболической энергии белка, жира и углеводов
драт соответственно.Двадцать процентов по весу каждого продукта питания
(за исключением засахаренных фруктовых соков) были отложены, а
объединены. В конце каждого 24-часового периода объединенные образцы
гомогенизировали. Аликвоту немедленно сушили вымораживанием
(автоматическая сублимационная сушилка Virtis, Гардинер, Нью-Йорк), а остаток
der замораживали и хранили при -20 # {176} C.
Замороженный образец сушили до постоянного веса, чтобы установить содержание в нем воды
. Остаток измельчали до порошка, который был проанализирован на азот
(10), экстрагируемый жир методом Сокслета
(11) и содержание золы.Пищевой белок был принят равным 6,25
xобщ.N, а содержание углеводов рассчитано по разнице
(то есть сухой вес — [вес белка + жир + зола]).
Большая часть избыточных углеводов была обеспечена сахаром
фруктовых соков с известным однородным составом и содержанием энергии.
Они не были включены в 20% повторяющуюся выборку, но были проанализированы отдельно
; их энергетическое содержание
близко соответствует значениям, указанным производителями.Энергетическая ценность
фруктовых соков была добавлена к общей энергетической ценности
высокоуглеводных диет.
Расход энергии
В течение первых двух дней диеты с высоким содержанием жиров и низким содержанием углеводов
расход энергии не измерялся, но физическая активность была зафиксирована шагомером (Pedoboy # 10, Barigo Barometer
Fabrik Gmbh). , Швенингер, ФРГ). Частота сердечных сокращений контролировалась
непрерывно с использованием портативного прибора для мониторинга сердечного ритма
ment (HRM, Difa, Breda, Holland).Субъекты выполняли
различных видов физической активности, например бег и плавание,
в течение этого периода, чтобы истощить запасы гликогена в мышцах. В
в конце второго дня каждый испытуемый был помещен в камеру непрямого калориметра
(12) с открытым контуром, где в течение следующих 10 дней непрерывно измеряли расход энергии
. Скорость метаболизма мета-
в состоянии покоя измерялась в течение 1 часа каждое утро с помощью вытяжной системы с вентилируемым колпаком
внутри камеры (12).Каждый день испытуемые
проходили два 30-миллиметровых периода (начиная с 1130 и 17:30)
на беговой дорожке (Quinton Inst Co., Сиэтл, Вашингтон) со скоростью 2 мили в час (3,22
км / ч), уклон 5% утром и 2 мили в час (3,22 км / ч), днем 10% уклон
. В течение оставшейся части дня спонтанная физическая активность была разрешена в пределах, установленных камерой, но большие физические нагрузки не были разрешены.
Субъектам разрешалось покидать камеру дважды в день
на 30 мм после измерений скорости метаболизма в покое в
утром и снова днем в 16:30, в течение которых
раз были проверены калибровки анализаторов и были выполнены другие измерения
, например, масса тела, сбор мочи
и т. д.
Баланс питательных веществ
Стул собирали с 1 дня до нескольких дней после теста
. При каждом изменении диеты субъект потреблял 1 г car-
mine red в качестве фекального маркера. Стул взвешивали, замораживали, сушили замораживанием
и анализировали на содержание азота, жира и золы, а количество углеводов составляло
, рассчитанное по разнице, как описано выше.
Круглосуточное потребление питательных веществ и метаболической энергии —
потреблений было рассчитано из таблиц пищевых продуктов (9).Общее 24-часовое потребление энергии
было также определено на основе прямого анализа
20% высушенного дублированного образца и скорректировано на
потерь питательных веществ в скоплениях стула между появлением
фекальных маркеров.
Мочу собирали в течение дня (14 часов) и ночи (10
часов) и тестировали на глюкозу (Gluketur-Test, Boehringer
Mannheim Gmbh, Mannheim, FRG), и общий азот был проанализирован. (10).Суточное окисление белка рассчитывали путем суммирования
экскреции азота с мочой в течение дня и ночи и умножения
на 6,25. Круглосуточное окисление углеводов
и жиров рассчитывали по классической формуле
las (13) на основе небелкового респираторного коэффициента.
На основании данных о составе энергии, поступающей в тело
, которая окислялась и покидала тело с мочой и fe-
гостем 10 июля 2011 г. www.ajcn.orgDownloaded from
Диета с высоким содержанием углеводов — Mayo Clinic
Определение
Диета с загрузкой углеводов, также называемая диетой с загрузкой углеводов, — это стратегия улучшения ваших спортивных результатов в соревнованиях на выносливость за счет увеличения количества топлива, сохраняемого в ваших мышцах.
Углеводная загрузка происходит, когда вы придерживаетесь высокоуглеводной «тренировочной диеты» одновременно с уменьшением уровня активности за несколько дней до соревнований.
Назначение
Любая физическая активность требует углеводов в качестве топлива.В большинстве случаев ваше тело использует имеющиеся запасы энергии в качестве топлива.
Но когда вы занимаетесь длительными и интенсивными спортивными соревнованиями, вашему телу требуется дополнительная энергия, чтобы продолжать работу. Цель углеводной загрузки — дать вам энергию, необходимую для завершения упражнения на выносливость с меньшим утомлением, и улучшить ваши спортивные результаты.
Углеводная загрузка может быть наиболее полезной, если вы спортсмен на выносливость — например, марафонец, пловец, велосипедист или все трое — готовясь к соревнованиям, которые продлятся 90 минут или больше.Другим спортсменам обычно не нужна углеводная загрузка. Обычно достаточно получать около половины калорий из углеводов.
Сведения о диете
Роль углеводов
Углеводы, также известные как крахмал и сахар, являются основным источником энергии для вашего тела. Сложные углеводы включают бобовые, злаки и крахмалистые овощи, такие как картофель, горох и кукуруза. Простые углеводы содержатся в основном во фруктах и молоке, а также в продуктах с сахаром, таких как конфеты и другие сладости.
Во время пищеварения ваше тело расщепляет углеводы на сахар. Сахар попадает в ваш кровоток, где затем передается отдельным клеткам для обеспечения энергии. Сахар хранится в печени и мышцах в виде гликогена — вашего источника энергии.
Увеличьте запасы энергии
Обычно в ваших мышцах накапливается лишь небольшое количество гликогена — достаточно, чтобы поддерживать вас во время развлекательных упражнений. Если вы тренируетесь более 90 минут, в ваших мышцах может закончиться гликоген.В этот момент может наступить усталость, и ваша работоспособность может ухудшиться.
Но с углеводной загрузкой вы сможете накапливать больше энергии в своих мышцах. Это может дать вам выносливость, чтобы выдержать более длительные соревнования на выносливость. Но вам все равно придется потреблять некоторые источники энергии во время вашего мероприятия.
Углеводы
Углеводная нагрузка выполняется за неделю до тренировки на высокую выносливость. За один-три дня до мероприятия увеличьте потребление углеводов примерно до 8-12 граммов углеводов на килограмм веса тела.Сократите потребление продуктов с высоким содержанием жиров, чтобы компенсировать потребление продуктов, богатых углеводами.
Также сократите свои тренировки за три-четыре дня до соревнований. Сочетание большего количества углеводов и постепенного снижения активности, по-видимому, увеличивает запасы гликогена в мышцах.
Сколько углеводов вам нужно, зависит от вашей цели по общему количеству калорий, а также от вашего вида спорта. Для большинства спортсменов от 5 до 7 граммов углеводов на килограмм веса тела в день является правильным для общих тренировок. (Обратите внимание, что 1 килограмм равен 2.2 фунта). Спортсменам на выносливость может потребоваться до 12 граммов на килограмм.
Пример плана питания с высоким содержанием углеводов
Вот примерный план приема углеводов для спортсмена, который весит 77 килограммов. Он основан на 4,5 граммах углеводов на каждый фунт (10 граммов на килограмм) веса тела.
Вы можете настроить этот примерный план приема углеводов в соответствии со своими вкусами и потребностями в питании.
| Пример плана питания с высоким содержанием углеводов | ||
|---|---|---|
| Товар (сумма) | Углеводы (граммы) | Всего калорий |
| Завтрак | ||
| Молоко обезжиренное (12 унций) | 18 | 125 |
| 1 простой бублик (4.2 унции) | 52 | 260 |
| Арахисовое масло гладкое (2 столовые ложки) | 7 | 191 |
| Мед (2 столовые ложки) | 35 | 128 |
| Банан (1 средний) | 27 | 105 |
| Полдник | ||
| Хрустящие хлопья с изюмом и миндалем (1 стакан) | 74 | 360 |
| Виноградный сок (12 унций) | 55 | 225 |
| Обед | ||
| Молоко, шоколад с пониженным содержанием жира (12 унций) | 46 | 285 |
| 4 ломтика белого хлеба (1 унция на ломтик) | 49 | 266 |
| Куриная грудка, запеченная без кожи (4 унции или 1/2 грудки) | 0 | 187 |
| Салат Ромэн, тертый (1/4 стакана) | 0.5 | 2 |
| Ломтики красных помидоров (1/2 стакана) | 2 | 11 |
| Майонез, светлый (2 столовые ложки) | 3 | 71 |
| Чипсы Tortilla, обезжиренные, запеченные (1 унция) | 23 | 118 |
| Молодая морковь (12) | 10 | 42 |
| Полдник | ||
| Нежирный фруктовый йогурт (8 унций) | 47 | 250 |
| Мюсли из нежирных фруктов (1/2 стакана) | 33 | 157 |
| Черника (1 стакан) | 21 | 83 |
| Клюквенный сок, несладкий (12 унций) | 42 | 156 |
| Ужин | ||
| Дикий атлантический лосось, запеченный (3 унции) | 0 | 155 |
| Обеденный булочка из цельной пшеницы (2 булочки по 1 унции каждый) | 29 | 151 |
| Молоко обезжиренное (12 унций) | 18 | 125 |
| Салат комбайн: — Салат ромэн, тертый (2 стакана) | 3 | 16 |
| — Зелень или сладкий зеленый перец (1/4 стакана) | 2 | 7 |
| -Зеленое яблоко, нарезанное (1 среднее) | 25 | 95 |
| -Сушеная клюква (1/3 стакана) | 33 | 130 |
| -Английские грецкие орехи, измельченные (1/4 стакана) | 4 | 191 |
| — Сыр Азиаго, тертый (1 унция) | 1 | 134 |
| — Обезжиренная заправка для салата Ranch (2 столовые ложки) | 6 | 55 |
| Ужин | ||
| Клубника (1 стакан) | 11 | 46 |
| Щербет с любым вкусом (1 1/2 стакана) | 78 | 416 |
| Итого | 754.5 | 4,543 |
Источник: Nutritionist Pro, 2018
.Результаты
Углеводная нагрузка может дать вам больше энергии во время соревнований на выносливость. Вы можете почувствовать меньшую усталость и увидеть улучшение своих показателей после углеводной загрузки. Но углеводная загрузка эффективна не для всех.
Другие факторы могут повлиять на ваши спортивные результаты или повлиять на эффективность вашей стратегии загрузки углеводов, включая то, насколько вы в хорошей форме, насколько хорошо вы гидратируете и насколько интенсивно вы тренируетесь.Даже при углеводной загрузке вы все равно можете ощущать мышечную усталость.
Для мужчин диета с высоким содержанием углеводов может повысить уровень гликогена, хранящегося в мышцах, на 100 процентов от вашего нормального количества. Во время углеводной загрузки женщинам может потребоваться потреблять больше калорий, чем обычно, чтобы получить те же преимущества, что и мужчинам.
Несмотря на углеводную нагрузку, вам все равно необходимо восполнять энергию своего тела во время соревнований на выносливость, чтобы поддерживать уровень сахара в крови. Вы можете делать это, периодически употребляя спортивные напитки, гели или батончики, фрукты, твердые или жевательные конфеты во время мероприятия по 30–60 граммов каждый час или два.И не забывайте есть продукты, богатые углеводами, после тренировки на выносливость, чтобы пополнить запасы гликогена.
Риски
Углеводная нагрузка подходит не каждому атлету на выносливость. Перед началом углеводной загрузки рекомендуется проконсультироваться с врачом или диетологом, особенно если у вас диабет. Возможно, вам также придется поэкспериментировать с разным количеством углеводов, чтобы найти то, что лучше всего подходит для вас.
Диета с высоким содержанием углеводов может вызвать некоторый дискомфорт или побочные эффекты, например:
- Пищеварительный дискомфорт. Возможно, вам придется отказаться или ограничить употребление продуктов с высоким содержанием клетчатки за один или два дня до мероприятия. Фасоль, отруби и брокколи могут вызвать спазмы с газом, вздутие живота и жидкий стул.
- Изменения уровня сахара в крови. Углеводы могут повлиять на уровень сахара в крови. Если у вас диабет, следите за уровнем сахара в крови во время тренировки или тренировок, чтобы узнать, что лучше всего подходит для вас. И поговорите со своим диетологом или врачом, чтобы убедиться, что ваш план питания безопасен для вас.
- Основы углеводной загрузки для достижения спортивных результатов.Академия питания и диетологии. https://www.eatright.org/fitness/sports-and-performance/fueling-your-workout/basics-of-carbohydrate-loading-for-sports-performance. Проверено 5 июля 2018 г.
- Kerksick CM, et al. Позиция Международного общества спортивного питания: Выбор времени для питательных веществ. Журнал Международного общества спортивного питания. 2017; 14:33.
- Thomas TD, et al. Позиция Академии питания и диетологии, диетологов Канады и Американского колледжа спортивной медицины: питание и спортивные результаты.Журнал Академии питания и диетологии. 2016; 116: 501.
- Duyff RL. Ешьте разумно для занятий спортом. В: Руководство по полноценному питанию и питанию Академии питания и диетологии. 5-е изд. Нью-Йорк, Нью-Йорк: Houghton Mifflin Harcourt; 2017.
- Kenney WL, et al. Состав тела и спортивное питание. В кн .: Физиология спорта и физических упражнений. 6-е изд. Шампейн, штат Иллинойс: кинетика человека; 2015.
- Nutritionist Pro диетологический анализ (компьютерная программа). Стаффорд, Техас: Axxya Systems; 2008 г.https://nexgen1.nutritionistpro.com/shop/product-detail/nutritionist-pro-diet-analysis-software-13. По состоянию на 27 сентября 2018 г., .
- Deldique L, et al. Рекомендации по здоровому питанию бегунов на выносливость: обновленная информация.

