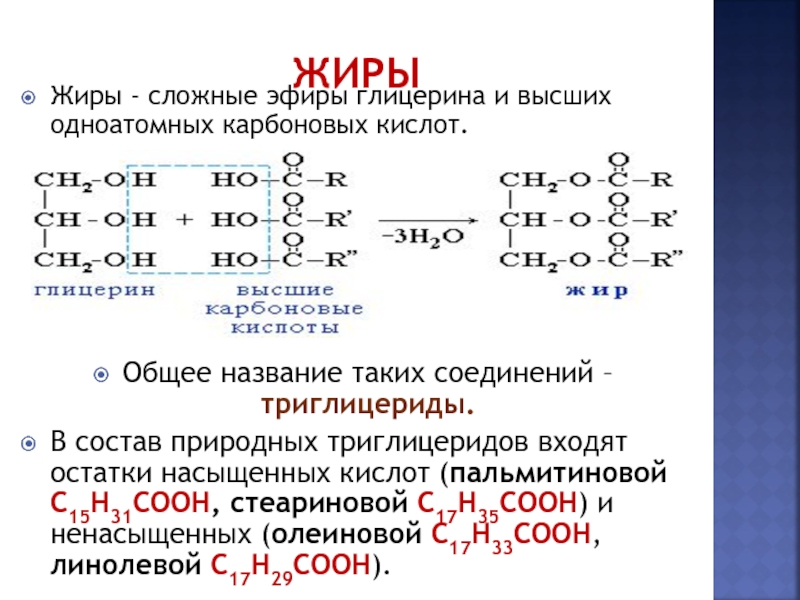
Линолевая кислота, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
=3260°C23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,074d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t° пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.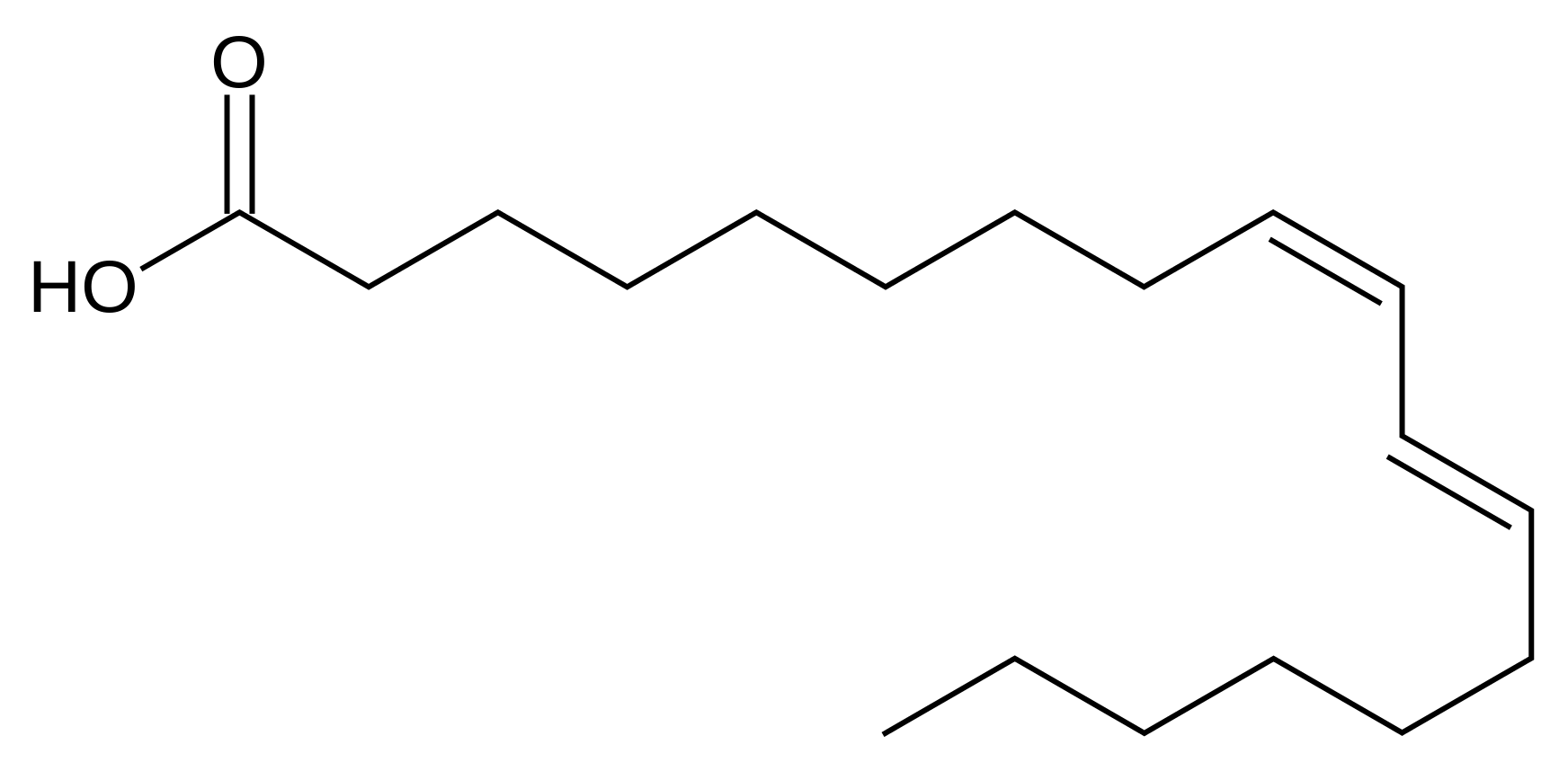
Чтобы получить подробное описание элемента, кликните по его названию.
Линолевая кислота. Свойства, особенности, сфера применения
Линолевая кислотаCAS номер: 60-33-3
Брутто формула: C18h42O2
Внешний вид: маслянистая жидкость желтого цвета.
Химическое название: Linoleic acid, (Z,Z)-9,12-Octadecadienoic acid; cis-9,cis-12-Octadecadienoic acid; Linolic acid.
Физико-химические свойства:
Молекулярный вес 280.45 г/моль
Плотность 0,902
Температура плавления -5 ºC
Температура кипения 229-230°С (16 мм рт.ст.)
Показатель преломления 1.4687-1.4707
Растворимость: Субстанция растворима в метаноле, ацетоне. Нерастворима в холодной воде.
Опасные продукты, образующиеся в результате горения: монооксид углерода, двуокись углерода и фтористый водород.
Описание:
Линолевая кислота (также называемая цис, цис, -9,12-октадекадиеновая кислота) является примером полиненасыщенной жирной кислоты из-за наличия двойных связей C = C. Она представляет собой омега-6 жирную кислоту. Это основная жирная кислота, содержащаяся в растительных маслах, таких как соевое, кукурузное, рапсовое. Ее используют для производства маргарина, кулинарных масел, а также мыла, эмульгаторов и быстросохнущих масел.
Она представляет собой омега-6 жирную кислоту. Это основная жирная кислота, содержащаяся в растительных маслах, таких как соевое, кукурузное, рапсовое. Ее используют для производства маргарина, кулинарных масел, а также мыла, эмульгаторов и быстросохнущих масел.
Линолевая кислота относится к одному из двух классов незаменимых жирных кислот, которые необходимы организму человека и животных. Если человек не потребляет достаточное количество этих эссенциальных жирных кислот, то могут возникнуть некоторые проблемы со здоровьем. Экспериментальный рацион с недостаточным количеством линолеата (солевая форма кислоты) вызывает умеренное поражение кожи, выпадение волос и нарушения в процессе восстановлении кожи. Линолевая кислота выполняет особую роль в поддержании здоровья сердца. Рандомизированные клинические испытания показали, что замена насыщенного жира в пище линолевой кислотой снижает общее количество холестерина ЛПНП(липопротеины низкой плотности). Имеются также некоторые свидетельства того, что линолевая кислота улучшает чувствительность к инсулину и нормализует артериальное давление.
Двумя семействами EFA (ненасыщенных жирных кислот) являются ω-3 (или омега-3 или n-3), которые поступают из рыбьего жира, и ω-6 (омега 6, n-6) — из растительных масел (одна из них — линолевая кислота). Когда в 1923 году они были обнаружены в качестве важных питательных веществ, два семейства незаменимых жирных кислот были обозначены как «витамин F». Но примерно в 1930 году было установлено, что они лучше классифицируются с жирами, чем с витаминами, поэтому название «витамин F» было заменено.
Применение:
Поскольку линолевая кислота является основным питательным веществом, она обычно добавляется в энтеральные, парентеральные формы и детские смеси, где содержание жира может варьироваться в зависимости от конкретного использования. Существуют также средства с линолевой кислотой, предназначенные для местного писпользования: кремы, мази и др. При местном применении линолевая кислота помогает лечить расстройства кожи, связанные с ее дефицитом.
Линолевая кислота и ее изомер (конъюгированная линолевая кислота) активно используются в специальном спортивном питании для похудения за счет уменьшения подкожного жира. Также применяется в ряде БАДов, принимаемых для снижения риска заболеваний сердечно-сосудистой системы и даже для профилактики онкологических заболеваний. Также назначается в составе комплексной терапии при болезни Альцгеймера, показывая положительный эффект в патогенезе болезни на ранней стадии процесса.
Получение:
Промышленный синтез линоленовой кислоты состоит в следующем. Вначале получают этиловый эфир линолевой кислоты путем смешивания 3-х компонентов: тетрабромстеариновой кислоты (перекристаллизованная), абсолютного этилового спирта и гранулированного цинка. Полученную смесь нагревают, учитывая, что реакция экзотермическая, периодически охлаждают. Минут через 5, когда начнется реакция отщепления брома, смесь помещают в обратный холодильник и она поддается кипячению 30 минут. Затем с определенным интервалом приливают раствор хлористого водорода. Полученную смесь совмещают с раствором поваренной соли, дожидаясь расслоения. Затем эмульсию центрифугируют и промывают.
Затем с определенным интервалом приливают раствор хлористого водорода. Полученную смесь совмещают с раствором поваренной соли, дожидаясь расслоения. Затем эмульсию центрифугируют и промывают.
Полученный эфир растворяют спиртовым 95% денатурированным раствором едкого натра и оставляют на ночь при комнатной температуре. Эту массу растворяют теплой водой с добавлением углекислого газа и разбавленной серной кислоты. Линолевая кислота всплывает на поверхность в виде прозрачного слоя. Полученную кислоту хранят под углекислым газом.
Действие на организм:
Линолевая кислота (18: 2ω6, цис, цис-9,12-октадекадиеновая кислота) является наиболее сильно потребляемой ПНЖК, обнаруженной в рационе человека. При потреблении линолевая кислота совершает 4 первичных пути. Как и все жирные кислоты, ее можно использовать как источник энергии. Ее можно этерифицировать с образованием нейтральных и полярных липидов, таких как фосфолипиды, триацилглицерины и сложные эфиры холестерина. В составе мембранных фосфолипидов линолевая кислота функционирует как структурный компонент для поддержания определенного уровня мембранной текучести трансдермального водного барьера эпидермиса. Кроме того, при высвобождении из мембранных фосфолипидов она может быть ферментативно окислена до различных производных, участвующих в клеточной передаче сигналов (то есть 13-гидрокси или 13-гидропероксиоктадекадиеновой кислоты( 13-H (P) ODE).
В составе мембранных фосфолипидов линолевая кислота функционирует как структурный компонент для поддержания определенного уровня мембранной текучести трансдермального водного барьера эпидермиса. Кроме того, при высвобождении из мембранных фосфолипидов она может быть ферментативно окислена до различных производных, участвующих в клеточной передаче сигналов (то есть 13-гидрокси или 13-гидропероксиоктадекадиеновой кислоты( 13-H (P) ODE).
В качестве исходного соединения для семейства PU 6 PUFA линолевая кислота может быть удлиненной и ненасыщенной до других биоактивных СО 6 PUFA, таких как γ-линоленовая кислота (18: 3ω6) и арахидоновая кислота (20: 4ω6). Впоследствии арахидоновая кислота может быть превращена в мириады биологически активных соединений, называемых эйкозаноидами, такими как простагландины и лейкотриены. Эти эйкозаноиды важны при нормальной метаболической функции клеток и тканей, но при постоянном выделении и избытке они, как известно, способствуют ряду хронических заболеваний, таких как воспаление и онкология.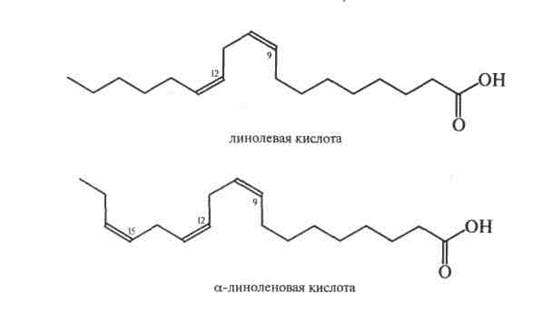
После потребления и абсорбции энтероцитами, выстилающими тонкий кищечник, линолевую кислоту упаковывают в хиломикроны в виде фосфолипидов, триацилглицеринов или эфиров холестерина и затем поступает в общую циркуляцию (подключичную вену) через грудной канал. Линолевая кислота доставляется в печеночные и внепеченочные ткани, так как хиломикроны делипидируются в пути и очищаются печенью при ее переходе на гораздо более мелкие остаточные частицы. После клеточного поглощения судьба линолевой кислоты определяется потребностями ткани, то есть включением в мембранные фосфолипиды, десатурацией и удлинением и т. Д.
Линолевая кислота является существенным (незаменимым) питательным веществом, которое содержит две двойные связи на девятом и 12-м атомах углерода из карбонильной функциональной группы. Поскольку люди не могут включать двойную связь за девятый углерод жирной кислоты, эта жирная кислота не может быть синтезирована и, следовательно, должна потребляться с пищей. В качестве основного компонента церамидов линолевая кислота участвует в поддержании трансдермального водного барьера эпидермиса. Содержание линолевой кислоты у младенцев может быть столь низким, как 0,5-2,0 % энергии, и лишение линолевой кислоты (то есть безжирное внутривенное вскармливание) может привести к чешуйчатым повреждениям кожи, замедлению роста и изменениям плазменной жирной кислоты и тромбоцитопении. Поскольку линолевая кислота находится в изобилии в детских смесях и продуктах питания и в грудном молоке человека, существенная нехватка жирных кислот не присуща здоровым людям. Аналогичным образом доказательство недостатка PU6 PUFA крайне редко встречается у взрослого населения в отсутствие врожденной ошибки метаболизма, то есть дефицита FADS2 (десатуразы жирных кислот 2, Δ6 десатуразы), скорости, ограничивающей скорость десатурации линолевых кислота к арахидоновой кислоте.
В качестве основного компонента церамидов линолевая кислота участвует в поддержании трансдермального водного барьера эпидермиса. Содержание линолевой кислоты у младенцев может быть столь низким, как 0,5-2,0 % энергии, и лишение линолевой кислоты (то есть безжирное внутривенное вскармливание) может привести к чешуйчатым повреждениям кожи, замедлению роста и изменениям плазменной жирной кислоты и тромбоцитопении. Поскольку линолевая кислота находится в изобилии в детских смесях и продуктах питания и в грудном молоке человека, существенная нехватка жирных кислот не присуща здоровым людям. Аналогичным образом доказательство недостатка PU6 PUFA крайне редко встречается у взрослого населения в отсутствие врожденной ошибки метаболизма, то есть дефицита FADS2 (десатуразы жирных кислот 2, Δ6 десатуразы), скорости, ограничивающей скорость десатурации линолевых кислота к арахидоновой кислоте.
Хотя линолевая кислота является важным питательным веществом, «нет никакой конкретной информации о количестве линолевой кислоты, необходимой для коррекции симптомов (ω6) дефицита ПНЖК», поэтому рекомендуемые ежедневные дозы(RDA) еще не установлены. Как таковые диетические эталонные дозы линолевой кислоты составляют адекватные дозы для женщин и мужчин в возрасте от 19 до 50 лет 12 г / сут и 17 г / сут соответственно. Данные основаны на приблизительном медианном потреблении здоровых людей.
Как таковые диетические эталонные дозы линолевой кислоты составляют адекватные дозы для женщин и мужчин в возрасте от 19 до 50 лет 12 г / сут и 17 г / сут соответственно. Данные основаны на приблизительном медианном потреблении здоровых людей.
 Отмеченными исключениями являются бобы, в которых линолевая кислота составляет от 40 до 50% от общего количества ПНЖК.
Отмеченными исключениями являются бобы, в которых линолевая кислота составляет от 40 до 50% от общего количества ПНЖК.
Токсикологические данные:
Может быть токсичным при вдыхании, при контакте с кожей и при проглатывании.
При оральном применении (LD50): 3200 мг / кг [мышь].
При оральном применении (LD50): 3200 мг / кг [крыса].
Формула Линолевой кислоты структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C18H32O2
Рациональная формула: С17Н31COOH
Химический состав Линолевой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 18 | 77,1% |
| H | Водород | 1. 008 008 |
32 | 11,5% |
| O | Кислород | 15.999 | 2 | 11,4% |
Молекулярная масса: 280,452
Не следует путать с линоленовой кислотой.
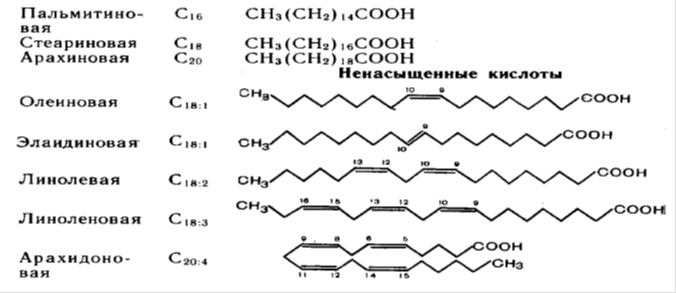
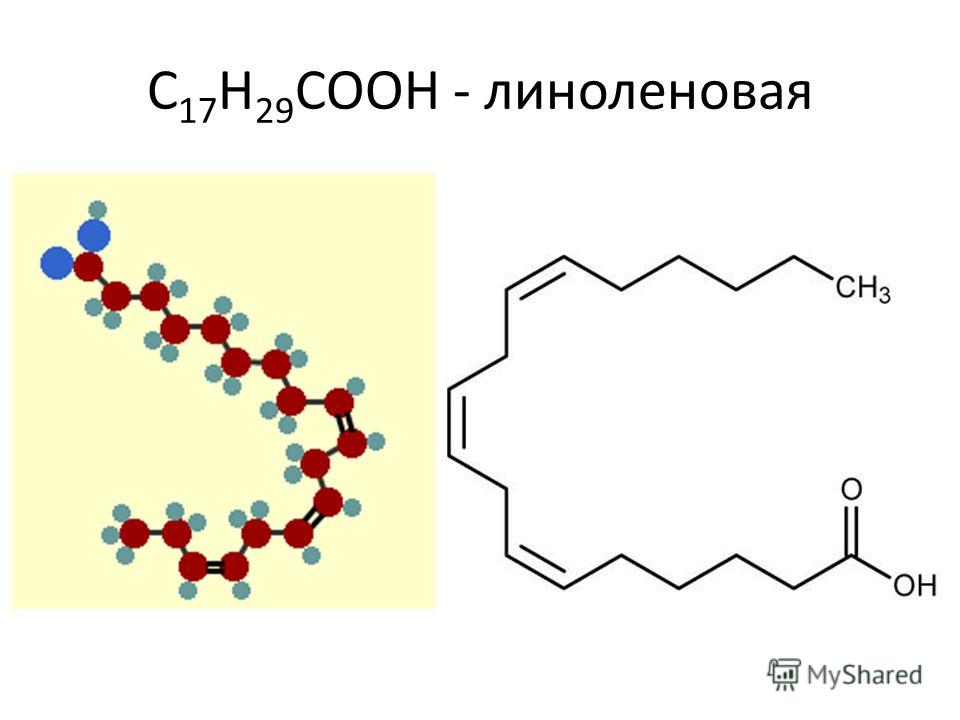
Линолевая кислота — одноосновная карбоновая кислота с двумя изолированными двойными связями CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH. Относится к омега-6-ненасыщенным жирным кислотам.
История
Формула линолевой кислоты С17Н31COOH была установлена в 1889 г. профессором А. Н. Реформатским.
Свойства
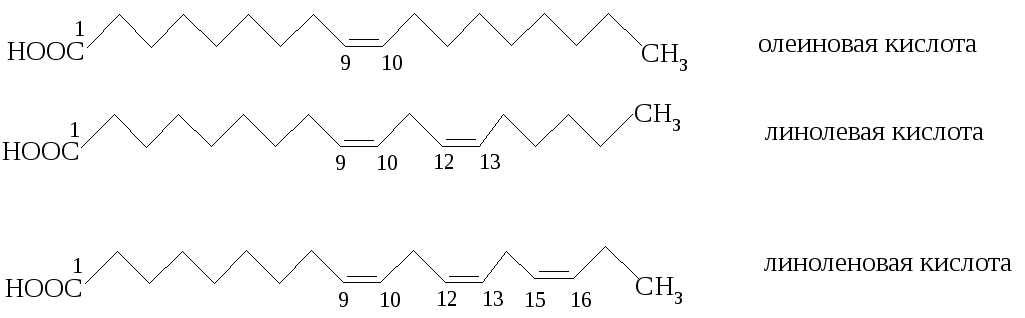
Линолевая кислота — светло-жёлтая маслянистая жидкость, нерастворимая в воде, но хорошо растворимая во многих органических растворителях. Tпл −11 °C, tkип 182 °C (532 н/м², или 4 мм рт. ст.), плотность 0,903 г/см³ (20 °C). В натуральных жирах линолевая кислота находится в виде геометрического цис-изомера. Она имеет неразветвлённую цепь углеродных атомов и две изолированные (не сопряжённые) двойные связи, одна из которых расположена между 9-м и 10-м, а вторая между 12-м и 13-м углеродными атомами (9,12-уноктадиеновая кислота). По положению двойной связи эта кислота относится к семейству кислот ω-6. Имея такое строение, линолевая кислота окисляется кислородом воздуха легче, чем олеиновая.
ст.), плотность 0,903 г/см³ (20 °C). В натуральных жирах линолевая кислота находится в виде геометрического цис-изомера. Она имеет неразветвлённую цепь углеродных атомов и две изолированные (не сопряжённые) двойные связи, одна из которых расположена между 9-м и 10-м, а вторая между 12-м и 13-м углеродными атомами (9,12-уноктадиеновая кислота). По положению двойной связи эта кислота относится к семейству кислот ω-6. Имея такое строение, линолевая кислота окисляется кислородом воздуха легче, чем олеиновая.
Нахождение в природе
Содержится в меньшей степени в животных жирах. Широко распространена в растительных маслах.
Биохимическое значение
Линолевая кислота вместе с линоленовой кислотой относится к так называемым незаменимым жирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов — триглицеридов и фосфатидов. Линолевая кислота относится к классу омега-6-ненасыщенных жирных кислот, поэтому организм человека способен синтезировать из неё относящуюся к этому же классу четырежды ненасыщенную арахидоновую жирную кислоту. В клеточных мембранах человека линолевой кислоты содержится в среднем в 10 раз раз больше, чем омега-3-ненасыщенной α-линоленовой жирной кислоты, что доказывает критическую важность линолевой кислоты и всего класса омега-6-ненасыщенных жирных кислот для нормального функционирования клеточных и субклеточных мембран. В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многих растительных масел и животных жиров, например соевого, хлопкового, подсолнечного, льняного, конопляного масел, китового жира.
Линолевая кислота относится к классу омега-6-ненасыщенных жирных кислот, поэтому организм человека способен синтезировать из неё относящуюся к этому же классу четырежды ненасыщенную арахидоновую жирную кислоту. В клеточных мембранах человека линолевой кислоты содержится в среднем в 10 раз раз больше, чем омега-3-ненасыщенной α-линоленовой жирной кислоты, что доказывает критическую важность линолевой кислоты и всего класса омега-6-ненасыщенных жирных кислот для нормального функционирования клеточных и субклеточных мембран. В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многих растительных масел и животных жиров, например соевого, хлопкового, подсолнечного, льняного, конопляного масел, китового жира.
Линолевая кислота — Справочник химика 21
Таким образом, определив величину Д В1 и зная скорости фотохимически инициированного и темнового процессов ии и можно определить отношение Поскольку из данных по стационарной скорости реакции при известной скорости инициирования можно определить отношение к / к , то метод фотохимического последействия дает возможность раздельного определения констант скорости продолжения и квадратичного обрыва цепей. На рис. 81 приведена кинетическая кривая окисления этилового эфира линолевой кислоты при 25° С и при давлении кислорода 160 мм рт. ст. [c.305]
На рис. 81 приведена кинетическая кривая окисления этилового эфира линолевой кислоты при 25° С и при давлении кислорода 160 мм рт. ст. [c.305] Лимонная кислота Линолевая кислота [c.71]
Химизм действия сиккативов еще ие достаточно выяснен, но они, бесспорно, ускоряют образование перекисей, так как металлы с переменной валентностью являются переносчиками кислорода. Механизм действия РЬО на высыхание льняной олифы может быть объяснен следующим образом (L—остаток линолевой кислоты) [c.244]
Смесь димера линолевой кислоты (40%) и эфиров фосфорной кислоты [c.198]
Эффективное противокоррозионное действие при введении в этилированные бензины оказывает присадка, состоящая из 70— 90 % (масс.) полимеризованной линолевой кислоты и 10—30 % [c.275]
Окислительная полимеризация происходит при образовании полимеров из ненасыщенных соединений за счет поглощения ими кислорода. Процесс твердения пленки в этом случае ускоряется в присутствии сиккативов. Ниже приводятся некоторые реакции, характерные для окислительной полимеризации (в качестве соединения с неконцевой ненасыщенностью используется радикал линолевой кислоты) [c.212]
Процесс твердения пленки в этом случае ускоряется в присутствии сиккативов. Ниже приводятся некоторые реакции, характерные для окислительной полимеризации (в качестве соединения с неконцевой ненасыщенностью используется радикал линолевой кислоты) [c.212]
В среднем соотношение скоростей гидрирования линоленовой, олеиновой и линолевой кислот равно 70 30 1. [c.44]
Возможен и другой ход полимеризации, при котором три молекулы линолевой кислоты реагируют одновременно и дают тример [c.28]
Оценка эффективности разделения кислот рассмотрена А. Л. Маркманом и Б. А. Кацем [315] на примере отделения насыщенных и олеиновой кислот от линолевой кислоты. Величину селективности S они предложили выражать следующим образом [c.222]
Совершенно другие свойства имеют ненасыщенные жирные кислоты с двумя двойными связями h3n-4t)2. Из этих кислот наиболее распространена в растительных маслах линолевая кислота, быстроокисляющаяся кислородом воздуха, а при нагревании легко полимеризующаяся. Процесс полимеризации может привести к образованию димеров, тримеров и полимеров. Принимается, что при полимеризации линолевой кислоты получается следующий димер [c.27]
Процесс полимеризации может привести к образованию димеров, тримеров и полимеров. Принимается, что при полимеризации линолевой кислоты получается следующий димер [c.27]
ЛI — содержание линолевой кислоты во фракции, выделенной из комплекса, вес. % [c.222]
Л2 — содержание линолевой кислоты во фракции из фильтрата, вес. %. [c.222]
ЛИНОЛЕВАЯ КИСЛОТА — ненасыщенная карбоновая кислота с изолированными двойными связями, т. пл.—5,2 С, С5НцСН=СНСН2СН= СН (СНа),СООН. Для Л. к. возможны 4 геометрических изомера. Л. к. относится к незаменимым жирным кислотам в природе встречается в виде триглицеридов и в смеси с триглицеридами других кислот входит в состав важнейших высыхающих масел, применяемых в производстве лаков, красок, эмалей и олиф. В подсолнечном масле Л. к. до 52—53%, в льняном — до 30%, в конопляном — до 50—60% и т. д. [c.147]
При определении содержания линолевой кислоты во фракциях но значениям йодных и родановых чисел величину селективности можно выразить следующим образом [c.
 222]
222]Числа n могут быть не только целыми, но и дробными. Например, окисление этилового эфира линолевой кислоты до соответствующей перекиси [c.151]
При ступенчатом гидрировании линолевой, линоленовой и других еще более непредельных кислот над N -катализатором получается смесь изомерных олеиновых кислот, которые известны под общим названием изоолеиновых кислот. Последние можно получить при ступенчатом гидрировании линолевой кислоты, благодаря насыщению водородом различных двойных связей [c.357]
Число изоолеиновых кислот возрастает с увеличением числа двойных связей в исходной молекуле линоленовая кислота при гидрировании образует три изомерных линолевых кислоты [c.357]
Талловое масло представляет собой смесь непредельных жирных и смоляных кислот, сильно различающихся по строению и свойствам. Фракция жирных кислот состоит примерно из равных количеств олеиновой и линолевой кислот и небольшого количества пальмитиновой кислоты.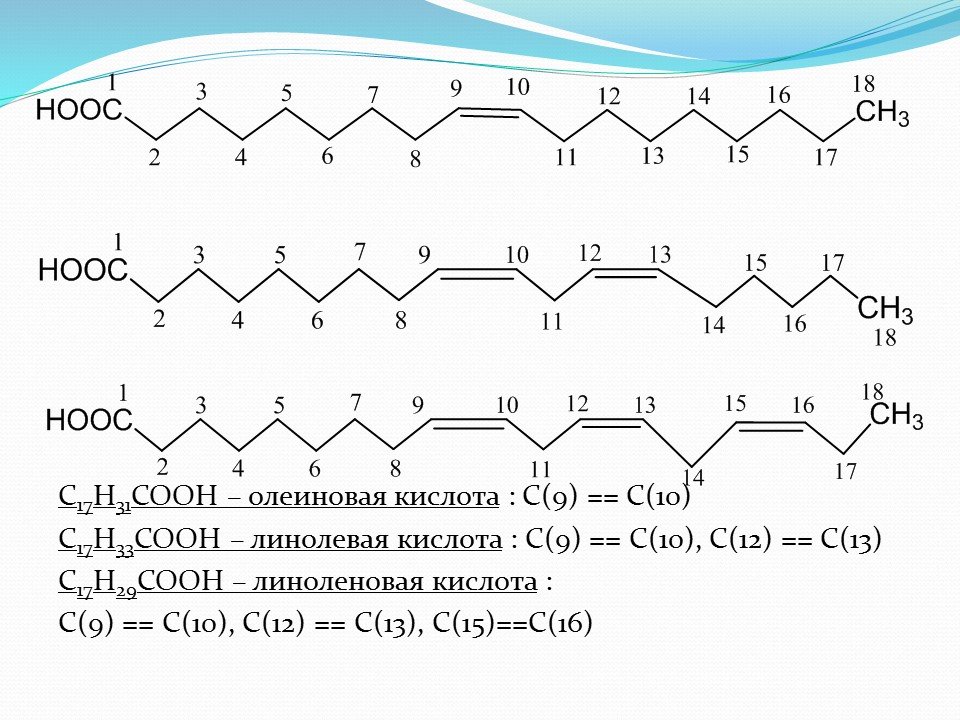 Смоляные кислоты состоят из смеси но меньшей мере семи кислот, изомерных с абиетиновой (I). Содержание каждой кислоты варьируется в зависимости от исходного сырья и процесса получения таллового масла. Изомерные смоляные кислоты отличаются от абиетиновой кислоты числом и положением двойных связей. Так, наряду с абиетиновой кислотой (I), содержание которой составляет —40% фракции смоляных кислот, имеется неоабиетиновая кислота (II) и дигидроабиетиновая кислота (III), суммарное содержание которых =[c.106]
Смоляные кислоты состоят из смеси но меньшей мере семи кислот, изомерных с абиетиновой (I). Содержание каждой кислоты варьируется в зависимости от исходного сырья и процесса получения таллового масла. Изомерные смоляные кислоты отличаются от абиетиновой кислоты числом и положением двойных связей. Так, наряду с абиетиновой кислотой (I), содержание которой составляет —40% фракции смоляных кислот, имеется неоабиетиновая кислота (II) и дигидроабиетиновая кислота (III), суммарное содержание которых =[c.106]
Растворимости смолы в масле можно достичь также добавками стеариновой и линолевой кислот, глицерина и других многоатомных спиртов, глицерина с фталевым ангидридом и т. д. Лаки и краски, приготовленные из таких модифицированных бакелитов, отличаются прекрасной кроющей способностью и высокой прочностью. [c.498]
Линолевая кислота Растительное С=С масло [c.460]
Первый столбец цифр содержание глицерида н-линолевой кислоты, второй а Содержание глицерида изолинолевой кислоты.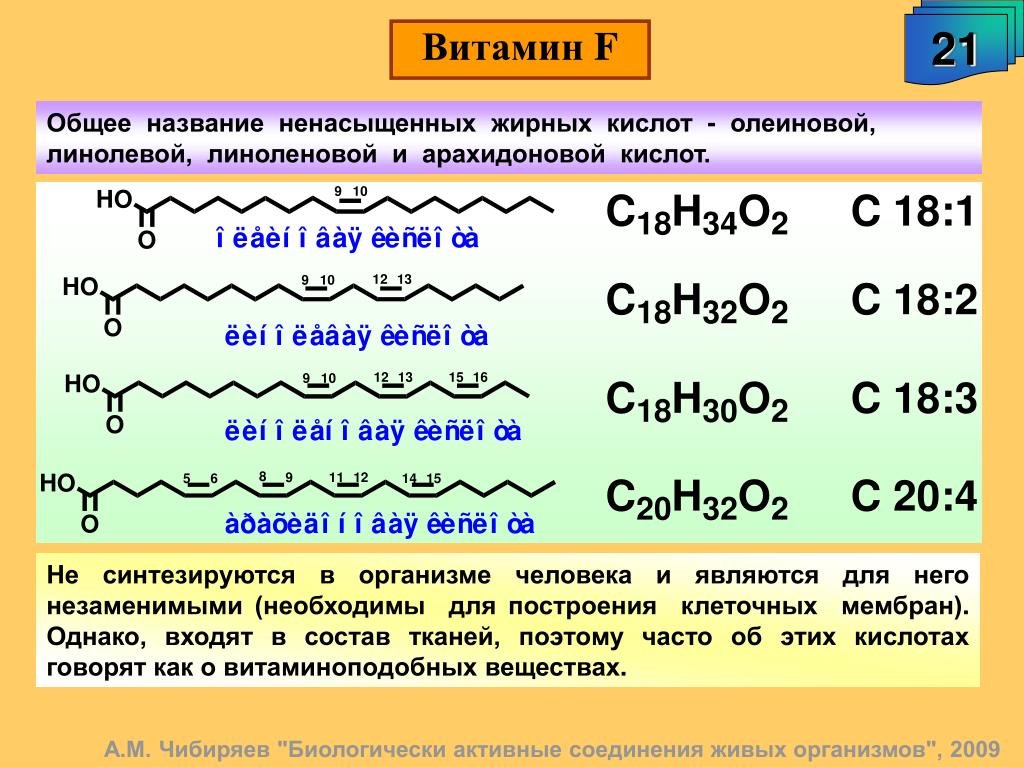 [c.43]
[c.43]
Полученный тример, который имеет три двойные связи, может полимеризоваться с новыми молекулами линолевой кислоты, или другими ненасыщенными кислотами, что приведет к образованию еще более сложных продуктов [11, с. 31]. При исследовании жира, который в течение 15 веков находился на морском дне, установлено, что он содержит много (63,47о) насыщенных жирных кислот [12]. Эйблсан и Паркеп [9, с. 110] показали, что в морских илах присутствуют главным образом насыщенные жирные кислоты лишь с небольшой примесью ненасыщенных. Это является убедительным доказательством протекания подобных полимеризацион-ных процессов в ненасыщенных жирных кислотах при их длительном пребывании в отсутствие кислорода. [c.28]
Соединения, способные служить диспергентами в топливах, найдены среди алкиламинов, нефтяных сульфонатов щелочно-земельных металлов (Са, Ва), жирных кислот, некоторых фосфорсодержащих соединений, наф-тенатов, фенолятов, полярных полимеров, содержащих азотистые основания, и др. [1—5, 9, 10, 14—19]. Указывается также на эффективность сукцинимидов [6], сульфоната натрия, три-н-бутиламина, димера линолевой кислоты, бариевой соли бис-/г-7 рет -алкилфенолдисуль-фида и других соединений. Описано уже более 70 соединений, и список этот довольно быстро пополняется [20— 24]. [c.140]
[1—5, 9, 10, 14—19]. Указывается также на эффективность сукцинимидов [6], сульфоната натрия, три-н-бутиламина, димера линолевой кислоты, бариевой соли бис-/г-7 рет -алкилфенолдисуль-фида и других соединений. Описано уже более 70 соединений, и список этот довольно быстро пополняется [20— 24]. [c.140]
Показано, что противоизносной присадкой может служить товарный ингибитор коррозии для реактивных топлив Santolene С, представляющий собой в основном димер линолевой кислоты [9, 10, 17—20] (см. гл. 8). Влияние этой присадки в различных концентрациях на противоизносные свойства очищенных топлив видно из следующих данных [19] [c.175]
Достигнуты значительные успехи в селекции рапса удалось снизить содержание в рапсовом масле линоленовой кислоты (до 3%) в пользу линолевой масла с низким содержанием линоленовой кислоты, кроме того, обладают более приятным запахом преобладает запах плодов и частично снижается запах рыбы. Таким же путем в масле снижено и содержание экологоопасной эруковой кислоты. С использованием новейших достижений биотехнологии в Канаде выведен новый сорт рапса — anola, отличающийся практическим отсутствием эруковой кислоты и соотношением линолевая кислота линоленовая кислота = 2 5. Канола сейчас широко используется во всем мире в технических целях. Интенсивные исследования в этой области ведет algen In . [c.248]
С использованием новейших достижений биотехнологии в Канаде выведен новый сорт рапса — anola, отличающийся практическим отсутствием эруковой кислоты и соотношением линолевая кислота линоленовая кислота = 2 5. Канола сейчас широко используется во всем мире в технических целях. Интенсивные исследования в этой области ведет algen In . [c.248]
Непредельные высшие жирные кислоты с одной или двумя двойными связями и их алкиловые эфиры присоединяют фенолы по месту двойных связей в присутствии фтористого бора. Фенол ж метиловый эфир олеиновой кислоты в присутствии фтористого бора и HgO при нагревании в течение 5 час. до 110° С образуют метиловый эфир 10-( -оксифенил)-октадекановой кислоты [95]. Аналогично фенол присоединяется к метиловому эфиру линолевой кислоты в присутствии фтористого бора [96]. [c.195]
Продукт полимеризации органических кислот Беззольные полярные соединения типа высших кислот Димеры и гримеры линолевой кислоты и бис-диаминофенил-ортофосфат [c. 375]
375]
Высыхающие масла имеют высокое процентное содержание г ш-церидов линолевой, линоленовой и других еще более ненасыш,енных кислот. Высыхание происходит тем быстрее, чем больше в масле содержится линолевой кислоты. Тигшчиые высыхаюи ие масла характерны присутствием в них до бОЧо линолевой кислоты (табл. 18). [c.239]
Подсолнечное, маковое и ореховое масла содержат 30—50, и линолевой кислоты и поэтому высыхают медленнее полувысыхающпс масла). Наконец, такие масла, как оливковое и сурепное, совсем не высыхают, а лишь прогоркают ири хранении они содержат много олеиновой и мало линолевоГ кислоты невысыхающие масла). [c.239]
Согласно новейшим исследованиям, в особенности Уотермана, при отверждении жиров происходит не только гидрирование, но и элаиди-низация , т. е. переход олеиновой кислоты в элаидиновую, и тем самым повышение температуры плавления жира. Отверждение жиров может быть достигнуто и путем нагревания с одним никелем или (еще лучше) с 802 при ПО—П5°, причем в этих условиях происходит элаидиниза-ция.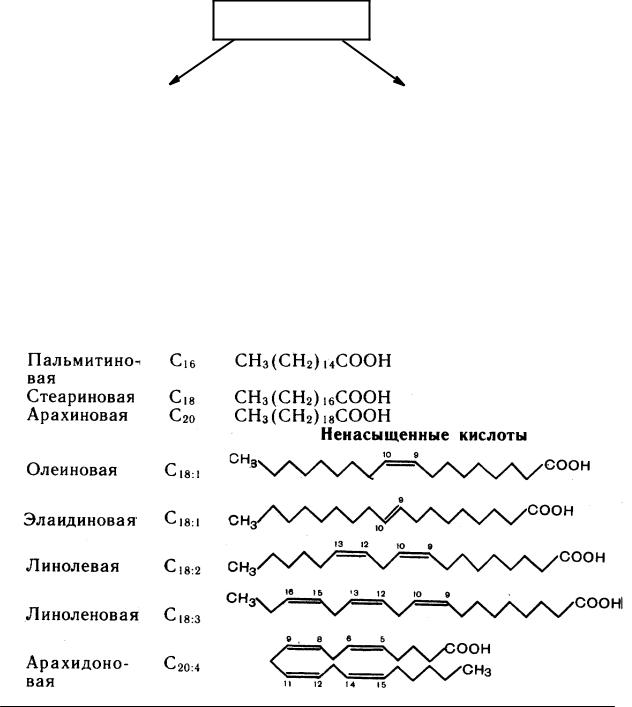 Если производить нагревание с 50г при еще более высокой температуре, то происходит также перегруппировка линолевой кислоты в кислоты с сопряженными двойными связями. При этом температура плавления масла возрастает, но одновременно увеличивается и его способность к окислению и полимеризации, т. е. масло становится высыхающим . [c.267]
Если производить нагревание с 50г при еще более высокой температуре, то происходит также перегруппировка линолевой кислоты в кислоты с сопряженными двойными связями. При этом температура плавления масла возрастает, но одновременно увеличивается и его способность к окислению и полимеризации, т. е. масло становится высыхающим . [c.267]
Включение в состав аддуктов веществ, растворимых углеводородом (в частности, летучих препаратов), применяемых для уничтожения вредных организмов, так называемых фумигантов, делает обращение с подобными веществами и безопаснее, и удобнее. Ад-дуктообразование используют для защиты таких жирных кислот, как неустойчивая линолевая кислота, от окисления на воздухе. Подобные аддукты мочевины можно добавлять к пищевым продуктам. Обращает на -себя внимание способность сухой тиомочевины поглощать ССЦ с образованием аддукта, что можно использовать для регенерации этого летучего растворителя. [c.29]
Олифы применяются для изготовления и разведения густотертых красок, шпаклевок и для грунтовки окрашиваемой поверхности. Краски, изготовленные на основе олифы, являются одним из основных средств защиты металлов от атмосферной коррозии (например, крыши зданий), а дерева —от гниения. Олифы используются для декоративной отделки внешней и внутренней поверхности объектов и изделий. Высококачественную олифу можно изготовить из касторового масла, в состав глицерида которого входит рицинолевая кислота (оксиолеиновая). Реакцией дегидратации из этой кислоты можно получить высыхающую линолевую кислоту. Таким образом, из невысыхающего касторового масла образуется высыхающая касторовая олифа, пригодная для выполнения малярных работ. [c.171]
Краски, изготовленные на основе олифы, являются одним из основных средств защиты металлов от атмосферной коррозии (например, крыши зданий), а дерева —от гниения. Олифы используются для декоративной отделки внешней и внутренней поверхности объектов и изделий. Высококачественную олифу можно изготовить из касторового масла, в состав глицерида которого входит рицинолевая кислота (оксиолеиновая). Реакцией дегидратации из этой кислоты можно получить высыхающую линолевую кислоту. Таким образом, из невысыхающего касторового масла образуется высыхающая касторовая олифа, пригодная для выполнения малярных работ. [c.171]
Линолевая кислота С17Н31СООН представляет собой ненасыщенную кислоту с двумя двойными связями [c.385]
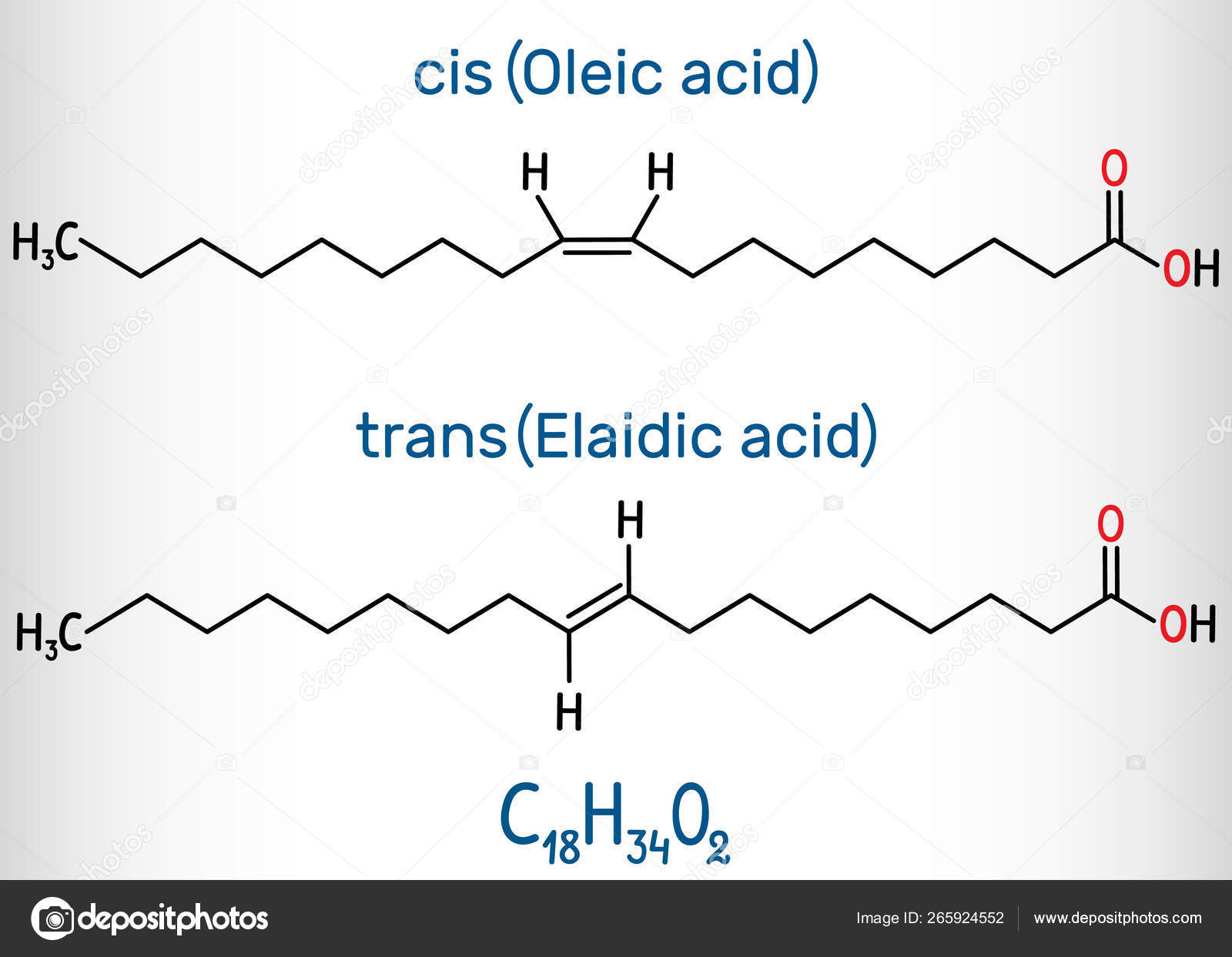
Линолеиовая кислота С17Н29СООН сопутствует линолевой кислоте в льняном масле. Содержит три непредельные связи [c.386]
Основы неорганической химии для студентов нехимических специальностей (1989) — [ c.
 331
]
331
]
Органикум. Практикум по органической химии. Т.2 (1979) — [ c.98 ]
Биохимия Том 3 (1980) — [ c.151 ]
Введение в химию природных соединений (2001) — [ c.107 ]
Синтезы органических препаратов Сб.3 (1952) — [ c.277 ]
Названия органических соединений (1980) — [ c.0 ]
Начала органической химии Книга первая (1969) — [ c.324 , c.330 ]
Органическая химия (1979) — [ c.645 ]
Молекулярная биотехнология принципы и применение (2002) — [ c.409 , c.410 ]
Справочник биохимии (1991) — [
c. 143
,
c.147
]
143
,
c.147
]
Количественный органический анализ по функциональным группам (1983) — [ c.297 ]
Биоорганическая химия (1991) — [ c.458 , c.460 , c.477 ]
Биологическая химия (2002) — [ c.56 ]
Биохимия (2004) — [ c.287 ]
Органическая химия (1990) — [ c.552 ]
Органическая химия (2001) — [ c.363 ]
Органическая химия (1998) — [ c.424 , c.426 ]
Теоретические основы биотехнологии (2003) — [
c.29
,
c. 300
]
300
]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.301 ]
Справочник Химия изд.2 (2000) — [ c.489 ]
Установление структуры органических соединений физическими и химическими методами том 2 (1967) — [ c.240 , c.241 , c.263 , c.522 ]
Органическая химия (1964) — [ c.500 , c.559 ]
Жидкостная колоночная хроматография том 3 (1978) — [ c.2 , c.202 ]
Энциклопедия полимеров Том 2 (1974) — [ c.140 , c.141 ]
Энциклопедия полимеров Том 3 (1977) — [
c. 2
,
c.140
,
c.141
]
2
,
c.140
,
c.141
]
Энциклопедия полимеров том 1 (1972) — [ c.0 ]
Общий практикум по органической химии (1965) — [ c.404 ]
Основы органической химии (1968) — [ c.448 ]
Промышленная органическая химия (1977) — [ c.23 , c.604 , c.609 ]
Реакции органических соединений (1966) — [ c.284 ]
Основные начала органической химии том 1 (1963) — [ c.476 ]
Биохимия растений (1966) — [
c.287
,
c.318
,
c.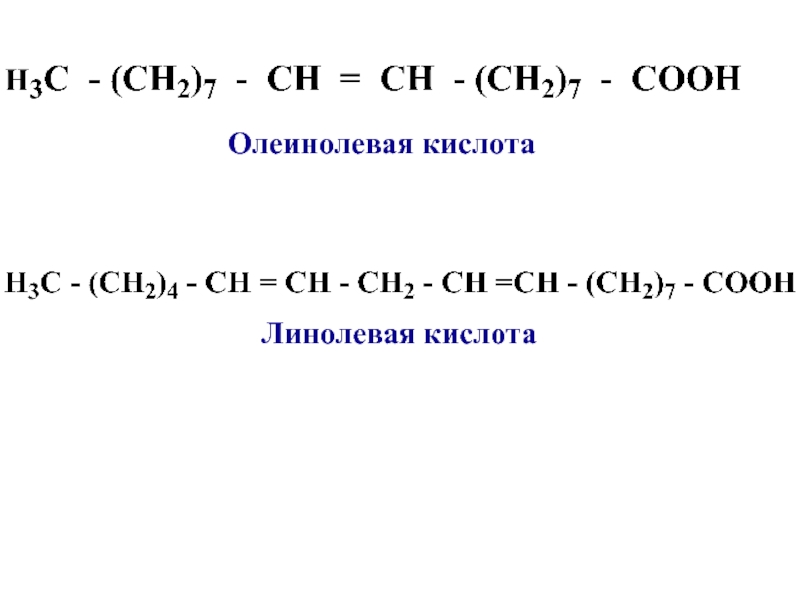 320
,
c.328
]
320
,
c.328
]
Энциклопедия полимеров Том 1 (1974) — [ c.0 ]
Энциклопедия полимеров Том 2 (1974) — [ c.140 , c.141 ]
Энциклопедия полимеров Том 3 (1977) — [ c.2 , c.140 , c.141 ]
Основы биохимии Т 1,2,3 (1985) — [ c.328 , c.561 , c.633 , c.819 ]
Основы органической химии (1983) — [ c.234 , c.237 ]
Курс органической химии (1979) — [ c.227 ]
Органическая химия для студентов медицинских институтов (1963) — [
c. 117
,
c.133
,
c.135
,
c.144
]
117
,
c.133
,
c.135
,
c.144
]
Электрохимический синтез органических веществ (1976) — [ c.88 ]
Биологическая химия Издание 3 (1960) — [ c.91 , c.93 ]
Биологическая химия Издание 4 (1965) — [ c.94 , c.96 , c.316 ]
Краткая химическая энциклопедия Том 1 (1961) — [ c.0 ]
Электродные процессы в органической химии (1961) — [ c.94 ]
Основы органической химии 1 Издание 2 (1978) — [ c.537 ]
Основы органической химии Часть 1 (1968) — [
c. 448
]
448
]
Курс органической химии (1970) — [ c.157 ]
Органическая химия Углубленный курс Том 2 (1966) — [ c.5 , c.576 , c.579 , c.579 , c.583 , c.584 , c.594 ]
Основные начала органической химии Том 1 Издание 6 (1954) — [ c.408 ]
Органическая химия Издание 2 (1980) — [ c.296 ]
Органическая химия (1956) — [ c.327 , c.347 ]
Органическая химия (1972) — [
c.247
,
c.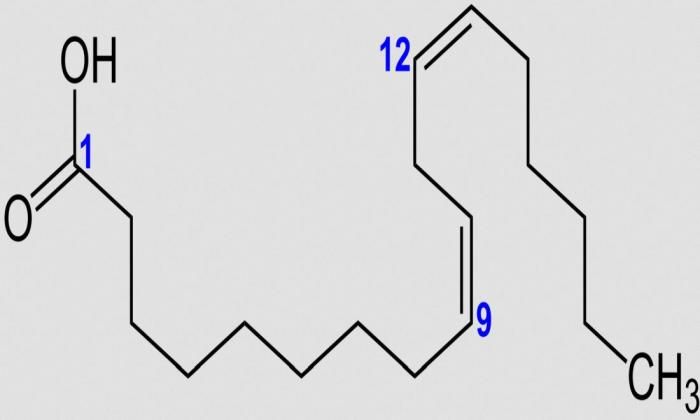 268
]
268
]
Основные начала органической химии Том 2 1957 (1957) — [ c.703 ]
Основные начала органической химии Том 2 1958 (1958) — [ c.703 ]
Биохимия растений (1968) — [ c.192 ]
Органическая химия (1976) — [ c.126 , c.139 ]
Сырье и полупродуктов для лакокрасочных материалов (1978) — [ c.236 ]
Электрохимия органических соединений (1968) — [ c.159 ]
Химия жиров Издание 2 (1962) — [ c.44 , c.231 , c.240 ]
Электрохимический синтез органических веществ (1976) — [
c. 88
]
88
]
Органическая химия Издание 3 (1963) — [ c.199 ]
Органическая химия (1956) — [ c.189 ]
Химия органических лекарственных препаратов (1949) — [ c.243 , c.670 ]
Поверхностно-активные вещества _1979 (1979) — [ c.111 ]
Пенополимеры на основе реакционноспособных олигомеров (1978) — [ c.55 ]
Лакокрасочные покрытия (1968) — [ c.46 , c.71 , c.335 ]
Сырье и полупродукты для лакокрасочных материалов (1978) — [ c.236 ]
Водорастворимые пленкообразователи и лакокрасочные материалы на их основе (1986) — [
c. 33
,
c.43
]
33
,
c.43
]
Основы химии диэлектриков (1963) — [ c.263 ]
Химия и технология пленкообразующих веществ (1978) — [ c.283 , c.284 , c.285 , c.287 , c.288 , c.293 , c.311 ]
Курс органической химии Издание 4 (1985) — [ c.190 , c.204 ]
Органическая химия (1972) — [ c.247 , c.268 ]
Органическая химия Издание 2 (1976) — [ c.253 ]
Органическая химия Издание 3 (1980) — [
c. 234
,
c.253
]
234
,
c.253
]
Лакокрасочные материалы (1961) — [ c.138 ]
Химия лаков, красок и пигментов Том 1 (1960) — [ c.28 , c.29 , c.67 , c.77 , c.346 , c.369 ]
Особенности брожения и производства (2006) — [ c.21 , c.23 , c.41 ]
Анализ органических соединений Издание 2 (1953) — [ c.21 , c.218 , c.219 , c.237 ]
Курс органической химии (0) — [
c. 258
,
c.259
,
c.260
,
c.271
]
258
,
c.259
,
c.260
,
c.271
]
Краткая химическая энциклопедия Том 2 (1963) — [ c.75 ]
Органическая химия (1964) — [ c.559 , c.560 ]
Справочное руководство по эпоксидным смолам (1973) — [ c.129 ]
Начала органической химии Кн 1 Издание 2 (1975) — [ c.304 , c.309 , c.310 ]
Диеновый синтез (1963) — [ c.232 , c.233 ]
Химия органических лекарственных веществ (1953) — [ c.478 ]
Органическая химия Издание 4 (1970) — [
c.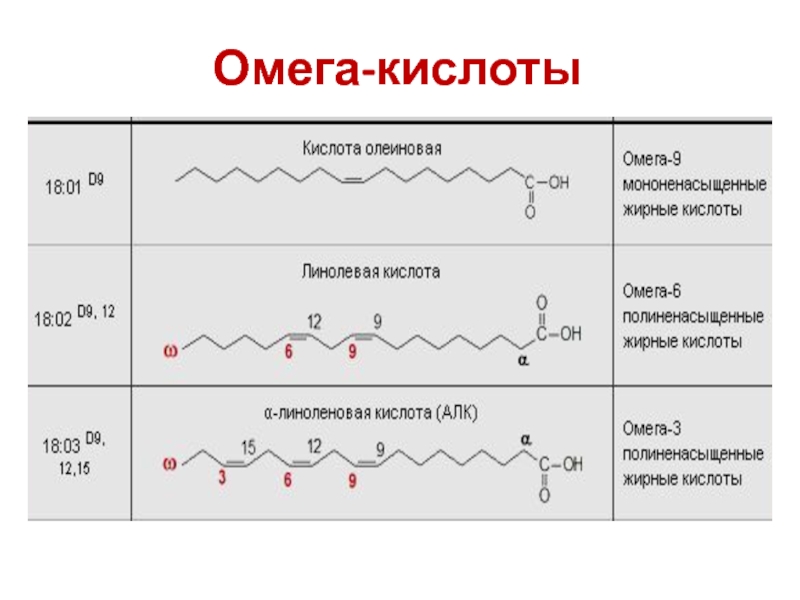 122
]
122
]
Химия древесины Т 1 (1959) — [ c.0 ]
Курс органической химии (1955) — [ c.200 ]
Поверхностноактивные вещества и моющие средства (1960) — [ c.0 ]
Биология Том3 Изд3 (2004) — [ c.325 ]
Коррозия металлов Книга 1,2 (1952) — [ c.825 ]
Синтезы органических препаратов Сборник 3 (1952) — [ c.277 ]
Биохимия Издание 2 (1962) — [ c.84 , c.86 , c.316 ]
Жизнь зеленого растения (1983) — [ c.164 ]
Биохимия человека Т.2 (1993) — [
c.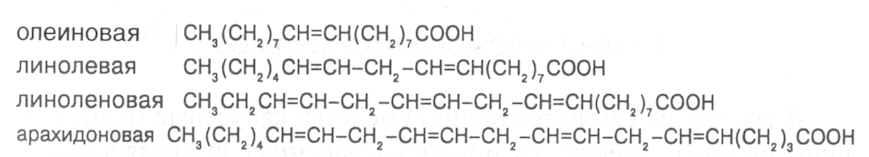 230
,
c.231
,
c.238
,
c.239
,
c.240
,
c.241
,
c.242
,
c.275
,
c.278
]
230
,
c.231
,
c.238
,
c.239
,
c.240
,
c.241
,
c.242
,
c.275
,
c.278
]
Биохимия человека Том 2 (1993) — [ c.230 , c.231 , c.238 , c.239 , c.240 , c.241 , c.242 , c.275 , c.278 ]
Технические культуры (1986) — [
c.71
,
c. 73
,
c.97
,
c.131
,
c.135
]
73
,
c.97
,
c.131
,
c.135
]
Основы биохимии (1999) — [ c.159 , c.375 , c.415 ]
Биологическая химия (2004) — [ c.288 , c.296 ]
Коррозия металлов Книга 2 (1952) — [ c.0 ]
Основы химии диэлектриков (1963) — [ c.263 ]
Органический анализ (1981) — [ c.136 , c.500 ]
польза и применение в косметике
Что такое линолевая кислота, ее свойства
Линолевая кислота относится к полиненасыщенным незаменимым жирным кислотам, а именно к классу Omega-6 (не путать с альфа-линолевой кислотой — Omega-3).:max_bytes(150000):strip_icc()/Linoleic_acid-58b5faf83df78cdcd82c2659.jpg) «Незаменимость» этих кислот заключается в том, что мы не можем производить их сами, поэтому должны получать этот бесценный материал вместе с пищей.
«Незаменимость» этих кислот заключается в том, что мы не можем производить их сами, поэтому должны получать этот бесценный материал вместе с пищей.
Человек получает линолевую кислоту через пищу © iStock
В организме человека линолевая кислота присутствует в качестве липида клеточных мембран, то есть выполняет защитную функцию и помогает клеткам адаптироваться к неблагоприятным условиям и выживать даже в непростых ситуациях.
Вернуться к оглавлениюВ чем польза линолевой кислоты для организма
Как и все незаменимые жирные кислоты, линолевая необходима для нормального функционирования человеческого организма, для здоровья и долголетия. Вот ее главные достоинства.
-
Участвует в жировом и липидном обмене
Поступает в организм линолевая кислота с пищей, так же, как арахидоновая — самая активная из класса Omega-6.
 Присутствует в каждой клетке, особенно необходима печени, мозгу, мышцам.
Присутствует в каждой клетке, особенно необходима печени, мозгу, мышцам. -
Укрепляет иммунитет
Способствует защите клеток от воздействия патогенных бактерий и вирусов.
-
Участвует в жировом обмене
За эту способность линолевую кислоту включают в состав биодобавок для похудения.
-
Наращивает мышечную массу
Линолевая кислота улучшает обмен веществ и усвояемость белков, за счет чего способствует приросту мышечной массы. Неудивительно, что ее любят и ценят бодибилдеры.
-
Улучшает состояние кожи, волос, ногтей
Без баланса жирных кислот в организме говорить о красе ногтей, кожи и волос не приходится. Кроме того, линолевая кислота входит в состав гидролипидной пленки, удерживающей влагу и защищающей кожу.
При каких проблемах применяется
Линолевую кислоту можно принимать в виде пищевой добавки © iStock
В составе пищевых добавок линолевую кислоту рекомендуют принимать при определенных показаниях:
-
сухость кожи, себорея, воспаления, экзема;
-
избыточный вес;
-
заболевания нервной системы;
-
гормональный дисбаланс;
-
диабет;
-
артрит.

Недостаток линолевой кислоты
Выявить недостаток линолевой кислоты в организме может только специальный анализ. Однако есть симптомы, которые могут подсказать, что в организме не все ладно с синтезом Omega-6.
- 1
Сухость кожи, шелушение. Если в роговом слое мало липидов, нет ничего удивительного в том, что его целостность нарушается и кожа теряет влагу. Ведь линолевая кислота служит цементом, скрепляющим роговые чешуйки.
- 2
Акне. Недостаток линолевой кислоты в организме приводит к нарушению процесса отшелушивания и закупорке пор. Воспаление в этом случае вполне закономерно.
- 3
Частые простуды и инфекции. Иммунная система дает сбой при нарушении липидного обмена, а линолевая кислота — ее непосредственный участник.
- 4
Боли в суставах. Незаменимые жирные кислоты облегчают состояние больных артритом.
Продукты питания, содержащие линолевую кислоту
Растительные масла – основной источник линолевой кислоты © iStock
Линолевая кислота содержится в растительных маслах, а арахидоновая («животный» вариант Omega-6) — в мясе, сливочном масле, молоке. Наличие линолевой кислоты в продуктах питания наглядно продемонстрирует таблица.
Содержание линолевой кислоты в продуктах
| Продукт (масло, жир) | Линолевая кислота |
| Сафлоровое масло | 79,00% |
| Масло виноградных косточек | 78,00% |
| Подсолнечное масло | 72,00% |
| Кукурузное | 48,00% |
| Соевое | 62,00% |
| конопляное | 55,00% |
| оливковое | 15,00% |
| горчичное | 14,00% |
| жир птицы | 10-20,00% |
| свиной жир | 8–9% |
| бараний | 3–4% |
| говяжий | 2–5% |
| молочный | 2–5,2% |
Объем потребления
При потреблении продуктов или пищевых добавок, содержащих незаменимые жирные кислоты, важно соблюдать соотношение между Omega-3 и Omega-6. Идеальный баланс 1:1 соблюдали наши далекие предки. Соотношение, рекомендованное экспертами по питанию с учетом современных реалий, составляет 1:5.
Идеальный баланс 1:1 соблюдали наши далекие предки. Соотношение, рекомендованное экспертами по питанию с учетом современных реалий, составляет 1:5.
Для здоровья важен правильный баланс жирных кислот Omega-6 и Omega-3 © iStock
Однако на деле показатель Omega-6 достигает 10, а иногда и 20. Причина столь явного перевеса Omega-6 объясняется просто: мы недостаточно потребляем продукты, содержащие Omega-3. Сегодня основными поставщиками жирных кислот выступают растительные масла, а также мясные продукты, но не морская рыба (главный источник Omega-3).
Средняя суточная норма линолевой кислоты для взрослого человека до 50 лет составляет 12 г у женщин и 17 г — у мужчин, что соответствует приблизительно 6-9 чайным ложкам подсолнечного масла. С возрастом эта доза уменьшается.
Вернуться к оглавлениюОграничения к использованию
В рационе современного человека нет дефицита жирных кислот Omega-6. Он их получает в избытке, поливая салаты растительным маслом и не ограничивая себя в потреблении животных жиров. А вот кислот Omega-3 остро не хватает, особенно жителям тех стран, где мало едят жирную морскую рыбу.
Он их получает в избытке, поливая салаты растительным маслом и не ограничивая себя в потреблении животных жиров. А вот кислот Omega-3 остро не хватает, особенно жителям тех стран, где мало едят жирную морскую рыбу.
Между тем благополучие организма зависит именно от баланса жирных кислот: преобладание Omega-6 может нанести ему вред и стать причиной хронических воспалительных процессов с далеко идущими и крайне негативными последствиями.
Потребляя продукты, содержащие линолевую и арахидоновую кислоты — растительные масла и животные жиры, — не забывайте балансировать их пищей, богатой кислотами Omega-3. Формула здоровья заключается в правильном соотношении полиненасыщенных жирных кислот в организме.
Вернуться к оглавлениюОбзор средств
В составе косметики, как и в пище, линолевая кислота чаще всего фигурирует в своей естественной биодоступной форме — в виде растительного масла. Косметические средства, богатые Omega-6, как правило, адресуются коже с такими проблемами:
-
сухость;
-
увядание;
-
воспаление.

Формулы объединяет задача восстановить или укрепить липидный барьер кожи. Вот лишь несколько средств.
Косметика c линолевой кислотой обладает питательными и смягчающими кожу свойствами
-
Питательный ночной бальзам для лица с эфирным маслом майорана, Decléor, адресуется сухой и очень сухой коже, восстанавливает ее и укрепляет способность к самозащите. В основе формулы — подсолнечное масло, чрезвычайно богатое Omega-6.
-
Экстраординарный крем-масло «Роскошь питания», L’Oréal Paris, нежно заботится о коже, успокаивая и защищая ее с помощью ценных масел, включая масло пенника лугового.
-
Увлажняющий тоник Ultra Facial Toner, Kiehl’s, не имеет спирта в составе, смягчает кожу, в том числе благодаря маслу абрикосовых косточек, содержащего 20% линолевой кислоты.

Кремы с линолевой кислотой укрепляют липидный барьер кожи
-
Крем-уход для защиты сухой кожи Nutrilogie I, Vichy, восстанавливает защитные функции эпидермиса, стимулируя синтез собственных липидов кожи.
-
Тройное корректирующее липидовосполняющее средство Triple Lipid Restore 2:4:2, SkinCeuticals, укрепляет защитную функцию кожи, насыщая ее жирными кислотами за счет подсолнечного масла в составе.
-
Корректирующий крем-гель для проблемной кожи с тонирующим эффектом Effaclar Duo(+), La Roche Posay, содержит линолевую кислоту и помогает справиться со следами постакне.
НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ • Большая российская энциклопедия
В книжной версии
Том 22.
 Москва, 2013, стр. 284
Москва, 2013, стр. 284Скопировать библиографическую ссылку:
Авторы: О. Б. Рудаков
НЕЗАМЕНИ́МЫЕ ЖИ́РНЫЕ КИСЛО́ТЫ (НЖК, эссенциальные жирные кислоты), одноосновные полиненасыщенные карбоновые кислоты, необходимые для нормальной жизнедеятельности млекопитающих; соединения общей формулы $\ce{Ch4(Ch3)}_x \ce{(CH Ch3)}_y \ce{(Ch3)}_z\ce{COOH}$ ($x = 1,4,5,7$, $y = 1–6$, $z = 0–7$ , число атомов $\ce{C}$ от $18$ до $24$, цис-конфигурация). Первоначально к Н. ж. к. относили две кислоты растит. происхождения – линолевую $\ce{Ch4(Ch3)4(CH= CHCh3)2(Ch3)6COOH}$ и $α$-линоленовую (триеновую) $\ce{Ch4Ch3(CH= CHCh3)3(Ch3)6COOH}$, которые не синтезируются в животном организме, но являются незаменимыми предшественниками в биосинтезе др. продуктов; напр., линолевая кислота служит единственным предшественником арахидоновой кислоты, которая, в свою очередь, играет роль предшественника в биосинтезе простагландинов и тромбоксанов. Недостаток линолевой и $α$-линоленовой кислот в пище млекопитающих подавляет рост, угнетает репродуктивную функцию, вызывает дерматиты, уменьшает коагулирующие свойства крови, нарушает работу сердца. В дальнейшем к Н. ж. к. стали относить также метаболиты линолевой и $α$-линоленовой кислот – арахидоновую, докозагексаеновую, эйкозапентаеновую и др. кислоты. Как правило, эти кислоты могут синтезироваться в животном организме, не являясь незаменимыми в строгом смысле, но их условно относят к Н. ж. к., поскольку они способны устранять симптомы недостаточности линолевой и $α$-линоленовой кислот (арахидоновая кислота в 10 раз активнее в нормализации перечисленных нарушений, чем линолевая).
продуктов; напр., линолевая кислота служит единственным предшественником арахидоновой кислоты, которая, в свою очередь, играет роль предшественника в биосинтезе простагландинов и тромбоксанов. Недостаток линолевой и $α$-линоленовой кислот в пище млекопитающих подавляет рост, угнетает репродуктивную функцию, вызывает дерматиты, уменьшает коагулирующие свойства крови, нарушает работу сердца. В дальнейшем к Н. ж. к. стали относить также метаболиты линолевой и $α$-линоленовой кислот – арахидоновую, докозагексаеновую, эйкозапентаеновую и др. кислоты. Как правило, эти кислоты могут синтезироваться в животном организме, не являясь незаменимыми в строгом смысле, но их условно относят к Н. ж. к., поскольку они способны устранять симптомы недостаточности линолевой и $α$-линоленовой кислот (арахидоновая кислота в 10 раз активнее в нормализации перечисленных нарушений, чем линолевая). Общее число Н. ж. к. строго не определено. Широко используют сокращённые обозначения Н. ж. к.: записывают число атомов $\ce{C}$, число двойных связей и положение наиболее удалённой двойной связи, напр. для $α$-линолeновой кислоты – $18:3$ $ω$-3; такие обозначения относят любую из Н. ж. к. к одному из двух семейств – линолевой кислоты ($ω$-6) или $α$-линоленовой кислоты ($ω$-3), указывая на пути их биосинтеза и метаболизма.
Общее число Н. ж. к. строго не определено. Широко используют сокращённые обозначения Н. ж. к.: записывают число атомов $\ce{C}$, число двойных связей и положение наиболее удалённой двойной связи, напр. для $α$-линолeновой кислоты – $18:3$ $ω$-3; такие обозначения относят любую из Н. ж. к. к одному из двух семейств – линолевой кислоты ($ω$-6) или $α$-линоленовой кислоты ($ω$-3), указывая на пути их биосинтеза и метаболизма.
Н. ж. к. – вязкие жидкости, хорошо растворимые в органич. растворителях, нерастворимые в воде. Обладают химич. свойствами карбоновых кислот. Легко полимеризуются, изомеризуются, гидрируются, окисляются. Н. ж. к. получают гидролизом жиров. Н. ж. к. участвуют в биосинтезе простагландинов и др. липопероксидов, являются компонентами всех биологич. мембран и т. д. Проявляют высокую антиоксидантную активность, замедляют развитие атеросклероза, улучшают обмен веществ. В организм человека линолевая и $α$ -линоленовая кислоты поступают с пищей в составе растит. масел и животных жиров, др. кислоты – в составе животных жиров. Для биологически активного комплекса из Н. ж. к. используется неточное назв. «витамин F». Потребность человека в Н. ж. к. в расчёте на линолевую кислоту ок. 10 г в сутки.
В организм человека линолевая и $α$ -линоленовая кислоты поступают с пищей в составе растит. масел и животных жиров, др. кислоты – в составе животных жиров. Для биологически активного комплекса из Н. ж. к. используется неточное назв. «витамин F». Потребность человека в Н. ж. к. в расчёте на линолевую кислоту ок. 10 г в сутки.
Функциональные свойства и преимущества липосом
В работе рогового слоя кожи, служащего защитой от внешних физических воздействий, фосфолипиды – и фосфатидилхолин в частности – играют не столь важную роль. В липидных бислоях обнаруживаются лишь следы фосфолипидов, в то время как основными компонентами являются свободные жирные кислоты, холестерин, церамиды, триглицериды и углеводороды. Однако в более глубоких слоях эпидермиса фосфатидилхолин является одним из важнейших компонентов всех биологических мембран, в особенности плазматических клеточных мембран. Кроме того, фосфатидилхолин опосредованно участвует в преобразовании церамидов в сфингомиелин. В этом случае фосфатидилхолин, препятствуя увеличению количества церамидов в клетках, продлевает их жизнь в апоптозе (Рис.1).
В этом случае фосфатидилхолин, препятствуя увеличению количества церамидов в клетках, продлевает их жизнь в апоптозе (Рис.1).
Рис.1 Медиаторная роль фосфатидилхолина в биосинтезе липидов при созревании барьера.
Пояснения к рисунку: в живых кератиноцитах фосфатидилхолин отвечает за превращение церамидов в сфингомиелины, а увеличение уровня церамидов внутри живых клеток является признаком клеточного старения.
Состав фосфатидилхолина человека и фосфатидилхолина растительного происхождения представлен жирными кислотами, среди которых доминируют ненасыщенные жирные кислоты. Наиболее часто используемый в косметических препаратах фосфатидилхолин сои содержит до 70% линолевой кислоты в общей массе жирных кислот. Температура фазового перехода фосфатидилхолина сои в водосодержащих системах ниже 00С. В этом заключается его способность разжижать липидные бислои рогового слоя, которая характеризуется степенью увеличения показателя трансэпидермальной потери воды (TEWL) после кратковременного воздействия.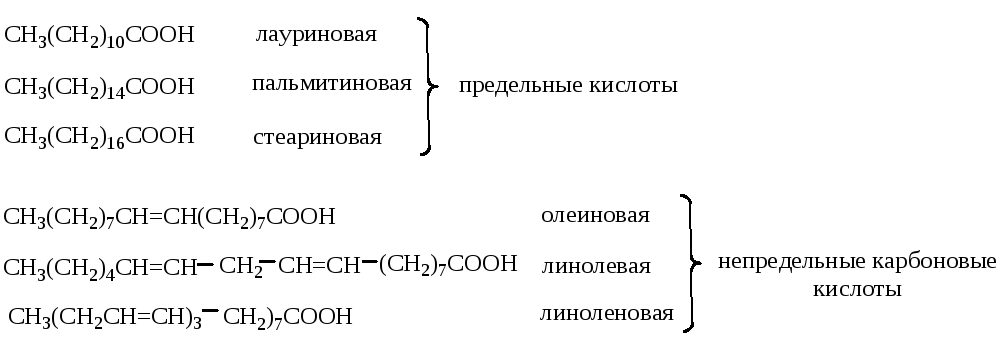 Незначительное увеличение показателя TEWL совпадает с проникновением фосфатидилхолина и сходных с ним по формуле активных агентов. Из-за большого содержания линолевой кислоты и высокой проникающей способности, фосфатидилхолин сои быстро доставляет линолевую кислоту в кожу и может быть использован для успешного лечения акне.
Незначительное увеличение показателя TEWL совпадает с проникновением фосфатидилхолина и сходных с ним по формуле активных агентов. Из-за большого содержания линолевой кислоты и высокой проникающей способности, фосфатидилхолин сои быстро доставляет линолевую кислоту в кожу и может быть использован для успешного лечения акне.
Прочно связываясь с поверхностными белками эпидермиса (например, кератином), фосфатидилхолин оказывает кондиционирующий и смягчающий эффекты, хорошо известные со времен начала разработок продуктов по уходу за кожей. Так, например, шампуни раньше содержали в своем составе яичный желток, который смягчал волосы и предохранял их от статического электричества. Яичный желток богат лецитином, основным компонентом которого является фосфатидилхолин.
В данном случае не имеет значения, в какой форме фосфатидилхолин входит в состав препарата. При приготовлении фосфатидилхолина практически всегда будут образовываться бислой содержащие структуры, такие как липосомы, поскольку это наиболее естественная форма организации данного вещества.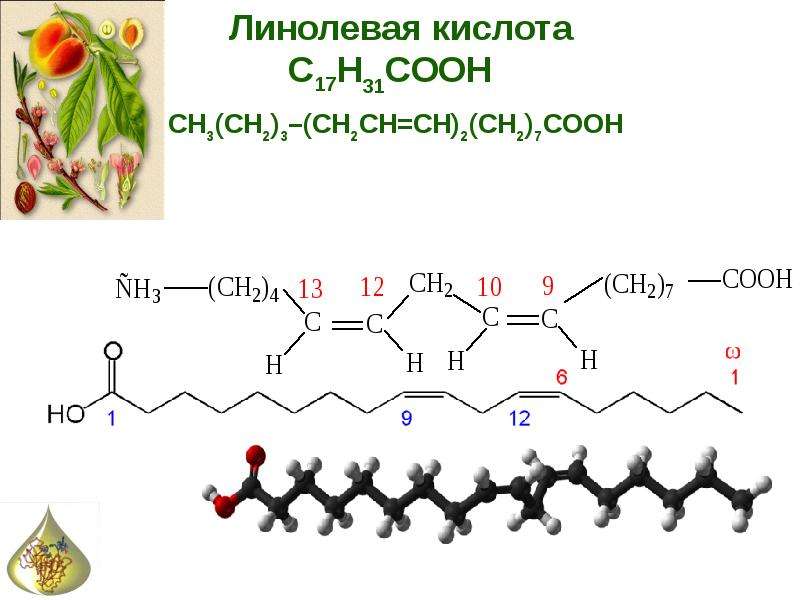 Например, фосфатидилхолин при большом количестве воды самопроизвольно трансформируется в липосомы, которые стабилизируются при добавлении невысоких концентраций солей или водорастворимых органических соединений, таких как мочевина. С другой стороны, известно, что неинкапсулированные вещества намного легче проникают через роговой слой, предварительно обработанный фосфатидилхолином. Поэтому липосомы не являются обязательным условием проявления функциональных свойств фосфатидилхолина, но их использование удобно, поскольку работа с чистым фосфатидилхолином требует большого опыта, а иногда еще и терпения.
Например, фосфатидилхолин при большом количестве воды самопроизвольно трансформируется в липосомы, которые стабилизируются при добавлении невысоких концентраций солей или водорастворимых органических соединений, таких как мочевина. С другой стороны, известно, что неинкапсулированные вещества намного легче проникают через роговой слой, предварительно обработанный фосфатидилхолином. Поэтому липосомы не являются обязательным условием проявления функциональных свойств фосфатидилхолина, но их использование удобно, поскольку работа с чистым фосфатидилхолином требует большого опыта, а иногда еще и терпения.
Поскольку фосфатидилхолин известен способностью увеличивать проницаемость мембран, свойство это обычно ассоциируется с липосомами. Липосомы – это везикулы, которые способствуют облегчению переноса косметических агентов в роговой слой. В этих условиях роговой слой выступает в роли депо для этих агентов. Системные исследования активных препаратов показали, что увеличение впитывающей способности не означает увеличения проницаемости. Часто фосфатидилхолин замедляет проницаемость активных агентов и предотвращает резкое увеличение их концентрации в начале применения. Происходит более продолжительное по времени прохождение веществ из рогового слоя. Это свойство делает фосфатидилхолин и липосомы чрезвычайно привлекательными при применении витаминов, поливитаминов и других веществ, оказывающих воздействие на регенерирующую способность базальных клеток эпидермиса.
Часто фосфатидилхолин замедляет проницаемость активных агентов и предотвращает резкое увеличение их концентрации в начале применения. Происходит более продолжительное по времени прохождение веществ из рогового слоя. Это свойство делает фосфатидилхолин и липосомы чрезвычайно привлекательными при применении витаминов, поливитаминов и других веществ, оказывающих воздействие на регенерирующую способность базальных клеток эпидермиса.
С другой стороны, липосомы, состоящие из ненасыщенного фосфатидилхолина, следует использовать с большой осторожностью, поскольку они не улучшают естественную барьерную функцию кожи, за исключением их опосредованного, участия в образовании церамида I. Церамид I содержит линолевую кислоту и является одним из важных активизирующих барьерную функцию веществ. В препаратах, предназначенных для защиты кожи, следует использовать вместо ненасыщенного фосфатидилхолина полностью гидрогенизированный фосфатидилхолин (Рис. 2).
Рис. 2. Гидрогенизированный фосфатидилхолин (n=14, 16)
2. Гидрогенизированный фосфатидилхолин (n=14, 16)
Аналогично церамидам гидрогенезированный фосфатидилхолин способен стабилизировать нормальный уровень TEWL (трансэпидермальной потери воды) роговой слоя после воздействия на него гидрофильных или липофильных веществ. В таблице 1 представлены основные свойства ненасыщенного и гидрогенизированного фосфатидилхолина. Гидрогенизированный фосфатидилхолин, полученный из сои, содержит в основном пальмитиновую и стеариновую кислоты. Поскольку ненасыщенный и насыщенный фосфатидилхолин обладают специфическими свойствами, имеет смысл совмещение их в одном косметическом или дерматологическом продукте.
Аббревиатуры: TEWL – трансэпидермальная потеря воды (transepidermal water loss), CIR – Cosmetic Ingredient Review (организация по оценке безопасности компонентов применяемых в косметике)
Липосомы
Липосомы представляют собой сферческие везикулы, мембраны которых состоят из одного (однослойные) или более (многослойные) бислоев фосфатидихолина. Иногда, особенно в патентах, говорят не о липосомах, а о «везикулах с внутренней водной фазой». В зависимости от процесса приготовления везикулы могут отличаться как по размеру (диаметр в пределах от 15 до 3500 нм), так и по форме (одиночные и соединенные частицы). Наибольшая стабильность липосом наблюдается в пределах 100 – 300 нм в чистых водных дисперсиях высокообогащенного (80-100%) фосфатидилхолина сои.
Иногда, особенно в патентах, говорят не о липосомах, а о «везикулах с внутренней водной фазой». В зависимости от процесса приготовления везикулы могут отличаться как по размеру (диаметр в пределах от 15 до 3500 нм), так и по форме (одиночные и соединенные частицы). Наибольшая стабильность липосом наблюдается в пределах 100 – 300 нм в чистых водных дисперсиях высокообогащенного (80-100%) фосфатидилхолина сои.
Эффективными препаратами являются чистые дисперсии липосом с липофильными добавками на мембранах сфер и/или гидрофильными добавками на внутренней и внешней водяных фазах в пределах диапазона их несущей способности. Проведены исследования с целью повысить способность липосом инкапсулировать липиды, поскольку потребители привыкли пользоваться богатыми липидами кремами. Были предприняты попытки ввести в дисперсии липосом более высокое содержание липидов и для стабилизации добавляли дополнительно эмульгаторы. Сегодня известно, что сочетаемость липосом и эмульгаторов ограничена. Более того, дополнительные эмульгаторы оказывают ослабляющее действие на барьерное сродство фосфатидилхолина. Они вымывают фосфатидилхолин и липиды из кожи во время очищения. Из этого положения есть только один рациональный выход – использовать вместо липосом наночастицы («наноэмульсии», «нанодисперсии»), состоящие из фосфатидилхолина и липидов. Установлено, что в момент, когда исчерпывается способноcть бислоев включать липиды, капельки масла начинают соединяться с липосомами [8]. Дальнейшее увеличение соотношения липиды/фосфатидилхолин и использование гомогенизаторов высокого давления приводит к образованию наночастиц. Наночастицы состоят из капелек масла, окруженных монослоем фосфатидилхолина. Преимущество наночастиц в том, что они позволяют вводить в состав большее количество липидов, оставаясь при этом стабильными, и не требуют введения дополнительных эмульгаторов.
Более того, дополнительные эмульгаторы оказывают ослабляющее действие на барьерное сродство фосфатидилхолина. Они вымывают фосфатидилхолин и липиды из кожи во время очищения. Из этого положения есть только один рациональный выход – использовать вместо липосом наночастицы («наноэмульсии», «нанодисперсии»), состоящие из фосфатидилхолина и липидов. Установлено, что в момент, когда исчерпывается способноcть бислоев включать липиды, капельки масла начинают соединяться с липосомами [8]. Дальнейшее увеличение соотношения липиды/фосфатидилхолин и использование гомогенизаторов высокого давления приводит к образованию наночастиц. Наночастицы состоят из капелек масла, окруженных монослоем фосфатидилхолина. Преимущество наночастиц в том, что они позволяют вводить в состав большее количество липидов, оставаясь при этом стабильными, и не требуют введения дополнительных эмульгаторов.
Дисперсии липосом на основе ненасыщенного фосфатидилхолина нестабильны и быстро окисляются. Как и линолевые эфиры и линолевые диглицериды, эти дисперсии должны быть стабилизированы антиоксидантами. С точки зрения натуральности, лучше использовать комплекс витаминов С и Е (соответственно, их производные – ацетаты и пальмитаты). В некоторых случаях фосфатидилхолин и мочевина демонстрируют способность стабилизировать друг друга [9,10].
С точки зрения натуральности, лучше использовать комплекс витаминов С и Е (соответственно, их производные – ацетаты и пальмитаты). В некоторых случаях фосфатидилхолин и мочевина демонстрируют способность стабилизировать друг друга [9,10].
Ненасыщенный фосфатидилхолин может быть замещен насыщенным, типа гидрогенизированного фосфатидилхолина сои. Так как температура фазового перехода у гидрогенизированного фосфатидилхолина значительно выше, приготовление липосом на их основе технологически более сложный процесс и ограничивает их фармакологическое применение.
Новая разработка в области косметических средств с использованием гидрогенизированного фосфатидилхолина сои – это технология DMS (дерма-мембранная структура – Derma Membrane Structure) [11]. DMS – это обычные кремы, содержащие гидрогенизированный фосфатидилхолин сои, совместимые с кожным салом триглицериды средней цепи (MCT – medium chain triglycerides), масло ши и сквалан. Наряду с дисперсиями липосом и наночастиц, DMS являются еще одним способом сочетания фосфатидилхолина с гидрофильными и липофильными составляющими без использования дополнительных эмульгаторов. DMS устойчивы к воде и поту и, поэтому, подходят для защиты кожи, создания солнцезащитных кремов без добавления силиконов и\или минеральных масел. DMS можно легко трансформирать в другие конечные продукты путем простого перемешивания с жидкими липидами и/или водными фазами при комнатной температуре.
DMS устойчивы к воде и поту и, поэтому, подходят для защиты кожи, создания солнцезащитных кремов без добавления силиконов и\или минеральных масел. DMS можно легко трансформирать в другие конечные продукты путем простого перемешивания с жидкими липидами и/или водными фазами при комнатной температуре.
Рис. 3. Препараты с фосфатидилхолином без дополнительных эмульгаторов
Как отмечалось ранее, DMS предназначены для защиты кожи, однако добавление наночастиц и/или дисперсий липосом обогащает DMS ненасыщенным фосфатидилхолином, содержащим линолевую кислоту. Получаемый продукт имеет кремовую консистенцию, стабилен и не комедогенен. Эффект кремов с DMS на увлажнение, смягчение и тонизацию кожи сохраняется в течение нескольких дней после применения.
Липосомы, наночастицы и DMS требуют использования консервантов. Здесь могут возникнуть сложности, поскольку фосфатидилхолин (лецитин) дезактивирует большинство традиционных консервантов [12]. С другой стороны, следует избегать проникновения консервантов в кожу, так как они могут вызвать раздражение и сенсибилизацию кожи. В данной ситуации предпочтительными являются гликоли, такие как, пропиленгликоль, глицерин, бутиленгликоль, пентиленгликоль, гексиленгликоль, сорбитол и их сочетания. В отличие от этанола, применение которого ограничено концентрацией, данные полиолы одновременно обладают и увлажняющим эффектом.
С другой стороны, следует избегать проникновения консервантов в кожу, так как они могут вызвать раздражение и сенсибилизацию кожи. В данной ситуации предпочтительными являются гликоли, такие как, пропиленгликоль, глицерин, бутиленгликоль, пентиленгликоль, гексиленгликоль, сорбитол и их сочетания. В отличие от этанола, применение которого ограничено концентрацией, данные полиолы одновременно обладают и увлажняющим эффектом.
В начале проведения разработок в области липосом фосфатидилхолин из-за его гидролитической нестабильности в водных системах в течение длительного времени и высоких температур заменяли на полиглицерины и другие синтетические производные. Фосфатидилхолин распадается на лизофосфатидилхолин и свободные жирные кислоты. Разрыв глицеридной связи, происходит в основном при рН выше 7, поэтому препараты с показателем рН в пределах от 5,5 до 7 являются для большинства случаев использования достаточно стабильными. На гидролиз фосфатидилхолина также влияет количество дополнительных поверхностно-активных составляющих.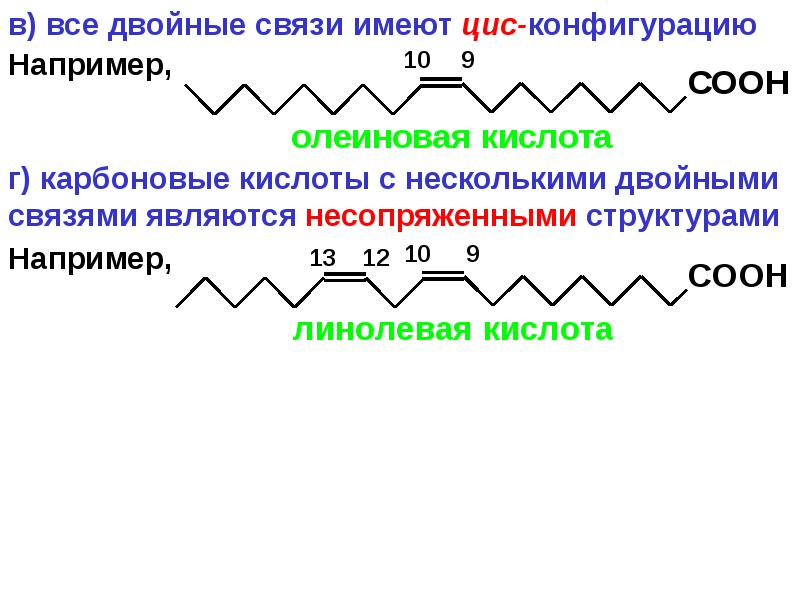 Это еще одна причина использования дисперсий липосом без дополнительных эмульгаторов.
Это еще одна причина использования дисперсий липосом без дополнительных эмульгаторов.
Как уже отмечалось выше, дисперсии липосом являются очень удобным способом включения фосфатидилхолина в косметические препараты для получения наиболее полного спектра функциональности. В продаже имеются предлипосомные жидкие фазы с содержанием фосфатидилхолина до 20% и более [13]. Существуют также работы по использованию быстрорастворимых липосом в сочетании с углеводами в форме порошков [1]. Интерес представляют также масла, образующие дисперсии липосом без дополнительных эмульгаторов [14]. Эти препараты имеют в своей основе смесь фосфатидилхолина, триглицеридов и спирта. Липосомы образуются самопроизвольно при вливании смесей в воду. Такие липосомы имеют высокое сродство к поверхностным липидам кожи, и могут быть использованы при уходе за обезвоженной и чувствительной кожей. Описаны многочисленные способы приготовления липосом [1].
Большинство специалистов, работающих в области дисперсий липосом, сегодня сходятся во мнении, что липосомы не проникают в кожу нетронутыми везикулами, и не впитываются в кожу. По современным представлениям, липосомы, как правило, деформируются и фрагментируются. Поэтому их размер, форма и многослойная структура не имеют значения при применении. Имеет значение – химическая композиция всего препарата.
По современным представлениям, липосомы, как правило, деформируются и фрагментируются. Поэтому их размер, форма и многослойная структура не имеют значения при применении. Имеет значение – химическая композиция всего препарата.
Области применения фосфатидилхолина вытекают из его многофункциональных свойств. Препараты с ненасыщенным фосфатидилхолином используются для поддержания процессов регенерации кожи, борьбы со старением, предотвращения угревой сыпи и доставки в кожу других активных агентов, таких как витамины и их производные. Препараты с гидрогенизированным фосфатидилхолином используются для защиты кожи, в том числе и от солнца [15]. На рисунке 4 показан выбор основных компонентов для подготовки «натуральных» составов, которые будут совместимы с роговым слоем, компонентами кожного сала и их функциями.
Рис. 4. Основные компоненты «натуральных» препаратов
Подписи к рисунку: horny layer — роговой слой, deeper skin layers — глубокие слои кожи, PC — фосфатидилхолин, РС-Н — гидрогенизированный фосфатидилхолин, МСТ-триглицериды средней цепи, SPF — солнцезащитный фактор, NMF — натуральный увлажняющий фактор, MeX- минеральные соли, AA- активные агенты, barrier — барьер, sebum – кожное сало, sun protection – защита от солнца, skin moisturizing — увлажнение кожи, gradient of mineral salts — градиент минеральных солей, linoleic acid ceramides — церамиды линолевой кислоты, vitamins — витамины.
Дисперсии липосом являются не только инновационным и эффективным косметическим продуктом, но и удобной формой для работы с фосфатидилхолином. Они с успехом используются в дерматологии для профилактики и лечения различных кожных заболеваний. В таблице 2 приведена сравнительная характеристика липосом с препаратами на основе фосфатидилхолина.
Липосомы, наночастицы и DMS структуры более совместимы со структурой кожи в отличии от обычно применяемых традиционны эмульсии. «Совместимость» означает, что препараты не нарушают целостность липидных бислоев кожи и не вымываются во время очищения кожи. С точки зрения современных стратегий косметики, эти препараты содержат минимальное количество вспомогательных компонентов, которые являются лишь дополнительной нагрузкой для кожи. «Совместимость» означает также, что липиды и гидрофильные агенты вводятся в роговой слой, а естественные условия остаются ненарушенными.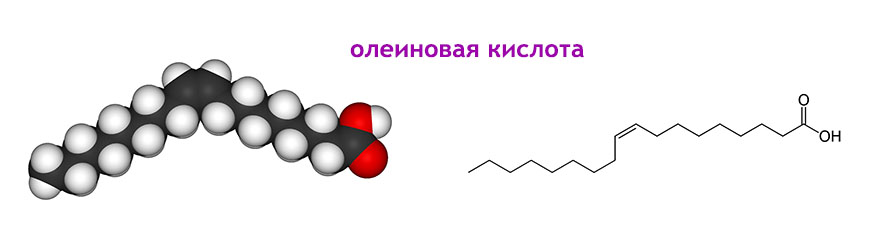
Следует отметить тот факт, что фосфатидилхолин не требует применения в больших концентрациях, так как опыт показывает, что препараты остаются стабильными и при малых количествах. При повторном применении препаратов на основе фосфатидилхолина в роговом слое наблюдается кумулятивный эффект. Липосомы, наночастицы и DMS совместимы друг с другом и в этом смысле могут быть использованы как модульная система. Составление рецептур на их основе открывает неограниченные возможности и большое будущее этих препаратов.
Литература.
1. Lasic DD. Liposomes and niosomes. In: Rieger MM, Rh ein LD, eds. Surfactants in Cosmetics. 2d ed. New York: Marcel Dekker, 1997:263-283.
2. Wendel A. Lecithins, phospholipids, liposomes in co smetics, dermatology and in washing and cleansing preparations. Augsburg: Verlag fuer chemische Industrie, 1994.
3. Wendel A. Lecithins, phospholipids, liposomes in cosmetics, dermatology and in washing and cleansing preparations Part II.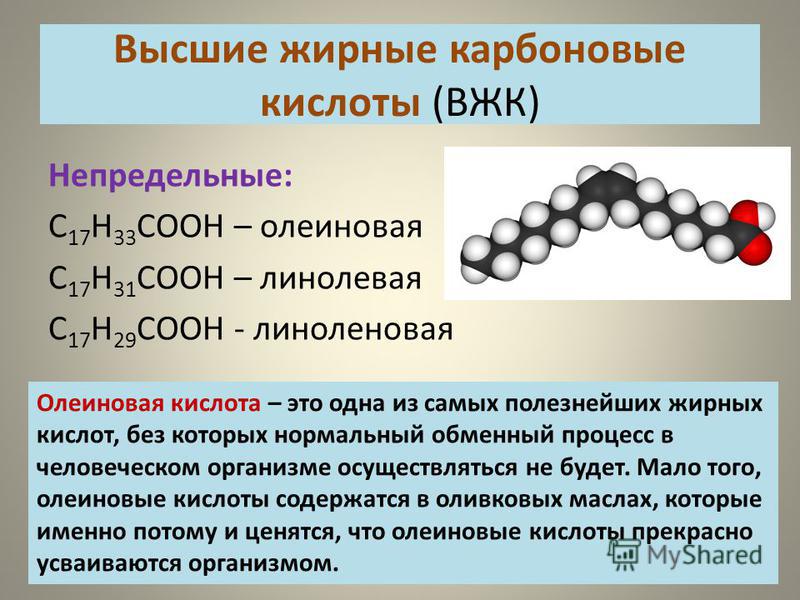 Augsburg: Verlag fuer chemische Industrie, 1997.
Augsburg: Verlag fuer chemische Industrie, 1997.
4. Braun-Falco O, Korting HC, Maibach HI, eds. Liposom e Dermatics. Berlin: Springer-Verlag, 1992.
5. Ghyczy M, Nissen H-P, Biltz H. The treatment of acne vulgaris by phosphatidylcholine from soybeans, with a high content of linoleic acid. J Appl Cosmetol 1996; 14:137-145.
6. Lautenschlaeger H. Kuehlschmierstoffe und Hautschutz – neue Perspektiven. Mineraloeltechnik 1998 (5):1-16.
7. Cosmetic Ingredient Review. Lecithin and Hydrogenated Lecithin. Washington: The Cosmetic, Toiletry, and Fragrance Association, 1996.
8. Lautenschlaeger H. Liposomes in dermatological preparations Part II. Cosmet Toilet 1990; 105 (7):63-72.
9. Nippon Surfactant Kogyo KK, Japanese Patent 199104364104 (1992).
10. Lautenschlaeger, German Patent 4021082 (1990).
11. Kutz G. Galenische Charakterisierung ausgewaehlter Hautpflegeprodukte.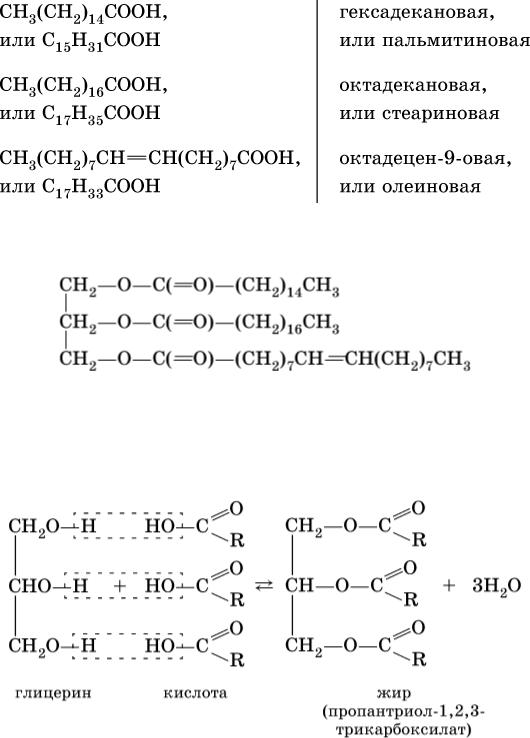 Pharmazeutische Zeitung 1997; 142 (45):4015-4019.
Pharmazeutische Zeitung 1997; 142 (45):4015-4019.
12. Wallhaeusser KH. Praxis der Sterilisation, Desinfektion – Konservierung. 5th ed. Stuttgart: Georg Thieme Verlag, 1995:43, 394.
13. Roeding J. Properties and characterisation of pre-liposome systems. In Braun-Falco O, Korting HC, Maibach HI, eds. Liposome Dermatics. Berlin: Springer-Verlag, 1992:110-117.
14. Lautenschlaeger, German Patent 4021083 (1990).
15. Feingold KR. Permeability barrier homoeostasis: Itsbiochemical basis and regulation. Cosmet Toilet 1997; 112 (7):49-59. 16.
Dr. Hans Lautenschläger
Опубликовано в Handbook of Cosmetic Science and Technology, p. 155-163
edited by A. O. Barel, M. Paye and H. I. Maibach CRC Press Taylor & Francis Group, Boca Raton 2006
определение, структура, функции и продукты питания
Линолевая кислота или LA (18 атомов углерода), от латинского linon, означающего лен, плюс олеиновая кислота, что означает масло или оливковое масло, была выделена Сакком Ф. в 1844 году из льняного масла.
в 1844 году из льняного масла.
Точная структура была выяснена Хильдич Т.П. и другие. в 1939 году и был синтезирован Рафаэлем Р.А. и Sondheimer F. в 1950.
Это полиненасыщенная жирная кислота (ПНЖК) с двумя двойными связями цис (Z) (первая из метильных концов находится в омега-6 (ω-6) или n-6, так, сокращенно 18: 2n-6) член подгруппы, называемой длинноцепочечными жирными кислотами (LCFA), от 14 до 18 атомов углерода.
Свойства
Молекулярный вес: 280,44548 г / моль
Молекулярная формула: C 18 H 32 O 2
Название IUPAC: (9Z, 12Z) -октадека-9,12-диеновая кислота
Регистрационный номер CAS : 60-33-3
PubChem: 5280450
В очищенном виде это бесцветное масло , легко окисляемое воздухом, с температурой плавления -12 ° C (10,4 ° F; 261,15 K) и температурой кипения 202 ° C (395,6 ° F; 475,15). K) при 1,4 мм рт. Ст. Или 230 ° C (446 ° F; 503.15 К) при 16 мм рт.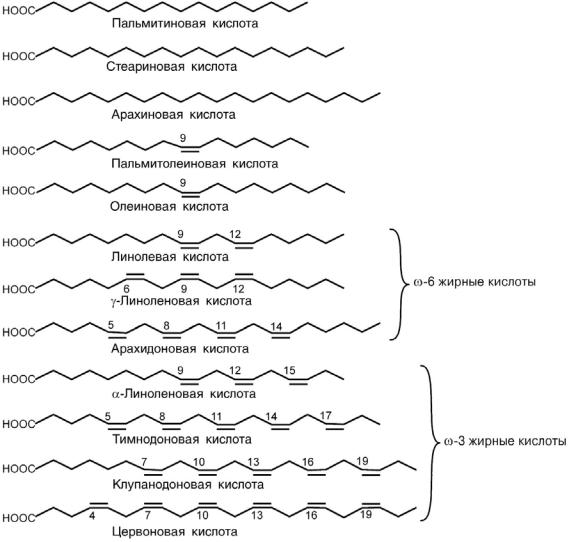
Синонимы
LA
(Z, Z) -9,12-октадекадиеновая кислота
α-линолевая кислота
линолевая кислота
9- цис, 12- цис -линолевая кислота
9Z, 12Z-линолевая кислота
цис -дельта9,12-октадекадиеновая кислота
9,12-линолевая кислота
18: 2n-6
СОДЕРЖАНИЕ
Метаболизм линолевой кислоты
Производится de novo, из олеиновой кислоты, только заводом.
Это первичный продукт синтеза полиненасыщенных жирных кислот растений, наиболее часто встречающийся в тканях растений и животных.
Животные не могут его синтезировать, потому что у них отсутствует Δ12-десатураза , фермент, катализирующий его синтез, и они обязаны получать ее из растительных пищевых продуктов: поэтому это незаменимая жирная кислота (EFA ).
Функция линолевой кислоты
Это предшественник всех полиненасыщенных жирных кислот омега-6.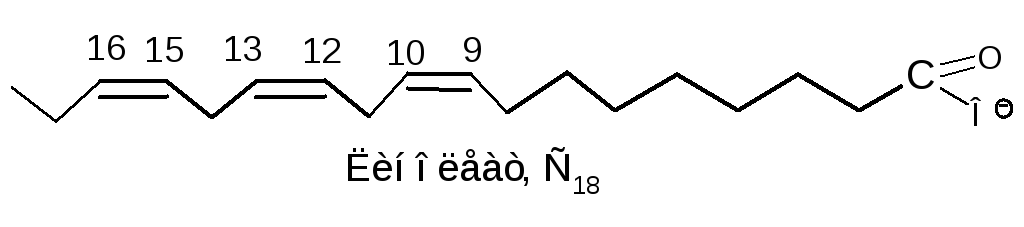
Он превращается в гамма-линоленовую кислоту в реакции, катализируемой Δ6-десатуразой; затем она удлиняется с образованием дигомо-гамма-линоленовой кислоты, которая, в свою очередь, обесцвечивается в реакции, катализируемой Δ5-десатуразой, с образованием арахидоновой кислоты, которая удлиняется с образованием адреновой кислоты (пока все омега-6).
LA важен тем, что он необходим для синтеза арахидоновой кислоты, предшественника многих эйкозаноидов , таких как:
- простагландины;
- тромбоксанов;
- лейкотриенов.
Для этой роли в синтезе эйкозаноидов его дефицит вызывает задержку роста, замедление заживления ран и дерматит, репродуктивную недостаточность, ожирение печени и полидипсию.
Источники питания
Хотя природа производит LA в концентрациях, довольно равных концентрациям альфа-линоленовой кислоты, современное сельское хозяйство значительно обогатило его растительную составляющую и, следовательно, некоторые пищевые продукты для растений и, в меньшей степени, рационы скота, особенно богатые этой жирной кислотой, могут быть хороший источник для людей.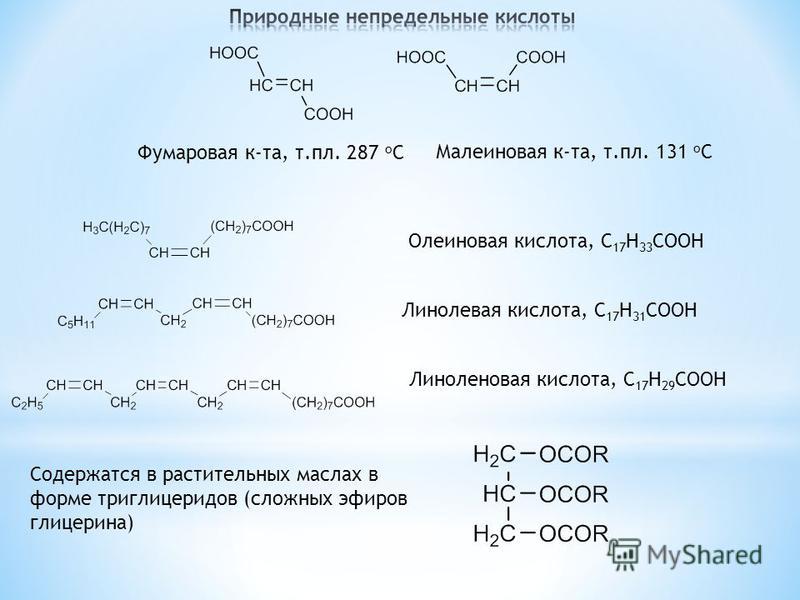
Он содержится в большом количестве в виде сложного эфира глицерина в жирах грецкого ореха, арахиса, семенах хлопка, мака, подсолнечника, винограда, кукурузы, кунжута и сои, а также в других маслах.
Вместе с олеиновой кислотой и пальмитиновой кислотой она входит в тройку наиболее распространенных жирных кислот в триацилглицеринах жировой ткани и липопротеинах плазмы.
Список литературы
Akoh C.C. и Мин Д. «Пищевые липиды: химия, питание, биотехнология» 3-е изд. 2008
Чоу Чинг К. «Жирные кислоты в продуктах питания и их влияние на здоровье» 3-е изд.2008
Эксперты расходятся во мнениях относительно добавления жирных кислот в детское питание
Исследователи изучают такие эффекты, как развитие зрительных систем младенцев и различия в их так называемом поведении внимания (как долго они смотрят на новые и знакомые изображения), что позволяет прогнозировать позже IQ
Доктор Роберт Т. Холл, начальник отдела развития человеческого потенциала Детской больницы милосердия в Канзас-Сити, штат Миссури, сказал, что крупнейшее на сегодняшний день исследование в Северной Америке показало, что у доношенных детей «больше ничего нет чем временная разница в зрительном развитии в возрасте от 2 до 4 месяцев у детей, которых кормили смесями с добавками; после этого различия исчезают.
Но доктор МакКолл сказал, что два исследования недоношенных детей показали, что у тех, кто получал добавленную смесь, было лучше поведение внимания в первый год жизни, но он «не стал бы ставить ферму» на то, приведет ли это к более высокому уровню внимания. интеллект.
Есть также проблемы с безопасностью. В исследованиях недоношенных детей, вскармливаемых смесью с добавлением рыбьего жира, зрительное развитие детей улучшилось, но их рост замедлился. Они были короче, весили меньше и имели меньшую голову, чем сопоставимые младенцы, получавшие стандартную смесь.- сказал Лукас.
«Теперь мы думаем, что рыбий жир нецелесообразно использовать» в качестве источника DHA, поскольку другие ингредиенты в масле могли оказать неблагоприятное воздействие на рост, — сказал доктор Лукас. Он сказал, что в настоящее время невозможно добавлять чистую DHA в формулу, потому что «она поставляется в смеси с другими веществами».
Хотя рыбий жир является основным пищевым источником DHA, он происходит из растений, в частности из микроскопических водорослей, которые растут. в океане и продвигаются вверх по пищевой цепочке, становясь все более концентрированными по мере продвижения.
Доктор Рональд Кляйнман, эксперт по педиатрическому питанию в Массачусетской больнице общего профиля и Гарвардской медицинской школе, отметил: «Количество DHA в грудном молоке может варьироваться в двадцать раз в зависимости от диеты матери». ест, тем больше ДГК будет в ее молоке. Он сказал, что, хотя DHA наиболее важна для мозга и зрительной системы, она также важна для развития иммунной, желудочно-кишечной и репродуктивной систем.
Доктор Коннор сказал, что он посоветует женщинам «есть рыбу во время беременности и кормления грудью», чтобы накопить запас ДГК, и «кормить грудью своих младенцев, если это вообще возможно, в течение первых трех или трех человек». четыре месяца жизни, время самого быстрого включения DHA в мозг.Он отметил, что до того, как молоко было обогащено витаминами A и D, младенцам обычно давали жир печени трески, богатый источник DHA. Что касается нынешних детских смесей, он сказал: «На мой взгляд, мы должны максимально отражать грудное молоко, потому что это то, что природа предусмотрела для младенцев. Как только будет определено, что добавление этих жирных кислот безопасно, мы должны это сделать ».
Как только будет определено, что добавление этих жирных кислот безопасно, мы должны это сделать ».
RCSB PDB — 1IGZ: Кристаллическая структура линолевой кислоты, связанной в циклооксигеназном канале эндопероксида простагландина H-синтазы-1.
Простагландин-эндопероксид H-синтазы-1 и -2 (PGHS) могут насыщать кислородом полиненасыщенные жирные кислоты с 18-22 атомами углерода, хотя и с разной эффективностью. Здесь мы сообщаем о кристаллических структурах эйкозапентаеновой кислоты (EPA, 20: 5 n-3) и линолевой кислоты (LA, 18: 2 n …
Эндопероксид простагландина H-синтазы-1 и -2 (PGHS) могут насыщать кислородом 18- 22 углеродных полиненасыщенных жирных кислоты, хотя и с различной эффективностью. Здесь мы сообщаем о кристаллических структурах эйкозапентаеновой кислоты (EPA, 20: 5 n-3) и линолевой кислоты (LA, 18: 2 n-6), связанных в активном центре циклооксигеназы Co (3+) протопорфирин IX-реконструированный овечий PGHS-1 (Co (3 +) — oPGHS-1) и сравните эффекты замен активного центра на скорость оксигенации EPA, LA и арахидоновой кислоты (AA). И EPA, и LA связываются в активном центре с ориентациями, аналогичными тем, которые наблюдались ранее для AA и дигомо-гамма-линоленовой кислоты (DHLA). Для EPA наличие дополнительной двойной связи (C-17 / C-18) заставляет этот субстрат связываться в «напряженной» конформации, в которой C-13 смещен по отношению к Tyr-385, остатку, который отводит водород от субстрат жирных кислот. Предположительно, это несовпадение является причиной низкой скорости оксигенации EPA. Для LA карбоксильная половина связывается в более протяженной конфигурации, чем AA, что приводит к расположению C-11 рядом с Tyr-385.Val-349 и Ser-530, недавно идентифицированные как важные детерминанты для эффективной оксигенации DHLA с помощью PGHS-1, играют сходные роли в оксигенации EPA и LA. Приблизительно 750- и 175-кратное снижение эффективности оксигенации EPA и LA наблюдалось для V349A oPGHS-1 по сравнению с 2-кратным изменением для AA. Val-349 контактирует с C-2 и C-3 EPA и C-4 LA, ориентируя карбоксильные половины этих субстратов так, чтобы омега-концы были выровнены должным образом для отвода водорода.
И EPA, и LA связываются в активном центре с ориентациями, аналогичными тем, которые наблюдались ранее для AA и дигомо-гамма-линоленовой кислоты (DHLA). Для EPA наличие дополнительной двойной связи (C-17 / C-18) заставляет этот субстрат связываться в «напряженной» конформации, в которой C-13 смещен по отношению к Tyr-385, остатку, который отводит водород от субстрат жирных кислот. Предположительно, это несовпадение является причиной низкой скорости оксигенации EPA. Для LA карбоксильная половина связывается в более протяженной конфигурации, чем AA, что приводит к расположению C-11 рядом с Tyr-385.Val-349 и Ser-530, недавно идентифицированные как важные детерминанты для эффективной оксигенации DHLA с помощью PGHS-1, играют сходные роли в оксигенации EPA и LA. Приблизительно 750- и 175-кратное снижение эффективности оксигенации EPA и LA наблюдалось для V349A oPGHS-1 по сравнению с 2-кратным изменением для AA. Val-349 контактирует с C-2 и C-3 EPA и C-4 LA, ориентируя карбоксильные половины этих субстратов так, чтобы омега-концы были выровнены должным образом для отвода водорода. Замена S530T снижает V (max) / K (m) EPA и LA в 375 и 140 раз.Ser-530 устанавливает шесть контактов с EPA и четыре с LA с участием C-8 — C-16; эти взаимодействия влияют на выравнивание субстрата для отвода водорода. Интересно, что замена Phe-205 увеличивает объем сайта циклооксигеназы, позволяя EPA насыщаться кислородом более эффективно, чем с нативным oPGHS-1.
Замена S530T снижает V (max) / K (m) EPA и LA в 375 и 140 раз.Ser-530 устанавливает шесть контактов с EPA и четыре с LA с участием C-8 — C-16; эти взаимодействия влияют на выравнивание субстрата для отвода водорода. Интересно, что замена Phe-205 увеличивает объем сайта циклооксигеназы, позволяя EPA насыщаться кислородом более эффективно, чем с нативным oPGHS-1.
Ссылки по теме: & nbsp
Организация : & nbsp
Департамент биохимии и молекулярной биологии, Университет штата Мичиган, Ист-Лансинг, Мичиган 48824, США.
Скрыть аннотацию полностью
Что такое CLA? | Молочное питание
Вернуться к жирности
Конъюгированная линолевая кислота (КЛК) относится к группе встречающихся в природе изомеров линолевой кислоты, присутствующих в жирах и молочных продуктах жвачных животных. В отличие от промышленных жирных кислот транс , транс CLA может иметь большую потенциальную пользу для здоровья человека.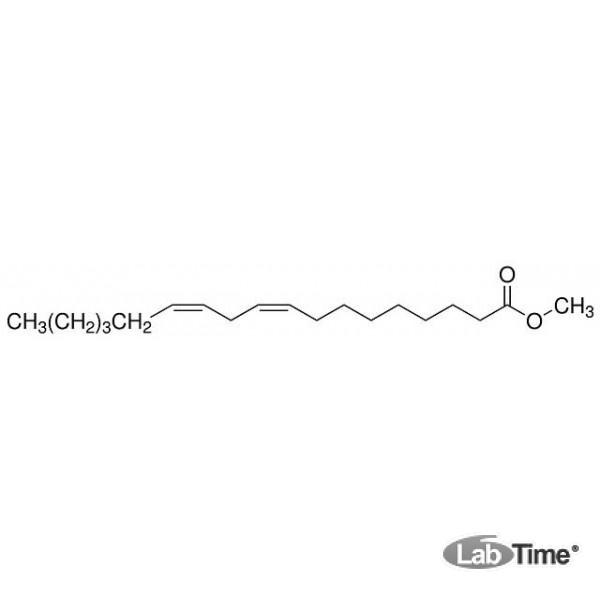
изомеров CLA получают в результате биогидрирования линолевой кислоты бактериями рубца животных.Изомеры, содержащие двойную связь в конфигурации транс , являются биологически активными. 1 Было показано, что CLA обладает многочисленными преимуществами для здоровья в отношении сердечно-сосудистых заболеваний, рака, ожирения, остеопороза и иммунной системы.
Для получения дополнительной информации прочтите «Влияние CLA».
Молочные продукты являются самым богатым источником CLA, обеспечивая около 70% всей диетической CLA, по сравнению с 25% из говядины и меньшими количествами из других жвачных животных. 2
Более того, до 40% из транс в канадском молочном жире составляет вакценовая кислота (изомер олеиновой кислоты), по крайней мере 20% которой превращается в CLA в организме человека. 3-4 Напротив, элаидиновая кислота, которая представляет собой промышленный изомер транс олеиновой кислоты и доминирующую промышленную жирную кислоту транс , не превращается в CLA и, как было показано, оказывает неблагоприятное воздействие на здоровье сердечно-сосудистой системы.
Наиболее изученными биоактивными КЛК являются цис -9, транс -11 изомер ( c -9, t -11 CLA, также известный как руменная кислота) и транс -10, Изомер цис -12 ( т, -10, с 12 CLA).Изомер цис, -9, транс, -11 является преобладающим изомером в пищевых продуктах, на его долю приходится до 90% общего количества CLA, содержащегося в молочных продуктах и мясе жвачных животных. Изомер транс, -10, цис, -12 составляет 5% или менее от общего количества CLA. 5
Структурные различия между несопряженными и конъюгированными двойными связями в полиненасыщенной жирной кислоте:
Структурные различия между цис и транс двойными связями в ненасыщенной жирной кислоте:
Структуры линолевой кислоты (вверху), c -9, т -11 CLA (посередине) и т -10, c 12 CLA (внизу):
Ключевые слова: конъюгированная линолевая кислота
Глава 7 — Липиды — CHE 120 — Введение в органическую химию — Учебник
7.
 2 жиры и масла
2 жиры и маслаЦели обучения
- Объясните, почему жиры и масла называют триглицеридами.
- Объясните, как жирнокислотный состав триглицеридов определяет, является ли вещество жиром или маслом.
- Опишите важность ключевых реакций триглицеридов, таких как гидролиз, гидрирование и окисление.
Жиры и масла — самые распространенные липиды в природе. Они обеспечивают энергией живые организмы, изолируют органы и переносят жирорастворимые витамины через кровь.
Структуры жиров и масел
Жиры и масла называются триглицеридами (или триацилцилгеролов ), потому что они представляют собой сложные эфиры, состоящие из трех звеньев жирных кислот, соединенных с глицерином , тригидрокси спиртом:
Если все три группы ОН в молекуле глицерина этерифицированы одной и той же жирной кислотой, полученный эфир называется простым триглицеридом . Хотя простые триглицериды были синтезированы в лаборатории, они редко встречаются в природе. Вместо этого типичный триглицерид, полученный из природных жиров и масел, содержит два или три различных компонента жирных кислот и, таким образом, называется смешанным триглицеридом .
Вместо этого типичный триглицерид, полученный из природных жиров и масел, содержит два или три различных компонента жирных кислот и, таким образом, называется смешанным триглицеридом .
Триглицерид называется жиром , если он является твердым при 25 ° C; его называют маслом , если оно является жидкостью при этой температуре. Эти различия в точках плавления отражают различия в степени ненасыщенности и количестве атомов углерода в составляющих жирных кислотах. Триглицериды, полученные из животных источников, обычно представляют собой твердые вещества, тогда как триглицериды растительного происхождения обычно представляют собой масла.Поэтому мы обычно говорим о животных жирах и растительных маслах.
Невозможно составить единую формулу для представления встречающихся в природе жиров и масел, потому что они представляют собой очень сложные смеси триглицеридов, в которых представлено множество различных жирных кислот. В таблице 7.2 «Средний состав жирных кислот некоторых распространенных жиров и масел (%) *» показан состав жирных кислот некоторых распространенных жиров и масел. Состав любого данного жира или масла может варьироваться в зависимости от вида растений или животных, от которых он происходит, а также от диетических и климатических факторов.Приведем лишь один пример: сало свиней, откормленных кукурузой, более насыщено, чем сало свиней, откормленных арахисом. Пальмитиновая кислота является наиболее распространенной из насыщенных жирных кислот, а олеиновая кислота — наиболее распространенной ненасыщенной жирной кислотой.
Состав любого данного жира или масла может варьироваться в зависимости от вида растений или животных, от которых он происходит, а также от диетических и климатических факторов.Приведем лишь один пример: сало свиней, откормленных кукурузой, более насыщено, чем сало свиней, откормленных арахисом. Пальмитиновая кислота является наиболее распространенной из насыщенных жирных кислот, а олеиновая кислота — наиболее распространенной ненасыщенной жирной кислотой.
Таблица 7.2 Средний состав жирных кислот некоторых обычных жиров и масел (%) *
| Жиры: | Лаурик | Миристик | Пальмитик | Стеарич | Олеич | Линолевая | Линоленовая |
|---|---|---|---|---|---|---|---|
| масло сливочное (коровье) | 3 | 11 | 27 | 12 | 29 | 2 | 1 |
| жир | 3 | 24 | 19 | 43 | 3 | 1 | |
| сало | 2 | 26 | 14 | 44 | 10 |
| Масла: | Лаурик | Миристик | Пальмитик | Стеарич | Олеич | Линолевая | Линоленовая |
|---|---|---|---|---|---|---|---|
| рапсовое масло | 4 | 2 | 62 | 22 | 10 | ||
| кокосовое масло † | 47 | 18 | 9 | 3 | 6 | 2 | |
| Масло кукурузное | 11 | 2 | 28 | 58 | 1 | ||
| оливковое масло | 13 | 3 | 71 | 10 | 1 | ||
| арахисовое масло | 11 | 2 | 48 | 32 | |||
| соевое масло | 11 | 4 | 24 | 54 | 7 |
* Сумма менее 100% указывает на присутствие жирных кислот с менее чем 12 атомами углерода или более чем 18 атомами углерода.
† Кокосовое масло очень насыщено. Он содержит необычно высокий процент легкоплавких насыщенных жирных кислот C 8 , C 10 и C 12 .
Такие термины, как насыщенный жир или ненасыщенное масло , часто используются для описания жиров или масел, полученных из пищевых продуктов. Насыщенные жиры содержат высокую долю насыщенных жирных кислот, в то время как ненасыщенные масла содержат высокую долю ненасыщенных жирных кислот.Высокое потребление насыщенных жиров, наряду с высоким потреблением холестерина, является фактором повышенного риска сердечных заболеваний. (Для получения дополнительной информации о холестерине см. Раздел 7.4 «Стероиды».)
Физические свойства жиров и масел
Вопреки тому, что можно было ожидать, чистых жиров и масел не имеют цвета, запаха и вкуса. Характерные цвета, запахи и привкусы, которые мы ассоциируем с некоторыми из них, передаются посторонними веществами, растворимыми в липидах и поглощенными этими липидами. Например, желтый цвет сливочного масла обусловлен наличием пигмента каротина; вкус сливочного масла происходит от двух соединений — диацетила и 3-гидрокси-2-бутанона — вырабатываемых бактериями в сливках для созревания, из которых изготовлено масло.
Например, желтый цвет сливочного масла обусловлен наличием пигмента каротина; вкус сливочного масла происходит от двух соединений — диацетила и 3-гидрокси-2-бутанона — вырабатываемых бактериями в сливках для созревания, из которых изготовлено масло.
Жиры и масла легче воды, их плотность составляет около 0,8 г / см. 3 . Они плохо проводят тепло и электричество и поэтому служат отличными изоляторами для тела, замедляя потерю тепла через кожу.
Химические реакции жиров и масел
Жиры и масла могут участвовать в различных химических реакциях — например, поскольку триглицериды являются сложными эфирами, они могут гидролизоваться в присутствии кислоты, основания или определенных ферментов, известных как липазы.Гидролиз жиров и масел в присутствии основания используется для производства мыла и называется омылением . Сегодня большинство мыла получают путем гидролиза триглицеридов (часто из твердого жира, кокосового масла или того и другого) с использованием воды под высоким давлением и температурой [700 фунтов / дюйм 2 (∼50 атм или 5000 кПа) и 200 ° C]. Карбонат натрия или гидроксид натрия затем используется для преобразования жирных кислот в их натриевые соли (молекулы мыла):
Карбонат натрия или гидроксид натрия затем используется для преобразования жирных кислот в их натриевые соли (молекулы мыла):
Взгляд поближе: мыло
Обычное мыло представляет собой смесь натриевых солей различных жирных кислот, полученную в результате одного из старейших методов органического синтеза, практикуемого людьми (уступающего только ферментации сахаров для получения этилового спирта).И финикийцы (600 г. до н. Э.), И римляне изготавливали мыло из животного жира и древесной золы. Несмотря на это, массовое производство мыла началось только в 1700-х годах. Мыло традиционно изготавливали путем обработки расплавленного сала или жира с небольшим избытком щелочи в больших открытых чанах. Смесь нагревали и пропускали через нее пар. После завершения омыления мыло осаждали из смеси добавлением хлорида натрия (NaCl), удаляли фильтрованием и несколько раз промывали водой.Затем его растворяли в воде и повторно осаждали, добавляя еще NaCl. Глицерин, полученный в реакции, также извлекали из водных промывных растворов.
Пемза или песок добавляются для производства чистящего мыла, а такие ингредиенты, как духи или красители, добавляются для получения ароматного цветного мыла. При продувке расплавленного мыла воздухом образуется плавающее мыло. Мягкое мыло, изготовленное с использованием солей калия, более дорогое, но дает более тонкую пену и более растворимо. Они используются в жидком мыле, шампунях и кремах для бритья.
Грязь и сажа обычно прилипают к коже, одежде и другим поверхностям, смешиваясь с маслами для тела, кулинарными жирами, консистентными смазками и подобными веществами, которые действуют как клеи. Поскольку эти вещества не смешиваются с водой, промывание одной только водой мало помогает их удалить. Однако мыло удаляет их, потому что молекулы мыла имеют двойную природу. Один конец, называемый головкой , несет ионный заряд (карбоксилат-анион) и поэтому растворяется в воде; другой конец, tail , имеет углеводородную структуру и растворяется в маслах.Углеводородные хвосты растворяются в почве; ионные головки остаются в водной фазе, а мыло разбивает масло на крошечные, заключенные в мыло, капельки, называемые мицеллами , которые рассеиваются по всему раствору. (Для получения дополнительной информации о клеточной структуре см. Раздел 7.3 «Мембраны и мембранные липиды».) Капли отталкиваются друг от друга из-за их заряженных поверхностей и не сливаются. Когда масло больше не «склеивает» грязь с загрязненной поверхностью (кожа, ткань, посуда), грязь с мылом можно легко смыть.
(Для получения дополнительной информации о клеточной структуре см. Раздел 7.3 «Мембраны и мембранные липиды».) Капли отталкиваются друг от друга из-за их заряженных поверхностей и не сливаются. Когда масло больше не «склеивает» грязь с загрязненной поверхностью (кожа, ткань, посуда), грязь с мылом можно легко смыть.
Двойные связи в жирах и маслах могут подвергаться гидрированию, а также окислению. Гидрогенизация растительных масел для производства полутвердых жиров — важный процесс в пищевой промышленности. По химическому составу она по существу идентична реакции каталитического гидрирования, описанной для алкенов в главе 1 «Обзор органической химии / углеводороды», раздел 1.14 «Химические свойства алкенов».
В промышленных процессах количество двойных связей, которые гидрируются, тщательно контролируется для получения жиров желаемой консистенции (мягких и податливых).Таким образом, дешевые и распространенные растительные масла (рапсовое, кукурузное, соевое) превращаются в маргарин и кулинарные жиры. При приготовлении маргарина, например, частично гидрогенизированные масла смешивают с водой, солью и обезжиренным сухим молоком вместе с ароматизаторами, красителями и витаминами A и D, которые добавляются для придания внешнего вида, вкуса и питания. масла. (Также добавляются консерванты и антиоксиданты.) В большинстве коммерческих арахисовых масел арахисовое масло частично гидрогенизировано для предотвращения его отделения.Потребители могут уменьшить количество насыщенных жиров в своем рационе, используя оригинальные необработанные масла в своих продуктах, но большинство людей предпочитают намазывать маргарин на тосты, чем поливать их маслом.
При приготовлении маргарина, например, частично гидрогенизированные масла смешивают с водой, солью и обезжиренным сухим молоком вместе с ароматизаторами, красителями и витаминами A и D, которые добавляются для придания внешнего вида, вкуса и питания. масла. (Также добавляются консерванты и антиоксиданты.) В большинстве коммерческих арахисовых масел арахисовое масло частично гидрогенизировано для предотвращения его отделения.Потребители могут уменьшить количество насыщенных жиров в своем рационе, используя оригинальные необработанные масла в своих продуктах, но большинство людей предпочитают намазывать маргарин на тосты, чем поливать их маслом.
Многие люди перешли с масла на маргарин или растительное масло из-за опасений, что насыщенные животные жиры могут повысить уровень холестерина в крови и привести к закупорке артерий. Однако во время гидрирования растительных масел происходит реакция изомеризации, в результате которой образуются транс жирных кислот, упомянутых во вводном эссе. Однако исследования показали, что транс жирных кислот также повышают уровень холестерина и увеличивают частоту сердечных заболеваний. Trans жирные кислоты не имеют изгиба в своей структуре, который имеет место в цис жирных кислотах, и, таким образом, упаковываются вместе так же, как насыщенные жирные кислоты. В настоящее время потребителям рекомендуется использовать полиненасыщенные масла и мягкий или жидкий маргарин и снизить общее потребление жиров до менее 30% от общего количества потребляемых калорий каждый день.
Однако исследования показали, что транс жирных кислот также повышают уровень холестерина и увеличивают частоту сердечных заболеваний. Trans жирные кислоты не имеют изгиба в своей структуре, который имеет место в цис жирных кислотах, и, таким образом, упаковываются вместе так же, как насыщенные жирные кислоты. В настоящее время потребителям рекомендуется использовать полиненасыщенные масла и мягкий или жидкий маргарин и снизить общее потребление жиров до менее 30% от общего количества потребляемых калорий каждый день.
Жиры и масла, находящиеся в контакте с влажным воздухом при комнатной температуре, в конечном итоге подвергаются реакциям окисления и гидролиза, в результате чего они становятся прогорклыми и приобретают характерный неприятный запах. Одной из причин запаха является выделение летучих жирных кислот в результате гидролиза сложноэфирных связей. Сливочное масло, например, выделяет масляную, каприловую и каприновую кислоты с неприятным запахом. Микроорганизмы, присутствующие в воздухе, выделяют липазы, которые катализируют этот процесс. Гидролитическую прогорклость можно легко предотвратить, накрыв жир или масло и храня их в холодильнике.
Микроорганизмы, присутствующие в воздухе, выделяют липазы, которые катализируют этот процесс. Гидролитическую прогорклость можно легко предотвратить, накрыв жир или масло и храня их в холодильнике.
Другой причиной образования летучих соединений с запахом является окисление компонентов ненасыщенных жирных кислот, в частности, легко окисляемой структурной единицы
в полиненасыщенных жирных кислотах, таких как линолевая и линоленовая кислоты. Один особенно неприятный продукт, образующийся в результате окислительного расщепления обеих двойных связей в этом звене, — это соединение, называемое малоновый альдегид .
Прогорклость — серьезная проблема пищевой промышленности, поэтому химики-пищевые химики всегда ищут новые и лучшие антиоксиданты , вещества, добавляемые в очень небольших количествах (0.001% –0,01%), чтобы предотвратить окисление и тем самым уменьшить прогорклость. Антиоксиданты — это соединения, у которых сродство к кислороду больше, чем у липидов, содержащихся в пище; таким образом, они функционируют, преимущественно уменьшая запас кислорода, абсорбированного продуктом. Поскольку витамин Е обладает антиоксидантными свойствами, он помогает уменьшить повреждение липидов в организме, особенно ненасыщенных жирных кислот, содержащихся в липидах клеточных мембран.
Упражнения по обзору концепции
Какие функции выполняет жир в организме?
Какие из этих триглицеридов вы ожидаете найти в маслах в больших количествах? В жирах? Обоснуйте свой выбор.
ответов
Жиры служат источником энергии для живых организмов. Они также обеспечивают изоляцию органов тела и переносят жирорастворимые витамины.
Ожидается, что триглицерид слева будет в больших количествах присутствовать в жирах, потому что он состоит из большего количества насыщенных жирных кислот. Ожидается, что триглицерид справа будет присутствовать в маслах в больших количествах, потому что он состоит из большего количества ненасыщенных жирных кислот.
Основные выводы
- Жиры и масла состоят из молекул, известных как триглицериды, которые представляют собой сложные эфиры, состоящие из трех единиц жирных кислот, связанных с глицерином.

- Увеличение процентного содержания жирных кислот с более короткой цепью и / или ненасыщенных жирных кислот снижает температуру плавления жира или масла.
- Гидролиз жиров и масел в присутствии основы дает мыло и известен как омыление.
- Двойные связи, присутствующие в ненасыщенных триглицеридах, можно гидрогенизировать для превращения масел (жидких) в маргарин (твердый).
- При окислении жирных кислот могут образовываться соединения с неприятным запахом. Это окисление можно свести к минимуму добавлением антиоксидантов.
Упражнения
1. Изобразите структуру каждого соединения.
а. Тримиристин
г. триглицерид, который, вероятно, содержится в арахисовом масле
2. Изобразите структуру каждого соединения.
а. трипальмитин
г. триглицерид, который, вероятно, содержится в сливочном масле
3.Нарисуйте структуры для записи реакции полного гидрирования трипальмитолеина (см.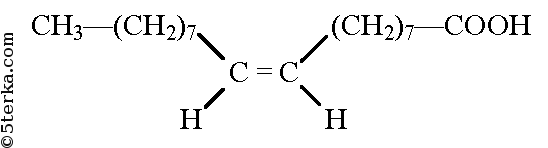 Таблицу 7.1 «Некоторые общие жирные кислоты, содержащиеся в природных жирах», где представлена конденсированная структура пальмитолеиновой кислоты). Назовите образовавшийся продукт.
Таблицу 7.1 «Некоторые общие жирные кислоты, содержащиеся в природных жирах», где представлена конденсированная структура пальмитолеиновой кислоты). Назовите образовавшийся продукт.
4. Изобразите структуры для записи реакции полного гидрирования трилинолеина (см. Таблицу 7.1 «Некоторые общие жирные кислоты, содержащиеся в природных жирах», где представлена конденсированная структура линолевой кислоты). Назовите образовавшийся продукт.
5.Нарисуйте структуры для записи реакции гидролиза трилаурина в основном растворе (см. Таблицу 7.1 «Некоторые общие жирные кислоты, содержащиеся в природных жирах», где представлена конденсированная структура лауриновой кислоты).
6. Изобразите структуры для записи реакции гидролиза тристеарина в основном растворе (см. Таблицу 7.1 «Некоторые общие жирные кислоты, содержащиеся в природных жирах», где представлена конденсированная структура стеариновой кислоты).
7.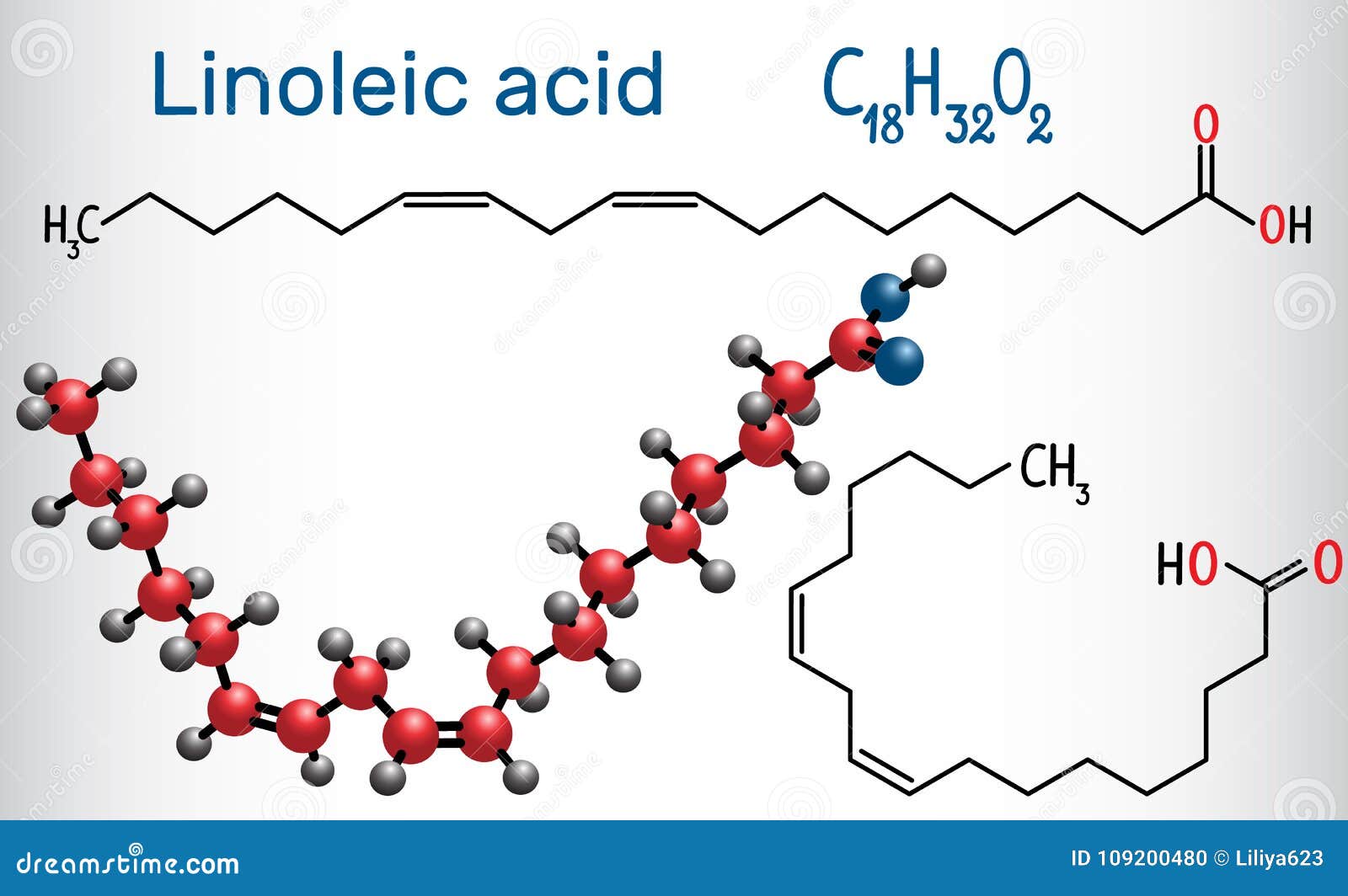
а. Какие соединения с неприятным запахом образуются при прогоркании масла?
г.Как образуются эти соединения?
г. Как можно предотвратить прогорклость?
8.
а. Какое соединение с неприятным запахом образуется при реакции ненасыщенных жирных кислот с кислородом в атмосфере?
г. Как можно предотвратить этот процесс?
ответов
1.
3.
5.
7.
а. карбоновые кислоты меньшего размера, такие как масляная, каприловая и каприновая кислоты
г. Эти соединения образуются в результате гидролиза триглицеридов, содержащихся в масле.
г. Прогорклость можно предотвратить, накрыв масло (чтобы не допустить попадания влаги) и храня его в холодильнике. (Низкие температуры замедляют реакции гидролиза.)
Диетическая линолевая кислота и риск ишемической болезни сердца | Источник питания
Замена насыщенных жиров и углеводов линолевой кислотой — основным полиненасыщенным жиром, содержащимся в растительном масле, орехах и семенах — снижает риск ишемической болезни сердца, согласно новому исследованию Гарвардской школы общественного здравоохранения.
Мы поговорили об исследовании с ведущим автором Марьям Фарвид, приглашенным ученым и научным сотрудником Такеми из Департамента питания, чтобы узнать больше.
1. Ваше исследование показывает, что за счет уменьшения количества потребляемых нами насыщенных жиров и углеводов и замены этих калорий продуктами, богатыми линолевой кислотой, такими как растительное масло, орехи и семена, мы можем снизить риск развития ишемической болезни сердца. болезнь. Что такого особенного в линолевой кислоте? И следует ли потребителям сосредоточиться на снижении количества насыщенных жиров и углеводов в равной степени, или мы должны сокращать одно больше, чем другое?
Замена насыщенных жиров или углеводов растительными маслами и получение значительных преимуществ указывает на то, что уменьшение количества насыщенных жиров или углеводов — не единственная причина положительного воздействия линолевой кислоты.Вместо этого линолевая кислота сама по себе играет особую роль в поддержании здоровья сердца. Рандомизированные клинические испытания показали, что замена насыщенных жиров линолевой кислотой снижает общий холестерин и холестерин ЛПНП. Есть также некоторые доказательства того, что линолевая кислота улучшает чувствительность к инсулину и артериальное давление.
Рандомизированные клинические испытания показали, что замена насыщенных жиров линолевой кислотой снижает общий холестерин и холестерин ЛПНП. Есть также некоторые доказательства того, что линолевая кислота улучшает чувствительность к инсулину и артериальное давление.
2. В последнее время много говорят о здоровых и нездоровых жирах, а насыщенные жиры обсуждаются в средствах массовой информации. Что читатели могут узнать из вашего исследования о полиненасыщенных и насыщенных жирах?
Наши данные убедительно подтверждают, что замена насыщенных жиров растительными маслами, богатыми полиненасыщенными жирами, полезна для профилактики ишемической болезни сердца.Текущие дебаты о роли насыщенных жиров упускают из виду важный момент: заменитель питательного вещества. Если насыщенные жиры заменить углеводами (обычно рафинированными), пользы от сердечных заболеваний не будет. Вот почему во многих эпидемиологических исследованиях не было обнаружено значительной связи между насыщенными жирами и риском ИБС, поскольку углеводы обычно использовались в качестве средства сравнения.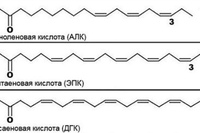 Однако, если насыщенные жиры заменить полиненасыщенными, то есть явная польза для профилактики сердечных заболеваний.
Однако, если насыщенные жиры заменить полиненасыщенными, то есть явная польза для профилактики сердечных заболеваний.
3. Есть ли определенное количество потребителей линолевой кислоты, которые должны съедать каждый день? Какие источники самые лучшие?
В соответствии с рекомендациями Американской кардиологической ассоциации, наши данные по-прежнему поддерживают потребление 5–10% энергии линолевой кислоты * для снижения риска ИБС. Линолевая кислота является преобладающей n-6 полиненасыщенной жирной кислотой (ПНЖК) в западной диете, и мы можем получить ее из растительных масел, таких как подсолнечное, сафлоровое, соевое, кукурузное и каноловое масла, а также орехов и семян.Столовая ложка соевого или кукурузного масла содержит около 7-8 г линолевой кислоты, а 7 очищенных грецких орехов содержат около 11 г линолевой кислоты. Следует отметить, что важные источники линолевой кислоты, такие как соевые бобы, масла канолы и грецкие орехи, также содержат значительные количества альфа-линоленовой кислоты, растительной жирной кислоты омега-3.
* Например, для диеты в 2000 калорий, что соответствует 100-200 калориям из линолевой кислоты.
4. В вашем исследовании также рассматриваются утверждения о провоспалительных свойствах линолевой кислоты.Можете ли вы объяснить, что вы обнаружили, когда исследовали это?
Были высказаны опасения по поводу того, что повышенное потребление линолевой кислоты вредно для здоровья сердца из-за потенциальных воспалительных и тромбогенных свойств . Линолевая кислота может быть удлинена до арахидоновой кислоты и впоследствии синтезирована до множества провоспалительных эйкозаноидов, что может увеличить риск ИБС. Но это предположение не подтверждается рандомизированными контролируемыми исследованиями кормления, в которых не было обнаружено, что потребление линолевой кислоты с пищей увеличивает уровень арахидоновой кислоты или маркеров воспаления в плазме.Напротив, некоторые исследования показали, что противовоспалительные эффекты диет с более высоким содержанием линолевой кислоты по сравнению с диетами с более высоким содержанием насыщенных жиров.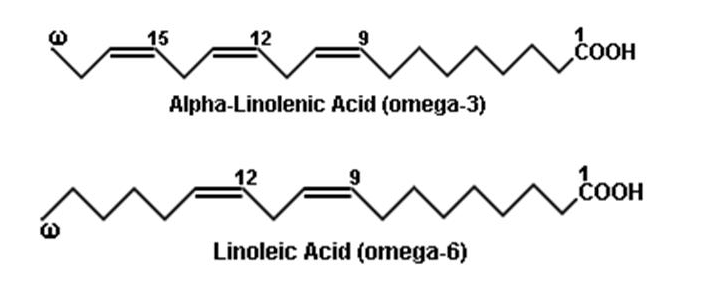
5. На основании этого нового исследования, какие простые шаги потребители могут предпринять, чтобы улучшить свое питание?
Вместо масла, сливок, сала и других животных жиров в качестве основного источника кулинарного жира следует использовать жидкие растительные масла, такие как соевое, кукурузное, оливковое и рапсовое масло, для приготовления пищи, салата и за столом. Хотя оливковое масло содержит мало линолевой кислоты, многие исследования показали пользу для здоровья средиземноморской диеты, богатой оливковым маслом.Орехи и семена также являются отличными источниками полезных жиров.
Ссылки
1. Фарвид М.С., Дин М., Пан А, Сан К., Чиув С.Е., Штеффен Л.М., Виллетт В.С., Ху Ф.Б. Линолевая кислота в пище и риск ишемической болезни сердца: систематический обзор и метаанализ проспективных когортных исследований. Тираж . 2014
Учебное пособие по химии жирных кислот
Пожалуйста, не блокируйте рекламу на этом сайте.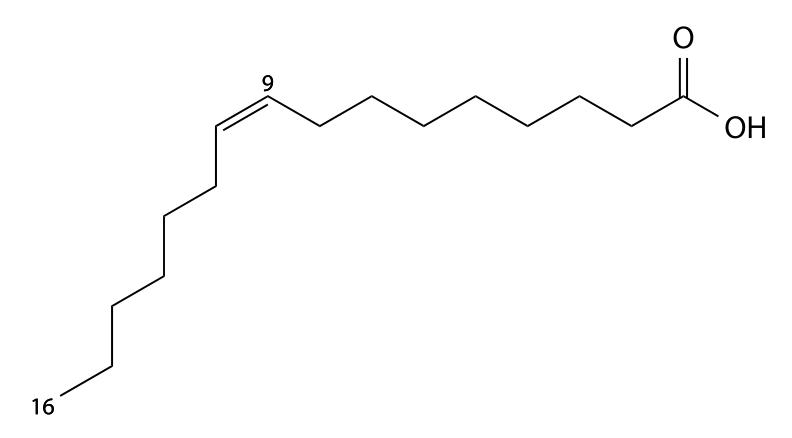
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Жирные кислоты: структура и формула
Жирные кислоты — это карбоновые кислоты с длинной цепью, они содержат карбоксильную функциональную группу COOH .
Общая формула жирной кислоты: R- COOH , где R представляет собой длинную углеводородную цепь.
Если углеводородная цепь R содержит только одинарные связи между атомами углерода, жирная кислота называется насыщенной.
| Насыщенные жирные кислоты | ||
|---|---|---|
| Название | Концентрированная структурная формула | Молекулярная формула |
| пальмитиновая кислота | CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 — COOH (канал 3 (канал 2 ) 14 COOH ) | С 16 В 32 О 2 |
| стеариновая кислота | CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 — COOH (канал 3 (канал 2 ) 16 COOH ) | C 18 H 36 O 2 |
Общая формула насыщенной жирной кислоты: C n H 2n O 2
Например:
Если углеводородная цепь R содержит ТОЛЬКО одну двойную связь между атомами углерода (C = C), то жирная кислота считается мононенасыщенной (приставка «моно» означает единицу, «ненасыщенная» относится к присутствию C = C или C≡C).
| Мононенасыщенные жирные кислоты | ||
|---|---|---|
| Название | Концентрированная структурная формула | Молекулярная формула |
| пальмитолеиновая кислота | CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH = CH-CH 2 -CH 2 -CH 2 — Канал 2 -Канал 2 -Канал 2 -Канал 2 — COOH (CH 3 (CH 2 ) 5 CH = CH (CH 2 ) 7 COOH ) | C 16 H 30 O 2 |
| олеиновая кислота | CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH = CH-CH 2 — CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 — COOH (CH 3 (CH 2 ) 7 CH = CH (CH 2 ) 7 COOH ) | C 18 H 34 O 2 |
Теперь давайте сравним структуру насыщенной жирной кислоты со структурой мононенасыщенной жирной кислоты.
Чтобы ввести ОДИН C = C в насыщенную жирную кислоту, известную как пальмитиновая кислота (C 16 H 32 O 2 ), чтобы получить мононенасыщенную жирную кислоту, известную как пальмитолеиновая кислота, необходимо удалить 2 атома водорода из структуры и формулы пальмитиновой кислоты, поэтому молекулярная формула пальмитоелевой кислоты — C 16 H (32-2) O 2 , что соответствует C 16 H 30 O 2
Для жирных кислот, содержащих такое же количество атомов углерода, формула мононенасыщенной жирной кислоты содержит на 2 атома водорода меньше, чем формула насыщенной жирной кислоты.
Общая молекулярная формула мононенасыщенной жирной кислоты: C n H 2n-2 O 2
Например:
- Если n = 16
, тогда 2n-2 = (2 × 16) -2 = 32-2 = 30
Молекулярная формула мононенасыщенной жирной кислоты: C 16 H 30 O 2
- Если n = 18
, тогда 2n-2 = (2 × 18) -2 = 36-2 = 34
Молекулярная формула мононенасыщенной жирной кислоты: C 18 H 34 O 2
Если в структуре углеводородной цепи молекулы жирной кислоты присутствует более одного C = C, жирная кислота считается полиненасыщенной (приставка «поли» означает «много», «ненасыщенная» относится к присутствию C = C или C≡C).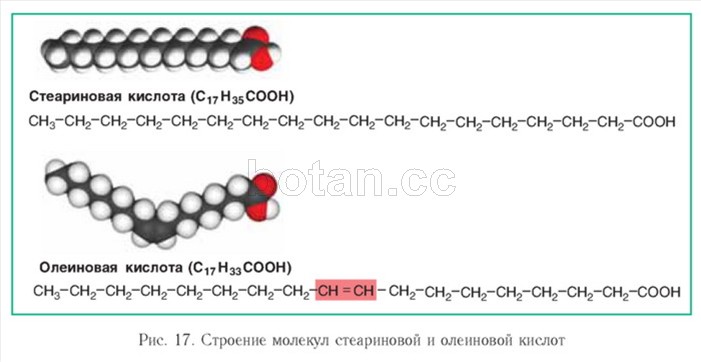
| Полиненасыщенные жирные кислоты | ||
|---|---|---|
| Название | Концентрированная структурная формула | Молекулярная формула |
| линолевая кислота | CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH = CH-CH 2 -CH = CH-CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 — COOH (CH 3 (CH 2 ) 4 CH = CHCH 2 CH = CH (CH 2 ) 7 COOH ) | С 18 В 32 О 2 |
| α -линоленовая кислота | CH 3 -CH 2 -CH = CH-CH 2 -CH = CH-CH 2 -CH = CH-CH 2 -CH 2 -CH 2 -CH 2 -канальный 2 -канальный 2 -канальный 2 — COOH (CH 3 CH 2 CH = CHCH 2 CH = CHCH 2 CH = CH (CH 2 ) 7 COOH ) | C 18 H 30 O 2 |
Теперь сравним формулу мононенасыщенной жирной кислоты, известной как олеиновая кислота, C 18 H 34 O 2 , с формулой жирной кислоты, содержащей 18 атомов углерода, но 2 двойных связи, линолевой кислоты, C 18 H 32 O 2 .
Увеличение количества двойных связей на 1 уменьшает количество атомов водорода в структуре (и формуле) на 2.
В общем, мы можем сказать, что молекулярная формула жирной кислоты будет C n H 2n- 2x O 2
, где n = общее количество атомов углерода в структуре жирной кислоты.
и x = количество двойных связей между атомами углерода
Например:
- стеариновая кислота (насыщенная жирная кислота)
п = 18
2н = 2 × 18 = 36
х = 0
2 х = 2 × 0 = 0
2н — 2 х = 36 — 0 = 36
C n H 2n- 2x O 2 is C 18 H 36 O 2 - олеиновая кислота (мононенасыщенная жирная кислота, один C = C)
п = 18
2н = 2 × 18 = 36
х = 1
2 х = 2 × 1 = 2
2n — 2 x = 36 — 2 = 34
C n H 2n- 2x O 2 is C 18 H 34 O 2 - линолевая кислота (полиненасыщенная жирная кислота, два C = C)
п = 18
2н = 2 × 18 = 36
х = 2
2 х = 2 × 2 = 4
2n — 2 x = 36 — 4 = 32
C n H 2n- 2x O 2 is C 18 H 32 O 2 - α -линоленовая кислота (полиненасыщенная жирная кислота, три C = C)
п = 18
2н = 2 × 18 = 36
х = 3
2 х = 2 × 3 = 6
2n — 2 x = 36 — 6 = 30
C n H 2n- 2x O 2 is C 18 H 30 O 2
Свойства жирных кислот
Физические свойства жирных кислот, то есть температура плавления и растворимость, определяются природой длинной углеводородной цепи.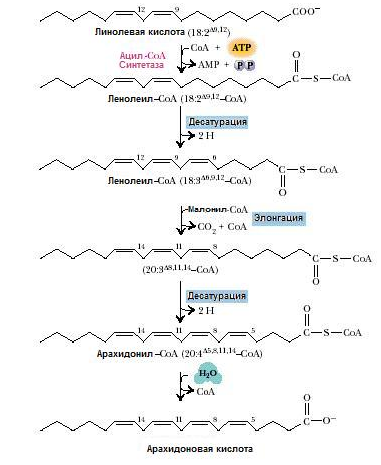
Жирные кислоты — неполярные молекулы.
Даже несмотря на то, что карбоксильная группа является полярной функциональной группой, взаимодействия между молекулами жирных кислот и между молекулами жирных кислот и растворителем определяются природой длинной неполярной углеводородной цепи.
Рассмотрим насыщенную жирную кислоту, известную как пальмитиновая кислота, C 16 H 32 O 2 :
| CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 -CH 2 | -COOH |
| длинная неполярная углеводородная цепь | функциональная группа карбоновой кислоты |
В образце чистой пальмитиновой кислоты любые взаимодействия между функциональными группами карбоновых кислот будут минимальными, потому что практически все межмолекулярные взаимодействия происходят между этими длинными неполярными углеводородными цепями, и эти взаимодействия представляют собой слабые межмолекулярные силы, известные как силы Лондона или силы дисперсии. .Однако, поскольку насыщенные жирные кислоты имеют аккуратную зигзагообразную структуру, они хорошо сочетаются друг с другом:
.Однако, поскольку насыщенные жирные кислоты имеют аккуратную зигзагообразную структуру, они хорошо сочетаются друг с другом:
СансCCCCCCCCCCCCCCCCCC
и так много таких взаимодействий!
Чем больше длина цепи насыщенного углеводорода, тем больше взаимодействий между молекулами!
Изучая свойства карбоновых кислот, вы могли бы заметить, что точка плавления алкановых кислот (насыщенных карбоновых кислот) увеличивается с увеличением длины неполярной углеводородной цепи.По мере увеличения длины неполярного углеводорода степень слабого ван-дер-ваальсова притяжения (силы Лондона или дисперсионные силы) между молекулами увеличивается.
Это приводит к тому, что требуется больше энергии, чтобы ослабить притяжение между молекулами и расплавить вещество.
Насыщенная жирная кислота — это просто длинноцепочечная алкановая кислота.
По мере увеличения длины неполярной углеводородной цепи температура плавления насыщенной жирной кислоты увеличивается.
Ожидается, что насыщенные жирные кислоты будут твердыми при комнатной температуре и давлении.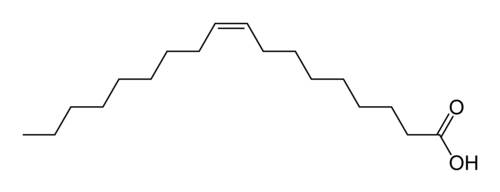
Но что произойдет, если молекула жирной кислоты ненасыщенная?
В природных жирных кислотах введение одной или нескольких двойных связей в длинную углеводородную цепь вызывает «изгиб» цепи (цис-геометрия).
Олеиновая кислота, мононенасыщенная жирная кислота, C 18 H 34 O 2 , с этим перегибом, называется цис-олеиновой кислотой, и ее скелетная структура показана ниже:
В результате этого «перегиба» эти молекулы не упаковываются вместе, поэтому степень слабых межмолекулярных сил, действующих между молекулами, меньше.Следовательно, для плавления ненасыщенной жирной кислоты требуется меньше энергии. Предполагается, что температура плавления ненасыщенной жирной кислоты будет ниже, чем точка плавления насыщенной жирной кислоты.
Длинная неполярная углеводородная цепь жирной кислоты также определяет ее растворимость в воде и других растворителях.
Полярные молекулы воды более сильно притягиваются друг к другу посредством водородных связей, чем к молекулам жирных кислот, потому что единственное взаимодействие, которое они могут иметь с молекулами жирных кислот, — это слабые межмолекулярные силы, известные как силы Лондона или силы дисперсии.
Следовательно, жирные кислоты не растворяются в воде, жирные кислоты считаются нерастворимыми в воде.
Однако жирные кислоты будут растворимы в неполярных растворителях, таких как углеводороды, жиры и масла, где неполярные углеводородные цепи могут взаимодействовать с молекулами неполярного растворителя посредством слабых межмолекулярных сил, известных как силы Лондона или силы дисперсии.
Что касается химических свойств жирных кислот, мы ожидаем, что ненасыщенные жирные кислоты будут вступать в реакции присоединения, например, с галогенами, такими как йод (I 2 ), в то время как насыщенные жирные кислоты не могут вступать в реакции присоединения.
Ниже приведены некоторые свойства жирных кислот:
| Тип | General Formula | Пример | Недвижимость |
|---|---|---|---|
| Насыщенный (без двойных связей) | C n H 2n O 2 (n = количество атомов углерода) | CH 3 (CH 2 ) 14 COOH пальмитиновая кислота CH 3 (CH 2 ) 16 COOH | ⚛ твердые вещества инертные относительно неполярные нерастворимые в воде ⚛ больше в животных жирах |
| Мононенасыщенные (1 двойная связь) | C n H 2n-2 O 2 (n = нет.  атомов углерода) атомов углерода) | CH 3 (CH 2 ) 7 CH = CH (CH 2 ) 7 COOH олеиновая кислота | мягче, чем насыщенные жирные кислоты реакционноспособен ⚛ относительно неполярен ol нерастворим в воде |
| Полиненасыщенные (> 1 двойная связь) | C n H 2n- 2x O 2 (n = нет.атомов углерода x = нет. двойные связи) | CH 3 (CH 2 ) 4 CH = CHCH 2 CH = CH (CH 2 ) 7 COOH линолевая кислота | ⚛ скорее всего масла реактивные относительно неполярные нерастворимые в воде больше в растительных маслах |