Мышцы на картошке. Польза картофельного белка.
Екатерина ШмырёваМаркетолог
444
Чтобы мышечная ткань восстанавливалась, человеческому организму необходим белок. В белках растительного происхождения зачастую не хватает полезных аминокислот, которые необходимы нашему организму для восстановления. Но нам есть чем это оспорить. Учёные Университета Маастрихта исследовали влияние картофельного белка на синтез мышечного белка и обнаружили, что реакция организма не отличается от реакции на молочный белок. Более того, при употреблении 30 грамм концентрированного картофельного белка после тренировки, скорость синтеза мышечного белка увеличивалась, по сравнению с употреблением молочного.
В исследовании, опубликованном в журнале Medicine & Science in Sports & Exercise, исследователи предсказали, что два типа белков будут иметь почти идентичные процессы синтеза мышечного белка (MPS) — метод, при котором организм превращает аминокислоты в мышечный белок.
Картофельный белок эффективен для мышц
Участники, которые употребляли 30 граммов концентрата картофельного белка, демонстрировали те же уровни MPS, что и те, кто потреблял 30 граммов концентрата молочного белка. Результаты исследования опровергли идею о том, что для наращивания мышечной массы необходим только животный белок, и подтвердили теорию о том, что растительные белки столь же эффективны, когда дело доходит до наращивания мышечной массы.
“Анаболический ответ на физические нагрузки зависит от стимуляции упражнений и увеличения количества циркулирующих аминокислот после приема пищи”, — пишет ведущий автор исследования и профессор физиологии физических упражнений и питания в Медицинском центре Маастрихтского университета Люк Дж.К. Ван Лун, доктор философии.
“В целом, считается, что белки растительного происхождения обладают меньшими анаболическими свойствами из-за их меньшей усвояемости и неполного аминокислотного профиля.
Тестирование картофельных белков по сравнению с молочным белком и влияние на физические нагрузки
Исследователи привлекли 24 здоровых мужчин в возрасте от 18 до 35 лет, чтобы проанализировать, как белковые добавки повлияли на наращивание мышечной массы. Исследователи провели предварительную проверку участников перед употреблением белковых добавок. После испытаний исследовательская группа провела два дополнительных измерения для изучения показателей MPS в периоды отдыха и восстановления.
В исследовании использовался двойной слепой сбор данных, в ходе которого участники выполняли упражнения на тренажере для жима ногами, случайным образом потребляя либо 30 граммов картофельного, либо молочного белка. После упражнений исследователи зафиксировали сопоставимые уровни MPS.
“Основной результат заключается в том, что прием картофельного белка может увеличить скорость синтеза мышечного белка в состоянии покоя и при физических нагрузках, и что этот ответ не отличается от приема эквивалентного количества молочного белка”, — сказал ван Лун в интервью Medical News Today.
Употребление одного картофеля не обеспечит достаточное количество белка, чтобы получить все преимущества. Картофель содержит только 1,5 процента белка от его веса в свежем виде. В исследовании, однако, использовались картофельные концентраты из картофельных соков, которые будут выброшены или использованы для корма. Исследователи отметили, что в будущем необходимо будет провести дополнительные исследования, оценивающие зависимость доз.
Исследование финансировалось Альянсом исследований и образования в области картофеля (APRE), но организация показала, что она не участвовала в разработке или проведении анализа данных.
Наращивание мышц с помощью растительного белка
Голландское исследование присоединилось к обширному портфелю исследований, направленных на доказательство того, что растительный белок может принести организму такую же пользу, как и источники белка животного происхождения. В январе этого года Гамильтон Рошель из Университета Сан-Паулу опубликовал исследование в научном журнале Sports Medicine, в котором анализировалось развитие мышц у всеядных и веганов.
В ходе исследования всеядные и веганы потребляли по 1,6 грамма белка на килограмм массы тела для наращивания мышечной массы. В течение трехмесячного периода исследователи пришли к выводу, что участники, употреблявшие растительные продукты, не показали существенной разницы в мышечных волокнах, целых мышцах или мышечной массе.
“Высокобелковая диета исключительно растительного происхождения (цельные продукты растительного происхождения плюс добавки с изолятом соевого белка) не отличается от смешанной диеты с белком (цельные продукты смешанного приготовления плюс добавки с сывороточным протеином) в плане поддержания мышечной силы и увеличения массы, предполагая, что источник белка не влияет на силовые тренировки -индуцированная адаптация у нетренированных молодых людей, потребляющих достаточное количество белка ”, — писали исследователи в то время.
Авторы пишут, что большинство растительных белков, используемых в протеиновых порошках для упражнений, — это гороховый белок, соевый белок, рис или другие растительные источники, но мало кто изучал белок в картофеле.
Средняя картофелина содержит около 4,3 грамма белка, а это значит, что практически невозможно получить полное количество белка (или даже 30 граммов) из картофеля, поэтому исследование не предполагало, что вы едите только картофель и ожидаете наращивания мышечной массы.
Выводы исследования должны были спровоцировать размышления об источнике белка для спортсменов, которые полагаются на молочные белки, чтобы переоценить потребность в животных и растительных источниках белка в их рационе.
Галерея
- картофель
Предыдущая статья
Следующая статья
- Главная
- Блог
- О компании
- Вакансии
- Контакты
- Выполненные проекты 200+
- Технологии
- Оборудование
- Сотрудничество
Заказать консультацию
Выберете тему консультации, укажите номер телефона, на который вам позвонить. Мы свяжемся с вами в течении 1 часа.
Мы свяжемся с вами в течении 1 часа.
Заголовок
Поделиться
О чем расскажет анализ на аминокислоты? – официальный сайт сети лабораторий «Хромолаб» в Москве
Анализ на аминокислоты — основный метод оценки степени усвоения пищевого белка, а также метаболического дисбаланса. Это исследование дает возможность своевременно выявить и скорректировать наследственные или приобретенные нарушения.
Значение аминокислот для нашего организма
Аминокислоты необходимы для синтеза гормонов и других биологически активных веществ, для образования клеток иммунной системы, транспортных молекул. Без аминокислот невозможны все виды окислительно-восстановительных реакций и другие биохимические процессы. Аминокислоты обеспечивают жизнедеятельность на клеточном уровне, от которой зависит состояние всего организма в целом.
Источниками свободных аминокислот в организме являются белки пищи, собственные белки тканей и синтез из углеводов и жиров. Аминокислоты, в отличие от жиров и глюкозы, не запасаются, поэтому в экстренных для организма ситуациях распадаются белки мышц, печени и плазмы крови, которые выполняют важные функции. Именно поэтому белковое голодание или дефицит отдельных аминокислот так опасны для здоровья.
Аминокислоты, в отличие от жиров и глюкозы, не запасаются, поэтому в экстренных для организма ситуациях распадаются белки мышц, печени и плазмы крови, которые выполняют важные функции. Именно поэтому белковое голодание или дефицит отдельных аминокислот так опасны для здоровья.
Полученные с пищей белки подвергаются полному распаду до аминокислот в ЖКТ, через кишечную стенку аминокислоты всасываются и с током крови распространяются по всему организму, где из них синтезируются белки. При распаде белков и аминокислот азот выводится мочой в форме мочевины, а оставшаяся углеродная часть используется для синтеза углеводов, липидов или окисляется до аденозинтрифосфорной кислоты (АТФ) – основного источника энергии для клеток и организма в целом.
Какие заболевания поможет диагностировать исследование до появления первых клинических симптомов?
Повышение общего уровня аминокислот в крови может говорить о следующих заболеваниях или отклонениях от нормы:
- сахарный диабет;
- печеночная недостаточность с энцефалопатией;
- почечная недостаточность;
- эклампсия в период беременности;
- заболевания, сопровождающиеся распадом белка;
- контроль усвоения белковосодержащих нутриентов;
- дефицит и нарушения в транспортных белках;
- высокая интенсивность физических нагрузок или травма.

Снижение общего уровня аминокислот в крови может говорить о следующих заболеваниях или отклонениях от нормы:
- воспалительные процессы организма, сопровождающиеся субфебрильной лихорадкой;
- заболевания почек;
- ревматоидный артрит;
- недостаточное питание;
- воспалительные заболевания ЖКТ, сопровождающехся нарушением всасывания питательных веществ;
- избыточный синтез гормонов коры надпочечников;
- ослабление иммунитета.
Чем поможет анализ на аминокислоты?
С момента введения теста наша лаборатория выполнила более 12 000 исследований на определение общего уровня аминокислот.
Выявлены основные клинические моменты:
— У 8 000 пациентов мы определили дефицит незаменимых аминокислот;
— У 4 000 пациентов обнаружены нарушения в белковом и жировом обмене;
— У большинства пациентов после перенесенного COVID-19 (SARS-CoV-2) обнаружен дисбаланс нутриентов с накоплением промежуточных продуктов метаболизма.
Определение концентраций аминокислот вместе с оценкой концентраций ацилкарнитинов покажет:
— Полноценную картину жирового и белкового обмена в организме;
— Наличие или отсутствие митохондриальной недостаточности;
— Полноценную оценку особенностей метаболизма при планировании и беременности, особенно у пациентов с хроническими заболеваниями.
Что вы найдете в нашем бланке после исследования?
Интерпретация заменимых, незаменимых аминокислот и ацилкарнитинов
Заменимые аминокислоты – это аминокислоты, поступающие в организм человека с белковой пищей, либо образующиеся в организме из других аминокислот.
Незаменимые аминокислоты – это аминокислоты, которые не могут быть получены в организме человека с помощью биосинтеза, поэтому должны постоянно поступать в виде пищевых белков.
Каждая аминокислота, помимо общих функций, обладает какими-либо специфическими особенностями.
Аргинин (Arg)(заменимая) — способствует укреплению иммунитета, регенерации тканей, улучшает кровоток в капиллярах, борется с атеросклерозом, является ключевым метаболитом в процессах азотистого обмена.
Валин (Val) (незаменимая) — отвечает за восстановление мышечной и нервной тканей, защищает миелиновую оболочку, окружающую нервные волокна в головном и спинном мозге, способствует поддержанию азотистого баланса, препятствует снижению уровня серотонина, понижает чувствительность организма к боли, холоду, жаре.
Лейцин (Leu) (незаменимая) — отвечает за оптимальный уровень глюкозы в крови, структуру мышечной ткани, укрепляет иммунную систему.
Метионин (Met) (незаменимая) — снижает содержание холестерина, увеличивает содержание антиоксиданта глютатиона, способствует выводу тяжелых металлов и токсинов из организма, восстановлению тканей внутренних органов, регуляции содержания аммиака.
Фенилаланин (Phe) (незаменимая) — обеспечивает оптимальный уровень серотонина, участвует в работе нервной системы, играет важную роль в синтезе гормона инсулина, тироксина, меланина.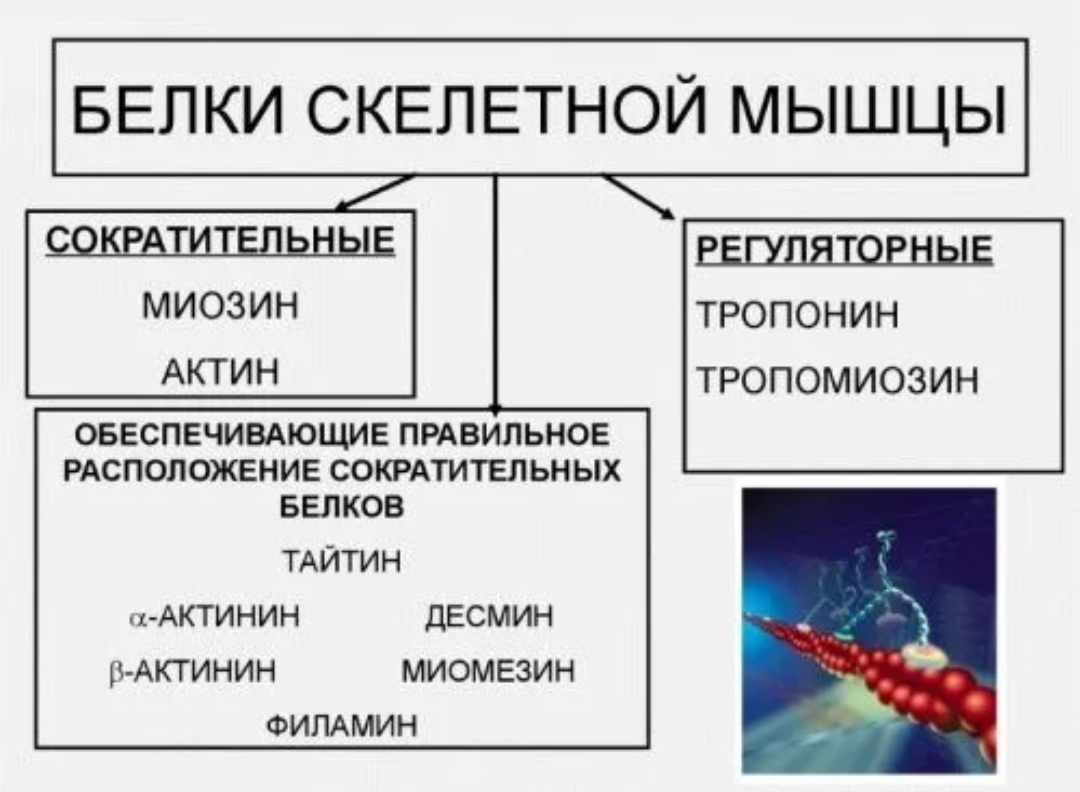
Аланин (Ala) (заменимая) — участвует в укреплении мышечной ткани и способствует повышению выносливости организма, регулирует уровень сахара в крови.
Аспарагиновая кислота (Asp) (заменимая) — необходима для нормальной работы иммунной системы, синтеза ДНК и РНК, для аппарата наследственности, клеточного роста, процесса деления клеток.
Глицин (Gly) (заменимая) — улучшает метаболические процессы в тканях мозга, также необходим для синтеза креатина, участвующего в расщеплении аденозинтрифосфорной кислоты (АТФ) для получения энергии для работы мышц и всех тканей, и органов.
Глутаминовая кислота (Glu) (заменимая) — играет основную роль в азотистом обмене, в деятельности скелетной мускулатуры, участвует в белковом и углеводном обмене, способствует синтезу аденозинтрифосфорной кислоты (АТФ), обезвреживанию и выведению из организма аммиака, повышает устойчивость организма к гипоксии.
Пролин (Pro) (заменимая) – участвует в синтезе коллагена и соединительной ткани, способствует поддержанию тонуса кожи, мышц, стенок сосудов, способствует заживлению ран.
Тирозин (Tyr) (заменимая) – участвует в работе центральной нервной системы и осуществлении высшей нервной деятельности, участвует в выработке гормона щитовидной железы — тироксина, участвует в процессах обмена белков, жиров и углеводов, участвует в выработке нейромедиаторов допамина и норэпинефрина, способствует выработке мелатонина и улучшает функцию надпочечников, подавляет аппетит, способствует уменьшению отложения жиров.
Орнитин (Orn) (заменимая) —снижает концентрацию аммиака в плазме крови, способствует нормализации кислотно-щелочного состояния организма и выработке инсулина и соматотропного гормона. Улучшает белковый обмен при заболеваниях, требующих парентерального питания.
Цитруллин (Cit) (заменимая) —участвует в метаболизме мочевины, является промежуточным метаболитом в утилизации токсичного вещества – аммиака.
В информативном бланке результата исследования на Аминокислоты в плазме крови (13 показателей) вы увидете референсное значение каждого маркера:
Ацилкарнитины – производные L-карнитинов. Это временные соединения, образующиеся с целью транспортировки жирных кислот через мембрану митохондрий для дальнейшего их окисления. Определение этих соединений позволяет диагностировать недостаточность различных ферментов, принимающих участие в метаболизме жирных кислот. Кроме того, это маркёр различных заболеваний сердечно-сосудистой системы, головного мозга, печени.
Это временные соединения, образующиеся с целью транспортировки жирных кислот через мембрану митохондрий для дальнейшего их окисления. Определение этих соединений позволяет диагностировать недостаточность различных ферментов, принимающих участие в метаболизме жирных кислот. Кроме того, это маркёр различных заболеваний сердечно-сосудистой системы, головного мозга, печени.
Определение концентраций ацилкарнитинов совместно с определением уровня аминокислот используется для оценки метаболизма карнитина и нарушений обмена жирных кислот, органических кислот и белкового обмена, для оценки риска развития сердечно-сосудистых заболеваний, патологий печени, головного мозга, для выявления митохондриальной дисфункции и дисбаланса в обмене нутриентов.
Анализ рекомендуется для адекватной коррекции диеты и мониторинга эффективности лечения различных заболеваний, связанных с обменом жирных кислот в организме.
Результаты исследования на Ацилкарнитины в плазме крови подробно описаны в бланке результата по всем маркерам:
мышечный протеин
мышечный протеинРекламный ролик
1 из 17 0003
Реклама
Реклама
мышечный белок
- 1
МЫШЦЫ
БЕЛКИ
Представлено;- MAAZ UL HAQ
Институт глаз Гупта c.
 L.
L. - МЫШЕЧНЫЙ БЕЛОК • Мышечная масса состоит из белка. • Большую роль играют структурные белки, а именно актин, миозин и белки, сшивающие актин, тропомиозин и тропонин. • Мышцы также содержат другие белки — миоглобина, коллагена, ферментов и др. 2
- 3
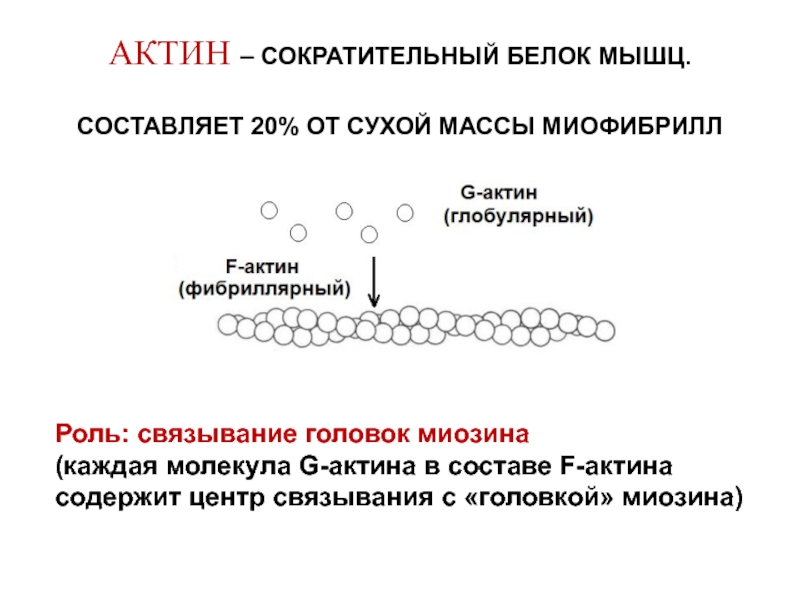
- АКТИН • Основной компонент тонких нитей саркомера. • Он существует в двух формах – Мономерный G-актин Полимерный F-актин. • G-актин составляет около 25 % мышечных белков. бой. • В присутствии ионов Mg G-актин полимеризуется с образованием растворимый двойной спиральный F-актин толщиной 6-7 нм. 4
- ФУНКЦИЯ АКТИНА Некоторые основные роли актина включают: • Являясь структурным составом и опорой цитоскелета. • Делиться и производить, чтобы позволить клеткам двигаться спонтанно и активно. • Служит поддерживающей структурой для белка миозина во время мышечного контроля. действие. 5
- ТРОПОМИОЗИН И ТРОПОНИН
• Сшивающие белки обнаружены в ассоциации с актином.
• Хотя они и незначительны по массе, но важны с точки зрения
их функции.
 • Тропомиозин, состоящий из двух цепей, присоединяется к F-актину в t
он гудит.
• Тропоны состоят из трех полипептидных цепей-
тропонин Т, тропинин I, тропонин С
6
• Тропомиозин, состоящий из двух цепей, присоединяется к F-актину в t
он гудит.
• Тропоны состоят из трех полипептидных цепей-
тропонин Т, тропинин I, тропонин С
6 - 7
- МИОЗИН • Миозины на самом деле представляют собой семейство белков, насчитывающее около 15 членов. • Миозин, который преимущественно присутствует в мышцах, — это миозин II. • миозин составляет примерно 55% мышц и находится в ик нити. • Миозин состоит из шести полипептидных цепей. • содержит одну пару тяжелых (H) цепей и две пары легких (L) цепей. цепи. 8
- ФУНКЦИЯ МИОЗИНА Миозин выполняет три важные функции: • Входит в состав толстой нити мышечного волокна. • Аминоконцевые глобулярные концы миозина имеют три аденозиновых соединения. активность фосфатазы (АТФазы), гидролизует АТФ до АДФ + Pi и p обеспечивает свободную энергию для сокращения мышц. • Миозин взаимодействует с актином и создает силу, которая перемещает он толстая и тонкая нить мимо друг друга. 9
- 10
- Легкие и тяжелые меромиозины
• Когда миозин расщепляется трипсином, два фрагмента, а именно LMM
и HMM производятся.
 • Легкий меромиозин представляет собой а-спиральные волокна хвоста миозина.
, и не может связываться с F-актином.
• Тяжелый меромиозин содержит фиброзную и глобулярную части
осин.
• HMM ингибируют активность АТФазы и связываются с F-актином.
11
• Легкий меромиозин представляет собой а-спиральные волокна хвоста миозина.
, и не может связываться с F-актином.
• Тяжелый меромиозин содержит фиброзную и глобулярную части
осин.
• HMM ингибируют активность АТФазы и связываются с F-актином.
11 - 12
- МЫШЕЧНОЕ СОКРАТЕНИЕ • Во время фазы расслабления мышечного сокращения головка S-1 миозина гидролизует АТФ до АДФ и Pi. • При сокращении мышца стимулируется к окончательному формированию актина. комплекс озин-АДФ-Пи. • Следующим шагом является рабочий ход, который приводит в движение актиновые филаменты над миозиновыми филаментами. За этим следует выпуск ADP и Pi, а также изменение конформации миозина. n комплекс находится в низкоэнергетическом состоянии. 13
- • Свежая молекула АТФ теперь связывается с образованием актин-миозинового АТФ c комплекс. 14
- Источники АТФ для сокращения мышц
АТФ – постоянный источник энергии для мышц
цикл сокращения и расслабления. АТФ может быть
генерируется следующими способами.
 • За счет фосфорилирования гликолиза на уровне субстрата с использованием глюкозы
или гликоген.
• Путем окислительного фосфорилирования.
• Из креатинфосфата.
15
• За счет фосфорилирования гликолиза на уровне субстрата с использованием глюкозы
или гликоген.
• Путем окислительного фосфорилирования.
• Из креатинфосфата.
15 - Заболевания мышц мышечная дистрофия — • Мышечная дистрофия является наследственным заболеванием в Какие мышцы постепенно изнашиваются. • Это вызвано мутациями в гене, кодирующем белок н дистрофин. • Мышечная дистрофия относится к группе заболеваний, связанных с прогрессирующая потеря мышечной массы и последующая потеря силы. 16
- СПАСИБО…… 17
Реклама
Помощь с мышечными белками и сигналами
Все ресурсы по анатомии и физиологии человека
6 диагностических тестов 306 практических тестов Вопрос дня Карточки Learn by Concept
Справка по анатомии и физиологии человека » Системная физиология » Скелетно-мышечная физиология » Мышечная физиология » Помощь с мышечными белками и сигналами
При злокачественной гипертермии общая анестезия вызывает неконтролируемое увеличение метаболизма скелетных мышц, в результате чего тело вырабатывает тепло быстрее, чем оно может охладиться и использовать запасы кислорода в организме. Дантролен — это лекарство, используемое для лечения этого состояния, так как оно блокирует увеличение внутриклеточного кальция. Какова роль кальция в сокращении мышц?
Дантролен — это лекарство, используемое для лечения этого состояния, так как оно блокирует увеличение внутриклеточного кальция. Какова роль кальция в сокращении мышц?
Выброс ацетилхолина в синаптическую щель
Ускоряет проведение потенциалов действия
Связывается с актином и сдвигает его, чтобы укоротить мышцу
Стабилизирует клеточную мембрану клеток скелетных мышц
Связывается с тропонином, чтобы обнаружить сайты связывания актина
Привязать к тропонин для раскрытия сайтов связывания актина
Объяснение:При сокращении скелетных мышц кальций связывается с тропонином, открывая места связывания актина.
Чтобы произошло сокращение скелетных мышц, белок миозин должен соединиться с белком актином и сдвинуть его, чтобы уменьшить длину саркомера, который является сократительной единицей мышцы. В состоянии покоя участки актина, с которыми должен связываться миозин, покрыты белком тропомиозином. Тропонин представляет собой белок, присоединенный к тропомиозину, с которым может связываться кальций.
Тропонин представляет собой белок, присоединенный к тропомиозину, с которым может связываться кальций.
Когда потенциал действия достигает мышечной клетки, он проходит по Т-трубочкам и достигает саркоплазматического ретикулума. Саркоплазматический ретикулум высвобождает запасы кальция, которые связываются с тропонином. Это связывание вызывает конформационное изменение тропонина, которое заставляет его смещать положение присоединенного тропомиозина, открывая сайты связывания на актине. Затем миозин может связываться, и может происходить сокращение.
Миозин связывается с актином и сдвигает его, укорачивая саркомер. Секреторные везикулы выделяют ацетилхолин в синаптическую щель при стимуляции пресинаптического нейрона. Эта стимуляция вызывает приток кальция к окончаниям аксона, но не связана напрямую с увеличением внутриклеточного кальция мышечной клетки. Дистрофин — белок, стабилизирующий клеточную мембрану скелетных мышц. Миелинизация аксонов ускоряет проведение потенциалов действия.
Сообщить об ошибке
После Нового года вы решаете больше заниматься спортом и с энтузиазмом просыпаетесь ранним холодным утром, чтобы отправиться на пробежку. Поначалу вы чувствуете себя прекрасно, но через десять минут бега вы чувствуете невыносимую боль в правой икре, которая заставляет вас остановиться и сесть на бордюр. Вы чувствуете, как сокращаются икры, и замечаете, что пальцы ног направлены вниз. Вы не можете изменить это положение и думаете, что у вас мышечная судорога. Через несколько минут боль стихает, и вы снова можете двигать ногой. Какой молекулярный дефицит отвечает за это состояние?
Возможные ответы:АТФ
Ацетилхолин
Натрий
Кальций
Калий
Правильный ответ :АТФ
Пояснение:Дефицит АТФ является основной причиной судорог скелетных мышц.
Во время анаэробной фазы упражнений АТФ быстро расходуется до того, как может начаться клеточное дыхание. Сокращение мышц требует, чтобы миозин связывался с актином и сдвигал его для укорочения саркомера. Присоединение АДФ и неорганического фосфата к головке миозина заставляет ее связываться с актином. Высвобождение АДФ и неорганического фосфата заставляет миозиновую головку изгибаться и тянуть актин. Связывание АТФ с миозином необходимо для того, чтобы миозин высвободил свою связь с актином. Гидролиз АТФ до АДФ и неорганического фосфата заставляет миозин снова связываться с актином.
Сокращение мышц требует, чтобы миозин связывался с актином и сдвигал его для укорочения саркомера. Присоединение АДФ и неорганического фосфата к головке миозина заставляет ее связываться с актином. Высвобождение АДФ и неорганического фосфата заставляет миозиновую головку изгибаться и тянуть актин. Связывание АТФ с миозином необходимо для того, чтобы миозин высвободил свою связь с актином. Гидролиз АТФ до АДФ и неорганического фосфата заставляет миозин снова связываться с актином.
Когда запасы АТФ истощаются, миозин не может отсоединиться от актина, поэтому скелетная мышца «застревает» на своем месте. Во время этого периода судорог пораженная мышца не может двигаться, и попытка сделать это с силой может привести к ее разрыву. Когда вы отдыхаете и пополняете запасы АТФ, миозин освобождается от актина, и мышца может снова укорачиваться или удлиняться.
Хотя дефицит электролитов также может вызывать мышечную слабость и судороги, это происходит только тогда, когда они истощаются во время чрезмерного потоотделения и регидратации с помощью простой воды. Потоотделение вызывает потерю электролитов, а потребление воды снижает концентрацию существующих электролитов. Гипонатриемия и гипокальциемия являются основными причинами судорог при дефиците электролитов. Дефицит ацетилхолина может вызвать мышечную слабость, как при миастении или ботулизме.
Потоотделение вызывает потерю электролитов, а потребление воды снижает концентрацию существующих электролитов. Гипонатриемия и гипокальциемия являются основными причинами судорог при дефиците электролитов. Дефицит ацетилхолина может вызвать мышечную слабость, как при миастении или ботулизме.
Сообщить об ошибке
Какой белок должен претерпеть конформационные изменения, чтобы миозин мог присоединяться к актину?
Верно ответ:тропомиозин
Объяснение: Актин содержит сайты связывания миозина, которые должны быть закрыты, когда мышца не сокращается; в противном случае миозин постоянно присоединялся бы к актину, вызывая нестимулированное сокращение. Когда кальций высвобождается из саркоплазматического ретикулума, он присоединяется к тропонину. Затем тропонин вызывает конформационные изменения в тропомиозине. Это изменение изменяет ориентацию тропомиозина в сторону от места связывания при действии. При обнаружении сайта связывания миозин может прикрепляться к актиновой нити и сокращать саркомер.
Титин охватывает всю длину саркомера и играет ключевую роль в поддержании эластичности мышц. Коллаген обеспечивает прочность на растяжение вокруг мышц и в основном содержится во внеклеточном матриксе. АТФ не является белком и используется в качестве источника энергии для процесса сокращения.
Сообщить об ошибке
Где в саркомере находится АТФаза?
Возможные ответы:Поперечные канальцы
Полоска А
Саркоплазматический ретикулум
Толстые филаменты
Правильный ответ:Саркоплазматический ретикулум
Объяснение: Саркоплазматический ретикулум внутри мышечных клеток – это место, где хранится и высвобождается большое количество ионов кальция. Высвобождение кальция является обязательным этапом мышечного сокращения. Рецептор рианодина перекачивает ионы кальция из внутриклеточной жидкости внутрь саркоплазматического ретикулума, этот процесс поддерживает низкий уровень внутриклеточных ионов кальция, обеспечивает быстрое накопление кальция и создает градиент концентрации. Мембрана саркоплазматического ретикулума содержит насосы ионов кальция/АТФазы. Этот насос переносит внутриклеточные ионы кальция в саркоплазматический ретикулум.
Мембрана саркоплазматического ретикулума содержит насосы ионов кальция/АТФазы. Этот насос переносит внутриклеточные ионы кальция в саркоплазматический ретикулум.
Сообщить об ошибке
Какова роль парвальбумина во время мышечного сокращения?
Возможные ответы:Парвальбумин действует как медленно высвобождающийся буфер кальция, который высвобождается из саркоплазматического ретикулума.
Парвальбумин необратимо связывает кальций, предотвращая чрезмерное сокращение мышц.
Парвальбумин вызывает высвобождение кальция из саркоплазматического ретикулума.
Парвальбумин при связывании с АТФ предотвращает высвобождение кальция из саркоплазматического ретикулума
Парвальбумин существует только в кровотоке и не связан с сокращением мышц.
Правильный ответ:Парвальбумин действует как медленно высвобождающийся буфер кальция, который высвобождается из саркоплазматического ретикулума.
Объяснение: Парвальбумин — это белок, родственный альбумину, который содержится в крови. Однако парвальбумин играет другую роль и содержится в мышцах. Парвальбумин существует в цитоплазме мышц и обратимо связывается с кальцием, который высвобождается из саркоплазматического ретикулума в процессе мышечного сокращения. Парвальбумин, связывающий кальций, является экзотермическим и производит лабильное тепло. Затем парвальбумин медленно высвобождает кальций обратно в цитоплазму. Это делает парвальбумин медленно высвобождающимся кальциевым буфером.
Однако парвальбумин играет другую роль и содержится в мышцах. Парвальбумин существует в цитоплазме мышц и обратимо связывается с кальцием, который высвобождается из саркоплазматического ретикулума в процессе мышечного сокращения. Парвальбумин, связывающий кальций, является экзотермическим и производит лабильное тепло. Затем парвальбумин медленно высвобождает кальций обратно в цитоплазму. Это делает парвальбумин медленно высвобождающимся кальциевым буфером.
Сообщить об ошибке
Какова роль фосфокреатина (ФКр) в поддержании концентрации АТФ во время мышечного сокращения?
Возможные ответы:PCr сигнализирует о высвобождении АТФ из саркоплазматического ретикулума во время мышечного сокращения, поддерживая высокую концентрацию АТФ во время процесса сокращения.
AQP (аденозинквадфосфат) превращается в АТФ путем переноса высокоэнергетического фосфата из AQD в Cr. Эта реакция: AQP + Cr -> ATP + PCr
PCr не влияет на концентрацию АТФ во время мышечного сокращения.
АДФ, который расщепляется до АМФ, регенерируется в АТФ путем переноса фосфата из ПКр в АМФ. Это реакция: 2PCr + AMP -> ATP + 2Cr
АТФ, который расщепляется на АДФ, регенерируется в АТФ путем переноса фосфата из PCr в АДФ. Это реакция: ПКр + АДФ -> АТФ + Cr
Правильный ответ:АТФ, который расщепляется до АДФ, регенерируется в АТФ путем переноса фосфата из ПКр в АДФ. Эта реакция: ПКр + АДФ -> АТФ + Cr
Объяснение:PCr или фосфокреатин поддерживает концентрацию АТФ во время сокращения и использования мышц. Он делает это путем переноса своей фосфатной группы на АДФ, который является продуктом распада АТФ. Когда АТФ расщепляется до АДФ, PCr отдает фосфат АДФ для воссоздания АТФ. Эта реакция ПКр + АДФ -> АТФ + Cr катализируется ферментом КФК.
Сообщить об ошибке
Тетаническое сокращение мышечного волокна приводит к значительному увеличению внутриклеточной концентрации чего из следующего?
Возможные ответы:Магний
Фосфор
Натрий
Калий
Кальций
Правильный ответ :Кальций
Объяснение: Сокращение мышц зависит от повышения внутриклеточной концентрации кальция.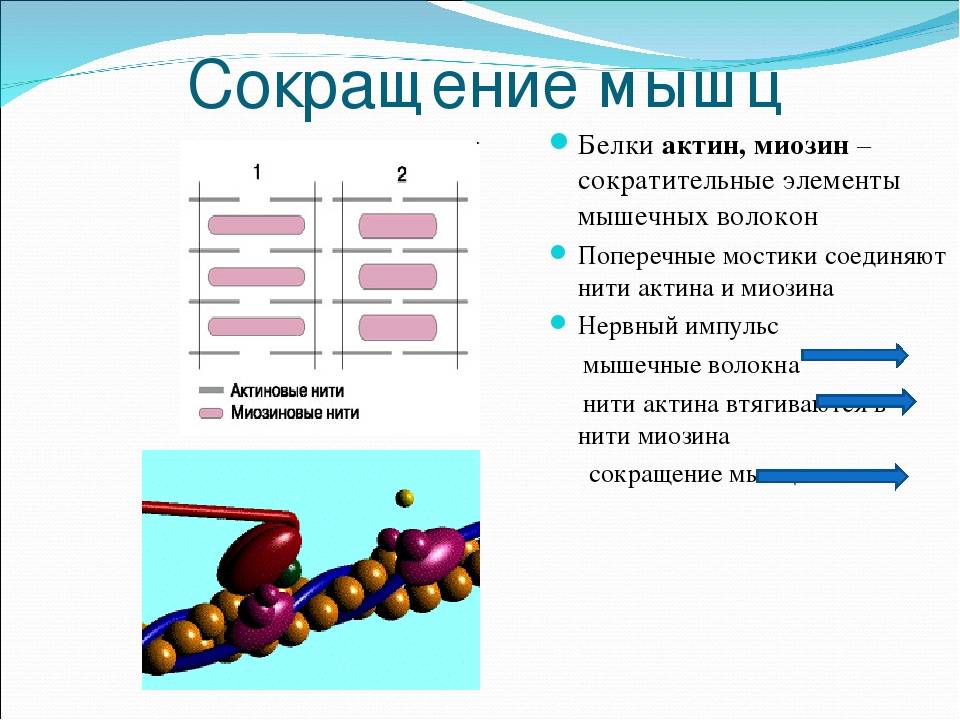 Для поддержания максимального сокращения мышечного волокна уровень внутриклеточного кальция должен оставаться выше нормы. Внутриклеточные концентрации натрия, калия и магния не влияют на сокращение мышц.
Для поддержания максимального сокращения мышечного волокна уровень внутриклеточного кальция должен оставаться выше нормы. Внутриклеточные концентрации натрия, калия и магния не влияют на сокращение мышц.
Сообщить об ошибке
Какова роль креатинфосфокиназы (КФК) в скелетных мышцах?
Возможные ответы:КФК катализирует перенос фосфата из АТФ (аденозинтрифосфат) в Cr (креатин)
КФК катализирует перенос фосфата из ПКр (фосфокреатин) в АДФ (аденозиндифосфат) 9000 3
КПК катализирует расщепление АТФ во время мышечных сокращений
КФК катализирует выработку ПКр (фосфокреатин) из двух АТФ (аденозинтрифосфат)
Ни один из ответов не является правильным.
Правильный ответ:КФК катализирует перенос фосфата из ПКр (фосфокреатин) в АДФ (аденозиндифосфат)
Объяснение: Когда АТФ используется в процессе мышечного сокращения, она регенерируется путем переноса фосфата из ПКр (фосфокреатин) в АДФ (аденозиндифосфат).