Роль и функции митохондриальных ферментов в клеточном обмене веществ
Содержимое
- 1 Митохондриальные ферменты
- 1.1 Значение митохондриальных ферментов
- 1.2 Митохондрии как «энергетические централы» клеток
- 1.3 Основные функции митохондриальных ферментов
- 1.4 Взаимосвязь между митохондриальными ферментами и обменом веществ
- 1.5 Митохондриальные ферменты и аэробный обмен веществ
- 1.6 Участие митохондриальных ферментов в синтезе АТФ
- 1.7 Митохондриальные ферменты и окислительный фосфорилирование
- 1.8 Роль митохондриальных ферментов в цикле Кребса
- 1.9 Митохондриальные ферменты и электронно-транспортная цепь
- 1.10 Болезни, связанные с нарушением митохондриальных ферментов
- 1.11 Генетические заболевания, вызванные мутациями митохондриальных ферментов
- 1.12 Заболевания, связанные с дефицитом митохондриальных ферментов
- 1.13 Видео по теме:
- 1.14 Вопрос-ответ:
- 1.14.
 0.1 Какие функции выполняют митохондриальные ферменты в клеточном обмене веществ?
0.1 Какие функции выполняют митохондриальные ферменты в клеточном обмене веществ? - 1.14.0.2 Какие патологии могут быть связаны с дисфункцией митохондриальных ферментов?
- 1.14.0.3 Как митохондриальные ферменты влияют на процесс окислительного фосфорилирования?
- 1.14.0.4 Какие митохондриальные ферменты отвечают за метаболизм липидов и аминокислот?
- 1.14.
Мета-описание для статьи о митохондриальных ферментах. Изучаем роль и функции ферментов внутри митохондрий. Узнайте, как митохондриальные ферменты влияют на энергетический метаболизм и многое другое.
Митохондрии являются важной структурой клетки, отвечающей за клеточное дыхание и обмен веществ. Одним из ключевых элементов митохондриального обмена веществ являются митохондриальные ферменты, которые выполняют ряд важных функций. Они участвуют в метаболических путях, обеспечивающих клетке энергию и углеродные источники для синтеза различных биомолекул.
Один из основных митохондриальных ферментов — цитохром С оксидаза — играет важную роль в фосфорилировании окислительного дыхания.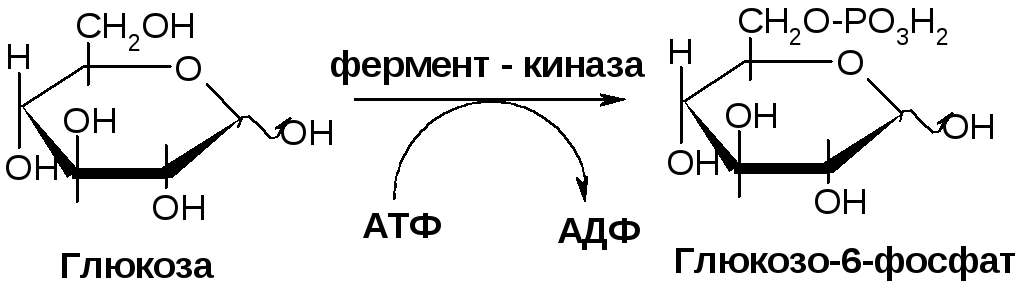 Он обеспечивает передачу электронов и протонов по дыхательной цепи, что приводит к синтезу АТФ — основному источнику энергии для клетки. Без участия этого фермента клетка не смогла бы функционировать и выполнять свои жизненно важные процессы.
Он обеспечивает передачу электронов и протонов по дыхательной цепи, что приводит к синтезу АТФ — основному источнику энергии для клетки. Без участия этого фермента клетка не смогла бы функционировать и выполнять свои жизненно важные процессы.
Кроме того, митохондриальные ферменты играют роль в метаболизме углеводов. Они участвуют в гликолизе, процессе, в результате которого глюкоза расщепляется на пироиндолмаслевую кислоту, преобразуется в пировиноградную кислоту, а затем окисляется в митохондриях с образованием АТФ. Также ферменты митохондрий участвуют в аминокислотном и липидном обмене, обеспечивая клетке не только энергию, но и строительные блоки для синтеза белков и липидов.
Значение митохондриальных ферментов
Митохондриальные ферменты играют важную роль в клеточном обмене веществ. Они участвуют в метаболических процессах и обеспечивают энергетические потребности клеток. Ферменты, находящиеся в митохондриях, активно участвуют в синтезе АТФ – основного носителя энергии в клетках.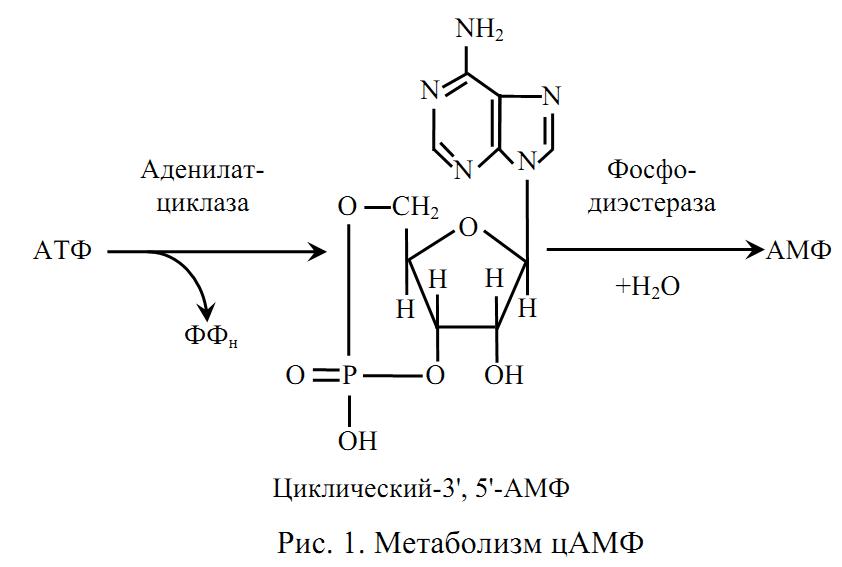
Митохондриальные ферменты также играют важную роль в обмене липидов и аминокислот. Они участвуют в синтезе и транспорте жирных кислот, а также в образовании и распаде аминокислотных молекул. Это помогает поддерживать баланс липидов и аминокислот в клетках и обеспечивает необходимые субстраты для других процессов.
Митохондриальные ферменты также играют важную роль в регуляции клеточного метаболизма. Они контролируют скорость метаболических процессов, влияют на активность других ферментов и регулируют сложные биохимические путi. Неправильное функционирование митохондриальных ферментов может приводить к различным нарушениям обмена веществ и развитию различных патологий.
Таким образом, митохондриальные ферменты играют ключевую роль в клеточном обмене веществ. Они обеспечивают энергетические потребности клеток, участвуют в обработке пищевых веществ, регулируют метаболизм липидов и аминокислот, а также контролируют клеточный метаболизм в целом. Понимание и изучение роли митохондриальных ферментов является важным шагом в развитии наших знаний о жизненных процессах и здоровье клеток.
Митохондрии как «энергетические централы» клеток
Митохондрии — это особые органеллы, которые выполняют важную функцию в клеточном обмене веществ. Они являются своеобразными «энергетическими централами» клеток, так как являются основным источником энергии в форме АТФ.
Кроме участия в синтезе АТФ, митохондрии также участвуют в других важных биохимических процессах. Они принимают активное участие в бета-окислении жирных кислот, где они разлагают жирные кислоты и образуют АЦП. Этот процесс является основным источником энергии для многих тканей, таких как сердечная мышца или мышцы скелета.
Также митохондрии являются местом производства аденозиндифосфата (АДФ) и типичным местом окисления глицерина. Они также принимают участие в метаболизме аминокислот и участвуют в процессе синтеза и разрушения липидов и нуклеотидов.
В целом, митохондрии выполняют множество функций, связанных с клеточным обменом веществ. Они являются основным источником энергии в клетке и участвуют в различных биохимических процессах, необходимых для нормальной работы организма.
Основные функции митохондриальных ферментов
Митохондрии – это органоиды, которые выполняют важные функции в клеточном обмене веществ. Одним из ключевых компонентов митохондрий являются митохондриальные ферменты. Они играют центральную роль в регуляции множества биохимических процессов, происходящих внутри этих органоидов.
Кроме того, митохондриальные ферменты участвуют в обеспечении биосинтеза различных веществ. Они катализируют реакции, необходимые для синтеза аминокислот, липидов и других молекул, которые являются строительными элементами клетки. Это позволяет митохондриальным ферментам играть важную роль в обновлении клеточных структур и поддержании их функций.
Кроме того, митохондриальные ферменты участвуют в контроле над процессами генетической экспрессии. Они участвуют в регуляции транскрипции и трансляции генов, что позволяет им влиять на синтез белков и их функции. Таким образом, митохондриальные ферменты играют важную роль в регуляции метаболических процессов и поддержании гомеостаза в клетке.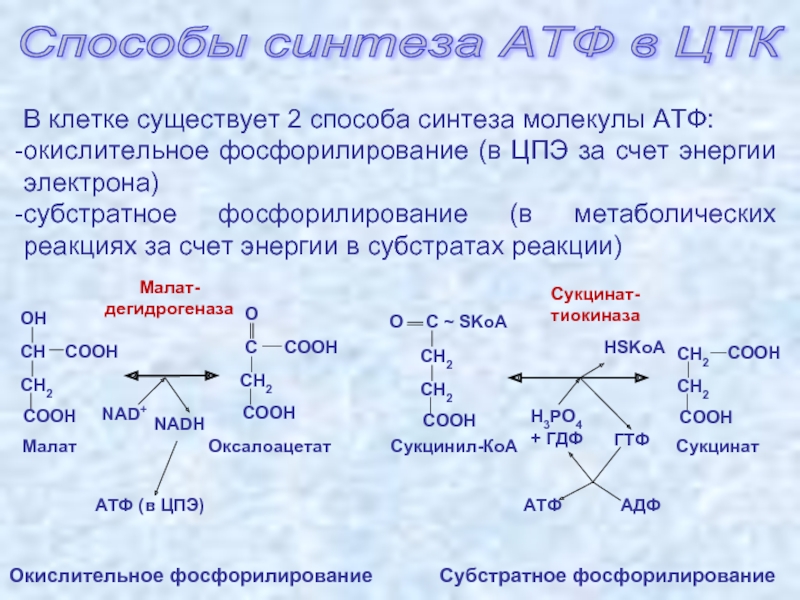
Взаимосвязь между митохондриальными ферментами и обменом веществ
Митохондрии выполняют важную функцию в клетке, отвечая за обмен веществ. Одним из ключевых компонентов этого процесса являются митохондриальные ферменты, которые играют роль катализаторов в метаболических реакциях.
Митохондриальные ферменты участвуют в различных обменных процессах, таких как гликолиз, цикл Кребса и окислительное фосфорилирование. Они активируются и регулируются в зависимости от потребностей клетки и обеспечивают необходимую энергию для ее жизнедеятельности.
Митохондриальные ферменты также играют важную роль в других процессах обмена веществ, таких как бета-окисление жирных кислот, производство глюкозы в глюконеогенезе и обмен аминокислот. Они участвуют в различных реакциях перекисного окисления и антиоксидантной защите клетки.
Таким образом, митохондриальные ферменты играют неотъемлемую роль в обмене веществ клетки, обеспечивая необходимую энергию и участвуя в различных метаболических процессах. Их активность и функционирование влияют на общее состояние и работу клеток, а также на общий обмен веществ в организме.
Их активность и функционирование влияют на общее состояние и работу клеток, а также на общий обмен веществ в организме.
Митохондриальные ферменты и аэробный обмен веществ
Митохондриальные ферменты играют важную роль в аэробном обмене веществ клеток. Митохондрии выполняют функцию энергетического завода клетки, где с помощью митохондриальных ферментов происходит процесс окисления пищевых веществ, таких как глюкоза и жирные кислоты, с целью выделения энергии в виде АТФ.
Аэробный обмен веществ предполагает наличие кислорода, который необходим для окисления пищевых веществ и производства энергии. Митохондрии являются местом, где происходит слишком оксигенации и окисления молекул, позволяющих получить энергию.
Митохондриальные ферменты включают в себя такие важные ферменты, как цитохромы, дезоксирибонуклеазу, киназы, оксидазы и другие. Они участвуют в различных реакциях окисления, фосфорилирования, а также в процессах синтеза и разрушения различных метаболитов.
Благодаря митохондриальным ферментам, клетки могут эффективно расщеплять и использовать пищевые вещества, получая энергию и поддерживая свою жизнедеятельность. Они также играют важную роль в регуляции обмена веществ и поддержании гомеостаза в клетках.
Они также играют важную роль в регуляции обмена веществ и поддержании гомеостаза в клетках.
Участие митохондриальных ферментов в синтезе АТФ
Митохондрии являются органеллами клетки, где происходит основной процесс синтеза АТФ — основной энергетической молекулы клетки. Синтез АТФ происходит внутри митохондрий с помощью нескольких важных ферментов.
Одним из таких ферментов является карбамоилфосфатсинтетаза. Этот фермент играет важную роль в синтезе мочевинного цикла, который является одним из путей образования АТФ. Карбамоилфосфатсинтетаза обеспечивает связывание аммиака с углекислым газом, что в результате приводит к образованию карбамоилфосфата, необходимого для синтеза АТФ.
Еще одним важным ферментом, участвующим в синтезе АТФ, является сукцинатдегидрогеназа. Этот фермент осуществляет окисление сукцината до фумарата в процессе цикла Кребса. Окисление сукцината освобождает электроны, которые затем переносятся на белки электронного транспортного цепи митохондрий и в конечном итоге используются для синтеза АТФ.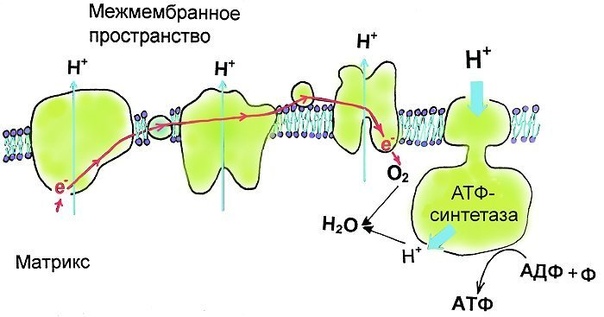
Таким образом, участие митохондриальных ферментов в синтезе АТФ является критическим для поддержания энергетического обмена в клетке. Они обеспечивают непрерывный синтез АТФ, который является основным источником энергии для частных процессов в клетке и поддерживает ее жизнедеятельность.
Митохондриальные ферменты и окислительный фосфорилирование
Митохондриальные ферменты представляют собой группу белков, играющих важную роль в процессе окислительного фосфорилирования внутри митохондрий. Они катализируют реакции, необходимые для превращения питательных веществ в энергию, которую клетка может использовать.
Один из ключевых ферментов, участвующих в окислительном фосфорилировании, — это Цитохром С оксидаза. Он является составной частью комплекса IV дыхательной цепи митохондрий и катализирует последний шаг в процессе дыхания клетки — превращение кислорода и электронов в воду.
Еще одним важным митохондриальным ферментом является Сукцинатдегидрогеназа. Она участвует в цикле Кребса и катализирует окислительное декарбоксилирование сукцината до фумарата, сопровождаемое одновременной редукцией фумарата до фумарата. Эта реакция обеспечивает образование высокоэнергетических молекул НАДН и ФАДНН, которые затем используются в окислительном фосфорилировании.
Она участвует в цикле Кребса и катализирует окислительное декарбоксилирование сукцината до фумарата, сопровождаемое одновременной редукцией фумарата до фумарата. Эта реакция обеспечивает образование высокоэнергетических молекул НАДН и ФАДНН, которые затем используются в окислительном фосфорилировании.
Все эти митохондриальные ферменты работают в тесной взаимосвязи в процессе окислительного фосфорилирования, обеспечивая превращение энергии из питательных веществ в форму, доступную для использования клеткой.
Роль митохондриальных ферментов в цикле Кребса
Цикл Кребса, также известный как цикл карбоксиловых кислот, является важным этапом клеточного обмена веществ. Он протекает в митохондриях и играет центральную роль в процессе окисления органических молекул и выработке энергии. Различные митохондриальные ферменты участвуют в каждом шаге этого сложного цикла, обеспечивая его нормальное функционирование.
Один из главных ферментов, участвующих в цикле Кребса, — это цитратсинтаза. Она катализирует первый шаг цикла, превращая оксалоацетат и ацетил-КоА в цитрат. Цитрат является важным межпродуктом, который получается из ацетил-КоА, молекулы, образующейся в процессе окисления глюкозы. Цитратсинтаза играет ключевую роль в переносе этих молекул в цикл Кребса и их дальнейшей окислительной фосфорилироваке.
Она катализирует первый шаг цикла, превращая оксалоацетат и ацетил-КоА в цитрат. Цитрат является важным межпродуктом, который получается из ацетил-КоА, молекулы, образующейся в процессе окисления глюкозы. Цитратсинтаза играет ключевую роль в переносе этих молекул в цикл Кребса и их дальнейшей окислительной фосфорилироваке.
Другим важным ферментом, участвующим в цикле Кребса, является изоцитратдегидрогеназа. Этот фермент катализирует превращение изоцитрата в α-кетоглютарат, производя при этом NADH и СО2. Именно этот шаг цикла является ключевым для дальнейшего использования энергии в процессе дыхательной цепи и выработки АТФ.
Также, в цикле Кребса активно участвуют альфа-кетоглютаратдегидрогеназа, сукцинатдегидрогеназа, фумаратгидратаза, малатдегидрогеназа и другие митохондриальные ферменты. Они катализируют реакции окисления и переноса электронов, обеспечивая образование NADH и FADh3 — соединений, необходимых для дальнейшего процесса аэробного дыхания.
Митохондриальные ферменты и электронно-транспортная цепь
Митохондриальные ферменты играют важную роль в функционировании электронно-транспортной цепи (ЭТЦ) внутри митохондрий. Они участвуют в каскаде реакций, которые позволяют переносить электроны через мембрану митохондрий и генерировать энергию в форме АТФ.
Они участвуют в каскаде реакций, которые позволяют переносить электроны через мембрану митохондрий и генерировать энергию в форме АТФ.
Электронно-транспортная цепь включает несколько митохондриальных ферментов, в том числе цитохром b5, цитохром c, цитохром оксидазу и никотинамидадениндинуклеотид-трансгидрогеназу. Последний является ключевым ферментом, отвечающим за перенос электронов в ЭТЦ, и его активность является важным маркером функционирования митохондрий.
Работа электронно-транспортной цепи основана на последовательной передаче электронов от одного фермента к другому. Митохондриальные ферменты, такие как цитохромы, играют роль переносчиков электронов и позволяют энергии, высвобождающейся при передаче электронов, использоваться для синтеза АТФ.
Электронно-транспортная цепь в митохондриях происходит на внутренней митохондриальной мембране, которая обладает большой поверхностью, содержит множество ферментов и комплексов для передачи электронов. Митохондриальные ферменты играют роль катализаторов в этих реакциях и позволяют эффективно использовать энергию, полученную из питательных веществ, для жизнедеятельности клетки.
Болезни, связанные с нарушением митохондриальных ферментов
Митохондриальные ферменты играют ключевую роль в клеточном обмене веществ, и их нарушение может привести к различным заболеваниям. Одним из наиболее распространенных заболеваний, связанных с дефектами митохондриальных ферментов, является митохондриальная дисфункция.
Митохондриальная дисфункция может проявляться различными способами, в зависимости от того, какой конкретный фермент был нарушен. Например, дефекты в ферменте цитохром оксидазы могут вызвать снижение энергетического обмена в клетках, что приводит к ухудшению функции органов и тканей.
Другим примером заболевания, связанного с нарушением митохондриальных ферментов, является наследственная митохондриальная энцефалопатия. В этом случае, дефекты в ферментах, участвующих в процессе преобразования пищевых веществ в энергию, приводят к нарушению работы головного мозга и нервной системы. Симптомы этого заболевания могут включать задержку развития, мышечную слабость, нарушения координации движений и другие нарушения нервной системы.
Также известны случаи наследственных заболеваний, связанных с дефектами ферментов, распадающих липиды. При этих заболеваниях наблюдается нарушение обработки жиров в клетках, что может привести к накоплению жировых кислот в организме и повреждению органов и тканей.
Болезни, связанные с нарушением митохондриальных ферментов, являются серьезными и часто хроническими. Для их диагностики и лечения требуется специализированная медицинская помощь. В настоящее время исследования в этой области продолжаются, и надеется, что в будущем будут разработаны новые подходы к диагностике и лечению этих заболеваний.
Генетические заболевания, вызванные мутациями митохондриальных ферментов
Митохондрии являются органеллами, выполняющими важную функцию в клеточном обмене веществ. Они содержат собственную ДНК и множество ферментов, которые участвуют в процессах энергетического обмена. Однако, мутации в генах, кодирующих митохондриальные ферменты, могут привести к появлению генетических заболеваний.
Генетические заболевания, вызванные мутациями митохондриальных ферментов, имеют разнообразные проявления и могут затрагивать различные системы организма. Например, одним из наиболее известных заболеваний является митохондриальная дистрофия, которая поражает мышцы и приводит к нарушению их функционирования. Также мутации в митохондриальных ферментах могут быть причиной различных неврологических расстройств, нарушения работы органов пищеварения и дыхательной системы, а также различных форм нарушений обмена веществ и энергетического обмена.
Одной из особенностей генетических заболеваний, связанных с мутациями митохондриальных ферментов, является их передача по материнской линии. Это связано с тем, что митохондрии наследуются от матери, а не от отца. Поэтому, если женщина является носителем мутации в митохондриальных ферментах, то она может передать это заболевание своим потомкам, независимо от пола ребенка.
Такие генетические заболевания часто являются хроническими и прогрессирующими, то есть с течением времени симптомы становятся более выраженными. Лечение таких заболеваний направлено на симптоматическую терапию и поддержание нормальной работы органов и систем организма. Однако, разработка методов генной терапии, направленных на устранение мутаций в митохондриальных генах, является перспективным направлением исследований в данной области медицины.
Лечение таких заболеваний направлено на симптоматическую терапию и поддержание нормальной работы органов и систем организма. Однако, разработка методов генной терапии, направленных на устранение мутаций в митохондриальных генах, является перспективным направлением исследований в данной области медицины.
Таким образом, генетические заболевания, вызванные мутациями митохондриальных ферментов, представляют серьезную проблему современной медицины. Они могут влиять на различные органы и системы организма и передаваться по наследству от матери к ребенку. Лечение таких заболеваний ограничивается симптоматической терапией, однако исследования в области генной терапии могут в будущем привести к созданию методов, позволяющих устранить мутации в митохондриальных генах и предотвратить или лечить эти заболевания.
Заболевания, связанные с дефицитом митохондриальных ферментов
Митохондрии играют важную роль в клеточном обмене веществ, и их неправильная функция может привести к различным заболеваниям. Дефицит митохондриальных ферментов является одной из наиболее распространенных причин нарушения работы митохондрий, что приводит к различным патологиям.
Дефицит митохондриальных ферментов является одной из наиболее распространенных причин нарушения работы митохондрий, что приводит к различным патологиям.
Одним из наиболее известных заболеваний, связанных с дефицитом митохондриальных ферментов, является митохондриальная дисфункция, которая может проявляться в различных формах, включая митохондриальные нейродегенеративные заболевания, митохондриальные энцефаломиопатии и митохондриальные миопатии. Эти заболевания проявляются разными симптомами, включая мышечную слабость, задержку развития, нарушение координации и неврологические нарушения.
Другим распространенным заболеванием, связанным с дефицитом митохондриальных ферментов, является Лейбовитц-Сибергер-Брукс-Синдром, характеризующийся нарушениями функции митохондрий в клетках нервной системы. Это врожденное заболевание приводит к различным симптомам, включая задержку психомоторного развития, эндокринные нарушения и нарушения функции сердца.
Одной из особых форм митохондриальной патологии, связанной с дефицитом митохондриальных ферментов, является Мелас-синдром (mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes). Это редкое заболевание характеризуется судорогами, нарушением функции головного мозга и повышенным содержанием молочной кислоты в крови. Основным нарушением в Мелас-синдроме является дефицит ферментов, ответственных за производство энергии в митохондриях.
Это редкое заболевание характеризуется судорогами, нарушением функции головного мозга и повышенным содержанием молочной кислоты в крови. Основным нарушением в Мелас-синдроме является дефицит ферментов, ответственных за производство энергии в митохондриях.
Видео по теме:
Вопрос-ответ:
Какие функции выполняют митохондриальные ферменты в клеточном обмене веществ?
Митохондриальные ферменты выполняют несколько ключевых функций в клеточном обмене веществ, таких как участие в процессе окислительного фосфорилирования, продукция энергии в форме АТФ, метаболизм липидов и аминокислот, регуляция реакций окисления и многое другое.
Какие патологии могут быть связаны с дисфункцией митохондриальных ферментов?
Дисфункция митохондриальных ферментов может привести к различным патологиям, таким как митохондриальные заболевания, нарушение метаболического баланса, диабет, сердечно-сосудистые заболевания, онкологические заболевания и другие.
Как митохондриальные ферменты влияют на процесс окислительного фосфорилирования?
Митохондриальные ферменты играют важную роль в процессе окислительного фосфорилирования, который является основным механизмом продукции энергии в клетке. Они катализируют реакции окисления и фосфорилирования, что приводит к образованию АТФ — основного источника энергии клетки.
Какие митохондриальные ферменты отвечают за метаболизм липидов и аминокислот?
Существует несколько митохондриальных ферментов, которые участвуют в метаболизме липидов и аминокислот. Например, ацетилкоэнзим А карбоксилаза, которая катализирует реакцию синтеза малонил-КоА из ацетил-КоА и КО₂, или трансаминазы, которые катализируют реакцию переноса аминной группы между аминокислотами и α-кетокислотами.
Наука: Наука и техника: Lenta.ru
Nature Catalysis: созданы эффективные катализаторы для искусственного фотосинтеза
Фото: Trnava University / Unsplash
Американские химики разработали новую искусственную систему фотосинтеза, которая по эффективности превосходит предыдущие фотокатализаторы. Она включает искусственные ферменты, состоящие из металл-органических каркасов и различных дополнительных соединений, улучшающих биохимические превращения. Результаты научной работы опубликованы в журнале Nature Catalysis.
Она включает искусственные ферменты, состоящие из металл-органических каркасов и различных дополнительных соединений, улучшающих биохимические превращения. Результаты научной работы опубликованы в журнале Nature Catalysis.
Многие искусственные ферменты отличаются от природных тем, что они не способны осуществлять сложные химические превращения, а катализируют лишь простые реакции из-за того, что в них присутствуют аналоги только активных центров. У естественных ферментов кроме таких центров имеются кофакторы — малые соединения, которые связаны с функциональными участками молекулы и также участвуют в биохимических реакциях. К таким соединениям относят, например, одиночные аминокислоты, пигменты, НАДФ и АТФ.
Исследователи Чикагского университета разработали искусственный фермент на основе металл-органических каркасов (MOF) — соединений, состоящих из ионов металлов и связанных с ними органических молекул. Они создали каркас MOZ, состоящий из гафния и иридия и включающий активные центры с атомами железа, в виде одного слоя, чтобы обеспечить максимальную площадь поверхности для химических реакций. Затем в монослои внесли различные аминокислоты — глутамин и аспарагин, — получив различные типы каркасов, обозначенные как MOZ-2 и MOZ-3.
Затем в монослои внесли различные аминокислоты — глутамин и аспарагин, — получив различные типы каркасов, обозначенные как MOZ-2 и MOZ-3.
Материалы по теме:
Полученные MOF добавляли в раствор восстановителя и тестировали при комнатной температуре, давлении углекислого газа в одну атмосферу и облучении видимым светом в течение шести часов. Активность каждого MOZ проверяли по количеству продуктов реакции — угарного газа и метана. MOZ-1 продемонстрировал семикратное увеличение эффективности по сравнению с простой смесью MOF и пигментов с атомами железа. MOZ-2 и MOZ-3 еще более активно преобразовывали углекислый газ, чем их предшественник.
Авторы изучили механизмы, которые играют важную роль в эффективности искусственных ферментов, и выяснили, что одним из важных факторов является стабильность водородной связи между углекислым газом и аминокислотами аспарагин и глутамин. На основе этого была создана MOZ-4, к которой присоединены боковые группы на основе мочевины, что позволило повысить активность катализатора в 27 раз. Дополнительно был создан катализатор фотоокисления воды MOZ-7 с боковыми амидными группами. Комбинация MOZ-4 и MOZ-7 позволила достигнуть полного искусственного фотосинтеза (1 + n)CO2 + 2h3O → Ch5 + nCO + (2 + n/2)O2, превзойдя известные фотокатализаторы по эффективности более чем на порядок.
Дополнительно был создан катализатор фотоокисления воды MOZ-7 с боковыми амидными группами. Комбинация MOZ-4 и MOZ-7 позволила достигнуть полного искусственного фотосинтеза (1 + n)CO2 + 2h3O → Ch5 + nCO + (2 + n/2)O2, превзойдя известные фотокатализаторы по эффективности более чем на порядок.
По словам ученых, для промышленного получения природного газа потребуется масштабирование реакции на несколько порядков, поэтому говорить о таком практическом применении искусственных ферментов пока еще рано. Однако разработка может оказаться полезной для производства фармацевтических препаратов или, например, нейлона.
Регуляторы энергии: ферменты и АТФ
Ферменты
Если бы вся энергия реакции высвобождалась одновременно, большая ее часть была бы потеряна в виде тепла — сжигая клетки — и мало что могло бы быть захвачено для выполнения метаболической (или любой другой) работы. Организмы выработали множество материалов и механизмов, таких как ферменты, которые контролируют и позволяют поэтапно использовать высвобождаемую энергию.
Ферменты контролируют состояние энергии, которое молекула должна достичь, прежде чем она сможет высвобождать энергию, и являются главными катализаторов биохимических реакций. Они не расходуются и не изменяются в реакциях. По сути, ферменты уменьшают энергию активации , необходимую для начала реакции, временно связываясь с реагирующими молекулами и тем самым ослабляя химические связи.
Почти все из более чем 2000 известных ферментов являются белками, почти все из которых работают с  Их называют изоферментов , и каждый специфичен для своего процесса.
Их называют изоферментов , и каждый специфичен для своего процесса.
Две разные структурные модели используются для объяснения того, почему ферменты работают так эффективно. Согласно модели «замок-и-ключ» , в молекуле фермента есть место, активный центр (замок), в который -субстрат (ключ) подходит благодаря электрическому электричеству последнего. заряд, размер и форма. В действительности, однако, соединение оказывается гораздо более гибким, чем допускает эта модель. модель с индуцированной подгонкой принимает это во внимание и заявляет, что, хотя размер и форма сопоставимы, активный центр является гибким и, по-видимому, приспосабливается к подложке. При этом он укрепляет соединение, когда молекулы собираются вместе, и инициирует ферментативную реакцию. Однако это работает физически, химически связь фермент-субстрат является точной и специфичной, один фермент для каждого субстрата. \
\
АТФ (аденозинтрифосфат)
Энергия — это валюта живого мира, а АТФ, подобно монетам, переходящим из рук в руки в нашей экономике, — это средство, с помощью которого энергия циркулирует внутри клеток и между ними; это самое обычное 
АТФ незаменим для краткосрочного использования энергии, но бесполезен ни для долговременного хранения энергии, ни для процессов, требующих большого количества энергии. Первые потребности удовлетворяются в растениях главным образом за счет крахмала и липидов, вторые — за счет сахарозы.
Ферменты захвата АТФ — PMC
1. Chou CY, Yu LPC, Tong L. J Biol Chem. 2009; 284:11690–11697. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Jitrapakdee S, Wallace JC. Curr Protein Pept Sci. 2003; 4: 217–229. [PubMed] [Google Scholar]
3. Li H, Fast W, Benkovic SJ. Белковая наука. 2009; 18:881–892. [бесплатная статья PMC] [PubMed] [Google Scholar]
4. Мурзин А.Г. Curr Opin Struct Biol. 1996; 6: 386–394. [PubMed] [Google Scholar]
5. Гальперин М.Ю., Кунин Е.В. Белковая наука. 1997;6:2639–2643. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Esser L, Wang CR, Hosaka M, Smagula CS, Sudhof TC, Diesenhofer J.
7. Jitrapakdee S, St Maurice M, Rayment I, Cleland WW, Wallace JC, Attwood PV. Биохим Дж. 2008;413:369–387. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Fan C, Moews PC, Shi Y, Walsh CT, Knox JR. Proc Natl Acad Sci U S A. 1995; 92:1172–1176. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Fan C, Moews PC, Walsh CT, Knox JR. Science (Вашингтон, округ Колумбия), 1994; 266:439–443. [PubMed] [Google Scholar]
10. Хиби Т., Нисиока Т., Като Х., Танидзава К., Фукуи Т., Кацубэ Ю., Ода Джи. Nat Struct Biol. 1996; 3:16–18. [PubMed] [Google Scholar]
11. Sloane V, Blanchard CZ, Guillot F, Waldrop GL. Дж. Биол. Хим. 2001; 276:24991–24996. [PubMed] [Google Scholar]
12. Waldrop GL, Rayment I, Holden HM. Биохимия. 1994; 33:10249–10256. [PubMed] [Академия Google]
13. Володько В.Т., Фрейзер М.Е., Джеймс М.Н.Г., Бриджер В.А. Дж. Биол. Хим. 1994; 269:10883–10890. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
14. Тоден Дж. Б., Файрстин С., Никсон А., Бенкович С. Дж., Холден Х. М. Биохимия. 2000; 39:8791–8802. [PubMed] [Google Scholar]
15. Wang W, Kappock TJ, Stubbe J, Ealick SE. Биохимия. 1998; 37:15647–15662. [PubMed] [Google Scholar]
16. Thoden JB, Kappock TJ, Stubbe J, Holden HM. Биохимия. 1999; 38:15480–15492. [PubMed] [Академия Google]
17. Чжан Ю., Уайт Р. Х., Илик С. Э. Биохимия. 2008; 47: 205–217. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Thoden JB, Blanchard CZ, Holden HM, Waldrop GL. Дж. Биол. Хим. 2000; 275:16183–16190. [PubMed] [Google Scholar]
19. Миллер Г.Дж., Уилсон М.П., Майерус П.В., Херли Дж.Х. Мол Ячейка. 2005;18:201–212. [PubMed] [Google Scholar]
20. Gitler D, Xu Y, Kao HT, Lin D, Lim S, Feng J, Greengard P, Augustine GJ. Дж. Нейроски. 2004; 24:3711–3720. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Полехина Г., Борд П.Г., Гали Р.Р., Россджон Дж., Паркер М. В. Эмбо Дж. 1999; 18:3204–3213. [Статья бесплатно PMC] [PubMed] [Google Scholar]
В. Эмбо Дж. 1999; 18:3204–3213. [Статья бесплатно PMC] [PubMed] [Google Scholar]
22. Welin M, Grossmann JG, Flodin S, Nyman T, Stenmark P, Tresaugues L, Kotenyova T, Johansson I, Nordlund P, Lehtioe L. Nucleic Acids Res. 2010; 38:7308–7319. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Thoden JB, Holden HM, Firestine SM. Биохимия. 2008;47:13346–13353. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Чжан И, Морар М, Илик СЭ. Cell Mol Life Sci. 2008;65:3699–3724. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Jiang H, Rao KS, Yee VC, Kraus JP. Дж. Биол. Хим. 2005; 280:27719–27727. [PubMed] [Google Scholar]
26. Канамори Т., Кану Н., Атоми Х., Иманака Т. Дж. Бактериол. 2004; 186: 2532–2539. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Новак Б.Р., Молдован Д., Уолдроп Г.Л., де Кейрос М.С. Белки: структура, функция, биоинф. 2010; 79: 622–632. [Академия Google]
28. Roon RJ, Hampshire J, Levenberg B.J Biol Chem.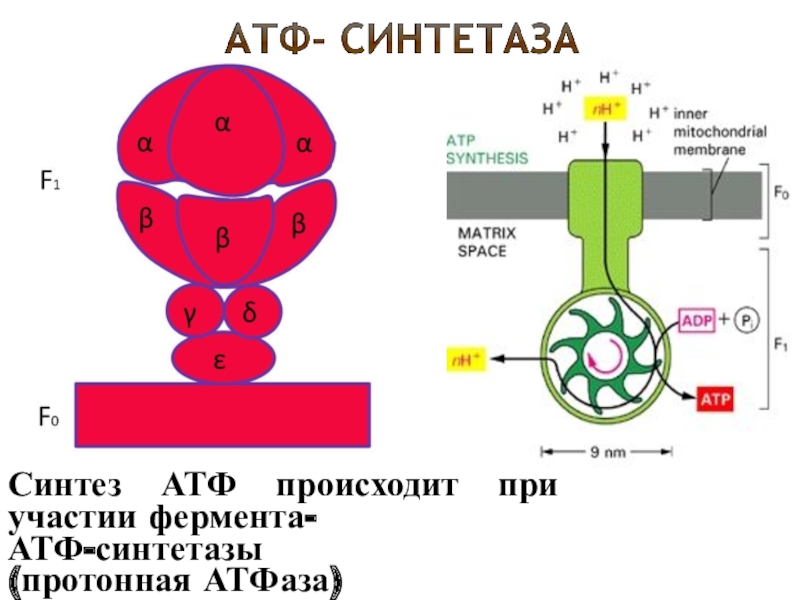 1972; 247:7539–7545. [PubMed] [Google Scholar]
1972; 247:7539–7545. [PubMed] [Google Scholar]
29. Roon RJ, Levenberg B. Methods Enzymol. 1970; 17: 317–324. [Google Scholar]
30. Строуп П.К., Никерсон К.В., Харрис С.Д., Морияма Э.Н. БМС Эвол Биол. 2011;11:80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Huang CS, Sadre-Bazzaz K, Shen Y, Deng B, Zhou ZH, Tong L. Nature (London, UK) 2010; 466:1001–1005. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Lasso G, Yu LPC, Gil D, Xiang S, Tong L, Valle M. Structure (Кембридж, Массачусетс, США) 2010;18:1300–1310. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Dal Piaz F, Vassallo A, Lepore L, Tosco A, Bader A, De Tommasi N. J Med Chem. 2009;52:3814–3828. [PubMed] [Google Scholar]
34. Erck C, Peris L, Andrieux A, Meissirel C, Gruber AD, Vernet M, Schweitzer A, Saoudi Y, Pointu H, Bosc C, Salin PA, Job D, Wehland J. Proc Natl Acad Sci U S A. 2005; 102:7853–7858. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Kosuge T, Hoshino T. FEMS Microbiol Lett. 1997; 157:73–79. [PubMed] [Google Scholar]
Kosuge T, Hoshino T. FEMS Microbiol Lett. 1997; 157:73–79. [PubMed] [Google Scholar]
36. Kang WK, Icho T, Isono S, Kitakawa M, Isono K. MGG, Mol Gen Genet. 1989; 217: 281–288. [PubMed] [Google Scholar]
37. Nishida H, Nishiyama M, Kobashi N, Kosuge T, Hoshino T, Yamane H. Genome Res. 1999; 9: 1175–1183. [PubMed] [Google Scholar]
38. Collard F, Stroobant V, Lamosa P, Kapanda CN, Lambert DM, Muccioli GG, Poupaert JH, Opperdoes F, Van Schaftingen E. J Biol Chem. 2010;285:29826–29833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Neale JH. Дж. Нейрохим. 2011 [PMC free article] [PubMed] [Google Scholar]
40. Сакаи Х., Васильева М.Н., Мацуура Т., Секине Си, Готох К., Нишияма М., Терада Т., Ширузу М., Курамицу С., Васильев Д.Г., Йокояма С. Дж Мол Биол. 2003; 332: 729–740. [PubMed] [Google Scholar]
41. Hiratake J. Chem Rec. 2005; 5: 209–228. [PubMed] [Google Scholar]
42. Wilson MP, Hugge C, Bielinska M, Nicholas P, Majerus PW, Wilson DB. Proc Natl Acad Sci U S A. 2009;106:9831–9835. С9831/9831-С9831/9837. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 2009;106:9831–9835. С9831/9831-С9831/9837. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Attwood PV. Int J Biochem Cell Biol. 1995; 27: 231–249. [PubMed] [Google Scholar]
44. Attwood PV, Wallace JC. Acc Chem Res. 2002; 35: 113–120. [PubMed] [Google Scholar]
45. Эроглу Б., Пауэрс-Ли С.Г. Арх Биохим Биофиз. 2002; 407:1–9. [PubMed] [Google Scholar]
46. Li H, Xu H, Graham DE, White RH. Proc Natl Acad Sci U S A. 2003;100:9785–9790. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Healy VL, Mullins LS, Li X, Hall SE, Raushel FM, Walsh CT. хим. биол. 2000; 7: 505–514. [PubMed] [Google Scholar]
48. Marolewski AE, Mattia KM, Warren MS, Benkovic SJ. Биохимия. 1997; 36: 6709–6716. [PubMed] [Google Scholar]
49. Мюллер Э.Дж., Мейер Э., Рудольф Дж., Дэвиссон В.Дж., Стуббе Дж. Биохимия. 1994; 33: 2269–2278. [PubMed] [Google Scholar]
50. Mullins LS, Lusty CJ, Raushel FM. Дж. Биол. Хим. 1991; 266:8236–8240. [PubMed] [Академия Google]
[PubMed] [Академия Google]
51. Маллинз Л.С., Завадске Л.Е., Уолш К.Т., Раушель Ф.М. Дж. Биол. Хим. 1990; 265:8993–8998. [PubMed] [Google Scholar]
52. Ogita T, Knowles JR. Биохимия. 1988; 27:8028–8033. [PubMed] [Google Scholar]
53. Wang HC, Ciskanik L, Dunaway-Mariano D, Von der Saal W, Villafranca JJ. Биохимия. 1988; 27: 625–633. [PubMed] [Google Scholar]
54. Powers SG, Meister A. Proc Natl Acad Sci U S A. 1976; 73:3020–3024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Ellsworth BA, Tom NJ, Bartlett PA. хим. биол. 1996;3:37–44. [PubMed] [Google Scholar]
56. McDermott AE, Creuzet F, Griffin RG, Zawadzke LE, Ye QZ, Walsh CT. Биохимия. 1990; 29: 5767–5775. [PubMed] [Google Scholar]
57. Climent I, Rubio V. Arch Biochem Biophys. 1986; 251: 465–470. [PubMed] [Google Scholar]
58. Meyer E, Leonard NJ, Bhat B, Stubbe J, Smith JM. Биохимия. 1992; 31: 5022–5032. [PubMed] [Google Scholar]
59. Wimmer MJ, Rose IA, Powers SG, Meister A. J Biol Chem. 1979; 254: 1854–1859. [PubMed] [Академия Google]
J Biol Chem. 1979; 254: 1854–1859. [PubMed] [Академия Google]
60. Гибсон Г.Э., Маллинз Л.С., Раушель Ф.М. Биоорг хим. 1998; 26: 255–268. [Google Scholar]
61. Кэрролл Л.Дж., Сюй Ю., Тралл С.Х., Мартин Б.М., Данауэй-Мариано Д. Биохимия. 1994; 33:1134–1142. [PubMed] [Google Scholar]
62. Лин Ю., Лусин Дж. Д., Йе Д., Данауэй-Мариано Д., Эймс Дж. Б. Биохимия. 2006; 45: 1702–1711. [PubMed] [Google Scholar]
63. Ye D, Wei M, McGuire M, Huang K, Kapadia G, Herzberg O, Martin BM, Dunaway-Mariano D. J Biol Chem. 2001; 276:37630–37639. [PubMed] [Академия Google]
64. Skedelj V, Tomasic T, Masic LP, Zega A. J Med Chem. 2011;54:915–929. [PubMed] [Google Scholar]
65. Triola G, Wetzel S, Ellinger B, Koch MA, Huebel K, Rauh D, Waldmann H. Bioorg Med Chem. 2009;17:1079–1087. [PubMed] [Google Scholar]
66. Чакраварти П.К., Гринли В.Дж., Парсонс В.Х., Патчетт А.А., Комбс П., Рот А., Буш Р.Д., Меллин Т.Н. J Med Chem. 1989; 32: 1886–1890. [PubMed] [Google Scholar]
67. Duncan K, Walsh CT. Биохимия. 1988; 27:3709–3714. [PubMed] [Академия Google]
Duncan K, Walsh CT. Биохимия. 1988; 27:3709–3714. [PubMed] [Академия Google]
68. Zeczycki TN, St Maurice M, Attwood PV. Open Enzyme Inhib J. 2010; 3:8–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Miller JR, Dunham S, Mochalkin I, Banotai C, Bowman M, Buist S, Dunkle B, Hanna D, Harwood J, Huband MD, Karnovsky A, Kuhn М., Лимберакис С., Лю Дж.Ю., Меренс С., Мюллер В.Т., Нарасимхан Л., Огден А., Орен Дж., Вара Прасад Дж.В. , Чжу Т., Стовер К.К. Proc Natl Acad Sci U S A. 2009;106:1737–1742. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Мочалкин И., Миллер Дж. Р., Нарасимхан Л., Танабал В., Эрдман П., Кокс П. Б., Прасад JVNV, Лайтле С., Хабанд М. Д., Стовер К. К. ACS Chem Biol. 2009; 4: 473–483. [PubMed] [Google Scholar]
71. Firestine SM, Paritala H, McDonnell JE, Thoden JB, Holden HM. Биоорг Мед Хим. 2009;17:3317–3323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Shen Y, Volrath SL, Weatherly SC, Elich TD, Tong L. Mol Cell.

 0.1 Какие функции выполняют митохондриальные ферменты в клеточном обмене веществ?
0.1 Какие функции выполняют митохондриальные ферменты в клеточном обмене веществ?